Синдром Базедова (Basedow) - синонимы, авторы, клиника
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
ММА имени И.М. Сеченова
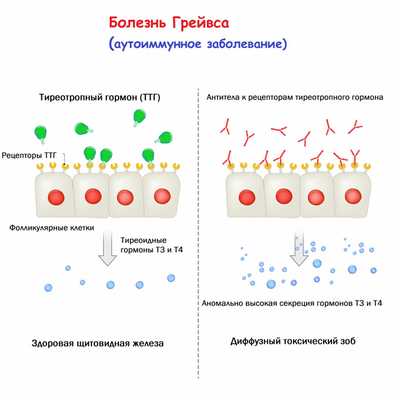
Б олезнь Грейвса (болезнь Базедова, диффузный токсический зоб, БГ) - системное аутоиммунное заболевание, развивающееся вследствие выработки антител к рецептору тиреоторопного гормона (ТТГ), клинически проявляющееся поражением щитовидной железы (ЩЖ) с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией (эндокринная офтальмопатия, претибиальная микседема, акропатия). Одновременное сочетание всех компонентов системного аутоиммунного процесса встречается относительно редко и не является облигатным для постановки диагноза. В большинстве случаев наибольшее клиническое значение при БГ имеет поражение ЩЖ.
В США и Англии частота новых случаев БГ варьирует от 30 до 200 случае на 100 тысяч населения в год. Женщины заболевают БГ в 10-20 раз чаще. В регионах с нормальным йодным обеспечением болезнь Грейвса является наиболее частой причиной стойкого тиреотоксикоза, а в йододефицитных регионах в этиологической структуре токсического зоба БГ конкурирует с функциональной автономией ЩЖ (узловой и многоузловой токсический зоб). В России в качестве синонима термина болезнь Грейвса (болезнь Базедова) традиционно используется термин диффузный токсический зоб, который не лишен ряда существенных недостатков. Во-первых, он характеризует лишь макроскопическое (диффузный зоб) и функциональное (токсический) изменение ЩЖ, которое не является облигатным для болезни Грейвса: с одной стороны, увеличения железы может не быть, с другой - он может быть не диффузным. Вместе с тем, диффузное увеличение ЩЖ в сочетании с тиреотоксикозом может иметь место при других заболеваниях, в частности, при так называемой диффузной функциональной автономии. Использование более широкого термина «болезнь» (а не просто токсический зоб) применительно к обсуждаемому заболеванию, скорее всего, более оправдано, поскольку он в большей мере подчеркивает системность аутоиммунного процесса. Кроме того, во всем мире традиционно наиболее часто используется и, таким образом, узнается именно термин болезнь Грейвса, а в немецко-говорящих странах - болезнь Базедова.
БГ является мультифакториальным заболеванием, при котором генетические особенности иммунного реагирования реализуются на фоне действия факторов окружающей среды. Наряду с этнически ассоциированной генетической предрасположенностью (носительство гаплотипов HLA-B8, -DR3 и -DQA1*0501 у европейцев) в патогенезе БГ определенное значение придается психосоциальным и средовым факторам. Так, уже достаточно давно обсуждается значение инфекционных и стрессорных факторов, в частности, ряд работ выдвигает теорию «молекулярной мимикрии» между антигенами ЩЖ, ретробульбарной клетчатки и рядом стресс-протеинов и антигенов бактерий (Yersinia enterocolitica). Эмоциональные стрессорные и экзогенные факторы, такие как курение, могут способствовать реализации генетической предрасположенности к БГ. Так, была обнаружена временная взаимосвязь между манифестацией БГ и потерей супруга (партнера). Курение повышает риск развития БГ в 1,9 раз.
БГ в ряде случаев сочетается с другими аутоиммунными эндокринными заболеваниями (сахарный диабет 1 типа, первичный гипокортицизм); такое сочетание принято обозначать, как аутоиммунный полигландулярный синдром II типа.
В результате нарушения иммунологической толерантности, аутореактивные лимфоциты (CD4 + - и CD8 + -T-лимфоциты, B-лимфоциты) опосредованно адгезивными молекулами (ICAM-1, ICAM-2, E-селектин, VCAM-1, LFA-1, LFA-3, CD44) инфильтрируют паренхиму ЩЖ, где распознают ряд антигенов, которые презентируются дендридными клетками, макрофагами, В-лимфоцитами и HLA-DR-экспримирующими фолликулярными клеткам. В дальнейшем цитокины и сигнальные молекулы инициируют антигенспецифическую стимуляцию В-лимфоцитов, в результате чего начинается продукция специфических иммуноглобулинов против различных компонентов тироцитов. В патогенезе БГ основное значение придается образованию стимулирующих антител к рецептору ТТГ (АТ-рТТГ). Эти антитела связываются с рецептором ТТГ, приводят его в активное состояние, запуская внутриклеточные системы (каскады цАМФ и фосфоинозитолов), которые стимулируют захват ЩЖ йода, синтез и высвобождение тиреоидных гормонов, а также пролиферацию тироцитов. В результате развивается синдром тиреотоксикоза, доминирующий в клинической картине БГ.
Клиническая картина
Классическая мерзебургская триада (зоб, тахикардия, экзофтальм), описанная еще Карлом Базедовым, встречается примерно у 50% пациентов. Примерно в 2/3 случаев БГ развивается в возрасте после 30 лет, не менее, чем в 5 раз чаще - у женщин. В отдельных популяциях (Япония, Швеция) БГ почти в половине случаев манифестирует на протяжении первого года после родов.
Как указывалось, клиническая картина БГ определяется синдромом тиреотоксикоза, для которого характерны: похудение (часто на фоне повышенного аппетита), потливость, тахикардия и ощущение сердцебиения, внутреннее беспокойство, нервозность, дрожь рук (а порой, всего тела), общая и мышечная слабость, быстрая утомляемость и ряд других симптомов, подробно описанных в литературе. В отличие от многоузлового токсического зоба, который связан с функциональной автономией ЩЖ, при БГ, как правило, имеет место короткий анамнез: симптомы развиваются и прогрессируют быстро и в большинстве случаев приводят пациента к врачу в пределах 6-12 месяцев. У пожилых пациентов тиреотоксикоз любого генеза часто протекает олиго- или моносимптомно (вечерний субфебрилитет, аритмии) или даже атипично (анорексия, неврологическая симптоматика). При пальпаторном исследовании примерно у 80% пациентов удается выявить увеличение ЩЖ, порой весьма значительное: пальпаторно железа плотноватая, безболезненная.
В ряде случаев, при БГ на первое место могут выходить проявления эндокринной офтальмопатии (выраженный экзофтальм, нередко имеющий несимметричный характер, диплопия при взгляде в одну из сторон или вверх, слезотечение, ощущение «песка в глазах», отечность век). Здесь следует оговориться, что наличие у пациента выраженной эндокринной офтальмопатии (ЭОП) позволяет практически безошибочно установить пациенту этиологический диагноз уже по клинической картине, поскольку среди заболеваний, протекающих с тиреотоксикозом, ЭОП сочетается только с БГ.
Диагностика
Диагностика в типичных случаях не вызывает существенных трудностей (табл. 1). При подозрении на наличие у пациента тиреотоксикоза ему показано определение уровня ТТГ высокочувствительным методом (функциональная чувствительность не менее 0,01 мЕд/л). При обнаружении пониженного уровня ТТГ пациенту проводится определение уровня свободных Т4 и Т3: если хотя бы один из них повышен - речь идет о манифестном тиреотоксикоза, если они оба в норме - о субклиническом.
После подтверждения наличия у пациента тиреотоксикоза проводится этиологическая диагностика, направленная на выявление конкретного заболевания, которое его обусловило. При УЗИ примерно в 80% случаев БГ обнаруживается диффузное увеличение ЩЖ; кроме того, этот метод может выявить характерную для большинства аутоиммунных заболевания гипоэхогенность ЩЖ. По данным сцинтиграфии при БГ выявляется диффузное усиление захвата изотопа железой. Как и при всех других аутоиммунных заболеваниях ЩЖ, при БГ могут определяться высокие уровни классических антител к ЩЖ (антитела к тиреоидной пероксидазе - АТ-ТПО и антитела к тиреоглобулину - АТ-ТГ). Это наблюдается не менее чем в 70-80% случаев БГ. Таким образом, обнаружение классических антител не позволяет отличить БГ от хронического аутоиммунного, послеродового и «безболевого» («молчащего») тиреоидита, но может, в сумме с другими признаками, существенно помочь в дифференциальной диагностике БГ и функциональной автономии ЩЖ. Следует помнить о том, что классические антитела могут обнаруживаться у здоровых людей без каких-либо заболеваний ЩЖ. Большее диагностическое значение имеет определение уровня антител к рецептору ТТГ (АТ-рТТГ), которое, увы, пока не абсолютно из-за несовершенства имеющихся тестсистем. В таблице 2 представлена краткая характеристика других заболеваний, протекающих с тиреотоксикозом, с которыми необходимо дифференцировать БГ.
Прежде всего, планируя лечение, нужно отчетливо понимать, что при БГ речь идет об аутоиммунном заболевании, причиной которого является выработка антител к ЩЖ иммунной системой. Вопреки этому, к сожалению, очень часто приходится сталкиваться с представлением о том, что хирургическое удаление части ЩЖ само по себе способно вызвать ремиссию заболевания (т.е., по сути, аутоиммунного процесса), хотя как хирургия БГ, так и терапия радиоактивным йодом-131 идеологически должна восприниматься, лишь как удаление из организма «органа-мишени» для антител, ликвидирующее тиреотоксикоз. В настоящее время существует 3 метода лечения БГ, каждый из которых не лишен существенных недостатков.
Прежде всего, планируя лечение, нужно отчетливо понимать, что при БГ речь идет об аутоиммунном заболевании, причиной которого является выработка антител к ЩЖ иммунной системой. Вопреки этому, к сожалению, очень часто приходится сталкиваться с представлением о том, что хирургическое удаление части ЩЖ само по себе способно вызвать ремиссию заболевания (т.е., по сути, аутоиммунного процесса), хотя как хирургия БГ, так и терапия радиоактивным йодом-131 идеологически должна восприниматься, лишь как удаление из организма «органа-мишени» для антител, ликвидирующее тиреотоксикоз. В настоящее время существует 3 метода лечения БГ, каждый из которых не лишен существенных недостатков.
Консервативное лечение болезни Грейвса
Назначается для достижения эутиреоза перед оперативным лечением, а также в отдельных группах пациентов в качестве базового длительного курса лечения, который в некоторых случаях приводит к стойкой ремиссии. Длительную консервативную терапию имеет смысл планировать далеко не у всех пациентов. В первую очередь, речь идет о пациентах с умеренным увеличением объема ЩЖ (до 40 мл); при зобе больших размеров после отмены тиреостатиков неминуемо разовьется тиреотоксикоз. Кроме того, консервативную терапию нецелесообразно планировать у пациентов с крупными (более 1-1,5 см) узловыми образованиями в ЩЖ и при наличии выраженных осложнений тиреотоксикоза (мерцательная аритмия, выраженный остеопороз и др.). Практически бессмысленно (и главное - небезопасно для пациента) назначение повторных курсов лечения при развитии рецидива тиреотоксикоза спустя 12-24 месяца тиреостатической терапии. Важным условием планирования длительной тиростатической терапии является готовность пациента следовать рекомендациям врача (комплаентность) и доступность квалифицированной эндокринологической помощи.
В качестве основных тиреостатиков на протяжении многих десятилетий в клинической практике во всем мире используются препараты из группы тионамидов: тиамазол (Метизол) и пропилтиоурацил. Ключевой механизм действия тионамидов заключается в том, что, попадая в ЩЖ, они подавляют действие тиреоидной пероксидазы, ингибируют окисление йода, йодирование тиреоглобулина и конденсацию йодтирозинов. В результате прекращается синтез тиреоидных гормонов и купируется тиреотоксикоз. Наряду с этим выдвигается не всеми поддерживаемая гипотеза о том, что тионамиды, в первую очередь, тиамазол, обладают эффектами на иммунологические изменения, развивающиеся при БГ. В частности, предполагается, что тионамиды влияют на активность и количество некоторых субпопуляций лимфоцитов, снижают иммуногенность тиреоглобулина за счет уменьшения его йодирования, снижают продукцию простагландинов Е2, IL-1, IL-6 и продукцию тироцитами белков теплового шока. Именно с этим связывается тот факт, что в правильно отобранной группе пациентов с БГ, на фоне подержания тионамидами эутироза в течение 12-24 месяцев примерно в 30% случаев можно ожидать развития стойкой ремиссии заболевания.
Если пациенту планируется проведение курса тиростатической терапии, тионамиды в начале назначаются в относительно больших дозах: 30-40 мг тиамазола (на 2 приема) или пропилтиоурацила - 300 мг (на 3-4 приема). На фоне такой терапии спустя 4-6 недель у 90% пациентов с тиреотоксикозом средней тяжести удается достичь эутиреоидного состояния, первым признаком которого является нормализация уровня свободного Т4. Уровень ТТГ может еще долго оставаться сниженным. На период до достижения эутиреоза (зачастую и на более длительный срок) большинству пациентов целесообразно назначение b -адреноблокаторов (пропранолол - 120 мг/сут на 3-4 приема или длительнодействующие препараты, например, атенолол - 100 мг/сут однократно). От «увлечения» малыми стартовыми дозами тиамазола, когда исходно предлагалось назначать 10-15 мг препарата в день, в последнее десятилетие большинство руководств отошли, поскольку при таком варианте терапии достижение эутиреоза растягивается на слишком большой промежуток времени, что клинически не выгодно, зачастую небезопасно и не исключает риска лейкопенических реакций. В то же время от небезопасного назначения мегадоз тиамазола в качестве стартовой терапии (80-120 мг) также отошли за исключением случаев тяжелейшего тиреотоксикоза.
После нормализации уровня свободного Т4 пациенту начинают снижать дозу тиреостатика и примерно через 2-3 недели переходят на прием поддерживающей дозы (10-15 мг в день). Параллельно, начиная от момента нормализации уровня Т4 или несколько позже, пациенту назначается левотироксин в дозе 50-100 мкг в день. Такая схема получила название «блокируй и замещай»: один препарат блокирует железу, другой замещает формирующийся дефицит тиреоидных гормонов. Схема «блокируй и замещай» проста в использовании, поскольку позволяет полностью заблокировать продукцию тиреоидных гормонов, что исключает возможность возвращений тиреотоксикоза. Критерием адекватности терапии является стойкое поддержание нормального уровня Т4 и ТТГ (последний может приходить в норму на протяжении нескольких месяцев от начала лечения). Вопреки бытующим представлениям тиамазол и пропилтиоурацил сами по себе не обладают так называемым «зобогенным» эффектом. Увеличение размера ЩЖ на фоне их приема закономерно развивается лишь при развитии медикаментозного гипотиреоза, которого можно легко избежать, назначив левотироксин в рамках схемы «блокируй и замещай».
Поддерживающая терапия «блокируй и замещай» (10-15 мг тиамазола и 50-100 мкг левотироксина) продолжается от 12 до максимум 24 месяцев (табл. 1). Дальнейшее увеличение объема ЩЖ на фоне проводимой терапии даже при условии стойкого поддержания эутиреоза (это закономерно произойдет при медикаментозном гипотиреозе или, наоборот, при недостаточной блокаде ЩЖ) существенно снижает шансы на успех лечения. На протяжении всего лечения у пациента с интервалом не менее чем 1 раз в месяц необходимо проводить определение уровня лейкоцитов и тромбоцитов. Редким (0,06%), но грозным осложнением тионамидов (как тиамазола, так, с практически одинаковой частотой пропилтиоурацила) является агранулоцитоз, казуистически редко - изолированная тромбоцитопения. После окончания курса лечения препараты отменяются; наиболее часто рецидив развивается в течение первого года после прекращения терапии.
Оперативное лечение
По современным представлениям, целью оперативного лечения, равно как и обсуждаемой ниже терапии йодом-131, является удаление большей части ЩЖ, с одной стороны, обеспечивающее развитие послеоперационного гипотиреоза, а с другой (что наиболее принципиально) - исключающее любую возможность рецидива тиреотоксикоза. С этой целью рекомендуется проведение предельно субтотальной резекции ЩЖ с оставлением тиреоидного остатка не более 2-3 мл. Проведение субтотальных резекций, с одной стороны, несет высокий риск сохранения или отдаленного рецидива тиреотоксикоза, а с другой, отнюдь не исключает развития гипотиреоза. При выполнении так называемых «экономных резекций», объем которых во всем мире расцениваются, как неадекватный, следует понимать, что оставляя во время операции достаточную для продукции тиреоидных гормонов часть ЩЖ, в организме, по сути дела, остается «мишень» для антитиреоидных антител, продуцирующихся клетками иммунной системы.
Таким образом, полеоперационный гипотиреоз в настоящее время перестал рассматриваться, как осложнение оперативного лечения БГ, и является его целью. Предпосылкой для этого стало внедрение в широкую клиническую практику современных препаратов левотироксина, на фоне адекватного приема которых у пациента сохраняется стойкий эутиреоз и качество жизни, не отличающееся от обычного. На сегодняшний день можно без преувеличения сказать, что не существует такого гипотиреоза, компенсация которого при грамотном использовании современных препаратов тиреоидных гормонов была бы невозможна. Неудачи в лечении послеоперационного и любого другого гипотиреоза следует искать либо в недостаточной квалификации проводящего заместительную терапию, либо в несоблюдении пациентом достаточно простых рекомендаций по приему препарата.
Терапия радиоактивным йодом
Можно без преувеличения сказать, что во всем мире большая часть пациентов с БГ, равно как и с другими формами токсического зоба, в качестве лечения получает именно терапию радиоактивным йодом-131. Это связано с тем, что метод эффективен, неинвазивен, относительно дешев, лишен тех осложнений, которые могут развиться во время операции на ЩЖ. Единственными противопоказаниями к лечению йодом-131 являются беременность и грудное вскармливание.
Если в нашей стране по сей день продолжает бытовать мнение о том, что терапия йодом-131 показана лишь пожилым пациентам, которым по тем или иным причинам невозможно провести операцию, то на самом деле, уже не существует нижней возрастной границы для назначения йода-131, и во многих странах йод-131 с успехом используется для лечения БГ у детей. Было доказано, что независимо от возраста риск терапии йодом-131 существенно ниже такового при оперативном лечении.
В значимых количествах йод-131 накапливается только в ЩЖ; после попадания в нее, он начинает распадаться с выделением b -частиц, которые имеют длину пробега около 1-1,5 мм, что обеспечивает локальную лучевую деструкцию тироцитов. Безопасность этого метода лечения демонстрирует тот факт, что в ряде стран, например, в США, где 99% пациентов с БГ получают йод-131 в качестве лечения первого выбора, терапия йодом-131 при БГ осуществляется в амбулаторном порядке. Существенное преимущество заключается в том, что лечение йодом-131 можно проводить без предварительной подготовки тионамидами. При болезни БГ, когда целью лечения является разрушение ЩЖ, терапевтическая активность, с учетом объема ЩЖ, максимального захвата и времени полувыведения йода-131 из ЩЖ, рассчитывается исходя из предполагаемой поглощенной дозы в 200-300 Гр. Гипотиреоз обычно развивается в течение 6 месяцев после введения йода-131.
Серьезной проблемой отечественной эндокринологии является фактическое отсутствие в распоряжении эндокринологов такого прекрасного способа лечения БГ, как терапия йодом-131.
Заключение
БГ является одним из самых частых аутоиммунных заболеваний человека. Его клиническая картина и прогноз в большинстве случаев определяются стойким тиреотоксикозом, который при отсутствии адекватного лечения может привести к тяжелой инвалидизации пациента. Существующие на сегодняшний день принципы лечения БГ, хотя и не лишены недостатков, но позволяют полностью избавить пациента от тиреотоксикоза и обеспечить приемлемое качество жизни.
Болезнь Грейвса
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Болезнь Грейвса: причины появления, симптомы, диагностика и способы лечения.
Определение
Болезнь Грейвса (другие названия - Базедова болезнь, токсический зоб) - наследственное аутоиммунное заболевание, которое может развиться в любом возрасте. Женщины болеют примерно в 5 раз чаще, чем мужчины. Болезнь характеризуется избыточной выработкой тиреоидных гормонов, что приводит к тиреотоксикозу (избытку гормонов щитовидной железы в кровеносном русле).
Замечено, что патологический процесс часто запускается в ситуациях, когда организм испытывает стресс.
Причины появления болезни Грейвса
Болезнь Грейвса связывают с врожденным дефектом специфических Т-лимфоцитов (в организме Т-лимфоциты регулируют скорость защитной реакции, ее продолжительность, обеспечивают клеточный иммунитет). Вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих тиреостимулирующие иммуноглобулины - АТ-рТТГ. АТ-рТТГ воздействуют на рецепторы к ТТГ и начинают стимулировать клетки щитовидной железы. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии).
Спусковым механизмом нарушения иммунологической толерантности может стать вирусная инфекция, стресс, курение.
При болезни Грейвса щитовидная железа может увеличиться до такой степени, что будет видна визуально. При отсутствии лечения она начинает сдавливать пищевод и трахею, вызывая нарушения глотания и дыхания.
Классификация заболевания
Классифицируется болезнь Грейвса по размеру зоба, а также по степени тяжести синдрома тиреотоксикоза.
В России до настоящего времени обычно используется классификация эндемического зоба по О.В. Николаеву, предложенная еще в 1955 году.
0-я степень - щитовидная железа не видна и не пальпируется;
1-я степень - щитовидная железа не видна, но пальпируется и виден при глотании перешеек;
2-я степень - щитовидная железа видна во время глотания, пальпируется, форма шеи не изменена;
3- я степень - щитовидная железа видна, меняется контур шеи («толстая шея»);
4-я степень - большой зоб, нарушающий конфигурацию шеи;
5-я степень - огромный зоб, сдавливающий пищевод и трахею.
Классификация по тяжести тиреотоксикоза
Субклинический период - заболевание устанавливается на основании данных гормонального исследования, клиническая картина может отсутствовать или быть стертой.
Манифестный период - присутствует развернутая клиническая картина заболевания.
Осложненный период - присутствуют осложнения (мерцательная аритмия, сердечная недостаточность, тирогенная относительная надпочечниковая недостаточность, дистрофические изменения паренхиматозных органов (печени, селезенки и т.д.), психоз, значительный дефицит массы тела).
Симптомы болезни Грейвса
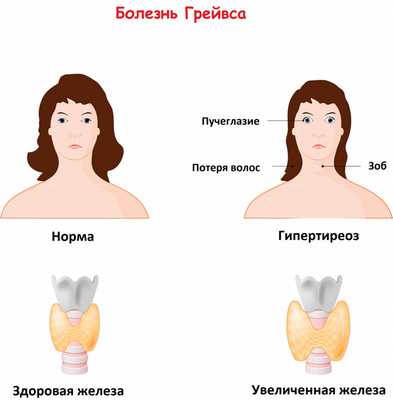
Болезнь Грейвса отличается большим разнообразием клинических проявлений. Больные предъявляют жалобы на учащенное сердцебиение (тахикардию), аритмию, жар (непереносимость теплых и душных помещений), сильное потоотделение, ощущение внутренней дрожи, потерю массы тела при хорошем аппетите, частый неоформленный стул. Характерен подъем систолического («верхнего») давления и снижение диастолического (нижнего). Многие страдают из-за нарушения сна, быстрой утомляемости и снижения работоспособности. Отмечаются отеки ног, слабость мышц, неприятное чувство сжатости в области шеи.
Второе название заболевания - Базедова болезнь - свидетельствует о том, что у пациентов нередко регистрируются офтальмологические нарушения (эндокринная офтальмопатия), которые проявляются пучеглазием (поражением мягких тканей глазницы). Можно услышать жалобы на регулярное слезотечение, давление и «песок» в глазах, двоение, отечность век, светобоязнь.
При пальпаторном обследовании примерно у 80% пациентов удается выявить увеличенную щитовидную железу.
У пациентов репродуктивного возраста может наблюдаться снижение либидо (у мужчин), для женщин характерны нарушения менструального цикла.
Как правило, симптомы развиваются быстро, поэтому пациенты приходят на прием к врачу в течение 6-12 мес. после их манифестации.
Диагностика болезни Грейвса
При подозрении на наличие у пациента тиреотоксикоза следует исследовать уровень ТТГ высокочувствительным методом.
Отражает общее содержание гормона тироксина в крови - суммарный уровень свободной и связанной с белками фракциями. Синонимы: Анализ крови на общий тироксин. Th.
При пониженном показателе уровня ТТГ пациенту проводится определение уровня св. Т4 и св. Т3: если хотя бы один из них повышен - речь идет о манифестном тиреотоксикозе, если оба показателя в норме - о субклиническом.
Свободный, не связанный с транспортными белками плазмы крови тироксин. Синонимы: Анализ крови на свободный тироксин. Free T4; Free Form of Thyroxin. Краткая характеристика .
Синонимы: Свободный трийодтиронин. Free T3. Краткое описание исследуемого вещества Трийодтиронин свободный Трийодтиронин свободный (Т3св.) относится к тиреоидным .
В число обязательных входят анализы на антитела к тиреоидной пероксидазе и к тиреоглобулину.
Синонимы: Анализа крови на АТ-ТПО; Антитела к микросомальному антигену; АТПО. Antimicrosomal Antibodies; Antithyroid Microsomal Antibodies; Thyroid Peroxidase Autoantibodies; TPO Antibodies; Thyroid Peroxidase Test; Thyroid microsomal a.
Синонимы: Анализ крови на АТ-ТГ; Антитела к ТГ; АТТГ; АнтиТГ; Анти-ТГ. Tg Autoantibody; TgAb; Anti-Tg Ab; ATG. Краткое описание исследования «Антитела к тиреоглобулину&raq.
После подтверждения тиреотоксикоза проводится диагностика с целью выявления конкретного заболевания. Ультразвуковая картина болезни Грейвса не специфичная и характерна для других аутоиммунных заболеваний щитовидной железы. Кроме того, при болезни Грейвса могут определяться высокие уровни антитиреоидных антител - ат-ТПО и ат-ТГ. Однако вкупе с другими признаками заболевания и УЗИ, и анализ крови на ат-ТПО и ат-ТГ могут помочь в диагностике.
Исследование щитовидной и паращитовидных желез, позволяющее оценить их структуру, а также обнаружить патологические изменения этих органов и регионарных лимфоуз.
Большее диагностическое значение имеет определение уровня антител к рецепторам ТТГ (ат-рТТГ).
Синонимы: Анализ крови на антитела к рецепторам ТТГ; Ат-рТТГ; Аутоантитела к рецепторам тиреотропного гормона; Тиреоидстимулирующий иммуноглобулин; Анти-ТТГр. Thyroi.
К каким врачам обращаться
В связи патологическими состояниями, сопутствующими болезни Грейвса, пациенты (особенно пожилые) нередко находятся под наблюдением кардиологов, терапевтов, гастроэнтерологов, а к эндокринологам попадают только при нарастании клинической картины основного заболевания. Поэтому всех пациентов с впервые выявленной необъяснимой сердечной недостаточностью, мерцательной аритмией, синдромом хронической усталости необходимо обследовать по поводу тиреотоксикоза.
Лечение болезни Грейвса
Консервативная терапия
Консервативное лечение препаратами из группы тионамидов (препаратами, блокирующими выработку гормонов щитовидной железы) показано пациентам с умеренно увеличенным объемом щитовидной железы (до 40 мл) и без серьезных тиреотоксических осложнений. Если через 1-2 года после консервативной терапии произошел рецидив, назначать ее повторно не имеет смысла.
Радиотерапия
Терапия радиоактивным йодом выполняется с целью разрушения щитовидной железы. Метод неинвазивен, достаточно эффективен и лишен побочных эффектов, которые могут развиться после хирургической операции.
Оперативное лечение
Назначают пациентам в случае, если щитовидная железа имеет очень большие размеры, узлы или есть подозрение на их озлокачествление. Удаление щитовидной железы позволяет добиться послеоперационного гипотиреоза, который компенсируется за счет приема левотироксина и не приводит к снижению качества жизни пациентов.
Лечение эндокринной офтальмопатии
Рекомендуются глазные капли с дексаметазоном и ношение солнцезащитных очков.
Начиная со 2-й степени офтальмопатии пациентам назначают глюкокортикоиды. При резистентности к лечению или при рецидивах назначают рентгенотерапию на область орбиты. В сложных случаях прибегают к хирургической декомпрессии глазницы с удалением ретробульбарной клетчатки, а при необходимости - костных стенок глазницы. Косметические операции проводят, если требуется коррекция экзофтальма и косоглазия, развивающихся в результате фиброзных процессов.
Осложнения
Тиреотоксикоз негативно воздействует не только на щитовидную железу, но и на другие органы и системы. Чтобы избежать инвалидизации, требуется своевременное и правильное лечение.
Наиболее опасное осложнение болезни Грейвса - тиреотоксический криз. Он проявляется резким возбуждением, повышением температуры до 40 оС, сердцебиением до 200 ударов в минуту, усилением диспепсии (тошноты, рвоты, жажды). Затем могут появиться признаки надпочечниковой недостаточности (нарушение микроциркуляции, нитевидный пульс). Эта ситуация требует принятия срочных мер для снижения уровня тиреоглобулина и проявлений криза. Факторами развития тиреотоксического криза могут быть стресс, различные заболевания, избыточная физическая нагрузка, и т.д.
К осложнениям диффузного токсического зоба относятся осложнения после его хирургического лечения: гипопаратиреоз, повреждение возвратного гортанного нерва, в результате чего развивается осиплость голоса, кровотечения, аллергические реакции на препараты.
Профилактика болезни Грейвса
Прогноз при своевременной диагностике и надлежащем лечении благоприятный. Благодаря доступной заместительной терапии удается добиться нормализации метаболических процессов и исчезновения клинических проявлений заболевания.
Профилактикой диффузного токсического зоба является отказ от курения, приема лекарств, в побочных эффектах которых упоминается влияние на выработку тиреоидных гормонов, а также йод-содержащих препаратов, соблюдение оптимального режима дня для минимизации стрессовых ситуаций и регулярный контроль ТТГ.
- Федеральные клинические рекомендации по диагностике и лечению тиреотоксикоза с диффузным зобом (диффузный токсический зоб, болезнь Грейвса-Базедова), узловым/многоузловым зобом. Трошина Е.А., Свириденко Н.Ю., Ванушко В.Э и соавт. М. 2014.
- Клинические рекомендации «Диффузный токсический зоб». Дети. Разраб. Российская ассоциация эндокринологов. - 2021. - 35 с.
- Фадеев В.В. Диагностика и лечение болезни Грейвса. Медицинский совет, журнал. №4/2014. С. 44-48.
- Ванушко. В.Э., Фадеев В.В. Болезнь Грейвса (клиническая лекция). Эндокринная хирургия, журнал. №1/2013. С. 23-33.
Диффузный токсический зоб (Базедова болезнь, или болезнь Грейвса) - симптомы и лечение
Что такое диффузный токсический зоб (Базедова болезнь, или болезнь Грейвса)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Родионова Е. А., терапевта со стажем в 14 лет.
Над статьей доктора Родионова Е. А. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Диффузный токсический зоб — это аутоиммунное поражение щитовидной железы.
Диффузный токсический зоб впервые был описан в трудах Роберта Джеймса Грейвса и Карла Адольфа фон Базедова в середине ХIХ века. Кроме данного заболевания, тиреотоксикоз может встречаться и при других заболеваниях щитовидной железы (тиреоидит, токсическая аденома и др.), что требует дифференциальной диагностики, так как лечение этих состояний не является однотипным, а осложнения из-за отсутствия или неправильного лечения могут привести к необратимым патологическим изменениям. [1] , [2]
В англоязычных странах это заболевание называют болезнью Грейвса, а немецкоязычных — Базедовой болезнью. Диффузный токсический зоб развивается из-за нарушенной функции СД8+-лимфоцитов и выработки антитиреоидных антител, среди которых особое значение придаётся тем, которые имеют сродство к рецепторам тиреотропного гормона в щитовидной железе. Эти антитела выявляются в среднем у 50% пациентов с диффузным токсическим зобом. С этими рецепторами в норме связывается тиреотропный гормон (ТТГ), что стимулирует выработку и выделение тиреоидных гормонов (ТГ). Антитела при связывании с рецепторами ТТГ увеличивают секрецию тироксина (Т4) и трийодтиронина (Т3) «в обход» регуляции ТТГ. Повышенный уровень тиреотропного гормона обуславливает развитие тиреотоксикоза. До конца не ясна причина такого дефекта иммунной системы. Имеются данные, позволяющие говорить о роли генетической предрасположенности, в частности, более широкой распространённости аллелей HLA-B8 и BW-35 у пациентов с этой болезнью. [4] Однако не выявлено какой-то одной аллели, ответственной за болезнь Грейвса. Вероятно, здесь имеет место взаимодействие нескольких аллелей.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы диффузного токсического зоба
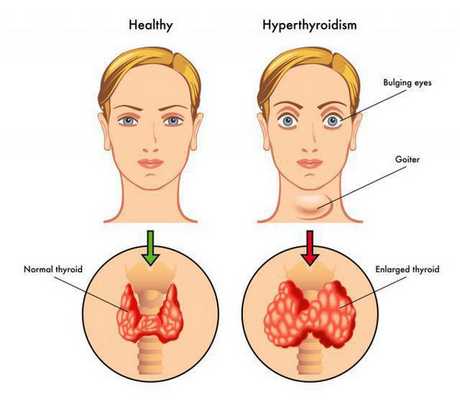
Диффузный токсический зоб чаще развивается у женщин моложе тридцати лет. [1] Синдром тиреотоксикоза связан с более интенсивным метаболизмом. Увеличивается частота сердечных сокращений, поднимается артериальное давление. Характерен подъём систолического («верхнего») давления и снижение диастолического, то есть поднимается пульсовое давление, проявляющееся выраженной пульсацией крупных и мелких артерий. [4] Характерно повышенное потоотделение, так как организм старается отдать избыточно вырабатываемое тепло (из-за нарушенной регуляции окислительного фосфорилирования). Стимуляция нервной системы проявляется раздражительностью, тремором рук. Аппетит повышается, однако масса тела снижается из-за ускоренного распада белков в организме. Редко встречается так называемый fat-Базедов-вариант, при котором масса тела увеличивается. [4] Пациенты с ДТЗ часто жалуются на слабость мышц, утомляемость, одышку. Щитовидная железа может быть увеличенной, однако нет зависимости между степенью ее увеличения и тяжестью состояния. В норме объём щитовидной железы у мужчин не превышает 25 см 3 , а у женщин — 18 см 3 . Симптомы, как правило, развиваются относительно быстро — за 6-12 мес. В 80% случаев пальпаторно определяется увеличенная, безболезненная щитовидная железа. На раннем этапе болезни пациенты могут обратиться с какой-либо одной из перечисленных жалоб, поэтому врач должен быть хорошо осведомлён о признаках тиреотоксикоза и необходимых диагностических мероприятиях. У бессимптомных пациентов с субклиническим тиреотоксикозом болезнь выявляется случайно, если по каким-либо показаниям сдаётся анализ крови на ТТГ.
При Базедовой болезни могут появляться признаки эндокринной офтальмопатии, возникающей из-за поражения периорбитальной клетчатки: выраженный экзофтальм (не всегда симметричный), диплопия, отечность век, ощущение «инородного тела в глазах». Это сильно облегчает работу врача в плане диагностики, так как среди всех состояний с тиреотоксикозом эндокринная офтальмопатия характерна именно для диффузного токсического зоба. Не следует путать эндокринную офтальмопатию с глазными симптомами тиреотоксикоза, среди которых можно выделить синдром Грефе и синдром Кохера (верхнее веко отстаёт при взгляде вверх и вниз соответственно), синдром Мебиуса (взгляд не фиксируется вблизи), синдром Штельвага (уменьшение частоты морганий). Стоит отметить, что выраженность глазных симптомов не зависит от тяжести дисфункции щитовидной железы. [4]
Некоторые авторы в развитии диффузного токсического зоба выделяют четыре стадии:
- Невротическая (вегетативный невроз и незначительное увеличение или нормальные размеры щитовидной железы);
- Нейрогормональная (увеличенные размеры щитовидной железы и клиническая картина тиреотоксикоза);
- Висцеропатическая (нарушение функции органов);
- Кахектическая (тиреотоксические кризы и общая дистрофия). [4]
Патогенез диффузного токсического зоба
Кроме генетических факторов, есть предположения о роли стресса и инфекции в развитии болезни Грейвса, а также действия токсических веществ. [4] Из-за иммунологических нарушений, происходит инфильтрация щитовидной железы лимфоцитами, выработка антител к различным её компонентам, главным образом — к рецепторам ТТГ, что приводит к стимуляции выработки ТГ и пролиферации тироцитов. Эти антитела также называют тиреостимулирующими иммуноглобулинами. Избыточное действие ТГ в организме приводит к развитию тиреотоксикоза, с признаками которого больные диффузным токсическим зобом обычно обращаются к врачу. [1] , [2]
Классификация и стадии развития диффузного токсического зоба
Согласно классификации тиреотоксикоза по Фадееву В.В. и Мельниченко Г.А., выделяется:
- субклинический;
- манифестный;
- осложнённый.
Также существует классификация зоба (патологического увеличения щитовидной железы), в которой выделяется три степени зоба, в зависимости от данных осмотра и пальпации щитовидной железы.
Классификация зоба, рекомендованная ВОЗ (2001)
- 0 cтепень: зоба нет (объём каждой доли не превышает объёма дистальной фаланги большого пальца руки обследуемого);
- I степень: зоб пальпируется, но не виден при нормальном положении шеи, или же имеются узловые образования, не приводящие к увеличению щитовидной железы;
- II степень: зоб чётко виден при нормальном положении шеи. [4] , [5]
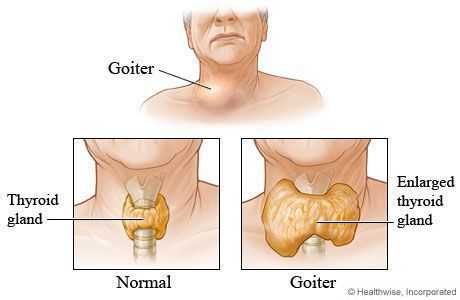
Патоморфологическая классификация диффузного токсического зоба (три варианта заболевания) опирается на данные гистологического исследования биоптата или удалённой щитовидной железы. [4] , [5]
Осложнения диффузного токсического зоба
Развившийся при диффузном токсическом зобе тиреотоксикоз поражает все системы организма. Если надлежащим образом не лечить это заболевание, то оно грозит тяжёлой инвалидизацией, а аритмии и сердечная недостаточность даже могут привести к летальному исходу.
Наиболее опасным осложнением болезни Грейвса является тиреотоксический криз, развитие которого связывают с неблагоприятными факторами (стресс, различные заболевания, выраженная физическая нагрузка, операция и др.). Появляется резкое возбуждение, температура повышается до 40 о С, частота сердечных сокращений достигает 200 ударов в минуту, может развиться фибрилляция предсердий, усиливаются явления диспепсии (тошнота, рвот, понос, жажда), повышается пульсовое артериальное давление. Затем могут появиться признаки недостаточности надпочечников (гиперпигментация, нитевидный пульс, нарушение микроциркуляции). Состояние ухудшается за несколько часов. Это ургентная ситуация, требующая неотложных мер, направленных на снижение концентрации ТГ, борьбу с надпочечниковой недостаточностью, дегидратацией, гипертермией, метаболическими нарушениями и недостаточностью кровообращения. В/в вводится гидрокортизон, проводится дезинтоксикационная и тиреостатическая терапия. К осложнениям диффузного токсического зоба также можно отнести осложнения хирургического его лечения: гипопаратиреоз, повреждение n. laryngeus recurrens (при повреждении одного нерва появляется осиплость голоса, при повреждении двух может возникнуть асфиксия), кровотечения, аллергические реакции на препараты. Об осложнениях тиреостатической терапии будет сказано ниже. [5]
Диагностика диффузного токсического зоба
При наличии у пациента признаков тиреотоксикоза ему определяют уровень тиреотропного гормона (ТТГ) высокочувствительным методом (чувс. 0,01 мЕд/л). Если уровень ТТГ меньше нормы, то исследуют концентрацию св. Т4 (тетрайодтиронин, тироксин) и Т3 (трийодтиронин). Существует понятие о так называемом субклиническом тиреотоксикозе, когда уровни Т4 и Т3 оказываются в норме. Среди антител наибольшее клиническое значение имеет уровень антител к рецепторам ТТГ (АТ-рТТГ). Высокие их титры с большой долей вероятности указывают на то, что мы имеем дело именно с болезнью Грейвса. Другие антитела, такие, как антитела к тиреоидной пероксидазе и тиреоглобулину (АТ-ТПО и АТ-ТГ), выявляются и при других состояниях, поэтому имеют значение только в комплексной оценке, и их определение может помочь в некоторых ситуациях.
На УЗИ при болезни Грейвса характерными признаками являются сниженная эхогенность и увеличение объёма (около 80% случаев). При обнаружении очаговых образований, при подозрении на опухолевые, проводится биопсия с цитологическим исследованием. В некоторых ситуациях (дифференциальная диагностика с функциональной автономией, загрудинный зоб) проводится сцинтиграфия щитовидной железы. Дифференциальная диагностика проводится с функциональной автономией щитовидной железы (характерно наличие узлов на УЗИ, «горячих» при сцинтиграфии, отсутствие антител, нет эндокринной офтальмопатии), подострым тиреоидитом (острое начало, боли в щитовидной железе, повышение температуры, связь с перенесённым инфекционным заболеванием), безболевым («молчащим») тиреоидитом (чаще бывает субклинический тиреотоксикоз), послеродовым тиреоидитом (возникает в течение 6 месяцев после родов). [3] , [5]
Лечение диффузного токсического зоба
Лечение болезни Грейвса может проводиться эндокринологом или терапевтом. К сожалению, в настоящее время лечение диффузного токсического зоба направлено только на орган-мишень, то есть щитовидную железу, а не на выработку антител, являющуюся непосредственной причиной развития болезни. Даже после удаления щитовидной железы продолжают синтезироваться антитела к рецепторам тиреотропного гормона, хотя тиреотоксикоза уже не возникает (при адекватной заместительной терапии). [9]
Итак, существует три способа лечения диффузного токсического зоба:
- консервативное лечение;
- радиойодтерапия;
- оперативное лечение.
Выбор метода зависит от возраста, сопутствующих заболеваний, степени увеличения щитовидной железы, желания пациента и возможностей лечебного учреждения. Консервативный метод лечения диффузного токсического зоба заключается в назначении тиреостатиков. В некоторых случаях (до 30%) курс такого лечения способен привести к стойкой ремиссии, в некоторых — является подготовкой к использованию другого, более радикального метода (хирургическое лечение или терапия йодом-131). Считается, что консервативная терапия неэффективна при выраженном увеличении щитовидной железы (более 40 см 3 ) и с признаками сдавления окружающих тканей, при наличии крупных узлов в ней, а также при наличии осложнений (фибрилляция предсердий, остеопороз и др.). При рецидиве после курса терапии тиреостатиком, повторный длительный курс не назначается. [5] В подобных случаях проводится курс медикаментозной подготовки к радиойодтерапии или операции.
Важным условием адекватного проведения консервативного лечения является приверженность пациента к лечению и доступность лабораторного контроля. Тиреостатики блокируют синтез тиреоидных гормонов и купируют тиреотоксикоз. По прошествии 4-6 недель тиреостатической терапии, при наступлении эутиреоидного состояния, обычно к лечению добавляют левотироксин. [4] В период тиреотоксикоза (до нормализации Т4) также целесообразно назначение препаратов из группы β-адреноблокаторов: они подавляют тканевое превращение Т4 в Т3, снижают частоту сердечных сокращений. Критерием адекватности лечения является нормальный уровень Т4 и ТТГ. Курс лечения продолжается 12-18 месяцев. Во время лечения необходимо контролировать показатели общего анализа крови. Это необходимо для контроля грозных осложнений тиреостатической терапии — агранулоцитоза и тромбоцитопении, требующих немедленной отмены препаратов. Симптомы агранулоцитоза: лихорадка, боль в горле, жидкий стул. [4] При их появлении пациенту необходимо экстренно сдать кровь на общий анализ и прекратить приём тиреостатиков до получения результатов анализа. Рецидив чаще всего наступает в первые 12 месяцев после завершения курса.
Под хирургическим лечением подразумевается удаление всей или большей части щитовидной железы. [8] Операция проводится только в состоянии эутиреоза. В настоящее время удаление этого органа не является фатальным для человека, так как имеются все возможности адекватной и недорогой заместительной терапии левотироксином. С другой стороны, при оставлении даже небольшого фрагмента железы, сохраняется вероятность рецидива заболевания, это орган-мишень для антитиреоидных антител, выделяемых иммунной системой. Таким образом, послеоперационный гипотиреоз теперь не рассматривается в качестве осложнения операции, а является её целью. Доза левотироксина после операции подбирается индивидуально и обычно составляет 1,7 мкг/кг в сутки.
В России радиойодтерапия мало распространена, что связано с дефицитом йода-131. Противопоказанием к радиойодтерапии является только беременность и период кормления грудью. Даже детский возраст не является помехой к её проведению. [6] Данный метод заключается в приёме внутрь предварительно рассчитанной дозы йода-131, который накапливается в щитовидной железе, распадается в выделением β-частиц, что приводит к лучевой деструкции тироцитов. Радиойодтерапия по сути является нехирургическим методом удаления ткани щитовидной железы. [1] , [5] , [7]
Прогноз. Профилактика
Прогноз при своевременной диагностике и надлежащем лечении благоприятный. Не рекомендуется приём лекарств, побочным эффектом которых является влияние на выработку тиреоидных гормонов, например амиодарона. Диффузный токсический зоб в большинстве случаев успешно лечится и не является приговором. Благодаря общедоступной и относительно недорогой заместительной терапии, удаётся добиться нормализации метаболических процессов и исчезновения клинических проявлений. Однако осложнения болезни Грейвса способны привести к необратимым патологическим изменениям в организме. Профилактика диффузного токсического зоба у прямых родственников больных чётко не разработана, однако можно рекомендовать отказ от курения, йод-содержащих лекарств, соблюдение оптимального режима дня для минимизации стрессовых ситуаций и регулярный контроль ТТГ. Чёткой связи между поступлением йода с пищей и болезнью Грейвса не выявлено, в регионах с недостаточным содержанием йода диффузный токсический зоб встречается не чаще; в отличие от функциональной автономии, которая в этих областях становится основной причиной тиреотоксикоза. [3] , [7]
Диффузный токсический зоб (болезнь Грейвса, Базедова болезнь)
Информация, представленная на странице, не должна быть использована для самолечения или самодиагностики. При подозрении на наличие заболевания, необходимо обратиться за помощью к квалифицированному специалисту. Провести диагностику и назначить лечение может только ваш лечащий врач.
Содержание статьи:
Что такое диффузный токсический зоб?
Болезнь Грейвса (Базедова болезнь, диффузный токсический зоб, ДТЗ) - аутоиммунная патология, характеризующаяся избытком тиреоидных гормонов, продуцируемых щитовидной железой. Повышенный уровень этих гормонов провоцирует тиреотоксикоз - состояние, при котором иммунная система человека атакует собственный организм, как следствие, поражаются практически все органы и системы.
Тиреотоксикоз и болезнь Грейвса - не синонимы. Тиреотоксикоз - синдром, сопутствующий ДТЗ, но он также может присутствовать при других патологиях и быть вызванным другими причинами (передозировка L-тироксина, опухоли, метастазы).
Женщины страдают Базедовой болезнью примерно в 5 раз чаще мужчин. В большинстве случаев патология манифестирует в возрасте от 20 до 50 лет, однако случаи заболевания фиксируются у детей и пожилых людей. Существует версия, что заболеванию более подвержены люди, испытывающие хронический стресс. ДТЗ считается опасным для жизни, так как приводит к необратимым изменениям в органах и тканях Источник:
Диффузный токсический зоб. Пашенцева А.В., Вербовой А.Ф. Клиническая медицина, 2017. с. 780-788 .
Диффузный токсический зоб или болезнь Базедова
Редкий медицинский учебник, в котором упоминается щитовидная железа, обходится без фотографии больного с большим образованием в области шеи и глазами навыкате — классического портрета человека, страдающего диффузным токсическим зобом, или базедовой болезнью.
Это одно из самых известных эндокринных заболеваний и наиболее частая причина тиреотоксикоза. Им страдает 1% всех женщин и 0,1% мужчин [1]. Базедова болезнь, или болезнь Грейвса, или диффузный токсический зоб (ДТЗ),— аутоиммунное органоспецифическое заболевание, обусловленное гиперсекрецией тиреоидных гормонов. Термин «диффузный токсический зоб» принят в отечественной эндокринологии, название «болезнь Грейвса» употребляется в англоязычных, а «болезнь Базедова» или «синдром Базедова» — в немецкоязычных странах.
Впервые это заболевание было описано в 1835 году ирландцем Робертом Джеймсом Грейвсом (1797-1853). Почти одновременно с ним, в 1840 году, немецкий врач Карл Адольф фон Базедов (1799-1854) описал наблюдаемую им у четырех пациентов так называемую мерзебургскую триаду (по названию города Мерзебурга, где он работал) — тахикардию, экзофтальм и зоб, которые являются характерными симптомами ДТЗ. Сам Базедов назвал описанное им заболевание экзофтальмической кахексией.
Этиология и патогенез
В основе механизма развития базедовой болезни лежит выработка аутоантител к рецепторам плазматических мембран тиреоцитов, близким к рецепторам тиреотропина. Эти антитела получили название тиреостимулирующих иммуноглобулинов. Причина их образования неясна (как неясны причины и других аутоиммунных заболеваний). Считается, что пусковым механизмом могут служить психические травмы, аллергические реакции, воспалительные заболевания, однако главную роль в патогенезе играет врожденная иммунологическая недостаточность, связанная с наследственными факторами.
Генетические исследования показывают, что если один из монозиготных близнецов страдает болезнью Базедова, то для другого риск заболевания составляет 60%; в случае дизиготных пар этот риск равен лишь 9% [4].
Диффузный токсический зоб часто сочетается с другими аутоиммунными заболеваниями [4]. Чаще им болеют женщины молодого и среднего возраста. Интересно, что вырабатывающиеся при ДТЗ антитела оказывают на орган-мишень стимулирующее, а не разрушающее действие, как при прочих аутоиммунных процессах. Постоянно находясь в состоянии повышенной активности, щитовидная железа продуцирует избыточное количество тиреоидных гормонов. Как правило (но не всегда), это приводит к ее диффузному увеличению и развитию офтальмопатии. Клинические проявления базедовой болезни определяются тиреотоксикозом — синдромом, который обусловлен длительным повышением концентрации тиреоидных гормонов в крови и тканях.
Поскольку гормоны щитовидной железы принимают участие в регуляции функций практически всех систем организма, повышение их концентрации оказывает негативное влияние на многие органы и системы. В целом можно сказать, что при тиреотоксикозе ускоряются все метаболические процессы.
Клиническая картина при базедовой болезни: причины и симптомы
Эндокринологи знают, что диагноз при заболеваниях щитовидной железы часто можно поставить, как говорится, «от двери», то есть по одному внешнему виду и поведению больного, по тому, как он зашел и заговорил. Страдающие базедовой болезнью, как правило, выглядят достаточно характерно: они эмоционально лабильны, тревожны, очень подвижны и беспокойны. Им свойственны обидчивость и слезливость, они склонны к депрессиям (однако могут быть и эйфоричными). Эти пациенты обычно худые, с горячими и влажными на ощупь кожными покровами, им всегда жарко. Их глаза всегда неестественно блестят, часто присутствует экзофтальм разной степени выраженности.
При осмотре у них обнаруживается тахикардия и в большинстве случаев диффузное увеличение щитовидной железы, которое и называется зобом. Если шея худая, его видно глазом. При пальпации железа безболезненная, мягкоэластичной консистенции. Кроме этих наиболее часто встречающихся симптомов, описанных еще Карлом Базедовым, существует много других, выявляющихся при более детальном обследовании.
1. Повреждающее действие избытка тиреоидных гормонов на сердечно-сосудистую систему приводит к появлению экстрасистолии, постоянной или реже пароксизмальной синусовой тахикардии, мерцательной аритмии, систолической артериальной гипертензии, постепенно развиваются миокардиодистрофия и сердечная недостаточность.
2. Похудание при повышенном аппетите, горячие кожные покровы, субфебрилитет, избыточная потливость, мышечная слабость — проявления катаболического синдрома.
3. При поражении центральной и периферической нервной системы отмечаются тремор пальцев рук («симптом Мари») и всего тела («симптом телеграфного столба»), повышаются сухожильные рефлексы.
4. В результате действия избытка Т3 и Т4 нарушается вегетативная иннервация мышц глазного яблока и верхнего века и развиваются глазные симптомы, которых описано более 50. Чаще всего встречаются симптомы Кохера и Грефе — отставание верхнего века от радужки при взгляде вниз и, соответственно, вверх.
Глазные симптомы следует отличать от аутоиммунной офтальмопатии — самостоятельного аутоиммунного заболевания, развивающегося у половины больных ДТЗ, преимущественно у мужчин. При этом заболевании возникает отек ретробульбарной клетчатки, нарушение функции глазодвигательных мышц и экзофтальм. Постепенно происходит разрастание соединительной ткани, и изменения становятся необратимыми, развиваются конъюнктивиты и кератиты с изъязвлением роговицы, больные слепнут. Офтальмопатией занимаются окулисты. Лечение состоит в поддержании эутиреоидного состояния, назначении глюкокортикоидов и НПВС. В отсутствие адекватной терапии офтальмопатия прогрессирует. Если изменения в параорбитальной области уже приняли необратимый характер, офтальмопатия сохраняется у пациента и после устранения тиреотоксикоза.
5. Возможны боли в животе, неустойчивый стул и нарушение функций печени.
6. Встречается синдром эктодермальных нарушений (ломкость ногтей,выпадение и ломкость волос).
7. Может отмечаться нарушение функции других эндокринных желез. Часто страдают надпочечники, у женщин — репродуктивная система. Наблюдаются нарушения менструального цикла, снижение фертильности, гиперпролактинемия.
8. В небольшом проценте случаев базедовой болезни сопутствует претибиальная микседема — уплотнение кожи голеней и стоп.
Тиреотоксический криз
Наиболее опасное осложнение тиреотоксикоза — тиреотоксический криз. Это остро развивающийся клинический синдром, который представляет собой сочетание тиреотоксикоза с тирогенной надпочечниковой недостаточностью.
Тиреотоксический криз развивается на фоне неадекватной тиреостатической терапии после хирургических вмешательств и при острых экстратиреоидных заболеваниях. Причины его возникновения изучены недостаточно. Больные с тиреотоксическим кризом подлежат наблюдению и лечению в отделении реанимации.
Клинически тиреотоксический криз проявляется резким нарастанием симптомов тиреотоксикоза с прогрессирующим нарушением функций сердечно-сосудистой системы, ЖКТ, ЦНС, печени и почек. Отмечается гипертермия до 40 °С, тахикардия, угнетение сознания вплоть до комы. Тиреотоксическая кома почти всегда заканчивается летальным исходом. Кроме того, часто развивается крайне трудно корригируемая острая сердечно-сосудистая недостаточность, которая является самым тяжелым осложнением тиреотоксического криза. Летальность при тиреотоксическом кризе достигает 75% [3].
Больные с тиреотоксикозом часто пользуются большой популярностью у лиц противоположного пола, если, конечно, изменения их внешности и поведения выражены умеренно и не воспринимаются немедиками как болезненные. Помню, как пациентка, у которой на фоне успешного лечения симптоматика ушла, жаловалась мне, что раньше у нее от поклонников отбоя не было, теперь же блеск в глазах пропал, а с ним и сексуальная привлекательность…
Дифференциальная диагностика диффузного токсического зоба
2. Обязательным при подозрении на базедову болезнь является исследование ТТГ и тиреоидных гормонов крови. Пониженный уровень ТТГ — это абсолютный диагностический критерий. Не следует забывать, что уровень Т3 и Т4 повышен в случае клинически развернутого тиреотоксикоза, при субклинической форме Т3 и Т4 могут быть в норме при пониженном ТТГ. Кроме того, почти всегда выявляется высокий уровень антител к рецептору ТТГ и часто — циркулирующие антитела к тиреоидной пероксидазе и тиреоглобулину (АТ-ТПО и АТ-ТГ).
3. При УЗИ выявляется диффузное увеличение щитовидной железы. Однако данные УЗИ не являются решающими, поскольку увеличение железы возможно и при других состояниях.
4. При сцинтиграфии выявляется диффузное накопление радиопрепарата всей тканью железы.
Дифференциальный диагноз проводится в первую очередь с заболеваниями и состояниями, протекающими с синдромом тиреотоксикоза (пузырный занос, ТТГ-секретирующая аденома гипофиза, некоторые тиреоидиты, функционирующие метастазы рака щитовидной железы), а также с заболеваниями сердечно-сосудистой системы, надпочечников, психопатиями.
Лечение болезни Базедова
На сегодняшний день существует три способа лечения диффузно токсического зоба щитовидной железы: терапия тиреостатиками, радиоактивным йодом-131 и оперативное лечение. Они используются на протяжении почти 100 лет, и за это время не было изобретено других эффективных методов лечения страдающих базедовой болезнью.
1. В случае если базедова болезнь была выявлена впервые, а также для достижения эутиреоидного состояния перед оперативным вмешательством и радиотерапией, назначаются тиреостатические препараты. В основном сейчас применяются тионамиды, блокирующие синтез и освобождение тиреоидных гормонов,— это тиамазол и пропилтиоурацил. Тиреостатики — достаточно безопасные препараты, клинически значимые побочные эффекты при их использовании отмечаются редко, но надо помнить, что на их фоне возможно развитие агранулоцитоза.
Показания к применению тиреостатиков ограничены. Имеет смысл назначать их при умеренно выраженных клинических проявлениях впервые выявленного тиреотоксикоза и при отсутствии осложнений [5]. Кроме того, курс лечения составляет полтора года и не каждому пациенту по силам. На фоне терапии развивается медикаментозный гипотиреоз и, как следствие, компенсаторно увеличивается щитовидная железа. Это вызывает необходимость по достижении эутиреоза назначать заместительную терапию левотироксином. Наряду с тиреостатиками для купирования проявлений со стороны сердечно-сосудистой системы часто назначаются бета-блокаторы.
Понятно, что тиреостатические препараты не оказывают никакого влияния на активность иммунной системы, иначе говоря, на причину заболевания они не действуют, а только уменьшают негативное воздействие избытка тиреоидных гормонов на организм, то есть тиреотоксикоз. После полуторагодичного курса лечения выздоравливает примерно половина пациентов [1, 4]. Кроме того, существуют случаи спонтанного излечения ДТЗ практически без какой‑либо терапии (по разным источникам, 2-5% [5]). Таким образом, заболевание либо проходит, либо требует радикального лечения.
При ДТЗ всегда повышается скорость обмена кортикостероидов: усиливается их распад и выведение, в результате чего развивается относительная надпочечниковая недостаточность, усиливающаяся при кризе.
Иногда в самом начале лекарственной терапии можно сделать предположение о ее перспективах и эффективности. Опыт показывает, что мало шансов на излечение у:
- больных с зобом больших размеров;
- мужчин;
- пациентов с изначально высоким уровнем T3 и Т4;
- больных с высоким титром антител к рецептору ТТГ [6].
2. Оперативное лечение базедовой болезни состоит в предельной субтотальной резекции щитовидной железы или даже тиреоидэктомии. Цель операции — достижение необратимого гипотиреоза, в связи с чем назначается пожизненная заместительная терапия левотироксином.
3. При терапии радиоактивным йодом назначается йод-131 в лечебной активности порядка 10-15 мКи. Показания к лечению радиойодом не отличаются от показаний к оперативному лечению.
Однажды мне довелось видеть больного, у которого в результате неадекватной терапии при умеренно выраженном клиническом тиреотоксикозе офтальмопатия привела к потере зрения на оба глаза и некротическим изменениям роговицы. Офтальмологи зашивали ему веки, причем удалось им это не с первой попытки — швы прорезались, настолько выраженным был экзофтальм.
Единственные противопоказания к нему — беременность и лактация. Женщинам репродуктивного возраста терапия радиоактивным йодом проводится только после теста на беременность, и в течение года после лечения рекомендуется контрацепция.
Период полураспада радиоактивного йода-131 — всего 8 суток, облучение проводится локально. Поэтому по неинвазивности и безопасности этот метод даже предпочтительнее оперативного вмешательства, и в развитых странах он давно уже является методом выбора.
У нас все же более популярно оперативное лечение. Применение радиоактивного йода — дорогостоящий метод, и на него существует большая очередь, потому что радиологический центр в России только один — в городе Обнинске Калужской области. Отечественные нормы радиоактивной безопасности отличаются от западных и не позволяют проводить лечение радиойодом амбулаторно. К тому же пациенты часто опасаются слова «радиоактивный» и категорически отказываются от такого способа лечения.
Тактика лечения больных базедовой болезнью в разных странах и медицинских школах может существенно различаться. Так, например, в США в 60% случаев впервые выявленного ДТЗ пациентам рекомендуется лечение радиоактивным йодом [2].
В течение полутора лет пациент принимает тиреостатики, после чего через определенные промежутки времени оценивается уровень ТТГ и тиреоидных гормонов [5]. Если эти показатели свидетельствуют о сохраняющемся тиреотоксикозе, ставится вопрос о радикальном лечении, которым в Европе, скорее всего, будет радиоактивный йод, а в нашей стране — операция.
Прогноз
Прогноз в большинстве случаев благоприятный. В случае многолетнего медикаментозного лечения, а иногда и в его отсутствие (такое тоже возможно), у пациентов развиваются экстратиреоидные осложнения, чаще всего со стороны сердечно-сосудистой системы. Но тиреотоксикоз рано или поздно сменяется гипотиреозом: долго функционирующая в усиленном режиме щитовидная железа в конце концов истощается, и количество продуцируемых ею гормонов падает ниже нормы.
Таким образом, пациенты, как получившие радикальное лечение, так и не получавшие его вовсе, приходят к одному результату — гипотиреозу. Правда, качество жизни у вторых во все годы существования ДТЗ невысокое, а первые при условии дальнейшего пожизненного приема левотироксина живут полноценной жизнью.
Существует определенная разница в отечественной и западной терминологии. В западной литературе наравне с термином «тиреотоксикоз» и в синонимичном ему значении употребляется понятие «гипертиреоз». Российские же эндокринологи гипертиреозом называют любое повышение функциональной активности щитовидной железы, которое может быть не только патологическим, но и физиологическим, например, при беременности. Этот факт следует учитывать, читая англоязычную литературу.
Читайте также:
- Пути передачи сигналов от мозжечка. Клетка Пуркинье мозжечка
- Синдром истощения яичников: причины, симптомы и лечение
- Атозибан, НПВС ( нестероидные противовоспалительные средства ), нифедипин, нитроглицерин при преждевременных родах.
- Гематология раневого процесса. Лучевые методы контроля раны
- Проблемы трудоустройства при шизофрении. Нюансы наделения властью больных шизофренией
