Синдром Гиппеля-Линдау (Hippel-Lindau) - синонимы, авторы, клиника
Добавил пользователь Дмитрий К. Обновлено: 22.01.2026
ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского», Москва, Россия
Отделение хирургии пороков сердца Российского научного центра хирургии им. акад. Б.В. Петровского РАМН, Москва
ФГБНУ «Медико-генетический научный центр», Москва, Россия
Медико-генетический центр «Геномед», Москва, Россия
Отделение хирургии печени, желчных путей и поджелудочной железы Российского научного центра хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. Б.В. Петровского РАМН
Лаборатория электронной микроскопии и иммуногистохимии Централизованного патологоанатомического отделения ГБОУ ВПО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Минздравсоцразвития России
РНЦХ им. акад. Б.В. Петровского РАМН, Москва
Нейроэндокринная опухоль поджелудочной железы и миелолипома надпочечника, ассоциированные с болезнью Гиппеля—Линдау 2-го типа
Болезнь Гиппеля—Линдау (Von Hippel—Lindau syndrome — VHL) — это наследственное заболевание, связанное с делециями и мутациями в гене Va184Leu (VHL tumour suppressor gene) [1]. Частота данного заболевания составляет 1 случай на 36 000—39 000 человек [2]. VHL имеет вариабельный фенотип, который наиболее часто проявляется в виде гемангиобластомы сетчатки, почечно-клеточной карциномы, эндокринных заболеваний надпочечников и поджелудочной железы [3].
По классификации ВОЗ выделяют VHL 1-го и 2-го типов [2]:
1. VHL 1-го типа: ретинальная ангиома, гемангиобластома, почечно-клеточная карцинома. Данный тип встречается в 83% всех случаев болезни Гиппеля—Линдау [4].
2А — ангиома сетчатки, гемангиобластома и феохромоцитома;
2В — ангиома сетчатки, почечно-клеточная карцинома и феохромоцитома;
2С — только феохромоцитома.
VHL в сочетании с феохромоцитомой встречается только в 17% случаев [4].
Опухоли поджелудочной железы при болезни Гиппеля—Линдау довольно редки и представлены нейроэндокринными поражениями, а также кистозными образованиями (простая киста, серозная цистаденома) [3].
Сочетание болезни Гиппеля—Линдау с эндокринными заболеваниями поджелудочной железы наблюдается в 5—10% случаев [2, 5, 6]. Как правило, это нейроэндокринные опухоли (NET), дисплазия островков Лангерганса и дуктулоинсулярные комплексы [7].
Эндокринные опухоли поджелудочной железы чаще всего светлоклеточные (60% наблюдений), с формированием солидных и железистых структур. При этом в строме опухоли определяются тонкостенные кровеносные сосуды с периваскулярными кровоизлияниями и пучками коллагеновых волокон [8, 9]. Данная гистологическая картина очень напоминает метастаз почечно-клеточной карциномы. Однако в отличие от почечно-клеточного рака также можно увидеть трабекулярные и гирляндоподобные структуры, характерные для эндокринных опухолей.
Иногда в нейроэндокринных образованиях поджелудочной железы, ассоциированных с VHL, определяются многовакуольные клетки с большим количеством липидов. В таких случаях данные образования имитируют перстневидно-клеточный рак особенно при пункционной биопсии поджелудочной железы [1, 10].
Иммуногистохимическое исследование в клетках NET выявляет положительную экспрессию хромогранина, А и синаптофизина [8]. 22% NET при болезни Гиппеля—Линдау негативны к хромогранину А, 17% — очагово-позитивны [6].
Известно, что 35% NET имеют очаговую реакцию к панкреатическим полипептидам, соматостатину, инсулину или глюкагону [9]. В отличие от синдрома множественных неоплазий 1-го типа важной особенностью является положительная реакция к ингибину [1]. Сильная коэкспрессия HIF-1-α, cyclinD1, CA9 и VEGF с отрицательной реакцией к инсулину и глюкагону позволяет отличить нормальные и опухолевые островки Лангерганса в случаях VHL [11].
При молекулярно-генетическом исследовании (флюоресцентная in situ гибридизация) определяется аллельная делеция 2-й копии VHL-гена [9].
Большинство нейроэндокринных опухолей поджелудочной железы при болезни Гиппеля—Линдау доброкачественны и имеют первую степень дифференцировки (2 митоза и менее на 10 HPF, индекс Ki-67 ≤2%). Вместе с тем для данной патологии существует 3 дополнительных критерия оценки потенциала злокачественности по Blansfield [3]:
1) размер опухоли 3 см и более в диаметре;
2) мутация в экзоне 3;
3) увеличение опухоли в размере в 2 раза и более за 500 дней.
Если данные критерии отсутствуют, больной с NET поджелудочной железы при VHL наблюдается каждые 2—3 года, при этом оперативное лечение не проводится. Если есть хотя бы один из указанных критериев, больной наблюдается каждые 6 мес — 1 год. При наличии 2 или 3 критериев необходима операция, так как есть риск малигнизации опухоли [3]. Некоторые авторы предлагают при размере образования 2 см в диаметре выполнять энуклеацию опухоли, при размере 3 см — резекцию поджелудочной железы, более 3 см в диаметре — панкреатодуоденальную резекцию [6].
В литературе встретился только один случай ассоциации болезни Гиппеля—Линдау с миелолипомой [12]. Известно, что эта доброкачественная опухоль неизвестной этиологии составляет 2,5% всех первичных опухолей надпочечника и, возможно, развивается в результате эндокринного дисбаланса [2, 13, 14]. В литературе описано 6 случаев сочетания миелолипомы с аденомой коры надпочечников [13, 14]. При этом опухоль состоит из двух клеточных элементов: светлых и эозинофильных клеток аденомы надпочечника, формирующих альвеолярные структуры. Среди этих клеток определяются участки хорошо отграниченной жировой ткани, смешанной с рассеянными островками элементов костного мозга эритробластами, клетками миелоидного и лимфоидного ряда [14]. Случаи сочетания миелолипомы и феохромоцитомы надпочечника в отечественной и зарубежной литературе нами не встретились.
Приводим собственное наблюдение нейроэндокринной опухоли поджелудочной железы и миелолипомы надпочечника, ассоциированной с VHL 2-го типа.
Больная 44 лет поступила в ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского» 14.05.15 с жалобами на сердцебиение, слабость, потливость, головокружение, затруднение дыхания.
В анамнезе дважды оперирована по поводу феохромоцитомы: в 1987 г. выполнена субтотальная адреналэктомия справа, в 1995 г. — субтотальная адреналэктомия слева. Гистологически оба раза была диагностирована доброкачественная феохромоцитома. Племянник больной оперирован по поводу двусторонней феохромоцитомы в возрасте 11 и 17 лет. Сын оперирован в марте 2015 г. также по поводу феохромоцитомы.
При компьютерном томографическом исследовании в январе 2014 г. у пациентки выявлены образования в проекции левого надпочечника и тела поджелудочной железы.
В июле 2014 г. в ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского» больной выполнена энуклеация опухоли головки поджелудочной железы с удалением образования забрюшинного пространства слева. Согласно протоколу операции, опухоль забрюшинного пространства 3 см в диаметре располагалась медиальнее левой почки, между нижним краем тела поджелудочной железы, левой почечной артерией и левой почечной веной. При интраоперационном УЗИ опухоль головки поджелудочной железы имела размер 1,5×1×1 см.
В марте 2015 г. выявлено новое образование в задних отделах головки поджелудочной железы. При УЗИ по заднемедиальному краю культи головки поджелудочной железы определялось гипоэхогенное слабо васкуляризированное образование размером 3,7×2 см с неровными контурами. ПЭТ-КТ в области резекции головки поджелудочной железы показала метаболически активное образование размером 2,6×2,2 см.
25.05.15 больной выполнена панкреатодуоденальная резекция. Во время операции при интраоперационном УЗИ в задненижних отделах головки поджелудочной железы обнаружено гипоэхогенное образование до 2 см в максимальном измерении.
При макроскопическом исследовании материала после первой операции образование поджелудочной железы было неправильной формы, бурого цвета, плотное, размером 2,5×1,5×1,3 см. Опухоль забрюшинного пространства (5×3×2 см) на разрезе имела вид ткани надпочечника с визуализацией коркового слоя в виде узкой полоски. В центральных отделах образование надпочечника было представлено тканью серо-розового цвета с очаговым кровоизлиянием. В материале после второй операции в головке поджелудочной железы выявлено четко отграниченное образование серовато-бурого цвета размером 1,8×1×1 см плотной консистенции.
При гистологическом исследовании опухоли поджелудочной железы в обоих случаях обнаружено инкапсулированное образование, состоящее из мономорфных клеток с хорошо развитой светлой цитоплазмой, образующих тубулярные, гирляндоподобные и трабекулярные структуры без митотической активности и признаков лимфоваскулярной инвазии (рис. 1, а). В некоторых участках клетки опухоли напоминали перстневидные или имели многовакуольную цитоплазму. В строме образования определялись пучки коллагеновых волокон с большим количеством кровеносных сосудов с тонкими стенками неправильной формы. В клетках опухоли отмечалась PAS-негативная реакция, при окраске по Гримелиусу очагово выявлялись аргирофильные гранулы.
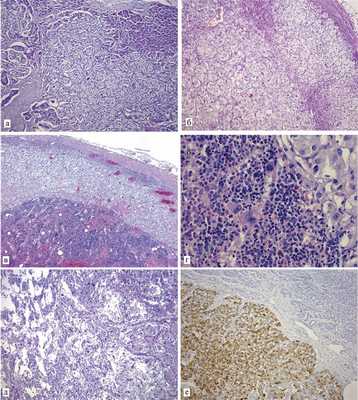
Рис. 1. Болезнь Гиппеля—Линдау. а — высокодифференцированная нейроэндокринная опухоль поджелудочной железы состоит из светлых клеток, формирующих тубулярные и трабекулярные структуры; б — доброкачественная феохромоцитома левого надпочечника, светлые клетки мозгового слоя с умеренным ядерным полиморфизмом формируют железистые и альвеолярные структуры; в, г — на фоне феохромоцитомы участки миелолипомы надпочечника, жировая ткань с островками клеток эритроидного, миелоидного и лимфоидного ряда; д — гемангиобластоподобные структуры среди клеток опухоли; е — клетки опухоли поджелудочной железы экспрессируют хромогранин А; а—д — окраска гематоксилином и эозином; е — иммуногистохимическое исследование; а, б, д, е — ×200; в — ×100; г — ×400.
При гистологическом исследовании образования забрюшинного пространства выявлена ткань надпочечника с гиперплазией и узловой перестройкой коркового слоя. В мозговом слое обнаружено образование, состоящее из двух компонентов. Первый компонент представлен светлыми клетками, формирующими трабекулярные и альвеолярные структуры (см. рис. 1, б). Определялись участки с умеренным ядерным полиморфизмом. Второй компонент в виде вкраплений представлен жировой тканью, смешанной с рассеянными островками мегакариоцитов, клеток эритроидного, миелоидного и лимфоидного ряда (см. рис. 1, в, г). Фигуры митоза, некротические изменения и признаки капсулярной и васкулярной инвазии в образовании надпочечника не определялись.
На границе коркового и мозгового слоя надпочечника обнаружены гемангиобластоподобные структуры с большим количеством мелких кровеносных сосудов капиллярного типа и стромальными вакуолизированными клетками со светлой цитоплазмой (см. рис. 1, д).
В светлоклеточном компоненте опухоли надпочечника отмечалась положительная реакция со следующими маркерами: хромогранином, А (см. рис. 1, е), синаптофизином, СD56, Ki-67 (менее 1%) и отрицательная реакция с RCC, CD10, СК18 и CK19.
Для хромосомного микроматричного анализа ткани опухоли поджелудочной железы из парафиновых блоков использована микроматрица Oncoscan («Affymetrix», США). Все этапы лабораторного исследования проведены в соответствии с протоколом производителя («Affymetrix», США). Анализ данных проводился с помощью программы ChAS, версия 3.0.
В результате исследования получен сигнал, соответствующий двум копиям гена VHL. Вне гена в исследуемом образце обнаружены множественные делеции и амплификации (рис. 2). Подобные профили были ранее описаны у пациентов с нейроэндокринными опухолями [15]. При этом делеций и амплификаций гена VHL обнаружено не было (рис. 3).
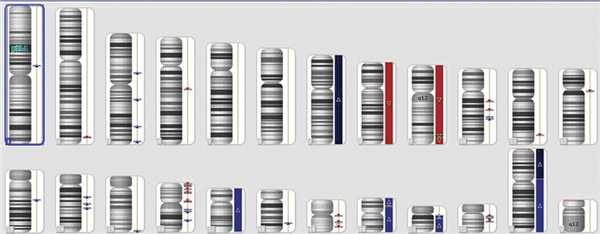
Рис. 2. Делеции и амплификации в образце опухоли поджелудочной железы.

Рис. 3. Ген VHL. Анализ покрытия гена маркерами указывает на отсутствие делеций и амплификаций (стрелкой указана локализация гена на 3-й хромосоме).
Белки, кодируемые геном VHL играют роль в кислородчувствительном пути, в стабильности и ориентации микротрубочек, супрессии опухоли, образовании ресничек, регуляции старения, цитокиновом сигнальном пути и сборке нормального внеклеточного фибронектинового матрикса [15].
С учетом клинических данных, результатов молекулярно-генетического исследования и иммунофенотипа было сделано заключение о болезни Гиппеля—Линдау 2-го типа с наличием высокодифференцированной опухоли поджелудочной железы, доброкачественной феохромоцитомы и миелолипомы надпочечника.
Заключение
Сочетание болезни Гиппеля—Линдау с нейроэндокринной опухолью поджелудочной железы и миелолипомой надпочечника наблюдается крайне редко. Для постановки диагноза необходимо комплексное клинико-морфологическое и молекулярно-генетическое обследование. В плане дифференциальной диагностики обязательны оценка потенциала злокачественности образований, а также исключение метастаза почечно-клеточной карциномы или перстневидно-клеточного рака.
Болезнь Гиппеля-Линдау ( Цереброретинальный ангиоматоз )
Болезнь Гиппеля-Линдау — аутосомно-доминантная генная патология, обуславливающая развитие в организме целого ряда полиморфных опухолей. Наиболее часто это ангиомы сетчатки, гемангиобластомы ЦНС, феохромоцитомы, новообразования почек и поджелудочной железы. Иногда проявлением заболевания выступает единичный опухолевый процесс. Диагноз верифицируется после неврологического и офтальмологического обследований, проведения КТ или МРТ головного мозга и позвоночника, УЗИ или КТ почек, поджелудочной железы, надпочечников, генетической диагностики. Лечение состоит в раннем выявлении и удалении появляющихся опухолевых образований.
МКБ-10

Общие сведения
Болезнь встречается с частотой 1 случай на 36 тыс. чел. Отличается большим полиморфизмом и различной локализацией возникающих опухолей. Наиболее распространенным признаком является ретинальный ангиоматоз, который сопровождает до 75% случаев заболевания. Зачастую он выступает диагностическим маркером данной патологии. Гемангиобластомы мозжечка по различным данным наблюдаются в 35-70% случаев, новообразования и кисты почек — у 25% больных, поражение поджелудочной железы — у 24%, феохромоцитома — у 7%. По причине большой вариабельности новообразований пациенты, имеющие болезнь Гиппеля-Линдау, нуждаются в совместной курации специалистов в области офтальмологии, неврологии, онкологии, урологии, гастроэнтерологии, эндокринологии.
Причины болезни Гиппеля-Линдау
Болезнь Гиппеля-Линдау является генной патологией. Примерно в 80% случаев она наследуется аутосомно-доминантным способом с неполной пенетрантностью гена. Еще в 20% случаев болезнь Гиппеля-Линдау возникает вследствие новых мутаций. Аберрации затрагивают расположенный в 3-ей хромосоме участок р25-26, а именно ген VHL, который играет роль супрессора, подавляющего рост новообразований. На сегодняшний день известно около 140 мутаций данного гена.
В результате недостаточной онкосупрессии происходит рост новообразований, преимущественно ангиоретикулом и гемангиобластом. Опухоли поражают мозжечок и сетчатку глаза, реже отмечаются внутримозговые опухоли полушарий, новообразования подкорковых структур и продолговатого мозга, еще реже — опухоли спинного мозга и периферических нервов. Из-за неполной проявленности генетических аберраций у некоторых пациентов может наблюдаться лишь один клинический признак болезни.
В соответствии с классификацией, болезнь Гиппеля-Линдау имеет 2 типа: без феохромоцитомы и с ее наличием. Второй тип подразделяется на варианты: 2А — с низким риском развития аденокарциномы почки, 2В — с высоким риском карциномы, 2С — наблюдается только феохромоцитома. При всех вариантах заболевания, кроме 2С, возможно наличие гемангиобластом ЦНС и ангиом сетчатки.
Симптомы болезни Гиппеля-Линдау
Дебют неврологических проявлений обычно приходится на 3-4-е десятилетия жизни. В детском возрасте болезнь Гиппеля-Линдау отличается появлением неврологической симптоматики на фоне уже существующих зрительных расстройств. В ряде случаев заболевание у детей манифестирует субарахноидальным кровоизлиянием.
Поражение ЦНС. Наиболее часто источником первичных симптомов выступают церебеллярные кисты (кисты мозжечка). Они манифестируют общемозговыми симптомами (диффузными головными болями, тошнотой без связи с приемом пищи, рвотой, шумом в ушах), обусловленными повышением внутричерепного давления. К первым признакам также относятся эпиприступы, они могут быть генерализованными либо фокальными. Со временем проявляются признаки поражения мозжечка, формирующие симптомокомплекс мозжечковой атаксии: статическая и динамическая дискоординация, адиадохокинез, гиперметрия и асинергия, интенционный тремор, миодистония. По мере роста церебеллярного новообразования возникает смещение и сдавление мозгового ствола, сопровождающееся стволовыми симптомами, в первую очередь, расстройством глотания, диплопией, дизартрией. Спинальные опухоли (чаще ангиоретикуломы) проявляются корешковыми синдромами, выпадением глубоких видов чувствительности, отсутствием сухожильных рефлексов. В 80% случаев спинальной патологии отмечается клиника, сходная с сирингомиелией. Возможна картина полного поражения поперечника спинного мозга.
Поражение глаз на ранних стадиях диагностируются лишь при офтальмоскопии. После 8 лет появляются жалобы на туманность изображения и его искажение (метаморфопсии). У половины пациентов выявляется поражение обоих глаз. Увеличивающиеся со временем ангиомы сетчатки приводят к расстройству кровообращения в ее сосудах, ишемии и кистозной дегенерации. В поздней стадии возможны увеит, катаракта, отслойка сетчатки, глаукома, гемофтальм.
Поражение почек в 60-90% случаев представлено кистами, в 45% случаев — ренальноклеточной карциномой. Как правило, почечная карцинома клинически дебютирует в возрасте от 40 до 50 лет у больных, которые ранее уже лечились по поводу новообразований. В половине случаев на момент диагностирования карциномы выявляются ее метастазы. Сочетание поликистоза почек с ангиоматозом сетчатки более характерно, чем его комбинация с церебральными ангиомами. У 35% пациентов, имеющих болезнь Гиппеля-Линдау, поликистоз диагностируется посмертно. В детском возрасте при семейном типе заболевания поликистоз почек зачастую является его единственным проявлением.
Феохромоцитома почти в половине случаев имеет двусторонний характер. Может выступать единственным клиническим проявлением болезни. В сочетании с почечной карциномой наблюдается довольно редко.
Поражение поджелудочной железы от 30 до 72% составляют ее кисты. Кисты поджелудочной железы носят доброкачественный характер и редко приводят к клинически значимой ферментативной недостаточности панкреас. Хотя известны случаи полного замещения кистой нормальных тканей железы с развитием сахарного диабета.
Диагностика болезни Гиппеля-Линдау
Полная верификация диагноза осуществляется коллегиально неврологом, офтальмологом и генетиком при участии других врачей: онколога, эндокринолога, уролога, гастроэнтеролога.
На начальном этапе проводят полный неврологический и офтальмологический осмотр. С целью выявления церебеллярных образований назначают КТ или МРТ головного мозга. Для обнаружения опухолей другой локализации необходимо УЗИ или КТ почек, УЗИ поджелудочной железы или ее МРТ, МРТ позвоночника, КТ надпочечников. Проводится анализ уровня катехоламинов и ферментов поджелудочной железы. ДНК-диагностика направлена на выявление мутаций в VHL-гене.
Предполагать и исключать болезнь Гиппеля-Линдау следует в каждом случае выявления ангиоматоза сетчатки в ходе офтальмоскопии, особенно при наличии отягощенного семейного анамнеза. В начальной стадии офтальмоскопия может определять одиночную ангиому сетчатки с дилатацией питающих ее сосудов, впоследствии ангиомы становятся множественными, характерны аневризмы и змееобразная извитость сосудов. Диагностировать самые ранние изменения сосудов сетчатки и стертые формы позволяет флюоресцентная ангиография сетчатки. С ее помощью можно дифференцировать изменения сетчатки, сопровождающие болезнь Гиппеля-Линдау, от другой офтальмологической патологии: ретинопатий, ритинита, ретинобластомы, нейропатии зрительного нерва и пр. Уточнение диагноза возможно при помощи лазерной томографии сетчатки.
Лечение и прогноз болезни Гиппеля-Линдау
Сегодня болезнь Гиппеля-Линдау имеет лишь симптоматическое лечение. Оно направлено на ликвидацию возникающих опухолевых образований. Для как можно более раннего выявления опухолей рекомендовано наблюдение и ежегодное обследование пациентов.
Ранние стадии ангиоматоза сетчатки являются показанием к фокусной лучевой терапии, однако через год после ее проведения может возникнуть радиационная ретинопатия. В отношении ангиом небольшого размера возможна лазерная коагуляция, диатермокоагуляция, при больших образованиях — транссклеральная криопексия. Если болезнь Гиппеля-Линдау сопровождается новообразованиями ЦНС, необходима консультация нейрохирурга.
Возможно хирургическое удаление опухоли мозжечка, полушарий мозга, зрительного нерва. Описаны случаи применения стереотаксической хирургии. При диагностировании почечной карциномы производится частичная нефрэктомия, при выявлении феохромоцитомы — ее удаление. Хирургическое лечение доброкачественных новообразований поджелудочной железы показано при увеличении их размеров свыше 2-3 см.
Без проведения лечения заболевание приводит к слепоте вследствие прогрессирующего ангиоматоза сетчатки и к летальному исходу вследствие развития опухолей церебральной и соматической локализации. При наблюдении и лечении пациенты доживают в среднем до 40-50-летнего возраста. Половина летальных исходов обусловлена гемангиобластомами ЦНС. На ранних стадиях радикальное удаление этих опухолей удается у большинства больных, однако новообразования склонны рецидивировать в среднем через 6 лет после их удаления.
Киста поджелудочной железы - симптомы и лечение
Что такое киста поджелудочной железы? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лядова Владимира Константиновича, хирурга со стажем в 15 лет.
Над статьей доктора Лядова Владимира Константиновича работали литературный редактор Юлия Липовская , научный редактор Елена Максимова и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Киста поджелудочной железы (pancreatic cyst) — это ограниченное скопление жидкости или содержащее жидкость образование в поджелудочной железе.

Часто они развиваются бессимптомно, поэтому выявляются обычно случайно, когда человек обследуется по поводу других патологий. Это стало возможным благодаря бурному развитию диагностических методик (УЗИ, КТ и МРТ) и повышению их доступности. По статистике, при выполнении КТ или МРТ органов брюшной полости кисты в поджелудочной железе могут обнаружиться у 3-14 % обследованных [1] .
Киста поджелудочной железы — это собирательное понятие, которое объединяет совершенно разные заболевания:
- кистозные образования поджелудочной железы воспалительной природы;
- кисты поджелудочной железы неопухолевой природы;
- кистозные опухоли (или неоплазии) поджелудочной железы.
Иногда кисты поджелудочной железы являются просто особенностью развития человека и не требуют лечения или специального интенсивного наблюдения, но, чтобы это подтвердить или опровергнуть, обычно требуется квалифицированное обследование.
Также нужно знать, что некоторые кисты поджелудочной железы могут стать злокачественными, поэтому при их обнаружении важно обратиться к грамотным специалистам, которые смогут понять, нужна ли операция или достаточно индивидуальной программы наблюдения. Чаще операция не требуется.
Причины развития кист поджелудочной железы
Основные причины — острый панкреатит (воспаление поджелудочной железы), опухолевые изменения в протоковой системе или самой ткани железы, а также врождённые факторы, например передающаяся по наследству болезнь Гиппеля — Линдау. При этом заболевании в достаточно молодом возрасте образуются опухоли почек, головного мозга и надпочечников. В 35-70 % случаев развиваются кисты поджелудочной железы. Болезнь встречается у одного из 36 тысяч человек [3] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы кисты поджелудочной железы
Часто киста поджелудочной железы не вызывает никаких симптомов. Жалобы, связанные с кистозным образованием в этом органе, встречаются примерно у каждого пятого пациента или даже реже [2] . Например, при крупной кисте в поджелудочной железе может возникать тяжесть или боль в верхних отделах живота.
В редких случаях пациенты сами могут заметить плотное, обычно почти безболезненное выпячивание в левом подреберье или по средней линии живота выше пупка. Иногда в этой области может возникать боль. Если появились такие симптомы, стоит обратиться к врачу.
Патогенез кисты поджелудочной железы
Поджелудочная железа — крупный орган, расположенный позади желудка. Справа от неё находится двенадцатиперстная кишка, слева — селезёнка.

Механизм развития кист различается в зависимости от вида:
- Кистозные образования поджелудочной железы воспалительной природы развиваются п ри остром панкреатите, когда в ткани или рядом с поджелудочной железой скапливается жидкость.
- Кисты поджелудочной железы неопухолевой природы могут быть связаны с генетическими заболеваниями, которые передаются по наследству или возникают из-за случайных мутаций генов. Например, киста может образоваться, если есть мутация в гене VHL, который подавляет бесконтрольное деление клеток [3] .
- Кистозные опухоли появляются, когда протоки поджелудочной железы закупориваются и расширяются из-за появления в стенке протоков клеток, производящих слизь (муцин).
У поджелудочной железы две основные функции: выработка богатого ферментами сока, который необходим для пищеварения, и производство ряда гормонов. Сок поджелудочной железы по системе протоков попадает в двенадцатиперстную кишку, где помогает переварить пищу. Если киста блокирует отток сока, её главный проток расширяется и может развиться острый панкреатит.

Основными гормонами поджелудочной железы являются инсулин и глюкагон. Они поддерживают уровень глюкозы (сахара) в крови. Поэтому ранним симптомом некоторых опухолевых заболеваний поджелудочной железы является сахарный диабет (повышение уровня сахара в крови), однако при кистах железы такое случается очень редко.
Классификация и стадии развития кисты поджелудочной железы
I. Кистозные образования поджелудочной железы воспалительной природы. Они возникают после перенесённого острого панкреатита. Чаще всего в мировой практике используется модифицированная в 2012 году Атлантская классификация острого панкреатита [4] . В этой классификации выделено 4 типа кистозных образований:
- Скопление жидкости без некроза (омертвения) тканей поджелудочной железы:
- Острое перипанкреатическое жидкостное скопление — появляется в ткани поджелудочной железы и жировой клетчатке вокруг неё в первые 4 недели от начала заболевания. Оно не ограниченно капсулой и часто самостоятельно рассасывается.
- «Ложная», или псевдокиста, — появляется позднее 4 недель, когда у жидкостного скопления образуется видимая на момент диагностики капсула.
- Скопление жидкости, связанное с некрозом тканей поджелудочной железы:
- Острое некротическое скопление — появляется в первые 4 недели от начала заболевания. Такое образование не ограничено капсулой и содержит омертвевшие участки ткани поджелудочной железы и жировой клетчатки вокруг неё.
- Отграниченный некроз — появляется позднее 4 недель. Скопление жидкости ограничено капсулой.
II. Кисты поджелудочной железы неопухолевой природы. Включают так называемые «истинные» кисты»: лимфоэпителиальные и ретенционные. «Истинная» киста представляют собой пузырёк с жидкостью, который окружён клетками эпителия. В норме эпителий выстилает слизистые оболочки, в том числе оболочку протоков поджелудочной железы. У «ложных» кист и кистозных опухолей нет такой эпителиальной выстилки.
III. Кистозные опухоли поджелудочной железы (или неоплазии). Это наиболее важная с точки зрения онкологии группа, так как некоторые такие опухоли могут стать злокачественными. В этой группе выделяют серозные цистаденомы, муцинозные кистозные неоплазии, внутрипротоковые папиллярно-муцинозные опухоли (ВПМО), солидные псевдопапиллярные опухоли и кистозные нейроэндокринные опухоли [5] .
Классификация внутрипротоковых папиллярно-муцинозных опухолей:
- ВПМО главного панкреатического протока. Такие образования обычно удаляются, так как у них высокий риск стать злокачественными.
- ВПМО боковых ветвей главного панкреатического протока. Это самая распространённая форма кист поджелудочной железы, нередко является множественной и у большинства пациентов не приводит к развитию рака.
- Смешанный тип [6] .

Осложнения кисты поджелудочной железы
Острый панкреатит. Может развиться, если киста блокирует отток поджелудочного сока в двенадцатиперстную кишку. Состояние сопровождается интенсивной, опоясывающей болью в верхних отделах живота, появлением тошноты и рвоты и повышением в крови уровня пищеварительных ферментов (амилазы, липазы и др.).
Механическая желтуха. Возникает, если образование в правых отделах (головке) поджелудочной железы сдавливает желчный проток. В этом случае желчь всасывается в кровь и начинает выделяться с мочой. Поэтому у пациента с механической желтухой моча тёмно-коричневого цвета, обесцвеченный кал (вплоть до белой окраски), желтушные белки глаз и кожа.
![Желтуха [13]](https://probolezny.ru/media/bolezny/kista-podzheludochnoy-zhelezy/zheltuha-13_s_onaL7M0.jpg)
Рак поджелудочной железы. Это наиболее тяжёлое осложнение кистозных опухолей поджелудочной железы. Процесс связан с накоплением мутаций в эпителии кист. Чаще всего это наблюдается в муцинозных (продуцирующих слизь) опухолях: ВПМО и муцинозных кистозных опухолях.
Клетки с признаками выраженных предраковых изменений выявляются в 38-68 % удалённых ВПМО главного панкреатического протока. При муцинозных кистозных опухолях частота озлокачествления ниже и составляет, по последним данным, около 10 %. Этот показатель возрастает по мере увеличения размеров таких образований [7] [8] .
Диагностика кисты поджелудочной железы
У большинства пациентов кисты поджелудочной железы выявляются случайно, поэтому осмотр и сбор жалоб не имеют большого значения.
Сбор анамнеза
При изучении истории болезни врач может уточнить:
- Болел ли пациент недавно острым панкреатитом. Если да, то, скорее всего, киста связана с воспалением. Однако иногда сама по себе киста поджелудочной железы может привести к развитию панкреатита. Особенно важно помнить об этом в тех ситуациях, когда панкреатит развился не на фоне употребления алкоголя или желчнокаменной болезни.
- Есть ли у кого-либо из родственников опухоли и кисты почек, головного мозга или надпочечников. Если да, врач заподозрит болезнь Гиппеля — Линдау и порекомендует проконсультироваться с медицинским генетиком.
Инструментальная диагностика
Основой диагностики кист поджелудочной железы являются инструментальные методы обследования.
УЗИ или КТ с внутривенным контрастированием. Позволяют обнаружить образования в поджелудочной железе. Однако точность этих методов обычно недостаточна, чтобы установить природу кисты и, соответственно, определить тактику лечения.
МРТ. Наиболее важный метод при кистах поджелудочной железы, так как с его помощью можно установить, связана ли киста с протоковой системой железы. Также МРТ с внутривенным контрастированием помогает выявить утолщения стенки кист, а это важнейший признак развития предраковых изменений. Использование так называемого режима DWI (диффузионно-взвешенные изображения) позволяют врачу судить о вероятности развития злокачественной опухоли на фоне кисты. Кроме этого, МРТ не сопровождается лучевой нагрузкой, не требует специальной подготовки и является нетравматичным, безопасным методом. Это особенно важно, поскольку большинству пациентов после выявления кисты нужно наблюдаться не менее нескольких лет [9] .
Эндосонография, или эндоУЗИ. В последние годы приобретает всё большее значение. Суть методики в том, что врач исследует поджелудочную железу через стенку желудка с помощью эндоскопа с закреплённым на конце ультразвуковым датчиком. Это позволяет изучить все детали новообразования или кисты с максимально возможным разрешением (около 1 мм). Исследование проводится строго натощак.

Огромным преимуществом эндоУЗИ является возможность провести биопсию. Специальная игла проводится через канал эндоскопа и позволяет взять на анализ содержимое кисты, а также ткань из стенки образования для микроскопического исследования.
Поскольку прибор имеет довольно большой диаметр, а само исследование обычно длится около часа, оно проводится под внутривенным наркозом и часто требует госпитализации в стационар. В нашей стране эндоУЗИ не применяется широко из-за дефицита самих приборов и высокой стоимости игл для биопсии под контролем эндоУЗИ [10] .
Лабораторная диагностика
Микроскопическое исследование содержимого кисты на амилазу, опухолевые маркеры CEA и СA19-9, а также муцин. Позволяет точно определить природу кисты и вероятность её злокачественной трансформации. Если в полученной жидкости повышен уровень амилазы (фермента поджелудочной железы), то можно говорить о «ложной» кисте и планировать соответствующее лечение.
Тест на мутацию в гене VHL. Выполняется при подозрении на синдром Гиппеля — Линдау. Анализ позволяет подтвердить или опровергнуть диагноз. На основании результатов врач выберет схему наблюдения не только для самого пациента, но и его ближайших родственников.
Дифференциальная диагностика
Особенности некоторых типов кистозных опухолей, которые позволяют различить их между собой:
- Серозные цистаденомы имеют характерные признаки на КТ- или МРТ-изображениях: множественные перегородки (вид «губки» или «пчелиных сот»), центральный рубец с кальцинатами. Такие образования не склонны к озлокачествлению.
- Муцинозные кистозные неоплазии чаще представлены единичной полостью.
- Особенностью ВПМО является связь с протоковой системой поджелудочной железы.
Дифференциальная диагностика этих и более редких образований часто требует провести биопсию под контролем эндоУЗИ.
Киста поджелудочной железы может быть похожа по некоторым признакам на другие образования:
- некоторые варианты протокового или нейроэндокринного рака поджелудочной железы — они могут иметь полость внутри опухоли, напоминающую кисту поджелудочной железы;
- образования рядом расположенных органов: двенадцатиперстной и тощей кишки, почки и надпочечника.
В большинстве случаев применение МРТ и/или эндоУЗИ позволяет отличить эти образования от кист поджелудочной железы.
Лечение кисты поджелудочной железы
Тактика лечения кист поджелудочной железы полностью определяется их природой.
«Ложные» кисты
«Ложные» кисты могут рассасываться самостоятельно. Лечение обычно проводится, если киста крупная и вызывает симптомы. Обычно эффективным является дренирование кисты в просвет желудка. Процедура проводится с помощью эндоУЗИ в специализированных учреждениях. Некоторым пациентам требуется операция, при которой формируется шов между стенками кисты и участком тонкой кишки, чтобы содержимое кисты оттекало в кишечник.
Кисты поджелудочной железы неопухолевой природы
Такие кисты, в том числе при наследственных генетических синдромах, обычно не требуют специального лечения.
Кистозные опухоли поджелудочной железы
Наиболее сложной является тактика ведения пациента при кистозных опухолях поджелудочной железы:
- При серозных цистаденомах вероятность злокачественной трансформации очень низкая, поэтому они редко требуют операции.
- ВПМО боковых ветвей главного панкреатического протока нужно оперировать, если есть факторы риска:
- появление в стенке узелков размером > 5 мм, которые накапливают контрастный препарат;
- быстрое увеличении образования: на несколько миллиметров в течение 6-12 месяцев;
- большой размер (> 4 см).
- ВПМО главного панкреатического протока и смешанного типа являются показанием к удалению, как и солидные псевдопапиллярные опухоли.
- Муцинозные кистозные неоплазии< 3 см очень редко становятся злокачественными, поэтому, если они не растут в течение нескольких лет, некоторые руководства рекомендуют не проводить хирургическое лечение, хотя этот вопрос ещё обсуждается. Тактика в таких случаях определяется индивидуально с учётом предпочтений пациента. То же самое касается кистозных нейроэндокринных опухолей небольшого размера [11] .
Методы лечения
Лекарственное лечение (химиотерапия) применяется только в том случае, когда при исследовании опухоли после операции выясняется, что она была злокачественной.
Хирургическое лечение является единственным способом лечения кист поджелудочной железы, однако такие операции часто приводят к развитию осложнений или даже летальному исходу. Именно поэтому в мире разработаны детальные показания к операциям при кистах поджелудочной железы, основанные на риске их злокачественного перерождения.
Наиболее опасной операцией является панкреато-дуоденальная резекция — удаление правой половины поджелудочной железы (её головки) и двенадцатиперстной кишки. У этих структур единое кровоснабжение, поэтому они удаляются вместе. Такая операция должна выполняться только в специализированных центрах и отделениях, где вероятность смерти пациента на фоне потенциальных осложнений не превышает 5 %. Те или иные осложнения развиваются примерно у половины перенёсших эту операцию пациентов.

Операции на левой половине поджелудочной железы очень редко приводят к летальному исходу. Однако они часто сопровождаются осложнениями: сок поджелудочной железы разъедает окружающие ткани, что приводит к воспалению и формированию свища. Поэтому у таких пациентов в течение нескольких недель сохраняется трубка, по которой сок поджелудочной железы оттекает из брюшной полости [12] .
Важно помнить, что, несмотря на возможные осложнения, эти операции необходимы из-за крайне неблагоприятного прогноза рака поджелудочной железы. Правильно определить показания и выполнить такое вмешательство может лишь хирург-онколог, постоянно сталкивающийся в своей практике с подобными образованиями.
Реабилитация после таких операций может быть достаточно длительной и обычно занимает от нескольких недель до нескольких месяцев.
Прогноз. Профилактика
Прогноз при кистах поджелудочной железы определяется их видом. Кисты после панкреатита и образования неопухолевой природы обычно не оказывают влияния на продолжительность жизни пациентов.
При кистозных опухолях прогноз зависит от того, успела ли образоваться злокачественная опухоль. Рак поджелудочной железы плохо поддаётся лечению: даже при I-II стадии полное излечение возможно не более, чем у 20 - 30 % пациентов после обширной операции и комплексного химиотерапевтического лечения. Поэтому удаление кистозных опухолей поджелудочной железы является профилактикой неблагоприятного течения болезни.
Важно при этом помнить, что у большинства кист и кистозных опухолей очень низкий риск стать злокачественными, в то время как риски операции довольно существенны. Поэтому решение об операции должна принимать целая команда специалистов, среди которых должен быть врач лучевой диагностики, эндоскопист, хирург и онколог [1] [2] [11] .
Профилактика кист поджелудочной железы
Все меры по профилактике развития острого панкреатита (отказ от злоупотребления алкоголем, чрезмерного количества жирной пищи и т. п.) снижают и вероятность образования «ложных» кист поджелудочной железы.
Синдром Гиппеля-Линдау (Hippel-Lindau) - синонимы, авторы, клиника
ФГУ Эндокринологический научный центр, Москва
Эндокринологический научный центр, Москва
Болезнь фон Гиппеля-Линдау (VHL-синдром)
Болезнь фон Гиппеля-Линдау является наследственным опухолевым синдромом, предполагающим развитие различных доброкачественных и злокачественных новообразований (гемангиобластома центральной нервной системы и сетчатки глаза, опухоль внутреннего уха, карцинома и кисты почек, феохромоцитома, нейроэндокринная опухоль и кисты поджелудочной железы, цистаденома придатка яичка у мужчин и широкой связки у женщин). Болезнь фон Гиппеля-Линдау - наиболее распространенная причина наследственного рака почки.
В 1895 г. Ю. фон Гиппель [1] описал пациента с ретинальной ангиомой, а в 1926 г. А. Линдау [2] — пациента с ретинальной ангиомой и гемангиоматозом центральной нервной системы. Год спустя тот же автор обнаружил ассоциацию этих проявлений с почечными и панкреатическими кистами [3]. Термин «синдром von Hippel—Lindau» (VHL) был введен Мелмоном и Роузеном [4]. Этот синдром выявляется приблизительно у 1 из 36 000 человек [5] и обусловлен мутацией в участке 3p25/26, где локализован ген подавления роста опухоли VHL [6—8]. 23% пациентов не имеют семейного анамнеза заболевания [9—13].
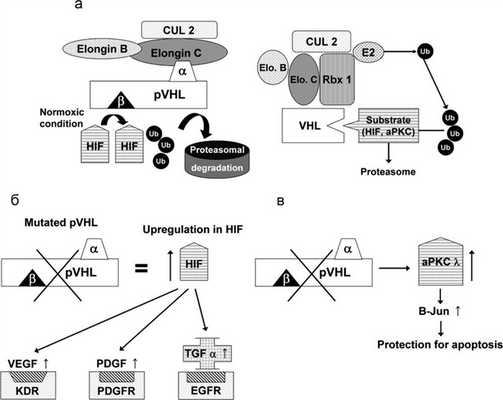
Ген VHL был идентифицирован в 1993 г. [8, 14]. Приблизительно у 20% пациентов выявляется делеция VHL-локуса в материнской или отцовской аллели [15, 16]. Герминальные мутации VHL наследуются по аутосомно-доминантному типу. Почти все мутации VHL у пациентов с феохромоцитомой являются миссенс-мутациями. Ген VHL состоит из 3 экзонов. Белок VHL (pVHL) включает 213 аминокислотных остатков, и его молекулярная масса равна приблизительно 28 кДa. Клетки с дефицитом pVHL накапливают фактор, индуцирующий гипоксию (HIF), что приводит к перепроизводству HIF-зависимых продуктов (которые вовлечены в адаптацию к гипоксии): сосудистого эндотелиального фактора роста (VEGF), эритропоэтина и трансформирующего ростового фактора альфа (TGF). Это объясняет сильную васкуляризацию VHL-ассоциированных опухолей [17—19]. Таким образом, продукт мутированного гена VHL приводит к сверхрегулированию различных генов, участвующих в патогенезе гипоксии, ускоряет ангиогенез, изменяет внеклеточный матрикс и регуляцию клеточного цикла [20—28]. Однако точные механизмы туморогенеза при синдроме VHL в настоящее время остаются неизвестными (рис. 1). Рисунок 1. Комплекс VBC (VHL protein and Elongin B, C) и механизм его действия. а — Normoxic condition — нормальное давление кислорода; Ub — убиквитин; HIF — фактор, индуцирующий гипоксию; pVHL — VHL-протеин; α — элонгин C-связывающий домен pVHL; β — β-домен (субстратсвязывающий домен) pVHL; CUL2 — куллин-2, формирующий комплекс с элонгином-B, C и pVHL; б — мутация гена VHL и, как результат, отсутствие регуляции HIF, VEGF, PDGF и TGF-α; в — мутация гена VHL и отсутствие регуляции aPKC λ (атипичная протеинкиназа C) [29].
VHL-синдром характеризуется развитием гемангиобластом сетчатки глаза (ангиомы сетчатки) и центральной нервной системы (ЦНС), билатеральной и мультифокальной дифференцированной карциномы почки, поликистоза почек, феохромоцитомы, кист и нейроэндокринных опухолей поджелудочной железы, папиллярной цистаденомы придатка яичка у мужчин и широкой связки у женщин, опухолей внутреннего уха. Поражение различных органов и степень этого поражения очень вариабельны (табл. 1, 2).

Клинически заболевание делится на две группы. Тип 1 включает главным образом большие делеции или мутации гена VHL и характеризуется полным фенотипом заболевания [поражение сетчатки, кисты или опухоли головного и спинного мозга, панкреатические, почечные, и селезеночные кисты, солидные панкреатические опухоли (реже аденокарциномы), карциномы почек, цистаденомы эпидидимуса и опухоль внутреннего уха], но без феохромоцитомы. Тип 2, при котором развивается феохромоцитома (миссенс-мутации гена VHL может иметь и неполный фенотип [13, 37, 40]. Тип 2 подразделяется на подтипы с низким (тип 2A) и высоким (тип 2B) риском развития рака почки, а также тип 2C, проявляющийся только феохромоцитомой [35, 38, 41—43] (табл. 3).
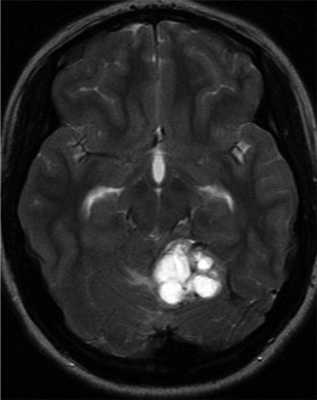
Гемангиобластомы ЦНС могут выявляться в детском возрасте, однако средний возраст диагностирования составляет 29 лет [32, 45, 46]. VHL-ассоциированные гемангиобластомы выявляются в среднем на 15 лет раньше, чем спорадические [47]. В зависимости от размера и местоположения опухоли клинические признаки гемангиобластомы ЦНС включают головную боль, тошноту, головокружение, атаксию, расстройство координации движений, нистагм, расстройства речи. Гемангиобластома спинного мозга может приводить к слабости конечностей и парестезиям. Диагноз устанавливается с помощью МРТ головного мозга и позвоночника. Гемангиобластомы обычно характеризуются медленным ростом и имеют высокий риск кровотечений, часто являются мультифокальными. Понимание патогенеза заболевания важно для выбора оптимального времени скрининга на опухоли и лечение [19]. Исследование тканей ЦНС умерших пациентов помогло пониманию гистогенеза гемангиобластом [49]. Активация фактора, индуцирующего гипоксию 2-альфа (HIF 2-α) происходит в маленьких мезенхимальных опухолях и в мезенхимальном компоненте больших опухолей. Активация HIF 1-α наблюдается в эпителиальном компоненте. Это позволило предполагать, что поражение ЦНС при VHL-синдроме — длительный процесс гемангиобластической пролиферации и дифференцировки [50] (рис. 2). Рисунок 2. Гемангиобластома ЦНС.
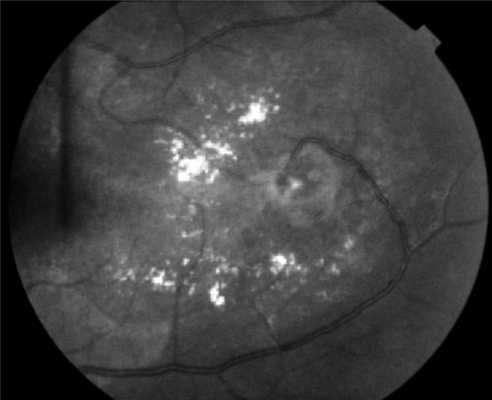
Поражения глаз выявляются примерно у 37% пациентов с VHL-синдромом, среди них только у 14% обнаруживается полная делеция VHL [51, 52]. Приблизительно у 8% пациентов снижена острота зрения [53]. Для лечения ангиомы сетчатки используют лазерную или криотерапию [32, 34, 54]. Недавние исследования [ 55, 56] показали, что при внутривенном введении антагониста сосудистого эндотелиального фактора роста (anti-VEGF) в течение 7 мес размер гемангиобластом не уменьшается (рис. 3). Рисунок 3. Ангиоматоз сетчатки.
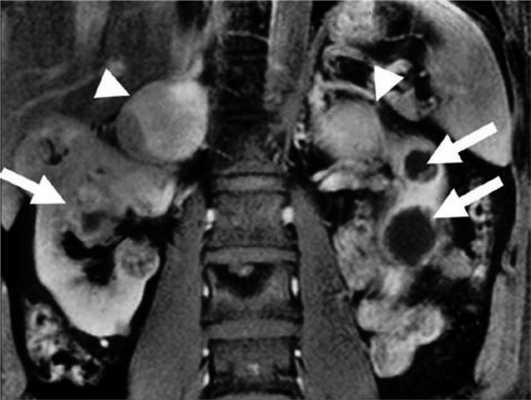
У пациентов с синдромом VHL могут встречаться как кисты, так и рак почек [57—62]. Средний возраст манифестации — 37 лет. Для диагностики используют КТ и УЗИ [36, 63, 64]. Поскольку со`лидные раки могут содержать кистозные части (что затрудняет дифференцирование доброкачественных и злокачественных процессов с помощью визуализирующих методик), при отсутствии данных о метастазах лечение должно быть направлено на удаление этих образований по возможности с соблюдением принципа органосохраняющей операции. Это позволяет поддерживать почечную функцию максимально долго и избежать диализа [58, 65]. Опухоли почек отличаются медленным ростом (3 см (по стандартам США) или 5 см (по стандартам Европы) [58, 60, 67, 68]. Некоторые авторы [69] сообщают о высоком риске местного рецидива (приблизительно 50%) в среднем в течение 53 мес (диапазон 10—115 мес) и росте опухоли со скоростью 34 мм/год (диапазон 1—10,8 мм). «Золотым» стандартом лечения небольших опухолей является открытая и лапароскопическая частичная нефрэктомия. В настоящее время используются также альтернативные методы — криотерапия и радиочастотная аблация [70]. Последние методы могут повлиять на результат патоморфологического диагноза, хотя, по некоторым данным, патоморфологический диагноз после первого цикла криотерапии приблизительно в 91% случаев подтверждает результаты предварительной биопсии [71].
Феохромоцитома выявляется примерно у 26% пациентов с синдромом VHL [37]. У пациентов с очевидно спорадической феохромоцитомой в 3—11% случаев впоследствии выявляют мутацию VHL [10, 12, 13]. Феохромоцитома может быть первым проявлением синдрома [30, 72]. В большинстве случаев надпочечниковые феохромоцитомы при VHL-синдроме двусторонние (синхронные или метахронные) [37, 73]. Вненадпочечниковые феохромоцитомы встречаются примерно в 30% случаев [37, 74—76]. Феохромоцитомы как часть синдрома VHL имеют исключительно норадреналиновый фенотип. Биохимические маркеры опухоли могут помочь отличить VHL-ассоциированные феохромоцитомы от феохромоцитом при синдроме МЭН 2-го типа [75]. Различия в биохимическом фенотипе при VHL-синдроме и МЭН 2-го типа связаны с различной экспрессией тирозингидроксилазы (TH) — лимитирующего фермента синтеза катехоламинов, и фенилэтаноламин-N-метилтрансферазы (PNMT). У пациентов с синдромом VHL отмечена низкая экспрессия PNMT, преобразующей норадреналин в адреналин. Различия биохимического фенотипа также связаны с различиями хранения, транспорта и секреции катехоламинов [77]. МЭН 2-ассоциированные феохромоцитомы содержат более высокие концентрации катехоламинов из-за более выраженной экспрессии TH. VHL-ассоциированные феохромоцитомы, секретируют катехоламины непрерывно, тогда как при синдроме МЭН 2 отмечен эпизодический характер секреции. Это определяет и различия клинических проявлений двух синдромов. Например, пациенты с МЭН 2 чаще жалуются на кризовые подъемы АД [78]. Помимо генетических различий [26], регистрируется разная экспрессия эритропоэтина и его рецептора [79]. Кроме того, около 80% феохромоцитом бессимптомны и выявляются случайно при визуализирующих исследованиях. Низкая чувствительность некоторых радионуклидных методов визуализации может объясняться относительной нехваткой гранул хранения или уменьшенной экспрессией мембранного норадреналина или везикулярных моноаминных транспортеров [80]. Поэтому сцинтиграфия с 123 I-MIBG (метайодбензилгуанидином) часто не обнаруживает VHL-связанные надпочечниковые феохромоцитомы [81, 82]. ПЭТ с 6-18F-фтордопамином более чувствительный метод [36, 83]. Злокачественные феохромоцитомы с метастазами в легких, печени, костях, лимфоузлах редко встречаются при синдроме VHL [37, 74, 84—87]. Метастазы выявляются менее чем в 7% случаев [37]. К сожалению, в настоящее время нет четких признаков, позволяющих надежно отличить доброкачественную от злокачественной феохромоцитомы, хотя уже известно, что герминальная мутация гена SDHB, является в этом отношении точным маркером [86—88]. Выявление феохромоцитомы у пациентов с синдромом VHL особенно важно, учитывая высокую вероятность хирургических вмешательств по поводу других опухолей (гемангиобластом ЦНС и др.). Невыявленная феохромоцитома при других вмешательствах может привести к опасным для жизни гипертоническим кризам. Более 70% феохромоцитом у детей являются VHL-ассоциированными. Каждому пациенту с VHL-синдромом и подтвержденной феохромоцитомой до оперативного лечения необходимо проводить ПЭТ с 6-18F-фтордопамином или сцинтиграфию с 123 I-MIBG для выявления вненадпочечниковой феохромоцитомы или метастазов [89]. Лечение феохромоцитомы оперативное. В то же время 6-месячная терапия ингибиторами тирозинкиназы приводит к уменьшению опухоли на 21% и сокращению уровня норметанефринов и хромогранина А в плазме [90] (рис. 4). Рисунок 4. Двусторонняя феохромоцитома и поликистоз почек.
Цистаденомы эпидидимуса — доброкачественные опухоли, которые могут быть двусторонними [48]. Чаще они имеют около 2 см в диаметре, могут распространяться на семенной канатик, приводя к бесплодию. Хирургическое лечение обычно не проводят; необходимо наблюдение [92].
У 35—75% пациентов с синдромом VHL имеются доброкачественные кисты и микрокистозные аденомы поджелудочной железы [93—96]. По данным КТ, у 17% пациентов выявляются панкреатические нейроэндокринные опухоли [95, 97, 98]. Из 633 пациентов с VHL-синдромом у 108 (17%) обнаруживались панкреатические эндокринные опухоли, и у 9 (8%) были выявлены метастазы [99]. Метастазирование более вероятно, если размеры опухоли превышают 3 см. У 78% пациентов с метастазами (7 из 9) мутация локализовалась в экзоне 3 гена VHL, и удвоение массы опухоли в среднем происходило за 337 дней. Таким пациентам необходимо оперативное лечение. Если размеры опухоли меньше 3 см, она растет медленно, а мутация локализована не в экзоне 3, то можно ограничиться наблюдением за пациентом. Средний возраст диагностики нейроэндокринных опухолей поджелудочной железы — 35 лет. Панкреатические кисты встречаются у больных начиная с 15 лет и чаще являются бессимптомными. В зависимости от размера и местоположения клинические симптомы могут быть вызваны обструкцией желчных путей и/или ферментной недостаточностью. В таких случаях устанавливают желчный стент и/или назначают ферментные препараты.
Гормонально-активные нейроэндокринные опухоли встречаются редко [95, 100]. По данным последних исследований, смертность при панкреатических эндокринных опухолях составляет 6%. В 60% случаев при сцинтиграфии обнаруживают рецепторы соматостатина; злокачественные опухоли выявлялись в 58% случаев [101].
Опухоли внутреннего уха располагаются в лабиринте, под твердой мозговой оболочкой на задней поверхности пирамиды височной кости [102—104]. Эти опухоли практически не метастазируют [105]. Симптомы включают потерю слуха, звон в ушах, головокружение и/или парез лицевого нерва [106, 107]. Таким образом, пациентам с мутацией VHL абсолютно показаны аудиологический осмотр, а также КТ или МРТ внутреннего уха с высокой разрешающей способностью, так как раннее хирургическое вмешательство способно сохранить слух. У пациентов с двусторонними опухолями, приводящими к глухоте, слух может быть восстановлен кохлеарным имплантом [108].
У 90% носителей мутации VHL к 60-летнему возрасту имеются те или иные клинические проявления синдрома [45]. На долгосрочный прогноз и смертность обычно влияет наличие гемангиобластом сетчатки и ЦНС, а также карциномы почки на поздних стадиях [31—33]. Таким образом, своевременное обследование и выявление патологии, ассоциированной с VHL-синдромом, является залогом успешного лечения и увеличения продолжительности жизни пациента (табл. 4).
Читайте также:
