Синдром Казабаха-Мерритта (Kasabach-Merritt) - синонимы, авторы, клиника
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Солитарная гемангиома с тромбоцитопенией потребления (Синдром Казабаха-Мерритт) - это редко встречающееся заболевание. Диагностика и лечение до настоящего времени представляет определенные сложности. В статье представлены два клинических случая диагностики и лечения синдрома Казабаха-Мерритт.
Ключевые слова
Полный текст
По классификации, предложенной Международным обществом исследования сосудистых аномалий (ISSVA), все сосудистые аномалии подразделяют на сосудистые опухоли и сосудистые мальформации. Синдром Казабаха-Мерритт - это опухоль, относящаяся к «tufted»-ангиомам и капошиформным гемангиоэндотелиомам [1]. Данная болезнь неясной этиологии, возможно, аутосомно-доминантного типа наследования, описанная H. Kasabach, K. Merritt в 1940 г. [2], встречается только у детей первого года жизни. Проявляется интенсивно растущей, обширной капиллярной гемангиомой с общей кровоточивостью микроциркуляторного типа, прогрессирующей тромбоцитопенией потребления и анемией [3]. Наиболее частая локализация гигантских гемангиом в коже туловища, шеи, лица, головы, реже во внутренних органах, в основном - это печень, головной мозг [4]. Терапия гемангиом в настоящее время достаточно стандартизирована - длительно и в высоких дозах используются глюкокортикоиды (преднизолон или метилпреднизолон), интерферон, а при не эффективности - винкристин. Альтернативными методами лечения являются лазерная терапия, склерозанты и эмболизирующие вещества, криодеструкция 5. Однако и в этих случаях не всегда удается достичь желаемого результата. Поэтому большой интерес вызывает пропранолол. Это неселективный β-блокатор, обладающий антиангиальным, гипотензивным и антиаритмическим эффектом. По данным литературы, пропранолол может тормозить и вызывать регрессию гемангиомы [9, 10]. Под нашим наблюдением находились два ребенка с синдромом Казабаха - Мерритт, госпитализированных в отделение челюстно-лицевой хирургии Детской республиканской клинической больницы (ДРКБ). Первый клинический случай. Девочка З., 07.10.2010 года рождения (3 мес), поступила в отделение челюстно-лицевой хирургии 01.02.2011 г. с диагнозом: Гемангиома правой околоушно-жевательной области» (а есть у этого заболевания диагноз по МКБ?) Анамнез жизни: ребенок от первой нормальной беременности. Роды первые срочные, физиологические. Масса при рождении 3800 г, длина 52 см. Анамнез заболевания: При рождении визуализировался экхимоз щечной области диаметром 1,0 х 1,5 см. В течение 3 мес образование интенсивно увеличивалось в размере. В феврале 2011 г. ребенок впервые консультирован челюстно-лицевым хирургом ДРКБ. Девочка госпитализирована в отделение ЧЛХ с диагнозом: D18.0 Гемангиома любой локализации, «Обширная гемангиома околоушно-жевательной области справа». Проведено обследование: ОАК Hb - 95г/л; Tr - 180 000; L - 6,9 · 109; лейкоцитарная формула в пределах нормы; свертываемость 3/30//, длительность кровотечения -1/,95//. РКТ головы и шеи - гемангиома околоушно-жевательной области справа больших размеров с распространением на боковую поверхность шеи. Инъекционная склеротерапия проведена 03.02.2011. С улучшением была выписана домой. 17.02.2011. в тяжелом состоянии за счет тромбоцитопении, анемии и респираторных нарушений вследствие агрессивного роста образования была вновь госпитализирована в отделение челюстно-лицевой хирургии по неотложным показаниям. ОАК Hb - 83г/л; Tr - 26 000; L - 6,28 · 109; моноцитоз; свертываемость 4/ 46//, длительность кровотечения -0/50//; ПТИ-43%; биохимические показатели в пределах нормы. Местно: выраженный, обширный, напряженный отек мягких тканей околоушно-жевательной области справа с переходом на верхнее веко, подчелюстную, шейную области, синюшно-багрового цвета. РКТ в динамике - патологическое образование околоушно-жевательной области справа, интенсивно накапливающее контрастное вещество (гемангиома? ангисаркома?), зона обширного перифокального отека, отека мягких тканей парафарингеального пространства справа с сужением просвета ротоглотки. На основании клинико-гематологической картины поставлен диагноз - синдром Казабаха - Мерритт. 18.02.2011 г. была проведена ангиография с эндоваскулярной окклюзией наружной сонной артерии. Начато консервативное лечение: пульс-терапия преднизолоном (10 мг/кг/сут, № 3) с дальнейшим переводом на пероральный прием в течение 3 мес, заместительная терапия эритроцитарной массой, СЗП (расшифровать). На фоне проводимого лечения у ребенка отмечалась положительная динамика: отек ангиоматозной ткани уменьшался, становился менее напряженным, купированы респираторные нарушения, нормализовались показатели периферической крови, Tr - 178 000; Hb - 107 г/л. В августе 2011 г. начата терапия пропранололом (максимальная доза 3 мг/кг/сут) в течение года, на фоне чего отмечалось значительное улучшение местного статуса, отек мягких тканей регрессировал. При достижении полной стабилизации клинико-лабораторной картины ребенок был выписан домой. До настоящего времени девочка находится под наблюдением в ДРКБ, регулярно обследуется в динамике. Состояние удовлетворительное, лицо симметричное, отека мягких тканей околоушной области не определяется, но сохраняется незначительная цианотичность кожных покровов. По данным УЗИ от 22.03.2013 г. визуализируется патологическое образование околоушной и щечной области размером 67 х 39 х 63 мм с нечеткими неровными контурами, содержащее сосуды диаметром 3,7-5,2 мм, артерии с максимальной скоростью 0,59 м/с, вены с ЛСК - 0,13 м/с, неоднородное по структуре с гипоэхогенными участками размером до 4,5 мм. Утолщение ПЖС до 6,0 мм, не содержащее сосудов. В ОАК от 03.2013 г. Tr - 240 000; Hb - 125 г/л; L - 7,4 · 109/л; ЭКГ в пределах возрастной нормы. Второй клинический случай. Девочка А., 26.03.2012 г.р. (27 дней жизни), поступила в отделение челюстно-лицевой хирургии ДРКБ 22.04.2012 г. в тяжелом состоянии из-за тромбоцитопении, анемии, коагулопатии, респираторных нарушений вследствие сдавления верхних дыхательных путей агрессивно растущим ангиоматозным образованием в околоушно-жевательной, щечной, подчелюстной области шеи слева, с переходом на правую половину подчелюстной области. Анамнез жизни. Ребенок от второй нормальной беременности. Вторые срочные физиологические роды. Масса при рождении 3260 г, рост 54 см. Закричала не сразу, по Апгар 2б-5б-8б (обвитие пуповиной). При рождении визуализировали обширную гемангиому шеи, лица, без видимых признаков отека. Анамнез заболевания. В возрасте 11 дней консультирована педиатром и челюстно-лицевым хирургом ДРКБ. Анализ периферической крови без патологических изменений. Выставлен предварительный диагноз: D18.0 Гемангиома любой локализации, «Обширная гемангиома в околоушно-жевательной, щечной, подчелюстной области шеи слева с переходом на правую половину подчелюстной области». Синдром Казабаха - Мерритт? Назначен пропранолол, ОАК с контрольным осмотром через неделю. Дома пропранолол ребенку не давали. С 20.04.2012 г. ухудшение состояния, резкое увеличение размеров гемангиомы, нарастание вялости, бледности. Обратились в приемный покой ДРКБ, в анализах крови тромбоцитопения 6 тыс., анемия 73 г/л, респираторные нарушения вследствие сдавления верхних дыхательных путей. Госпитализирована по экстренным показаниям в отделение ЧЛХ. Данные представлены в таблице. В отделении проведено обследование. УЗИ образования - в подбородочной области, боковой поверхности шеи, левой щечной области на глубине 2 мм от поверхности кожи визуализируется обширное патологическое сосудистое образование с неровными нечеткими контурами, неоднородное по структуре, с участками повышенной и пониженной эхогенности, состоящее из множества патологических сосудов: диаметром от 1,2-6,0 мм, артериальные сосуды с максимальной скоростью 0,60 м/с, венозные сосуды с максимальной скоростью 0,42 м/с. Патологическое образование имеет питающий артериальный сосуд слева диаметром в В-режиме 1,3 мм, при ЦДК (расшифровать) диаметром 3,5 мм с максимальной скоростью 0,60 м/с, данный сосуд отходит от НСА (расшифровать) на уровне бифуркации, выше НСА диаметром 1,5 мм, сосуды питающие на уровне перешейка щитовидной железы справа и слева, и со стороны полости рта слева. ОАК: Hb - 73 г/л; Tr - 7 000; L - 5,18 · 109; моноцитоз; свертываемость 3/03//, длительность кровотечения - 0/35//; фибриноген 0,75 г/л, ПТИ - 43%; биохимические показатели в пределах нормы. Местно: асимметрия лица за счет выраженного, обширного, напряженного отека мягких тканей темно-бордового цвета, без четких границ околоушно-жевательной, щечной области слева, с переходом на верхнее веко, подчелюстную, шейную области справа. Поставлен диагноз: синдром Казабаха-Мерритт. Выполнена рентгенэндоваскулярная окклюзия сосудов, питающих образование. Данное оперативное вмешательство повторено четыре раза в связи с непрекращающимся ростом образования, прогрессирующей тромбоцитопенией и тяжестью состояния. Параллельно проводилось консервативное лечение: пульс-терапия преднизолоном 15 мг/кг/сут № 5 с дальнейшим пероральным приемом 2 мг/кг, пропранолол 3 мг/кг длительно, интерферон, симптоматическая и заместительная терапия Tr-массой № 5 и Er-массой № 2, СЗП № 2. На фоне пропранолола, пульс-терапии глюкокортикоидами и внутривенным введением интерферона клинически отмечалось улучшение: уменьшение размеров гемангиомы, цвет кожных покровов в области гемангиомы бледнел, купировался респираторный синдром, увеличилось количество тромбоцитов и гемоглобина. После стабилизации состояния в июле 2012 г. ребенок переведен в стационар по месту жительства для продолжения лечения. До настоящего времени девочка наблюдается в ДРКБ. В течение года принимала пропранолол 3 мг/кг/сут. Состояние ребенка стабильное, ближе к удовлетворительному. Лицо стало симметрично, но сохраняется цианоз на месте сосудистой опухоли. При повторных УЗИ после окклюзии сохраняется патологическое сосудистое образование, патологических сосудов меньше. ЭКГ, показатели периферической крови в пределах физиологической нормы. ОАК от 04.06.2013 г. Hb - 122 г/л; Er - 3,4 г/л; Rt - 3%; Tr - 254 тыс. Вывод Таким образом, рассматривая эти два клинических случая, можно сделать вывод, что применение рентгенэндоваскулярной окклюзии сосудов, питающих образование, и прием пропранолола говорят об очевидном преимуществе этих методов. Приостанавливается не только рост, но и сокращается размер опухоли. Начальные признаки улучшения отмечаются уже в первые сутки лечения. Сокращение длительности лечения преднизолоном - наименьшее количество побочных эффектов. Развитие обеих пациенток соответственно своему возрасту.
Синдром Казабаха-Мерритта
Синдром Казабаха-Мерритта (СКМ) — редкое педиатрическое заболевание, при котором гемангиома сочетается с тромбоцитопенией и коагулопатией потребления. Имеет неясную этиологию. При СКМ у ребенка возникает сосудистая опухоль большого размера, наблюдаются мелкие геморрагии, могут быть массивные кровотечения. Диагностика синдрома основана на оценке клинических проявлений, сонографии мягких тканей, исследованиях клеточного состава и свертывающей способности крови. Медикаментозное лечение проводится кортикостероидами, пропранололом. Хирургическая помощь нужна для уменьшения косметического дефекта и радикального удаления опухоли.
МКБ-10
Общие сведения
Синдром Казабаха-Мерритта встречается в современной педиатрии крайне редко, хотя один из его компонентов — доброкачественная сосудистая неоплазия — выявляется с частотой 1:1500 живых новорожденных. В медицинской литературе описано около 200 клинических случаев синдрома у детей первого года жизни, в другие возрастные периоды патология не развивается. Свое название заболевание получило благодаря американским ученым Казабах и Мерритт, которые в 1940 году описали связь между гигантской гемангиомой и тромбоцитопенией у младенца.
Причины
Этиологические факторы синдрома Казабаха-Мерритта не установлены. Некоторые специалисты считают, что болезнь обусловлена аутосомно-доминантным типом наследования. Существует теория о связи гемангиомы с гормональным фоном, поскольку заболевание чаще поражает девочек. К предрасполагающим факторам относят плохую экологию, действие тератогенных факторов при беременности, наличие у женщины экстрагенитальных патологий.
Патогенез
Большинство ученых полагают, что развитие синдрома вызвано чрезмерным накоплением и стазом тромбоцитов в кровеносных сосудах гемангиомы. Замедление кровотока в опухоли и повреждения эндотелия этой зоны провоцируют быстрое внутрисосудистое свертывание крови, для которого затрачивается большое количество специальных свертывающих факторов. В результате возникает коагулопатия потребления, которая усугубляет нарушения системы гемостаза.
Симптомы
Характерные сосудистые опухоли видны сразу после рождения ребенка или появляются в первые месяцы его жизни. Гемангиомы при СКМ преимущественно расположены на голове и туловище, в редких случаях они локализуются во внутренних органах, что затрудняет диагностику. Кожа над новообразованием красно-фиолетового оттенка, плотная и горячая на ощупь. При болезни Казабаха-Мерритта опухоли быстро увеличиваются в объеме, опережая рост ребенка.
Нарушение свертывания крови проявляется петехиями — мелкими красными высыпаниями на коже и слизистых, которые связаны с поражением внутрикожных капилляров. При массивной тромбоцитопении бывают кровотечения из пупочной ранки, желудочно-кишечного тракта. Изредка возникает кровоизлияние в гемангиому, из-за чего она увеличивается в размерах, становится напряженной, кожные покровы над неоплазией выглядя натянутыми и блестящими.
В большинстве случаев при синдроме Казабаха-Мерритта общее состояние младенца остается удовлетворительным, поскольку сосудистые образования практически не болят. Появление двигательного беспокойства, повышенной плаксивости, проблем со сном характерно для кровоизлияния в новообразование, вследствие чего ребенок ощущает боль и дискомфорт. У младенца может быть отставание в физическом развитии, медленный набор массы тела.
Осложнения
У страдающих синдромом Казабаха-Мерритта летальный исход наступает в 10-37% случаев, что обусловлено частыми геморрагическими осложнениями заболевания. У детей высокий риск развития ДВС-синдрома и профузного кровотечения в фазе гипокоагуляции. Реже возникают кровоизлияния в жизненно важные органы. Среди серьезных осложнений синдрома Казабаха-Мерритта выделяют гиперсистолическую сердечную недостаточность, полиорганную недостаточность.
Еще одна группа негативных последствий болезни — инфекционные осложнения. Они развиваются при изъязвлении поверхности гемангиомы, что сопровождается внедрением в рану патогенных микроорганизмов и нагноением. При этом есть риск распространения процесса с формированием флегмоны, началом сепсиса, септического шока. При локализации сосудистой опухоли на коже большую значимость приобретает косметический дефект.
Диагностика
Постановка диагноза синдрома Казабаха-Мерритта начинается с полного клинического осмотра младенца. При обследовании педиатр сразу же обнаруживает сосудистую опухоль, определяет ее границы и наличие осложнений. При детальном осмотре кожи выявляются петехиальные высыпания. Дальнейший план обследования включает инструментальные и лабораторные методы:
- УЗИ мягких тканей. Сонография рекомендована для оценки размеров и распространенности гемангиомы вглубь тканей, обнаружения тромбов и кровоизлияний в клетчатке. При подозрении на внутриорганную локализацию сосудистой неоплазии делают УЗИ органов грудной и брюшной полости, в ряде случаев требуется нейросонография.
- Анализы крови. В гемограмме обнаруживают гипохромную микроцитарную анемию, снижение уровня тромбоцитов — значение менее 40 г/л связано с явными клиническими проявлениями геморрагического синдрома. При проведении коагулограммы снижен ПТИ, удлиняется АЧТВ, присутствуют другие признаки нарушений свертываемости крови.
Лечение синдрома Казабаха-Мерритта
Консервативная терапия
Основу лечения синдрома Казабаха-Мерритта составляет гормонотерапия кортикостероидами, которые провоцируют развитие фибробластов в патологическом очаге. В неоплазии формируется соединительная ткань, сдавливающая сосуды и уменьшающая их кровенаполнение. Объем гемангиомы сокращается, кожный покров над ней бледнеет, снижается риск жизнеугрожающих кровотечений. Гормоны в педиатрической практике применяют по физиологической альтернирующей схеме или в режиме пульс-терапии.
Для успешного регресса сосудистого новообразования младенцу требуется 1-4 курса гормонотерапии длительностью по 28 дней каждый. При лечении глюкокортикоидами проводят коррекцию электролитного баланса крови с помощью растворов хлористого кальция, глюконата кальция. Как вариант поддерживающей терапии назначается аскорбиновая кислота, витамины группы В.
Второй компонент лечения — коррекция нарушений гемостаза при выраженной тромбоцитопении. Ребенку переливают тромбоцитарный концентрат, используют ингибиторы фибринолиза, вводят замороженную плазму и криопреципитат. На фоне массивных кровотечений начинается анемия, которая требует заместительной терапии эритроцитарной массой.
Перспективным средством терапии синдрома Казабаха-Мерритта является неселективный блокатор пропранолол. Он вызывает сосудистый спазм, угнетает факторы роста опухоли, стимулирует апоптоз клеток. Клинические наблюдения показывают, что при приеме препарата быстро уменьшается размер гемангиомы, кожа бледнеет и размягчается. Однако, применение пропранолола иногда провоцирует «рикошетный» рост новообразования.
Хирургическое лечение
Радикальная терапия предполагает удаление гемангиомы в короткие сроки, но у детей с синдромом Казабаха-Мерритта формируются большие по размеру неоплазии, которые не подлежат одномоментному лечению. Инвазивные методы в основном проводят после гормонотерапии, когда опухоль становится меньше, ее сосуды частично спадаются. Неплохие косметические результаты показывает криотерапия пораженной зоны, интенсивная местная рентгенотерапия, инъекционная склеротерапия.
Прогноз и профилактика
Для синдрома Казабаха-Мерритта характерна высокая смертность вследствие профузных кровотечений, но использование современного комплексного подхода позволило сократить процент летальных исходов. При раннем назначении гормонотерапии удается остановить рост опухоли, вызвать ее регрессию, однако изменение цвета кожи на месте гемангиомы представляет серьезную косметическую проблему. Меры профилактики синдрома не разработаны.
1. Случай синдрома Казабаха-Мерритта у ребенка/ Н.И. Макеева, Ю.В. Одинец, И.Н. Поддубная// Современная педиатрия. — 2018.
2. Терапия детей с синдромом Казабаха-Мерритта/ Л.А. Хачатрян, А.А. Масчан// Педиатрия. Журнал им. Г.Н. Сперанского. — 2018.
3. Применение пропранолола в лечении синдрома Казабаха-Мерритта у детей (обзор литературы)/ Д.В. Федорова, Л.А. Хачатрян// Вопросы гематологии/онкологии и иммунопатологии в педиатрии. — 2016.
4. Опыт диагностики и лечения синдрома Казабаха-Мерритта у детей первого года жизни/ П.В. Токарев// Практическая медицина. — 2013.
Педиатрия
Журнал имени Г.Н. Сперанского
издается с мая 1922 года
Каталог
2018 / Том 97 / № 4
Ю.Г. Федюкова, Э.Г. Бойченко, А.М. Попов, Т.А. Макарова, И.А. Гарбузова, С.А. Боронина, Н.А. Филатова, Г.Р. Шарапова, В.Н. Фокин, М.А. Раков, О.В. Макарова, А.Н. Шапочник, Л.И. Жарикова, Ю.В. Румянцева, А.И. Карачунский
О.В. Паина, Е.В. Семенова, П.В. Кожокарь, А.С. Боровкова, А.С. Фролова, А.Г. Хабирова, К.А. Екушов, Т.Л. Гиндина, А.Л. Алянский, И.М. Бархатов, Л.С. Зубаровская, Б.В. Афанасьев
Д.А. Евстратов, П.А. Жарков, А.В. Пшонкин, Ю.Г. Абугова, Ю.Ю. Дьяконова, Н.М. Ершов, Л.А. Потапенко, С.А. Радыгина, Е.В. Феоктистова, В.В. Фоминых, Д.В. Литвинов, В.В. Щукин, Н.В. Мякова
М.В. Тихонова, О.И. Быданов, А.С. Слинин, Н.А. Большаков, И. Мельхер, А.В. Ремизов, В.Ю. Рощин, Н.Г. Ускова, А.В. Нечеснюк, Д.В. Литвинов, М.В. Телешова, Н.С. Грачев, А.Е. Друй, Д.Ю. Качанов, А.И. Карачунский
Ю.И. Ровда, С.А. Шмулевич, А.В. Шабалдин, Е.В. Шабалдина, Н.Н. Миняйлова, И.Н. Сизова, Е.Б. Лукоянычева
Е.А. Сальникова, С.С. Озеров, А.Е. Самарин, М.В. Рыжова, И.Д. Бородина, А.В. Нечеснюк, О.И. Щербенко, Е.П. Ерега, А.П. Шапочник, М.Б. Белогурова, А.Н. Зайчиков, И.Э. Гербек, А.И. Карачунский, А.Г. Румянцев, Э.В. Кумирова
Т.В. Cергеева, Д.Ю. Качанов, А.В. Нечеснюк, Н.С. Грачев, М.В. Телешова, В.Ю. Рощин, Г.В. Терещенко, Т.В. Шаманская, С.Р. Варфоломеева
Е.В. Дерипапа, Ю.А. Родина, А.Л. Лаберко, Д.Н. Балашов, Н.В. Мякова, С.Б. Зимин, Н.В. Давыдова, М.А. Гордукова, Д.С. Абрамов, Г.В. Пай, Л.Н. Шелихова, А.П. Продеус, М.А. Масчан, А.А. Масчан, А.Ю. Щербина
Я.Я. Яковлев, Ф.К. Манеров, О.И. Андриянова, С.А. Дудкин, Н.В. Матвеева, Н.В. Селиванова, О.А. Загородникова, О.В. Доманская
М.Г. Кантемирова, А.А. Глазырина, С.Х. Курбанова, Ю.Ю. Новикова, О.А. Коровина, А.А. Лапшин, Д.А. Медянцева, Д.Ю. Овсянников, И.Е. Колтунов
Искать статью, автора
СТАТЬИ ПО НАЗВАНИЯМ
Архив журнала
Пресс-конференция к 100-летию журнала «Педиатрия» имени Г.Н. Сперанского»
Состоялся выпуск специальной программы на телеканале "Россия сегодня", посвященный 100-летию журнала «Педиатрия» имени Г.Н. Сперанского».
РУМЯНЦЕВ Александр Григорьевич - ЗАСЛУЖЕННЫЙ ВРАЧ РОССИЙСКОЙ ФЕДЕРАЦИИ
Указом Президента Российской Федерации, за заслуги перед государством и многолетнюю добросовестную работу присвоено почетное звание «ЗАСЛУЖЕННЫЙ ВРАЧ РОССИЙСКОЙ ФЕДЕРАЦИИ» РУМЯНЦЕВУ Александру Григорьевичу
Обновление разделов сайта
Российская научно-практическая конференция «Менингококковая инфекция - недооцененные проблемы. Другие бактериальные и вирусные поражения нервной системы» 15-16 февраля 2022 г

Мы приглашаем принять участие всех желающих 15-16 февраля в Российской научно-практической конференции «Менингококковая инфекция - недооцененные проблемы. Другие бактериальные и вирусные поражения нервной системы».
Материалы сайта предназначены для лиц 18 лет и старше.
Адрес для корреспонденции: 115054, Москва, М-54, а/я 32.
Индексы для индивидуальных подписчиков: 71458, 71695 (год)
Индексы для предприятий и организаций: 71459, 71696 (год)
Международный индекс:
ISSN 0031-403X (Print)
ISSN 1990-2182 (Online)
Импакт-фактор журнала можно уточнить на сайте: www . elibrary . ru
Теоретические и клинические аспекты тромбоцитопении новорожденных
Рассмотрены причины и механизмы развития тромбоцитопений у новорожденных, описан алгоритм диагностического поиска в случае выявления тромбоцитопении, приведен пример клинического наблюдения новорожденного с диагнозом «изоиммунная тромбоцитопеническая пурп
Causes and mechanims of newborns' thrombocytopenia development have been analysed, algprithm of diagnostic process in case of thrombocytopenia revealing has been described, case of clinical observation of newborn with diagnosis thrombocytopenic isoimmune purpura has been reviewed.
К тромбоцитопениям относят состояния, при котором количество тромбоцитов периферической крови составляет менее 150 × 10 9 /л. Это довольно частый гематологический синдром в неонатальном периоде. У 1-5% детей тромбоцитопения регистрируется при рождении, но только у 0,1-0,5% новорожденных она является тяжелой (количество тромбоцитов менее 50,0 × 10 9 /л) [1, 2]. Примерно в половине случаев тромбоцитопения проявляется геморрагическим синдромом.
Причины тромбоцитопений у новорожденных весьма вариабельны [3]. Это могут быть первичные тромбоцитопении, в основе которых, как правило, лежат иммунопатологические процессы. Вторичные (симптоматические) тромбоцитопении возникают на фоне различных состояний, среди которых чаще вирусные или бактериальные инфекции, тяжелые гипоксические проявления, иммунодефицитные состояния, синдром внутрисосудистого свертывания крови и др. Все формы тромбоцитопенической пурпуры по механизму возникновения являются приобретенными, даже в случаях рождения ребенка с клинической картиной тромбоцитопенической пурпуры.
Механизмы развития тромбоцитопений в неонатальном периоде различны. Среди них выделяют:
1. Повышенное разрушение тромбоцитов — в результате иммунных процессов:
а) изоиммунная (аллоиммунная) тромбоцитопеническая пурпура. Развитие данного заболевания схоже с гемолитической болезнью, однако иммунологический конфликт обусловлен несовместимостью плода и матери по тромбоцитарным антигенам (чаще всего по PLA1-антигену, который отсутствует у матери). В сенсибилизированном материнском организме появляются антитромбоцитарные антитела, которые, проникая через плаценту, вызывают разрушение тромбоцитов у плода. Изосенсибилизация может быть как при повторной, так и при первой беременности. Встречается с частотой 1 случай на 1000 новорожденных [4];
б) трансиммунная тромбоцитопеническая пурпура развивается у детей, родившихся от матерей, страдающих аутоиммунной тромбоцитопенией. Это бывает при идиопатической тромбоцитопенической пурпуре, системной красной волчанке, аутоиммунном тиреоидите, синдроме Эванса и др. Аутоантитела матери проникают через плаценту и вызывают разрушение тромбоцитов у плода. Поскольку после рождения ребенка проникновение антител от матери к ребенку прекращается, то данная форма заболевания имеет благоприятный прогноз.
Механическое разрушение тромбоцитов в результате повышенного их потребления в кавернозных сосудистых образованиях встречается при синдроме Казабаха-Мерритта.
2. Повышенное потребление тромбоцитов при синдроме внутрисосудистого свертывания крови, искусственной вентиляции легких, гемолитико-уремическом синдроме.
3. Недостаточная продукция тромбоцитов — а-, гипомегакариоцитозы. Выделяют исключительно амегакариоцитарные тромбоцитопении, которые не сочетаются с какими-либо другими видами патологии. Гипомегакариоцитозы — сочетаются или с синдромом отсутствия лучевой кости (ТАР-синдром), или с другими костными и органными дефектами и дисплазиями. Панцитопении — когда а-, гипомегакариоцитоз сочетается с аплазией других ростков кроветворения, с различными нарушениями пигментации, врожденными аномалиями скелета, глаз, ушей, сердца.
Помимо вышеперечисленных механизмов и форм заболевания выделяют гетероиммунные тромбоцитопении, при которых антитела вырабатываются против чужого антигена, расположенного на поверхности тромбоцитов. Примером чужеродного антигена являются лекарства, вирусы. Также возможно развитие тромбоцитопении в результате изменения антигенной структуры тромбоцитов, под влиянием вирусного воздействия. После выведения лекарства из организма или выздоровления от вирусной инфекции признаки болезни исчезают и больной выздоравливает.
Развитию тромбоцитопении новорожденных способствует и ряд токсических и лекарственных форм, употребляемых беременными женщинами. В их числе — алкоголь, тиазидные препараты, гидралазин, сульфаниламиды, фуразолидон, фенилбутазон, эстрогены, гепаринотерапия и др.
Механизм развития тромбоцитопений при внутриутробных инфекциях довольно сложен и связан с недостаточной продукцией тромбоцитов костным мозгом, угнетением мегакариоцитарного ростка токсинами возбудителя, гиперспленизмом, ДВС-синдромом.
Алгоритм диагностического поиска в случае выявления тромбоцитопении у новорожденного предусматривает:
1) сбор анамнестических данных: у матери — наличие аутоиммунной тромбоцитопении (идиопатическая тромбоцитопеническая пурпура, системная красная волчанка, аутоиммунный тиреоидит, синдром Эванса и др.); аномалий плаценты (хориоангиоматоз, отслойка, тромбоз), применения лекарственных препаратов. У новорожденного — преморбидный фон (гипоксические состояния, недоношенность, задержка внутриутробного развития (ЗВУР), переношенность и т. д.); наличие основного заболевания (внутриутробная инфекция, иммунодефицитные состояния, гигантская гемангиома и т. д.);
2) определение характера тромбоцитопении — первичности или вторичности;
3) изучение клинических данных: геморрагический синдром в первые дни жизни ребенка в виде кожных проявлений (петехии, экхимозы), кровотечений из микроциркуляторного русла (носовые, десневые и пр.), кровотечения из пуповинного остатка, мелена. Для геморрагического синдрома при тромбоцитопениях характерны спонтанность, несимметричность, полиморфность и полихромность. Локализацию кровоизлияний в склерах и конъюнктиве следует расценивать как прогностически неблагоприятный признак в плане возникновения кровоизлияний в головной мозг. При трансиммунной форме геморрагический синдром постепенно идет на спад, поскольку поступление антитромбоцитарных антител к ребенку от матери прекращается и разрушения тромбоцитов не происходит [5]. В случае вторичных тромбоцитопений геморрагии развиваются на фоне основного заболевания, характерным симптомом является гепатосленомегалия. Выраженность геморрагического синдрома у новорожденных при ТОRCH-инфекциях зависит не только от возбудителя, но и от гестационного возраста, в котором плод подвергся действию инфекционного агента. Для синдрома Казабаха-Меррита характерно развитие мелены новорожденных;
4) оценку лабораторных показателей. О наличии тромбоцитопении свидетельствует:
- число тромбоцитов в периферической крови менее 150 × 10 9 /л на фоне нормальных других ее показателей;
- увеличение продолжительности кровотечения по Дуке более 4 мин;
- снижение ретракции кровяного сгустка менее 60%;
- гиперплазия мегакриоцитарного ростка (более 54-114 в 1 мкл) в миелограмме;
- отсутствие отклонений в лабораторных тестах, характеризующих коагуляционное звено гемостаза.
Обнаружение антитромбоцитарных антител подтверждает иммунный характер заболевания. Выявление диагностически значимого повышения титра антител к какому-либо возбудителю (цитомегаловирусу (ЦМВ), вирусу Эпштейна-Барр, вирусу краснухи, простого герпеса и др.) подтверждает вторичность тромбоцитопении (гетероиммунные формы заболевания).
Только последовательное и тщательное проведение всех этапов диагностического поиска позволяет врачу получить четкое представление о происходящих в организме ребенка процессах и выработать правильную тактику лечения.
Наличие геморрагического синдрома независимо от характера тромбоцитопений (первичный или вторичный) ставит в основу лечебных мероприятий купирование геморрагических проявлений.
При иммунных тромбоцитопениях в случае легкого течения заболевания, сопровождающегося только кожным синдромом. В качестве препаратов выбора служат ангиопротекторы — этамзилат 12,5% раствор по 0,1 мл/кг в/в или в/м 2-4 раза в сутки или по 500 мг 4-6 раз в сутки внутрь. Фармакологическое действие препарата связано с повышением устойчивости капилляров, уменьшением их проницаемости, улучшением микроциркуляции, а также стимуляцией образования фактора свертывания крови III, нормализации адгезии тромбоцитов [6]. Ингибиторы фибринолиза — эпсилон-аминокапроновая кислота в дозе 50 мг/кг в/в капельно один раз в сутки. Ее действие базируется на торможении активирующего влияния стрептокиназы, урокиназы и тканевых киназ на фибринолиз, нейтрализации эффектов калликреина, трипсина и гиалуронидазы, уменьшении проницаемости капилляров [6]. Подавление иммунопатологического процесса достигается путем применения глюкокортикоидов — преднизолон в дозе не менее 2 мг/кг в сутки в два приема. Возможно проведение альтернативной терапии — иммуноглобулины человека нормальные (Иммуновенин, Пентаглобин, Октагам) в дозе 0,4 г/кг в сутки в/в в течение 5 дней. Положительный эффект иммуноглобулинов обусловлен блокадой Fc-рецепторов макрофагов, что уменьшает опсонизацию тромбоцитов и предотвращает их разрушение в кровеносном русле. Применение иммуноглобулинов позволяет получить более быстрый (через 24-48 часов), но менее стойкий эффект, чем при применении глюкокортикоидов. Поэтому довольно часто прибегают к комбинированному использованию этих препаратов. Однако по данным зарубежных авторов использование преднизолона и иммуноглобулинов при аллоиммунной форме заболевания остается дискутабельным [7, 8].
В случае развития жизнеугрожающих кровотечений показано применение тромбоцитарного концентрата. К его применению необходим тщательный и взвешенный подход, поскольку при иммунных формах переливание тромбоконцентрата противопоказано, т. к. его использование может еще больше усугубить процесс в связи с избыточным образованием антител. Показанием к трансфузии тромбоцитов является число тромбоцитов менее 20/нл без признаков кровотечения и менее 30/нл при признаках кровотечения [7]. Расчетной дозой для переливания тромбоконцентрата является 10 мл/кг, однако оптимальная доза может быть получена при проведении индивидуального математического расчета в пересчете на один из параметров (массу тела, объем циркулирующей крови, площадь тела). После трансфузии необходим контроль уровня тромбоцитов. Клиническим критерием эффективности трансфузий тромбоконцентрата служит купирование геморрагического синдрома, увеличение количества тромбоцитов у больного через 1 час после трансфузии не менее чем на 50-60 × 109/л и удержание результата через 24 часа.
При вторичных тромбоцитопениях необходимо проводить терапию основного заболевания, поскольку прогноз определяется именно его течением.
Таким образом, диагностика тромбоцитопений новорожденных является весьма сложным процессом, грамотное проведение которого во многом предопределяет успех терапевтических мероприятий, а следовательно — прогноз и качество жизни пациента.
Приводим собственное клиническое наблюдение новорожденного с диагнозом «изоиммунная тромбоцитопеническая пурпура», которая была диагностирована у ребенка с сопутствующим заболеванием — врожденным пороком сердца.
Анамнез жизни. От первой беременности, протекала на фоне кандидозного кольпита. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к вирусу простого герпеса 1-го типа. Роды в срок, масса при рождении 3060 г, длина 53 см. К груди приложен сразу, сосал активно. При рождении на коже отмечались множественные элементы от петехий до экхимозов, местами сливные. В раннем неонатальном периоде желтуха физиологическая появилась на третьи сутки жизни, уровень общего билирубина 170 мкмоль/л, глюкоза — 4,3 ммоль/л, C-реактивный белок (СРБ) менее 5 нг/мл. Максимальная убыль первоначальной массы тела составила 8,5%, пупочный остаток отпал на четвертые сутки жизни. Отмечалась легкая неврологическая симптоматика в виде снижения рефлекторной активности, мышечной гипотонии. Гемограмма в первые сутки жизни: гемоглобин 150 г/л, эритроциты — 4,6 × 10 12 /л, цветовой показатель — 0,9, лейкоциты — 9,4 × 10 9 /л, палочкоядерные нейтрофилы — 3%, сегментоядерные — 65%, лимфоциты — 27%, моноциты — 4%, эозинофилы — 1%. СОЭ 3 мм/час. В течение раннего неонатального периода кожно-геморрагический синдром сохранялся и имел тенденцию к усилению в виде появления новых элементов. Проведено лечение: этамзилат, менадиона натрия бисульфит (Викасол), фототерапия. В связи с отсутствием положительной динамики ребенок переведен на второй этап лечения.
При поступлении. Состояние тяжелое. Кожа бледно-розовая, акроцианоз, периорбитальный цианоз в покое, геморрагии по всему туловищу от мелкоточечных до экхимозов 3-4 см в диаметре, полихромные. Слизистые оболочки неба, глотки, конъюнктивы, склеры чистые. Со стороны внутренних органов: дыхание через нос свободное, при аускультации над всей поверхностью легких проводится пуэрильное дыхание, хрипов нет, перкуторно — коробочный оттенок перкуторного звука, частота дыхания 45 в минуту. Область сердца визуально не изменена, при аускультации сердечные тоны приглушены, ритм сохранен, частота сердечных сокращений 123 в минуту. Живот при пальпации мягкий, печень у края реберной дуги, селезенка не пальпируется. Пупочная область без особенностей. Стул, диурез не нарушены. В течение последующих трех дней сохранялось прежнее состояние, на туловище множественные геморрагии, в т. ч. и «свежие», аппетит снижен. Со стороны сердца при аускультации во втором межреберье слева грудины выслушивался систолический шум средней интенсивности. Печень +3,5 см из-под края реберной дуги, селезенка +1,0 см. Масса тела 2850 г.
Обследование. Динамика результатов гемограммы представлена в таблице.
СОЭ на протяжении всей госпитализации не превышала 6 мм/час. Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови уровень СРБ менее 10 нг/мл, печеночные пробы в норме, умеренная гипопротеинемия. Иммуноферментный анализ (ИФА) на специфические антитела к антигенам ЦМВ — отрицательные, ИФА на специфические антитела к антигенам вируса Эбштейна-Барр — отрицательные, ИФА с герпесвирусами 1-го, 2-го типа — IgМ — отрицательные, IgG — положительный, индекс авидности 72%. ИФА на специфические антитела к хламидийному антигену — отрицательные, ИФА с микоплазменным антигеном — отрицательные, ИФА к токсоплазменному антигену — отрицательные. В коагулограмме: протромбиновый тест — международное нормализованное отношение (МНО) — 1,0, протромбиновый индекс (ПТИ) — 100%, протромбиновое время — 15,3 сек; фибриноген — 1,62 г/л, тромбиновое время — 16 сек. Миелограмма на 14-е сутки жизни (5-й день госпитализации): бластные клетки 0,5%, индекс созревания нейтрофилов — 1,0, индекс созревания эритрокариоцитов — 0,8, лейкоэритробластические соотношения — 1,3:1,0 (норма 2,1:4,5). Заключение: тип кроветворения нормобластический. Отшнуровка тромбоцитов слабо выражена, имеется много мегакариоцитов разной степени зрелости.
Исследование крови у матери отклонений в гемограмме не выявило.
На электрокардиограмме признаки гипертрофии правого желудочка и межжелудочковой перегородки. ЭХО-КГ-исследование: выявлены дополнительная трабекула левого желудочка, дефект межпредсердной перегородки 6 мм, сброс крови слева направо. Сократительная способность миокарда желудочков удовлетворительная, фракция выброса 68%. УЗИ органов брюшной полости: печень 53 мм, структура однородная. Селезенка размер 44 × 26 мм, структура однородная. Почки: слева — лоханка 7 мм, размер 46 × 21 мм, справа — размер 45 × 22 мм. Нейросонография: гипоксические изменения и признаки незрелости структур головного мозга.
Таким образом, данный клинический пример демонстрирует сложность интерпретации клинико-лабораторных показателей у детей периода новорожденности. Лабораторная диагностика иммунных тромбоцитопений во многих лечебных учреждениях нашей страны еще недостаточно развита. Только четкий алгоритм диагностического поиска позволит врачу достаточно быстро и четко оценить все многообразие причин, приводящих к развитию тромбоцитопений новорожденных и оперативно и правильно назначить адекватную терапию. Поэтому распространение информации о патогенезе и существующих методах исследования различных форм иммунных тромбоцитопений и внедрение этих методов в клиническую практику является необходимым условием улучшения диагностики и повышения эффективности лечения этих заболеваний.
Литература
- Масчан А. А., Румянцев А. Г. Иммунно-опосредованные тромбоцитопении новорожденных: дифференциальный диагноз и принципы терапии // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2010, т. 9, № 3, с. 13-18.
- Пшеничная К. И. Врожденные тромбоцитопатии у детей: особенности диагностики, симптоматики и лечения: Автореф. дисс. д-ра мед. наук. СПб, 2002. 28 с.
- Шабалов Н. П. Неонатология: Учебн. пособие. Т. 2. М.: МЕДпресс-информ. 2004. 640 с.
- Durand-Zaleski I., Schlegel N., Blum-Boisgard C. et al. Screening primiparous women and newborns for fetal/neonatal alloimmune thrombocytopenia: a prospective comparison of effectiveness and costs. Immune Thrombocytopenia Working Group // Am J Рerinatol. 1996; 13 (7): 423-431.
- Головко О. К., Линчевский Г. Л., Воробьева О. В. Клинические аспекты иммунных тромбоцитопений в неонатологии // Здоровье ребенка. 2006. № 2. С. 115-122.
- Регистр лекарственных средств. М.: РЛС-2005. 1440 с.
- Рооз Р. Неонатология. Практические рекомендации: пер. с нем. М.: Мед. лит. 2011. 592 с.
- Berkowitz R. L., Kolb E. A., McFarland J. G. et al. Parralel randomized trials of risk-based therapy for fetal alloimmune thrombocytopenia // Am. J. Obstet Gynecol. 2006; 107 (1): 91-96.
Н. М. Судакова*, доктор медицинских наук, профессор
Н. И. Гревцева**
О. М. Зубов**
О. В. Лазарева**
* Белгородский государственный университет, **МУЗ «Городская детская больница», Белгород
Роль гормонотерапии в лечении синдрома КАЗАБАХА-МЕРРИТА у детей
Рисунок 1. Синдром Казабаха — Мерритта у двухмесячной девочки Что такое синдром Казабаха — Меррита? Каков характер гемангиом при синдроме Казабаха — Меррита? Какова роль гормональной терапии? Поиск наиболее рационального мет
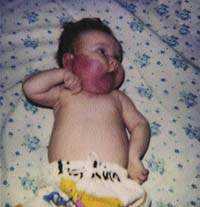 |
| Рисунок 1. Синдром Казабаха — Мерритта у двухмесячной девочки |
Что такое синдром Казабаха — Меррита?
Каков характер гемангиом при синдроме Казабаха — Меррита?
Какова роль гормональной терапии?
Поиск наиболее рационального метода лечения сложных гемангиом у детей заставил признать эффективность кортикостероидной терапии.
Синдром Казабаха — Меррита — очень редкое и опасное заболевание. Речь идет о симптомокомплексе, наблюдаемом у новорожденных или детей раннего грудного возраста, при котором гигантская гемангиома сочетается с нарушением свертываемости крови и тромбоцитопенией. Этот синдром обусловлен накоплением тромбоцитов в огромном сосудистом ложе гемангиомы, которые там уничтожаются [1, 2, 5, 6, 7, 8, 9, 12, 13, 14, 16, 17].
Подобная гемангиома и первичная тромбоцитопения наблюдались нами у семи больных, что составило 1,1% всех больных, получавших гормональное лечение.
Все дети с синдромом Казабаха — Меррита были в возрасте до 6 месяцев. Четверо из них родились недоношенными, с весом ниже физиологического.
У детей более старшего возраста синдром Казабаха — Меррита встречается крайне редко [1, 2, 7, 8, 9].
Гемангиомы были обнаружены сразу же после рождения ребенка. Отмечено, что гемангиомы у больных с синдромом Казабаха — Меррита отличались интенсивно бурным ростом, рост опухоли, как правило, значительно опережал рост ребенка.
К моменту обращения в клинику у пяти больных площадь поражения составляла более 100 кв. см. У шести детей с синдромом Казабаха — Меррита гемангиомы были единичными, а у одного больного отмечались четыре гемангиомы общей площадью 95 кв. см. Все гемангиомы имели глубокое расположение: у трех детей наблюдались кавернозные гемангиомы, у четырех — комбинированные.
Локализация гемангиом была различной. Так, в двух случаях гемангиомы локализовались в области нижних конечностей и ягодиц; еще в двух — в области верхних конечностей и туловища; у двоих детей — в области туловища; у одного ребенка — в области головы, шеи и спины. Характерным признаком больных с синдромом Казабаха — Меррита были кровоизлияния, появляющиеся в области гемангиом или по соседству с ними. Этот признак наблюдался у детей еще в период новорожденности.
Опухоль, как правило, малоболезненна и не вызывает особого беспокойства у ребенка. Периодически возникающие геморрагические кризы с кровоизлияниями в гемангиому вызывают ее увеличение и напряжение. Пораженная кожа приобретает темно-фиолетовый цвет и блестит. Петехии и кровоподтеки часто наблюдались поверх гемангиомы или рядом с ней. У трех больных отмечались периодические кровотечения из ложа сосудистой опухоли, которые были остановлены консервативными методами.
Диагноз при синдроме Казабаха — Меррита ставится на основании клинических и лабораторных данных. Количество тромбоцитов в крови у данной группы больных было резко уменьшено и составляло от 30х109/л до 100х109/л. Отмечено, что наименьшее количество тромбоцитов наблюдалось у тех больных, которые родились недоношенными и находились на искусственном вскармливании.
Сначала наступает тромбоцитопения, с течением времени уровень фибриногена снижается, а протромбиновое время (частично тромбопластиновое время) заметно увеличивается.
Таким образом, гематологическая картина становится похожей (но не идентичной) на развитую внутрисосудистую коагулопатию.
При периодических геморрагических кризах и повторяющихся кровотечениях из ложа сосудистой опухоли анализы крови указывают на усиливающуюся тромбоцитопению, развивается анемия, иногда удлиняется время кровотечения и замедляется время свертывания.
Все больные с синдромом Казабаха — Меррита получали гормональное лечение.
Существуют различные схемы медикаментозного лечения гемангиом, чаще всего из цитостатических препаратов используется кортикостероидная терапия преднизолоном [3, 4, 10, 11, 15].
Следует отметить, что в первом полугодии жизни ребенка гормональная терапия наиболее эффективна. Дозы преднизолона (в таблетках) назначались из расчета 4-6-8 мг на 1 кг, в зависимости от веса и возраста ребенка.
Суточная доза преднизолона делилась на два приема: в 6 часов утра ребенок получал 2/3 дозы, а в 9 часов утра — 1/3 дозы препарата.
Преднизолон рекомендовалось принимать после еды.
Лечение проводилось по наиболее физиологичной альтернирующей схеме, при которой препарат принимался через день без снижения дозировки.
Продолжительность курса гормонального лечения составляла 28 дней.
При необходимости через 6-8 недель проводился повторный курс гормонального лечения по той же методике с учетом веса и возраста ребенка.
Одному больному потребовалось два курса гормонального лечения, двум — три курса, а четырем больным — четыре курса гормонотерапии.
Лечение проводилось амбулаторно у четырех больных, в стационаре — у трех больных из-за плохих анализов крови или невозможности контролировать эффективность лечения по месту жительства. В период лечения гормонами больным рекомендовалась обычная диета, прием жидкости не ограничивался. Очень полезны отвары кураги и изюма, фрукты, овощи и соки в зависимости от возраста. Особо важная роль при этом отводится грудному вскармливанию.
С целью профилактики возможного снижения функции коры надпочечников, а также нарушения электролитного равновесия одновременно с кортикостероидными препаратами целесообразно назначать 5- или 7,5%-ный раствор хлористого калия, глюконат кальция в возрастной дозировке, аскорбиновую кислоту (100-150-200 мг в сутки), поливитамины.
Каких-либо осложнений во время лечения преднизолоном и после его отмены не наблюдалось. Возможное проявление признаков экзогенного гиперкортицизма в виде нарушений жирового обмена, отмеченных у двух больных, не должно служить причиной отмены курса гормонального лечения. Эти явления исчезают самостоятельно после его окончания.
Во время преднизолонотерапии макроскопическое наблюдение за опухолью обнаруживает признаки регрессии и остановку роста гемангиомы в первые дни лечения. Уже после второго-третьего приема преднизолона у всех больных отмечалось побледнение гемангиом и некоторое их уплощение. На 7-10-й день лечения гемангиомы незначительно уменьшались в объеме и на их поверхности появлялись белесоватые островки участков здоровой кожи, которые расчленяли гемангиому на все меньшие участки. В первую очередь на гормонотерапию реагировали возвышающиеся участки опухоли, отмечались снижение интенсивности окраски, уплощение и сморщивание гемангиомы. Эти явления прогрессировали и к окончанию курса гормонотерапии становились четкими. Рост сосудистой опухоли во время лечения не наблюдался.
Все дети, получавшие гормональную терапию, находились под наблюдением сосудистого хирурга и педиатра.
Уже в процессе первого курса гормональной терапии наблюдался резкий выброс тромбоцитов в кровь и анализы крови медленно улучшались.
На рис. 2 представлены показатели тромбоцитов в крови у больных с синдромом Казабаха — Меррита в процессе лечения преднизолоном.
После окончания гормонального лечения в анализах крови тромбоцитопении не отмечалось, количество тромбоцитов составляло от 180х109/л до 360х109/л.
Гормонотерапия при синдроме Казабаха — Меррита у детей не дает осложнений, связанных с применением преднизолона, и не вызывает синдрома кортикальной зависимости после его отмены. Во всех случаях был хороший терапевтический эффект.
Следует отметить, что, несмотря на высокую эффективность гормонотерапии при сидроме Казабаха — Меррита у детей, ни у одного больного не был получен косметический эффект, удовлетворяющий хирурга и родителей. У всех больных гемангиомы приходилось долечивать другими способами, в частности с помощью криодеструкции.
Таким образом, гормональный метод лечения синдрома Казабаха — Меррита у детей является довольно результативным, так как хорошо останавливает рост сосудистой опухоли, что особенно важно при лечении обширных и глубоких гемангиом сложной анатомической (критической) локализации. Долечивание гемангиом после гормононотерапии другими методами позволяет получить положительный косметический эффект.
Следовательно, гормонотерапию при синдроме Казабаха — Меррита у детей следует рассматривать как основной метод лечения.
Литература
1. Бобоев Д., Иванова И. Болезни новорожденного. София, 1992.
2. Братанов Б. Клиническая педиатрия. София, 1983.
3. Гасанов Д. Г. Роль преднизолона в лечении гемангиом критической локализации у детей: Автореф. канд. дис. М., 1980, с. 20.
4. Завьялов П. В., Гасанов Д. И. Кортикостероидная терапия гемангиом у детей // Хирургия. 1975. № 8. С. 127-129.
5. Ивановская Т. Е. Патологическая анатомия болезней плода и ребенка. М., 1989, т. 1.
6. Свистунова Т. М. Лечение обширных гемангиом кожи и подкожной клетчатки при синдроме Казабаха — Мерритта // Вопр. онкологии. 1970. Т. 16, № 4, с. 123.
7. Федореев Г. А. Гемангиомы кожи у детей. Л., 1971.
8. Черствый Е. Д., Кравцов Г. И. Болезни плода, новорожденного и ребенка. Минск, 1991.
9. Deller F. K., Ruhrmenn G. Zur Pathogenese des Kasabach—Meritt Syndroms // Klin. Wschr. 1959. Bd. 37. S. 1078.
10. Bresse M-F., David M., Hume H., et al. Successful treatment of Kasabach—Merritt syndrome wich prednisone and epsilon-aminocaproic acid // Ped Hematol Oncol 1991; 8: 329-334.
11. Edgerton N. The treatment of hemagiomas with special reference to the role of steroid therapy // Ann. Surg., 1976, v. 183, № 5, p. 517-530.
12. Edgerton M. T. Steroid therapy of haemangiomas // Symposium on Vascular Malformations and Melonotic Lesions. Ed. by Williams H. G. St. Louis, C. V. Mosby, 1983. P. 74-87.
13. Haltey R. M., Sabio H., Howell C. G., et al. Successful management of an infant with a giant hemangioma of the retroperitoneum and Kasabach—Merritt Syndrome with alpha-interferon // J. Pediatr. Surg. 1993; 28: 1356-1359.
14. Kasahach H. H., Merritt K. K. Capillary hemangioma with extensive purpura: report of a case // Am. J. Dis. Child 1940; 59: 1063-1070.
15. Ozsoylu S., Irken G., Gurgey A. High dose intravenous methylprednisolone for Kasabach—Merritt Syndrome // Eur. J. Pediatr. 1989; 148: 403-405.
16. Sato Y., Frey E. E., Wicklund B., et al. Embolization therapy in the management of infantile hemangioma with Kasabach—ІMerritt syndrome // Pediatr. Radiol. 1987; 17: 503-504.
17. Stahl R. L., Henderson M., Hooks M. A., et al. Therapy of the Kasabach—Merritt syndrome with cryoprecipitate plus intraarterial thrombin and aminocaproic acid // Am. J. Hematol., 1991: 36: 272-274.
Читайте также:
