Синдром Пфейфера-Вебера-Крисчена (Pfeifer-Weber-Christian) - синонимы, авторы, клиника
Добавил пользователь Владимир З. Обновлено: 31.01.2026
Идиопатический панникулит Вебера-Крисчена (ИПВК) относится к редким заболеваниям из группы системных болезней соединительной ткани. Верификация диагноза ИПВК является трудной задачей, так как до настоящего времени нет четких диагностических тестов для определения этого заболевания.
Цель исследования - изучение особенностей клинической картины и данных дополнительных исследований ИПВК как одного из вариантов лобулярного панникулита (ЛПн).
Пациенты и методы. Обследовано 19 больных (2 мужчины и 17 женщин) в возрасте от 32 до 71 года с ИПВК. Средняя длительность заболевания составляла 65,1±11,3 мес.
Результаты. Данные анамнеза у 12 больных позволили выделить три предполагаемых фактора развития заболевания: хирургическое вмешательство (у 6), переохлаждение (у 4) и острая респираторно-вирусная инфекция (у 2). У 10 (53%) больных в воз- расте 47-71 года индекс Кетле достигал 31,8±7,2 см/кг, что позволило диагностировать ожирение II степени. В зависимости от клинических проявлений выделено три формы ИПВК: узловатая (10 больных), бляшечная (6) и инфильтративная (3). Симптом «блюдца» имелся у 74% пациентов, в том числе во всех наблюдениях при хроническом течении (р=0,02). Количество пораженных участков достоверно отличалось при узловатой и бляшечной формах (р=0,01). По данным ROC-анализа, оптимальные значения чувствительности (80%) и специфичности (83%) по визуальной аналоговой шкале (ВАШ) боли у пациентов с этими формами соответствовали точке разделения 60 мм, при этом прогностическая ценность положительного результата составляла 0,89 (ДИ 0,71-1,1; р=0,011). У 3 больных инфильтративная форма была представлена типичной клинической картиной (показатели по ВАШ боли - 83,1±12,5 мм), причем у 1 из них выявлен мезентериальный панникулит. Показана корреляция (р=0,02; r=0,5) между уровнем СРБ и формой заболевания, причем уровень СРБ был максимальным при инфильтративной форме ИПВК. При патоморфологическом исследовании биоптата кожи и подкожной жировой клетчатки из узла, проведенном у всех пациентов, определялись диффузная лейколимфоцитарная инфильтрация, единичные многоядерные клетки, очаги некроза и пролиферация липоцитов.
Выводы. ИПВК представляет собой клинический вариант ЛПн, требующий проведения развернутого диагностического поиска.
Синдром Пфейфера-Вебера-Крисчена (Pfeifer-Weber-Christian) - синонимы, авторы, клиника
ГКБ №14 им. В.Г. Короленко Департамента здравоохранения Москвы
Городская клиническая больница №14 им. В.Г. Короленко, Москва
Рецидивирующий лихорадочный ненагнаивающийся панникулит Вебера-Крисчена
Журнал: Клиническая дерматология и венерология. 2011;9(3): 15‑18
Гребенюк В.Н., Дударева Л.А., Тогоева Л.Т., Мураков С.В. Рецидивирующий лихорадочный ненагнаивающийся панникулит Вебера-Крисчена. Клиническая дерматология и венерология. 2011;9(3):15‑18.
Grebeniuk VN, Dudareva LA, Togoeva LT, Murakov SV. Recurrent febrile non-suppurative Weber-Christian panniculitis. Klinicheskaya Dermatologiya i Venerologiya. 2011;9(3):15‑18. (In Russ.).
В статье представлено клиническое наблюдение за пациенткой с болезнью Вебера-Крисчена.
Болезнь Вебера—Крисчена (синонимы: рецидивирующий лихорадочный ненагнаивающийся панникулит, нодулярный панникулит Пфейфера—Вебера—Крисчена) — редкое идиопатическое иммуноаллергическое воспаление жировой ткани с лимфоидно-гистиоцитарной инфильтрацией, некрозами, образованием липогранулем и типичных крупных клеток с пенистой цитоплазмой [1]. Клиническая и гистопатологическая картина заболевания впервые описана К. Пфейфером в 1892 г. и названа «очаговой атрофией подкожной жировой клетчатки». Термин «рецидивирующий узловатый панникулит» был предложен в 1925 г. Ф.П. Вебером. В 1928 г. Г.Э. Крисчен дополнил описание симптоматикой интоксикационного синдрома и ввел понятие «рецидивирующий лихорадочный ненагнаивающийся панникулит», что в настоящее время описывается как синдром Вебера—Крисчена [2]. В отечественной литературе этот синдром впервые описан в 1961 г. Ю.В. Постновым и Л.Н. Николаевой. Этиология заболевания неизвестна, предполагается ее связь с перекрестной иммунологической реакцией, на что указывает обнаружение у больных повышенного уровня сывороточных циркулирующих иммунных комплексов [3]. Ранее болезнь Вебера—Крисчена рассматривали скорее как разновидность узловатой эритемы или T-клеточной лимфомы, а не в качестве самостоятельного заболевания [4]. Примерно в 25% случаев болезнь Вебера—Крисчена сочетается с заболеваниями аутоиммунной природы, в частности, с гломерулонефритом, склеродермией, дерматомиозитом, системной красной волчанкой, ревматоидным артритом, хроническим аутоиммунным гепатитом и гемолитической анемией [3, 5].
Болезнь Вебера—Крисчена чаще встречается у молодых женщин и женщин средней возрастной группы с избыточной массой тела. Выделяют три клинические формы спонтанного панникулита: узловатую, бляшечную и инфильтративную. Первичным элементом дерматоза является узел, расположенный в подкожной жировой клетчатке. Кожа над высыпаниями вначале не изменяет окраски, а впоследствии может приобретать разные тона — от ярко-розовых до коричнево-багровых. Вначале узлы мягкие, затем они становятся плотными и полностью или частично спаянными с кожей. Появляются они обычно приступообразно по несколько узлов сразу, располагаясь как симметрично, изолированно, так и группами и сливаясь, образуют большие бляшки или тяжи в виде четок. Разрешаются они, как правило, не вскрываясь, и оставляют после себя атрофию и различной глубины вдавления в центре. Узлы могут локализоваться по всему кожному покрову, но предпочтительно располагаются на нижних и верхних конечностях и ягодицах, причем чаще на разгибательных поверхностях. Длительность существования узлов разная — от нескольких дней до нескольких месяцев, причем при регрессе одних узлов могут появляться свежие, что обусловливает длительное течение данного заболевания. Рецидивы могут наступать через разные промежутки времени: от нескольких дней или месяцев до нескольких лет. С каждым новым рецидивом количество узлов может увеличиваться. Проявлениями заболевания на коже может предшествовать интоксикационный синдром, включающий недомогание, головные боли, субфебрильную или фебрильную лихорадку (37—40 °С), а также артралгии [1—3, 6, 7]. Иногда возникают боль в животе и диарея (висцеральная форма заболевания). У таких пациентов постмортально обнаруживаются узлы в жировой ткани брыжейки [2]. При системном поражении жировой ткани у пациентов с болезнью Вебера—Крисчена может наблюдаться неврологическая симптоматика, характерная для менингита, перикардит, а также поражения печени и глаз [2, 4]. К атипичным вариантам дерматоза относят безлихорадочную (синдром Ротмана—Макаи) и изъязвляющуюся формы, причем язвы долго не заживают [4].
Воспалительные узлы при болезни Вебера—Крисчена являются результатом локальной дегенерации и некроза подкожной жировой клетчатки. Некротизированные дольки жировой ткани первоначально характеризуются нейтрофильной инфильтрацией. Характер инфильтрата быстро меняется, среди жировых клеток появляются гистиоциты, которые проникают в них и «пожирают» жировые клетки. Далее клеточные элементы исчезают, появляются фибробласты, узлы замещаются соединительной тканью, иногда наблюдаются явления артериита [1, 2, 4, 7].
Лабораторная картина заболевания характеризуется повышением скорости оседания эритроцитов, лейкопенией, гипо- или гиперкомплементемией, появлением антимитохондриальных антител и антител к гладкомышечной ткани и повышенным уровнем иммуноглобулинов плазмы крови и циркулирующих иммунных комплексов, а также отклонениями от нормы показателей гемостаза и коагулограммы [3, 5].
Дифференциальная диагностика проводится с другими заболеваниями из группы панникулитов: реактивным, холодовым, постстероидным, узловатой эритемой, индуративной эритемой Базена [1, 4, 6].
Лечение болезни Вебера—Крисчена преимущественно симптоматическое. Эффективна кортикостероидная терапия при купировании рецидивов, но излечение не наступает, поэтому препаратами выбора при лечении болезни Вебера—Крисчена в настоящее время считают цитостатики [3]. По данным Е.В. Вербенко (1975), хороший клинический эффект достигается при применении стероидов перорально и инъекционно для обкалывания узлов, а также антиоксидантов и гепатопротекторов. Кроме того, в некоторых случаях необходима терапия первичных заболеваний, следствием которых явился панникулит Вебера—Крисчена.
В настоящее время в мировой литературе описано около 200 случаев болезни Вебера—Крисчена, в отечественной — около 40. В связи с этим каждый случай представляет особый клинический интерес.
Мы наблюдали за больной П., 1954 г. рождения, жительницей Москвы, длительно и многократно находившейся на стационарном лечении в женском кожном отделении городской клинической больницы №14 им. В.Г. Короленко.
Пациентка считает себя больной с 2000 г., когда впервые на верхних конечностях появились синюшные пятна, на месте которых позже стали образовываться узлы, выступающие над кожей. Длительное время наблюдалась у хирурга, возникающие узлы иссекались. В январе 2007 г. была направлена врачом районного кожно-венерологического диспансера на обследование и лечение в ГКБ №14 им. В.Г. Короленко, где при патоморфологическом исследовании был диагностирован спонтанный панникулит Вебера—Крисчена. После терапии, включавшей преднизолон, гепатопротекторы, противовоспалительные препараты, отмечен положительный эффект. После выписки пациентка самостоятельно отменила преднизолон, что послужило причиной обострения в августе 2007 г. Пациентка лечилась с положительным эффектом в ГКБ №14 им. В.Г. Короленко с ноября 2007 г. по январь 2008 г. Последующие обострения были в июле и ноябре 2009 г.
История жизни. Росла и развивалась нормально. Наследственность не отягощена. Наличие вредных привычек отрицает.
Перенесенные заболевания: подозрение на хронический аутоиммунный тиреоидит с узлообразованием в левой доле, синовит левого голеностопного сустава, искривление перегородки носа, миопия слабой степени обоих глаз.
Аллергоанамнез не отягощен.
Общий статус. При поступлении предъявляла жалобы на появление узлов на коже лица и конечностей, слабость, боли в суставах кистей, коленных и локтевых суставах. Больная правильного телосложения, повышенного питания. Общее состояние удовлетворительное. В легких везикулярное дыхание, хрипов нет. Артериальное давление 135/80 мм рт.ст. Тоны сердца звучные, ритмичные, Ps 85 в минуту. Живот при пальпации мягкий, безболезненный. Периферические лимфатические узлы не увеличены. Костно-суставная система внешне не изменена. Физиологические отправления в норме.
Местный статус. На коже лица, разгибательных поверхностях верхних (рис. 1, а) Рисунок 1. Узел на коже плеча и его разрешение в участок западения кожи с атрофией. а — до лечения; б — после лечения. и нижних конечностей локализовались высыпания в разных стадиях развития (эволюционный полиморфизм). Вначале появлялись розово-синюшные пятна. При их пальпации определялись гиподермальные узлы плотной консистенции, не спаянные с подлежащими тканями. Со временем коричневато-бордовые узлы увеличивались с 0,5 до 3,5 см в диаметре и выступали над кожей. На правом крыле носа (рис. 2, а) Рисунок 2. Узел и его уплощение на правом крыле носа. а — до лечения; б — после лечения. располагался узел розового цвета диаметром 2 см, плотный, при пальпации малоподвижный. На месте разрешившихся узлов оставались участки западения атрофированной кожи. В полости рта на левой небной дужке обнаружен узел 1,5 см в диаметре (рис. 3, а). Рисунок 3. Узел и его частичное регрессирование на левой небной дужке. а — до лечения; б — после лечения. За время наблюдения узлы не вскрывались и не изъязвлялись. Одновременно с появлением узлов у пациентки развился гипертрофический ринит.
В клиническом анализе крови показатели были в пределах нормы, исключая повышение скорости оседания эритроцитов (25 мм/ч). В клиническом анализе мочи патологических изменений не выявлено. В биохимическом анализе крови показатели белкового и липидного обмена в пределах нормы, С-реактивный белок - 6 мг/л.
Электрокардиограмма. Ритм синусовый правильный. Отклонение электролитной оси влево. Блокада передней левой ветви пучка Гиса.
При рентгенологическом иссследовании локтевых и коленных суставов выявлен регионарный остеопороз, начальные артрозные изменения. На рентгенограмме кистей — сужение суставных щелей в межфаланговых суставах, артрозные изменения.
Рентгенограмма органов грудной клетки: очаговые и инфильтративные изменения в легких не выявлены.
Медицинское заключение ТКБ №7: ЛФД — данных за туберкулез не выявлено; проба Манту с 2 ТЕ отрицательная; иммуноферментный анализ — МБТ не обнаружены.
Антитела к ВИЧ, HBs-Ag, HCV отрицательные. Реакция микропреципитации отрицательная. Реакция иммунофлюоресценции 200/абс и реакция иммобилизации бледных трепонем отрицательные.
Анализ кала: яйца гельминтов не обнаружены.
Патоморфологическое исследование. Эпидермис со сглаженными эпидермальными выростами, умеренным гиперкератозом. Верхняя часть дермы отечная и фиброзированная. В глубоких отделах дермы и подкожно-жировой клетчатке выявлен диффузный воспалительный инфильтрат из макрофагов, гистиоцитов, плазматических клеток и лимфоцитов, в центре инфильтрата часть макрофагов и гистиоцитов представлена в виде крупных пенистых клеток, в сосудах — картина васкулита. Заключение: выявленные изменения могут наблюдаться при болезни Вебера—Крисчена (панникулит лихорадящий, рецидивирующий, ненагнаивающийся).
Консультация специалистов. Невропатолог: неврологической патологии не выявил. Окулист: миопия слабой степени обоих глаз. ЛОР: искривление перегородки носа. Гинеколог: синдром коагулированной шейки матки. Эндокринолог: данных за эндокринную патологию нет.
Проведенная терапия, включавшая дезинтоксикационные препараты, гепатопротекторы, ферменты, антиоксиданты, делагил, проспидин (внутримышечно 1,4 г на курс), дексаметазон (55 мг/сут), препараты калия, способствовала достижению выраженного улучшения. Купированы проявления рецидива, большая часть узлов регрессировала полностью или частично.
В приведенном нами клиническом случае диагноз спонтанного панникулита Вебера—Крисчена основывался на данных анамнеза, клинической картине и течении дерматоза, а также результатах биопсии. Трудности его диагностирования связаны с редкой встречаемостью дерматоза, в связи с чем он малознаком дерматологам. Характеризуется данное заболевание длительным волнообразным течением со склонностью к обострениям и резистентностью к лечению. Положительная динамика терапии кожного процесса достигнута благодаря проведению комплексной терапии, включавшей гормональные кортикостероидные и цитостатические препараты (см. рис. 1—3, б). В нашем случае также следует отметить необычную локализацию узла на небной дужке полости рта.
Кафедра акушерства и гинекологии Витебского государственного медицинского университета, Республика Беларусь
ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России, Челябинск, Россия, 454092
МБУЗ «Челябинская ГКБ №6», Челябинск, Россия, 454047
Спонтанный лихорадящий ненагнаивающийся рецидивирующий панникулит Вебера—Крисчена или липоидный некробиоз? Сложный для диагностики случай заболевания у ребенка
Журнал: Клиническая дерматология и венерология. 2017;16(5): 84‑89
В практике дерматолога периодически встречаются сложные для диагностики случаи заболеваний. В статье для дискуссии представлена история болезни ребенка 2 лет, скончавшегося от процесса, клинически соответствующего течению панникулита Вебера—Крисчена и имеющего патоморфологическую картину липоидного некробиоза.
Врачам-дерматологам чрезвычайно важно постоянно пополнять свои знания и умения или, как сейчас принято говорить, компетенции. В настоящее время этому способствует достаточное количество постоянно издаваемых печатных и существующих электронных изданий и публикаций. С появлением интернета значительно упростился поиск необходимой информации. Выполненные в последние годы фундаментальные исследования уточнили патогенез и позволили усовершенствовать диагностику большинства дерматозов. Широкий рынок издательских услуг сделал возможным публикацию атласов хорошего полиграфического качества [1]. Тем не менее большое число кожных заболеваний, множество функций, выполняемых кожей, ее тесные нейрогуморальные связи с внутренними системами организма предъявляют высокие требования к уровню информированности врачей-дерматовенерологов [2]. Поэтому в практике клиницистов периодически встречаются случаи, диагностика которых может быть затруднена в связи с редкостью диагностируемого дерматоза или его клинических проявлений.
Особенно сложными для диагностики бывают случаи заболеваний кожи у детей. Они во многом отличны от аналогичной патологии взрослых, и эта разница наиболее заметна в раннем возрасте пациентов. Кроме того, в педиатрической дерматологии кожные признаки являются важным аспектом в распознавании тяжелых системных заболеваний [3].
Сложный для распознавания случай встретился и в нашей практике, а участие морфологов не облегчило, а усложнило формирование окончательного диагноза.
Описание клинического случая
Больной Ц., 2 года, был доставлен в гнойное хирургическое отделение муниципального бюджетного лечебно-профилактического учреждения одного из городов Челябинской области 13.10.15 в 04.40 в крайне тяжелом состоянии с жалобами на тошноту, рвоту, повышение температуры до 39 °C, с многочисленными инфильтратами на коже, появившимися ориентировочно 3—5 дней назад. В связи с тяжестью состояния больной был помещен в реанимационное отделение, но, несмотря на проводимую терапию, состояние прогрессивно ухудшалось и через 9 ч после поступления в стационар наступила смерть.
Диагноз при поступлении: сепсис с неуточненным первичным очагом. Септический шок. Тромбо-геморрагический синдром. Острый лейкоз? Манифестация С.Д.? Множественные внутрикожные инфильтраты (лейкемоиды? септические очаги?) Некроз кожи ягодицы.
Отцу ребенка было 58 лет; матери 26 лет — она страдала ДЦП, имела органические изменения личности, дефицит массы тела, вредные привычки в виде табакокурения, перенесла сифилис и получила полноценное лечение до наступления настоящей беременности. Ребенок был от первых оперативных родов в сроке 38—39 нед, масса тела при рождении составляла 3150 г, оценка по шкале Апгар — 5—7 баллов. В периоде адаптации отмечали патологическую убыль массы тела.
В 3 мес у ребенка была выявлена двусторонняя пиелокаликоэктазия, в 4, 5 и 7 мес переносил ОРВИ с присоединением конъюнктивита и назофарингита, в 9-месячном возрасте — острый гнойный подкожно-подслизистый парапроктит и операцию вскрытия парапроктита. В течение первого года жизни 3 раза болел ОРВИ, а в июле 2014 г. (в возрасте 1 год 6 мес) был вскрыт абсцесс правой голени. С этого же времени диагностирована хроническая анальная трещина. За последний год жизни имел 6 эпизодов, расцененных как ОРВИ, и операцию по поводу вскрытия панариция I пальца правой кисти. Таким образом, к моменту поступления у ребенка имелись 14 зафиксированных случаев заболеваний и 3 операции по поводу различных абсцессов, в общем анализе крови неоднократно отмечалось повышение СОЭ (см. таблицу).

Динамика общего анализа крови больного Ц. до поступления в стационар
При поступлении состояние было расценено как средней степени тяжести, ребенок был вялый, адинамичный. Кожа бледная, тургор тканей снижен. Дыхание слева ослаблено в нижних отделах. Частота дыхательных движений (ЧДД) 24 уд/мин. Частота сердечных сокращений (ЧСС) 124 в минуту. Живот мягкий безболезненный. Локально в области правой ягодицы определялся инфильтрат до 5 см в диаметре, кожа над ним была синюшного цвета, в центре — субэпидермальный пузырь 1,5×1 см. По периферии — гиперемия, умеренный отек, флюктуации нет.
При осмотре в 8:40 состояние ребенка тяжелое. Температура на момент осмотра 35,6 °С, сознание спутано, положение вынужденное (лежа на правом боку). Ребенок был вялый, адинамичный, при осмотре слабо стонал. Менингеальных симптомов не было выявлено. Параличей, парезов, нистагма не было, фотореакции сохранены. Зрачки симметричны. Кожные покровы имели сероватый оттенок, отмечался акроцианоз. Периферические лимфоузлы мелкие, единичные. В легких дыхание жесткое, хрипов не отмечали, в нижних отделах ослаблено. ЧДД — 28 в 1 мин. Тоны сердца ритмичные, глухие. ЧСС — 140 уд/мин. Живот не вздут, мягкий, на пальпацию не реагировал. Печень выступала на 1,5—2 см ниже края реберной дуги, селезенка не пальпировалась. Перистальтика выслушивалась. Объемных образований в брюшной полости не выявили. Мочился однократно самостоятельно малым количеством мочи. Был установлен катетер — получено 3 мл мочи. Стула не было. Ректально: тонус сфинктера снижен, ампула прямой кишки пустая, патологических образований на высоте пальца не выявлено. На коже лица, ушной раковины слева, верхних и нижних конечностей, передней брюшной стенки, грудной клетки имелись множественные инфильтраты по цвету бледнее, чем окружающая кожа, округлой формы, с четкими границами, размерами от 0,5 до 1,5 см, с участками цианоза внутри некоторых элементов. В области правой ягодицы с переходом на промежность был обнаружен инфильтрат неправильной формы буро-коричневого цвета с участком отслоенного эпидермиса, с серозным отделяемым. Участков размягчения, ран, свищей и гнойного отделяемого не было (рис. 1). Общий анализ крови: эритроциты 2,8·10 12 /л, гемоглобин 80 г/л, цветной показатель 0,86, лейкоциты 1,1·10 9 /л, СОЭ 3 мм/ч. Лейкоформула: сегментоядерных 2%, эозинофилов 0, базофилов 0, моноцитов 13%, лимфоцитов 35% (подсчет на 50 клетках, на 4 стеклах), тромбоциты 160,6·10 9 /л, гематокрит 36%, время свертывания крови 4 мин — 4 мин 30 с, протромбиновый индекс 77%. Билирубин 27,3 мкмоль/л (прямой — 11,1 мкмоль/л, непрямой — 16,1 мкмоль/л). Общий белок 79 г/л, мочевина 7,6 моль/л, креатинин 87,5 мкмоль/л, сахар крови 23,0 ммоль/л, сахар, ацетон в моче — отрицательны. В мазке из зева, из носа и в посеве содержимого пузыря, на коже ягодицы обнаружен Pseudomonas aeruginosa. В связи с повышенным уровнем сахара в крови, кроме прочих реанимационных мероприятий, ребенку через инфузомат с 13 до 19 ч был введен инсулин в дозе 10 единиц, что привело к временному снижению уровня сахара (рис. 2). Эндокринолог предположил наличие впервые выявленного сахарного диабета, но детский эндокринолог этот диагноз подверг сомнению. Невропатолог установил отек головного мозга. Наличие лейкоза гематолог исключил.
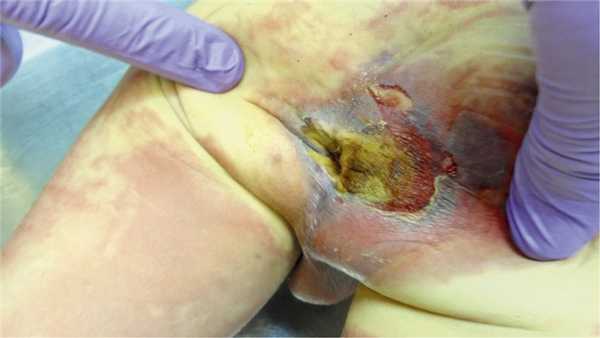
Рис. 1. Инфильтрат в области ягодицы с эрозией на поверхности пациента Ц.
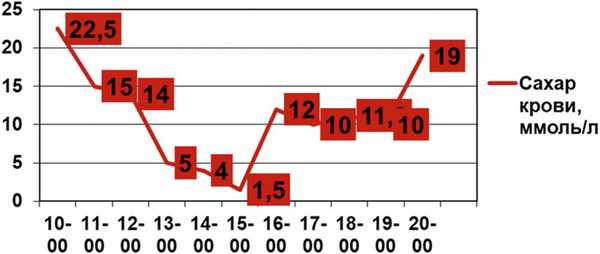
Рис. 2. Почасовая динамика уровня сахара в крови пациента Ц.
К 13:00 состояние ребенка прогрессивно ухудшалось и стало крайне тяжелым. Сознание спутано. На осмотр реагировал стоном и слабым сопротивлением. Кожные покровы с сероватым оттенком, отмечался акроцианоз. Температура 38,1 °С. В легких отмечалось жесткое дыхание, в нижних отделах ослабленное, хрипов не было. ЧДД — 28 в 1 мин. Тоны сердца ритмичные, глухие. ЧСС — 110 уд/мин. Живот не вздут, был мягкий, на пальпацию не реагировал. Объемных образований в брюшной полости не пальпировалось. По желудочному зонду поступало застойное желудочное содержимое с геморрагическим компонентом. Присоединились симптомы отека головного мозга — сомнительные менингеальные симптомы, положительный симптом Бабинского, слабовыраженный нистагм. На коже инфильтраты приобрели серо-цианотичный цвет, их размер и количество увеличились. Инфильтрат на ягодице также увеличился в размере, приобрел серо-черный оттенок. Несмотря на проведенную в полном объеме терапию, трижды включившие реанимационные мероприятия, 13.10.15 в 21:15 ребенок скончался.
Заключительный клинический диагноз: воспалительный инфильтрат правой ягодицы. Некроз кожи правой ягодицы. Сепсис. Септический шок III степени. Внебольничная левосторонняя пневмония. Тромбогеморрагический синдром. Множест-венные внутрикожные инфильтраты.
14.10.15 было проведено патологоанатомическое вскрытие, при котором после анализа комплекса изменений внутренних органов и кожных покровов, выставлен следующий патологоанатомический диагноз. Основное заболевание: рецидивирующий панникулит Вебера—Крисчена с поражением кожи спины, грудной клетки, живота, ягодиц, верхних и нижних конечностей — очаговый коагуляционный некроз дермы и подкожно-живой клетчатки без перифокальной клеточной реакции. Фоновое заболевание: неутонченный иммунодефицит. Акцидентальная инволюция тимуса IV степени; гипоплазия всех ростков кроветворения костного мозга; гипоплазия лимфомидных фолликулов селезенки, лимфоузлов; лейкопения (по клиническим данным). Осложнения основного заболевания: мацерация кожи правой ягодицы с переходом на анус. Флегмона правой ягодицы. Септицемия (бактериологический посев крови, легких, селезенки, ликвора, тонкого и толстого кишечника № 49—55 от 19.10.15 — выделена Ps. aerugenosae, 10 4 —10 6 ). Септический гнойный менингоэнцефалит, вентрикулит. Токсический серозный миокардит. Токсический серозный гепатит. ДВС-синдром. Отек и набухание головного мозга. Паренхиматозная дистрофия печени, почек, миокарда.
Однако при гистологическом исследовании препаратов пациента были выявлены патогистологические изменения, не соответствующие данному диагнозу, а именно: эпидермис атрофичен, в дерме, особенно в глубоких ее отделах, обнаруживаются очаги дезорганизации и некроза коллагена без четких границ, преимущественно некротический тип тканевой реакции. Инфильтрация мононуклеарами, гранулемоподобными скоплениями эпителиоидных клеток и гигантских многоядерных клеток. В мелких сосудах средней и нижней дермы отмечаются явления продуктивного васкулита» (рис. 3). Согласно М.А. Пальцеву и соавт. [4], данная гистологическая картина соответствует изменениям, происходящим при липоидном некробиозе.

Рис.3. Патогистологическая картина изменений кожи.
Как известно, узловатый ненагнаивающийся лихорадящий рецидивирующий панникулит Вебера—Крисчена чаще встречается у женщин 20—40 лет и чрезвычайно редко у детей, имеет острое начало и рецидивирующее лихорадящее течение. Заболевание начинается с недомогания, головной боли, иногда болей в мышцах и суставах и сопровождается лихорадкой различной степени выраженности (37—40 °С), что нередко расценивают, как ОРВИ. Возможно, что часто повторяющиеся подъемы температуры у описываемого ребенка относились как раз к данной патологии. Панникулит протекает приступообразно, продолжительность ремиссии бывает различной. Первичным элементом является узел, залегающий на разной глубине в подкожной жировой клетчатке. Узлы могут локализоваться на любом участке кожного покрова, они редко бывают единичными, чаще носят диссеминированный, множественный характер.
Различают три клинические разновидности панникулита: узловатую, бляшечную и инфильтративную. При узловатой разновидности узлы располагаются изолированно друг от друга, не сливаются, довольно четко отграничены от окружающей ткани и имеют различную окраску в зависимости от глубины залегания в подкожной жировой клетчатке (от цвета нормальной кожи до ярко-розового). Диаметр отдельных узлов колеблется от нескольких миллиметров до 10 см и более. При бляшечной разновидности отдельные узлы, сливаясь в конгломераты различного размера, занимают обширные зоны, иногда всю поверхность голени, бедра, плеча и т. д. Вследствие этого могут возникнуть отек и выраженная болезненность из-за сдавления сосудисто-нервных пучков. Поверхность таких бляшек-конгломератов бугристая, границы их нечеткие, консистенция плотноэластическая, доходящая иногда до склеродермоподобной плотности. Цвет конгломератов от розового до синюшно-багрового. При инфильтративной разновидности в зоне отдельных узлов или конгломератов возникают флюктуации, цвет очагов становится ярко-красным или багровым. Очаги принимают вид флегмонозных инфильтратов, но в отличие от последних при вскрытии их выделяется не гной, а желтоватая пенистая масса. Инфильтративную форму спонтанного панникулита часто ошибочно диагностируют как абсцесс или флегмону. Не по этой ли причине у ребенка, не достигшего трехлетнего возраста, трижды вскрывали абсцессы неясного происхождения? Длительность течения панникулита колеблется в довольно широких пределах: от нескольких недель до нескольких десятков лет. По остроте течения различают три формы узловатого ненагнаивающегося лихорадящего рецидивирующего панникулита Вебера—Крисчена: хроническую, подострую и острую. При хроническом варианте независимо от того, насколько острым было начало заболевания, дальнейшее его течение носит благоприятный для жизни больного характер. Общее состояние больных существенно не страдает, рецидивы нетяжелые и обычно заканчиваются благоприятно для больных, ремиссии длительные. Подострое течение спонтанного панникулита характеризуется выраженными общими симптомами заболевания: длительной лихорадкой гектического типа, нарастающей слабостью, изменениями состава крови (лейкопения, повышенная СОЭ). При быстрой смене ремиссий и рецидивов, характерной для подострого течения панникулита, количество узлов обычно увеличивается. Подострое течение отличается торпидностью заболевания к различным видам терапии. Если наступает ремиссия, то продолжительность ее невелика (1—3 мес), как и в данном клиническом случае. При каждом новом рецидиве общее состояние больного ухудшается, заболевание принимает острую форму и заканчивается летально в довольно короткие сроки (от 3 мес до 1 года).
Хотя заболевание у представляемого больного начиналось как лихорадочная инфекционная болезнь и по своей клинической картине напоминало инфекционный процесс, выявить возбудителя не удавалось. Исходя из описанного и анализируя течение заболевания, диагноз панникулита Вебера—Крисчена у нашего пациента можно было бы считать клинически доказанным, если бы не отсутствовало морфологическое его подтверждение.
Патоморфологические изменения при панникулите могут быть разделены на три стадии. На I стадии острое воспаление характеризуется инфильтрацией жировой клетчатки сегментоядерными нейтрофилами, лимфоцитами и гистиоцитами без образования абсцессов. На II стадии инфильтрат представлен преимущественно гистиоцитами с примесью лимфоцитов и плазматических клеток. Характерен фагоцитоз жира с образованием скоплений крупных светлых макрофагов с пенистой цитоплазмой, замещающих жировые клетки. В случае панникулита с прорывом узлов II стадия заканчивается некрозом макрофагального инфильтрата с образованием аморфной пенистой массы, содержащей отдельные сохранившиеся ядра и клетки воспаления. На III стадии (фибробластической) в инфильтрате нарастает количество фибробластов, а на месте скоплений гибнущих макрофагов формируется соединительная ткань [4].
Липоидный некробиоз может возникнуть в любом возрасте (чаще в 20—40 лет, несколько реже в старческом и детском возрасте), причем у 18—20% больных кожные изменения появляются задолго (1—10 лет) до развития сахарного диабета. Выделяют четыре основные формы липоидного некробиоза: склеродермоподобную, поверхностно-бляшечную, напоминающую кольцевидную гранулему, и узелковую. Склеродермоподобная форма встречается наиболее часто. Она характеризуется наличием на коже единичных, реже множественных бляшек, причем при этой форме липоидного некробиоза можно выделить три стадии развития. Первая стадия характеризуется появлением розовато-красных узелков конусовидной, чаще полусферической формы с гладкой поверхностью и перламутровым блеском. Вторая стадия характеризуется образованием инфильтрированных бляшек буровато-красного цвета с резко очерченными границами, размерами от 10-копеечной монеты до детской ладони. Весь очаг поражения возвышается над уровнем окружающей кожи; уже в этой фазе узелки, расположенные по краю очага, приобретают фиолетовые оттенки и возвышаются над уровнем его центральной части. После длительного существования (от нескольких месяцев до 2—3 лет) образуются округлые бляшки с блестящей поверхностью, с запавшим желтовато-буроватым центром и слегка возвышающимся краем фиолетово-красного цвета. При пальпации очагов поражения определяется склеродермоподобное уплотнение. Примерно в ¼ всех случаев липоидного некробиоза очаги поражения сопровождаются изъязвлениями. При этом язвы чаще встречаются у больных сахарным диабетом, чем без него. Язвы поверхностные, как правило, неправильных очертаний, края их зачастую мягкие, слегка подрыты. Отделяемое язв серозно-геморрагическое, при подсыхании образуются темно-коричневые корки.
Возможно, учитывая наличие кольцевидных инфильтратов фиолетового цвета с более светлым центром, что у нашего больного имела место склеродермоподобная форма липоидного некробиоза (рис. 4)? Или патоморфологические изменения, выявленные гистологически, не являются абсолютно патогномоничными, и при панникулите могут быть похожие процессы?
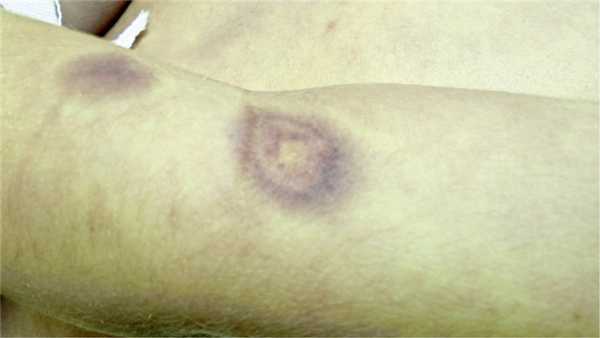
Рис.4. Кольцевидные инфильтраты на коже руки.
Мы будем благодарны коллегам за анализ данного случая, поскольку повышение своего профессионального уровня у дерматовенерологов является процессом не прекращающимся.
ФГБУ "Научно-исследовательский институт ревматологии им. В.А. Насоновой" РАМН, Москва
ФГБНУ «Научно-исследовательский институт ревматологии им. В.А.Насоновой», Москва, Россия
ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», Москва, Россия
ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва, Россия
Идиопатический лобулярный панникулит: клинико-морфологические корреляции
Журнал: Архив патологии. 2019;81(3): 37‑44
Панникулит является гетерогенной группой заболеваний, характеризующихся поражением подкожной жировой клетчатки (ПЖК) и нередко протекающих с вовлечением в процесс опорно-двигательного аппарата и внутренних органов. Это хроническое полиорганное заболевание. Отмечено, что «золотым стандартом» его диагностики является морфологическое исследование. Представлена современная классификация панникулита. Цель исследования — изучение морфологических особенностей идиопатического лобулярного панникулита (ИЛП) в соответствии с характером течения и клиническими формами заболевания. Материал и методы. Изучены биоптаты 62 больных с различными клиническими формами ИЛП. Биопсийный и операционный материал изучали светооптическими морфологическими методами. Статистическую обработку результатов проводили с использованием пакета статистического анализа данных Statistica 10 для Windows («StatSoft Inc.», СШA). Различия считали статистически значимыми при уровне ошибки p
Панникулит является гетерогенной группой заболеваний, характеризующихся поражением подкожной жировой клетчатки (ПЖК) и нередко протекающих с вовлечением в процесс опорно-двигательного аппарата и внутренних органов. Диагностика панникулита является довольно трудной задачей, особенно у пациентов ревматологического профиля, так как до настоящего времени нет четких клинических, морфологических и лабораторных данных для определения этого состояния. Принципиальное значение имеет морфологическая картина. Болезнь характеризуется чередованием периодов ремиссии и обострений. Полиморфизм клинической картины панникулита создает определенные трудности в диагностике заболевания. Отсутствие четких алгоритмов обследования нередко приводит к несвоевременному распознаванию болезни, что влечет за собой неадекватную тактику лечения больных.
В 1892 г. V. Pfeiffer [1] описал спонтанный панникулит как синдром очаговой атрофии ПЖК в области молочных желез, на щеках и нижних конечностях. В 1925 г. F. Weber [2] назвал это заболевание «ненагнаивающийся узловатый панникулит», а через 3 года H. Christian [3] отметил наличие лихорадки. И лишь в 1938 г. I. Brill назвал это заболевание болезнью Пфейффера—Вебера—Крисчена [4]. Первое описание в СССР сделали Ю.В. Постнов и Л.П. Николаева [5].
Особый интерес в практике ревматолога представляет идиопатический лобулярный панникулит (ИЛП) (син.: болезнь Вебера—Крисчена, панникулит Вебера—Крисчена и т. д.), который в соответствии с Международной классификацией болезней 10-го пересмотра (МКБ-10) относится к системным поражениям соединительной ткани (М 35.6). ИЛП рассматривается как хроническое заболевание с полиорганным поражением и расценивается как клинико-морфологический вариант лобулярного панникулита с определенной клинической симптоматикой. Заболевание характеризуется быстрым развитием ограниченных подкожных, как правило, множественных узлов, расположенных в клетчатке на разной глубине с преимущественной локализацией на нижних и верхних конечностях, реже на груди и животе. Обычно в течение нескольких недель узлы рассасываются, оставляя «блюдцеобразные» западения кожи вследствие развития атрофии ПЖК. Иногда откладываются соли кальция [1, 6]. Наряду с этим выделяют клинические стадии развития узла у больных в зависимости от цвета кожи в области уплотнения: 0 - отсутствуют высыпания, I — бледно-розовый или розовый цвет, II — красный или багрово-красный и III — синюшный цвет и/или подкожное уплотнение [6].

На сегодняшний день «золотым стандартом» диагностики этого заболевания является патоморфологическое исследование, занимающее одно из центральных мест в алгоритме обследования больных. Заключение патологоанатома о локализации и вовлечении сосудов в патологический процесс, а также характере клеточного состава инфильтрата помогает клиницистам уточнить диагноз в соответствии с существующей классификацией панникулита (табл. 1)[7, Таблица 1. Классификация панникулитов 8].
Особенностями ИЛП являются развитие воспаления в дольках ПЖК, липонекроз и формирование гранулем. Изменения проходят 3 морфологические стадии: островоспалительную, липофагическую и фиброзную [9]. К сожалению, чаще всего биопсию проводят на стадии фиброза. Следовательно, патологоанатом не имеет возможности отразить в своем заключении те морфологические признаки, которые могли бы способствовать правильной диагностике. В литературе отсутствуют данные о комплементарности морфологических и клинических стадий болезни.
Цель исследования — изучить морфологические особенности ИЛП в соответствии с характером течения и клиническими формами заболевания.
Материал и методы
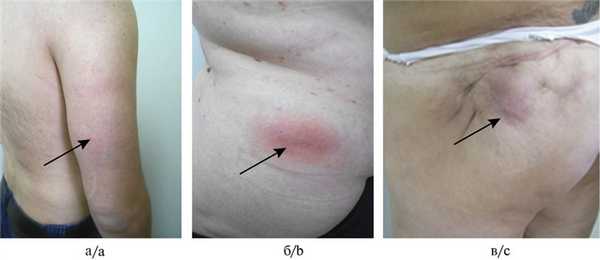
В исследование включены 62 больных с достоверным клиническим и морфологическим диагнозом ИЛП, из которых 6 (9,7%) имели I клиническую стадию узла, 25 (40,3%) — II и 31 (50%) — III стадию узла (рис. 1). Рис. 1. Клинические стадии уплотнения узла. а — I стадия; б — II стадия; в — III стадия.
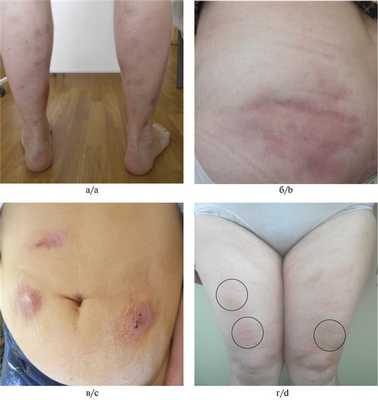
В 64,5% случаев преобладало хроническое течение заболевания, в 21% — подострое и в 14,5% — острое. Анализ клинических проявлений позволил выделить 4 формы ИЛП: узловатую (n=28), бляшечную (n=9), инфильтративную (n=14) и мезентериальную (n=11) (рис. 2). Рис. 2. Клинические формы идиопатического лобулярного панникулита. а — узловатая; б — бляшечная; в — инфильтративная; г — мезентериальная. Наряду с появлением болезненных узлов в подкожной клетчатке заболевание характеризовалось повышением температуры тела, изменениями лабораторных острофазовых воспалительных показателей (повышенные СОЭ, СРБ и т. д.). Мезентериальную форму ИЛП ставили на основании наличия не более 5 узлов на теле, появления болей в околопупочной области, синдрома раздраженного кишечника. У 5 пациентов была проведена ПЭТ-КТ, что позволило исключить IG4-ассоциированные, лимфопролиферативные и онкологические заболевания. В исследование включен операционный материал, полученный при ранее проведенном лапароскопическом обследовании больных.
У 16 (23,88%) пациентов уплотнения были незначительно болезненными, что соответствовало III стадии узла. У 29 (43,28%) больных зафиксирована выраженная боль, которая на II стадии узла наблюдалась у всех пациентов. Оценивали суммарную площадь поражения методом «ладони» [10]. Наряду с поражением ПЖК 51 (76,11%) пациент предъявлял жалобы на слабость и 48 (71,64%) — на повышение температуры до фебрильных цифр.
Пациентам проводили обширную хирургическую биопсию узла с последующим гистологическим исследованием. Материал обрабатывали рутинными гистологическими методами. В окрашенных гематоксилином и эозином препаратах оценивали локализацию изменений, наличие липонекроза, васкулитов, характер васкулитов, клеточный состав инфильтрата, наличие фибробластов, грануляционной ткани и склероза. Статистическую обработку результатов проводили с использованием пакета статистического анализа данных Statistica 10 для Windows («StatSoft Inc.», СШA). Различия считали статистически значимыми при уровне ошибки pt-критерий Стьюдента, Z-тест для сравнения процентов, непараметрические тесты: U-тест по методу Манна—Уитни, критерий Краскела—Уоллиса.
Результаты
На первом этапе исследования оценивали наличие морфологических признаков, которые отмечали при ИЛП независимо от клинических проявлений. Гистологическая картина характеризовалась преобладанием выраженного воспаления в дольках клетчатки с множественными фокусами липонекроза. Воспалительный инфильтрат был полиморфен. Наряду с лимфоцитами, лейкоцитами и гистиоцитами присутствовали эозинофилы и гигантские многоядерные клетки. В единичных случаях отмечали формирование гранулемоподобных структур.
Кожа вовлекалась в патологический процесс умеренно. Основные изменения были связаны с наличием скудных лимфогистиоцитарных инфильтратов дермы (88,7%) и слабовыраженных деструктивных васкулитов у 37 (59,67%) больных.
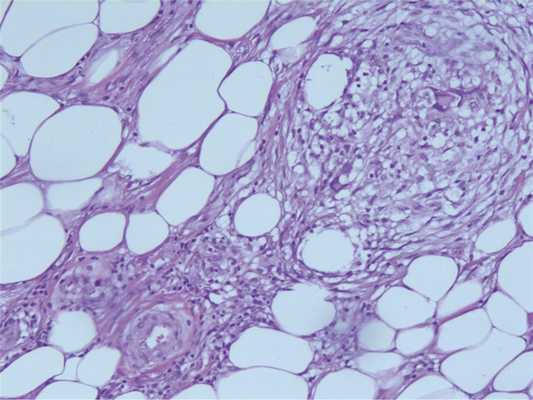
Почти у половины больных (27, 43,5%) в ПЖК на фоне воспаления выявляли липонекрозы и микрокисты (табл. 2, рис. Таблица 2. Морфологическая характеристика панникулита Примечание. ++ типичный показатель, + выявлен показатель, ± может присутствовать, — показатель не характерен. 3, а). Рис. 3. Подкожная клетчатка. а — липонекроз и образование кист, ×150; б — липофаги на фоне липонекроза, ×250; в — полиморфно-ядерные лейкоциты в инфильтрате, ×150; г — лимфоциты и эозинофилы в воспалительном инфильтрате. Вовлечение венул. Продуктивно-деструктивный васкулит, ×200. Окраска гематоксилином и эозином. Липофаги наблюдали у 26 (42%) пациентов, а гигантские многоядерные клетки — лишь у 11 (17,7%) (cм. рис. 3, б). Следует отметить преобладание лимфоцитов в инфильтрате более чем в половине случаев (42, 67,74%). Наряду с этим в 32,25% случаев были полиморфно-клеточные инфильтраты с преобладанием лейкоцитов (см. рис. 3, в). Хотя ИЛП считается лобулярным панникулитом без васкулита, было определено наличие продуктивных и продуктивно-деструктивных васкулитов у большинства пациентов (40, 64,5%) (см. рис. 3, г). Слабовыраженное вовлечение в патологический процесс септ определено в 67,74% случаев, т. е. имел место смешанный лобулярно-септальный панникулит. Описанные морфологические изменения можно было расценить как проявления острого процесса. У 14 больных обнаружены гранулемоподобные гистиоцитарные структуры в дольках подкожной клетчатки. Такие изменения укладывались в картину липофагической фазы панникулита. В единичных случаях наблюдали описанные изменения в сочетании с фокусами грануляционной ткани. При этом не отмечали выраженную фибропластическую реакцию.
На втором этапе провели анализ изменений в подкожной клетчатке в зависимости от характера течения заболевания. Из 62 больных ИЛП (в том числе у 9 с острым, у 13 с подострым и у 40 с хроническим течением болезни) у половины пациентов каждой подгруппы отмечали липонекроз (см. рис. 3, а). Следует отметить, что при подостром и остром течении преобладал полиморфно-клеточный воспалительный инфильтрат: 10 (76,92%) из 13 случаев подострого ИЛП и 8 (88,89%) из 9 случаев острого ИПЛ (см. рис. 3, в). В инфильтрате больных с хроническим течением ИЛП преимущественно присутствовали лимфоциты — у 38 (95%) из 40. В инфильтрате больных этой группы гигантские многоядерные клетки выявлены в большом количестве. Встречали гранулемы в дольках клетчатки (рис. 4). Рис. 4. Подкожная клетчатка. Гранулема, гигантские клетки. Окраска гематоксилином и эозином, ×250. Эозинофилы в инфильтратах статистически значимо выявляли у больных с хроническим течением ИЛП (χ 2 =13,43; р=0,001). Описанные изменения сопровождались развитием продуктивных васкулитов у половины пациентов этой подгруппы (21, 52,5%) (χ 2 =6,90; р=0,03). Частота формирования гранулемоподобных структур значимо не различалась в целом и в подгруппах заболевания. Независимо от характера течения ИЛП фиброз соединительнотканных септ и сосудов отсутствовал (χ 2 =5,98; р=0,05).
Таким образом, характер морфологических показателей заболевания коррелировал с клиническим течением ИЛП. Острое течение болезни характеризовалось преобладанием липонекроза и лимфолейкоцитарного воспаления в сочетании с продуктивно-деструктивными васкулитами. Это признаки островоспалительной фазы формирования узла. При хроническом течении преобладали лимфоциты и гистиоциты с гигантскими макрофагами (липофагами), а также отмечали наличие гранулемоподобных структур. Указанные морфологические изменения характерны для липофагической стадии формирования узла. В данном исследовании фибропластическую стадию панникулита не наблюдали. Вероятно, это объясняется тем, что пациенты находятся в клинике лишь в стадии обострения болезни, когда необходима дифференциальная диагностика.
Для оценки практической значимости морфологических признаков применяли статистические методы с построением графиков типа форест-плот. Сравнивали узловатую клиническую форму с бляшечной, инфильтративной и мезентериальной формами. Выявленные лимфоцитарные инфильтраты (отношение шансов (ОШ) 0,042; 95% доверительный интервал (ДИ) 0,007—0,271; р<0,005) с примесью эозинофилов (ОШ 0,306; 95% ДИ 0,065—1,428; р<0,005) явились критериальными признаками узловатой формы, тогда как полиморфно-клеточные инфильтраты (ОШ 23,750; 95% ДИ 3,689—152,885; р<0,005) с нейтрофилами (ОШ 10,800; 95% ДИ 2,095—55,666; р<0,005) с большей вероятностью свидетельствовали о бляшечной форме.
Наличие нейтрофильных лейкоцитов в инфильтратах являлось значимым фактором риска развития инфильтративной формы (ОШ 8,000; 95% ДИ 1,243—51,506; р<0,005) в отличие от узловатой.
Панникулит — это гетерогенная группа воспалительных заболеваний, характеризующихся поражением ПЖК и нередко протекающих с вовлечением в процесс опорно-двигательного аппарата и внутренних органов [6, 12]. Отсутствует единая концепция этиологии и патогенеза панникулита. Определенную роль в развитии панникулита могут играть инфекции (вирусные, бактериальные), травмы, гормональные и иммунные нарушения, прием лекарственных препаратов, заболевания поджелудочной железы, злокачественные новообразования и др. Лобулярный панникулит характеризуется патологией преимущественно долек клетчатки и может протекать с или без вовлечения сосудов в патологический процесс [13—15]. Многие авторы подчеркивают, что отсутствие васкулита является характерной особенностью ИЛП как самостоятельной нозологической формы [6, 9, 10]. Однако результаты представленного исследования показали, что продуктивно-деструктивные васкулиты, в частности венулиты, развиваются при острой и подострой форме заболевания ИЛП. При хроническом течении васкулиты могут быть продуктивными. Алгоритм диагностики этого заболевания включает морфологическую диагностику. Многие авторы отмечают, что это «золотой стандарт» диагностики заболевания [10, 12, 14, 16]. В связи с тем что изменения в узле разнообразные, фрагмент ткани должен быть большим. Это позволяет выявить весь спектр гистологических проявлений заболевания. В нашем исследовании определили, что для гистологического исследования необходим большой фрагмент воспаленного узла, т. е. должна быть проведена хирургическая эксцизионная биопсия с изучением всего доставленного для диагностики материала. Различные варианты пункционной биопсии менее травматичны, но полученные мелкие фрагменты клетчатки и цитологический материал не позволяют установить правильный диагноз. Алгоритм гистологического исследования начинался с определения локализации морфологических изменений в дольках или септах клетчатки. В случае воспаления в дольках необходимо отметить, есть ли поражение сосудов, т. е. идет ли речь о лобулярном панникулите без или с васкулитом. Таким образом определяли вид и подгруппу панникулита. Следующим этапом изучали характер инфильтрата в клетчатке. Определение клеточного состава воспалительного инфильтрата дает возможность выявить форму заболевания, а именно острую, подострую, хроническую. В медицинской литературе отсутствуют данные о корреляциях морфологических изменений в тканях при ИЛП в зависимости от характера течения. Показано, что преобладание лейкоцитов указывает на острую форму болезни. Большое количество лимфоцитов и гистиоцитов в инфильтрате характерно для подострого течения, а макрофаги, гигантские многоядерные клетки и гранулемы — для хронического течения. Полученные данные о характере инфильтрата, наличии фокусов некроза лишь частично согласуются с данными других авторов [14—18]. В представленном исследовании показано, что острое течение болезни характеризовалось преобладанием липонекроза и лимфолейкоцитарного инфильтрата в сочетании с продуктивно-деструктивными васкулитами. Это признаки островоспалительной фазы формирования узла. Морфологическая характеристика хронического течения ИЛП включает наличие лимфогистиоцитарного инфильтрата с примесью эозинофилов и гигантских многоядерных клеток долек ПЖК, продуктивных васкулитов. Это липофагическая фаза формирования узла. Гранулемоподобные структуры встречаются закономерно при ИЛП, однако они не коррелируют с характером течения ИЛП [9—11].
Результаты исследования выявили признаки, которые характеризуют различные клинические формы ИЛП — узловатую, бляшечную, инфильтративную и мезентериальную. При этом определено, какие признаки могут иметь диагностическое значение. Критериальными признаками узловатой формы болезни являются лимфоцитарные инфильтраты с примесью эозинофилов, тогда как бляшечная форма ассоциируется с полиморфно-клеточными инфильтратами с преобладанием нейтрофилов. Фактором риска развития инфильтративной формы является наличие нейтрофильных лейкоцитов в инфильтратах. Самой трудной для диагностики является мезентериальная форма ИЛП, так как основные изменения локализуются в мезентериальной клетчатке, а в ПЖК узлы формируются в небольшом количестве. Мезентериальная форма болезни характеризуется сочетанием полиморфно-клеточных инфильтратов с примесью нейтрофилов и эозинофилов на фоне минимальной выраженности воспаления долек. При этом характерно незначительное увеличение указанных клеток по сравнению со средними значениями.
Таким образом, для диагностики ИЛП необходима гистологическая верификация заболевания. Алгоритм исследования должен начинаться с определения преимущественного поражения долек или септ, характера поражения сосудов, а также качественного состава воспалительного инфильтрата. Такой подход способствует достоверной диагностике ИЛП (панникулит Вебера—Крисчена), определению характера течения, формы заболевания. Особенно важно выявить мезентериальную форму заболевания на основании изучения характера воспаления и клеточного состава подкожного узла.
Читайте также:
