Синдром широкого водопровода улитки. Диагностика широкого водопровода улитки.
Добавил пользователь Alex Обновлено: 28.01.2026
Отделение оториноларингологии, отделение компьютерной томографии Научного центра здоровья детей РАМН, Москва
ФГБНУ «Научный центр здоровья детей», Москва, Россия, 119991
Отделение рентгеновской компьютерной томографии Научного центра здоровья детей РАМН, Москва
Синдром расширенного водопровода преддверия: этиология, клиника, диагностика, реабилитация пациентов
Журнал: Вестник оториноларингологии. 2015;80(6): 46‑50
Цель статьи — описание клинических проявлений синдрома расширенного водопровода преддверия, применяемых в настоящее время методов его диагностики и описания тактики реабилитации пациентов с данным состоянием. Представлены сведения об анатомии, КТ-анатомии и патоморфологических изменениях водопровода преддверия, особенности клинической картины, современный алгоритм диагностики и возможности слуховой реабилитации данной группы больных.
Анатомия и рентгенанатомия водопровода преддверия. Внутреннее ухо (лабиринт) анатомически связано как с барабанной полостью через овальное окно преддверия и круглое окно улитки, так и с задней черепной ямкой через водопровод преддверия, водопровод улитки и внутренний слуховой проход.
Водопровод преддверия и водопровод улитки обеспечивают регуляцию давления в эндолимфатическом и перилимфатическом пространствах лабиринта.
Водопровод преддверия начинается внутренней апертурой, расположенной в нижних отделах эллиптического углубления, кпереди от устья общей ножки заднего и верхнего полукружных каналов. Заканчивается водопровод преддверия наружной апертурой, которая открывается на задней грани пирамиды височной кости кзади от отверстия внутреннего слухового прохода и книзу от борозды верхнего каменистого синуса. Внутри водопровода преддверия проходит эндолимфатический проток, который формируется из совместного протока эллиптического и сферического мешочков (ductus utriculosaccularis) и заканчивается резервуаром — эндолимфатическим мешком, который находится в дупликатуре твердой мозговой оболочки на задней поверхности пирамиды височной кости [1, 2]. Таким образом, эндолимфатическая система преддверия и улитки связаны между собой и являются замкнутым образованием. Эндолимфа течет по эндолимфатическому протоку в направлении эндолимфатического мешка.
Прижизненная визуализация водопровода преддверия стала возможной с внедрением в клиническую практику компьютерной томографии (КТ). На томограммах неизмененный водопровод преддверия (рис. 1) визуализируется в виде узкой линейной щели шириной до 1,5 мм, идущей от преддверия к задней грани пирамиды и заканчивающийся на ней отверстием, расположенным кзади от внутреннего слухового прохода [3, 4].
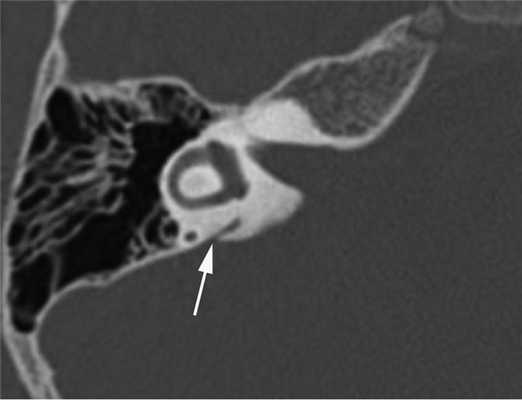
Рис. 1. Неизмененный водопровод преддверия (стрелка). Компьютерная томограмма правой височной кости в аксиальной проекции.
Синдром расширенного водопровода преддверия (СРВП) — достаточно распространенная аномалия костного лабиринта внутреннего уха, которая приводит к развитию тугоухости различной степени тяжести, обладает большой вариабельностью клинических проявлений, сочетается с другими заболеваниями и должна распознаваться специалистами. Постановка этого диагноза стала возможной благодаря все более широкому использованию КТ височных костей для выявления причин тугоухости неясного генеза.
Предполагают, что при расширенном эндолимфатическом протоке происходит рефлюкс эндолимфы в улитковый проток, в то время как нормальным считается перемещение эндолимфы от улиткового и полукружных протоков к эндолимфатическому мешку. Причиной снижения слуха могут быть нарушение нормального движения жидкости в эндолимфатической системе внутреннего уха, нарушения водно-электролитного и кислотно-щелочного баланса эндолимфы, приводящие к повреждению нейроэпителия [3, 5].
Этиология заболевания. СРВП как находка при КТ височных костей описывался различными авторами начиная с 80-х годов прошлого века. Семейное изолированное нарушение слуха с расширенным водопроводом преддверия было впервые описано в 1996 г. Griffith и соавт. (цит. по [2]).
Впоследствии выяснилось, что СРВП — наследственное заболевание с аутосомно-рецессивным типом наследования. Причиной является мутация в гене SLC26A4 (ген синдрома Пендреда — PDS), который локализован на хромосоме 7q22-q31, состоит из 21 экзона и кодирует трансмембранный транспортный белок пендрин. Остановка нормального развития уха возникает на 8—9-й неделе гестации. Мутации в данном гене могут приводить как к изолированной тугоухости (несиндромальная форма), так и к синдрому Пендреда (тугоухость и эутиреоидный зоб) или к дистальному почечному тубулярному ацидозу. Наличие двух мутантных аллелей SLC26A4 коррелирует с двусторонним синдромом расширенного водопровода преддверия и синдромом Пендреда, в то время как односторонняя аномалия и несиндромальный расширенный водопровод преддверия коррелируют с одной мутантной аллелью или мутантные аллели отсутствуют [6]. По данным некоторых авторов, присутствие аномального аллеля даже в гетерозиготном состоянии ассоциируется с более широким водопроводом преддверия и аномальным развитием преддверия [7]. СРВП может сочетаться с неполным разделением завитков улитки и аномалией Мондини [8—10].
Клиника. Обычно человек уже рождается с расширенным водопроводом преддверия. При этом нарушение слуха при СРВП присутствует с рождения или начинается в любом возрасте, чаще в дошкольном, но описаны случаи снижения слуха при данном синдроме и после 40 лет. Также при наличии данной аномалии могут сохраняться и нормальные пороги слуха [11]. Замечено, что снижение слуха может быть спровоцировано небольшой травмой головы, изменениями барометрического давления, физической нагрузкой, инфекционными заболеваниями, стрессом, гипертонической болезнью [3, 4, 8, 10, 12]. Нарушение слуха может носить сенсоневральный, смешанный или кондуктивый характер. Костно-воздушный разрыв на низких частотах встречается в 80% случаев [13].
Механизм появления на аудиограмме костно-воздушного интервала остается неясным. Существует гипотеза, что расширенный водопровод преддверия может быть причиной костно-воздушного интервала на аудиограмме из-за шунтирования (отвода) воздушно проведенных звуков от улитки, что повышает порог слуха для воздушно проведенных звуков, а увеличение разницы в импедансе между лестницей преддверия и барабанной лестницей улучшает пороги слуха для костно-проведенных звуков [14]. Тугоухость при этом синдроме бывает как односторонней, так и двусторонней. Также снижение слуха может быть флюктуирующим, прогрессирующим или внезапным. У лиц с несиндромальной формой СРВП слух более подвержен флюктуации, в ряде случае наблюдается спонтанное восстановление слуха.
СРВП — процесс всегда двусторонний, даже при наличии анатомической аномалии только с одной стороны. Пациенты с односторонним СРВП имеют более высокую частоту возникновения снижения слуха на втором ухе, чем пациенты с односторонней сенсоневральной тугоухостью без расширенного водопровода преддверия [15]. Скорость и степень снижения слуха при СРВП вариабельны и не коррелируют с шириной водопровода преддверия [3, 4, 9, 10]. S. Zwang и соавт. [16] не обнаружили корреляции между степенью снижения слуха и шириной внешней апертуры водопровода преддверия (в области эндолимфатического мешка). Это подтверждается и другими авторами, которые в то же время отмечают, что расширение водопровода в области внутренней апертуры может коррелировать с прогрессирующим ухудшением слуха [17].
Диагностика. СРВП часто мимикрирует заболевания среднего уха. Известно, что аномальное соединение внутреннего уха с подоболочечным пространством головного мозга, также как и «третье окно» лабиринта, может давать костно-воздушный разрыв на аудиограмме, более выраженный на низких частотах. Это явление описано в англоязычной литературе как интралабиринтная кондуктивная тугоухость, «псевдокондуктивная» тугоухость или «ложная» кондуктивная тугоухость [18]. Поэтому любое снижение слуха, характеризующееся нормальными тимпанограммами типа А, наличием акустических рефлексов и костно-воздушного интервала, более выраженного на низких частотах, должно вызывать подозрение на аномалию внутреннего уха. В таких случаях показано проведение высокоразрешающей мультиспиральной КТ височных костей, что позволит избежать эксплоративной тимпанотомии, проводимой ошибочно по поводу смешанной или кондуктивной тугоухости неясного генеза. На К.Т. данный синдром характеризуется расширением водопровода преддверия от 1,5 до 5—6 мм (рис. 2).
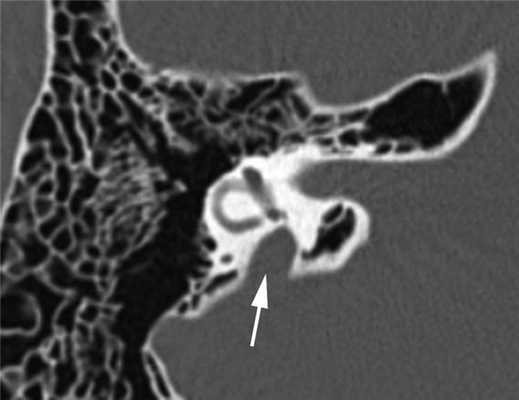
Рис. 2. Широкий водопровод преддверия (стрелка). Компьютерная томограмма правой височной кости в аксиальной проекции. Пациент А., 14 лет.
При наличии сенсоневральных нарушений слуха неясной этиологии показано выполнение МРТ головного мозга и пирамид височных костей. Т2-взвешенные изображения позволяют отчетливо выявить расширенный водопровод преддверия (рис. 3).
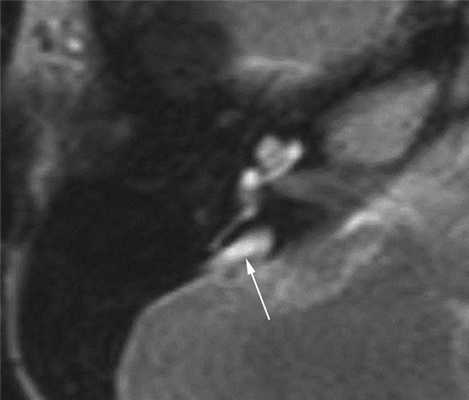
Рис. 3. Широкий водопровод преддверия (стрелка). Магнитно-резонансная томограмма правой височной кости в аксиальной проекции. Пациент А., 14 лет.
При данной аномалии развития необходима консультация эндокринолога (исследование функции и ультразвуковое исследование щитовидной железы) для выявления синдрома Пендреда, консультация генетика (ДНК-диагностика PDS-гена) и консультация нефролога для выявления дистального почечного тубулярного ацидоза.
Лечение и реабилитация. В литературе описан единичный случай лечения 12-летнего ребенка из Австралии, который внезапно оглох после травмы головы и у которого был обнаружен расширенный водопровод преддверия. Была проведена терапия стероидами и курс гипербарической оксигенации с хорошим улучшением порогов слуха на аудиограмме [19].
Тактика ведения пациентов с СРВП аналогична тактике ведения пациентов с повышенным внутричерепным давлением — рекомендуется избегать перепадов давления, физических нагрузок, занятий спортом, особенно занятий дайвингом. Также рекомендуется бессолевая диета. Для реабилитации хронической тугоухости при СРВП используются цифровые слуховые аппараты различной мощности. При односторонней глухоте для устранения проблем моноурального слуха нами используется система CROS. Система состоит из двух устройств. На стороне глухого уха применяется устройство в корпусе слухового аппарата, которое «собирает» звуки и передает их по беспроводной связи на сторону слышащего уха. На стороне слышащего уха располагается принимающее устройство (слуховой аппарат, но без усиления звуков). Это позволяет пациентам лучше разбирать речь в шумной обстановке. При асимметричной потере слуха успешно используется система BICROS.
На стороне глухого уха также используется передающее устройство в корпусе слухового аппарата. На стороне плохо слышащего уха — принимающее устройство, которое также работает и как слуховой аппарат (дает усиление звуков).
При двусторонней сенсоневральной глухоте проведение операции кохлеарной имплантации у пациентов с СРВП может осложняться gusher-синдромом.
Приводим несколько собственных клинических наблюдений.
1. Пациент А., 14 лет (аудиограмма, рис. 4), наблюдается в отделении нефрологии Научного центра здоровья детей с диагнозом: нефротический синдром, дистальный почечный тубулярный ацидоз. Снижение слуха возникло внезапно, без видимых причин, в возрасте 13 лет 6 мес. На компьютерной томограмме височных костей — двустороннее расширение водопровода преддверия (см. рис. 2). Высокоразрешающая МРТ пирамид височной кости также выявила широкий водопровод преддверия (см. рис. 3). Рекомендовано использование системы BICROS.
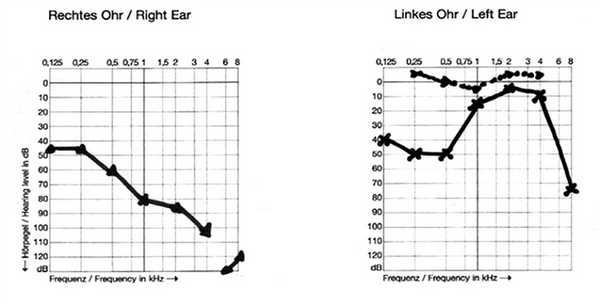
Рис. 4. Тональная пороговая аудиограмма пациента А., 14 лет.
2. Пациентка П., 6 лет (аудиограмма, рис. 5). Родители обратились по поводу впервые случайно замеченного снижения слуха на правое ухо. На компьютерной томограмме височных костей — признаки двустороннего синдрома расширенного водопровода преддверия. Состояние слуха стабильное в течение 5 лет. Рекомендовано использование системы CROS.
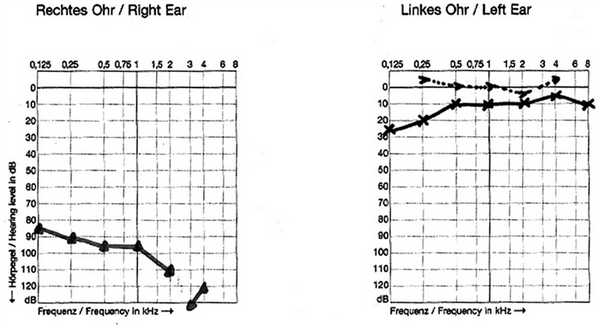
Рис. 5. Тональная пороговая аудиограмма пациентки П., 6 лет.
3. Пациентка С., 18 лет, обратилась с жалобами на медленно прогрессирующее снижение слуха, впервые замеченное в возрасте 6 лет, и постоянный пульсирующий шум в правом ухе (аудиограмма, рис. 6). С 6 лет регулярно два раза в год получала курсы консервативного лечения сенсоневральной тугоухости в условиях стационара с некоторым временным улучшением слуха. На компьютерной томограмме височных костей — признаки двустороннего расширения водопровода преддверия, высокое стояние луковицы яремной вены справа. Рекомендовано бинауральное слухопротезирование цифровыми слуховыми аппаратами малой мощности.
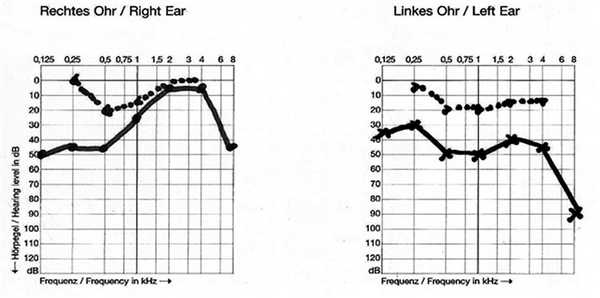
Рис. 6. Тональная пороговая аудиограмма пациентки С., 18 лет.
Заключение. Больным с тугоухостью неясного генеза в алгоритм обследования целесообразно включать КТ височной кости и МРТ головного мозга. Своевременное выявление изменений структур среднего и внутреннего уха позволяет использовать современные методы реабилитации, определить прогноз течения заболевания и избежать ненужных диагностических исследований и терапевтических процедур.
Синдром широкого водопровода улитки. Диагностика широкого водопровода улитки.
АФК — активные формы кислорода
БМ — болезнь Меньера
ВВМП — вызванные вестибулярные миогенные потенциалы
мРНК — матричная рибонуклеиновая кислота
МРТ — магнитно-резонансная томография
СП — суммационный потенциал улитки
ПД — потенциал действия слухового нерва
GLAST — glutathion aspartate transporter
HLA — human leukocyte antigens
КТ — компьютерная томография
Гидропс лабиринта — невоспалительная реакция эпителия внутреннего уха на раздражение, обусловливающая развитие эндолимфатического отека [1]. Фактически гидропс — патологически расширенное эндолимфатическое пространство, приводящее к увеличению эндолимфатического объема [2]. Заболевание характеризуется системным головокружением, нейросенсорной тугоухостью, низко- и высокочастотными шумами в ушах. Гидропс лабиринта — проблема отнюдь не только медицинского характера, она отражается на качестве жизни больного, затрагивает практически все сферы его жизнедеятельности. Следовательно, состояние требует особого избирательного подхода к диагностике, при этом сохраняя субъективные и объективные методы выявления гидропса лабиринта с учетом возраста и индивидуальных особенностей пациентов. Отметим также, что на сегодняшний день назрела острая необходимость совершенствования имеющихся методов диагностики патологии [3].
Гидропс лабиринта характеризуется избыточным накоплением эндолимфатической жидкости, вследствие чего повышается давление в перепончатом лабиринте системы внутреннего уха. Подавляющая часть экспертов уверены, что развитию гидропса способствуют два составляющих фактора: выработка большого количества эндолимфы сосудистой полоской спирального органа улитки и нарушение процесса ее удаления в эндолимфатическом мешке и эндолимфатической протоке, либо оба этих процесса, действующих совместно [4].
Причины нарушения резорбции лимфы могут быть врожденными и приобретенными. Врожденные причины встречаются крайне редко, например недоразвитие улитки. Приобретенный гидропс в основном может быть связан с аутоиммунными, травматическими, воспалительными, метаболическими заболеваниями [5].
На сегодняшний день все большее распространение получает теория вирусной этиологии гидропса лабиринта. Исследователи связывают это в целом с популяризацией изучения вирусной природы различных заболеваний [6]. Для понимания нарушений, которые приводят к гидропсу лабиринта, ученые обращаются к физиологии жидких сред мозга. Ключевыми в гомеостазе этих жидкостей являются несколько барьеров: 1 — барьер между жидкостями внутреннего уха и кровью, 2 — барьеры, связанные со спинномозговой жидкостью (ликвором), 3 —барьеры между отделами полостей среднего и внутреннего уха [1]. Чаще всего поражается гематолабиринтный барьер, причиной является нарушение тока эндолимфы, а также перелимфы [5].
Существуют две основные теории относительно тока эндолимфы. Первая, предложенная S. Guild еще в 1927 г., основана на механизме продольного тока, при котором эндолимфа продуцируется в улитке, протекает в переднюю часть перепончатого лабиринта, а именно в сферический мешочек, а затем абсорбируется в эндолимфатическом мешочке. Прерывание тока лимфы ведет к скоплению эндолимфы в верхних отделах и формированию гидропса [7]. Данная концепция противопоставляется концепции радиального тока, согласно которой лимфа секретируется и абсорбируется в улитковом канале. Исследование A. Salt и Y. Ma с использованием специальных ионных маркеров показало, что гомеостаз эндолимфы распределен по всему улитковому ходу [8].
Радиальный ток регулируется разными молекулами и ионными каналами, важную роль играют белки семейста аквапоринов. Во внутреннем ухе человека были обнаружены аквапорины 2, 3, 6 в эпителии эндолимфатического мешка. Аквапорины 1, 4, 5 экспрессируются в неэпителиальных клетках улитки, в частности в спиральной связке и фиброцитах [7]. T. Takeda и соавт. продемонстрировали, что введение вазопрессина, повышающего активность аквапорина 2, через 1 нед приводит к развитию гидропса у морских свинок [9]. Эти же исследователи показали, что введение антагониста вазопрессина — OPC 31260 может привести к коллапсу эндолимфатического протока, а также предотвратить развитие гидропса после хирургической облитерации протока. Эти исследования подтверждают роль аквапоринов в развитии гидропса лабиринта.
Недавнее исследование F. Di Berardino и A. Cesarini подтвердило возможную аллергическую природу гидропса. У 83% пациентов с гидропсом лабиринта, вошедших в исследование, были обнаружены положительные кожные пробы к одному или нескольким аллергенам, у 55% — чувствительность к глиадину, главному антигену при аллергии на пшеницу. К слову, данные тесты в контрольной группе, которую составляли здоровые пациенты, были отрицательными [10].
По данным исследований ряда ученых, спровоцировать гидропс лабиринта могут заболевания, связанные с расстройством кровообращения, например синдром позвоночной артерии — заболевание, которое напрямую никак не связано с проблемами внутреннего уха. В этой ситуации гидропс лабиринта проявляется как вторичное заболевание [11].
Важным возможным патогенетическим звеном в возникновении гидропса лабиринта является оксид азота (NO). Существует три основных типа NO-синтазы (NOS); ряд исследований показал, что экспрессия NOS II повышена у морских свинок в кортиевом органе, спиральных ганглиозных клетках, вестибулярных сенсорных и поддерживающих клетках после хирургической индукции гидропса [12]. Хроническая индукция NOS NMDA-рецепторами приводит к накоплению большого количества оксида азота и активных форм кислорода (АФК) [13]. Большое количество АФК в свою очередь способствует увеличению количества цитохрома С — важного элемента внутреннего пути апоптоза. Таким образом, возможно, гидропс лабиринта приводит к хронической активации NMDA-рецепторов и нейрональному повреждению [14].
Помимо оксида азота, серьезное действие на различные патологии внутреннего уха оказываает глутамат. Глутамат аспартатный транспортер GLAST важный фактор поддержания нетоксичного уровня глутамата в улитке [15]. Эксперименты показали, что при гидропсе лабиринта при определенных состояниях внутреннего уха повышаются мРНК GLAST и глутатион-синтаза, что позволяет предполагать новые пути для методов исследования природы гидропса [16].
Исторически диагноз гидропса устанавливался преимущественно на основании длительного анамнеза, так как большинство рутинных методов диагностики не является достаточно чувствительным и специфичным [17]. В современном мире существует несколько инструментальных методов диагностики данного патологического состояния.
Тональная пороговая аудиометрия — достаточно эффективный метод диагностики гидропса лабиринта. Большинство исследователей сходятся в одном: аудиологическое исследование — первый и необходимый этап инструментальной диагностики. При выявлении гидропса наблюдается повышение слуховых порогов с изменением восприятия низких тонов, аудиометрическая кривая носит преимущественно горизонтальный тип [4].
Использование надпороговой аудиометрии также считается важным методом для диагностики гидропса лабиринта. К таким исследованиям в первую очередь относят определение порога дискомфорта методом выравнивания громкости (проба Фаулера) и речевую аудиометрию. Проба Фаулера основана на психофизическом свойстве органа слуха, которое заключается в выравнивании громкости при повышении интенсивности звука на хуже слышащее ухо в том случае, если в нем присутствует ФУНГ. Выравнивание громкости в данном тесте можно объяснить следующим образом: наличие в хуже слышащем ухе ФУНГ обусловливает при каждом новом приращении интенсивности звука все меньшую ее прибавку, так как при этом феномене с увеличением интенсивности ощущение громкости возрастает в несколько раз больше, чем в норме или при кондуктивной тугоухости, при которой ФУНГ отсутствует. При проведении речевой аудиометрии в случае сенсоневральной тугоухости и значительном ФУНГ разборчивость речи при повышении интенсивности понижается, так как начинает влиять феномен слухового дискомфорта: звук кажется слишком громким и невнятным. Наличие ФУНГ обусловливает более крутое восхождение кривой разборчивости речи, а наличие слухового дискомфорта при высокой интенсивности звука — более ранний обрыв кривой [18].
Отечественными исследователями для диагностики гидропса лабиринта также предлагается определение чувствительности к ультразвуку и его латерализации по методу Б.М. Сагаловича. Было показано, что при гидропсе лабиринта слуховая чувствительность к ультразвуку составляет от 61 до 100 кГц. При наличии одностороннего гидропса он латерализуется в хуже слышащее ухо, при двустороннем — в лучше слышащее. В зарубежной литературе указанные методы не описываются [19].
G. Gates и соавт. отмечают, что дегидратационный тест, несмотря на его популярность среди клиницистов, представляет собой косвенный метод диагностики гидропса лабиринта [20]. После тональной пороговой аудиометрии пациенту вводят глицерол и повторяют аудиометрию через 1, 2, 3, 24, 48 ч. Если после введения препарата слух улучшается как минимум на 10 дБ или разборчивость речи повышается на 12% и более, то тест принято считать положительным [21].
Электрокохлеография (ЭКоГ) является еще одним стандартным методом, который используют для выявления гидропса лабиринта. Метод представляет электрофизиологический тест, который отражает повышение давления внутреннего уха через вздутие базилярной мембраны. При электрокохлеографии регистрируется электрическая активность улитки и слухового нерва, возникающая после предъявления звукового стимула. ЭКоГ измеряет отношение суммарного потенциала (СП) к потенциалу, который возникает в ответ на слуховое раздражение (ПД). Отношение менее чем 35% указывает на признаки гидропса лабиринта [17, 22]. Однако, по мнению некоторых авторов, подобная картина изменений ЭКоГ выявляется и при синдроме «третьего окна» (дигисценция полукружного канала, расширенный водопровод преддверия, улитки).
Решающее слово в этом случае принадлежит КТ височных костей, которая в настоящий момент является обязательным инструментальным исследованием для дифференциальной диагностики патологии внутреннего уха. Так, выполнение компьютерной реконструкции позволяет оценить объем лабиринта, эндолимфы и перилимфы, а также саккулюса и утрикулюса [23]. При этом нормальный объем эндолимфы составляет около 5 мкл, в мешочках преддверия и полукружных каналах — около 24 мкл. При наличии гидропса лабиринта объем эндолимфы увеличивается [24—27].
Метод регистрации вызванных вестибулярных миогенных потенциалов (ВВМП) является относительно новым в диагностике гидропса лабиринта [28, 29]. Это нейроэлектрофизиологический тест, который оценивает состояние отолитовых органов утрикулюса и саккулюса. Метод регистрации ВВМП применяют относительно мышц шеи через грудино-ключично-сосцевидную мышцу — цервикальные ВВМП или глазодвигательных мышц через нижние косые мышцы — окулярные ВВМП [30]. Отсутствие или снижение амплитуды ВВМП является признаком гидропса. Ряд экспертов считают, что метод ВВМП позволяет уточнить локализацию и распространенность гидропса [31]. Однако зачастую исследование проводят дополнительно к другим базовым методикам.
Сегодня для исследования микромеханики структур среднего и внутреннего уха применяют метод широкополосной импедансометрии [32]. Данный метод позволяет регистрировать акустический рефлекс стременной мышцы и определять резонансную частоту, что позволяет усовершенствовать метод низкочастотной тимпанометрии. Для исследования применяют зондирующие тоны на частотах от 200 до 8000 Гц, что обеспечивает более точную дифференциальную диагностику патологических изменений в структурах среднего и внутреннего уха, в частности при гидропсе лабиринта [33, 34].
К вестибулологическим методикам исследования гидропса лабиринта можно отнести статокоординаторные и статокинетические пробы, видеоимпульсный тест, битермальную калорическую пробу и метод регистрации вызванных вестибулярных миогенных потенциалов. Статокинетические и статокоординатные тесты хорошо переносятся пациентами и не требуют использования специального оборудования. Видеоимпульсный тест используют для изучения вестибулоокулярного рефлекса [35]. В основе метода лежит измерение скорости поворота головы и одновременного противовращения глазных яблок при зрительной фиксации. В качестве нормативных значений принимают диапазон коэффициента усиления рефлекса 0,76—1,18 и асимметрию между лабиринтами не более 8% [36—38].
Калорическая проба может проводиться как с использованием воды (водная), так и воздуха (воздушная), температуры выше и ниже на 7—12° температуры тела. Преимуществом воздушной методики является возможность ее применения у пациентов с хроническим гнойным процессом в среднем ухе, при котором проведение водной пробы противопоказано [39—41]. При наличии гидропса лабиринта отмечается асимметрия результатов калорической пробы. При этом у большинства (>82%) пациентов наблюдали снижение функции лабиринта с пораженной стороны [34].
Магнитно-резонансная томография (МРТ) является одним из современных методов обнаружения гидропса лабиринта различной локализации, в частности улитки, преддверия или системы полукружных каналов. При данном методе в качестве контрастного вещества используют гадолиний. Через 24 ч после интратимпанального введения данного вещества возможно оценить состояние эндо- и перилимфатического пространства внутреннего уха. Данный метод имеет большие перспективы в объективной верификации пери- и эндолимфатического гидропса лабиринта, так как описанные ранее методики исследования свидетельствуют о признаках общего гидропса лабиринта [42].
Однако, несмотря на достаточное количество применяемых методик выявления гидропса лабиринта, из изложенного в статье ясно, что однозначно информативного, высокочувствительного и специфичного метода на данный момент времени не существует, а известные способы часто имеют значительные ограничения. Все это обусловливает необходимость дальнейшей оптимизации диагностической стратегии описанного патологического состояния.
Компьютерная томография высокого разрешения для определения размеров водопровода улитки при отосклерозе
Журнал: Вестник оториноларингологии. 2019;84(4): 83‑83
Компьютерная томография высокого разрешения для определения размеров водопровода улитки при отосклерозе. Вестник оториноларингологии. 2019;84(4):83‑83.
High-resolution computed tomography of the inner ear: effect of otosclerosis on cochlear aqueduct dimensions. Vestnik Oto-Rino-Laringologii. 2019;84(4):83‑83. (In Russ.).
Ann Otol Rhinol Laryngol. 2019 Apr 11 (В Интернете представлена до публикации в печати) (англ. — США)
Водопровод улитки — это костный канал, соединяющий барабанную лестницу (scala tympani) с субарахноидальным пространством. Следуя теории патогенеза отосклероза, согласно которой происходят резорбция и образование новой кости, авторы статьи предположили, что водопровод улитки при этой патологии должен быть сужен. Был проведен ретроспективный анализ пациентов с отосклерозом, которым выполнили компьютерную томографию височных костей высокой степени разрешения. В контрольную группу включили 20 человек с индуцированной шумом нейросенсорной тугоухостью без отосклероза. В аксиальной проекции провели измерение формы и размеров водопровода улитки. В группу с отосклерозом были включены 25 мужчин и 52 женщины, средний возраст 52,2±17,6 года. В контрольной группе было 10 мужчин и 10 женщин, средний возраст 64±18,5 года. Размеры водопровода улитки, а именно протяженность водопровода, средняя ширина канала, основание апертуры водопровода, самый широкий диаметр апертуры и диаметр воронки водопровода в миллиметрах составили 12,19±1,66; 0,68±0,28; 4,21±1,67; 3,23±1,47 и 2,70±1,05 у пациентов с отосклерозом и 11,57±1,66; 0,69±0,29; 2,56±1,59; 2,77±1,67 и 2,58±1,03 в контрольной группе соответственно. Статистически достоверная разница была выявлена в протяженности водопровода улитки, диаметре основания апертуры и самом широком диаметре апертуры. Авторы делают вывод, что у больных с отосклерозом протяженность водопровода улитки и ширина воронки статистически длинней, чем в контрольной группе. Ширина водопровода не имеет статистически значимой разниц.
- (бесплатный номер
по вопросам подписки)
пн-пт с 10 до 18
- Издательство «Медиа Сфера»
а/я 54, Москва, Россия 127238
«Проект: Аудиология» - сборник научно-практических материалов для профессионалов в области аудиологии и слухопротезирования, включающий материалы конференций, статьи по кохлеарной имплантации, отоневрологии и законодательные акты по сурдологии.

Аномалии развития внутреннего уха и кохлеарная имплантация
В.Е. Кузовков, Ю.К. Янов, С.В. Левин
Санкт-Петербургский научно-исследовательский институт уха, горла, носа и речи
Кохлеарная имплантация (КИ) в настоящее время является общепризнанным в мировой практике и наиболее перспективным направлением реабилитации лиц, страдающих сенсоневральной тугоухостью высокой степени и глухотой, с последующей интеграцией их в среду слышащих. В современной литературе достаточно широко освещены вопросы классификации аномалий развития внутреннего уха, в том числе применительно к КИ, описаны хирургические методики проведения КИ при данной патологии. Мировой опыт КИ у лиц с аномалиями развития внутреннего уха насчитывает более 10 лет. В то же время в отечественной литературе отсутствуют работы по данной тематике.
В Санкт-Петербургском НИИ уха, горла, носа и речи впервые в России стала выполняться КИ у лиц, имеющих аномалии развития внутреннего уха. Трехлетний опыт подобных операций, наличие успешных результатов таких вмешательств, а также недостаточное количество литературы по данному вопросу, послужили причиной выполнения данной работы.
Классификация аномалий развития внутреннего уха. Современное состояние вопроса.
С появлением в конце 80-х - начале 90-х г.г. компьютерной томографии (КТ) высокого разрешения и магнитно-резонансной томографии (МРТ) данные методики стали широко применяться для диагностики наследственной тугоухости и глухоты, особенно при определении показаний к КИ. С помощью этих прогрессивных и высокоточных методик были выявлены новые аномалии, которые не укладывались в существовавшие классификации F. Siebenmann [5] и K. Terrahe [7]. В результате чего R.K. Jackler [1, 2] были предложена новая классификация, расширенная и модифицированная N. Marangos [4] и L. Sennaroglu [5]. Однако, следует отметить, что, в частности, МРТ в настоящее время выявляет настолько тонкие детали, что обнаруживаемые мальформации бывает трудно классифицировать [3, 4].
В своей классификации аномалий развития внутреннего уха, основанной на данных обычной рентгенографии и первых данных КТ, R.K. Jackler [1] принимал во внимание отдельное развитие преддверно-полукружной и преддверно-улитковой частей единой системы. Автор предположил, что различные типы аномалий появляются в результате задержки или нарушения развития на определенной стадии последнего. Таким образом, обнаруживаемые типы мальформаций соотносятся с временем нарушения. Позже автор рекомендовал относить комбинированные аномалии к категории А, и предположил связь таких аномалий с наличием расширенного водопровода преддверия (табл.1).
В классификации N. Marangos [3] включены неполное или аберрантное развитие лабиринта (табл. 2, пункт 5).
Таблица 2
Классификация аномалий развития внутреннего уха по N. Marangos
| Категория | Подгруппа |
| А = неполное эмбриональное развитие | 1. Полная аплазия внутреннего уха (аномалия Michel) 2. Общая полость (отоцист) 3. Аплазия/гипоплазия улитки (нормальный «задний» лабиринт) 4. Аплазия/гипоплазия «заднего лабиринта» (нормальная улитка) 5. Гипоплазия всего лабиринта 6. Дисплазия Mondini |
| В = аберрантное эмбриональное развитие | 1. Расширенный водопровод преддверия 2. Узкий внутренний слуховой проход (внутрикостный диаметр менее 2 мм) 3. Длинный поперечный гребень (crista transversa) 4. Внутренний слуховой проход, разделенный на 3 части 5. Неполное кохлеомеатальное разделение (внутреннего слухового прохода и улитки) |
| С = изолированные наследственные аномалии | Х-связанная тугоухость |
| D | Аномалии при наследственных синдромах |
Таким образом, описаны четыре категории (A-D) аномалий развития внутреннего уха. Расширенным водопровод преддверия автор считает, если межкостное расстояние в средней части превышает 2 мм, тогда как другие авторы приводят цифру в 1,5 мм.
L. Sennaroglu [4] дифференцирует 5 основных групп (табл. 3): аномалии развития улитки, преддверия, полукружных каналов, внутреннего слухового прохода и водопровода преддверия или улитки.
Основные группы и конфигурации кохлеовестибулярных аномалий по L. Sennaroglu
| Основные группы | Конфигурация |
| Кохлеарные аномалии | Аномалия Michel / аплазия улитки / общая полость / неполное разделение тип I / гипоплазия улитки / неполное разделение тип II / нормальная улитка |
| Вестибулярные аномалии | Преддверие: отсутствие / гипоплазия / расширение (включая аномалию Michel и общую полость) |
| Аномалии полукружных каналов | Отсутствие / гипоплазия / увеличенные размеры |
| Аномалии внутреннего слухового прохода | Отсутствие / узкий / расширенный |
| Аномалии водопроводов преддверия и улитки | Расширенный / нормальный |
Кохлеарные мальформации (табл. 4) были разделены автором по степени выраженности на шесть категорий в зависимости от времени нарушения нормального хода эмбрионального развития. Эта классификация аномалий развития улитки включает неполное разделение I и II типов.
Таблица 4
Классификация аномалий улитки по времени нарушения внутриутробного развития по L. Sennaroglu
| Кохлеарные мальформации | Описание |
| Аномалия Michel (3-я неделя) | Полное отсутствие кохлеовестибулярных структур, часто - апластичный внутренний слуховой проход, чаще всего - нормальный водопровод преддверия |
| Аплазия улитки (конец 3-ей недели) | Улитка отсутствует, нормальное, расширенное или гипопластическое преддверие, и система полукружных каналов, часто - расширенный внутренний слуховой проход, чаще всего - нормальный водопровод преддверия |
| Общая полость (4-ая неделя) | Улитка и преддверие - единое пространство без внутренней архитектуры, нормальная или деформированная система полукружных каналов, либо ее отсутствие; внутренний слуховой проход чаще расширен, чем сужен; чаще всего - нормальный водопровод преддверия |
| Неполное разделение тип II (5-ая неделя) | Улитка представлена единой полостью без внутренней архитектуры; расширенное преддверие; чаще всего - расширенный внутренний слуховой проход; отсутствующая, расширенная или нормальная система полукружных каналов; нормальный водопровод преддверия |
| Гипоплазия улитки (6-ая неделя) | Четкое разделение кохлеарных и вестибулярных структур, улитка в виде пузырька небольших размеров; отсутствие или гипоплазия преддверия и системы полукружных каналов; суженный или нормальный внутренний слуховой проход; нормальный водопровод преддверия |
| Неполное разделение, тип II (аномалия Мондини) (7-ая неделя) | Улитка в 1,5 завитка, кистозно расширенные средний и апикальный завитки; размеры улитки близки к норме; незначительно расширенное преддверие; нормальная система полукружных каналов, расширенный водопровод преддверия |
Учитывая вышеизложенные современные представления о видах кохлеовестибулярных нарушений, мы используем классификации R.K. Jackler и L. Sennaroglu, как наиболее соответствующие находкам, встречающимся в собственной практике.
Принимая во внимание небольшое число прооперированных пациентов, ниже представлен один случай успешной КИ при аномалии развития внутреннего уха.
Случай из практики.
В СПб НИИ ЛОР в марте 2007 года обратились родители пациентки К., 2005 года рождения с жалобами на отсутствие у ребенка реакции на звуки и отсутствие речи. В ходе обследования был установлен диагноз: Хроническая двухсторонняя сенсоневральная тугоухость IV степени, врожденной этиологии. Вторичное расстройство рецептивной и экспрессивной речи. Последствия перенесенной внутриутробной цитомегаловирусной инфекции, внутриутробного поражения центральной нервной системы. Резидуально-органическое поражение центральной нервной системы. Левосторонний спастический верхний монопарез. Аплазия I пальца левой кисти. Дисплазия тазобедренных суставов. Спастическая кривошея. Тазовая дистопия гипоплазированной правой почки. Задержка психомоторного развития.
По заключению детского психолога - познавательные способности ребенка в пределах возрастной нормы, интеллект сохранен.

При проведении игровой аудиометрии в слуховых аппаратах выявлены реакции на звуки интенсивностью 80-95 дБ в диапазоне частот от 250 до 1000 Гц.
КТ височных костей выявила наличие двухсторонней аномалии развития улитки в виде неполного разделения I типа (табл. 4). При этом данное утверждение верно как для левого, так и для правого уха, несмотря на различную, на первый взгляд, картину (рис.1).
Рис. 1. Данные КТ пациентки К.

Примечание: Так, справа (1) улитка представлена небольшой полостью, максимальный размер которой составляет не более 5 мм, преддверие и полукружные каналы отсутствуют. Слева (2) улитка представлена единой полостью без внутренней архитектуры, отмечается наличие расширенного преддверия (рис. 2, стрелка); расширенная система полукружных каналов (рис. 3, стрелка).
Рис.2. Расширенное преддверие слева

Рис. 3. Расширенная и деформированная система полукружных каналов слева
После обследования пациентке проведена КИ на левом ухе классическим доступом через антромастоидотомию и заднюю тимпанотомию, с введением электрода через кохлеостому. Для операции использовался специальный укороченный электрод (Med-El, Австрия), имеющий рабочую длину активного электрода около 12 мм, специально разработанный для применения в случаях аномалии или оссификации улитки.
Несмотря на сохранные слуховые косточки и сухожилие стременной мышцы, акустические рефлексы со стременной мышцы в ходе операции зафиксированы не были. Однако, при проведении телеметрии нервного ответа, были получены четкие ответы при стимуляции 7 электродов из 12.

Послеоперационная трансорбитальная рентгенография улиток выявила, что активный электрод импланта находится в общей полости (рис. 4, стрелка), приняв форму идеальной окружности.
Рис. 4. Трансорбитальная рентгенография. Укороченный электрод в общей полости.
При контрольном аудиологическом обследовании через год после операции у пациентки обнаружены реакции в свободном звуковом поле на звуки интенсивностью в 15-20 дБ в диапазоне частот от 250 до 4000 Гц. Речь пациентки представлена одно- и двусложными словами («мама», «дай», «пить», «киса» и др.), простой фразой из не более двух одно- или двусложных слов. Учитывая то, что возраст пациентки на момент повторного обследования составлял менее 3 лет, результаты слухоречевой реабилитации в данном случае следует считать отличными.
Современная классификация аномалий развития внутреннего уха не только дает представление о многообразии такой патологии и времени появления дефекта в процессе внутриутробного развития, но и является полезной при определении показаний к проведению кохлеарной имплантации, в процессе выбора тактики для проведения вмешательства. Представленное в работе наблюдение позволяет оценить возможности кохлеарной имплантации, как средства реабилитации, в сложных случаях, расширяет представления о показаниях к проведению имплантации.
Диагностика и лечение различных форм отосклероза. Клинические рекомендации
ГБУЗ «МОСКОВСКИЙ НАУЧНО - ПРАКТИЧЕСКИЙ ЦЕНТР
Национальная медицинская ассоциация оториноларингологов
Министерство здравоохранения Российской Федерации
Составители: д.м.н., проф. Крюков А.И., д.м.н., проф. Кунельская Н.Л., д.м.н. Гаров Е.В., к.м.н. доцент Белякова Л.В., д.м.н. Зеликович Е.И., к.м.н. Сидорина Н.Г., к.м.н. Фёдорова О.В., к.м.н. Загорская Е.Е., к.м.н. Зеленкова В.Н., к.м.н. Левина Ю.В., к.м.н. Лаврова А.С., к.м.н. Байбакова Е.В., к.м.н. Чугунова М.А., к.м.н. Шеремет А.С., Гарова Е.Е., Сударев П.А., Мищенко В.В.
Рекомендации рассмотрены и утверждены на заседании Национальной медицинской ассоциации оториноларингологов от 11-12 ноября 2014 года.
Экспертный совет: д.м.н. проф. Абдулкеримов Х.Т. (Екатеринбург); д.м.н. Артюшкин С.А. (Санкт-Петербург); д.м.н. проф. Гаращенко Т.И. (Москва); д.м.н. проф. Дайхес Н.А. (Москва); д.м.н. проф. Егоров В.И. (Москва); д.м.н. проф Карнеева О.В. (Москва); д.м.н. проф. Карпова Е.П. (Москва); д.м.н. проф. Коркмазов М.Ю. (Челябинск); д.м.н. проф. Кошель В.И. (Ставрополь); д.м.н. проф. Накатис Я.А. (Санкт-Петербург); д.м.н. проф. Овчинников А.Ю.(Москва); д.м.н. проф. Рязанцев С.В. (Санкт-Петербург); д.м.н. проф. Свистушкин В.М.(Москва); д.м.н. Фанта И.В. (Санкт-Петербург); член-корр. РАМН, д.м.н. проф. Янов Ю.К. (Санкт-Петербург).
Введение
По данным Бюро медицинской статистики Департамента здравоохранения города Москвы в структуре заболеваний уха в Лор-стационарах 5-8% - это больные отосклерозом. В структуре сурдологических отделений в последнее десятилетие этот показатель составляет 10-16%. Заболевание поражает наиболее социально активную часть населения в возрасте от 15 до 45 лет. В зависимости от локализации очагов отосклероза заболевание проявляется двусторонней, различного характера тугоухостью, поэтому принято выделять тимпанальную, смешанную и кохлеарную формы отосклероза. В настоящее время наблюдается увеличение распространённых форм отосклероза со смешанным характером тугоухости (от 22,7 до 31,2%).
В зависимости от расположения отосклеротических очагов в капсуле ушного лабиринта различают «гистологический» и «клинический» отосклероз. По данным литературы клинически выраженным отосклерозом, при котором очаги отосклероза расположены фенестрально, страдает 0,1-1% населения, гистологический отосклероз выявляется у 10-12% населения.
При «гистологическом» отосклерозе его очаги, располагаясь в «немых» зонах капсулы лабиринта, могут существовать бессимптомно или заболевание проявляется тугоухостью сенсоневрального характера. Такой вид тугоухости наблюдается при «кохлеарной форме отосклероза».
По данным J. Freeman (1979) кохлеарный отосклероз выявляется у 29% больных с прогрессирующей сенсоневральной тугоухостью. Согласно недавним исследованиям кохлеарная форма отосклероза встречается у 1,5-2,3% пациентов с хронической сенсоневральной тугоухостью, из них у 10% - с прогрессирующим её течением.
Тактика лечения пациентов с отосклерозом во много зависит от формы и стадии отосклероза: гистологический и клинический отосклероз, активная (незрелая) и неактивная (зрелая) его стадии.
Лечение тугоухости у больных фенестральной формой отосклероза с тимпанальной и смешанной тугоухостью - только хирургическое. В пользу проведения операции свидетельствует факт большего прогрессирования нейросенсорного компонента тугоухости в не оперированных ушах в сравнении с оперированными. Инактивирующая консервативная терапия при активной стадии отосклероза, как фенестральной, так и ретрофенестральной, направлена на инактивацию активных очагов отоспонгиоза с их переводом в неактивную склеротическую стадию. При кохлеарной форме, инактивирующая терапия способствует уменьшению прогрессирования сенсоневрального компонента.
Таким образом, современная диагностика различных форм и стадий отосклероза, индивидуальный подход к их лечению, появление новых сведений об анатомии внутреннего уха, нового технического обеспечения операций стремени (лазер, микроборы), развитие хирургической техники, накопление опыта применения различных методик стапедопластики и индивидуальный алгоритм выбора методики ведёт к повышению эффективности реабилитации больных с этим заболеванием.
Некоторые аспекты эпидемиологии и этиологии отосклероза.
Отосклероз - специфическое заболевание, представляющее собой первичное метаболическое поражение костной капсулы ушного лабиринта, выражающееся особой формой остеодистрофии с преимущественно двусторонним очаговым поражением энхондрального слоя капсулы. При этом вначале наблюдается деструкция костной ткани с образованием мягких отоспонгиозных кровенаполненных очагов, а затем - образование очень плотной склеротической кости вследствие отложения в этих очагах солей кальция. Эти фазы размягчения и склерозирования кости имеют волнообразное течение.
Многие авторы отмечают, что люди белой расы болеют отосклерозом в 7 раз чаще людей негроидной расы. Эпидемиологический анализ возраста и гендерные распределения показали более высокий частоту отосклероза у женщин (от 63 до 84%) в период между 15 и 45 годами (до 62%). За последние 30 лет исследований данное соотношение не изменилось, но отмечено увеличение среднего возраста пациентов с отосклерозом и уменьшение количества случаев этого заболевания.
Развитие отосклероза у детей до 14 лет наблюдается у 1,5-3%. В тоже время при анализе стапедопластик, выполненных у детей до 16 лет, в 17% случаях обнаружены очаги отосклероза.
В настоящее время описывается много теорий причин и патогенеза этого заболевания, которые в той или иной мере способствуют возникновению отосклероза. Среди основных гипотез можно выделить следующие: аутосомная доминантная наследственная, вирусная, аутоиммунная и эндокринно-метаболическая, которые разрабатываются до последнего времени.
Многочисленные генетические исследования доказывают, что отосклероз является аутосомно-доминантным заболеванием с проявляемостью гена от 20 до 40%, или неполной его проявляемостью. Современные генетическое исследования позволили определить гены, ответственные за развитие наследственного отосклероза и их локализацию - хромосомы 15q25-26 (ген OTSC1), 7q34-36 (OTSC2), 6р21-22 (OTSC3), 16q22-23 (OTSC4), 3q22-24 (OTSC5).
Присутствие антител в сыворотке крови к коллагену типа II и к коллагену IX у больных отосклерозом может свидетельствовать об аутоиммунную гипотезе развития отосклероза. Также это подтверждается исследованиями, которые выявили в сыворотке крови больных отосклерозом более высокий титр антител к коллагену типа II в сравнении со здоровыми. Выявлено участие трансформирующего фактора роста b1 (TGFB 1 - transforminggrowth factor) в патогенезе отосклероза. Его активность угнетает дифференцирование остеокластов и ингибирует нормальное ремоделирование капсулы лабиринта. Обнаружено участие костных морфогенетических белков (BMP - bonemorphogeneticproteins) BMP2, 4 и 7, которые влияют на хондрогенез, а их мутации вызывают нарушения остеогенеза.
Морфологические и биохимические исследования доказали ассоциации между вирусом кори, который относят к экологическим факторам, и развитием отосклероза. При имуногистохимических исследованиях хондроцитов костной ткани и, в особенности, отоспонгиозных очагов было подтверждено наличие структурных единиц вируса кори, а также наличие белка оболочки вируса. Наличие РНК вируса кори было доказано проведением полимеразной цепной реакции (ПЦР) при исследовании перилимфы и костной ткани у больных отосклерозом. Анализ перилимфы показал наличие антител к белкам вируса кори во всех случаях, и в 80% наличие РНК вируса в препаратах основания и арки стремени, однако в клеточных структурах очагов РНК вируса не обнаружено. Некоторые исследователи кроме вируса кори обнаружили и фактор некроза опухоли в основании стремени, удалённых во время операции у больных отосклерозом.
Несомненно, что в возникновении отосклероза играет роль филогенетическая особенность строения лабиринта у человека и унаследованная врожденная неполноценность лабиринтной капсулы. Это выражается в наследовании повышенной чувствительности (сенсибилизации) лабиринта, остатков его эмбрионального хряща ко всякого рода экзо - и эндогенным сдвигам. В этих условиях эти факторы приобретают роль провоцирующих.
В генезе отосклероза также отмечены эндокринно-обменные нарушения, однако роль их в манифестации отосклероза является сложной и недостаточно изученной. Наиболее вероятно, что проявлению отосклероза предшествует нарушение функций нескольких эндокринных желёз, в первую очередь тех, которые регулируют минеральный обмен (надпочечники, гипофиз, паращитовидные, половые железы).
Классификация отосклероза.
В России до сих пор используется классификация Н.А. Преображенского (1962) в зависимости от состояния порогов слуха по костной проводимости (КП) по данным тональной пороговой аудиометрии (ТПА): тимпанальная, смешанная и кохлеарная формы. Тимпанальная форма (пороги слуха по КП до 20); смешанная форма I (от 21 до 30 дБ); смешанная форма II (> 30 дБ) и кохлеарная форма (КП 50 дБ).
Однако, согласно многим патоморфологическим и клиническим исследованиям принято выделять гистологический и клинический отосклероз, активную (незрелую) и неактивную (зрелую) его стадии, что во многом определяет характер лечения больного.
За последнее десятилетие было немного исследований в этом направлении. Д.Ц. Дондитов (2000) и A. Gros с соавторами (2007) выделяют 4 типа стапедиального отосклероза (ограниченный, умеренный, распространённый и облитерирующий). В своём исследовании G. Malafronte с соавторами (2008) выделяет 3 типа стапедиального отосклероза: основание стремени голубого цвета (очаги в области переднего, заднего полюса и обоих полюсов), белое основание стремени (очаги распространяются по всему основанию стремени) и облитерирующая форма. R. Gristwood и J. Bedson (2008) также определяли 3 типа изменений ниши окна преддверия очагами отосклероза: лёгкие - в 47,2%, умеренные (сужение ниши 0,4-0,8 мм) - в 21,6% и тяжёлые (≤ 0,3 мм) - в 31,2%.
Согласно клиническим и морфо-гистохимическим исследованиям выделяют активные (незрелые, фиброзно-сосудистые) очаги, которые встречаются у 11-30% больных отосклерозом, умеренной активности - у 33,6% и неактивные (зрелые, склеротические) - у 36%. В первом случае очаги отосклероза называют еще «отоспонгиозными», а во втором - «отосклеротическими».
По данным компьютерной томографии (КТ) височных костей выделяют формы, в зависимости от распространения очагов отосклероза или отоспонгиоза: фенестральную, смешанную и кохлеарную. При кохлеарной форме - поражается костная капсула улитки, вследствие чего развивается тугоухость сенсоневрального характера.
Клиническая картина отосклероза.
Основными жалобами пациентов при всех формах отосклероза являются прогрессирующее, постепенное, «беспричинное» снижение слуха. Тугоухость при отосклерозе, как правило, двусторонняя, в 15-30% случаев определяется односторонний процесс. На течение заболевания и характер тугоухости влияет активность отосклеротических очагов. Так появление очагов в раннем возрасте вызывает быстрое прогрессирование тугоухости, чего не наблюдается в пожилом возрасте. При продолжительном заболевании (10-20 лет) в 2 раза уменьшается количество активных очагов. Период активности имеет различную продолжительность у разных пациентов, в зависимости от обменных и иммунобиологических функций организма.
Некоторые пациенты при тимпанальной или смешанной формах отосклероза с относительно хорошим уровнем слуха по КП, отмечают улучшение слуха в шумной обстановке («paracusis Wilisii»). Другим наиболее постоянным признаком отосклеротического поражения - это субъективное ощущение шума в одном или обоих ушах низко- и среднечастотного характера, крайне редко пациенты отмечают высокочастотный шум. Жалобы на головокружение и расстройство равновесия предъявляют лишь 24% пациентов. Объясняют данные вестибулярные расстройства внутрилабиринтной гипертензией.
При отомикроскопии обращает на себя внимание истончённая кожа слухового прохода и атрофичная (иногда в виде «пчелиных сот», симптом Лемперта) барабанная перепонка с чёткими опознавательными знаками. При активном отосклерозе иногда барабанная перепонка выглядит розовой (симптом Шварца), вследствие просвечивания сквозь истончённую барабанную перепонку активных отосклеротических очагов.
Диагностика отосклероза.

Рис 1. Активная форма отосклероза: плотность очагов +300 - +800 ед. Н.
При смешанных формах, выявленных по КТ височных костей, помимо фенестральной локализации очагов отоспонгиоза или отосклероза, определяются участки пониженной плотности капсулы лабиринта, окружающие улитку, распространяющиеся на область круглого окна, иногда до дна внутреннего слухового прохода (рис. 2). При смешанной форме распространения очагов отоспонгиоза или отосклероза, выявленных по КТ височных костей, по данным ТПА определяется смешанная форма тугоухости (1-2 ст.).

Рис. 2. Смешанная форма отосклероза (плотность очагов отоспонгиоза +300- +800 ед. Н).
При кохлеарном отосклерозе, в начальной его стадии в костной капсуле лабиринта, окружающей улитку, выявляются участки пониженной плотности +1500- +1100 ед. H. При умеренно выраженной активной стадии - в костной капсуле лабиринта, вокруг базального и апикального завитков улитки определяются хорошо видимые на томограммах участки пониженной плотности +1000- +600 ед. H, часто распространяющиеся на область круглого окна и могут достигать дна внутреннего слухового прохода и горизонтальных полукружных каналов (рис. 3).

Рис. 3. Кохлеарная форма отосклерза (плотоность очагов + 600 - +800 ед. Н).
На стадии далеко зашедшего кохлеарного отосклероза выявляется деминерализация костной капсулы ушного лабиринта на уровне базального и апикального витков улитки. Также изменения могут достигать преддверия и полукружных каналов. Плотность на этой стадии колеблется от +300 до +1200 ед. H. На этой стадии развития отосклероза могут определяться явления костной облитерации структур лабиринта. Наиболее часто явления облитерации по данным КТ височных костей выявляются в базальном завитке улитке и горизонтальном полукружном канале (табл. 1).
Таблица 1
Сводная таблица диагностики различных форм отосклероза
Лечение пациентов с различными формами отосклероза
С учётом современной диагностики различных форм отосклероза можно выделить основные варианты лечения пациентов с данной патологией.
Хирургическое лечение показано при выявлении тимпанальной и смешанных формах (1, 2 степень) отосклероза по данным ТПА, с фенестральным распространением очагов отосклероза по данным КТ височных костей и плотностью не менее +900-1000 ед. H.
Консервативная терапия - инактивирующее лечение проводится при кохлеарной форме отосклероза и при активной фазе отосклероза, выявленных на этапе обследования или интраоперационно.
Комбинированное лечение проводится пациентам, перед хирургическим лечением, с выявленными активной и смешанными формами отосклероза по данным КТ височных костей.
Слухопротезирование рекомендуется пациентам с высокими порогами КП (более 30 дБ) в том числе и после операции, при наличии единственно слышащего уха, при общих противопоказаниями для выполнения планового хирургического лечения и в случаях отказа пациента от операции.
Кохлеарная имплантация рекомендуется у больных кохлеарной формой отосклероза или высоких порогах слуха после стапедопластики с двусторонней тугоухостью 4-5 степени, при разборчивости простых односложных слов
Читайте также:
