Синдром средиземноморской лихорадки - синонимы, авторы, клиника
Добавил пользователь Валентин П. Обновлено: 21.01.2026
Семейная средиземноморская лихорадка (альтернативные названия: периодическая болезнь, армянская болезнь) - наследственное заболевание, распространенное преимущественно среди жителей средиземноморского бассейна (армян, евреев, арабов); проявляется периодически возникающими беспричинными приступами лихорадки и сильными болями в животе и/или в грудной клетке и сутавах в сочетании со значительным повышением уровня воспалительных острофазовых белков (СОЭ, СРБ) продолжительностью от 12 до 72 часов. Заболевание генетически обусловленное, наследуется по аутосомно-рецессивному типу (патологический ген подавлен доминантным и носитель дефектного гена может об этом не знать). Для развития болезни необходимо получить дефектный ген от обоих родителей.
В основе заболевания - мутация в гене MEFV. Известно более 70 мутаций гена. В норме ген MEFV отвечает за белок, обеспечивающий снижение воспалительного ответа путем торможения интерлейкина-1, вызывающего воспаление. Мутация гена приводит к нарушению работы белка, в результате чего не происходит физиологическое подавление интерлейкина-1, и возникают спонтанные эпизоды воспаления в брюшине, плевре и суставах, периодическая лихорадка до 40 градусов, постоянное субклиническое воспаление, а впоследствии - амилоидоз почек.
В исследовании оцениваются патогенные варианты во 2, 3, 5, 10 экзонах - наиболее часто встречающиеся в популяции.
Кому назначается исследование?
- При клинических признаках, подозрительных на средиземноморскую лихорадку
- При планировании деторождения
Как выполняется исследование?
Методом секвенирования по Сэнгеру
Как трактовать результат исследования?
Результат выдаётся в виде заключения с комментарием.
В норме патологических вариантов гена MEFV не обнаружено.
Поскольку средиземноморская лихорадка является аутосомно-рецессивным заболеванием, для развития заболевания необходимо наличие носительства 2-х патогенных мутаций на парных хромосомах: на одной паре - в гомозиготе; или на двух разных хромосомах (компаунд-гетерозиготность).
Результат исследования интерпретируется врачом. При отсутствии патологии гена MEFV в ряде случаев требуется исключение других генетических причин периодической лихорадки.
Можно сдавать кровь в течение дня, не ранее, чем через 3 часа после приема пищи или утром натощак. Чистую воду можно пить в обычном режиме.
Семейная средиземноморская лихорадка (периодическая болезнь): симптомы, диагностика, лечение
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Семейная средиземноморская лихорадка (Familial Mediterranean fever (FMF), периодическая болезнь) - это наследственное заболевание, характеризующееся рецидивирующими эпизодами лихорадки и перитонита, иногда с плевритом, кожными поражениями, артритом и очень редко перикардитом. Может развиться амилоидоз почек, который может вести к почечной недостаточности. Наиболее часто это заболевание встречается у потомков обитателей бассейна Средиземного моря. Диагноз во многом клинический, хотя доступно генетическое обследование. Лечение включает колхицин для профилактики острых атак, равно как и амилоидоза почек у большинства пациентов. Прогноз при лечении благоприятный.
Семейная средиземноморская лихорадка (ССЛ) - это заболевание, встречающееся у людей, происходящих от обитателей бассейна Средиземного моря, преимущественно евреев сефардов, североафриканских арабов, армян, турков, греков и итальянцев. В то же время случаи заболевания отмечаются также и в других группах (например, евреи ашкенази, кубинцы, бельгийцы), что предостерегает от исключения диагноза только на основании происхождения. Примерно у 50 % пациентов отмечается семейный анамнез заболевания, как правило, включая родных братьев и сестер.
Наиболее часто встречаемое из описываемых заболеваний, FMF поражает преимущественно национальности, проживающие в зоне средиземноморского бассейна (евреи-сефарды, турки, армяне, северные африканцы и арабы), хотя можно найти описание случаев периодической болезнью и у евреев-ашкенази, греков, русских, болгар, итальянцев. Частота встречаемости в зависимости от национальности - 1:1000 - 1:100000. У мужчин проявляется чаще, чем у женщин (1,8:1).
Причины периодической болезни
Семейная средиземноморская лихорадка вызывается мутациями гена MEFV, расположенного на коротком плече 16-й хромосомы, и наследуется по аутосомнорецессивному типу. Ген MEFV в норме кодирует белок (называемый пирин или маренострин), который экспрессируется циркулирующими нейтрофилами. Его предполагаемая функция состоит в том, чтобы снижать воспалительный ответ, вероятно, путем ингибирования активации и хемотаксиса нейтрофилов. Мутации гена приводят к синтезу дефектных молекул пирина; предполагают, что незначительные, неизвестные триггеры воспалительного ответа, которые в норме контролируются интактным пирином, не супрессируются, так как пирин дефектный. Клинические последствия включают спонтанные эпизоды преимущественно нейтрофильного воспаления в брюшной полости, а также в других местах.
Патогенез семейной средиземноморской лихорадки
Ген, дефект которого обуславливает данное заболевание, локализован на коротком плече 16 хромосомы (1бр13.3), обозначается как MEFV, экспрессируется преимущественно в гранулоцитах и кодирует протеин, называемый пирин (или маренострин). Ген состоит из 10 экзонов, регулирующих последовательность 781 аминокислотных остатков. Описано 26 мутаций, преимущественно в экзоне 10, а также в экзоне 2. Наиболее распространенная мутация -М694V (замена метиоина на валина> - встречается у 80% обследованных с периодической болезнью, ассоциирована тяжелым течением заболевания и высоким риском развития амилоидоза. Пирин относится к семейству транскрипционных факторов, определяется в цитоплазме миелоидных клеток. На основании различных исследований предполагается, что пирин играет негативную регуляторную роль в развитии воспалительного процесса.
Симптомы периодической болезни
Семейная средиземноморская лихорадка дебютирует, как правило, между 5 и 15 годами, однако может быть и значительно более позднее или раннее начало, даже в грудном возрасте. Атаки рецидивируют нерегулярно и варьируют у одного и того же пациента. Обычно длительность их составляет 24-72 часа, однако некоторые длятся неделю и более. Частота эпизодов варьирует от двух атак в неделю до одной атаки в год (наиболее часто одна атака каждые 2-6 недель). Тяжесть и частота атак имеют склонность к снижению во время беременности и при развитии амилоидоза. Спонтанные ремиссии могут длиться годами.
Основным проявлением является повышение температуры тела до 40 "С, обычно сопровождающееся симптомами перитонита. Боль в животе (как правило, начинающаяся в одном квадранте и распространяющаяся на весь живот) отмечается примерно у 95 % пациентов и может варьировать по тяжести от атаки к атаке. Снижение перистальтики, увеличение живота, напряжение мышц передней брюшной стенки и симптомы раздражения брюшины часто развиваются на пике атаки, и их невозможно отличить от перфорации внутреннего органа при физикальном обследовании.
Другие проявления включают острый плеврит (у 30 %); артрит (у 25 %), обычно с поражением коленного, локтевого и тазобедренного суставов; рожеподобную сыпь на нижней части ног; отек и болезненность мошонки, вызываемые воспалением оболочек яичка. Перикардит развивается очень редко. В то же время плевральные, синовиальные и кожные проявления семейной средиземноморской лихорадки варьируют по частоте среди различных популяций и наименее часто встречаются в США, чем где бы то ни было.
Наиболее серьезным осложнением семейной средиземноморской лихорадки является хроническая почечная недостаточность, вызванная отложением амилоида в почках. Отложения амилоида могут также обнаруживаться в ЖКТ, печени, селезенке, сердце, яичках и щитовидной железе.
Диагностика периодической болезни
Диагностика средиземноморской лихорадки во многом клиническая, однако сейчас доступны методы генной диагностики, которые особенно полезны при обследовании детей с атипичными клиническими проявлениями. Неспецифические признаки включают нейтрофильный лейкоцитоз, ускорение СОЭ, повышение уровня Среактивного белка и фибриногена. Суточная протеинурия выше 0,5 г/сут указывает на развитие амилоидоза почек. Дифференциальный диагноз проводят с острой интермиттирующей порфирией, наследственным ангионевротическим отеком с абдоминальными приступами, рецидивирующим панкреатитом и другими наследственными рецидивирующими лихорадками.
Какие анализы необходимы?
Лечение периодической болезни
Несмотря на тяжесть симптомов во время острых атак, у большинства пациентов они быстро исчезают, и пациенты чувствуют себя здоровыми до следующего эпизода. Широкое применение колхицина с профилактической целью привело к значительному снижению частоты развития амилоидоза и последующей почечной недостаточности.
Профилактическая доза колхицина составляет 0,6 мг внутрь 2 раза в день (некоторым пациентам необходим 4кратный прием колхицина, а часть пациентов может принимать его однократно). Эта доза обеспечивает полную ремиссию или отчетливое улучшение примерно у 85 % пациентов. Пациентам с редкими атаками, которые развиваются с предшествующим продромальным периодом, колхицин можно назначать лишь при развитии начальных симптомов, при этом доза составляет 0,6 мг внутрь каждый час в течение 4 часов, затем каждые 2 часа в течение 4 часов, затем каждые 12 часов в течение 48 часов. Как правило, назначение колхицина на пике атаки, даже при условии его внутривенного введения, оказывается неэффективным. Для достижения хорошего профилактического эффекта детям нередко требуются взрослые дозировки. Колхицин не повышает риск бесплодия и выкидышей у женщин с периодической средиземноморской лихорадкой, а также не повышает частоту врожденных пороков у плода при приеме матерью во время беременности.
Отсутствие эффекта при назначении колхицина часто связано с несоблюдением рекомендованного режима его приема или дозы, однако также отмечена корреляция между плохим ответом на терапию колхицином и низкой концентрацией колхицина в циркулирующих моноцитах. Еженедельное внутривенное введение колхицина может снизить частоту атак и их тяжесть у пациентов, не отвечающих на обычные схемы профилактической терапии колхицином. Альтернативами колхицину, которые, однако, не были еще исследованы, являются интерферон альфа по 3-10 млн единиц подкожно, празозин 3 мг внутрь 3 раза в день, а также талидомид.
Иногда для облегчения болевого синдрома необходимо назначение опиоидов, однако следует осторожно подходить к их назначению, чтобы не вызвать привыкания.
Диагностические критерии семейной средиземноморской лихорадки (периодической болезни)
Основные диагностические критерии
Дополнительные диагностические критерии
1 Периодически возникающие разлитой перитонит и/или плеврит (2-3 дня), сопровождающиеся выраженный болевым синдромом
2 Лихорадка, сопутствующая боли
4 Терапевтический эффект колхицина
5. Повторяющиеся приступы артрита
6. Эризипелоидная эритема
7. Начало заболевания в ранней детском возрасте или и период полового созревания
3. Национальная принадлежность
9. Отягощенный семейный анамнез
10. Неоправданные неоднократные оперативные вмешательства при абдоминальной или смешанной форме
11. Ремиссия во время беременности и возобновление приступов после родоразрешения
Семейная средиземноморская лихорадка (клинический случай).
Семейная средиземноморская лихорадка (ССЛ) - наследственное заболевание с аутосомно-рецессивным типом наследования, характеризуется спонтанными возвратными приступами лихорадки, асептическим воспалением серозных оболочек. Этиологическим фактором является мутация гена MEFV.
Цель: описать клинический случай ССЛ у ребенка 11 лет.
Материалы и методы: проведен анализ медицинской документации (ф.112, выписок из истории болезни) ребенка 11 лет с диагнозом ССЛ.
Результаты: Мальчик из семьи с неотягощенным анамнезом по ССЛ.
В кардиоревматологическое отделение ГБУЗ «ОДКБ» Оренбурга поступил пациент Т., 11 лет. Предъявлял жалобы боли и отёк голеностопных суставов, невозможность ходить из-за боли, на повышение температуры до фебрильных цифр (до 38,7), резкую общую слабость.
Дебют заболевания с 3 лет пациента беспокоят эпизоды лихорадки длительностью до 4 дней, сопровождающиеся болью в животе, суставными болями. Данные эпизоды возникали до 7 раз в год. Состояние при поступлении тяжелое, за счет лихорадки, полиартрита, абдоминального болевого синдрома.
В ходе исследования выявлены показатели крови, характерные для типичной атаки ССЛ (ускоренная СОЭ 48 мм/ч, лейкоцитоз 22*10^9/лс нейтрофильным сдвигом, увеличение СРБ более чем в 9 раз);кровь на волчаночный коагулянт (61,4), АТ к кардиолипину (IgG 27,IgM 44,4). По данным УЗИ суставов - выпот в левый локтевой сустав, локальное утолщение подкожно-жировой клетчатки в области правого голеностопного сустава за счет отека.
Кариотипированиене выявило генетических нарушений. Диагноз верифицирован в соответствии с турецкимипедиатрическимикритериями(Е.Yalcinkaya и соавт. 2009) так как отсутствие выявленных мутаций гена не исключает поставленный диагноз, чтовстречается в 10% случаев СЛ.
Диагноз: семейная средиземноморская лихорадка, период обострения. Получен отказ от лечения колхицином. На фоне гормоно- и цитостатической терапии положительная динамика: суставной синдром и лихорадка купировались. Особенностью клинического случая является: отсутствие мутаций в гене MEFV, низкая комплаентность (отказ от приема колхицина), чтов несколько раз повышает риск осложнений ССЛ, в том числе системного амилоидоза; с 2014 г. данное заболевание входит в перечень орфанных заболеваний и требует комплексного междисциплинарного подхода в тактике ведения.
Системная средиземноморская лихорадка

Системная средиземноморская лихорадка (ССЛ) (Familial Mediterranean Fever, FMF) — аутовоспалительное заболевание, характеризующееся периодически повторяющимися приступами лихорадки в сочетании с асептическим перитонитом, иногда плевритом, поражением кожи, артритом и редко перикардитом 1 .
Эпидемиология

Среди всех аутовоспалительных заболеваний для ССЛ в наибольшей степени характерна этническая предрасположенность. Наиболее подвержены заболеванию представители четырех этносов: евреи-сефарды (североафриканские, неашкеназские евреи), турки, арабы и армяне 1 . Знание этнической принадлежности пациента оказывает существенную помощь при установлении диагноза.
Но по мере изучения ССЛ стало понятно, что распространенность ССЛ не ограничивается указанными выше популяциями. Благодаря миграции населения в ХХ веке, заболевание распространилось по всему миру: США, Европа, Россия, Япония, Южная Америка и др 2 . Таким образом, заболевание было выявлено у представителей достаточно отдаленных этнических групп, что предостерегает от постановки диагноза исключительно на основе родословной.
Этиология и патогенез
Этиологическим фактором ССЛ выступает мутация гена MEFV, локализованного на коротком плече 16-й пары хромосом. Тип наследования — аутосомно-рецессивный, соответственно, если оба родителя являются здоровыми гетерозиготами, вероятность развития заболевания у их потомства составляет 25% (рис. 1). Вместе с тем имеются данные о возможности аутосомно-доминантного типа наследования при наличии мутации с высокой пенетрантностью 3 .
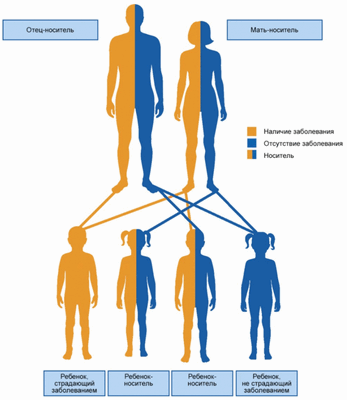
Рисунок 1. Аутосомно-рецессивный тип наследования
Мутации, ассоциированные с ССЛ, являются мутациями усиления функции, то есть они придают белку новую или повышенную активность с эффектом дозы аномального гена (т. е. увеличение количества копий аномального гена дает больший эффект). Ген MEFV в норме кодирует белок (так называемый пирин), который экспрессируется в циркулирующих нейтрофилах 4 .
Пирин представляет собой неотъемлемый структурный компонент врожденной иммунной системы и участвует в защитных реакциях от бактериальных токсинов, которые деполимеризуют актин и активируют инфламмасомы. Бактерии, которые производят подобные токсины, включают Clostridium difficile, Burkholderia cenocepacia, а также Vibrio cholerae 4 . Предполагается, что пирин притупляет воспалительный ответ, возможно, путем ингибирования хемотаксиса и активации нейтрофилов. Генные мутации приводят к появлению измененных молекул пирина, которые не ингибируют активацию инфламмасом.
Нарушение функции инфламмасом ведет к спонтанному запуску воспалительного каскада и гиперактивации системы врожденного иммунитета без видимой причины (в отсутствие инфекции или аутоиммунной реакции), основная патогенетическая роль в этом процессе принадлежит провоспалительному цитокину ИЛ-1β 4,5 .

Интерлейкин-1β активирует клетки врожденного иммунитета (нейтрофилы, моноциты; Т-лимфоциты; остеокласты), индуцирует экспрессию коллагеназ, разрушающих суставной хрящ, стимулирует выработку простагландина E2 в гипоталамусе, что приводит к развитию гипертермии центрального генеза. Воздействуя на эндотелий сосудов, ИЛ-1β способствует развитию сыпи и стимулирует атерогенез в кровеносных сосудах, а также активирует синтез острофазовых белков в печени 5 .
Клинические последствия гиперпродукции ИЛ-1β — спонтанные приступы системного воспаления с увеличением количества лейкоцитов за счет нейтрофилов и острофазовых показателей крови.
ССЛ дебютирует, как правило, до 20 лет. К основным типичным клиническим признакам заболевания относятся: лихорадка, абдоминальные проявления в виде острой боли в животе, артрит, плеврит, перикардит, сыпь на голенях и стопах, мышечные проявления и поражение мочеполовой системы 3,6 .
Клиническая картина
ССЛ характеризуется периодическими повторяющимися атаками системного воспаления продолжительностью 6-72 ч, проявляющегося фебрильной лихорадкой 38-40,5 °С и симптомами воспаления органов и систем 6,7 . Основные проявления заболевания представлены на рис. 2.
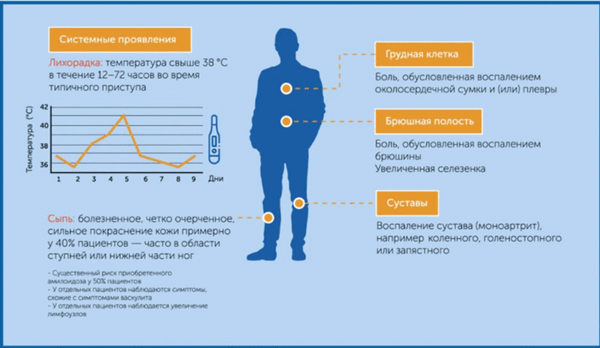
Рисунок 2. Клинические проявления ССЛ
Локализация процесса происходит преимущественно в четырех основных зонах 3 :
- Абдоминальная: с развитием асептического перитонита, проявляющегося выраженным болевым синдромом с картиной «острого живота».
- Торакальная: с развитием асептического плеврита, в большинстве случаев одностороннего.
- Суставная: с развитием артритов, главным образом суставов нижних конечностей.
- Кожная: основное проявление — рожеподобная эритема, как правило на голенях, над голеностопным суставом,
в котором имеются признаки артрита, и на тыльной поверхности стоп.
Частота атак ССЛ различна, что отражает ее тяжесть: от 1-2 раз в неделю до нескольких в год. Во время атаки возможны любые сочетания фебрильной лихорадки с проявлениями воспаления со стороны указанных систем. Редко атаки могут протекать в виде изолированной лихорадки. Практически всегда фебрильные атаки сопровождаются значительным повышением уровня острофазовых маркеров: СОЭ, СРБ, сывороточного амилоида А (SAA) 8,9 .
Значения острофазовых маркеров существенно снижаются вне атаки, но примерно у 63% пациентов сохраняется повышенный уровень того или иного острофазового показателя в промежутке между атаками. Ключевым и наиболее чувствительным маркером воспаления, в качестве оценки активности заболевания, эффективности лечения и риска развития амилоидоза, в настоящее время служит сывороточный а милоид А (SAA) 3,10 .
Существует три 11 варианта течения (фенотипа) ССЛ 12,13 :
- ССЛ I типа: протекает в виде типичных атак.
- ССЛ II типа: первым клиническим проявлением данного фенотипа является амилоидоз почек. До развития амилоидоза
у таких пациентов можно обнаружить только повышение уровня острофазовых маркеров. - ССЛ II типа: первым клиническим проявлением данного фенотипа является амилоидоз почек. До развития амилоидоза у таких пациентов можно обнаружить только повышение уровня острофазовых маркеров.
Осложнения
Амилоидоз почек — основное осложнение, которое определяет прогноз заболевания и приводит к развитию хронической почечной недостаточности. Хроническая почечная недостаточность вследствие амилоидоза - причина смерти 90% больных 14 с FMF 14 . Частота амилоидоза составляет 25-30% 1 и может зависеть от этнического происхождения пациента 15 . Так, у нелеченых пациентов турецкого происхождения частота амилоидоза достигает 60%, у евреев-сефардов — 75% 15 .
Факторы риска развития амилоидоза при ССЛ: мужской пол, наличие артрита, задержка диагноза, неадекватное лечение, а также семейный анамнез амилоидоза 14 .
Другим осложнением, имеющим существенно меньшее значение для прогноза заболевания, является спаечная болезнь.
Клиническими последствиями хронического воспаления при ССЛ могут быть нормоцитарно-нормохромная анемия, спленомегалия, задержка роста у детей, снижение плотности костей, мужское и женское бесплодие, преждевременные роды, повышенный риск сердечно-сосудистых заболеваний 11 .
Диагностика
Постановка диагноза ССЛ возможна на основании клинических данных, но для подтверждения диагноза важно провести молекулярно-генетическое исследование, которое особенно информативно при оценке атипичных случаев.
Генетическое тестирование используется для подтверждения, но не для исключения диагноза периодической болезни. Встречаются 5 основных патогенных мутаций гена MEFV: M694V, M694I, M680I, V726A, E148Q. Наибольшее число мутаций (до 38%) приходится на 10-й экзон. Мутации M694V приводят к более тяжелому течению заболевания с ранним началом, частому поражению суставов, высокому уровню амилоидоза при отсутствии лечения. Пациенты, гомозиготные по мутации M694V, в 6 раз чаще страдают амилоидозом по сравнению с другими генотипами. Мутации обнаруживаются также в экзонах 2, 3, 5 16,17,18 .
Следует иметь в виду, что у некоторых пациентов с очевидными фенотипическими признаками ССЛ выявляется только один мутантный ген, а иногда отсутствуют явные мутации в гене MEFV. Приблизительно у 10-20% пациентов, которые отвечают диагностическим критериям ССЛ, мутации в гене MEFV не выявляются, что предполагает наличие эпигенетических факторов и факторов внешней среды, способствующих патогенезу заболевания 19 . Неспецифические признаки включают: повышение уровня лейкоцитов с преобладанием нейтрофилов, СОЭ, С-реактивного белка и фибриногена. Экскреция с мочой > 0,5 г белка за сутки предполагает формирование амилоидоза почек 19 .
В диагностике ССЛ используют клинические диагностические критерии клиники Тель-Хашомер — это «золотой стандарт» (табл. 1) 20 .
Таблица 1. Диагностические критерии ССЛ клиники Тель-Хашомер 20
| Большие критерии | Типичные атаки: 1. Перитонит (генерализованный) 2. Плеврит (односторонний) или перикардит 3. Моноартрит (тазобедренного, коленного, голеностопного суставов) |
| Малые критерии | 1-3. Неполная атака с вовлечением ≥ 1 из нижеприведенных локализаций: 1. Живот 2. Грудная клетка 3. Сустав 4. Нагрузочная боль в ногах 5. Хороший ответ на терапию колхицином |
| Поддерживающие критерии | 1. Наличие случаев FMF в семейном анамнезе 2. Принадлежность к соответствующей этнической группе 3. Возраст начала заболевания — до 20 лет 4-7. Характеристика атаки: 4. Тяжелая, приковывающая к постели 5. Спонтанное разрешение атаки 6. Наличие бессимптомных промежутков 7. Повышение уровня лабораторных маркеров воспаления с возрастанием значений * ≥ 1 из следующих признаков: * количество лейкоцитов в клиническом анализе крови * СОЭ * сыворочный амилоид А и/или фибриноген 8. Эпизоды протеинурии/гематурии 9. Непродуктивная лапаротомия или удаление «белого» (без флегмонозного воспаления) аппендикса 10. Кровнородственный брак родителей |
Примечание.
Для постановки диагноза ССЛ необходимо соответствие ≥ 1 большим критериям, или ≥ 2 малым критериям, или 1 большому + ≥ 5 поддерживающим критериям, или 1 малому + ≥ 4 поддерживающим критериям из числа первых 5.
Лечение
Цель лечения ССЛ — достижение полного контроля над неспровоцированными приступами и минимизация субклинического воспаления в межприступный период 21 .
В настоящее время основное лечение ССЛ заключается в применении колхицина. Колхицин предотвращает атаки заболевания, снижает их частоту и тяжесть. Также важным фактором служит значительное уменьшение риска развития амилоидоза при применении адекватных доз препарата 22 .
Сегодня колхицин — единственный препарат, эффективность которого в отношении предотвращения амилоидоза доказана.
В соответствии с рекомендациями EULAR (2016) колхицин должен быть назначен сразу же после установления диагноза ССЛ (уровень доказательности А) 22 .
Колхицин эффективен у большинства, но далеко не у всех пациентов с ССЛ. У 20% пациентов с ССЛ на терапии колхицином
сохраняются воспалительные атаки и скрытое воспаление между приступами. Почему это происходит? Более 40% пациентов
не соблюдают рекомендации по лечению, 2-5% отмечают непереносимость и серьезные побочные эффекты терапии колхицином (тяжелая диарея, невропатия, рабдомиолиз и подавление активности костного мозга) 23 . Кроме того, существует понятие «колхицинрезистентности», когда пациент с ССЛ недостаточно отвечает на терапию максимально допустимой дозой колхицина. Колхицинрезистентность диагностируется при сохранении ≥ 1 атаки в месяц у комплаентных пациентов (получающих максимальную дозу колхицина ≥ 6 мес.) или при стойком повышении уровня СРБ/SАА в период между приступами 21,24,25 .
Доля пациентов с истинной колхицинрезистентностью достигает 15%. Таким пациентам показано назначение генно-инженерных биологических препаратов (ГИБП). Терапия ГИБП, блокирующими интерлейкин-1, — наиболее эффективный вариант патогенетического лечения пациентов с колхицинрезистентной ССЛ 21 . Выявление АА-амилоидоза требует интенсификации лечения с рассмотрением возможности биологической терапии вне зависимости от наличия
колхицинрезистентности у пациентов с ССЛ.
Одним из ингибиторов ИЛ-1 является канакинумаб — моноклональное антитело к ИЛ-1β. Канакинумаб селективно связывается с ИЛ-1β и полностью блокирует его действие. Препарат имеет длительный период полувыведения (26 дней), что делает возможным применять его при колхицинрезистентной ССЛ 1 раз в 4 недели в виде подкожных инъекций 2
Заключение
ССЛ является самым распространенным моногенным аутовоспалительным заболеванием и имеет отчетливую этническую предрасположенность. В России проживает немало представителей этнических групп (армяне, азербайджанцы, народы Северного Кавказа), в которых отмечается высокая распространенность мутации гена MEFV и, соответственно, ССЛ. Благодаря внедрению в клиническую практику молекулярной генетической диагностики выявляемость ССЛ увеличивается.
Тяжесть и прогноз заболевания определяются не только атаками системного воспаления, но и высоким риском развития вторичного АА-амилоидоза, который может привести к развитию хронической почечной недостаточности и гибели пациента. Патогенетическая лекарственная терапия ГИБП позволяет достичь значительного прогресса в ведении таких пациентов с улучшением прогноза, предотвращением развития жизнеугрожающих осложнений и улучшением качества жизни.
Средиземноморская (марсельская) лихорадка у детей
Что такое Средиземноморская (марсельская) лихорадка у детей -
Марсельская (известная также как средиземноморская) лихорадка — острое инфекционное заболевание, к которому приводят риккерии Rickettsia conorii, и которое имеет первичный аффект на месте укуса клеща, вызывает регионарный лимфоаденит, лихорадкой, пятнисто-папулезные высыпания.
Эпидемиология
Человек заражается от клещей при их укусе или при раздавливании данного насекомого, если после этого с помощью расчесывания он втирает риккетсии в поврежденную кожу и слизистые оболочки. Точно не известно, может ли заразиться человек от другого больного человека. Что касается ближайших очагов заболевания, они есть на Черноморском побережье Кавказа, в Крыму, на Апшеронском полуострове и в прибрежных районах Дагестана.
Что провоцирует / Причины Средиземноморской (марсельской) лихорадки у детей:
Rickettsia conorii, возбудитель болезни, был открыт в 1932 году. Инфекция хранится в организме некоторых видов собачьих клещей, ими же передается человеку, в т. ч. детям. Риккетсии в организме клещей хранятся на протяжении всей жизни, могут передаваться потомству через откладывание яиц.
Патогенез (что происходит?) во время Средиземноморской (марсельской) лихорадки у детей:
Через 2-3 часа на месте укуса появляется первичный аффект - участок воспаления, на котором позже происходит центральный некроз и изъязвление. Далее риккерсии из первичного очага через лимфу направляются к регионарным лимфатическим узлам. Часто в них возникает лимфоаденит - воспалительный процесс. Инфекция генерализируется, возбудитель средиземноморской лихорадки у детей проникает в эндотелий мелких сосудов. Это приводит к развитию специфического сосудистого гранулематоза (панваскулита).
Тяжесть заболевания у ребенка зависит от выраженности сосудистых изменений, что связано с риккетсиемией и токсемией. Под токсемией понимают заражение крови токсинами риккерсий. О значительном аллергическом компоненте свидетельствует обильная макулопапулезная сыпь, которая выглядит как множество розовых или фиолетовых бугорков, в центре каждого из которых имеется приподнятость небольшого размера. Места, пораженные макулопапулезной сыпью, обычно не зудят, не чешутся.
Симптомы Средиземноморской (марсельской) лихорадки у детей:
Наблюдается гиперемия лица (умеренная), это значит, что сосуды переполнены кровью, что приводит к красноватому оттенку кожи лица. То же касается сосудов склер и конъюнктив - они становятся инъецированными. В частых случаях бывает гиперемия слизистой оболочки ротоглотки, а также есть вероятность болей в горле. Язык больного ребенка обложен, налет имеет серый оттенок.
В течение всей болезни на коже сохраняется первичный аффект, представляющий собой воспалительный плотноватый инфильтрат с центральным некрозом, а затем струпом черного или коричневого цвета, окруженного зоной гиперемии диаметром до 5—7 мм. После прихода температуры в норму корочка отпадает, на ее месте образуется язвочка, которая покрывается эпителием на 3-4 неделе заболевания (в так называемом периоде реконвалесценции).
В зоне первичного аффекта возникает регионарный лимфаденит (воспаление, увеличение, болезненность лимфатических узлов). Лимфоузлы могут быть довольно крупного диаметра - до 5-10 см. При пальпации возникает болезненность. Если риккерсии проникают в организм ребенка через конъюнктиву, первичный аффект проявляется в виде конъюнктивита с хемозом (отеком конъюнктивы и линии века).
Важный симптом средиземноморской лихорадки у детей - сыпь. Она локализируется на 2-3-м дне заболевания на туловище, а позже распространяется по телу, локализируясь даже на лице, ладонях и стопах.
Изначально сыпь пятнистая, позже становится пятнисто-папулезной, в некоторых случаях превращаясь в красные прыщевидные образования. Пока у ребенка держится лихорадка, сыпь также есть на теле, а затем начинает постепенно угасать вместе со снижением температуры тела больного. Пигментация на месте высыпаний сохраняется на протяжении от 1 до 3 месяцев.
В разгар болезни в большинстве случаев появляется глухость сердечных тонов, относительная брадикардия. Часто увеличивается печень, а в более редких случаях - селезенка. При тяжелых случаях заболевания у детей отмечают бред, явления менингизма, тремор кистей рук и языка.
Анализ крови показывает лейкопению с относительным лимфоцитозом. СОЭ (скорость оседания эритроцитов) всегда незначительно повышена. Чаще всего случаются легкие и среднетяжелые формы, которые протекают благоприятно. Редко фиксируют тяжелые случаи марсельской лихорадки у детей. Болезнь иногда протекает атипично - сыпь не проявляется, нет первичного аффекта и регионарного лимфоаденита. Осложнения при данном заболевании встречаются редко, летальных случаев практически не бывает.
Диагностика Средиземноморской (марсельской) лихорадки у детей:
Диагностируют марсельскую лихорадку у детей с помощью выявления первичного аффекта, пятнисто-папулезной сыпи, лихорадки. А также врач должен быть оповещен о пребывании заболевшего ребенка в эндемическом очаге.
Используют лабораторную диагностику для подтверждения диагноза средиземноморской лихорадка у детей - РСК, РНГА с использованием цельного антигена R. conorii. Для выделения риккетсий из крови больных или клещей материал вводят внутрибрюшинно самцам морских свинок и при развитии у них периорхита подтверждают диагноз.
Марсельская лихорадка при постановке диагноза дифференцируется с менингококковой инфекцией, лекарственной аллергией, корью и другими риккетсиозами.
Лечение Средиземноморской (марсельской) лихорадки у детей:
Используют для лечения зтиотропную терапиию - левомицетин, тетрациклин и его аналоги в дозе, соответствующей возрасту, на протяжении лихорадочного периода и еще 2—3 дня после нормализации литературы. Врачи назначают противовоспалительные, антигистаминные и другие симптоматические средства.
Профилактика Средиземноморской (марсельской) лихорадки у детей:
Профилактические меры направлены на борьбу с клещами в эндемических очагах (обработка акарицидными препаратами собак, собачьих будок и других мест вероятного размножения клещей).
К каким докторам следует обращаться если у Вас Средиземноморская (марсельская) лихорадка у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Средиземноморской (марсельской) лихорадки у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Читайте также:
- Гемодинамика при дефекте межжелудочковой перегородки. Виды ДМЖП
- Размеры бронхов. Структура бронхиальной стенки
- Кровоснабжение женских половых органов. Кровоснабжение матки. Кровоснабжение яичников и маточных труб.
- ЭРХПГ, КТ, МРТ, УЗИ признаки водянки и эмпиемы желчного пузыря
- Синдром периодических движений конечностями во сне и синдром беспокойных ног
