Системная красная волчанка головного мозга на МРТ, ангиограмме
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Ревматические болезни относятся к группе заболеваний, которые характеризуются развитием аутоиммунных процессов против антигенов почти всех органов и тканей организма, что сочетается с образованием аутоантител с органонеспецифическими с
Ревматические болезни относятся к группе заболеваний, которые характеризуются развитием аутоиммунных процессов против антигенов почти всех органов и тканей организма, что сочетается с образованием аутоантител с органонеспецифическими свойствами.
Аутоиммунные процессы осуществляют информационный обмен между нейроэндокринной и иммунной системами, при этом главную роль играют аутоантитела к гормонам, медиаторам и их рецепторам. Продемонстрирован синтез нейропептидов в иммунокомпетентных клетках, а в клетках нейроэндокринной системы доказана возможность синтеза лимфокинов и монокинов.
Получены данные о нейрогенной регуляции функций иммунитета и их нарушений, в то же время иммунокомпетентные клетки и их медиаторы могут влиять на функцию центральной нервной системы (ЦНС) по принципу нейроиммуномодуляции. Показано, что свойством нейросекреции обладает вся центральная и периферическая нервная система. Влияние иммунной и нервной систем друг на друга реализуется через рецепторные структуры клеток, взаимодействие которых создает связи «рецептор-рецептор» и таким образом организует молекулярный механизм совместной работы обеих систем.
Функционирование клеток и сигнальная информация обеспечиваются медиаторами и нейротрансмиттерами в обеих системах, между нервной и иммунной системой происходит взаимообмен информацией с помощью цитокинов, стероидов и нейропептидов [1, 2].
Таким образом, доказана общность и взаимосвязь нервной и иммунной систем, сходство между их структурами и функциями и развитие нового направления современной иммунологии — нейроиммунологии [3, 4]. Широкий диапазон неврологических синдромов при аутоиммунных системных заболеваниях позволяет рассматривать их как модельные системы для изучения патогенетической роли иммунных механизмов поражения центральной и периферической нервной системы [5].
Потенциальными мишенями для аутоиммунной агрессии могут быть различные антигены нервной ткани, включая миелин, в том числе ассоциированный с гликопротеином, и его основной белок, ганглиозиды, белок ядер нейрональных клеток и другие [6]. Так, мишеневидные антигены при нейролюпусе представлены антигенами нейрональной ткани, рибосомальным Р-белком, рДНК, малым ядерным рибонуклеопротеидом, а также анионными фосфолипидами при антифосфолипидном синдроме, что обуславливает широкий спектр неврологической симптоматики при данной патологии [7, 8].
По данным различных авторов, частота поражений нервной системы при ревматических заболеваниях (РЗ) колеблется от 40% до 70% и выше, если учитывать психические синдромы и головную боль. Неврологические синдромы включены в классификационные критерии системных васкулитов, опубликованные Американской коллегией ревматологии в 1990 году, в диагностические критерии и критерии активности системной красной волчанки (СКВ), а также в ряд других диагностических критериев, в частности узелкового полиартериита у детей. Неврологические нарушения при РЗ требуют проведения дифференциальной диагностики и назначения адекватного лечения совместно ревматологом и неврологом.
При СКВ в диагностические критерии неврологических поражений включены судороги или психозы. Поражение ЦНС обусловлено в основном сосудистой патологией, к которой относят васкулопатию, тромбозы, истинные васкулиты, инфаркты и геморрагии [7]. В цереброспинальной жидкости обнаруживаются антинейрональные антитела, определяется повышение уровня белка, увеличение клеточного состава. Описаны разные виды судорожных припадков: большие, малые, по типу височной эпилепсии, а также гиперкинезы. При ЦНС-люпусе имеет место головная боль типа мигрени, устойчивая к анальгетикам, но отвечающая на лечение глюкокортикостероидами. Параличи черепных нервов обычно сопровождаются офтальмоплегией, мозжечковыми и пирамидными симптомами и нистагмом. Имеют место зрительные нарушения, преходящие нарушения мозгового кровообращения. Острый поперечный миелит встречается редко и имеет неблагоприятный прогноз. Психические синдромы разнообразны и характеризуются аффективными, органическими мозговыми или шизофреноподобными проявлениями [9, 10].
В рамках СКВ был описан и антифосфолипидный синдром. Этот синдром включает: рецидивирующие артериальные или венозные тромбозы, привычное невынашивание беременности и тромбоцитопению и дополнительные признаки: сетчатое ливедо, неврологические проявления: хорею, эпилепсию, мигренеподобную головную боль, нарушения мозгового кровообращения и деменцию вследствие множественных инфарктов, хронические язвы голеней, Кумбс-положительную гемолитическую анемию, клапанные поражения сердца и серологические маркеры — антифосфолипидные антитела, к которым относятся антикардиолипиновые антитела IgG и IgM и волчаночный антикоагулянт [11].
При системной склеродермии (ССД) неврологический синдром представлен в основном полиневритическими проявлениями, связанными с сосудистыми изменениями и фиброзными процессами в соединительной ткани. Для узелкового полиартериита характерны множественные мононевриты, для гранулематоза Вегенера — асимметричная полинейропатия, для неспецифического аортоартериита — дисциркуляторная энцефалопатия и нарушения мозгового кровообращения.
Собственные данные включали обследование 229 больных различными формами РЗ, среди которых 110 больных страдали системными заболеваниями соединительной ткани: 88 больных СКВ, 22 — ССД и 119 больных — системными васкулитами: облитерирующий тромбангиит (ОТ) — 21, узелковый полиартериит (УП) — 27, неспецифический аортоартериит — (НАА) — 32, геморрагический васкулит (ГВ) — 15 и гранулематоз Вегенера (ГрВ) — 2, другие формы — 22. Проведено детальное неврологическое исследование, ультразвуковая транскраниальная допплерография сосудов мозга, реоэнцефалография, компьютерная (КТ) и магнитно-резонансная томография (МРТ) головного мозга, электроэнцефалография, исследование иммунного статуса.
У большинства больных заболевания дебютировали кожным (50,6%), суставно-мышечным (35,4%) и сосудистым (27,1%) синдромом. Органные поражения в дебюте регистрировались с частотой 7%, синдром артериальной гипертензии — у 5,2%, лихорадка — у 7,0%, гематологические нарушения — 7,9%. Неврологические расстройства в дебюте заболевания отмечены у 12,2% и проявлялись моно- и полиневропатией и синдромом энцефаломиелополирадикулоневрита (ЭМПРН). Поражение периферической нервной системы в дебюте заболевания было особенно характерно для УП и наблюдалось у 30% больных. Основными синдромами дебюта со стороны ЦНС был цефалгический (10,5%) и вестибулярный (6,3%), чаще они наблюдались при НАА. Вовлечение ЦНС имело место у 96 (41,9%) больных, являясь наиболее выраженным при СКВ, НАА, УП.
Цереброваскулярная патология была доминирующей в клинической картине болезни у 34,7% больных, а иногда разнообразные симптомы поражения ЦНС развивались задолго до появления полисиндромной картины заболевания. Основные клинические проявления цереброваскулярной патологии включали: цефалгический (82%), астенический (76%), вестибулярно-атактический (80%), пирамидный (74%) синдромы, синдром вегетативно-сосудистой недостаточности (69%), диссомнический (79%) и базально-оболочечный (37%), гипопоталамической дисфункции (34,7%).
Описанная неврологическая симптоматика часто сочеталась с симптомами сосудистой недостаточности головного мозга, которые объединялись синдромом дисциркуляторной энцефалопатии 1 (11%), 2 (26,4%) или 3 (8%) степени. У 7,8% больных имели место преходящие нарушения мозгового кровообращения.
Гипоталамическая дисфункция у больных РЗ проявлялась полиморфными нейроэндокринными расстройствами, нарушением терморегуляции, преимущественно по типу пароксизмальной центральной гипертермии, инсомнией, патологией психоэмоциональной сферы.
Установлено достоверное преобладание у больных пирамидной недостаточности слева (41%). Преобладание пирамидной недостаточности справа регистрировалось реже (23,7%). Дистонические феномены в форме вестибулярно-мозжечковой установки кисти и диссоциированная мышечная гипотония в ногах также были более выражены слева. Полученные данные свидетельствуют о преобладающем поражении пирамидной и сенсорной систем, а также неспецифических структур правого полушария, которое тесно связано с гипоталамической областью и обеспечивает адаптацию организма к воздействующим факторам внешней среды. Обнаруженная функциональная асимметрия свидетельствует о срыве адаптационных механизмов нервной системы и указывает на роль дисфункции правополушарно-гипоталамической системы.
При использовании методов МРТ и/или КТ было выявлено изменение желудочковой системы в виде ее расширения или деформации и/или расширения субарахноидального пространства, а также очаговые поражения различных структур головного мозга, атрофия вещества мозга и краниовертебральные аномалии. Признаки наружной, внутренней или сочетанной гидроцефалии отмечались при всех нозологических формах. Очаговые изменения вещества мозга включали гиперденситивные зоны, гиподенситивные зоны с отеком или без него, единичные или множественные.
При исследовании сосудистой системы и мозгового кровообращения достоверно наблюдалось повышение тонуса сосудов, гипертонический и дисциркуляторный тип кровообращения по данным реоэнцефалографии (РЭГ) и увеличение линейной скорости кровотока по средней мозговой артерии. Больные с вовлечением ЦНС отличались по электроэнцефалографии: им были свойственны диффузные патологические изменения, наличие дезорганизации альфа-ритма, дизритмий и пароксизмальной активности.
Корреляционный анализ цереброваскулярной патологии и результатов инструментальных исследований сосудов головного мозга показал, что при всех нозологических формах у пациентов имело место нарушение венозной гемоциркуляции. В последующем происходило сужение церебральных артерий, ликвородинамические нарушения с формированием внутричерепной гипертензии, нарушением системы микроциркуляции в головном мозге. Очаговые поражения головного мозга отличались локализацией процесса в зависимости от нозологической формы. В табл. представлены основные неврологические проявления РЗ.
У 39% больных СКВ молодого возраста с поражением ЦНС имели место нарушения мозгового кровообращения, причем у половины из них инсульт развился в начале заболевания. Одновременно с инсультом в дебюте СКВ у больных чаще выявлялась «сосудистая бабочка» и/или вазоспастический синдром, повышение артериального давления, чаще диастолического. У этих больных отмечались умеренные или высокие титры кардиолипинов IgG, антител к нативной ДНК и ревматоидного фактора (РФ) IgM, что могло свидетельствовать о наличии текущего церебрального васкулита. Эти данные подтверждались выявлением гипертонуса резистивных интракраниальных сосудов и патологией микроциркуляторного русла в виде увеличения количества функционирующих капилляров, их выраженной извитостью с замедлением кровотока в артериолах. Изменения в свертывающей системе характеризовались синдромом гиперкоагуляции. Выявлены основные факторы риска развития инсульта у больных РЗ: артериальная гипертензия, поражения сердца, гиперкоагуляция, иммунное воспаление сосудистой стенки, асимметрия мозгового кровотока.
Среди больных РЗ цереброваскулиты (ЦВ) имели место у 28,3% больных. Диагноз ЦВ ставился при обнаружении очаговой неврологической симптоматики, изменений на глазном дне, снижения зрения, наличии признаков нарушения мозгового кровообращения, а также по результатам КТ и ядерно-магнитно-резонансной томографии (ЯМРТ), при которых выявлялись наружная и внутренняя гидроцефалия, очаговые изменения в коре и субкортикальном веществе. При этом с течением времени число очагов любой локализации в головном мозге нарастало. При магнитно-резонансном ангиографическом (МРА) исследовании отмечались множественные сегментарные неровности сосудистой стенки, циркулярные или эксцентричные стенозы и дилятация мелких и средних интракраниальных артерий с формированием аневризм, нарушения кровотока. Выявленное снижение интенсивности МРА-сигнала на фоне повышения активности ревматического процесса свидетельствовало о наличии ЦВ.
Иммунологическими маркерами ЦВ считали антитела к нативной ДНК, IgG-антитела к кардиолипину (аКЛ) и IgM аКЛ, антинейтрофильные цитоплазматические антитела (АНЦА), в меньшей степени — РФ и волчаночный антикоагулянт (ВА). Имели место клинико-иммунологические корреляции с неврологическими проявлениями.
Изолированный (первичный) ЦВ характеризовался обнаружением симптомов вовлечения ЦНС и такими признаками, как головная боль, судороги, менингеальный синдром, острая прогрессирующая энцефалопатия без признаков экстракраниального или системного васкулита, психические синдромы, деменция, прогрессирующее снижение интеллекта, инсульты, нарушения зрения, нистагм. Чаще перивентрикулярные очаги выявлялись в первый год заболевания.
Ряд больных обращались на консультацию к окулисту в связи с ухудшением зрения, вплоть до амавроза, наличием увеита, ишемического неврита. Ангиопатия сетчатки имела место у 41% этих больных, флебопатия — у 14%, ретиноваскулит — у 6%, ангиоспазм — у 13%, ангиосклероз — у 18%.
Полиневритический синдром встречался у подавляющего большинства больных (96,7%) в виде сенсорной, чувствительно-двигательной полиневропатии или в сочетании с поражениями ЦНС, с синдромом ЭПН и ЭМПРН. При ССД, ОТ и ГВ преобладали формы в виде чувствительной или чувствительно-двигательной полиневропатии, а при СКВ и НАА — формы с сочетанным поражением периферической НС (ПНС) и ЦНС — синдромы ЭПН и ЭМПРН. При ОТ и НАА отмечалась отчетливая диссоциация степени выраженности полиневропатии по оси тела, причем при ОТ симптоматика была более отчетливой в ногах, при НАА — в руках. В целом асимметричная полиневропатия имела место у 19,2% больных, достигая максимума при УП (59,3%).
Патология НС при РЗ нередко определяет прогноз, клиническую картину заболевания и качество жизни больных, а также требует обязательного сочетанного применения базисной противовоспалительной терапии, ангио- и нейропротекторов. К группе нейропротекторов относят Актовегин, Инстенон. Используются препараты, улучшающие мозговое кровообращение, — Винпоцетин, Кавинтон, метаболические средства с антигипоксантным действием — Ноотропил, Пирацетам, Церебролизин, по показаниям седативные и противосудорожные средства, антидепрессанты.
При РЗ терапия включает глюкокортикостероиды, иммуносупрессанты, иммуноглобулин, плазмаферез, иммуномодуляторы, дезагреганты, нестероидные противовоспалительные препараты и симптоматические средства.
Лечение состоит из нескольких этапов: быстрое подавление иммунного ответа в дебюте заболевания и при его обострениях (индукция ремиссии); длительная поддерживающая терапия иммуносупрессантами, в дозах, достаточных для достижения клинической и лабораторной ремиссии заболевания; определение степени повреждения органов или систем организма и их коррекция, проведение последующих реабилитационных мероприятий.
Первый этап включает эффективное подавление иммунного воспаления на ранних стадиях болезни и предполагает использование глюкокортикостероидов, иммуносупрессантов цитостатического действия типа Циклофосфана и антиметаболитного действия типа Метотрексата, цитокинсупрессивного препарата Циклоспорина А, внутривенного иммуноглобулина, назначение повторных курсов пульс-терапии метилпреднизолоном и Циклофосфаном, в сочетании с экстракорпоральными методами лечения.
При острых церебральных нарушениях при высокой активности СКВ используется схема пульс-терапии с введением Метипреда 1 г внутривенно 1 раз в день в течение 3 дней и с добавлением 800 мг Циклофосфана во 2-й день. При хроническом течении СКВ суточная доза преднизолона составляла 15-20 мг с последующим постепенным снижением, Циклофосфан применяется внутримышечно в дозе 400 мг в неделю до 1600-2000 мг на курс, затем по 200 мг в неделю в течение года и более. Апробируются препараты мофетила микофенолат и лефлуномид.
При патологии органа зрения назначают нестероидные противовоспалительные препараты в виде инъекций диклофенака, а затем пероральные препараты этой группы, дезагреганты, при наличии признаков воспалительной активности добавляют умеренные дозы глюкокортикостероидов, а при резком снижении зрения и выраженных признаках активности используют пульс-терапию.
Проводится определение наиболее эффективных и менее токсичных схем применения иммуносупрессивных препаратов, путей их введения, и включение в комплексное лечение больных препаратов, улучшающих микроциркуляцию и/или влияющих на реологические свойства крови (Гепарин, Фраксипарин, Трентал, Ралофект, Тиклид).
В ряде случаев назначают препараты типа Реаферона, а при наличии инфицированных язв, некрозов кожи или конечностей применяют антибиотики. Ввиду многообразия нозологических форм на выбор лекарственных средств в дебюте заболевания оказывает влияние распространенность патологического процесса и наличие интеркуррентной инфекции. Показано назначение ангиопротекторов и посиндромная терапия.
Учитывая высокий удельный вес неврологической патологии, больные РЗ должны проходить комплексное клинико-инструментальное неврологическое исследование уже на ранней стадии патологического процесса. Постановка диагноза РЗ и комплексная терапия глюкокортикостероидами и иммуносупрессантами способствуют коррекции нарушений ЦНС и ПНС.
Литература
Stenberg E. M. Neuroendocrine regulation of autoimmune / inflammatory diseases // J. Endocrinol. 2001; 169 (3): 429-435.
Насонова В. А., Иванова М. М., Калашникова Е. А. и др. Актуальные проблемы нейроиммунологии // Вестн. РАМН. 1994;1: 4-7.
Сrofford L. J. The hypothalamic-pituitary-adrenal axis in the pathogenesis of rheumatic diseases // Endocrinol. Metab. Clin. North. Am. 2002; 31 (1): 1-13.
Мотовилов А. А., Травина И. В., Проказова Н. В. и др. Антитела к нейтральным гликосфинголипидам и ганглиозидам у больных системной красной волчанкой с поражением центральной нервной системы // Клин. ревматол. 1995; 1: 36-38.
Иванова М. М. ЦНС-люпус: проблемы и достижения (результаты 10-летнего клинико-инструментального исследования) // Тер. арх. 2001; 5: 25-29.
Лисицина Т. А., Вельтищев Д. Ю., Серавина О. Ф. и др. Варианты психических нарушений у больных системной красной волчанкой // Научно-практ. ревматол. 2008; 4: 21-27.
Nived O., Sturfelt G., Liang M. H., De Pablo P. The ACR nomenclature for CNS lupus revisited // Lupus. 2003; 12: 872-876.
Н. П. Шилкина, доктор медицинских наук, профессор Н. Н. Спирин, доктор медицинских наук, профессор И. В. Дряженкова, кандидат медицинских наук ЯГМА, НУЗ «ДКБ на станции Ярославль «ОАО «РЖД», Ярославль
Системная красная волчанка головного мозга на МРТ, ангиограмме
Кафедра неврологии и нейрохирургии Иркутской государственной медицинской академии последипломного образования;
Клиническая больница №1, Иркутск
Иркутский государственный институт усовершенствования врачей
Сосудистая патология головного мозга у больных системной красной волчанкой женщин
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(3): 4‑8
Файзулина Д.Л., Шпрах В.В. Сосудистая патология головного мозга у больных системной красной волчанкой женщин. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013;113(3):4‑8.
Faĭzulina DL, Shprakh VV. Cerebrovascular disease in women with systemic lupus erythematosus. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(3):4‑8. (In Russ.).
Представлен анализ частоты факторов риска и структуры цереброваскулярной патологии (ЦВП) у больных системной красной волчанкой (СКВ) женщин. Обследованы 143 женщины (средний возраст - 36,7±12,7 года) с достоверной СКВ; в 46,3% случаев была выявлена острая либо хроническая ЦВП. Установлено, что у больных СКВ женщин в структуре ЦВП преобладали хронические формы (46,8%). Острые церебральные ишемии встречались в 21,7% случаев. В структуре хронической ЦВП преобладала дисциркуляторная энцефалопатия (ДЭ) I стадии (68,2%). Из основных факторов риска наиболее значимыми оказались гиподинамия (76,9%), ожирение (72%) и дислипидемия (66,4%). Кроме того, показана взаимосвязь структуры ЦВП со специфическими факторами риска (длительность, течение, активность СКВ). Представлены оригинальные способы математического прогнозирования развития ДЭ у больных СКВ женщин, не имеющих клинических проявлений цереброваскулярной патологии, предложена тактика диспансеризации в зависимости от результатов прогнозирования, приводится примерный перечень профилактических мероприятий, основанных на использовании систем индивидуального прогнозирования.
Нарушения мозгового кровообращения - одна из ведущих причин смертности и инвалидизации в РФ. По данным Национального регистра инсульта, ⅓ пациентов, перенесших инсульт, нуждаются в постоянной повседневной помощи, тогда как лишь 20% выживших больных способны вернуться к трудовой деятельности [11]. Еще более распространена хроническая цереброваскулярная патология [7], которая в отечественной литературе традиционно трактуется как дисциркуляторная энцефалопатия (ДЭ), или ишемическая болезнь головного мозга.
Высокая частота развития цереброваскулярных заболеваний (ЦВЗ) является следствием определенного типа поведения - нездоровое питание, низкий уровень физической активности, употребление табака и злоупотребление алкоголем - приводящего к ожирению, артериальной гипертензии, нарушениям липидного и углеводного обмена. И хотя эти заболевания можно предупредить, в настоящее время национальная превентивная политика требует совершенствования [7, 11].
Бремя, которое ложится на экономику страны и систему здравоохранения в связи с высокой частотой ЦВЗ, требует поиска эффективных стратегий снижения заболеваемости, смертности и инвалидизации от сосудистых заболеваний, совершенствования системы оказания медицинской помощи этим больным [7, 11].
Среди основных этиопатогенетических концепций цереброваскулярной патологии (ЦВП) выделяют традиционные факторы риска (нездоровое питание, низкий уровень физической активности, употребление табака и злоупотребление алкоголем) и некоторые ассоциированные с ними нозологические формы (артериальная гипертензия, атеросклероз, сахарный диабет, ишемическая болезнь сердца, облитерирующий атеросклероз артерий нижних конечностей). Кроме того, следует отметить высокую частоту развития ЦВП у больных с неинфекционными васкулопатиями и васкулитами на фоне аутоиммунных заболеваний. Наиболее приемлемой и удобной моделью для изучения таковых является системная красная волчанка (СКВ) [9, 12].
Актуальность изучения неинфекционных поражений сосудов обусловлена увеличением частоты аутоиммунных заболеваний, преимущественно у лиц молодого трудоспособного возраста, а также ранней инвалидизацией таких больных [1, 3, 5].
СКВ - распространенное хроническое заболевание преимущественно молодых женщин, развивающееся на фоне генетически обусловленного нарушения иммунорегуляторных механизмов и характеризующееся ранней инвалидизацией и высокой летальностью [3, 9].
Причинами поражения ЦНС при СКВ являются васкулопатия (приблизительно 65%), иммунокомплексный васкулит (10-15%), а также тромбозы мозговых сосудов (до 15%) и кровоизлияние в головной мозг [2, 3, 9, 10]. ЦВП при СКВ представлена острыми и хроническими формами нарушений мозгового кровообращения.
Особенностью ЦВП при СКВ является наличие стандартных (артериальная гипертензия, дислипидемия, избыточная масса тела, курение, дисметаболический синдром и др.) и специфических (иммунные комплексы, длительность, активность заболевания, тромбоцитопения, анемия, уровень СРБ, антифосфолипидный синдром, кумулятивная доза глюкокортикоидов и др.) факторов риска, что усложняет систематизацию и разработку тактики ведения таких пациентов [3-6, 8].
Цель исследования - изучение структуры ЦВП, ее традиционных и нетрадиционных факторов риска у больных СКВ женщин и разработка способа прогнозирования развития ДЭ у пациенток, не имеющих клинических проявлений ЦВП.
Материал и методы
Обследованы 143 женщины (средний возраст 36,7±12,7 года) с достоверным диагнозом СКВ, находившиеся на лечении в Иркутском городском ревматологическом центре.
В исследование включали больных с отсутствием в анамнезе указаний на перенесенные травмы головного мозга, заболевания ЦНС и периферической нервной системы (ПНС), не ассоциированные с СКВ. Все больные подписали протокол добровольного информированного согласия на участие в исследовании.
Распределение больных по возрасту проводилось в соответствии с классификацией возрастных категорий, принятой ВОЗ. Больных молодого возраста (
Больных с острым течением СКВ было выявлено 15 (10,5%), подострым - 53 (37,1%), хроническим - 75 (52,4%). С 1-й степенью активности оказалось 41 (28,7%), со 2-й - 84 (58,7%), с 3-й - 18 (12,6%) пациенток. По длительности заболевания: до 10 лет было 86 (60,1%), от 10 до 20 лет - 35 (24,5%), от 20 до 30 лет - 11 (7,7%), от 30 до 40 лет - 6 (4,2%), от 40 лет и старше - 5 (3,5%) пациенток. Средняя длительность заболевания составила 11,7±11,5 лет.
Объективная оценка состояния больного предусматривала комплексное клинико-неврологическое обследование, исследование соматического статуса с привлечением ревматолога, выполнение лабораторных анализов (уровни СРБ, комплемента сыворотки крови, фибриногена плазмы крови, АТ к н-ДНК, АТ к фосфолипидам, исследование липидного спектра крови) и проведение дополнительных методов исследования (офтальмоскопия, спондилография шейного отдела, электронейромиография, дуплексное сканирование брахиоцефальных сосудов, магнитно-резонансная спектроскопия и МРТ головного мозга).
Диагноз устанавливали в соответствии с критериями Американской ревматологической ассоциации [14]: наличие четырех критериев из одиннадцати соответствовали диагнозу СКВ. Диагноз антифосфолипидного синдрома (АФС) устанавливали согласно международным диагностическим критериям [13].
Важным этапом в исследовании было выявление факторов риска ЦВП у больных СКВ женщин.
Статистическую обработку материала осуществляли общепринятыми методами с использованием пакета BIOSTAT, Statistica 6.1. Результаты представлены в виде среднего значения и стандартного отклонения. Оценку статистической значимости различий проводили с помощью критериев Стьюдента и Манна-Уитни. Критический уровень значимости при проверке статистических гипотез - р=0,05. С помощью программы Statistica 6.1 проводили дискриминантный анализ, определяли прогностическую ценность факторов риска у больных СКВ женщин и выводили линейные дискриминантные уравнения для прогнозирования развития ДЭ у больных СКВ женщин без клинических проявлений ЦВП.
Результаты и обсуждение
Предрасполагающие факторы развития СКВ удалось выявить у 83 (58,0%) женщин, у 60 (42,0%) - предполагаемых (провоцирующих) факторов развития СКВ выявлено не было. Основными предрасполагающими факторами оказались стрессовые ситуации (28,9%), вирусная инфекция (30,1%), беременность и/или роды (18,1%), инсоляция (18,1%) и сочетание этих факторов (4,8%).
Основной синдром дебюта заболевания удалось уточнить у 89 (62,2%) пациенток. Наиболее часто встречались кожный (32,9%) и суставной (51,7%) синдромы или их сочетание (33,3%). Кроме того, были представлены дебюты: акушерский (13%), сосудистый (3,4%), нефролюпус (5,6%), эпилепсия (7,4%), ОНМК (3,7%) и др.
Для пациенток с СКВ характерен полиморфизм клинических проявлений, все многообразие которых можно объединить в несколько ведущих синдромов (табл. 1).
Патология нервной системы была выявлена у 110 (76,9%) женщин. При анализе ее структуры было показано преобладание цефалгического (69,2%), астеновегетативного (46,9%), вестибулоатактического (46,2%) синдромов и когнитивных нарушений (32,2%). Кроме того, встречались мигрень (29,4%), эпилепсия (10,5%), полинейропатия (18,9%), синдром паркинсонизма (8,4%).
Среди 143 женщин с СКВ цереброваскулярная патология (острая и хроническая) была обнаружена у 69 (46,3%).
Частота острых нарушений мозгового кровообращения (ОНМК) у женщин с СКВ составила 21,7% (31 пациентка), из них в 48,4% (15) случаев наблюдались транзиторные ишемические атаки (ТИА), в 51,6% (16 пациенток) - ишемические инсульты (ИИ). ТИА в 73,3% случаев отмечались в вертебрально-базилярном бассейне (ВББ) и в 26,7% - в каротидном бассейне (КБ), ИИ встречались чаще в КБ (68,7%), реже в ВББ (31,3%). Структура ОНМК в зависимости от возраста представлена на рис. 1. Рисунок 1. Структура ОНМК (ТИА и ИИ) в зависимости от возраста (в %).
У 5 (3,5%) женщин, больных СКВ, за 3-летний период наблюдения развились повторные ОНМК: ТИА - у 3 пациенток, ИИ - у 2.
Хроническая ЦВП диагностирована у 67 (46,8%) женщин, из них начальные проявления недостаточности мозгового кровообращения (НПНМК) были выявлены у 23 (34,3%) пациенток, ДЭ - у 44 (65,7%). Распределение ДЭ по стадиям оказалось следующим: больных с I cтадией было 30 (68,2%), со II - 12 (27,3%), с III - 2 (4,5%). При анализе в зависимости от возраста было показано преобладание НПНМК (78,3%) у молодых пациенток, а у лиц среднего и пожилого возраста - дисциркуляторной энцефалопатии (63,6%). При этом энцефалопатия I стадии достоверно чаще встречалась у молодых больных (87,5%), а у старших возрастных групп нарастала доля ДЭ II и III стадий.
При анализе стандартных факторов риска развития ЦВП у больных СКВ женщин наиболее частым оказалась гиподинамия (76,9% больных), что подтверждает и исследование M. Petri и соавт. [17], по данным которого гиподинамия имелась у 70% пациенток. Это, как правило, связано с широко распространенным среди больных СКВ ощущением слабости и поражением суставов. Избыточная масса тела, по данным M. Urowitz и соавт. [18], является одним из трех «классических» факторов риска (гиподинамия, дислипидемия, избыточная масса тела), которые выявляются более чем у ½ больных СКВ. В нашей работе она стала второй по частоте встречаемости и составила 72% (больных с I степенью ожирения - 68,9%, со II - 28,2% и с III - 2,9%). На третьем месте была дислипидемия, встречавшаяся у 66,4%. По данным других авторов, дислипидемия - весьма частое лабораторное нарушение, выявляемое при СКВ. Так, в работах F. Formiga и соавт. [15] те или иные нарушения липидного обмена выявлялись более чем у 50% пациенток с СКВ, а у сходных по полу и возрасту лиц без СКВ - только у 30%. АГ разной степени и стадии была выявлена у 28,1% пациенток (больных с I cтадией АГ - 12,5%, со II - 20%, с III - 67,5%). Курение отмечено у 18,9%. АФС был выявлен у 16,1%, а тромбозы различных локализаций - у 12,6% больных. Заболевания сердца были диагностированы у 10,5% больных, из них мерцательная аритмия - у 3 (26,7%). Частота поражений брахиоцефальных артерий (БЦА) по данным разных исследователей различна. Так, по данным S. Jimenes и соавт. [16], поражения БЦА отсутствовали в группе контроля и у больных СКВ моложе 35 лет, в возрасте 35-45 лет выявлялись у 33,3% больных против 5% в группе контроля, старше 45 лет - у 48 и 33,3% соответственно. По нашим данным, патология БЦА встречалась у 35,1% больных СКВ женщин, из них стенозирующие поражения - у 1,9%. Сахарный диабет встречался у 2,1% пациенток.
Изучая некоторые специфические факторы риска у больных СКВ женщин, имеющих ЦВП (тяжесть течения, активность и длительность СКВ), найдены следующие закономерности. При хроническом течении СКВ частота ТИА и ИИ значительно выше (73,3 и 62,5% соответственно), чем при остром и подостром течениях заболевания. Достоверно чаще ОНМК встречаются у больных со II степенью активности заболевания (ТИА в 60%, ИИ в 56,2% случаев). Частота ОНМК (ТИА и ИИ) нарастает прямо пропорционально длительности заболевания (рис. 2). Рисунок 2. Частота ОНМК (ТИА и ИИ) в зависимости от длительности заболевания. Таким образом, дальнейшее изучение факторов риска у больных СКВ, имеющих ЦВП, позволит более надежно разрабатывать систему лечебно-профилактических мероприятий.
Важным этапом нашего исследования стала разработка оригинального способа прогнозирования течения ДЭ у больных системной красной волчанкой женщин, не имеющих клинических проявлений ЦВП. Использование данного способа имеет важное практическое значение, позволяя не только прогнозировать ДЭ, но и планировать тактику ведения больных СКВ.
Способ прогнозирования ДЭ у больных СКВ женщин, не имеющих клинических проявлений ЦВП, включает клиническое обследование больных и отличается от существующих тем, что дополнительно определяются факторы риска и рассчитываются прогностические коэффициенты F 1 и F 2 по формулам, выведенным на основании дискриминантного анализа факторов риска, а также клинических и параклинических характеристик больных СКВ. При значении прогностических коэффициентов F 1 ≥F 2 прогнозируют развитие ДЭ в течение 5 ближайших лет.
После проведения дискриминантного анализа был предложен следующий набор ФР для прогнозирования развития ДЭ у больных СКВ женщин без ЦВП (табл. 2).
Дискриминантные уравнения для прогнозирования развития ДЭ у женщин, больных СКВ:
F 2 =-8,00-2,228·a 1 +0,870·а 2 -22,206·а 3 -21,177·а 4 -37,799·а 5 -27,251·а 6 -35,965·а 7 -26,644·а 8 -29,765·а 9 -7,329·а 10 ,
где а 1, 2…10 - градации ФР (см. табл. 2).
Для решения задачи прогнозирования развития ДЭ у конкретной больной СКВ нужно определить величину градаций каждого ФР СКВ, затем в дискриминантных уравнениях F 1 и F 2 суммировать константу дискриминантного уравнения и произведения величин градаций ФР СКВ на их дискриминантные коэффициенты. В результате получим две оценочные функции: F 1 и F 2 соответственно для больных СКВ без ЦВП и ДЭ. Прогностическое значение принимается по функции с большим значением. Если F 1 >F 2 , то больной СКВ угрожает развитие ДЭ, при F 1 < F 2 больная не попадает в группу риска.
Степень риска развития ДЭ оценивается с помощью прогностического индекса (ПИ), рассчитываемого по формуле:
где е - основание натурального логарифма (2,72), а F 1 >F 2 .
Оценку эффективности предлагаемого способа прогнозирования проводили в контрольных выборках больных СКВ женщин, страдающих ДЭ. Дисциркуляторная энцефалопатия была правильно предсказана у 63 из 67 больных, т.е. точность прогнозирования развития ДЭ составила 85,8%.
Предлагаемая тактика проведения диагностических и профилактических мероприятий у больных СКВ женщин без клинических проявлений ЦВП определяется в зависимости от степени риска развития у них ДЭ (табл. 3).
Таким образом, практически у половины (46,3%) больных СКВ женщин имела место ЦВП. Хроническая ЦВП была выявлена в 46,8% случаев, острая - в 21,7% случаев. Острая ЦВП представлена ТИА в 48,4% случаев и ИИ в 51,6%. В структуре ХЦВП преобладает (68,2%) дисциркуляторная энцефалопатия I стадии. Важными факторами риска развития ЦВП оказались не только традиционные, но и специфические, характерные только для больных СКВ, что необходимо учитывать при прогнозировании развития ЦВП и определении тактики ведения таких больных. Внедрение оригинальных систем прогнозирования позволит выделять среди пациентов с СКВ лиц, которым в ближайшие 5 лет угрожает развитие сосудистого заболевания головного мозга, и выбирать для них оптимальные индивидуальные комплексы профилактических мероприятий.
МРТ головного мозга при системной красной волчанке
Системная красная волчанка (СКВ) относится к аутоимммунным васкулитам, около 7% пациентов имеют поражение головного мозга. Патологические изменения проявляются в виде периваскулярного воспаления и пролиферации эндотелиальных клеток. 90% СКВ наблюдается у женщин и начинается с детского возраста. Заболевание затрагивает праактически все органы и системы. Диагноз ставится на основании клинических проявлений и лабораторных исследований (антитела в крови). Критерии сформулированы Американским Колледжем Ревматологов.
При МРТ головного мозга выявляются очаги, гиперинтенсивные на Т2-взвешенных МРТ, диффузная атрофия, венозные тромбозы, инсульты и кровоизлияния. МРТ головного мозга типа ДВИ показывает изменения только у 10-15% пациентов. Надо отметить, что МР-ангиография, как правило,не показывает изменений в крупных сосудах. Очень редко отмечаются стенозы в ветвях сосудов Виллизиева круга, приводящие даже к территориальным инфарктам. Однако МР-венография нередко показывает тромбоз пораженного синуса, как проявление антифосфодипидного синдрома.
При МРТ в СПб мы проводим дифференциальную диагностику, в первую очередь, с рассеянным склерозом. В отличие от демиелинизаций при СКВ на МРТ головного мозга нет характерного расположения очагов, напротив, имеются корковые очаги и ОНМК. При МРТ головного мозга наиболее затруднительна дифференциальная диагностика с лакунарными инфарктами, которые также могут быть проявлением поражения пенетрирующих сосудов при СКВ.
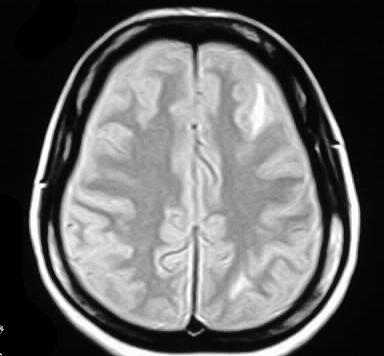
МРТ головного мозга. Т2-взвешенная аксиальная МРТ. Корково-подкорковые очаги при системной красной волчанке.
Очаги при МРТ головного мозга одинаково хорошо визуализируются в высоких полях и открытых МРТ.
КТ или МРТ ангиография сосудов головного мозга - что лучше
КТ (компьютерная томография) и МРТ (магнитно-резонансная томография) сосудов головного мозга применяются для диагностики патологий сосудистой сети головы и шеи. Альтернативное название этого исследования - МР или КТ-ангиография головного мозга. Что лучше выбрать - МРТ или КТ сосудов головного мозга? Ответ на это вопрос мы постараемся дать в этой статье.
Что такое МРТ и КТ сосудов головного мозга
Понятие КТ или МР-ангиография часто используется в медицинской литературе и практике как собирательный термин для любого обследования сосудов с помощью томографа. В МРТ центрах МР-ангиографией принято называть магнитно-резонансное исследование артерий, альтернативное название МР- артериография или МРТ сосудов головного мозга. Это обследование не включает сканирование вен головы. Для этого проводится отдельное исследование - МР-венография. Отличие МР-ангиографии от МР-венографии заключается в диагностическом фокусе и программном обеспечении. МРА визуализирует артериальную сосудистую систему, а МР-венография (МРВ) показывает венозное русло.
Такое же деление наблюдается в компьютерной томографии. В диагностических центрах Вам могут сделать КТ ангиографию - она же КТ сосудов головного мозга или КТ обследование вен - КТ венографию. КТ сосудов головного мозга чаще всего совмещаются с КТ сосудов шеи.

Отличия МРТ и КТ ангиографии от классической ангиографии
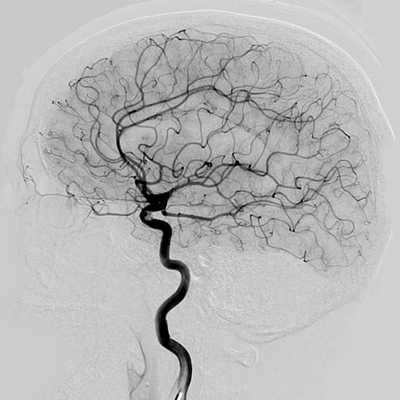
МРТ и КТ ангиографию не следует путать с прямой ангиографией. Классическая ангиография - это технологически простой метод исследования. Он появился в 1927 году, когда португальский невролог доктор Мониц провел первое ангиографическое исследование с введением контрастного вещества. Долгое время этот метод оставался золотым стандартом обследования сосудов головы, сердца, позвоночника, шеи, нижних конечностей и брюшной аорты. Основным недостатком данного вида ангиографии является необходимость сделать механический прокол сосудов (сонной или бедренной артерии), чтобы ввести контрастное вещество и обследующее устройство. Прямая АГ- это, в конечном счете, инвазивная манипуляция, требующая госпитализации и имеющая определенный риск осложнений. Кроме того, классическая ангиография дает возможность делать ангиограммы только в прямой или боковой проекции.
У прямой агиографии есть и диагностические ограничения. С ее помощью врач может достаточно подробно рассмотреть сами сосудистые аномалии (стеноз, окклюзии), но по ней нельзя получить информацию о мальформациях артерий, тромбозах вен, характере кровоизлияния при инсульте, состоянии вещества головного мозга. Для этого потребуется КТ или МРТ сосудов головного мозга.
| Классическая ангиография | КТ ангиография | МР ангиография |
 |
В чем разница между МР или КТ агиографией мозга
Принцип получения изображения - это основное принципиальное отличие МРТ и КТ сосудов головного мозга. При компьютерной агиографии используется рентген-лучи. Во время сканирования они проходят сквозь зону обследования под различными углами, а датчики аппарата оценивают скорость прохождения Х-лучей сквозь ткани различной плотности.
Компьютерная томография сосудов головного мозга и шеи требует обязательного применения контрастного вещества на базе йода. Без него томограммы будут носить малоинформативный характер. Введение контраста обычно осуществляется посредством катетера, устанавливаемого в районе локтевого сгиба. Процесс контрастирования не сложен, и может быть выполнен в амбулаторных условиях. Однако контрастирование йодосодержащим препаратом имеет свои риски. При попадании в организм йод оказывает нефротоксическое воздействие, поэтому за несколько дней до проведения КТ с контрастом пациентам с хронической почечной недостаточностью нужно сдать анализы крови на креатинин, позволяющие определить функциональность почек
КТ сосудов головного мозга с контрастированием имеет ряд недостатков - стоимость этого обследования велика, а беременным женщинам и детям ее не назначают из-за риска навредить детскому организму. Стоимость КТ ангиографии почти в два раза выше МРТ сосудов головного мозга поскольку всегда включает дополнительную цену контраста.



Работа МРТ основывается на эффекте ядерно-магнитного резонанса, при котором атомы водорода в клетках организма начинают колебательные движения, находясь под воздействием магнитного поля и радиочастотных импульсов. Этот резонанс улавливает томограф и транслирует в трехмерные изображения сосудистой сети. Поскольку кровь содержит много воды и является хорошим парамагнетиком, контрастирования для МР-агиографии в большинстве случаев не требуется.
МР-ангиография головного мозга обычно занимает в среднем 15-20 минут. Если необходимо введение контраста, продолжительность исследования доходит до 40 минут, поскольку врачу нужно по сути провести два сканирования: пре-контрастное и контрастное, а потом сравнить результаты. КТ сосудов головного мозга с контрастированием занимает 20-30 минут.
Биопсия и УЗИ при системной красной волчанке - что покажет

Анализ кожно-мышечный лоскут и биопсия, УЗИ брюшной полости являются аппаратными методами диагностики системной красной волчанки. Исходя из первичных симптомов, истории болезни, противопоказаний и диагностических целей, врач ревматолог назначает необходимые способы обследования. В большинстве случаев, анализ кожно-мышечный лоскут и биопсия выбираются как первичные методы диагностики. Если результаты исследования носят тревожный или неясный характер, дополнительно назначается УЗИ брюшной полости.
Волчанка - это аутоиммунное заболевание, которое возникает, когда иммунная система организма атакует собственные ткани и органы. Воспаление, вызванное волчанкой, может поражать множество различных систем организма, включая суставы, кожу, почки, клетки крови, мозг, сердце и легкие. Системную красную волчанку бывает трудно диагностировать, поскольку ее симптомы часто имитируют признаки других заболеваний. Самый характерный симптом волчанки - сыпь на лице, напоминающая крылья бабочки, распластанные по обеим щекам. Некоторые пациенты рождаются со склонностью к развитию СКВ, которая может быть спровоцирована инфекциями, некоторыми лекарствами или даже солнечным светом. Лекарства от системной красной волчанке не существует, но лечение может помочь контролировать симптомы.
Симптомы системной красной волчанке
Нет 2-х одинаковых случаев системной красной волчанке. Признаки могут появляться внезапно или развиваться медленно, быть легкими или тяжелыми, временными или постоянными. У большинства больных болезнь протекает в легкой форме и характеризуется эпизодами, называемыми вспышками, когда симптомы ухудшаются на некоторое время, затем улучшаются или даже полностью исчезают на некоторое время. Признаки волчанки зависят от того, какие системы организма поражены болезнью. Наиболее распространенные симптомы включают:
- усталость
- лихорадка
- боль, скованность и опухание суставов
- сыпь на лице в форме бабочки, покрывающая щеки и переносицу, или сыпь на других участках тела
- поражения кожи, которые появляются или ухудшаются после пребывания на солнце
- пальцы рук и ног становятся белыми или синими под воздействием холода или во время стресса
- одышка
- боль в груди
- сухость в глазах
- головные боли, спутанность сознания и потеря памяти.
Обратитесь к терапевту, если появилась необъяснимая сыпь, постоянная лихорадка, постоянная боль или усталость.
Причины системной красной волчанке
СКВ возникает в результате сочетания генетики и окружающей среды. У пациентов с наследственной предрасположенностью к волчанке болезнь может развиться, когда они вступают в контакт с чем-то в окружающей среде, что может вызвать заболевание. Однако причина волчанки в большинстве случаев неизвестна. Некоторые потенциальные провоцирующие факторы включают:
- солнечный свет. Воздействие солнца может вызвать поражение кожи волчанкой или вызвать внутреннюю реакцию
- инфекции. Наличие инфекции вызывает волчанку или рецидив у некоторых больных
- лекарства. Волчанка может быть спровоцирована некоторыми видами лекарств от давления, противосудорожными препаратами и антибиотиками. Пациентам, у которых волчанка вызвана лекарствами, обычно становится лучше, когда они прекращают их принимать. В редких случаях симптомы могут сохраняться даже после прекращения приема препаратов
УЗИ и Биопсия в диагностике системной красной волчанке - что покажет
Диагностика системной красной волчанке затруднена, поскольку симптомы значительно различаются у пациентов. Признаки могут меняться со временем и совпадать с симптомами многих других заболеваний. Ни одно исследование не может диагностировать волчанку. Сочетание анализов крови и мочи, признаков, а также результатов физического обследования позволяет поставить диагноз.
Лабораторные исследования в диагностике системной красной волчанке
Анализы крови и мочи могут включать в себя:
- полный анализ крови. Измеряет количество эритроцитов, лейкоцитов и тромбоцитов, а также количество гемоглобина - белка, содержащегося в эритроцитах. Результаты могут указывать на наличие анемии, которая часто встречается при волчанке. Низкий уровень лейкоцитов или тромбоцитов также может встречаться при волчанке
- скорость оседания эритроцитов. Этот анализ крови определяет скорость, с которой эритроциты оседают на дно пробирки в течение 1 часа. Высокая скорость указывает на системное заболевание, например волчанку. Скорость оседания не специфична для какого-то одного заболевания. Он может быть повышен, если есть волчанка, инфекция, другое воспалительное заболевание или рак
- оценка состояния почек и печени. Анализ крови позволяет оценить, насколько хорошо функционируют почки и печень. Волчанка может влиять на эти органы
- анализ мочи. Анализ образца мочи показывает повышенный уровень белка или эритроцитов в моче, что может произойти, если волчанка поразила почки
- исследование на антинуклеарные антитела (АНА). Положительный результат на наличие этих антител, вырабатываемых иммунной системой, указывает на стимулированную иммунную систему. При положительном результате на АНА, врач может посоветовать более специфический анализ на антитела
Ультразвуковое исследования в диагностике системной красной волчанке
Если иммунолог подозревает, что волчанка поражает легкие или сердце, он может предложить:
- рентген грудной клетки. На снимке грудной клетки могут быть обнаружены аномальные тени, свидетельствующие о наличии жидкости или воспаления в легких
- УЗИ сердца. При этом исследовании врач использует звуковые волны для получения изображения бьющегося сердца в реальном времени. Оно позволяет выявить проблемы с клапанами и другими частями сердца
- УЗИ брюшной полости
Биопсия в диагностике системной красной волчанке
Волчанка может по-разному повреждать почки, и лечение может быть различным, в зависимости от типа повреждения. В некоторых случаях необходимо исследовать небольшой образец ткани почки, чтобы определить наилучшее лечение. Образец может быть получен с помощью иглы или через небольшой разрез.Биопсия кожи иногда проводится для подтверждения диагноза волчанки, поражающей кожу.
Читайте также:
