Системная красная волчанка. Лекарственные средства для лечения остеопороза
Добавил пользователь Morpheus Обновлено: 21.01.2026
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Однако далеко не во всех случаях классическая ПТ позволяет быстро и надежно решать сложнейшие вопросы лечения в критических ситуациях и прогностически неблагоприятных вариантах течения СКВ. В настоящее время достаточно четко выявляется особая группа риска. В эту группу в первую очередь включаются пациенты с развитием СКВ в подростковом возрасте, быстропрогрессирующим волчаночным нефритом с диффузным поражением клубочкового аппарата и «полулуниями», стойкой артериальной гипертензией и азотемией, быстрым развитием нефротического синдрома в молодом возрасте, церебропатией с судорожным синдромом и комой, поперечным миелитом, геморрагическим пневмонитом, тромбоцитопенией, генерализованным поражением кожи и слизистых оболочек с развитием некрозов, сопровождающихся криоглобулинемией, гипокомплементемией и высоким уровнем антиядерных антител. Огромное значение в оценке жизненного прогноза у этой группы пациентов имеет своевременное назначение патогенетической терапии.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Изолированное применение ПФ при СКВ в большинстве случаев существенно ограничено развитием так называемого синдрома рикошета, возникающего непосредственно после удаления достаточно большого объема плазмы. Резкое повышение уровня аутоантител в ближайшие дни после процедуры — «рикошет» — связывается со стимуляцией лимфоцитов, продуцирующих аутоантитела по принципу обратной связи. Обычно лабораторный «рикошет» сопровождается обострением клинической картины, что в целом производит впечатление терапевтической неудачи. Логичными представляются два выхода из этой ситуации. Первый — сокращение времени между процедурами и проведение длительных серий ПФ в течение нескольких месяцев или даже лет. Второй, по-видимому, более рациональный и эффективный способ достижения стойкого клинического эффекта при назначении ПФ у больных СКВ — комбинирование экстракорпоральных методов и пульс-терапии МП и ЦФ в синхронном режиме.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Волчанка и остеопороз
Медикаменты, боль и скованность суставов способствуют потере кальция костной тканью и повышению риска подверженности переломам у людей, которые болеют волчанкой. Исследования показывают, что само заболевание повышает риск развития остеопороза. Читайте больше.
Что такое волчанка?
Волчанка является аутоиммунным заболеванием, когда организм нападает на свои собственные здоровые клетки и ткани. В результате, различные части тела - суставы, кожа, почки, сердце, лёгкие - могут воспалиться и повредиться. Существует множество разных видов волчанки. Системная красная волчанка (эритематозная) является формой заболевания, которое обычно и называется волчанкой.
Люди, страдающие волчанкой, имеют множество симптомов. Наиболее распространенными являются утомляемость, боль или опухание суставов, лихорадка, сыпь на коже и проблемы с почками. Обычно эти симптомы проявляются и исчезают. Когда симптомы проявляются, у больного человека, это называется обострением. Когда симптомы пропадают, говорят, что болезнь перешла в стадию ремиссии.
Согласно данным Национального Института артрита, скелетно-мышечных и кожных заболеваний при Национальном Институте Здравоохранения, 90 % людей с диагностированной волчанкой, являются женщинами. Болезнь в три раза чаще поражает афроамериканок, по сравнению с женщинами европеоидной расы. Латиноамериканки, уроженки Азии и коренные американки также подвержены повышенному риску. Волчанка обычно проявляется в возрасте между 15 и 45 годами. К сожалению, лекарства не существует.
Что такое остеопороз?
При остеопорозе кости теряют плотность и более подвержены переломам. Переломы, вследствие заболевания остеопорозом, могут привести к сильным болям и инвалидности. Остеопороз угрожает здоровью, как показали исследования, 44 миллионам американцев, 68 % которых являются женщинами:
Факторы риска развития остеопороза включают:
постклимактерический период или наступление преждевременной менопаузы у женщин или отсутствие месячных (аменорея)
Остеопороз является бессимптомным заболеванием, которое часто можно предотвратить. Но если его не выявить, он может прогрессировать на протяжении многих лет без проявления симптомов, до того момента, пока не случится перелом.
Связь между волчанкой и остеопорозом
Исследования показали, что при системной красной волчанке происходит повышенная потеря костной массы. На самом деле, женщины, которые больны волчанкой, почти в пять раз больше подвержены переломам, возникающим вследствие заболевания остеопорозом.
Люди, страдающие волчанкой, подвержены повышенному риску заболевания остеопорозом вследствие многих причин. Во-первых, медикаменты глюкокортикоиды, которые часто предписываются при лечении системной красной волчанки, могут стать причиной значительной потери костной массы. Кроме того, боли и утомляемость из-за болезни могут привести к пассивности, способствуя повышению риска заболевания остеопорозом. Исследования также показали, что потеря костной массы вследствие заболевания волчанкой, может стать непосредственным результатом заболевания. Тревожащим является тот факт, что 90 % людей, страдающих волчанкой, являются женщинами, группой, которая уже подвержена повышенному риску заболевания остеопорозом.
Стратегии управления процессом заболевания остеопорозом
Стратегии профилактики и лечения остеопороза, у людей страдающих волчанкой, не сильно отличаются от тех, которым должны следовать люди, не страдающие данным заболеванием.
Питание: Рацион питания, обогащенный кальцием и витамином D, очень важен для здоровья костей. Источники кальция включают молочные продукты с низким содержанием жира; тёмно-зелёные листовые овощи; обогащенные кальцием продукты питания и напитки. Также, для восполнения требуемой ежедневной нормы кальция можно принимать пищевые добавки.
Витамин D играет важную роль в усвоении кальция и для здоровья костей. Он синтезируется кожей под воздействием солнечного света. В то время как многие люди могут получать достаточное количество витамина D естественным путём и/или из витаминизированных продуктов питания, другие принимают пищевые добавки с содержанием витамина D, для восполнения требуемой ежедневной дозы.
Физическая активность: Как и мышцы, кости состоят их живой ткани, которая реагирует на физические нагрузки, укрепляясь. Весовые нагрузки, при которых вы преодолеваете силу притяжения, являются наилучшим способом тренировки костной ткани. Некоторые примеры: ходьба, подъём по лестнице, танцы и подъём тяжестей.
Системная красная волчанка. Лекарственные средства для лечения остеопороза
И.В. Меньшикова
Кафедра госпитальной терапии № 1 лечебного факультета ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва
Проблема остепороза (ОП) сохраняет свою актуальность на протяжении десятилетий из-за его широкой распространенности среди населения и роста числа остеопоротических переломов. Ревматические заболевания (РЗ) и применяемые в их лечении глюкокортикостероиды (ГКС) остаются одной из самых частых причин развития вторичного ОП, который в свою очередь осложняет течение РЗ. Анализируются механизмы развития вторичного и ГКС-индуцированного ОП. Приводятся международные и российские рекомендации по профилактике и лечению этого заболевания. Обращается особое внимание на современные препараты для лечения ОП.
Остеопороз (ОП) - хроническое системное метаболическое заболевание скелета, которое характеризуется прогрессирующим уменьшением костной массы и ухудшением качества кости, что приводит к снижению ее прочности и возрастанию риска переломов. По определению Всемирной организации здравоохранения (ВОЗ), ОП диагностируется при снижении минеральной плотности кости на 2,5 и более стандартных отклонений от пиковой костной массы (Т-критерий), по данным двухэнергетической рентгеновской абсобрциометрии (DEXA)[1].
Об актуальности проблемы ОП свидетельствует его широкое распространение: более 75 млн человек в Европе, США и Японии страдают ОП. По данным ВОЗ [2], ежегодно в мире по причине ОП происходит 8,9 млн переломов костей, а к 2025 г. ожидается их двукратное увеличение.
ОП классифицируется как первичный 1-го типа (постменопаузальный), первичный 2-го типа (сенильный), ювенильный, идиопатический и вторичный. Вторичный ОП может возникать в любом возрасте вследствие самых разных по этиологии заболеваний и одинаково часто поражает женщин и мужчин. По некоторым данным, вторичный ОП составляет 60 % случаев ОП у мужчин, 50 % - у женщин в пременопаузе и 20 % - у женщин в постменопаузе. За последние годы выполнен ряд мета-анализов, систематических обзоров и крупных проспективных когортных исследований по оценке влияния различных заболеваний на риск развития остеопоротических переломов. Среди них оценивались некоторые ревматические заболевания (РЗ): уровень доказательности А имеет, в частности, ревматоидный артрит (РА), а уровень доказательности С - такие заболевания, как системная красная волчанка (СКВ) и анкилозирующий спондилоартрит (АС) [3]. Среди причин вторичного ОП значительное место занимают лекарственные средства, в т.ч. и применяемые в ревматологии, например циклоспорин А, циклофосфамид и метотрексат. Самой частой причиной вторичного ОП (30-50 %) остается лечение глюкортикостероидами (ГКС), которое временно или постоянно получают 0,5-0,9 % населения [4].
Костная ткань представляет собой сложную, динамически изменяющуюся структуру, в которой существует определенный баланс между процессами формирования и резорбции, составляющими цикл ремоделирования кости. Этот цикл длится 90-130 дней. Резорбция остеокластами на протяжении 3 недель предшествует образованию новой кости остеобластами в течение последующих 3-4 месяцев. К важным стимуляторам остеокластогенеза относятся макрофагальный колониестимулирующий фактор (М-КСФ) и лиганд рецепторного активатора ядерного фактора κB (RANKL). Остеопротегерин (ОПГ), секретируемый остеобластами и стромальными клетками, блокирует взаимодействие RANKL с его рецептором RANK, действуя как физиологический регулятор костной резорбции. При воспалительных РЗ наиболее ярко видна роль иммунных факторов в развитии ОП.
Многие цитокины, 1,25-дигидроксивитамин D3, эстрогены, андрогены и другие молекулы влияют на продукцию RANKL и ОПГ:
- продукция RANKL снижается под действием интерлейкина (ИЛ)-1β, ИЛ-6 и фактора некроза опухоли α (ФНО-α);
- витамин D3 повышает продукцию RANKL;
- паратгормон и глюкокортикоиды повышают продукцию RANKL и угнетают продукцию ОПГ;
- эстрогены и фактор роста опухоли повышают продукцию ОПГ;
- интерферон-γ ингибирует индуцированный RANKL остеокластогенез;
- липополисахарид повышает продукцию ОПГ в фибробластах десны;
- ИЛ-7 стимулирует потерю костной массы через продукцию RANKL T-клетками;
- АТФ снижает экспрессию RANKL человеческими остеобластами;
- активированные Т-клетки продуцируют RANKL;
- лептин стимулирует RANKL [5, 6].
При РЗ, таких как РА, СКВ и АС, на возрастание риска развития ОП и переломов влияют активность болезни, ограничение подвижности и лекарственные средства. Резорбция костной ткани повышается при воспалении под влиянием таких цитокинов, как ФНО-α и ИЛ, RANKL/ОПГ и ДКК (белок Диккопфа) [7].
Механизмы развития вторичного ОП наиболее хорошо изучены при РА. Предполагают, что патогенез как периартикулярного, так и генерализованого ОП при этом заболевании и костных эрозий имеет общий механизм. Эта гипотеза подтверждается обнаружением центральной роли остеокластов, стимулированных дисбалансом в системе RANKL/RANK/ОПГ, во всех этих процессах [8]. Данные клинических исследований показали, что исходное соотношение RANKL : ОПГ у больных ранним нелеченым РА служит независимым предиктором прогрессирования повреждения суставов через 5 лет болезни [6]. Средняя частота генерализованного ОП у больных длительно текущим РА колеблется в пределах 7-26 % для шейки бедра и 19-32 % для позвоночника.
Среди общих факторов риска развития ОП при РА важную роль играют пожилой возраст, менопауза, низкая масса тела, низкая физическая активность, коррелирующая со степенью нарушения функции суставов. Непосредственно с заболеванием связаны в первую очередь активность воспалительного процесса, длительность болезни, тяжесть функциональных нарушений и прием ГКС [9]. Считается, что при длительном течении РА частота развития переломов как позвонков, так и других локализаций возрастает вдвое [7].
При СКВ наблюдается аккумуляция факторов риска развития ОП и переломов: прием ГКС, женский пол, дефицит витамина D у пациентов, избегающих солнечных лучей, почечная недостаточность, аменорея, воспалительный процесс, ограничение подвижности. Наиболее важной причиной ОП для больных СКВ является применение ГКС.
Е.Л. Насонов и соавт. (1997) [10] указывают следующие механизмы развития ОП у этих больных:
- Активность воспалительного процесса.
- Снижение функции яичников у женщин и гипогонадизм у мужчин.
- Поражение почек, вызывающее нарушение 1α-гидроксилирования витамина D.
- Развитие вторичного гиперпаратиреоза.
- Ограничение физической активности и недостаточная инсоляция.
- Лечение ГКС, гепарином, непрямыми антикоагулянтами и др.
В исследовании Bultnik и соавт. (2005) [11] деформации позвонков были обнаружены у 20 % больных СКВ, средний возраст которых составлял 41 год. За последние десятилетия продолжительность жизни пациентов с СКВ возросла на фоне лечения ГКС в сочетании с иммунодепрессантами, поэтому можно ожидать нарастания риска развития остеопоротических переломов у больных этой группы.
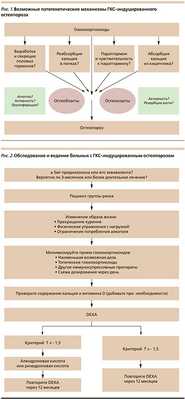
При серонегативных спондилоартритах, в первую очередь АС, риск развития переломов позвонков повышен, очевидно, вследствие потери костной массы и/или увеличения ригидности позвоночника. В некоторых исследованиях показано, что при умеренной воспалительной активности АС костная плотность как позвоночника, так и шейки бедра снижена. Напротив, при высокой активности снижается лишь костная плотность шейки бедра, тогда как в позвоночнике она может быть повышена за счет синдесмофитов [10].
При других РЗ, в частности васкулитах (гранулематозе Вегенера, узелковом полиартериите и гигантоклеточном артериите), в настоящее время нет статистических данных о частоте остепоротических переломов. Предполагают, что плотность кости снижается в первую очередь за счет применения ГКС. Наибольшая потеря костной массы происходит на ранней стадии болезни, вероятно, за счет как высокой воспалительной активности, так и приема высоких доз ГКС, поэтому этой категории больных особенно важно проводить обследование для выявления ОП и своевременного назначения антиостеопоротической терапии [7].
Наиболее частой причиной вторичного ОП считается прием ГКС [12]. Эпидемиологические исследования показывают, что возрастание риска остеопоротических переломов пропорционально регулярности и длительности приема ГКС, выше в первые 3 месяца терапии ГКС, ассоциировано с ускоренной потерей костной массы в течение первого года приема ГКС и, вероятно, связано даже с приемом низких доз ГКС. Патогенез ГКС-индуцированного ОП (ГКС-ОП) сложен [4, 12] и имеет две фазы. Фаза быстрой потери костной массы (до 3 % в год) характеризуется чрезмерной резорбцией, превышающей образование новой кости. Под действием ГКС снижается образование остеобластов и до 3 раз повышается их апоптоз. В то же время повышается активность остеокластов, отчасти за счет снижения концентрации ОПГ. ОПГ действует как растворимый рецептор для RANKL, а сниженная активность этого белка увеличивает взаимодействие между RANKL и его рецептором RANK, что приводит к активации пути с участием NF-κB. Другие механизмы включают сниженную экспрессию морфогенетических белков костной ткани и дифференцировку клеток - предшественников костного мозга в сторону адипоцитов [13].
Действие ГКС на костную ткань осуществляется путем прямого влияния на ее формирование и резорбцию, через воздействие на метаболизм кости и через половые гормоны (рис. 1). Кроме того, риск переломов возрастает и вследствие ГКС-индуцированного снижения мышечной силы, приводящего к падениям. ГКС снижают пролиферацию и функцию остеобластов путем воздействия на инсулиноподобный фактор роста (ИФР-1, ИФР-2) и фактор роста фибробластов (TGF-β1 - basic fibroblast growth factor), вызывают апоптоз остеоцитов (что может играть роль в развитии остеонекроза). ГКС могут вызывать отрицательный кальциевый баланс, уменьшая как всасывание кальция в кишечнике, так и реабсорбцию почками. Единого мнения об их молекулярном влиянии на витамин D нет, поскольку данные исследований на животных и человеке различны. ГКС могут также снижать продукцию половых гормонов, что приводит к усилению костной резорбции.
У пациентов, получающих ГКС, отмечена атрофия мышечных волокон 2-го типа и уменьшение количества волокон 1-го типа [14].
ОП отмечают у 30-50 % пациентов, системно получающих ГКС [4]. Потеря минеральной плотности кости (МПК) может достигать 10-12 % в год, а в течение первых 3 месяцев лечения риск переломов у таких больных возрастает в 2 раза по сравнению с популяцией. Установлено, что ГКС-индуцированные переломы возникают при более высоких, чем при первичном ОП, значениях МПК. У женщин в постменопаузе, принимающих ГКС, риск переломов выше. Он увеличивается при повышении дозы ГКС. Наиболее высокий риск имеют больные, принимающие ГКС в суточной дозе 7,5 мг и выше (уровень доказательности А), но и при приеме более низких доз ГКС снижается МПК и увеличивается риск переломов [14].
В то же время после прекращения приема ГКС скорость снижения МПК нормализуется. Все это диктует необходимость проведения профилактики ОП больным, получающим ГКС в любой дозе более 3 месяцев.
Профилактика вторичного и ГКС-ОП направлена в первую очередь на рациональное лечение основного заболевания, предотвращение потери костной массы и переломов. При этом следует также стараться исключить все другие факторы риска развития ОП (рис. 2).
Рациональное лечение любого из РЗ направлено на снижение воспалительной активности, предотвращение структурных повреждений, сохранение функции суставов и внутренних органов. Применяемые в лечении этих заболеваний ГКС обладают мощным противовоспалительным действием. Некоторые исследователи считают, что раннее назначение ГКС в малых дозах, в частности, в качестве «бридж»-терапии при РА может преду-преждать развитие костных эрозий. Однако применение даже малых доз ГКС в течение нескольких месяцев приводит к быстрой потере костной массы. Поэтому целесообразно стремиться назначать минимально эффективные терапевтические дозы ГКС, при возможности снижать их до полной отмены, использовать препараты для местного лечения, комбинации ГКС с цитостатиками или другими базисными препаратами (больными РА).
Согласно рекомендациям, принятым в Великобритании, начинать лечение ОП следует всем мужчинам и женщинам старше 65 лет одновременно с назначением ГКС, пациентам, имевшим переломы в анамнезе, и молодым пациентам с Т-критерием ≤ -1,5, которым предполагается назначение ГКС перорально, по крайней мере на 3 месяца [15].
Российские рекомендации по профилактике и лечению ГКС-индуцированного ОП (с указанием уровня доказательности) 2010 г. состоят в следующем [16]:
Для предупреждения потери МПК необходимо использование минимальных эффективных терапевтических доз ГКС, снижение дозы системных ГКС на фоне применения препаратов для местного лечения (А). Пациентам, принимающим ГК, рекомендуются сбалансированная диета с достаточным потреблением кальция, адекватная физическая нагрузка, исключение курения и алкоголя. Необходимы оценка риска падений и соблюдение рекомендаций по профилактике падений лицами, которые им подвержены (С).
Отклонение от пика костной массы (Т-критерий) на -1,5 и менее у пациентов, принимающих системные ГКС, что является основанием к назначению лечения (В).
Больным в возрасте 65 лет и старше, принимающим системные ГКС, а также пациентам, имеющим переломы в анамнезе, лечение ОП должно быть назначено одновременно с назначением терапии ГКС на длительный срок (А).
При назначении ГКС в любой дозе на срок более 3 месяцев одновременно необходимо рекомендовать проведение профилактических мероприятий (А).
Комбинация кальция и витамина D должна назначаться всем больным, начавшим прием системных ГКС. Доза витамина D для взрослых составляет 800 МЕ/сут, а элементарного кальция - 1000-1500 мг/сут, включая питание. Для больных, длительно принимающих ГКС, препараты витамина D и кальция должны быть обязательным компонентом любой схемы лечения ОП, однако не могут быть использованы в качестве монотерапии при вторичной профилактике и лечении.
Алендронат (5-10 мг/сут) - препарат первой линии для профилактики и лечения ГКС-ОП (А).
Инъекционная или назальная форма кальцитонина может быть использована в профилактике и лечении ГКС-ОП в постоянном (В) или интермиттирующем режиме (Д), однако он не может быть препаратом выбора из-за отсутствия данных о влиянии на риск переломов.
В качестве лечения ГКС-ОП может использоваться альфакальцидол (А).
Среди новых потенциальных препаратов для лечения ОП разрабатываются ингибиторы катепсина К, глюкагоноподобный пептид 2, антитела к склеростину и ДКК, обладающие анаболическим действием; модуляторы малых молекул, воздействующие на чувствительные к кальцию рецепторы [18].
Успешное лечение вторичного ОП при РЗ зависит от рационального лечения основного заболевания, выявления всех факторов риска развития и диагностики потери костной массы уже в начале болезни, а также своевременного назначения антиостеопоротических препаратов с последующим мониторированием динамики костной массы.
Литература
- Czerwinsky E., Badursky J.E., Marzinovska-Suchowierska E., Osiniec J. Current understanding of osteoporosis according to the position of the World Health Organization (WHO) and International Osteoporosis Foundation. Ortop. Traumatol. Rehabil. 2007;9(4):337-56.
- World Health Organization. Assessment of osteoporosis at the primary health care level. Summary report of a WHO Scientific Group. WHO, Geneva, 2007.
- Kanis J.A., Johanson H., Oden A., Johnel O., et al. A meta-analysis of prior corticosteroid use and fracture risk. Bone Miner Res. 2000;19:893-99.
- Weinstein R.S. Glucocorticoid-induced osteoporosis. Rev. Endocr. Metab. Disord. 2001;2:65-73.
- Boyle W.J., Simonet W.S., Lacely D.L. Osteoclast differentiation and activation. Nature. 2003;423:337-42.
- Geusens P.P., Landew R.B., Garnero P., et al. The ratio of circulating osteoprotegerin to RANKL in early rheumatoid arthritis patients predicts later joint destruction. Arthritis Rheum. 2006;54:1772-77.
- Geusens P., van Brussel M.S., Lems W.F. Osteoporosis and fracture risk: pathogenesis, epidemiology, clinical aspects and diagnosis. EULAR Compendium on Rheumatic Diseases. BMJ Publishing Group, 2009. P. 523-38.
- Brosch S., Redlich K., Pletschmann P. Pathogenesis of osteoporosis in rheumatoid arthritis. Acta Med. Austriaca. 2003;30(1):1-5.
- Cortet B., Flipo R.M., Duquesnoy D., Declambre B. Bone tissue in rheumatoid arthritis (1 and 2). Rev. Rheum. 1995;62:197-211.
- Насонов Е.Л., Скрипникова И.А., Насонова В.А. Проблема остеопороза в ревматологии. М., 1997. 429 с.
- Bultnik I.E., Lems W.F., Kostense P.J., et al. Prevalence of and risk factors for low bone mineral density and vertebral fractures in patients with systemic lupus erythematosus. Arthritis Rheum. 2005;52:2044-50.
- Canalis E., Bilezikian J.P., Angeli A, Giustina A. Perspectives on glucocorticoid-induced osteoporosis. Bone. 2004 34:593-98.
- Patsan D., Loddenkemper K., Buttgereit F. Molecular mechanisms of glucocorticoid-induced osteoporosis. Bone. 2001;29(6):498-505.
- Van Staa T.P. The pathogenesis, epidemiology and management of glucocorticoid-induced osteoporosis. Calcif Tissue Int. 2006;79:129-37.
- Compston J., Bowring C., Cooper A., et al. Diagnosis and management of osteoporosis in postmenopausal women and older men in the UK: National Osteoporosis Guidline Group (NOGG) update 2013. Maturitas Jun26 2013; [Medline].
- Остеопороз. Диагностика, профилактика и лечение. Под ред. О.М. Лесняк, Л.И. Беневоленкской. 2-е изд., перераб. и доп. М., 2010. 272 с.(Серия «Клинические рекомендации»).
- De Vries F., Bracke M., Leufkens G., et al. Fracture risk with intermittent high-dose oral glucocorticoid therapy. Arthritis Rheum. 2007;56(1):208-14.
- Saag K.G., Shane E., Boonen S., et al. Teriparatid or alendronate in glucocorticoid-induced osteoporosis. N. Engl. J. Med. 2007;357(20):2028-39.
- Watts N.B., Bilezikian J.P., Camacho P.M., Greenspan S.L., Harris S.F., et al. American Association of Clinical Endocrinologists Medical Guidelines for Clinical Practice for the diagnosis and treatment of postmenopausal osteoporosis. Endocr. Pract. 2010;16(Suppl 3):1-37.
- Roux Ch., Adami S. Osteoporosis treatment. EULAR Compendium on Rheumatic Diseases. BMJ. Publishing Group, 2009. P. 539-45.
- Shwartz E.M., Ritchlin C.T. Clinical development of anti-RANKL therapy. Arthritis Res. Ther. 2007;9(Suppl 1):s7.
Об авторах / Для корреспонденции
Лекарственная волчанка
Лекарственная волчанка - обратимый волчаночноподобный синдром, вызванный приемом лекарственных препаратов. Клинические проявления лекарственной волчанки сходны с СКВ и включают лихорадку, артралгии, миалгии, полиартрит, плеврит, пневмонит, гепатомегалию, гломерулонефрит. Диагноз основывается на характерных лабораторных критериях (определении в крови антинуклеарного фактора, антинуклеарных антител, LE-клеток) и связи симптоматики с приемом определенных лекарственных медикаментов. Обычно проявления лекарственной волчанки исчезают после отмены причинно значимого препарата; в тяжелых случаях назначаются кортикостероидные препараты.
Общие сведения
Лекарственная волчанка (лекарственный волчаночный синдром) - симптомокомплекс, обусловленный побочным действием лекарственных средств и регрессирующий после их отмены. Лекарственная волчанка по своим клиническим проявлениям и иммунобиологическим механизмам сходна с системной красной волчанкой. В ревматологии лекарственная волчанка диагностируется примерно в 10 раз реже, чем идиопатическая СКВ. В большинстве случаев лекарственно-индуцированный волчаночноподобный синдром развивается у пациентов в возрасте старше 50 лет, практически с одинаковой частотой у мужчин и женщин.
Причины лекарственной волчанки
Развитие лекарственной волчанки может провоцироваться длительным применением или высокими дозировками большого круга лекарственных препаратов. К медикаментам с известным побочным эффектом относятся антигипертензивные (метилдопа, гидралазин, атенолол), противоаритмические (новокаинамид), противотуберкулезные (изониазид), противосудорожные средства (гидантоин, фенитоин), сульфаниламиды и антибиотики (пенициллин, тетрациклин), нейролептики (хлорпромазин), соли лития, золота и другие препараты. Чаще всего лекарственная волчанка возникает у пациентов, страдающих артериальной гипертензией, аритмией, туберкулезом, эпилепсией, ревматоидным артритом, инфекционными заболеваниями и принимающих перечисленные препараты. Возможно развитие волчаночноподобного синдрома у женщин, длительно применяющих оральные контрацептивы.
Патогенез лекарственной волчанки связывается со способностью названных лекарственных препаратов вызывать в организме образование антинуклеарных антител (АНА). Большую роль в предрасположенности к патологии играет генетическая детерминация, а именно - ацетилирующий фенотип пациента. Медленное ацетилирование данных препаратов ферментами печени сопровождается выработкой более высоких титров AHA и более частым развитием лекарственной волчанки. Вместе с тем, у больных с волчаночным синдромом, индуцированным новокаинамидом или гидралазином, выявляется медленный тип ацетилирования.
В целом вероятность развития лекарственной волчанки зависит от дозы препарата и длительности фармакотерапии. При продолжительном приеме лекарственного средства у 10-30% пациентов, имеющих в сыворотке крови антинуклеарные антитела, развивается волчаночноподобный синдром.
Симптомы лекарственной волчанки
В клинике лекарственной волчанки преобладают общие проявления, суставной и кардио-пульмональный синдромы. Заболевание может манифестировать остро или постепенно с таких неспецифических симптомов, как недомогание, миалгия, лихорадка, незначительная потеря массы тела. 80% пациентов беспокоят артралгии, реже - полиартриты. У пациентов, принимающих противоаритмические средства (прокаинамид) наблюдаются серозиты (экссудативный плеврит, перикардит), тампонада сердца, пневмонит, асептические инфильтраты в легких. В ряде случаев возможно развитие лимфаденопатии, гепатомегалии, появление эритематозных высыпаний на коже.
В отличие от идиопатической системной красной волчанки, при лекарственно индуцированном синдроме редко встречаются бабочковидная эритема на щеках, язвенный стоматит, синдром Рейно, алопеция, нефротический синдром, неврологические и психические расстройства (судорожный синдром, психозы). Вместе с тем, для лекарственной волчанки, вызванной приемом апрессина, характерно развитие гломерулонефрита.
Диагностика лекарственной волчанки
От момента появления первых клинических симптомов лекарственной волчанки до постановки диагноза нередко проходит от нескольких месяцев до нескольких лет. В течение этого времени пациенты могут безрезультатно обследоваться у пульмонолога, кардиолога, ревматолога по поводу отдельных проявлений синдрома. Правильная постановка диагноза возможна при всесторонней оценке клинической симптоматики, сопоставлении признаков болезни с приемом определенных лекарственных средств, проведении иммунологических тестов.
Наиболее специфичными лабораторными критериями, указывающими на лекарственную волчанку, служит наличие в крови антинуклеарных антител (антител к гистонам), антинуклеарного фактора, антител к односпиральной ДНК, LE-клеток, снижение уровня комплемента. Менее специфичны для волчаночного синдрома, но высокоспецифичными для СКВ, являются антитела к ds ДНК, анти-Ro/SS-A, Ат к Sm-антигену, анти-La/SS-B. Дифференциальную диагностику лекарственной волчанки необходимо осуществлять с идиопатической СКВ, злокачественными опухолями легких и средостения.
Лечение лекарственной волчанки
Отмена лекарственного препарата, вызвавшего лекарственную волчанку, приводит к постепенному регрессу клинико-лабораторных признаков синдрома. Исчезновение клинической симптоматики обычно происходит в течение нескольких дней или недель после прекращения приема лекарственного средства. Антинуклеарные антитела исчезают медленнее - в течение нескольких месяцев (иногда до 1 года и дольше). С целью купирования суставного синдрома возможно назначение нестероидных противовоспалительных средств. При тяжелом течении лекарственной волчанки, длительной персистенции клинических симптомов обосновано назначение глюкокортикоидов.
Во избежание развития лекарственной волчанки не следует самопроизвольно и бесконтрольно принимать медикаменты; назначение фармакологических средств должно быть обоснованным и согласованным с лечащим врачом. Для предотвращения рецидива волчаночного синдрома необходима адекватная замена причинно значимого препарата альтернативным лекарственным средством.
Впервые за полвека появилось новое лекарство от волчанки

Новость
Знаменитый телесериал «Доктор Хаус» запоминается не только циничным и сварливым нравом главного героя — гения медицинской диагностики, — но и аутоиммунным заболеванием системной красной волчанкой, появляющейся там едва ли не в каждой серии и даже ставшей своеобразным рефреном сериала.
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ
В патогенезе СКВ важное место отводится иммунным механизмам, многие аспекты которых, несмотря на интенсивное изучение, остаются невыясненными. СКВ характеризуется обескураживающей «пестротой» иммунологических феноменов, что связывают с изменением практически всех известных функций иммунокомпетентных клеток (рис. 1).
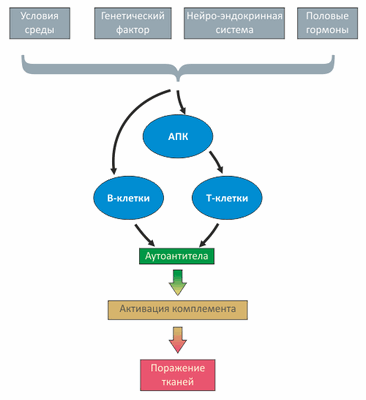
Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4-250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15-25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
«Я знаю пароль, я вижу ориентир»
В конце 1990-х в биофармацевтической компании Human Genome Sciences (Роквилл, Мэриленд, США) открыли молекулярный путь, «сузив» который, можно в какой-то степени сдержать развитие СКВ. В этом пути участвует белок, получивший название «стимулятор B-лимфоцитов» (или BLyS), — цитокин из семейства фактора некроза опухолей. Было обнаружено, что ингибирование BLyS позволяет несколько сдержать разыгравшуюся иммунную систему и уменьшить число колоний B-лимфоцитов, производящих аутоантитела, атакующие здоровые ткани.
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Дорога к этому свершению была долгой, потому что до 2009 года, когда белимумаб успешно прошел первые две фазы клинического тестирования, ещё ни одно лекарство против волчанки не добиралось до фазы III испытаний — рандомизированного мультицентрового исследования с участием большой популяции пациентов. (О процессе разработки лекарств и о клинических испытаниях см. «Драг-дизайн: как в современном мире создаются новые лекарства» [5].) Дело в том, что «строгая» система клинических проверок, основанная на идеологии доказательной медицины, просто не пропускала препараты-«кандидаты», оказывавшиеся на поверку просто неэффективными или опасными для здоровья пациентов.
«Под проекты разработки лекарств против волчанки было просто не получить финансирования, поскольку все знали, что эти разработки как одна проваливаются», — говорит Ричард Фьюри (Richard Furie), ревматолог из Нью-Йорка, руководивший клиническими исследованиями белимумаба. — «Люди открыто говорили: „вы никогда не добьетесь успеха [в клинических исследованиях]“» [6].
Целенаправленная терапия
Когда исследователи из Human Genome Sciences (HGS) открыли цитокин BLyS [7] на основе анализа генетической активности белых клеток крови, полной последовательности генома человека [8] еще не было. «Это было чудное время», — рассказал Дэвид Гилберт (David Hilbert), бывший руководитель исследований этой компании. — «Мы каждый день сидели над лимфоцитами и получали последовательности все новых и новых генов, про которые совершенно не было понятно, что они такое» [6].
В процессе исследования BLyS сотрудники HGS обнаружили, что количество этого цитокина сильно увеличивается при воспалении, а особенно — у больных волчанкой. Это была очень важная зацепка, хотя и было понятно с самого начала, что дорога предстоит нелёгкая, учитывая количество уже провалившихся клинических испытаний препаратов. Ситуация особенно осложнялась тем, что клинические проявления СКВ крайне разнообразны — от лёгкого дискомфорта у одних до тяжкого бремени на всю жизнь у других, — что и побудило, наверное, авторов «Доктора Хауса» включить волчанку в сериал в таком утрированном контексте.
Кстати, цитокину BLyS даже есть памятник, причем в процессе его синтеза на рибосоме: дочь основателя компании HGS, увлекающаяся молекулярной скульптурой [9], «позаимствовала» у отца белок для ваяния. Скульптура установлена в американском НИИ Колд Спринг Харбор.
Действие лекарств, селективно на молекулярном уровне «выключающих» некоторые ветви иммунитета, должно быть очень точным. Например, в 2008 закончились неудачей клинические испытания атацицепта (atacicept), ингибирующего не только BLyS, но и ещё один родственный белок. Тестирование на больных тяжелой формой волчанки — волчаночным нефритом — пришлось срочно прекратить из-за аномально высокого числа побочных инфекций у принимавших лекарство. Аналогичная ситуация была с антителом окрелизумабом (ocrelizumab), блокировавшим работу B-лимфоцитов по другому механизму.
Следующие на очереди
Белимумаб — только первое лекарство из находящихся на очереди в процессе тестирования у различных фармацевтических фирм (таких как Anthera, Eli Lilly и других). Часть разрабатываемых лекарств действуют также на BLyS, другие — ингибируют работу T-лимфоцитов, «атакуя» белок под «научным» названием B7-родственный белок, ещё один препарат ингибирует медиатор воспаления интерферон-γ. Самому же белимумабу пророчат светлое будущее — с точки зрения фармацевтических гигантов, это обозначает миллиардные продажи, выводящие препарат в заветный список «блокбастеров». Между прочим, это совершенно не обозначает полного излечения от болезни миллионам пациентов — эффективность препарата не такая уж и высокая (согласно официальной информации, помогает он одному пациенту из 11), тем более что тестирование проводили не на тяжелой форме заболевания [10]. Кроме того, белимумаб оказался неэффективен в лечении чернокожих пациентов. Впрочем, это все равно лучше, чем неспецифически «глушить» иммунитет пациентов. Жаль только, что большинству российских больных придется по старинке использовать преднизолон, хоть менее эффективный, но зато намного более дешевый, чем инновационный препарат «с пылу-жару».
Читайте также:
- Структура и организация поведения. Поисковое поведение
- Повышение давления в легочных артериях. Значение глубокого дыхания для кровотока
- Синдром Минора-Оппернгейма (Minor-Oppenheim)
- Внутри- и чрезкостная иммобилизация металлическими спицами (внутреннее шинирование кисти)
- Причины отравления сотрудников лабораторий
