Системная терапия диффузного атопического дерматита. Антигистаминные средства
Добавил пользователь Morpheus Обновлено: 22.01.2026
Атопический дерматит (еще его называют диффузный нейродермит) - это хроническое воспалительное заболевание кожи аллергической природы, главным симптомом которого является сильный зуд. Предрасположенность к диффузному нейродермиту, а также к другим атопическим заболеваниям ( бронхиальная астма , поллинозы , аллергический ринит) передается генетически. Поэтому обычно у человека, которому ставят подобный диагноз, обязательно найдется родственник с одним из перечисленных заболеваний. У большинства пациентов заболевание начинается в возрасте до 12 лет. В зрелом возрасте атопический дерматит манифестирует очень редко.
В отсутствие лечения заболевание протекает годами, с периодическими ремиссиями и обострениями и причиняет пациенту массу беспокойств.
Причины заболевания
Причиной развития аллергической реакции в коже при атопическом дерматите является гиперреактивность организма в ответ на взаимодействие с различными веществами. Эти вещества являются для организма больного аллергенами. В качестве аллергена может выступать пыльца растений, домашняя пыль, шерсть животных, различные пищевые продукты, бытовая химия и др. Выделяют воздушный, контактный и пищевой путь проникновения аллергена в организм.
Симптомы атопического дерматита
Для атопического дерматита характерно рецидивирующее течение с периодами обострений, которые возникают при повторном взаимодействии с аллергеном (например, при употреблении определенных продуктов в пищу или при контакте с животным). На частоту обострений влияют также сезон года (обострения чаще возникают в осенное-зимний период), эмоциональные нагрузки и другие факторы.
Главным симптомом заболевания является сухость и зуд кожи. Обострения сопровождаются распространенным отеком и покраснением кожи, появлением красных пятен с расплывчатыми границами, бляшек. В результате расчесывания на коже появляются эрозии, сопровождающиеся мокнутием. В случае занесения в кожу инфекции в местах поражения появляются гнойнички. Излюбленной локализацией атопического дерматита являются сгибательные поверхности суставов, передние и боковые поверхности шеи, лоб, виски, запястья, тыльная поверхность кистей и стоп.
Диагностика атопического дерматита
Диагноз атопический дерматит ставит врач-аллерголог на основании клинической картины и расспроса больного. В некоторых случаях пациенту назначают анализ на уровень иммуноглобулина Е (IgE) в сыворотке крови. Повышенное содержание этого иммуноглобулина говорит о склонности организма к аллергическим реакциям.
Для выявления конкретного аллергена, вызывающего обострения заболевания проводят кожные аллергические пробы. Во время этого исследования на кожу пациента в области предплечья наносят различные аллергены в небольших дозах. При положительной реакции на месте внедрения аллергена развивается покраснение или волдырь.
Что можете сделать Вы
Кожа человека с атопическим дерматитом «всегда готова» ответить на очередной контакт аллергической реакцией. Для того чтобы предотвратить обострения, следует избегать контакта с известными аллергенами. Поэтому в лечении атопического дерматита важное место занимает соблюдение назначенной диеты и поддержание чистоты в доме. Кроме того, следует помнить, что постоянное расчесывание кожи только усиливает аллергическую реакцию и способствует присоединению инфекции.
Не допускайте сухости кожи: принимайте ванны, пользуйтесь мылом как можно реже, регулярно смазывайте кожу увлажняющим лосьоном. Старайтесь не носить синтетическую и шерстяную одежду на голом теле (эти материалы усиливают зуд). Вам лучше подойдут свободная хлопковая одежда и белье.
Лечение и профилактика
Чем поможет врач
Основу терапии атопического дерматита составляют противоаллергические средства. В зависимости от тяжести течения это могут быть как мази для наружного применения, содержащие антигистаминные средства или глюкокортикостероиды, так и пероральные антигистаминные препараты.
В последние годы для лечения атопического дерматита также применяется аллерген-специфическая иммунотерапия (СИТ). Этот метод лечения состоит во введении в организм пациента возрастающих доз экстракта того аллергена, к которому у больного выявлена повышенная чувствительность. В результате такого лечения происходит постепенное повышение устойчивости организма к воздействию данного аллергена.
Альтернатива гормональным препаратам в лечении атопического дерматита
Кортикостероиды могут вызывать атрофию кожи, особенно на лице, а применение местных антибиотиков чревато формированием устойчивости бактерий и развитием аллергии. Поэтому специалисты - дерматологи часто рекомендуют негормональный препарат на основе активированного пиритиона цинка - крем Скин-кап. Его использование для наружного лечения атопического дерматита и диатеза возможно начиная с 1 года, а побочные действия, характерные для гормональных препаратов и местных антибиотиков отсутствуют. При этом противовоспалительный эффект препарата не уступает гормональным препаратам, а антибактериальное и противогрибковое действие позволяет нормализовать микрофлору кожи, снизить риск присоединения инфекции. Несомненно, назначение препарата возможно только после консультации с врачом.
Современные подходы к терапии атопического дерматита
Атопический дерматит является широко распространенным заболеванием у детей. Патогенетическую основу клинических проявлений атопического дерматита составляет хроническое аллергическое воспаление кожи, обусловленное воздействием на сенсибилизированный орган
Каковы показания для назначения глюкокортикоидов (наружно и перорально) при атопическом дерматите?
Когда рекомендуют специфическую иммунотерапию?
Атопический дерматит является широко распространенным заболеванием у детей. Патогенетическую основу клинических проявлений атопического дерматита составляет хроническое аллергическое воспаление кожи, обусловленное воздействием на сенсибилизированный организм ребенка различных аллергенов. В связи с этим принципы лечения атопического дерматита включают воздействие на основные звенья патогенеза аллергического воспаления и устранение аллергена. Оптимальные рекомендации по терапии ребенка с атопическим дерматитом должны содержать следующие позиции:
- мероприятия по устранению аллергена (элиминационная диета и изменения аллергенного окружения);
- наружная терапия;
- системная терапия.
Основанием для элиминационной диеты у ребенка с атопическим дерматитом являются результаты аллергологического обследования, включающие в себя положительные кожные пробы и/или обнаружение специфических иммуноглобулинов Е (IgE) к пищевым аллергенам в крови, а также положительные провокационные тесты с пищевыми продуктами. Последние представляются наиболее достоверным критерием. Исключение аллергена, к которому выявляется гиперчувствительность, должно быть максимально строгим и учитывать возможность его скрытого присутствия как компонента в других пищевых продуктах (табл. 1), а также перекрестного реагирования (табл. 2).
Элиминационная диета должна полностью соответствовать возрастной потребности ребенка в белках, жирах, углеводах и калориях. Это положение особенно важно для детей раннего возраста. Обычно продолжительность элиминационной диеты должна составлять не менее одного года, но в случаях выявления гиперчувствительности к аллергенам яиц, орехов, бобовых, рыбы, морепродуктов элиминационные мероприятия проводятся в течение как минимум двух лет. Расширение диеты должно проводиться после истечения представленных сроков и основываться на результатах повторного аллергологического обследования.
Особое внимание врача при назначении элиминационной диеты детям с атопическим дерматитом необходимо уделять неиммунной пищевой непереносимости, или так называемым псевдоаллергическим реакциям. К сожалению, методы неинвазивной диагностики последних недостаточно стандартизированы. Однако можно подозревать наличие псевдоаллергических реакций при наличии следующих критериев.
- Обострения атопического дерматита связаны с приемом продуктов, содержащих пищевые добавки (консерванты, антиоксиданты, нитриты, нитраты, сульфиты и др.).
- Реакция имеет дозозависимый характер, то есть зависит от количества съеденной пищи.
- Из анамнеза известно, что у ребенка «аллергия на все».
Наиболее часто псевдоаллергические реакции выявляются у детей с отягощенным перинатальным анамнезом, синдромом гипервозбудимости и дефицита внимания.
Для установления конкретного химического соединения, вызывающего псевдоаллергическую реакцию, у взрослых применяются провокационные пробы. В педиатрической практике диагноз псевдоаллергических реакций преимущественно основывается на перечисленных критериях. Псевдоаллергические реакции могут иметь место у детей как с наличием IgE-опосредованных реакций, так и при их отсутствии. Кроме того, необходимо иметь в виду, что нередко отмечается перекрестная гиперчувствительность к различным химическим соединениям. Выявление у ребенка псевдоаллергических реакций является показанием для исключения из диеты продуктов длительного хранения, а также продуктов, в состав которых входят подозреваемые химические соединения.
Элиминационные мероприятия при наличии гиперчувствительности к аллергенам домашней пыли преследуют цель уменьшить концентрацию аллергена в доме, где проживает ребенок (табл. 3). Большинство мероприятий проводятся во всем доме, однако особенно важно их соблюдение в спальне и детской комнате, то есть там, где ребенок находится большую часть времени.
Данный комплекс мероприятий также необходимо проводить у детей, входящих в группы риска развития тяжелого течения атопического дерматита, полиорганных атопических заболеваний, респираторных аллергозов. Группы риска определяются на основании выявления комплекса факторов, к которым относятся: наследственная отягощенность по атопическим заболеваниям; гиперчувствительность к аллергенам куриного яйца, молока; пищевая аллергия, продолжающаяся более года; наличие сенсибилизации к ингаляционным аллергенам; высокий уровень общего IgE; эозинофилия в периферической крови; тяжелое течение дерматита в детстве.
Современная системная и наружная терапия атопического дерматита у детей включает использование препаратов противовоспалительного действия, обладающих способностью ограничивать высвобождение и синтез медиаторов аллергического воспаления, а также блокировать их эффекты. В настоящее время доказана эффективность использования нескольких групп противовоспалительных препаратов, таких как антигистаминные, мембранотропные и глюкокортикостероиды.
Антигистаминные препараты (блокаторы Н1-гистаминовых рецепторов) уменьшают связывание гистамина с гистаминовыми рецепторами клеток — мишеней аллергической реакции, что снижает выраженность симптомов, обусловленных гистамином (отек, гиперемия, зуд). У большинства детей отмечается положительный эффект от применения антигистаминных препаратов, а основной беспокоящий больных симптом — зуд редко полностью исчезает на фоне этого лечения. Выбор конкретного препарата определяют перечисленные ниже положения.
- В связи с наличием седативного эффекта назначение антигистаминных препаратов первого поколения курсами у детей школьного возраста ограничено.
- Седативный эффект, создаваемый антигистаминными препаратами первого поколения, оказывает положительный эффект у детей с нарушением сна, у гипервозбудимых детей раннего возраста и т. д. Выраженность седативного эффекта пропорциональна степени угнетения кожного зуда за счет воздействия на его центральные механизмы. В связи с этим применение антигистаминных препаратов первого поколения (особенно пипольфена, димедрола, супрастина) предпочтительнее в период выраженного кожного зуда у детей любого возраста.
- Учитывая возможность развития тахифилаксии (снижения эффективности препарата) при длительном применении антигистаминных средств первого поколения, у ряда детей может потребоваться отмена лекарства или его замена. Поэтому, если планируется длительное лечебное или профилактическое применение антигистаминного препарата, лечение рациональнее начинать с антигистаминных препаратов второго поколения.
- Антигистаминные препараты второго поколения (кларитин, кестин, зиртек) тормозят развитие как ранней, так и поздней фазы аллергического воспаления, что, вероятно, может обусловливать их превентивное действие. При этом максимальная интенсивность блокирования поздней фазы аллергического воспаления развивается в течение месяца с начала их регулярного применения. В настоящее время эффективность превентивного применения антигистаминных препаратов у детей с атопическим дерматитом интенсивно изучается. В этой связи необходимо отметить результаты, полученные в ходе многоцентрового исследования по программе ETAC. Так, у детей младшего возраста с атопическим дерматитом, имевших моновалентную сенсибилизацию, зиртек предупреждал развитие сенсибилизации к новым аллергенам.
Необходимо учитывать возможность побочного действия антигистаминных препаратов второго поколения (терфенадин, астемизол), проявляющегося обычно при передозировке данных препаратов в виде удлинения интервала QT и риска развития сердечной аритмии (трепетание-мерцание желудочков). Риск данного осложнения повышается при их одновременном применении с макролидами и/или противогрибковыми средствами системного действия.
Пероральное и парентеральное введение глюкокортикостероидов — наиболее эффективный метод лечения атопического дерматита, однако при длительной терапии глюкокортикоидами могут возникнуть следующие осложнения: гипертония, ожирение, гипокалиемия, гипокальцемия, нарушение толерантности к глюкозе, иммуносупрессия, остеопороз. Эти осложнения в свою очередь также требуют коррекции. Кроме того, возможность развития обострения заболевания после отмены лечения ограничивает использование системных глюкокортикостероидов у детей с атопическим дерматитом. Их назначение показано лишь детям с тяжелым обострением атопического дерматита при недостаточной эффективности местной глюкокортикостероидной терапии и лечения антигистаминными препаратами. Длительность применения системных глюкокортикостероидов обычно не должна превышать семь дней, что позволяет свести к минимуму побочные эффекты от терапии и избежать длительного подавления функции коры надпочечников.
Кромоглициевая кислота и кромогликат натрия являются мембранотропными лекарственными средствами, тормозящими высвобождение и синтез медиаторов аллергического воспаления тучными клетками. Эффективность наружного и перорального применения кромогликата натрия и кромоглициевой кислоты при атопическом дерматите не подтверждается в контролируемых исследованиях. Вероятно, в качестве показания к назначению данных препаратов следует рассматривать наличие у ребенка поливалентной пищевой аллергии, когда исключение из питания ребенка выявленных причинно-значимых аллергенов оказывается недостаточно эффективным. Применение данной группы препаратов возможно у больных, имеющих псевдоаллергические реакции, а также при наличии сопутствующего аллергического поражения желудочно-кишечного тракта.
Препараты, содержащие n-3-полиненасыщенные жирные кислоты (эйконол, полиен), встраиваясь в фосфолипиды клеточных мембран, блокируют синтез лейкотриенов, снижают клеточную гиперчувствительность, модулируют иммунный ответ. В частности, эффективность применения n-3-полиненасыщенных жирных кислот показана у детей с диффузными и распространенными формами атопического дерматита; при частом вторичном инфицировании кожных покровов; наличии сочетания атопических и псевдоаллергических реакций у детей с атопическим дерматитом. Возможно их использование при атопическом гастроинтестинодермальном синдроме, а также при сочетании атопического и геликобактерассоциированного гастрита. Эффект от применения данного класса препаратов начинает проявляться на 3-4-й неделе. Однако результаты оценки клинической эффективности данных препаратов для лечения и профилактики атопического дерматита противоречивы, в связи с чем их широкое применение в качестве базисной терапии неоправданно.
Клиническое улучшение при использовании рекомбинантного гамма-интерферона у больных с атопическим дерматитом было продемонстрировано в нескольких исследованиях. Вместе с тем роль и оптимальная длительность безопасной терапии требуют дальнейшего уточнения. Кроме того, высокая стоимость, а также недостаточная длительность эффекта гамма-интерферона являются факторами, ограничивающими его использование.
Противоречивые результаты получены при применении рекомбинантного a-интерферона. Вероятно, использование a-интерферона может быть полезно у детей, имеющих наряду с атопическим дерматитом тяжелую соматическую патологию (гепатит, лейкоз).
Одним из перспективных направлений терапии атопического дерматита является использование специфической иммунотерапии (СИТ) ингаляционными аллергенами. Однако единого экспертного мнения об эффективности СИТ при данной патологии не выработано. Отсутствие положительного клинического эффекта от элиминационных мероприятий, направленных на снижение уровня экспозиции ингаляционных аллергенов, в течение 3-6 месяцев может являться основанием для рассмотрения возможности применения специфической иммунотерапии (СИТ) ингаляционными аллергенами у детей с атопическим дерматитом. Показания к проведению данного метода терапии должны определяться комплексом критериев. Наличие представленных ниже критериев может служить обоснованием для проведения СИТ, причем возможно использование неинвазивного — сублингвально-орального метода.
- Диффузная или распространенная форма атопического дерматита, среднетяжелое/тяжелое течение.
- Клинически значимая сенсибилизация ингаляционными аллергенами, подтвержденная на основании анамнеза, положительных кожных проб и/или обнаружения специфических IgE к данному аллергену.
- Наследственная отягощенность по аллергическим заболеваниям, особенно респираторным аллергозам.
- Гиперчувствительность к одной группе аллергенов.
Инфекции, поражающие кожные покровы, особенно Staphylococcus aureus, являются одной из наиболее частых проблем у больных с атопическим дерматитом. Известно, что колонизация кожи Staphylococcus aureus выявляется у 80-90% больных с атопическим дерматитом. Причем в случае упорного течения заболевания золотистый стафилококк выявляется практически у всех больных. Антистафилококковые антибиотики могут быть полезны в терапии больных с колонизацией кожи S. aureus. Применение эритромицина и других новых антибиотиков этого ряда (азитромицин, кларитромицин) обычно эффективно у больных, не имеющих колонизации кожи резистентными штаммами. У больных с макролидрезистентными штаммами S. aureus использование пенициллиназарезистентных пенициллинов (диклоксациллин, оксациллин или клоксациллин) предпочтительнее. Использование цефалоспоринов первого поколения достаточно эффективно как при стафилококковой, так и при стрептококковой инфекции. Вместе с тем при назначении препаратов пенициллинового и цефалоспоринового рядов необходимо учитывать повышенный риск побочных реакций при наличии у больных с атопическим дерматитом гиперчувствительности к грибковым аллергенам. Местное использование антибиотиков (эритромицина, линкомицина, гентамицина) может быть полезно для терапии пиодермии при атопическом дерматите; однако у больных с интенсивными и рецидивирующими проявлениями вторичной инфекции предпочтительнее использование системных антибиотиков.
Присоединение герпетической инфекции у детей с атопическим дерматитом является серьезным осложнением, особенно в случае диссеминации кожного поражения. Препаратом выбора в данной ситуации является ацикловир, назначаемый в возрастной дозировке четыре раза в день в течение 10 дней.
Грибковые инфекции также могут осложнять течение атопического дерматита и вносить определенный вклад в активизацию заболевания. Необходимо учитывать определенную вероятность развития сенсибилизации к грибковым аллергенам, в частности к Pityrosporum ovale, что, можно полагать, является одним из факторов, способствующих упорному течению сочетанного атопического и себорейного дерматита. В данной ситуации показано наружное использование противогрибковых препаратов.
Психонейровегетативные нарушения, безусловно, играют определенную роль в патогенезе атопического дерматита. Стандартная терапия в таких ситуациях заключается в коррекции вегетативной дисфункции в зависимости от ее типа общепринятыми методами, а также в проведении психотерапии. Однако до настоящего времени нет достоверных свидетельств об эффективности данных методов терапии у детей с атопическим дерматитом.
Возрастные морфофункциональные особенности кожи у детей обусловливают щадящее отношение к местной терапии атопического дерматита, особенно у детей раннего возраста. При этом важна этапность локальной терапии с учетом активности воспаления. Мази лучше всего действуют при хроническом поражении кожи (лихенификации), нежелательно их использование при остром процессе (мокнутие). Наиболее сложным остается вопрос о выборе рациональной глюкокортикоидной терапии. Безусловно, у детей предпочтительнее использование глюкокортикоидных препаратов, не имеющих в своем составе галогенов, которые в значительной степени обусловливают как терапевтический, так и побочные эффекты. Местно применяемые глюкокортикоиды способны утончать эпидермис и дерму, что особенно важно учитывать при их длительном использовании, а также у детей младшей возрастной группы. Возможно развитие контактного дерматита при локальном использовании глюкокортикоидных препаратов. Наиболее часто он обусловлен наличием в их составе пропиленгликоля, реже это связано с аллергическим контактным дерматитом, развивающимся как реакция непосредственно на стероидный компонент. Кроме того, при назначении сильных стероидных препаратов необходимо учитывать, что наличие грибковой инфекции является противопоказанием к их применению.
Среди негалогенизированых наружных глюкокортикоидов можно отметить препарат адвантан, который прошел всестороннюю проверку эффективности и безопасности у детей, в том числе раннего возраста. Необходимо подчеркнуть, что данный препарат используется один раз в сутки, а выраженный терапевтический эффект наступает на 5-6-й день применения. При достижении достаточного эффекта в течение 10-14 дней проводят поддерживающую терапию (разведение адвантана 1:1, 1:2 с детским кремом). Неоспоримым преимуществом адвантана является возможность его длительного применения с минимальным риском возникновения как местных, так и системных побочных явлений.
Таким образом, терапия атопического дерматита у детей, направленная на блокирование развития аллергического воспаления, должна быть строго индивидуальна и базироваться на выявлении особенностей патогенеза у конкретного ребенка.
Системная терапия диффузного атопического дерматита. Антигистаминные средства
Атопический дерматит (АД) — распространенное хроническое заболевание кожи, характеризуемое генетической предрасположенностью, наличием интенсивного зуда и возрастными особенностями морфологии высыпаний. Согласно современным эпидемиологическим данным по заболеваемости АД, развитие дерматоза наблюдают у 9-20% детей и у 5% взрослых. Формирование заболевания обусловлено генетической недостаточностью функциональной активности эпидермального барьера из-за дефицита синтеза белка филаггрина и наследственной аномалией адаптивного иммунитета с преобладанием воспалительных реакций по Th2-зависимому типу [1, 2].
Реализации генетической составляющей АД способствуют экологические факторы. В условиях антропогенного загрязнения окружающей среды из-за повышения концентрации тяжелых металлов и их воздействия на макроорганизм при несостоятельности эпидермального барьера наблюдают рост показателей средней заболеваемости по данной патологии и удельного веса осложненных форм и тяжелого течения дерматоза [3].
Ключевое значение в развитии АД имеет нарушение микробиома кожи пациентов. Более чем у 80% больных АД отмечают высокую контаминацию кожи Staphylococcus aureus, дрожжеподобными грибами рода Malassezia и Candida. Антигенное воздействие патогенной и резидентной микробиоты не только активизирует иммунные реакции, но и, в свою очередь, оказывает прямое повреждающее действие на эпидермальный барьер, что приводит к развитию стойкой воспалительной реакции в коже, резистентности к проводимой терапии и тяжелому течению заболевания [4, 5].
Однако независимо от особенностей течения АД или преобладания того или иного звена патогенеза неотъемлемым симптомом заболевания является зуд, интенсивность которого прямо коррелирует со степенью тяжести течения дерматоза. Несмотря на то что расчесывание кожи на время снижает интенсивность зуда у больных, именно постоянная травматизация кожи в большей мере, чем все остальные экзогенные факторы, нарушает целостность эпидермального барьера, увеличивает трансэпидермальную потерю воды, активизирует деятельность грибково-бактериальной микробиоты, способствует повышению выработки провоспалительных цитокинов, усугубляя выраженность воспалительного процесса. Таким образом, формируется порочный круг патологически взаимосвязанных процессов, обусловливающих хроническое течение АД [9, 10].
Механизм развития зуда при АД изучен недостаточно, так же как и при других воспалительных заболеваниях кожи. Предполагается ведущая роль в раздражении рецепторов кожи ферментами (протеазами), нейроактивными пептидами, а также IL-31, который вырабатывают Т-клетки и гранулоциты. Различные наблюдения показывают, что IL-31 индуцирует рост ганглиев дорсального корешка малого диаметра, что приводит к увеличению количества нервных волокон в коже больных АД, соответственно повышается чувствительность к минимальному воздействию экзогенных и эндогенных стимулов, как следствие, зуд становится постоянным [11, 12].
Многолетний клинический опыт и гистохимические исследования доказывают роль гистамина в развитии зуда при АД. Так, установлено повышение количества рецепторов Н1 и Н4 в пораженных участках кожи у пациентов при ингибировании активности Н3-рецепторов [13], а также тесная связь так называемых негистаминовых механизмов активации рецепторов, участвующих в развитии зуда при АД, с действием гистамина. Например, гистамин, высвобождаясь из тучных клеток, воздействует на С-миелиновые окончания нервных волокон и вызывает аксон-рефлекс, т.е. стимулирует высвобождение нейропептидов и, в частности, субстанции Р [14]. Выявлено, что стимуляция H1-рецепторов приводит к повышению уровня Ca 2+ , цГМФ, NFκB, киназ и протеаз, роль которых в патофизиологии воспалительной реакции при данном дерматозе показана в исследованиях. Кроме того, в коже больных АД обнаруживают повышенные количество тучных клеток, концентрацию гистамина в плазме и уровень спонтанного высвобождения гистамина из базофилов [15].
Цель исследования — определение эффективности современного антигистаминного препарата в комплексной терапии АД.
Материал и методы
Под динамическим клиническим наблюдением находились 60 больных АД в возрасте от 12 до 60 лет, из них 36 (60%) мужчин и 24 (40%) женщины. Средний возраст пациентов составил 22,25±3,56 года.
В рамках исследования проведен анализ данных анамнеза с целью определения триггеров возникновения АД и наличия сопутствующей патологии. Тяжесть течения заболевания оценивали путем определения площади поражения кожи — с помощью индексов BSA и SCORAD. В исследование включены пациенты с BSA менее 10% и SCORAD до 60 баллов. Критерием невключения в исследование являлись предшествующее проведение системной терапии с использованием глюкокортикостероидов, цитостатиков, моноклональных антител и применение фототерапии. Наиболее важным критерием оценки эффективности проводимой терапии было определение динамики индекса выраженности зуда (ИВЗ) по 10-балльной шкале. Всем больным предлагали оценить уровень своего здоровья по специализированной шкале с максимальным значением 100% — высокий уровень здоровья. Безопасность лечения оценивали с учетом нежелательных явлений на основании жалоб и объективного физикального обследования, а также динамики клинических анализов крови и мочи, биохимического анализа крови до и через 30 дней лечения.
Результаты исследования оценивали методами вариационной статистики с помощью пакета статистических программ MS Exel 7, Statsoft Statistica 17.0. При обработке полученных данных применяли методы непараметрической статистики с использованием среднеарифметических значений и их ошибки по таблице Стьюдента. Статистически значимыми считали различия при p
Результаты
На основании оценки степени тяжести АД при помощи дерматологических индексов легкое течение заболевания констатировано у 23 (38,33%) больных, среднетяжелое — у 37 (61,67%). При исследовании анамнеза заболевания установлен спектр коморбидной патологии у пациентов, вошедших наблюдательное исследование (рис. 1).
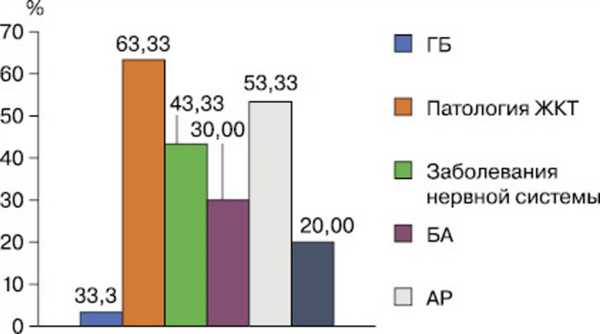
Рис. 1. Коморбидная патология у пациентов с атопическим дерматитом.
ГБ — гипертоническая болезнь, ЖКТ — желудочно-кишечный тракт, БА — бронхиальная астма, АР — аллергический ринит, патология лор-органов — оториноларингологические заболевания.
Основной жалобой пациентов был зуд различной интенсивности. ИВЗ в среднем составил 8,23±1,16 балла. Биоритм зуда у больных АД представлен на рис. 2.
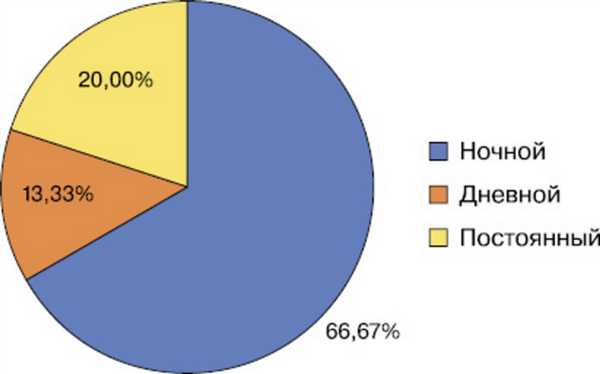
Рис. 2. Биоритм зуда у больных атопическим дерматитом.
Тестирование пациентов выявило, что у большинства больных зуд усиливался преимущественно к вечеру, наблюдался в течение всей ночи с ослаблением в утренние часы. У 8 (13,33%) больных активность зуда была максимальной в дневные часы и практически не влияла на сон. У 12 (20,00%) больных зуд был постоянным, различий в его интенсивности в течение суток не наблюдали.
Наличие зуда определяло формирование сопутствующих жалоб: нарушение сна отметили 58 (96,67%) пациентов, повышенную утомляемость — 48 (80,00%), общую слабость — 30 (50,00%), повышенную возбудимость — 26 (43,33%), повышенную потливость — 18 (30,00%). Общее состояние больных существенным образом сказывалось на качестве жизни, в среднем они оценивали свой уровень здоровья на 45,25±2,11%.
Всех пациентов случайным образом разделили на 2 клинические группы в зависимости от проводимой терапии. В 1-й группе (n=30) проводили традиционную терапию с использованием на кожу туловища и конечностей базовых средств, предназначенных для ухода за «атопичной» кожей, содержащих церамиды, топические глюкокортикостероиды высокой потенции, а на кожу лица — препарат из группы топических ингибиторов кальциневрина (такролимус). Больным 2-й группы (n=30) в комплексе с описанной терапией назначили современный антигистаминный препарат Никсар (биластин) по 20 мг/сут. Общий курс терапии 30 дней.
Никсар относится к лидерам среди антигистаминных препаратов новой генерации, что обусловлено его высокой селективностью к Н1-рецепторам, отсутствием метаболизации (активный метаболит), доказанной эффективностью при симптоматической терапии крапивницы и аллергического ринита (включая интермиттирующий и персистирующий аллергический риноконъюнктивит), а также высоким профилем безопасности [15]. Никсар снижает проницаемость капилляров, предупреждает развитие и облегчает течение аллергических реакций немедленного типа, предупреждает индуцированный гистамином спазм гладкой мускулатуры сосудов и внутренних органов. Препарат не оказывает клинически значимого действия на рецепторы серотонина, брадикинина, лейкотриена-D4, адрено- и мускариновые рецепторы. Биластин также может тормозить высвобождение гистамина, ИЛ-4 и фактора некроза опухоли из тучных клеток и гранулоцитов, что обеспечивает противовоспалительную активность препарата [16].
В результате терапии (см. таблицу) установлены достоверные различия в динамике индекса тяжести течения АД, которые характеризовались более выраженной депрессией средних значений SCORAD в группе, где пациенты принимали препарат Никсар в комплексе с топической терапией, уже через 2 нед от начала терапии и после окончания лечения.
Динамика средних значений индекса SCORAD в результате терапии
При оценке динамики ИВЗ отмечена аналогичная тенденция (рис. 3).
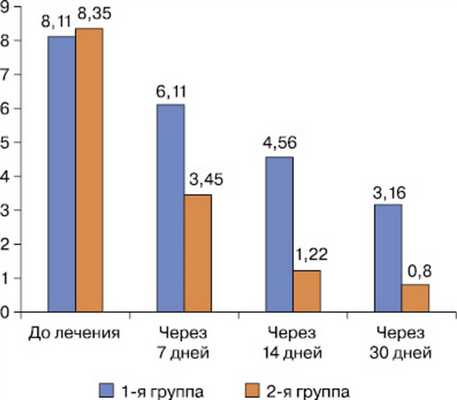
Рис. 3. Динамика средних значений индекса выраженности зуда.
Анализ интенсивности зуда на различных этапах лечения больных АД выявил, что включение в терапию современного антигистаминного препарата способствовало быстрому снижению интенсивности зуда, и по завершении терапии у пациентов, которые не применяли Никсар, средний ИВЗ был в 3 раза выше, чем во 2-й группе.
Заключение
Современные исследования позволяют констатировать мультифакториальность генеза зуда при АД. Роль гистамина в активации воспалительных процессов и в формировании зуда при АД очевидна и определена экспериментально, что обусловливает патогенетическую обоснованность использования современных антигистаминных средств в комплексной терапии АД. Анализ результатов исследования показал высокую терапевтическую эффективность комбинации рациональной местной терапии и препарата Никсар. Применение антагонистов Н1-рецепторов последней генерации повышает приверженность больных к лечению.
Участие авторов
Сбор и обработка материала — Ю.Н. Перламутров, К.Б. Ольховская, А.О. Ляпон
Написание текста — К.Б. Ольховская
Редактирование — Ю.Н. Перламутров
Авторы заявляют об отсутствии конфликта интересов.
Authors’ contributions:
Collecting and interpreting the data: Perlamutrov Yu.N., Olkhovskaya K.B., Lyapon A.O.
АтД — атопический дерматит
ГРЛС — государственный реестр лекарственных средств
ЛС — лекарственное средство
МНН — международное непатентованное название
ТН — торговое название
Введение
Охрана здоровья детей и подростков, своевременное и постоянное обеспечение их качественной медицинской помощью — одно из приоритетных направлений здравоохранения РФ. Атопический дерматит (АД) у этого контингента является лидирующей кожной патологией в структуре дерматозов различного генеза. На протяжении последних 40 лет практически всеми специалистами отмечен рост заболеваемости АД [1, 2 и др.]. Эпидемиологическое исследование, проведенное ISAAC в международном масштабе, позволило установить, что распространенность АД у детей в России достигла 15,5%, в Европе — 16%, в США — 17% [3]. Доля АД в структуре кожной патологии у детей, обратившихся в лечебно-профилактические и кожно-венерологические учреждения, по данным Уральского научно-исследовательского кожно-венерологического института, составляет 73,9%, среди детей, состоящих на диспансерном учете, — 78,9%, а у детей с установленной инвалидностью по заболеваниям кожи — 71,8% [4]. Настораживает факт резкого увеличения числа больных АД среди подростков и взрослых [5—7 и др.]. Данные научных исследований свидетельствуют, что во взрослом возрасте АД персистирует у 30—60% пациентов [8—10], а иногда этот показатель достигает 69,5—94,3% [6]. Некоторые публикации свидетельствуют, что данные официальной статистики о распространенности АД в России занижены в 10—20 раз и не дают истинного представления о ситуации в стране [11]. Анализ интенсивных показателей распространенности и заболеваемости АД у детей и подростков с использованием данных официальной статистики МЗ РФ за 2015 и 2016 г. [12] с учетом продолжительности каждого возрастного периода позволил доказать лидирование подростков в эпидемиологии этого аллергического заболевания. Этот факт подтвержден также вычислением коэффициента диспансеризации в России в целом и ее федеральных округах в частности [7]. Естественно, возникает вопрос, почему из года в год увеличивается число больных АД и регистрируется его персистенция в старших возрастных группах. Причин достаточно много: влияние трофоаллергенов (сама пища и добавки в нее), неблагоприятная экология, частые стрессы, химические вещества, наследственная предрасположенность к заболеванию и др. К сожалению, публикации, отражающие качество оказания медицинской помощи больным АД, единичны. Анализ дерматологами данного критерия на территории Уральского, Сибирского и Дальневосточного ФО (данные за 2005—2009 гг.) свидетельствует о низкой эффективности оказания амбулаторно-поликлинической помощи больным, в том числе диспансерного наблюдения [13]. При первичном посещении лечебных учреждений только 22% больных АД получают специализированную медицинскую помощь, 78% больных ограничиваются лишь консультацией педиатра [4].
В Государственной программе «Развитие здравоохранения» в России на период до 2025 г.» особое внимание уделяется удовлетворенности населения качеством медицинской помощи. Решение этой задачи базируется на совершенствовании деятельности лечебно-профилактических учреждений и повышении профессионализма медицинских работников. Особый акцент сделан на улучшении здоровья различных возрастных и социальных групп населения [14]. Для оценки эффективности лечения больных издан Приказ МЗ РФ от 10.05.17 №203н «Об утверждении критериев оценки качества медицинской помощи» [15]. В нем четко определено, что формирование плана лечения при первичном осмотре больного должно осуществляться с учетом предварительного диагноза, клинических проявлений, тяжести заболевания, состояния пациента. Назначение лекарственных препаратов необходимо проводить, основываясь на знании инструкций фирм-производителей лекарственных средств (ЛС), возраста и пола больного, особенностей течения заболевания, наличия его осложнений и сопутствующей патологии. Коррекция плана лечения с использованием стандартов медицинской помощи и клинических рекомендаций проводится после проведения обследования больного, установления окончательного клинического диагноза.
16.09.19 вступили в силу «Требования к организации проведения внутреннего контроля качества и безопасности медицинской деятельности», утвержденные Приказом МЗ РФ от 07.06.19 №381н [16]. Одной из задач этого документа является оценка характера, частоты и возможных нарушений при оказании медицинской помощи, которые явились причиной ухудшения состояния здоровья и неудовлетворенности ее качеством. Для решения этой задачи рекомендовано использовать анализ данных амбулаторных карт и/или историй болезни методом случайной выборки. Это позволит оценить качество и безопасность врачебной деятельности.
Основным документом, разрешающим применение ЛС в России, является Государственный реестр лекарственных средств (ГРЛС), информация о препарате изложена в инструкции фирмы-производителя. Главным документом, определяющим тактику лечения больных при заболеваниях различного генеза, являются клинические рекомендации. Данные консультативного приема больных АД свидетельствуют, что в клинической практике врачи обычно используют определенный набор ЛС.
Для лечения АД рекомендован ступенчатый подход [23, 24]. Он подробно представлен в ФКР РОДВиК (2015) [25], Клинических рекомендациях Союза педиатров России, Российской ассоциации аллергологов и клинических иммунологов (2016) [26], Европейских рекомендациях по лечению атопического дерматита (2018) [27]. При легкой степени тяжести АД (SCORAD 40 баллов) — системные глюкокортикостероиды и циклоспорин. В качестве базисной терапии обязательно используют эмоленты. Следовательно, АГП являются основной группой ЛС для системной терапии при среднетяжелом АД.
Согласно классификации Европейской ассоциации аллергологии и клинической иммунологии, принятой в России, выделяют 2 поколения антигистаминных средств [28, 29]. АГП I поколения действуют на периферические и центральные Н1-рецепторы гистамина, вызывают седативный эффект и не обладают дополнительным антиаллергическим свойством. Их нельзя рекомендовать для постоянно и длительного использовании, они показаны лишь при обострении АД короткими курсами на ночь для уменьшения зуда [26]. АГП II поколения действуют только на периферические Н1-гистаминорецепторы, не вызывают седативного эффекта, стабилизируют мембрану тучных клеток и обладают дополнительным противоаллергическим свойством. Поэтому неседативные АГП II поколения оказывают очень слабое действие и, как следствие, имеют низкую клиническую результативность при АД [26].
Назначая АГП больному АД, врач должен знать факторы, влияющие на их выбор. Это классификация АГП (I и II поколения); международные непатентованные названия (МНН) и торговые названия (ТН); наличие регистрации в ГРЛС РФ; показания в инструкции фирмы-производителя о возможности использования при АД; возраст больного; лекарственная форма препарата; противопоказания; совместимость с другими препаратами при наличии сопутствующей патологии; степень тяжести АД, наличие «атопического марша».
Цель исследования — оценить реальную практику использования дерматологами в клинической практике АГП для лечения АД у детей и подростков методом ретроспективного анализа амбулаторных карт.
Дизайн исследования
Исследование проводилось поэтапно.
III этап. Оценка приоритетов дерматологов в использовании АГП при лечении АД у больных в возрасте до 18 лет.
IV этап. Анализ ошибок врачей амбулаторного приема при назначении АГП в клинической практике для лечения АД у детей и подростков.
Материалы и методы
Результаты I этапа исследования представлены в табл. 1.
Эффективность нового антигистаминного препарата в комплексной терапии атопического дерматита у детей
В настоящее время аллергические заболевания, в связи с общим ростом, увеличением частоты их диагностики и выявляемости, заняли важное место в общей патологии человека и являются одними из наиболее распространенных во всем мире. Каждый четвертый-пятый житель нашей планеты имеет те или иные проявления аллергических заболеваний. В большинстве индустриально развитых стран такие аллергические заболевания, как бронхиальная астма, аллергический ринит и атопический дерматит, - изолированно или в различных сочетаниях поражают до 25% населения. Распространенность этих нозологических форм за последние 30 лет увеличилась в 3 раза (12).
- КЛЮЧЕВЫЕ СЛОВА: дерматит, анафилаксия, риноконъюнктивит, крапивница, гидроксизин, Ксизал
Термин «аллергия» происходит от двух греческих слов: «аллос» - другой, иной и «эргос» - действие. Буквальный перевод слова означает, таким образом, «действие по-другому». В современной науке данное понятие определяется следующим образом: аллергия - это состояние патологически повышенной реакции организма на какие-либо вещества чужеродной природы, в основе которой лежат иммунологические механизмы. Патологические состояния, характеризующиеся образованием антител и специфически реагирующих лимфоцитов, развиваются в ответ на контакт с соответствующим аллергеном (или аллергенами), который рассматривается как этиологический фактор (или факторы) болезни.
Аллергический ответ является очень сложным процессом, который включает в себя дегрануляцию тучных клеток, активацию Т-лимфоцитов, эпителиальных и эндотелиальных клеток, накопление в тканях эозинофилов и в меньшей степени базофилов, а также синтез и высвобождение хемокинов. Образование и секреция медиаторов тучными клетками, эозинофилами и базофилами прямо и/или косвенно способствует появлению симптомов аллергии.
В основе острых аллергических реакций лежит гиперчувствительность немедленного типа. Ее опосредуют молекулы, которые высвобождаются тучными клетками при взаимодействии аллергена с IgE на поверхности клеток: гистамин, триптаза и мембранные липидные медиаторы - лейкотриены, простагландины и фактор активации тромбоцитов. Медиаторы тучных клеток играют ключевую роль в развитии анафилаксии, риноконъюнктивита и крапивницы.
Гистамин, этот важнейший медиатор различных физиологических и патологических процессов в организме, был химически синтезирован в 1907 году. A. Windaus и W. Vogt впоследствии его выделили из тканей животных и человека. Еще позднее были определены его функции: желудочная секреция, нейромедиаторная функция в ЦНС, аллергические реакции, воспаление и др. Спустя почти 20 лет, в 1936 году, D. Bovet, A. Staub были созданы первые вещества, обладающие антигистаминной активностью.
Гистамин участвует в механизме практически всех основных симптомов аллергии. Поэтому первыми противоаллергическими средствами стали антигистаминные препараты (АГП). Первоначально эти препараты не обладали достаточной селективностью. Некоторые из первых представителей этой группы нашли применение не при аллергических, а при других заболеваниях благодаря наличию седативной, антисекреторной активности. Центральные эффекты этих препаратов были главным фактором, ограничивающим их применение при аллергических заболеваниях.
В 60-е годы была доказана гетерогенность рецепторов в организме к гистамину и выделены три их подтипа: Н1, Н2 и Н3, различающиеся по строению, локализации и физиологическим эффектам, возникающим при их активации и блокаде.
В процессе изучения были выделены блокирующие Н1-гистаминовые рецепторы, которые стали носить название антигистаминных, а лекарства, воздействующие на Н2-гистаминовые рецепторы (циметидин, ранитидин, фамотидин и др.), называют Н2-гистаминоблокаторами. Первые используются для лечения аллергических заболеваний, вторые применяются в качестве антисекреторных средств.
Большинство блокирующих Н1-гистаминовые рецепторы веществ оказывали следующие эффекты: противозудный, противоотечный, антиспастический, антихолинергический, антисеротониновый, седативный и местноанестезирующий, а также предупреждение гистамининдуцированного бронхоспазма (3).
Однако, несмотря на высокую терапевтическую эффективность данных препаратов, у них было выявлено множество побочных эффектов, связанных со способностью проникать через гематоэнцефалический барьер, за счет липофильных свойств, электрического заряда, и обладанием антихолинергической активностью. Среди основных побочных эффектов выделяют: центральные, связанные с угнетающим воздействием на ЦНС, проявляющиеся в виде сонливости, снижения психомоторной активности, то есть появления эффекта «седации» и воздействие на холинергическую активность, такие как сухость во рту, нарушение мочеиспускания, зрительные расстройства.
Изучая свойства блокатора Н1-рецепторов вещества гидроксизина, компания UCB Pharma обнаружила, что существенно дольше характерного седативного действия препарата длится его антигистаминное действие, и предположили, что антигистаминным действием обладает не сам гидроксизин, а один из его метаболитов. Длительное время не существовало технологий, позволяющих подтвердить это предположение. Расшифровать структуру вещества, обладающего длительным антигистаминным эффектом, выделить и синтезировать его удалось лишь в 1978 г. Цетиризин стал первым среди антигистаминных препаратов - естественных метаболитов.
Из положительных свойств данной группы, кроме значительной селективности в отношении периферических Н1-рецепторов, отсутствия седативного и кардиотоксического действия, можно выделить и дополнительные противоаллергические эффекты: торможение выделения медиаторов системного аллергического воспаления, включая цитокины и хемокины (триптаза, лейкотриен С4, простагландин D2, интерлейкины 3, 4 и 8, фактор некроза опухоли TNF, гранулоцитарно-макрофагальный колониестимулирующий фактор, RANTES), уменьшение экспрессии молекул адгезии (в том числе Р-селектина и ICAM-1), подавление хемотаксиса и активации эозинофилов и образования супероксидного радикала, снижение гиперреактивности бронхов и выраженности аллерген-индуцированного бронхоспазма (3, 5). Активность метаболитов может быть в 2-4 раза выше по сравнению с исходным соединением (для метаболитов акривастина, эбастина и лоратадина) или такой же (для метаболитов астемизола и кетотифена), а период полувыведения и продолжительность лечебного действия некоторых метаболитов гораздо выше, чем у препарата-предшественника.
Поэтому применение метаболитов более оправдано при проведении долговременной терапии аллергических заболеваний, в генезе которых значительную роль играют медиаторы поздней фазы аллергического воспаления: круглогодичного аллергического ринита, сезонного аллергического ринита или риноконъюнктивита с продолжительностью сезонных обострений более 2 недель, хронической крапивницы, атопического дерматита, аллергического контактного дерматита. Особенности фармакокинетики, хороший профиль безопасности и высокая клиническая эффективность делают их наиболее перспективными антигистаминными средствами в настоящее время. В связи с выявленным свойством цетиризина легко проникать в кожу и накапливаться в ней в высоких концентрациях даже после однократного приема, данный препарат активно применялся у пациентов с аллергическим поражением кожных покровов.
С момента успешного синтеза было известно, что цетиризин - это рацемическая смесь двух изомеров, левоцетиризина и декстроцетиризина. Также было известно, что гистаминовый рецептор I типа - стереоселективная структура и преимущественно связывает только один из изомеров. Лишь в 2001 году удалось применить технологию, позволяющую успешно разделить энантиомеры цетиризина.
При изучении левоцетиризина и декстроцетиризина было доказано, что второй практически не обладает антигистаминным действием.
Левоцетиризин является первым примером выделения активного энантиомера человеческого метаболита как самостоятельного противоаллергического лекарства.
Среди положительных свойств естественных метаболитов у левоцетиризина были доказаны также и хорошие фармакодинамические характеристики: избирательная, стойкая и длительная связь с Н1-рецептором, а также низкая межсубъектная вариабельность, т.е. предсказуемость антигистаминного действия. По параметрам фармакокинетики препарат превосходит практически все другие современные гистаминоблокаторы: в исследованиях показаны быстрая абсорбция, высокая биодоступность - близкая к 100%, минимальный метаболизм, отсутствие взаимодействия с изоферментами системы цитохрома CYP 450, малый объем распределения (6, 10, 11).
При изучении левоцетиризина доказано, что сродство к Н1-рецепторам у него в 2 раза больше, чем у цетиризина. Левоцетиризин оказывает влияние на гистаминозависимую стадию аллергических реакций, а также уменьшает миграцию эозинофилов, уменьшает сосудистую проницаемость, ограничивает высвобождение медиаторов воспаления. Предупреждает развитие и облегчает течение аллергических реакций, обладает противоэкссудативным, противозудным действием, практически не оказывает антихолинергического и антисеротонинового действия. В терапевтических дозах практически не оказывает седативного действия. Действие препарата начинается через 30 мин. (1 час) у 95% больных и сохраняется в течение 24 часов. Левоцетиризин на 90% связывается с белками плазмы. Биодоступность достигает 100%. Период полувыведения составляет 7-10 часов. Полностью выводится из организма за 96 часов.
В связи с тем, что левоцетиризин, как и его предшественник цетиризин, хорошо проникает в кожу, было решено провести клиническое исследование левоцетиризина при атопическом дерматите у детей.
Атопический дерматит является одним из первых аллергических заболеваний, ведущих в последующем к развитию бронхиальной астмы, аллергическому риниту / конъюнктивиту, сочетанных проявлений аллергопатологии («аллергический марш») (4).
В механизмах развития атопического дерматита ключевым звеном патогенеза служит аллергическое воспаление, опосредованное преимущественно Тh2-лимфоцитами, приводящие к появлению определенных цитокинов: IL-4, IL-13, IL-10, IL-5, стимулирующих В-клеточную продукцию IgE антител, а также индуцирующих активность и пролиферацию эозинофилов, увеличивающих экспрессию антигенов гистосовместимости II класса и служащих фактором роста тучных клеток. Особенностью IgE антител является их избирательная способность фиксироваться с помощью высокоаффинного рецептора (FcέRI) с тучными клетками. Согласно последним исследованиям, высокоаффинные рецепторы (FcέRI) присутствуют на поверхности антигенпрезентирующих дендритных клеток кожи больных атопическим дерматитом. Дендритные клетки, экспрессирующие FcέRI рецепторы и IgE антитела, могут усиливать вторичный иммунный ответ, что приводит к повышенному синтезу IgE антител посредством активации большего числа Тh2-лимфоцитов или дендритных клеток из периферической крови в кожу. Этому способствует IL-16 - хемоттрактант для CD4+ лимфоцитов, экспрессируемый в поврежденной коже больных атопическим дерматитом дендритными клетками.
В развитии воспаления кожи у больных атопическим дерматитом важное значение имеют кератиноциты эпидермиса (2), при стимуляции которых повышается продукция хемокина RANTES. Кератиноциты кожи больных атопическим дерматитом являются также важным источником тимического стромального лимфопоэтина, который активирует дендритные клетки к примированию наивных Тh-лимфоцитов и продукции IL-4, IL-13, FNO-α. Кроме того, кератиноциты кожи у больных атопическим дерматитом недостаточно продуцируют антимикробные пептиды, необходимые для защиты против бактерий, грибов и вирусов. Установлено, что именно Тh2-цитокины угнетают экспрессию одного из таких пептидов β-дефензина 2. Эти наблюдения позволяют понять повышенную колонизацию кожи больных атопическим дерматитом золотистым стафилококком, который поддерживает или обостряет кожный процесс при атопическом дерматите за счет секреции экзотоксина. Активированные под влиянием экзотоксина эозинофилы, макрофаги и клетки Лангерганса в свою очередь активируют кератиноциты к продукции IL-1 и FNO-α, которые изменяют функцию рецепторов адгезивных молекул на эндотелиальных клетках и способствуют рециркуляции Т-клеток в кожу. Активированные Т-лимфоциты кожи больных атопическим дерматитом могут запускать апоптоз кератиноцитов через Fas-лиганд, экспрессия которого усиливается под влиянием INF-γ, и кератиноциты становятся чувствительными к апоптозу. Взаимодействие Fas-лиганда с рецептором CD 95 рассматривается главный механизм повреждения кератиноцитов Т-клетками с последующим развитием спонгиоза и акантолиза - характерных проявлений атопического дерматита (2).
Определенное значение в развитии атопического дерматита играют и психосоматические расстройства. Сильный зуд, раздражительность, тревожный поверхностный сон, неадекватность реакций, белый дермографизм - классические проявления психосоматической патологии. При оценке психосоматического статуса у пациентов часто выявляется высокая степень тревожности, развитие реактивных депрессий, астеновегетативный синдром. В последнее время доказано, что основным субстратом в психонейроиммунном взаимодействии являются нейропептиды, (субстанция P, нейрокинин А, нейрокинин В, кальцитонин-геноподобный пептид), обеспечивающие взаимосвязь между нервными волокнами, тучными клетками и сосудами. В следствие аксонрефлекса развивается вазодилатация, проявляющаяся эритемой. Субстанция P обеспечивает высвобождение гистамина из тучных клеток кожи и оказывает прямое воздействие на сосуды, увеличивая их проницаемость.
Для оценки левоцетиризина в комплексной терапии атопического дерматита у детей, эффективность была изучена у 22 детей с атопическим дерматитом, имеющих среднетяжелое и тяжелое течение болезни. Оценка осуществлялась на основе динамики клинических симптомов и шкалы SCORAD.
В задачи исследования входило оценить противоаллергические эффекты, индивидуальную переносимость, наличие побочных эффектов.
Для решения поставленных задач была сформирована группа детей, страдающих атопическим дерматитом, представленная 22 пациентами.
Соотношение по полу в исследуемой группе было одинаковым - 50% девочек и 50% мальчиков. Все пациенты, включенные в группу исследования, были старше 6 лет, средний возраст составил 10,2 ± 3,6 лет. От 6-9 лет было 10 больных, от 10-17 было 12 детей (рисунок 1).
По тяжести течения атопического дерматита: 14 больных наблюдались с тяжелым течением, у 8 пациентов среднетяжелое течение болезни (рисунок 2).
При обследовании у большинства (71,5%) больных была выявлена поливалентная сенсибилизация (чаще бытовая, и/или пищевая, и/или эпидермальная). У 19 пациентов при обследовании была выявлена сочетанная аллергопатология. У 10 детей атопический дерматит сочетался с бронхиальной астмой, у 9 - с аллергическим ринитом легкой или средней степени тяжести, эти заболевания были в периоде ремиссии.
Левоцетиризин назначался в составе комплексной терапии наряду с топическими кортикостероидными препаратами (у части больных комбинированными с антибактериальными и противогрибковыми), длительность приема левоцетиризина составила в среднем 14 дней.
Критериями включения в протокол исследования эффективности левоцетиризина были следующие:
- возраст детей старше 6 лет;
- наличие установленного диагноза (атопический дерматит, согласно разработанных критериев постановки диагноза);
- отсутствие предыдущих курсов антигистаминных препаратов в течение 3 недель;
- на момент назначения левоцетиризина у всех пациентов отмечалось обострение атопического дерматита.
Так, у всех детей с тяжелым течением атопического дерматита (n = 14) отмечались распространенные эритематозно-сквамозные высыпания, лихенификация, трещины, множественные экскориации и геморрагические корочки. Наряду с этим у пациентов с тяжелым течением отмечался зуд различной интенсивности, который проявлялся как в дневное, так и ночное время, нарушая сон больного. Индекс SCORAD был равен 76,5 ± 11,3.
У пациентов со среднетяжелым течением атопического дерматита проявления атопического дерматита носили чаще локализованный характер с преимущественным поражением локтевых, коленных сгибов, реже голеностопных и лучезапястных суставов. При этом высыпания носили эритематозный характер, сопровождались сухостью с мелкопластинчатым шелушением и незначительным усилением кожного рисунка. Индекс SCORAD был равен 44,2 ± 3,4.
Оценка эффективности левоцетиризина осуществлялась врачом на 0, 3, 7 и 14-й дни использования препарата.
Читайте также:
- Влияние гормонов на желудок. Оценка эндокринных влияний на желудок
- Побочные эффекты декомпрессии организма. Образование эмболов при декомпрессии организма
- Удаление серной пробки. Воспалительные заболевания наружного слухового прохода
- Гипоспадия у мальчиков. Диагностика и лечение
- Диагностика задержки внутриутробного развития плода. Ведение задержки внутриутробного развития плода.
