Скорость диффузии. Закон Фика. Принципы облегченной диффузии.
Добавил пользователь Владимир З. Обновлено: 18.01.2026
Диффузия - процесс самопроизвольного выравнивания концентрации молекул, ионов, кол.частиц под влиянием их теплового или броуновского движения. Диффузия является макроскопическим проявлением теплового движения и поэтому идет тем быстрее, чем выше температура. Явление диффузии необратимо, она протекает до полного выравнивания концентраций, так как хаотическому распределению частиц отвечает максимальная энтропия системы.
где dm - изменение количества вещества (масса вещества, переносимого путем диффузии); dx dc - градиент концентраций в направлении x; dS - площадь поперечного сечения, через которое диффундирует вещество; dτ - продолжительность диффузии; D - коэффициент диффузии (коэффициент пропорциональности).
Математическое выражение коэффициента диффузии. Анализ уравнения.
Коэффициент диффузии численно равен количеству вещества, пере- носимого путем диффузии в направлении x при градиенте концентрации dx dc = 1, через сечение в 1 единицу площади за 1 единицу времени. Коэф- фициент диффузии имеет размерность м2 /c. Концентрация в уравнениях (1) и (2) измеряется в кг/м3 или моль/м3 . Знак (-) в уравнении (1) позволяет выразить массу вещества, переносимого путем диффузии, в виде положи- тельного числа, так как градиент концентраций - это величина отрица- тельная (движение веществ осуществляется в направлении уменьшения концентрации). Коэффициент диффузии может быть рассчитан по уравнению Стокса- Эйнштейна:
R - универсальная газовая постоянная (8,314 Дж/(моль·К)); Т - температура; NA - число Авогадро; η - коэффициент динамической вязкости среды, в которой происходит диффузия; r - радиус диффундирующих частиц.
Таким образом, коэффициент диффузии зависит от природы диффундирующего вещества (размера частиц), от природы среды, в которой осуществляется диффузия (вязкости среды) и от температуры. Коэффициент диффузии увеличивается с ростом температуры и снижается с увеличением размера диффундирующих частиц и с повышением вязкости среды.
Значение диффузии в биологических процессах.
Диффузия играет важную роль в процессах жизнедеятельности клеток и тканей животных и растений (например, Диффузия кислорода из лёгких в кровь и из крови в ткани, всасывание продуктов пищеварения из кишечника, поглощение элементов минерального питания клетками корневых волосков, диффузия ионов при генерировании биоэлектрических импульсов нервными и мышечными клетками). Различная скорость диффузии ионов через клеточные мембраны — один из физических факторов, влияющих на избирательное накопление элементов в клетках организма.
Значение диффузии в биологических процессах:
-скорость обмена веществ зависит как от скорости реакций обмена веществ, так от скорости движения реагирующих веществ движение реагирующих веществ в клетках и межклеточном веществе обусловлено диффузией скорость движения реагирующих веществ в клетках и межклеточном веществе определяется скоростью диффузии
-питательные вещества и продукты обмена в межклеточном веществе и в клетках перемещаются путем диффузии
-диффузия лежит в основе пассивного транспорта веществ через клеточные мембраны
различают простую диффузию, ограниченную диффузию, облегченную диффузию облегченная диффузия служит для транспорта крупных ионов и молекул или молекул жиронерастворимых веществ для них из-за большого размера транспорт через клеточные поры невозможен путь транспорта - через мембрану белками-переносчиками(транслоказами)
Сущность пассивного транспорта веществ, облегченной диффузии, активного транспорта.
Различают активный и пассивный перенос (транспорт) нейтральных молекул и ионов через биомембраны. Активный транспорт - происходит при затрате энергии за счет гидролиза АТФ или переноса протона по дыхательной цепи митохондрий. Пассивный транспорт не связан с затратой клеткой химической энергии: он осуществляется в результате диффузии веществ в сторону меньшего электрохимического потенциала. Примером активного транспорта может служить перенос ионов калия и натрия через цитоплазматические мембраны К - внутрь клетки, а Na - из нее, перенос кальция через саркоплазматического ретикулума скелетных и сердечных мышц внутрь везикул ретикулума, перенос ионов водорода через мембраны митохондрий из матрикса - наружу: все эти процессы происходят за счет энергии гидролиза АТФ и осуществляются особыми ферментами - транспортными АТФ-фазами. Наиболее известный пример пассивного транспорта - это движение ионов и калия через цитоплазматическую мембрану нервных волокон при распространении потенциала действия.
При облегченной диффузии вещества переносятся через мембрану также по градиенту концентрации, но с помощью специальных трансмембранных белков-переносчиков (транслоказ). Белок-переносчик имеет центр связывания, комплементарный переносимому веществу, поэтому для облегченной диффузии, в отличие от простой, характерна высокая избирательность: для каждого вещества или группы сходных веществ имеется свой переносчик.
Отличия облегченной диффузии от простой:
1) перенос ионов с участием переносчика происходит значительно быстрее по сравнению со свободной диффузией;
2) облегченная диффузия обладает свойством насыщения - при увеличении концентрации с одной стороны мембраны плотность потока вещества возрастает лишь до некоторого предела, когда все молекулы переносчика уже заняты;
3) при облегченной диффузии наблюдается конкуренция переносимых веществ в тех случаях, когда одним переносчиком переносятся разные вещества и при этом одни вещества переносятся лучше, чем другие, и добавление одних веществ затрудняет транспорт других;
4) есть вещества, блокирующие облегченную диффузию, они образуют прочный комплекс с молекулами переносчика, препятствуя дальнейшему переносу.
ДИФФУЗИЯ. ЗАКОН ФИКА
Движущей силой диффузии является градиент концентрации или степень невыравненности концентрации, т.е. изменение концентрации, приходящееся на единицу расстояния. Диффузия заканчивается с наступлением равновесия, для которого характерно равномерное распределение частиц по всему объему системы. Явление диффузии универсально, происходит и в истинных, и в кол.р-рах. Различие между этими растворами количественное, в скорости диффузии из-за размеров частиц.
Скорость диффузии выражается законом Фика , где m-количество (моль) продиффундировавшего вещества; t - продолжительность диффузии; S - площадь сечения сосуда, через который протекает диффузия; dc/dx - градиент концентрации; D - коэффициент диффузии, зависящий от свойств диффундирующих частиц и среды. Знак - поставлен потому, что градиент концентрации имеет отрицательное значение, т.е. диффузия протекает в направлении уменьшения концентрации. - скорость диффузии, или поток диффузии, выражает количество вещества, диффундирующего в единицу времени через единичную площадь, пропорциональна градиенту концентрации. D - коэффициент пропорциональности. Физический смысл D легко понять переписав уравнение в виде и приняв =1; S=1; t=1, тогда dm численно равно D. D - количество вещества, диффундирующего через единичную площадь сечения, за единицу времени при единичном градиенте концентрации. D называют удельной скоростью диффузии.
Эйнштейн (1908) вывел уравнение, связывающее D, абс. Температуру системы Т, вязкость среды h, радиус частиц дисп. фазы
Коэффициент диффузии прямо пропорционален Т, обратно пропорцианаленh и r 3 . Поскольку размеры кол.частиц велики, по сравнению с размерами молекул, постольку диффузия в кол.р-рах протекает медленно.
Зная D, используя уравнение Эйнштейна можно определить размеры кол.чатиц. Рассчитав радиус частиц, можно вычислить молярную массу вещества
М=4/3pr 3 rN. Перрен и Герцог, определив коэффициент диффузии в водных растворах, вычислили молярные массы некоторых углеводов, допустив, что их молекулы имеют сферическую форму.
Все экспериментальные методы определения коэффициента диффузии основаны на том, что раствор диффундирующего вещества приводят в контакт с растворителем, чтобы между ними образовалась четкая граница раздела. Систему выдерживают некоторое время при постоянной температуре и отсутствии внешних воздействий. Затем изучают наступившее в результате диффузии новое распределение концентрации растворенного вещества. Затем с помощью специальных таблиц вычисляют коэффициент диффузии.
Скорость диффузии
Диффузия относится к наиболее простым явлениям, которые изучаются в рамках курса физики. Этот процесс можно представить на бытовом ежедневном уровне.
Диффузия представляет собой физический процесс взаимного проникновения атомов и молекул одного вещества между такими же структурными элементами другого вещества. Итогом этого процесса становится выравнивание уровня концентрации в проникающих соединениях. Диффузию или смешивание можно видеть каждое утро на собственной кухне, когда происходит приготовление чая, кофе или иных напитков, в состав которых входит несколько основных компонентов.
Подобный процесс первый раз смог научно описать Адольф Фик в середине 19 века. Он дал ему оригинальное название, которое переводится с латинского языка как взаимодействие или распространение.
Скорость диффузии зависит от нескольких факторов:
- температуры тела;
- агрегатного состояния исследуемого вещества.
В различных газах, где существуют очень большие расстояние между молекулами, скорость диффузии будет самой большой. В жидкостях, где расстояние между молекулами заметно меньше, скорость также уменьшает свои показатели. Самая маленькая скорость диффузии отмечается в твердых телах, поскольку в молекулярных связях наблюдается строгий порядок. Атомы и молекулы сами совершают незначительные колебательные движения на одном месте. Скорость протекания диффузии увеличивается при росте окружающей температуры.
Закон Фика
Скорость диффузии принято измерять количеством вещества, которое переносится за единицу времени. Все взаимодействия должны осуществляться через площадь поперечного сечения раствора.
Основной формулой скорости диффузии является:
- $D$ - это коэффициент пропорциональности,
- $S$ - площадь поверхности, а знак «-» обозначает, что диффузия идет из области большей концентрации в меньшую.
Готовые работы на аналогичную тему
Такую формулу представил в виде математического описания Фик.
Согласно ей, скорость диффузии прямо пропорциональна градиенту концентрации и площади, через которую осуществляется процесс диффузии. Коэффициент пропорциональности определяет диффузию вещества.
Известный физик Альберт Эйнштейн вывел уравнения для коэффициента диффузии:
$D=RT/NA \cdot 1/6\pi\etaŋr$, где:
- $R$- это универсальная газовая постоянная,
- $T$- абсолютная температура,
- $r$- радиус диффундирующих частиц,
- $D$- коэффициент диффузии,
- $ŋ$- вязкость среды.
Из этих уравнений следует, что скорость диффузии будет возрастать:
- при повышении температуры;
- при повышении градиента концентрации.
Скорость диффузии уменьшается:
- при увеличении вязкости растворителя;
- при увеличении размера диффундирующих частиц.
Если молярная масса увеличивается, тогда коэффициент диффузии уменьшается. В этом случае скорость диффузии также уменьшается.
Ускорение диффузии
Существуют различные условия, которые способствуют ускорению протекания диффузии. Быстрота диффузии зависит от агрегатного состояния исследуемого вещества. Большая плотность материала замедляет химическую реакцию. На скорость взаимодействия молекул влияет температурный режим. Количественной характеристикой скорости диффузии является коэффициент. В системе измерений СИ его обозначают в виде латинской большой буквы D. Он измеряется в квадратных сантиметрах или метрах на секунду времени.
Коэффициент диффузии равняется количеству вещества, которое распределяется среди другого вещества через определенную единицу поверхности. Взаимодействие должно осуществляться на протяжении единицы времени. Для эффектного решения задачи необходимо добиться условия, когда разность плотностей на обеих поверхностях будет равна единице.
Также на скорость диффузии в твердых телах, жидкости в газах влияет давление и излучение. Излучение может быть разных видов, в том числе индукционное, а также высокочастотное. Диффузия начинается при воздействии определенного вещества-катализатора. Они часто выступают в роли пускового механизма для возникновения стабильного процесса рассеивания частиц.
При помощи уравнения Аррениуса описывают зависимость коэффициента от температуры. Оно выглядит следующим образом:
$D = D0exp(-E/TR)$, где:
- $Т$ - абсолютная температура, которая измеряется в Кельвинах,
- $E$ - минимально необходимая для диффузии энергия.
Формула позволяет больше понять о характерных чертах всего процесса диффузии и определяет скорость реакции.
Специальные методы диффузии
Сегодня практически нельзя применить обычные методы для определения молекулярного веса белков. Они обычно основаны на измерении:
- упругости пара;
- повышения температуры кипения;
- понижения температуры замерзания растворов.
Для эффективного решения задачи применяются специальные методы, которые разработаны для исследования веществ с высокой молекулярной структурой. Они предполагают определение скорости диффузии или вязкости растворов.
Метод определения ориентации и формы пор по скорости диффузии основан на исследовании скоростей диализа. В мембране должна происходить в этот момент свободная диффузия.
Также для определения скорости диффузии натрия могут применяться различные радиоизотопы. Такой специальный метод применяется для решения поставленных задач в сфере минералогии и геологии.
Активно применяется метод диффузии, который основан на определении диффузии макромолекул в растворе. Он был разработан для полимерных материалов. Согласно методу, идет определение коэффициента диффузии, а затем по этим данным узнают среднемассовую молекулярную массу.
В настоящее время отсутствуют прямые методы определения скорости диффузии водорода в катализаторе. Для этого используется так называемый второй путь активации.
Для определения скорости принято использовать специальные приборы. Они отличаются по виду от поставленных практических и научных задач.
Диффузия. Закон Фика. Коэффициент диффузии.
Диффу́зия-процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму.
Перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией.
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной)
первый закон Фика :показывает, что плотность потока вещества J ( ) пропорциональна коэффициенту диффузии D ( ) и градиенту концентрации
второй закон Фика:Коэффициент диффузии D зависит от температуры
Билет N18
1.Стоячая волна — колебания в распределённых колебательных системах с характерным расположением чередующихся максимумов (пучностей) и минимумов (узлов) амплитуды. Практически такая волна возникает при отражениях от преград и неоднородностей в результате наложения отражённой волны на падающую. При этом крайне важное значение имеет частота, фаза и коэффициент затухания волны в месте отражения.
Примерами стоячей волны могут служить колебания струны, колебания воздуха в органной трубе; в природе — волны Шумана.
В одномерном случае две волны одинаковой частоты, длины волны и амплитуды, распространяющиеся в противоположных направлениях (например, навстречу друг другу), будут взаимодействовать, в результате чего может возникнуть стоячая волна. Например, гармоничная волна, распространяясь вправо, достигая конца струны, производит стоячую волну. Волна, что отражается от конца, должна иметь такую же амплитуду и частоту, как и падающая волна.
Рассмотрим падающую и отраженную волны в виде:
где y0 -амплитуда волн, w -циклическая (угловая) частота, измеряемая в радианах в секунду,
k -волновой вектор, измеряется в радианах на метр, и рассчитывается как 2π поделённое на длину волны,
Поэтому результирующее уравнение для стоячей волны y будет в виде суммы y1 и y2:
В случае гармонических колебаний в одномерной среде стоячая волна описывается формулой:
где u — возмущения в точке х в момент времени t, u0 — амплитуда стоячей волны, w— частота , k — волновой вектор, — ϕ фаза.
2. Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой. Для одного моля газа Ван-дер-Ваальса оно имеет вид:
Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня, т.е. изобара Р = const пересекает кривую Р = Р(V) в одной или трех точках, как это изображено на рисунке. Причем с повышением температуры мы перейдем от немонотонной зависимости Р = Р(V) к монотонной однозначной функции. Изотерма при Ткр, которая разделяет немонотонные T < Tкр и монотонные T >Ткр изотермы, соответствует изотерме при критической температуре. При температуре выше критической зависимость Р = Р(V) является однозначной монотонной функцией объема. Это означает, что при T > Ткр вещество находится только в одном, газообразном состоянии, как это имело место у идеального газа. При температуре газа ниже критической такая однозначность исчезает, а это означает возможность перехода вещества из газообразного в жидкое и наоборот. На участке АСВ изотермы Т1 давление растет с увеличением объема (dP/dV) > 0. Данное состояние неустойчиво, поскольку здесь должны усиливаться малейшие флуктуации плотности. Поэтому область ВСА не может устойчиво существовать. В областях DLB и AGE давление падает с увеличением объема (dP/dV)Т < 0 - это необходимое, но не достаточное условие устойчивого равновесия. Эксперимент показывает, что система переходит из области устойчивых состояний GE (газ) в область устойчивых состояний LD (жидкость) через двухфазное состояние (газ - жидкость) GL вдоль горизонтальной изотермы GCL.
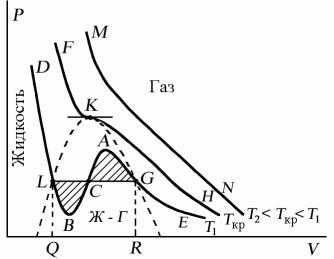
При квазистатическом сжатии, начиная с точки G, система распадается на 2 фазы - жидкость и газ, причем плотности жидкости и газа остаются при сжатии неизменными и равными их значениям в точках L и G соответственно. При сжатии количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе - увеличивается, пока не будет достигнута точка L, в которой все вещество перейдет в жидкое состояние.
Наличие критической точки на изотерме Ван-дер-Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. Критическую точку K мы определили как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна
Билет N19
1. Эффе́кт До́плера — изменение частоты и длины волн, регистрируемых приёмником, вызванное движением их источника и/или движением приёмника.Эффект Доплера применим не только для звука но и для световых волн.
; где ν-воспринимаемая приемником; ν0-частота звука
(приемника )=0 =ƛ/ ν* ν0
2. Внутренняя энергия реального газа будем определяться суммой кинетической энергии Eк теплового движения его молекул и потенциальной энергии взаимодействия молекул между собой - Eп:
Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие последних приводит к возникновению внутреннего давления p' на газ.Внутреняя энергия равна const.Следовательно -Eк= Eп - изменяя потенциальную энергию мы изменяем кинетическую, а следовательно и температуру.
Работа молекул газа против сил трения, в результате просачивания через перегородку, тратиться на изменение температуры газа. Охлаждение газа при расширении это положительный эффект Дж-Тм. Нагревание это отрицательный эффект.
Знак эффекта Дж-Тм зависит от того, какая из поправок играет большую роль в уравнении Вандервальса. Для одного и того же газа в зависимости от T и P может играть большую роль поправка А или В.Существуют такие параметры при которых роль поправок одинакова или такое состояние называется точки инверсии.
Билет N20
Об этом полезно знать:
Туристские маршруты и их типы В любом случае путешествия (пребывания, поездки, туры) проводят по заранее выбранным маршрутам и они имеют определенную.
Соотношение понятий «источник права» и «форма права» Понятия "форма права" и "источник права" тесно взаимосвязаны, но не совпадают.
ГЛАВА 9. АНАЛИЗ ФИНАНСОВОГО СОСТОЯНИЯ ПРЕДПРИЯТИЯ 9.1. Значение и задачи анализа финансового состояния Предприятия В условиях рыночных отношений исключительно велика роль анализа.
Правомерное поведение: понятие, признаки и виды Человеческое поведение - это психофизическая активность человека, направленная на взаимодействие с другими людьми и окружающей средой.
Что такое ТРА станции? Основные разделы ТРА станции? ТРА (техническо-распорядительный акт станции) Обязательно должны быть согласован со структурными подразделениями (ПЧ.
Диффузия: причины, особенности процесса, примеры в природе

Само слово «диффузия» латинского происхождения - «diffusio» в переводе с латыни означает «распространение, рассеивание». В физике под диффузией подразумевается процесс взаимопроникновения микрочастиц при соприкосновении разных материалов. Академическое определение того, что такое диффузия, звучит следующим образом: «Диффузия - это взаимное проникновение молекул одного вещества в межмолекулярные промежутки другого вещества вследствие их хаотичного движения и столкновения друг с другом». Какие свойства диффузии, причины ее возникновения, как проявляется этот процесс в разных веществах, об этом читайте далее.
Причины
Причиной возникновения диффузии является тепловое движение частиц (атомов, молекул, ионов и т. д.).
Чтобы более детально понять, как работают механизмы диффузии, рассмотрим это явление на конкретном примере. Если взять перманганат калия (в народе более известен как марганцовка) (KMnO4) и растворить в воде (H2O), то марганцовка в результате диссоциации распадется на K+ и MnO4-. Также важно заметить что молекула воды поляризирована и существует в виде сцепленных ионов H+ - OH-.
Из-за растворения марганцовки в воде произойдет хаотическое перемещение ионов обоих веществ, вследствие чего сцепленные ионы воды поменяют свой цвет и освободят место для других, еще не реагировавших ионов. Вода поменяет свой окрас и получит специфические свойства. Между водой и марганцовкой совершится диффузия.
Вот так этот процесс выглядит схематически.
Причем движимые частицы во время диффузии, всегда распространяются равномерно по всему предоставленному объему. Сам процесс диффузии занимает определенное время.
Также важно знать, что явление диффузии происходит далеко не со всеми веществами. Например, если воду перемешать не с марганцовкой, а с маслом, то диффузии между ними не будет, так как молекулы масла электрически нейтральны. Образованию какого-то соединения с молекулами воды помешают сильные связи внутри молекулы масла.
Еще стоит заметить, что скорость диффузии значительно увеличится при увеличении температуры, что вполне логично, ведь с увеличением температуры возрастет скорость движения частиц внутри вещества и как следствие, повышается шанс их проникновения в молекулы другого вещества.
Формула
Процесс диффузии в двухкомпонентной системе записывается при помощи закона Фика, и соответствующего уравнения:
В этом уравнении J - плотность материала, D - коэффициент диффузии, а ac/dx - градиент концентрации двух веществ.
Коэффициентом диффузии называют физическую величину, которая численно равна количеству диффундирующего вещества, которое проникает за единицу времени через единицу поверхности, если разность плотностей на двух поверхностях, находящихся на расстоянии равном единице длины, равна единице. Важно заметить, что коэффициент диффузии зависит от температуры.
В твердых телах
В твердых телах диффузия происходит очень медленно, если вообще происходит. Ведь для твердых тел характерно наличие кристаллической решетки, а все частицы расположены упорядочено.
Примером диффузии твердых тел может быть золото и свинец. Расположенные на расстояние 1 метра друг от друга, при комнатной температуре в 20 С, эти вещества будут понемногу проникать друг в друга, но будет это все идти очень медленно, подобная диффузия станет заметной не ранее чем через 4-5 лет.

В жидкостях
Скорость протекания диффузии в жидкостях в разы выше, нежели в твердых телах. Связи между частицами в жидкости гораздо слабее (обычно их энергии хватает максимум на образование капель), и взаимному проникновению частиц в молекулы двух веществ ничто не мешает.
Правда то, как быстро будет проходить диффузия, зависит от характера и консистенции жидкостей, в более густых растворах она происходит медленнее, ведь чем гуще жидкость, тем более сильные в ней связи между молекулами и тем труднее молекулам и частицам проникать друг в друга. Например, смешивание двух жидких металлов может занять несколько часов, в то время как смешивание воды и марганцовки (из примера выше) осуществляется за минуту.

В газах
В газах диффузия происходит еще быстрее, чем в жидкости, связи между частицами газообразных веществ практически отсутствуют, и никак не сцепленные частицы легко перемешиваются друг с другом, проникая в молекулы других газов. Небольшие коррективы при диффузии газов может вносить разве только гравитация.
Примеры в окружающем мире
- поддерживается однородный состав атмосферного воздуха вблизи поверхности нашей планеты,
- происходит питание растений,
- осуществляется дыхание человека и животных.
Значимый биологический процесс - фотосинтез осуществляется, в том числе и при помощи диффузии: как мы знаем, благодаря энергии солнечного света вода разлагается хлорофиллами на составляющие, кислород, который выделяется при этом, попадает в атмосферу и поглощается всеми живыми организмами. Так вот, и сам процесс поглощения кислорода человеком и животными, и обмен веществ у растений, все это поддерживается диффузией, без которой не могла бы существовать сама Жизнь.
Но это в глобальном плане, в более простых вещах, мы можем наблюдать диффузию:
- В саду, где цветы источают свой аромат благодаря диффузии (их частицы перемешиваются с частицами окружающего воздуха).
- Растворяя сахар в чае или кофе, чай или кофе становится сладким благодаря диффузии.
- При резке лука у вас начнут слезиться глаза, происходит это тоже по причине диффузии, молекулы лука смешиваются с молекулами воздуха и ваши глаза на это реагируют.
Таких примером можно приводить еще много.
Видео
И в завершение образовательное видео по теме нашей статьи.
Автор: Павел Чайка, главный редактор журнала Познавайка
Читайте также:
- Взаимосвязь глаз и мозга. Выявление внутричерепной опухоли по глазам
- Гипоэхогенные изменения стенки сосудов. Гипоэхогенные изменения просвета сосудов.
- Лимфатическая система и лимфатические узлы шеи
- Собеседование психиатра с детьми. Условия собеседования с детьми
- Синдром Кальве-Легга-Пертеса (Calve-Legg-Perthes)
