Случай использования гиалуроната натрия в консервативном лечении синдрома сдавления (импиджмент-синдром)
Добавил пользователь Владимир З. Обновлено: 01.02.2026
На сегодняшний день поиск оптимальных подходов к консервативному лечению пациентов с остеоартрозом является актуальной проблемой. Это объясняется распространенностью, полиэтиологичностью заболевания, а также увеличением частоты встречаемости остеоартроза
Abstract. To date, the search for optimal approaches to the conservative treatment of patients with osteoarthritis (OA) is an urgent problem. This is due to the prevalence, multifactorial of the disease, as well as an increase in the incidence of OA among young patients. In the early stages of the disease, as well as in the treatment of young patients, doctors prefer to choose the non-surgical treatment. In OA, the most vulnerable structure of the joint is hyaline cartilage. In degenerative-dystrophic diseases, it becomes thinner, and the synovial fluid in OA tends to lose its elastic properties. To reduce the load on the articular cartilage, ?prostheses? of synovial fluid - hyaluronic acid (HA) are actively used. HA is a natural component of synovial fluid, it serves as a lubricant for articular surfaces and provides a number of protective and regulatory effects. The HA injected from the outside takes on the load, compensating for the lost properties of the joint's own synovial fluid. So GC drugs are able to quickly relieve pain and return activity to the patient. During treatment, the choice of the HA drug should depend on the phenotype, age, stage of the disease, concomitant somatic pathology, daily physical activity and individual needs of the patient. The doctor selects a HA drug of different molecular weight, structure and concentration. As a consequence, the number of injections per course of treatment may also vary. It is necessary to evaluate in more detail the criteria for selecting the GC drug to improve the quality of treatment and results in the long term. The analysis of the literature data devoted to the selection of GC drugs presented on the domestic market, depending on the stage of the disease and the age of the patient. For citation: Otvetchikova D. I., Ryabkov E. V. Criteria for choosing a hyaluronic acid preparation for intra-articular administration in patients of different ages with osteoarthritis of the knee joint // Lechaschi Vrach. 2022; 7-8 (25): 47-51. DOI: 10.51793/OS.2022.25.8.007
Резюме. На сегодняшний день поиск оптимальных подходов к консервативному лечению пациентов с остеоартрозом является актуальной проблемой. Это объясняется распространенностью, полиэтиологичностью заболевания, а также увеличением частоты встречаемости остеоартроза среди пациентов молодого возраста. На ранних этапах заболевания и при лечении молодых пациентов врачи склоняются к нехирургическому лечению. При остеоартрозе наиболее уязвимой структурой является суставной хрящ. При дегенеративно-дистрофических заболеваниях он истончается, а синовиальная жидкость при остеоартрозе имеет тенденцию терять свои эластичные свойства. Для снижения нагрузки на суставной хрящ, активации хондроцитов и синовиоцитов часто используют? протезы? синовиальной жидкости - гиалуроновую кислоту. Гиалуроновая кислота является натуральным компонентом синовиальной жидкости, она снижает трение суставных поверхностей и обеспечивает целый ряд защитных и регуляторных эффектов. Вводимая извне гиалуроновая кислота берет на себя нагрузку, компенсируя утраченные свойства собственной синовиальной жидкости сустава. Так, препараты гиалуроновой кислоты способны быстро купировать боль и вернуть активность пациенту. При лечении выбор препарата гиалуроновой кислоты должен зависеть от фенотипа, возраста, стадии заболевания, сопутствующей соматической патологии, ежедневной физической активности и индивидуальных потребностей пациента. Врач подбирает препарат гиалуроновой кислоты различной молекулярной массы, структуры и концентрации. Как следствие, количество инъекций на курс лечения также может меняться. Необходимо более подробно оценивать критерии подбора препарата гиалуроновой кислоты для улучшения качества лечения и результатов в отдаленном периоде. Проведен анализ литературных данных, посвященных подбору представленных на отечественном рынке препаратов гиалуроновой кислоты в зависимости от стадии заболевания и возраста пациента.
Артроз - деструктивно-дистрофическое заболевание, поражающее любой сустав человека, характеризуется длительным течением с тенденцией к обострению и прогрессированию. Патологический процесс при остеоартрозе (ОА) задействует весь сустав: суставной хрящ, субхондральную кость, связки, капсулу, синовиальную оболочку и периартикулярные ткани [1]. Все же основной суставной структурой, которая повреждается при данном заболевании, является гиалиновый хрящ. Согласно литературным данным, частота заболеваемости прогрессивно увеличивается в зависимости от возраста пациента: у лиц старше 50 лет процент его распространения составляет 27%, у людей старше 60 лет - 97%, а после 75 лет ОА диагностируется практически у всего населения [2]. Возникающие при ОА структурные изменения суставного хряща, костной ткани и синовиальной оболочки во многом обусловлены несбалансированной нагрузкой, которая может быть связана с избыточной массой тела, нестабильностью сустава при движении, плохой координацией деятельности соответствующих мышц. Согласно данным литературы, чаще всего страдают тазобедренные (42,7%) и коленные (34,3%) суставы [3]. Немаловажным фактором риска в этиологии развития ОА является наличие травмы сустава в анамнезе. Данные опубликованных в иностранной литературе исследований свидетельствуют о том, что рост популярности активного отдыха, развитие игровых и экстремальных видов спорта приводят к росту травматизации коленных суставов, связочного аппарата и других внутрисуставных структур. С этим и связывают увеличение частоты встречаемости ОА у пациентов молодого возраста. Изменение среднего возраста пациентов, подверженных данной патологии, заставляет ученых рассматривать новые варианты лечения ОА.
ОА коленного сустава (КС) - хроническое заболевание, приводящее к нарушению функции сустава у пациентов, значительному ухудшению качества жизни и высокому риску инвалидизации [3, 4].
По данным иностранной литературы медицинские расходы на лечение ОА в различных странах с высоким уровнем дохода оцениваются от 1% до 2,5% валового внутреннего продукта этих стран [5], при этом затраты на эндопротезирование тазобедренного и коленного суставов составляют основную долю этих трат в системе здравоохранения [6]. Так, по данным некоторых авторов, расходы на эндопротезирование коленного сустава превышают сумму более 460 миллиардов долларов в год. Поскольку ОА КС является прогрессирующим и сложным заболеванием, включающим метаболические, генетические и биомеханические факторы, в настоящее время не существует универсальных методов лечения. В то время как эндопротезирование КС предлагает эффективное решение для выраженного ОА у пожилых людей, опасения по поводу долговечности имплантата и ревизионной операции у пациентов молодого и среднего возраста с менее тяжелым ОА склоняют специалистов к выбору консервативного метода лечения для облегчения симптомов и поддержания функции сустава.
Клиническая картина ОА КС характеризуется жалобами на боль в пораженном суставе,? хруст?, ограничение объема движений, локальное повышение температуры кожных покровов, иногда - увеличение сустава в объеме. Все это негативно сказывается и на психоэмоциональном состоянии пациента. Задачи перед клиницистами всегда одинаковые: устранение причин, способствующих развитию патологического процесса, купирование воспаления, восстановление утраченных функций.
В настоящее время получили распространение множество нехирургических методов лечения пациентов с артрозом суставов, особенно на ранних стадиях заболевания. В литературе встречаются работы, описывающие долгосрочные клинические исследования, подтверждающие улучшение состояния пациентов с ОА при применении комплексного подхода: медикаментозной терапии, обеспечивающей адекватное обезболивание и купирующее воспалительные явления, индивидуально разработанной программы медицинской реабилитации, включающей физиотерапевтическое лечение и лечебную физкультуру, санаторно-курортное лечение [6, 7].
При ОА наиболее уязвимой структурой сустава является гиалиновый хрящ. При дегенеративно-дистрофических заболеваниях он истончается, а синовиальная жидкость при ОА имеет тенденцию терять свои эластичные свойства. В состав синовиальной жидкости входят молекулы гликозаминогликана, который обеспечивает ее вязкоупругие свойства. При ОА синовиальная жидкость подвергается дегенеративным изменениям, аналогично другим тканям сустава, - уменьшается ее количество и средняя молекулярная масса, что коррелирует с болью и функциональными нарушениями биомеханики [8].
На сегодняшний день приоритетным методом лечения воспалительно-дегенеративных заболеваний суставов считается использование «заместительных» внутрисуставных инъекций - введение аналога («протеза») суставной жидкости. Самым широко применяемым компонентом таких препаратов является гиалуроновая кислота (ГК), входящая в состав многочисленных средств, представленных на отечественном и зарубежном рынках [9].
Европейское общество клинических и экономических аспектов остеопороза и остеоартрита (ESCEO) опубликовало рекомендации и алгоритм лечения ОА КС с помощью внутрисуставного введения ГК в качестве второй линии для пациентов, у которых сохраняется симптоматика, несмотря на использование нестероидных противовоспалительных препаратов [10]. У пациентов с неудовлетворительным ответом или у тех, кто не может переносить немедикаментозную терапию, внутрисуставные инъекции представляют собой жизнеспособный вариант симптоматического лечения [8].
Препараты ГК — это, по сути, хондропротекторы, которые снижают износ суставной поверхности и препятствуют повреждению хрящевого матрикса. ГК имеет свойство к биодеградации [11].
Пациенту требуется повторное введение «протезов» синовиальной жидкости с определенной периодичностью, поэтому особое внимание врачи уделяют препаратам пролонгированного действия. Основной целью в лечении ОА является повышение качества жизни пациентов. Поэтому важно подобрать лучший препарат ГК в каждом клиническом случае в зависимости от возраста, активности и степени выраженности патологии у пациента. Очевидно, что особую важность при использовании стоит уделить индивидуальным характеристикам выбранного препарата ГК.
Существует множество опубликованных про- и ретроспективных исследований, доказывающих клиническую эффективность применения препаратов ГК у лиц с различными степенями ОА [12]. В том числе сравнение препаратов ГК с различными физико-химическими свойствами и молекулярной массой [13].
Доказанным эффектом при применении ГК является улучшение скольжения суставных поверхностей относительно друг друга, уменьшение или купирование боли при осевой нагрузке, защита хряща при ударной нагрузке во время интенсивных физических тренировок. Все это улучшает функцию пораженного сустава, и ежедневная активность пациента возрастает [14].
Также известно, что на клеточном уровне ГК обладает антипатогенным, анаболическим, противовоспалительным и антиноцицептивным действием. Действие гиалуронатов не может объясняться исключительно механическими причинами, поскольку процесс деградации препарата в суставе исчисляется днями, а эффект от внутрисуставной инъекции сохраняется несколько месяцев. Это говорит о патогенетическом действии ГК на клеточном и тканевом уровне [15, 16].
Опубликованы работы, клинически подтверждающие противовоспалительное действие ГК на биохимическом уровне: блокирование провоспалительных цитокинов, снижение продукции простагландина Е2 и брадикинина, ингибирование матриксных металлопротеиназ и аггреканаз. Так, фрагменты ГК, связываясь в месте повреждения с рецепторами CD44, RHAMM, LYVE-1, TLR2 и TLR4 иммунокомпетентных клеток (моноцитов, макрофагов, Т-лимфоцитов и др.), приводят к торможению синтеза провоспалительных цитокинов (макрофагальных воспалительных белков: МВБ-1a и МВБ-1b; интерлейкинов ИЛ-1b, ИЛ-6, ИЛ-17 и фактора некроза опухолей ФНО-α) [9, 17]. Структурно-модифицирующее действие ГК на соединительную ткань сустава обусловлено активированием факторов роста: трансформирующего (TGF-β) и фибробластного (FGF) [18, 19].
Доказано, что ГК снижает локальное воспаление, уменьшает активность матриксных протеиназ, участвующих в дегенерации хряща и субхондральной кости [17]. Кроме этого, экзогенная ГК стимулирует рецепторы хондроцитов (CD44 и RHAMM), а также toll-подобные рецепторы макрофагов и дендритных клеток, что усиливает выработку факторов роста, пролиферацию и дифференцировку хондроцитов, продукцию протеогликанов. Это комплексное действие обогащает эндогенную суставную жидкость и способствует ее синтезированию.
Следовательно, насыщение экзогенной ГК синовиальной жидкости позволяет не только снизить интенсивность боли и уменьшить тугоподвижность сустава, но и воздействовать непосредственно на патогенез заболевания, подавляя воспаление, замедляя деструкцию хряща, улучшая трофику ткани.
Новый препарат Флексотрон Плюс, представленный на отечественном рынке, относится к группе протезов синовиальной жидкости с концентрацией гиалуроната натрия 2%. Продукт изготовлен из японской субстанции SHISEIDO, что является редкой особенностью представленных на российском рынке препаратов ГК. Его молекулярный вес достигает 2-2,5 мДа. Форма выпуска - шприц 3 мл, а значит, за одну инъекцию пациент получает большее количество действующего вещества (60 мг вместо 30 мг), чем у ранее изученного препарата Ферматрон Плюс, обладающего схожими биологическими свойствами. Доказано, что для эффективного лечения пациентам необходимо получить дозу препарата, эквивалентную 20-30 мг гиалуроната натрия, частотой 1 раз в неделю, курсом 3-5 инъекций. То есть минимальная терапевтическая концентрация действующего вещества кратна 80 мг [20]. Флексотрон Плюс позволяет достичь этой концентрации за меньший по длительности курс лечения (пациенту требуется всего 2 внутрисуставные инъекции).
То есть для достижения оптимального терапевтического эффекта у пациентов разных возрастных групп потребуется меньшая кратность введения, что уменьшит количество визитов к врачу. Препарат оптимален для снижения нагрузки на травмированный сустав, улучшает свойства собственной синовиальной жидкости и рекомендован в том числе к применению у пациентов раннего послеоперационного периода.
Выводы
Таким образом, результаты анализа литературных данных демонстрируют высокий уровень эффективности и безопасности внутрисуставного введения протезов синовиальной жидкости с разной концентрацией ГК. Эти препараты обладают оптимальным набором характеристик и позволяют достичь максимального терапевтического эффекта в лечении ОА КС, позволяют отсрочить или вовсе избежать эндопротезирования КС. Необходимо отметить, что для достижения лучших результатов лечения препарат должен подбираться специалистом строго индивидуально, а количество представленных на рынке Российской Федерации препаратов позволяет это сделать.
Выбор препарата будет зависеть от степени ОА, клинической картины и прогнозов заболевания у конкретного пациента, возраста, активности и других фенотипических особенностей. Для пациентов старшей возрастной группы, ведущих малоподвижный образ жизни, основной целью являются отсутствие боли при передвижении на небольшие дистанции и улучшение самообслуживания в быту, им больше подойдут препараты с низкой и средней концентрацией ГК. А 3-5-кратное введение пролонгирует терапевтический эффект, увеличит выработку эндогенной ГК, будет способствовать эффективному и продолжительному купированию болевого синдрома. Для пациентов молодого возраста, испытывающих потребность в интенсивной физической нагрузке, а также на начальных стадиях ОА предпочтительнее применять протезы синовиальной жидкости с высокой концентрацией ГК, что приведет к уменьшению кратности внутрисуставных инъекций.
Также важно учитывать кратность введения того или иного медицинского изделия. Динамическое наблюдение за пациентами с ОА КС, получавшими инъекции ГК, сможет определить долгосрочный эффект от лечения, установить четкую взаимосвязь подбора препарата ГК с учетом индивидуальных особенностей и потребностей каждого пациента, а также оптимизировать подход к лечению ОА КС.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
Федеральное государственное бюджетное учреждение Национальный медицинский исследовательский центр реабилитации и курортологии Министерства здравоохранения Российской Федерации; 121099, Россия, Москва, Новый Арбат, 32
Сведения об авторах:
Information about the authors:
Критерии выбора препарата гиалуроновой кислоты для внутрисуставного введения пациентам разного возраста при остеоартрозе коленного сустава/ Д. И. Ответчикова, Е. Н. Рябков
Для цитирования: Ответчикова Д. И., Рябков Е. Н. Критерии выбора препарата гиалуроновой кислоты для внутрисуставного введения пациентам разного возраста при остеоартрозе коленного сустав// Лечащий Врач. 2022; 7-8 (25): 47-51. DOI: 10.51793/OS.2022.25.8.007
Теги: гонартроз, синовиальная жидкость, боль, консервативное лечение
Случай использования гиалуроната натрия в консервативном лечении синдрома сдавления (импиджмент-синдром)
В поликлинику г. Москва обратился пациент 38 лет с жалобами на частые "ноющие" боли в левом плечевом суставе при движениях.
Жалобы
Боль локализуется в верхней части плечевого сустава, усиливается при отведении руки вверх. Особенно она усиливается при заведении руки за голову и при вращательных движениях в суставе. Характер боли всегда ноющий, притупленный. Периодически пациент отмечает жалобы на чувство дискомфорта в ночное время (с его слов, трудно найти положение для комфортного сна).
В основном, боль усиливается к концу рабочего дня и после спортивных нагрузок (плавание). Утром после сна пациент отмечает отсутствие болевых ощущений.
Анамнез
Со слов пациента, данные жалобы беспокоят его примерно два года. Травмы в анамнезе отрицает. Впервые боли стали беспокоить после очередной спортивной нагрузки. Самостоятельно использовал местно нестероидный противовоспалительный гель (НПВС) по 3 раза в день, на фоне которого отмечал слабоположительный временный эффект. Обращался к врачу-хирургу по месту жительства, был проведён курс физиотерапии и блокад с использованием кортикостероидов. На фоне проведённого лечения отметил стойкий положительный эффект, но спустя год жалобы появились вновь, более обострённо. Курс физиотерапии и местного использования НПВС эффекта не оказал, в связи с чем обратился в поликлинику.
Аллергий на медикаменты ранее не отмечал. Хронические заболевания: гипертоническая болезнь I степени, риск 1.
Обследование
На момент осмотра пациента положение активное. Ортопедические изделия не использует. Кожные покровы физиологической окраски, без высыпаний и повреждений. Визуально отёков и деформаций не выявлено. При пальпации определяется умеренная крепитация в проекции субакромиального пространства, усиливающаяся при ротации левой верхней конечности. Симптом "болевой дуги" слабоположительный с 110 градусов. Симптомы O'Brian, Jobe, "падающей капли", "предчувствия" отрицательные. Убедительных клинических данных о повреждении манжеты не выявлено. Нейро-сосудистых нарушений не обр.
По данным МРТ левого плечевого сустава был выявлен субакромиальный импиджмент, сдавление и дегенеративные изменения в структуре сухожилия надостной мышцы, умеренный бурсит. Повреждений структур вращательной манжеты и капсульно-связочного аппарата сустава обнаружено не было.
Диагноз
Лечение
С учётом временного эффекта от кортикостероидов пациенту назначен курс субакромиальных блокад с использованием препаратов гиалуроната натрия в концентрации 1%. Блокады выполнены из заднего доступа с периодичностью в одну неделю, общее количество инъекций — три. На время курса блокад спортивные нагрузки были снижены.
Через три недели после курса блокад был назначен курс лечебной физкультуры (ЛФК), направленный на постепенную разработку объёма движений в суставе. На фоне выполненных блокад пациент отметил стойкий положительный эффект в виде полного регресса болевого синдрома, чувства дискомфорта в ночное время суток, увеличения объёма движений в суставе.
Благодаря использованию препаратов гиалуроната натрия был достигнут стойкий терапевтический эффект. На контрольных осмотрах через 3, 6 и 12 месяцев после блокад пациент жалоб не предъявил, отметил снижение частоты возникновения чувства дискомфорта до полного регресса. Благодаря своевременному и постепенному курсу ЛФК достигнут полноценный объём движения в суставе.
Заключение
Данный случай показывает препарат гиалуроната натрия как препарат выбора при назначении курса субакромиальных блокад и возможность замены кортикостероидам при невозможности их использования (например, при сахарном диабете и т.п.).
Боль в области плечевого сустава является одной из наиболее частых причин обращения за медицинской помощью. Клиницисту необходимо выделять наиболее частые формы поражения плеча: тендиниты/миозиты мышц вращательной манжеты, импиджмент-синдром, адгезивный капсулит, бурсит. Опыт применения гиалуронатов у этой категории больных весьма ограничен, клинические рекомендации и общепринятые подходы в лечении отсутствуют.
Цель исследования: оценить эффективность и безопасность внутрисуставного применения гиалуроната натрия при патологии вращательной манжеты плечевого сустава.
Материал и методы: проведен ретроспективный анализ 27 больных (11 мужчин и 16 женщин) с верифицированным диагнозом «импиджмент-синдром плеча». Пациенты, имевшие артрит плечевого сустава или предшествующую травму, разрыв вращательной манжеты или адгезивный капсулит, исключались. Средний возраст составил 52,8±10,5 года. Все пациенты получали 3 внутрисуставные инъекции 2 мл 1% гиалуроната натрия в плечевой сустав еженедельно: 1-я группа — в виде монотерапии, 2-я группа получала дополнительно однократно инъекцию бетаметазона 7 мг/1 мл в субакромиальную сумку. В течение 2,5 мес. наблюдения оценивались: боль по визуальной аналоговой шкале (ВАШ, мм); объем активных движений в суставе (градусы), потребность в нестероидных противовоспалительных препаратах (НПВП).
Результаты исследования: исходно у пациентов 2-й группы интенсивность боли была выше (84,3±8,6) в сравнении с 1-й группой — 71,2±10,2 (р=0,004) и меньше объем активных движений — 79,5±8,2 и 88,5±11,8 соответственно (р=0,059). Обе лечебные стратегии были высокоэффективны. В обеих группах не было различий через 6 и 10 нед.: боль по ВАШ — 24,6±7,6 и 18,1±8,9 (р=0,194), 18,2±8,2 и 15,6±8,5 (р=0,527); объем движений — 128,3±16,4 и 139,2±9,2 (р=0,059), 142,6±16,0 и 145,2±8,7 (р=0,527) соответственно. На фоне лечения гиалуроновой кислотой (ГК) отказались полностью от лечения или снизили дозировку НПВП 4 (22,2%) и 12 (66,7%) пациентов соответственно.
Заключение: внутрисуставное введение препаратов ГК — эффективный и безопасный метод в комплексном лечении патологии вращательной манжеты плеча. Составляющей применения ГК является отсутствие метаболических эффектов, что чрезвычайно важно для коморбидных пациентов.
Ключевые слова: гиалуроновая кислота, гиалуронат, вращательная манжета, импиджмент-синдром, плечо, Ферматрон.
Clinical aspects in the treatment of rotator cuff disorders with hyaluronic acid
P.A. Shesternya, D.V. Yurin
Krasnoyarsk State Medical University named after Prof. V.F. Voino-Yasenetsky, Krasnoyarsk
Pain in the shoulder region is one of the most common causes of health encounter. The clinician needs to identify the most common forms of shoulder lesions: tendinitis/myositis of the rotator cuff muscles, impingement-syndrome, adhesive capsulitis, bursitis. Experience with the use of hyaluronates in this category of patients is quite limited, clinical recommendations and generally accepted approaches to treatment are lacking.
Aim: to evaluate the efficacy and safety of intra-articular injections of sodium hyaluronate in the rotator cuff disorders.
Patients and Methods: a retrospective analysis of 27 patients (11 men and 16 women) with verified diagnosis impingement-syndrome of the shoulder. Patients who had arthritis of the shoulder joint or previous injury, rotator cuff tear or adhesive capsulitis were excluded. The average age was 52.8±10.5 years. All patients received three intra-articular injections of 2 ml —1% sodium hyaluronate in the shoulder joint weekly: group 1 — monotherapy, group 2 — advanced single injection of betamethasone 7 mg/1 ml in the subacromial bursa. Within 2.5 months follow-up pain on a visual analogue scale (VAS); the active range of motion (ROM) and requirement of non-steroidal anti-inflammatory drugs (NSAIDs) were assessed.
Results: initially patients of group 2 had higher pain intensity in comparison with group 1 — 84.3±8.6 vs 71.2±10.2 (p=0.004) and lower ROM — 79.5±8.2 vs 88.5±11.8 (p=0.059), respectively. Both treatment strategies were high effective. Groups 1 and 2 did not differ after 6 and 10 weeks: pain scale were 24.6±7.6 vs 18.1±8.9 (p=0,194) and 18.2±8.2 vs 15.6±8.5 (p=0,527); range of motion — 128.3±16.4 vs 139.2±9.2 (p=0.059) and 142.6±16.0 vs 145.2±8.7 (p=0.527), respectively. There were 4 (22.2%) patients refused and 12 (66.7%) reduced dosage of NSAID in the group 1, received injection of hyaluronate only.
Conclusion: intra-articular administration of sodium hyaluronate is an effective and safe treatment strategy of the rotator cuff disorders. An important component of the hyaluronate application is the lack of metabolic effects, which is extremely important for comorbid patients.
Key words: hyaluronic acid, hyaluronate, rotator cuff, impingement-syndrome, shoulder, Fermathron.
For citation: Shesternya P.A., Yurin D.V. Clinical aspects in the treatment of rotator cuff disorders with hyaluronic acid // RMJ. 2018. № 12(II). P. 87-90.
Для цитирования: Клинические аспекты применения гиалуроновой кислоты при патологии вращательной манжеты плеча. РМЖ. 2018;12(II):87-90.
В статье представлены результаты оригинального исследования посвященного изучению эффективности и безопасности внутрисуставного применения гиалуроната натрия при патологии вращательной манжеты плечевого сустава.
Введение
Эффективность препаратов гиалуроновой кислоты (ГК) в лечении остеоартрита коленного сустава доказана, достаточно конкретно определена их роль в обновленном алгоритме ведения больных с данной патологией — ESCEO, 2016 [1]. Однако, несмотря на широкое использование ГК в клинической практике, до настоящего времени очень многие вопросы остаются нерешенными. За последние два десятилетия в значительной мере изменилась концепция вязко-эластической защиты (viscosupplementation concept), основывавшейся на физико-химических свойствах ГК в поддержании гомеостаза при ее внутрисуставном введении. В последующем было убедительно доказано, что противовоспалительный и структурно-модифицирующий эффекты являются более значимыми в отдаленных результатах лечения с применением ГК [2, 3].
Положительное влияние ГК на широкий спектр биологических процессов послужило основанием для использования ГК не только внутрисуставно (преимущественно в крупные суставы), но и околосухожильно. Механизм действия в этом случае, конечно же, не может быть объяснен механической «смазкой». Вероятно, экзогенный гиалуронат или продукты его биодеградации усиливают синтез протеогликанов, составляющих основу скользящей выстилки перитендона, и тем самым улучшают биомеханические свойства сухожилия [4]. Рациональность применения экзогенной ГК в лечении различной патологии мягких тканей активно обсуждается медицинским сообществом.
Боль в области плечевого сустава является одной из наиболее частых причин обращения за медицинской помощью. Эта чрезвычайно неоднородная группа пациентов представляет для врача-травматолога/ревматолога существенную проблему дифференциальной диагностики и выбора лечебной стратегии. Не более 5% от числа обратившихся имеют остеоартрит плечевого сустава, у подавляющего большинства отмечается патология мягких тканей [5]. От общего числа пациентов с жалобой на боль в плече 36% составляют пациенты с импиджмент-синдромом плеча [6].
Использовавшийся длительное время термин «периартрит», предложенный S. Duplay в 1872 г. и объединявший патологию различных анатомических образований в области плеча, абсолютно неприемлем, поскольку является не чем иным, как «мусорной корзиной» [7]. Клиницисту необходимо выделять наиболее частые формы поражения плеча: тендиниты/миозиты мышц вращательной манжеты, импиджмент-синдром, адгезивный капсулит, бурсит.
Опыт применения гиалуронатов у этой категории больных весьма ограничен, клинические рекомендации и общепринятые подходы в лечении отсутствуют. Оценка эффективности лечения лимитируется несколькими чрезвычайно важными аспектами: верификацией диагноза (поражение конкретного анатомического образования); способом применения — в плечевой сустав, субакромиальную сумку, околосухожильно; использованием визуализации инъекции (ультразвукового (УЗ) контроля); высоким уровнем плацебо-эффекта процедуры.
Накопленный опыт позволяет несколько сузить возможные показания для использования ГК при патологии плечевого сустава. В частности, нецелесообразность применения ГК при адгезивном капсулите плечевого сустава убедительно продемонстрирована в метаанализе четырех рандомизированных клинических исследований, включавших в общей сложности 273 больных [8]. В то же время при поражении вращательной манжеты использование ГК патогенетически обосновано [9]. В работах in vitro выявлено влияние ГК на процессы пролиферации, апоптоза, экспрессии коллагена I/III типа, ингибирование провоспалительных цитокинов и простагландина Е2 [10, 11].
Целью нашего исследования был ретроспективный анализ эффективности и безопасности применения гиалуроната внутрисуставно при патологии вращательной манжеты плечевого сустава.
Материал и методы
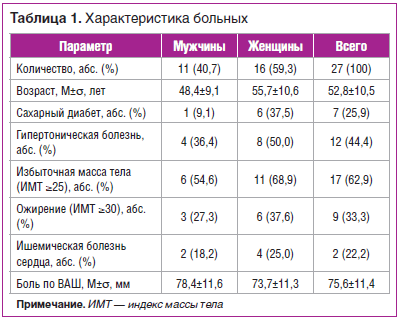
Проведен ретроспективный анализ больных с диагнозом «импиджмент-синдром плеча», получавших лечение в «Профессорской клинике» КрасГМУ им. проф. В.Ф. Войно-Ясенецкого в период 2014-2017 гг. Критериями исключения были: артрит плечевого сустава в анамнезе; предшествующая травма; наличие признаков разрыва вращательной манжеты; адгезивный капсулит плеча. Были проанализированы данные 27 пациентов в возрасте от 36 до 77 лет (табл. 1).
Средний возраст пациентов составил 52,8±10,5 года, среди больных превалировали женщины (59,3%), что согласуется с данными других работ. Обращает на себя внимание высокая коморбидность: каждый четвертый пациент страдал сахарным диабетом (25,9%) и ишемической болезнью сердца (22,2%), чуть менее половины — гипертонической болезнью (44,4%), две трети — имели избыточную массу тела (62,9%).
Верификация диагноза осуществлялась с помощью физикального обследования с проведением функциональных тестов (болезненной дуги Дауборна, Нира, Хоукинса, резистивных активных движений), УЗ-исследования плечевого сустава (Vivid S5, GE), при необходимости — магнитно-резонансной томографии (BRIVO MR355, GE).
Курс лечения включал 3 еженедельные инъекции 2 мл 1% гиалуроната натрия (Ферматрон™) в плечевой сустав под УЗ-контролем 21G (0,8×40 мм), использование нестероидных противовоспалительных препаратов (НПВП) топически и системно, ежедневный комплекс лечебной физкультуры, часть пациентов по показаниям получала однократно в первый день лечения инъекцию бетаметазона 7 мг/1 мл в субакромиальную или поддельтовидную сумку.
У всех пациентов исходно, на фоне лечения (через 1 и 2 нед.) и через 1 и 2 мес. после завершения лечения (6 и 10 нед.) оценивались: интенсивность боли по визуальной аналоговой шкале (ВАШ) 0-100 мм; объем активных движений в плечевом суставе (отведение во фронтальной плоскости) с использованием гониометра; потребность в НПВП.
Статистическая обработка полученных данных выполнялась при помощи программы SPSS, версия 21.0. Описательная статистика результатов исследования представлена для качественных признаков в виде процентных долей, для количественных — в виде средних арифметических (М) и стандартных отклонений (σ). Значимость различий качественных признаков в группах наблюдения оценивали при помощи непараметрического критерия χ 2 Пирсона с поправкой на непрерывность. При частоте встречаемости признака 5 и менее раз использовался точный критерий Фишера. Для оценки значимости статистических различий по количественным признакам проводили сравнение групп по непараметрическому ранговому критерию Манна — Уитни. Различия во всех случаях оценивали как статистически значимые при р
Результаты исследования
Наиболее полный анализ более чем двух десятков лечебных стратегий, предложенных для лечения импиджмент-синдрома плеча, проведенный по строгим правилам проведения метаанализов PRISMA, опубликован Dong W. et al. (2016). Общее количество больных, включенных в 33 рандомизированных клинических исследования, составило 2300. Среди неоперативных стратегий лечения были представлены как широко распространенные: кинезо-, лазеро- и магнитотерапия, инъекции ГК и ГКС, обогащенной тромбоцитами плазмы, НПВП, ударно-волновая терапия, так и менее значимые: акупунктура, мануальная терапия и др. В работе убедительно доказана главенствующая роль лечебной физкультуры, а инъекции ГК должны рассматриваться в качестве дополнения к программам физической реабилитации [12].
При этом специальные комплексы упражнений для плечевого пояса значительно эффективней традиционной лечебной физкультуры. Локальные инъекции ГКС являются своеобразной скорой помощью, оказывая быстрый противовоспалительный эффект, но не улучшая отдаленных исходов [13]. При этом в обоих метаанализах говорится о невысокой статистической мощности доказательств в отношении большинства используемых лечебных методик и необходимости индивидуального подхода в лечении каждого пациента.
Именно метаболическая «инертность» ГК должна учитываться при наличии у пациента клинически значимой сопутствующей патологии. Так, в работе Micu M.C. et al. (2016) был продемонстрирован сопоставимый эффект в снижении боли и увеличении объема движений в плечевом суставе от курса инъекций ГК в сравнении с ГКС через 2 мес. Ожидаемо эффект ГКС был более быстрым, но в течение пяти дней после введения бетаметазона в поддельтовидную бурсу у пациентов отмечались пиковый подъем АД и гипергликемия [14]. По нашему мнению, применение ГК обладает несомненными преимуществами у больных гипертонической болезнью, сахарным диабетом, глаукомой, имеющих тяжелые формы ишемической болезни сердца и сердечной недостаточности.
Другим чрезвычайно важным аспектом является молекулярная масса ГК. Согласно современной концепции гиалуронаты с невысокой молекулярной массой имеют преимущества в плане структурно-модифицирующего эффекта (стимуляции синтеза эндогенной ГК) перед высокомолекулярными и, особенно, сшитыми ГК. В работе Osti L. et al. (2015) препараты ГК с молекулярной массой (500-730, 1000, 1600 и 2200 кДа) оказывали сопоставимое влияние на процессы пролиферации, апоптоза, экспрессии коллагена I/III типа в культуре теноцитов [10].
Нами найдено единственное опубликованное исследование препарата Ферматрон™, посвященное данной тематике. Исследование выполнено у пациентов с патологией вращательной манжеты с рандомизацией и плацебо-контролем: 20 больных еженедельно получили 3 инъекции 20 мг (2 мл) гиалуроната в субакромиальную сумку и 20 пациентов — инъекции 0,9% раствора NaCl в том же режиме [15]. В течение 3-х недель наблюдения у больных, получавших ГК, статистически значимое снижение интенсивности боли отмечалось после первой же инъекции и продолжалось в течение всего периода наблюдения. Постинъекционных реакций, как и в нашей работе, выявлено не было.
Заключение
Поиск оптимального использования ГК в лечении различных заболеваний костно-мышечной системы продолжается. Ограничением представленной работы являются небольшое количество наблюдений и ретроспективный анализ полученных данных. Внутрисуставное введение препаратов ГК — эффективный и безопасный метод в комплексном лечении патологии вращательной манжеты плеча. Важной составляющей применения ГК является отсутствие метаболических эффектов, что чрезвычайно важно для коморбидных пациентов.
Синдром запястного канала (туннельный синдром) - симптомы и лечение
Что такое синдром запястного канала (туннельный синдром)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Михайлюка Игоря Геннадьевича, невролога со стажем в 13 лет.
Над статьей доктора Михайлюка Игоря Геннадьевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Синдром запястного канала — это наиболее распространённая форма туннельных синдромов, которая возникает в результате сдавления срединного нерва в месте его прохождения через такой анатомический "туннель", как запястный канал [1] .
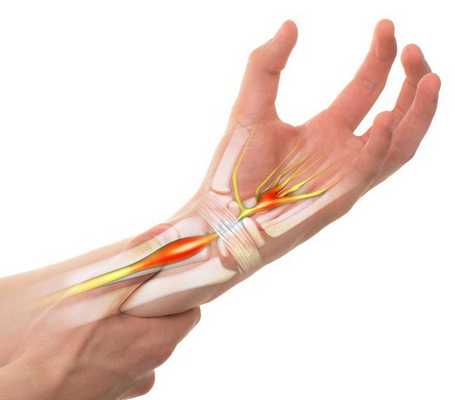
Средняя распространённость синдрома составляет 1-5,8 % [2] [3] , при этом она может значительно отличаться в зависимости от социальной группы человека и факторов риска, которым он подвергается [4] .
Основными факторами риска, предрасполагающими к развитию синдрома запястного канала, являются:
- возраст от 40 до 60 лет;
- женский пол; или избыточная масса тела;
- сахарный диабет; и курение[4][5][6] ;
- профессиональные факторы: интенсивная нагрузка на лучезапястный сустав во время физически сложной работы ( механик, слесарь ), удерживание кисти в неудобном положении, особенно в позиции сгибания или разгибания (фотограф, музыкант, швея), воздействие локальной или общей вибрации ( бурильщик, шлифовщик, асфальтоукладчик, водитель ), а также работа, связанная с длительным пребыванием за компьютером (программист, редактор, наборщик) [7][8][9] .
В большинстве случаев встречается так называемая идиопатическая форма синдрома запястного канала, при которой установить причину имеющихся симптомов не удаётся [5] . При этом, по данным компьютерной томографии, у таких пациентов имеется врождённая узость канала запястья [10] . Поэтому основная роль в формировании идиопатической формы синдрома, вероятно, принадлежит врождённым неизменяемым факторам (например, наследственности) [11] .
Вторичная форма синдрома запястного канала может возникать при поражении различных анатомических структур, которые расположены в запястном канале, в ходе некоторых заболеваний и состояний:
- системные заболевания соединительной ткани (например, ревматоидный артрит);
- тендовагинит мышц-сгибателей кисти (воспаление сухожилия мышцы и её оболочки);
- заболевания эндокринной системы;
- гиповитаминозы (нехватка витаминов в организме);
- беременность [3][5] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома запястного канала
Симптомы заболевания включают в себя чувствительные нарушения: онемение и парестезии (мурашки, покалывание, жжение) в области иннервации срединного нерва на кисти, т. е. в области пальцев с первого по четвёрты й.
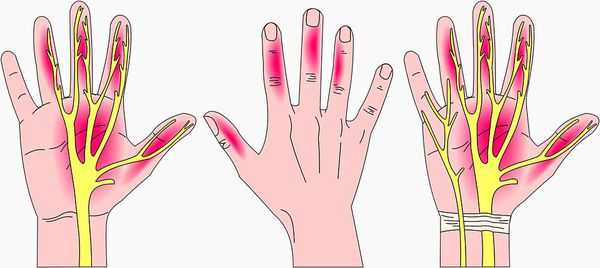
Дополнительно человек может испытывать ноющие, иногда жгучие болевые ощущения в этой области. При этом заподозрить именно синдром запястного канала, а не другое заболевание с похожими симптомами, позволяют следующие характеристики этих проявлений [12] :
- Нарушения чувствительности в виде онемения или парестезий, которые присутствуют минимум в двух пальцах с первого по четвёртый в течение по крайней мере одного месяца. Указанные симптомы могут появляться периодически или быть постоянными. Причём если сейчас симптомы присутствуют постоянно, то перед этим обязательно был период, когда они возникали периодически. Для соблюдения этого критерия недостаточно одной боли — ей обязательно должны сопутствовать онемение и парестезии.
- Онемение и парестезии становятся сильнее под влиянием хотя бы одного из указанных факторов: сон, удержание руки в одном положении, многократно повторяющиеся движения кисти.
- Онемение и парестезии уменьшаются под влиянием минимум одного из указанных факторов: смена положения или встряхивание руки, фиксация лучезапястного сустава ортезом (специальным приспособлением).
- Болевой синдром (при наличии) должен быть более выраженным в пальцах, области кисти и лучезапястного сустава, чем в предплечье, плече и шее.
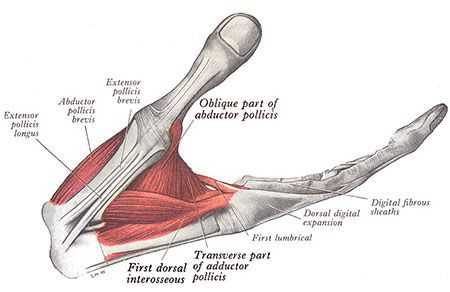
При выраженной степени повреждения срединного нерва в области прохождения его через запястный канал может присутствовать слабость мышц, за движения которых отвечает срединный нерв. Чаще всего, это мышцы возвышения большого пальца. Однако из-за часто встречающихся анастомозов (соединений) между срединным и локтевым нервом могут встречаться нетипичные для поражения срединного нерва варианты слабости мышц [13] .
Патогенез синдрома запястного канала
В основе развития чувствительных нарушений лежит повышение давления тканей внутри запястного канала, из-за чего и происходит сдавливание нервного ствола окружающими тканями [5] [14] . Такое давление снижает подвижность нерва, в связи с чем во время движений в лучезапястном суставе он подвергается микротравматизации. Вместе с этим из-за повышения давления в этой области страдает циркуляция венозной и артериальной крови и процесс аксонального транспорта — распространения нервного импульса. Это, в свою очередь, вызывает запуск биомеханические и структурные изменения в области запястного канала [5] [14] [15] .
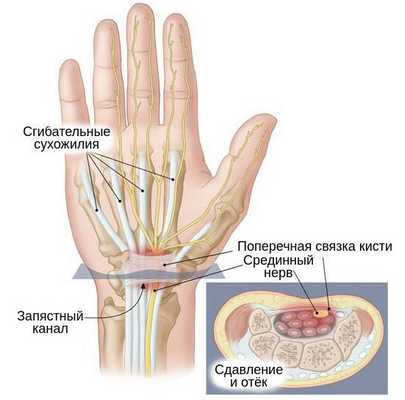
По причине недостатка поступления крови в нервном стволе начинают происходить биохимические изменения. Периоды снижения (ишемии) и возобновления кровотока приводят к оксидантному повреждению на клеточном и тканевом уровне, при этом в первую очередь повреждаются волокна, покрытые миелиновой оболочкой (защитным слоем) [16] . Возникшая ишемия и оксидантное повреждение усиливают выработку таких веществ, как цитокины и простагландины E2, которые отвечают за развитие боли [5] .
Чередование периодов ишемии и восстановления кровообращения создаёт отрицательное внутритканевое давление, а это в свою очередь приводит к отёку синовиальных оболочек (внутренних слоёв суставных капсул). В итоге содержимое запястного канала сдавливается ещё больше [5] [14] .
Если сдавление срединного нерва сохраняется довольно долго, то чрезмерный синтез белка интерлейкина-6 приводит к образованию рубцовой ткани внутри и вокруг нервного ствола. Это происходит из-за того, что данное вещество стимулирует увеличение количества фибробластов и разрастанию соединительной ткани [5] .
Классификация и стадии развития синдрома запястного канала
На начальной стадии заболевания обычно присутствуют только симптомы нарушения чувствительности — онемение или парестезии, иногда сопровождающиеся болью, которые возникают периодически, чаще ночью, при удержании руки долгое время в одном положении, выполнении многократно повторяющихся движений в лучезапястном суставе. Со временем эти симптомы становятся постоянными, и при дальнейшем прогрессировании заболевания возникает слабость мышц, за движение которых отвечает срединный нерв, с их последующей истощением [5] .
Чёткой взаимосвязи между степенью синдрома по данным электронейромиографии и выраженностью клинических симптомов заболевания в исследованиях выявлено не было. Это объясняют повреждением тонких нервных волокон типа Аδ и С, проводимость которых электронейромиография оценить не может. Удаётся зафиксировать изменения только при повреждении Аβ-волокон, которое при синдроме запястного канала возникает обычно значительно позже, чем первые симптомы заболевания [5] .
Ещё одной причиной, вызывающей несоответствие клинических симптомов со степенями нарушения проводимости по срединному нерву в области запястного канала, является вариабельность иннервации кисти локтевым и срединным нервом [13] .
Деление патологического процесса синдрома на стадии является важной задачей, которую только предстоит решить. Она поможет принимать решение о выборе тактики лечения — использовать консервативные методы имеет смысл только на начальных стадиях заболевания [12] .
Осложнения синдрома запястного канала
Главным осложнением синдрома запястного канала является необратимое поражение срединного нерва. Оно приводит к стойким расстройствам чувствительности в области иннервации данного нерва, а также к слабости мышц кисти, за движение которых он отвечает.
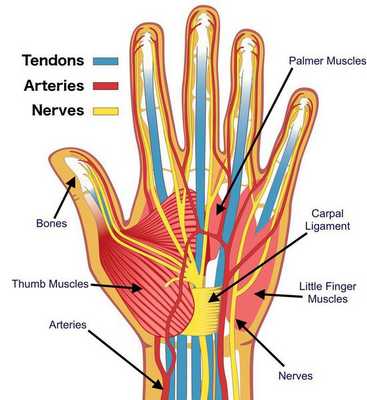
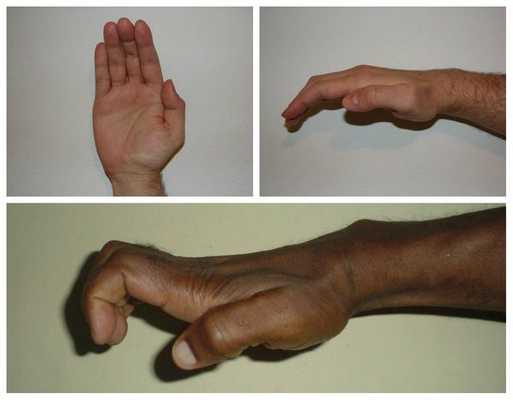
Срединный нерв на кисти иннервирует мышцы возвышения большого пальца, а также первые две червеобразные мышцы. Поэтому при повреждении нерва может нарушаться функция указанных мышц, что приводит к нарушению сгибания, отведения, противопоставления большого пальца (соприкосновение его подушечки с подушечками других пальцев), а также сгибания указательного и среднего пальцев. Параллельно со слабостью развивается гипотрофия указанных мышц (истончение и уменьшение мышечных волокон).
Всё это в конечном итоге приводит к невозможности нормально пользоваться рукой и развитию специфичной форме кисти, которая получила образное название "обезьянья лапа".
У некоторых пациентов помимо указанных нарушений также может наблюдаться развитие стойкого хронического болевого синдрома в области кисти и запястья, который с трудом поддаётся лечению [5] .
Для предупреждения развития данных осложнений важно вовремя провести правильную диагностику состояния и назначить корректное лечение.
Диагностика синдрома запястного канала
В основе диагностики поражения срединного нерва лежат клинические и электрофизиологические критерии.
Осмотр пациента направлен не только на выявление симптомов, характерных для синдрома запястного канала (онемение, парестезии, боль), но и на то, чтобы исключить другие возможные пр ичины жалоб: шейную радикулопатию, отражённую боль при миофасциальном или фасеточном синдроме, диабетическую нейропатию, множественную мононейропатию, плечевую плексопатию, синдром верхней аппертуры грудной клетки, иррадиацию боли при эпикондилите.
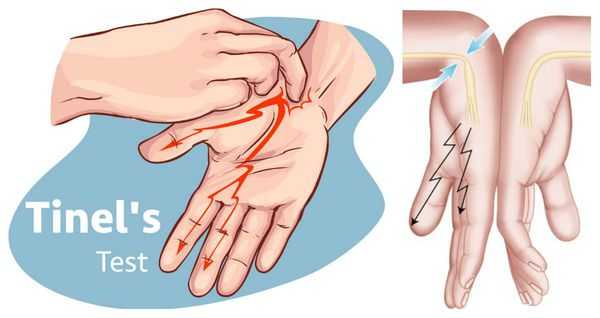
Физикальный осмотр включает оценку чувствительности в области иннервации срединного нерва, мануальное тестирование силы мышц, а также специальные провокационные тесты, при выполнении которых у людей с с индромом запястного канала имеющиеся симптомы нарастают. Наиболее часто используют тест Тинеля, при котором лёгкое постукивание над запястным каналом вызывает покалывание и прострелы в пальцы, либо тест Фалена, при котором удержание запястья в максимально согнутом состоянии в течение 30 секунд приводит к появлению или усилению имеющихся у пациента жалоб [5] .
Чаще всего для инструментальной диагностики синдрома применяют метод стимуляционной электронейромиографии. При его выполнении срединный нерв с помощью электрического тока стимулируется в определённых местах. Вызванные таким образом потенциалы регистрируются и анализируются. Так можно определить место сдавления нерва, степень поражения сенсорных и моторных волокон, а также морфологический тип поражения (поражение миелиновых оболочек или отростков нервных клеток) [5] [12] [21] .
Несмотря на то, что метод электронейромиографии является достаточно чувствительным и специфичным, его нельзя использовать в отрыве от клинических симптомов заболевания, так как известно множество вариантов нарушений проведения импульса по периферическим нервам без клинических признаков того или иного заболевания.
В последнее время в процессе диагностики синдрома запястного канала всё чаще используют УЗИ, а также КТ и МРТ. Их применение оправдано, так как они помогают выявить морфологические изменения срединного нерва и окружающих его структур, а также те или иные аномалии в области канала запястья, которые могут вызывать клинические симптомы у данных пациентов [22] .
Однако применение КТ и МРТ в диагностике синдрома запястного канала ограничено из-за высокой стоимости по сравнению с другими методами и высоких требований к способности аппаратуры. Поэтому методом выбора, позволяющим исключить структурную патологию в области запястного канала, является УЗИ.
Лечение синдрома запястного канала
Начальным методом терапии пациентов с синдромом запястного канала может стать изменение повседневной активности, исключение вредных профессиональных факторов, эргономичная организация рабочего места при работе за компьютером — использование специальных мышек, ковриков и клавиатур [23] .

Следующим методом, показавшим свою эффективность и безопасность, является ортезирование запястья, при котором лучезапястный сустав помещается в нейтральное положение. Таким образом минимизируется негативное воздействие на срединный нерв со стороны окружающих его структур [5] .

В комплексном лечении могут использоваться и многие другие методики: мануальная терапия, физиотерапия, кинезиотейпирование, однако данные об их эффективности противоречивы [5] .
В качестве терапии у пациентов с синдромом запястного канала также используется медикаментозное лечение. Оно направлено на уменьшение воспаления и отёка в области запястного канала, что приводит к купированию симптомов.
В клинической практике применяется достаточно большое количество лекарственных средств, однако для большинства препаратов эффект является кратковременным и малозначительным. Исключением являются препараты кортикостероидов, особенно при локальном применении в форме медикаментозных параневральных блокад (введение анестетика в пространство около почек) [5] .
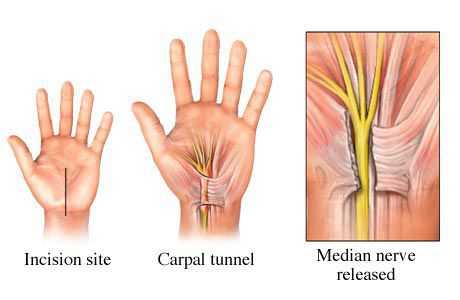
Также существует большое разнообразие методов оперативного лечен ия, которые отличаются лишь вариантами оперативного доступа [24] . Однако в основе любого вмешательства лежит рассечение поперечной связки запястного канала и освобождение срединного нерва от компрессии (сдавления) окружающими тканями.
Выбор варианта операции и техники лечения зависит от многих факторов:
- степени сдавления срединного нерва;
- наличия сопутствующих заболеваний;
- особенностей анатомии запястного канала;
- предпочтений хирурга [25] .
Хирургическое вмешательство — радикальный метод лечения, который позволяет нормализовать давление внутри запястного канала. Эффект от оперативного лечения превосходит все существующие в данный момент консервативные методы. Кроме того, уже через две недели после операции люди могут вернуться к своей профессиональной деятельности. Однако не смотря на широкое распространение синдрома запястного канала до сих пор нет единой тактики определения показаний к выполнению операции. Различные авторы предлагают свои критерии, которые позволяют отобрать пациентов для оперативного лечения, и в каждом случае решение принимается индивидуально [2] [5] .
Не смотря на разнообразие методов, единого подхода к лечению пациентов с синдромом запястного канала не существует.
Одна точка зрения заключается в том, что оперативное лечение должно использоваться только в крайнем случае: при неэффективности проведённого консервативного лечения и при наличии выраженной симптоматики в виде слабости и гипотрофии мышц [26] .
Также существует мнение, что несмотря на большое разнообразие консервативных методов лечения их эффективность крайне низка, поэтому достигнутый результат лечения является кратковременным. В связи с этим не рекомендуется затягивать с хирургическим вмешательством, так как оно является наиболее эффективным методом лечения [2] [5] .
Прогноз. Профилактика
Синдром запястного канала является прогрессирующим состоянием. Без лечения со временем он может привести к стойкому повреждению срединного нерва и, как следствие, нарушению функции кисти из-за невозможности сгибать с первого по третий палец, а также приводить и противопоставлять большой палец, который выполняет важную роль в повседневной жизни любого человека.
Пока нет достоверных научных данных о том, может ли какое-либо консервативное лечение предотвратить прогрессирование заболевания. Даже при хирургическом лечении и высвобождении срединного нерва от сдавливающих его структур в 1/3 случаев возможен рецидив заболевания в первые пять лет после операции [27] .
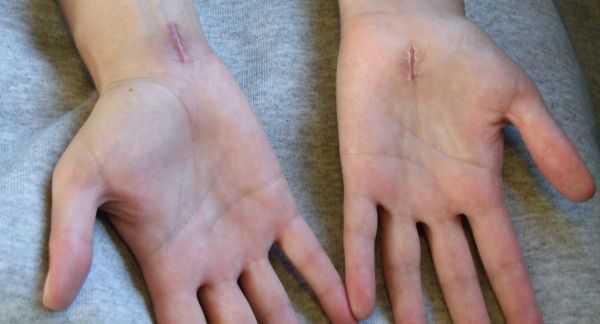
К осложнениям оперативного лечения синдрома относят:
- кровотечение и образование гематомы в области послеоперационной раны;
- инфекционные осложнения;
- образование рубцов и спаек в области разреза;
- повреждение чувствительных ветвей срединного нерва, следствием чего может стать стойкое онемение в области иннервации срединного нерва [5] .
Учитывая, что синдром запястного канала часто связан с анатомической узостью запястного канала, методы надёжной профилактики заболевания пока не разработаны. Поэтому предупреждение развития синдрома может быть направлена только на коррекцию таких факторов риска, как избыточный вес или ожирение, повышенный уровень гликемии при сахарном диабете, злоупотребление алкоголем, курение, вредные производственные факторы, включающие чрезмерную нагрузку на лучезапястный сустав. К сожалению, эффективность всех этих мероприятий часто оказывается крайне низкой [4] [5] [9] .
Читайте также:
- Отрубевидный лишай (разноцветный лишай). Диагностика и лечение
- УЗИ, рентгенограмма при танатоформной дисплазии у плода
- Пример невротической делинквентности (правонарушений) у подростка
- Изменения психики при эпилепсии. Эпилептический статус.
- Трахеотомия и техника ее выполнения при стенозе гортани и трахеи
