Случай связанной с тимомой миастении у пожилого мужчины
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
ФГБОУ ВО «Иркутский государственный медицинский университет» Минздрава России, Иркутск, Россия
Качество жизни больных миастенией с различными типами течения
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2017;117(1‑2): 64‑69
Цель исследования. Изучение качества жизни больных миастенией и его сопряженности с особенностями клинических проявлений при различных вариантах течения заболевания. Материал и методы. Обследовали 103 пациента с миастенией. Использовали комплекс тестов и шкал для оценки неврологического дефицита и качества жизни. Результаты и заключение. В результате исследования выделено 2 типа течения миастении: благоприятный и неблагоприятный. Показано, что применение тимэктомии статистически достоверно способствует улучшению качества жизни больных миастенией. Установлено, что единственным благоприятным прогностическим признаком успешно выполненной тимэктомии при миастении является минимальная длительность заболевания до ее выполнения. Благоприятное и мягкое течение миастении наблюдается при преобладании в клинической картине слабости экстраокулярных мышц и мышц конечностей. Самые низкие показатели качества жизни отмечены при вовлечении в патологический процесс дыхательных и бульбарных мышц (p
Миастения — наиболее распространенная форма расстройств нервно-мышечной передачи [1]. Основной целью лечения миастении является индукция ремиссии. На сегодняшний день назрела необходимость изучения прогнозирования развития ремиссии.
Актуальность проблемы определяется тенденцией к увеличению распространенности миастении с середины XX века, которая достигла 32 случая на 100 000 населения [2, 3]. Это связано с улучшением качества диагностики миастении, постарением населения и увеличением продолжительности жизни больных. Диагноз «миастения» до сих пор ассоциируется с повышенной смертностью, особенно в группе с поздним началом заболевания [4]. Сообщается, что смертность больных миастенией выше у мужчин, чем у женщин [5]. Однако существуют исследования, опровергающие этот факт: среди женщин миастения чаще дебютирует в пожилом возрасте с более высокой частотой сопутствующих заболеваний, в этом случае отмечается более высокий показатель смертности [4]. Имеющиеся данные литературы, касающиеся вопросов клинического течения миастении, также противоречивы [6]. До настоящего времени нет единого мнения относительно факторов, влияющих на характер течения заболевания, так как у части пациентов один вариант может переходить в другой. Для подбора адекватного лечения больным миастенией необходимо учитывать особенности протекания заболевания [7]. Выделение варианта клинического течения миастении позволяет сформулировать полный клинический диагноз при его постановке, определить тактику лечения и разработать индивидуальные реабилитационные мероприятия [8].
Миастения не создает трудностей при клинической интерпретации и диагностике, однако для построения более полной картины заболевания необходима всесторонняя оценка качества жизни [9]. Оценка качества жизни позволяет объективно определять тяжесть состояния больных в дополнение к клинической картине миастении, в связи с этим основанием для настоящего исследования послужила проблема соотношения клинического паттерна с показателями качества жизни больных миастенией.
Цель исследования — изучение качества жизни больных миастенией и его сопряженности с особенностями клинических проявлений при различных вариантах течения заболлевания.
Материал и методы
Наблюдали 103 пациентов с миастенией. Их средний возраст составил 36,2±12,4 года. Критериями включения пациентов в исследование были: верифицированный диагноз миастении, выставленный на основании основных диагностических критериев [10], подписанное информированное согласие больного. Критериями исключения были: миастенический синдром, тяжелые сопутствующие соматические и неврологические заболевания, отсутствие подписанного информированного согласия больного.
Для изучения клинического течения миастении использовалась отечественная классификация миастении, предложенная Б.М. Гехтом [11]. В соответствии с этой классификацией все обследованные больные были разделены на четыре группы: с ремиттирующим (n=26), стационарным (n=17), прогрессирующим (n=48) и злокачественным (n=12) течением. Определение показателей качества жизни проводилось с помощью опросника Short form 36 (SF-36) [12]. Тяжесть двигательных расстройств у больных миастенией оценивалась при помощи количественной шкалы QMGS — Quantitative Myasthenia Gravis Score [13]. Статистическая обработка результатов осуществлялась с использованием пакета прикладных программ IBM SPSS Statistics 22.0 и Microsoft Excel. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался равным 0,05 (p — достигнутый уровень значимости).
Результаты и обсуждение
В связи с тем, что миастения является хронической патологией и требует длительного лечения симптоматическими и патогенетическими средствами, особое внимание было уделено клиническим характеристикам заболевания. Общий балл шкалы QMGS варьировал от 0 до 21. Выявлено, что при ремиттирующем течении балл по шкале составлял 0, при стационарном 10±4,04, при прогрессирующем — 13,58±2,39, а при злокачественном — 16,0±3,4 (рис. 1). В результате проведенного однофакторного дисперсионного анализа определено, что дисперсия между средними значениями шкалы QMGS в группах вариантов течения миастении в 87,364 раза выше, чем внутригрупповая дисперсия (F=87,364; p<0,0001).
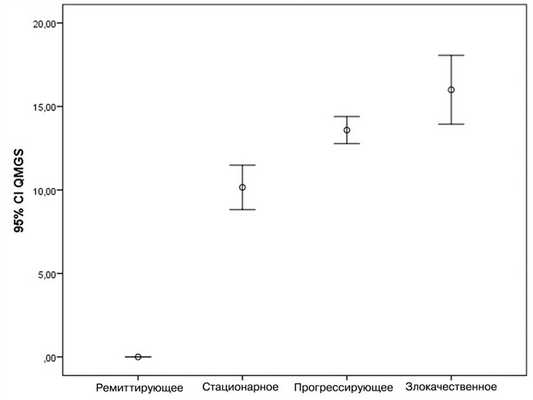
Рис. 1. Средние значения шкалы QMGS при различных вариантах течения миастении.
Применение данной шкалы позволяет оценить выраженность клинических проявлений миастении на фоне различных методов лечения больных с разными формами и типами течения заболевания. Часто встречающимся симптомом при легких формах миастении являлась слабость мышц конечностей (25%). При тяжелых формах достоверно чаще встречались дыхательные (59%) и бульбарные (55%) нарушения (p<0,003). Это имеет прогностическое значение, т. е. отсутствие у пациента дыхательных и бульбарных нарушений свидетельствует о более мягком течении заболевания.
Проводя анализ клинического течения миастении у исследованной когорты пациентов, мы учитывали особенности дебюта заболевания. Чаще всего миастения дебютировала с общей слабости (19,8%) и птоза (37,8%), реже в качестве симптомов дебюта выступали нарушение жевания (13%) и дизартрия (6,8%). Количество симптомов дебюта у больных было различным. Более чем в половине случаев — у 61 (59,2%) пациента отмечалось моносимптомное начало заболевания, у 34 (33%) пациентов заболевание проявлялось двумя симптомами, у 5 (4,8%) пациентов симптомов дебюта было три, у 3 (2,9%) пациентов заболевание началось с появления четырех и более симптомов одновременно.
В наших клинических наблюдениях миастения чаще встречалась у молодых женщин (44,6%), наиболее частым симптомом дебюта был птоз (27,8%), среди сопутствующей патологии часто встречались заболевания сердечно-сосудистой системы (59,1%). Неблагоприятными прогностическими симптомами являлись дыхательные и бульбарные нарушения.
Основные клинические показатели при различных вариантах течения миастении приведены в таблице.
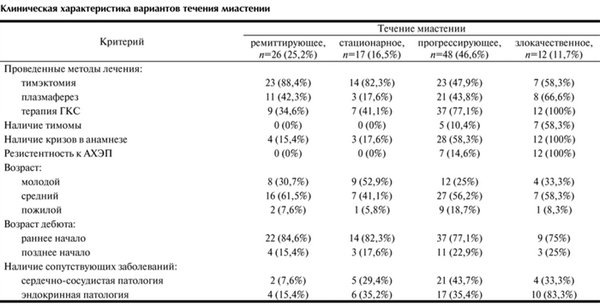
Клиническая характеристика вариантов течения миастении
При ремиттирующем типе течения кратковременные миастенические симптомы (глазодвигательные, бульбарные или генерализованные) сменялись спонтанной или медикаментозно вызванной ремиссией. Под полной ремиссией подразумевается отсутствие мышечной слабости без какой-либо терапии. При медикаментозной ремиссии симптомы миастении отсутствуют на фоне патогенетической терапии глюкокортикоидами (ГКС). В данной группе было 26 (25,2%) пациентов. Периоды ухудшения состояния пациенты этой группы отмечали чаще весной и осенью, а также под влиянием внешних факторов — стрессов и инфекций. В эти периоды возникала необходимость приема ГКС для компенсации миастенических проявлений. Длительность ремиссий варьировала и составляла у разных пациентов от нескольких недель до 15 лет. К данной группе относились пациенты в основном молодого (до 40 лет) и среднего (40—60 лет) возраста (92,3%) с преимущественно ранним дебютом миастении (84,6%) и низким процентом сопутствующих заболеваний: 2 (7,6%) пациента имели сопутствующую сердечно-сосудистую патологию, у 4 пациентов (15,4%) отмечалась эндокринная патология. При этом ранним дебютом считалось начало заболевания в возрасте до 40 лет. К числу сопутствующих сердечно-сосудистых заболеваний относили гипертоническую болезнь, ишемическую болезнь сердца, нарушение сердечного ритма, врожденные или приобретенные пороки сердца, а к сопутствующей эндокринной патологии относились гипотиреоз, тиреотоксикоз и сахарный диабет. Большинство больных из данной подгруппы — 23 (88,4%) человека были прооперированы по поводу миастении. Такие пациенты (34,6%) меньше всего нуждались в гормональной терапии и получали ее в периоды обострений. Это наиболее благоприятный тип течения заболевания. Использование тимэктомии приводит к стабилизации и регрессу неврологической симптоматики, причем, чем раньше от начала заболевания выполнена операция, тем благоприятнее прогноз: в 31,3% случаев наблюдалась стойкая послеоперационная ремиссия у пациентов, которым была выполнена тимэктомия в течение первых 2-х лет от начала заболевания. На рис. 2 показано распределение пациентов в период ремиссии после тимэктомии в зависимости от длительности болезни к моменту операции. Отмечалось, что ремиссия быстрее и чаще наступала при выполнении тимэктомии больным с самой короткой длительностью болезни — до 2-х лет.
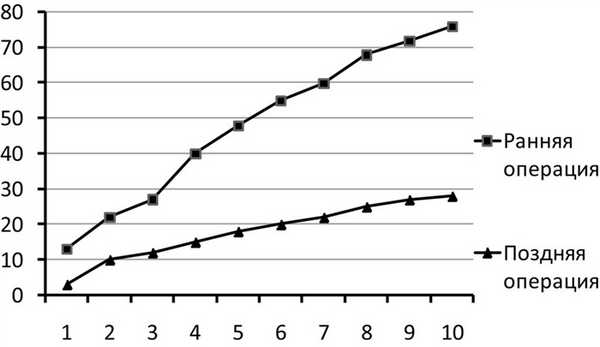
Рис. 2. Распределение пациентов в ремиссии после тимэктомии в зависимости от длительности болезни к моменту операции. По оси абсцисс — годы после операции, по шкале ординат — количество больных в ремиссии. Ранняя операция — операция, выполненная в течение первых 2 лет от момента дебюта заболевания, поздняя — выполненная пациентам с длительностью болезни более 2 лет.
Стационарное течение характеризовалось достаточной стабильностью и монотонностью протекания заболевания на протяжении определенного периода времени, заболевание не менялось ни по тяжести проявления, ни по клинической картине. В нашем исследовании такой тип течения отмечается у 17 (16,5%) больных. Эта форма может возникнуть остро, а в дальнейшем под влиянием лечения приобретает непрогрессирующий характер. В данной группе отсутствовали пациенты с резистентностью к АХЭП, тимома была у 1 (5,8%) больного, а миастенические кризы отмечались у 3 (17,6%) пациентов. Большинство больных этой группы, как и в случае с ремиттирующим течением, относились к молодому и среднему возрасту с ранним дебютом заболевания. Однако число пациентов с сопутствующими заболеваниями в этой группе было больше, чем в группе с ремиттирующим течением; 14 (82,3%) больных перенесли тимэктомию.
Прогрессирующее течение наблюдалось у большинства обследованных больных — 48 (46,6%). Начало заболевания возникало либо молниеносно, остро, либо медленно. С течением времени имелась тенденция к ухудшению состояния, в патологический процесс вовлекались новые группы мышц, увеличивалась выраженность симптоматики. У 1/3 пациентов данной группы миастения сочеталась с тимомой (33,3%), по поводу которой часть из них были прооперированы, и более чем у 58,3% отмечались кризы в анамнезе. Эти пациенты в большей степени нуждались в терапии ГКС (77,1%), число лиц пожилого возраста в этой группе было больше, чем в других группах — 9 (18,7%) пациентов. Данная группа также отличалась большим количеством сопутствующей патологии: 21 (43,7%) больной имел сердечно-сосудистые заболевания, а 17 (35,4%) — сопутствующую эндокринную патологию.
Злокачественное течение наблюдалось у 12 (11,7%) больных и характеризовалось чаще всего острым началом и склонностью к дыхательным нарушениям. Тяжесть их состояния была наиболее высокой. В эту же группу были отнесены больные в стабильно тяжелом состоянии, несмотря на все лечебные процедуры. Причем число пациентов с тимомами было достоверно выше (p<0,005). Частота сопутствующих эндокринных заболеваний была достоверно выше (83,3%, p<0,01). Любая из описанных выше форм, чаще под влиянием инфекции, может принять злокачественный характер. Однако спонтанные ремиссии при миастении могут возникнуть при любом варианте течения заболевания, даже при злокачественном течении.
Резистентность к антихолинэстеразным препаратам (АХЭП) выявлена у всех больных со злокачественной формой заболевания, а также у части больных с прогрессирующим течением (14,6%). Больные с ремиттирующим и стационарным течением имели хороший ответ на введение АХЭП. Наличие кризов в анамнезе отягощает течение заболевания. Все больные с резистентностью к АХЭП имели кризы в анамнезе.
Изучение особенностей влияния различных факторов на клиническое течение миастении позволило нам разделить варианты миастении на 2 основных типа: благоприятный и неблагоприятный. К благоприятному отнесли ремиттирующее и стационарное, к неблагоприятному — прогрессирующее и злокачественное течение. Таким образом, неблагоприятное течение развивается при наличии сопутствующих эндокринологических заболеваний и/или тимомы, перенесенных миастенических или холинергических кризов в анамнезе, а также при позднем дебюте болезни. Заболевание имеет благоприятное течение при хорошем отклике на АХЭП, при отсутствии тимомы и кризов, а также при начале миастении в молодом возрасте. Установление варианта клинического течения миастении и выявление факторов, влияющих на развитие неблагоприятного течения заболевания, позволяют повысить эффективность лечебных и профилактических мероприятий за счет подбора индивидуального подхода к лечению и реабилитации таких больных. Неблагоприятный тип течения миастении является показанием к оперативному лечению.
Клинические особенности миастении оказывают существенное влияние на физическое и психологическое состояние пациента. Уровень неврологического дефицита может приводить к социальным ограничениям, таким как выбор профессии, вождение автомобиля, возможность создания семьи. У таких пациентов нарушается социальная и трудовая адаптация. Даже поражение небольшой группы мышц приводит к птозу и диплопии. При генерализованной форме заболевания социальные проблемы еще больше усугубляются.
Изучена связь параметров качества жизни больных с вариантами течения миастении. Разница показателей по шкале физической роли связана с влиянием физического состояния на выполнение служебных обязанностей на работе, выполнение будничной деятельности. Показатели были ниже у пациентов со злокачественным течением заболевания (p<0,001). Показатель «общее здоровье» отражает оценку больным своего состояния здоровья в настоящий момент и перспектив лечения в дальнейшем. Пациенты в ремиссии имели бо́льшую удовлетворенность лечением, чем пациенты со стационарным течением (p<0,05). Шкала «жизнеспособности» отражает самочувствие и переносимость физических нагрузок. Пациенты со злокачественным тяжелым течением заболевания чаще себя чувствовали уставшими, обессиленными (p<0,001). У больных с прогрессирующим течением максимальные изменения касались шкал, характеризующих ограничения физических функций (p<0,001), возможности осуществления физической деятельности (p<0,001), изменения общего состояния здоровья (p<0,001), энергичности (p<0,005), в меньшей степени ухудшения психологического здоровья и наличия физической боли (p>0,05). Болевой синдром не характерен для миастении, а его присутствие может лишь указывать на наличие у больных сопутствующей патологии, сопровождающейся болевыми синдромами. Больные с прогрессирующим и злокачественным течением заболевания страдают от ограничений в физическом состоянии и социальном функционировании в большей степени, чем пациенты с ремиттирующим и стационарным течением. Показатели качества жизни у пациентов в ремиссии имели самые высокие значения по сравнению с другими подгруппами: это касалось как показателей, отвечающих за физическое здоровье, так и показателей психического здоровья.
По результатам корреляционного анализа по коэффициенту Спирмена установлена связь клинических факторов с качеством жизни. С суммарными оценками опросника SF-36 связаны степень тяжести заболевания (r=-0,41), характер течения (r=-0,21), длительность (r=-0,47), возраст дебюта заболевания (r=-0,29), уровень значимости составил р
Проведена оценка влияния характера течения миастении на показатели шкалы SF-36. Анализ среднегрупповых величин показателей, характеризующих качество жизни, выявил достоверное снижение большинства из них в исследуемых подгруппах. На рис. 3 представлены значения показателей физического и психического компонентов здоровья по шкале SF-36 у пациентов с различными вариантами течения миастении.
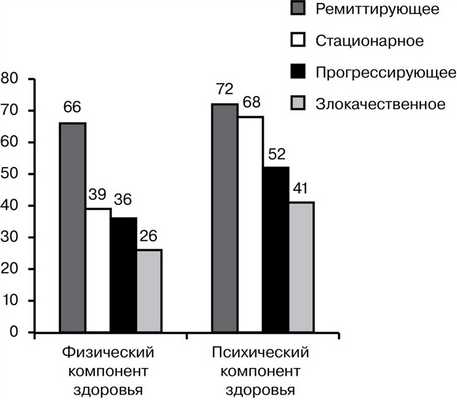
Рис. 3. Значения показателей физического и психического компонентов здоровья в зависимости от варианта течения миастении. По оси ординат — баллы по шкале SF-36.
На течение миастении влияют возраст дебюта, клинический паттерн заболевания и компенсация двигательных расстройств на фоне проводимых методов лечения. Благоприятными прогностическими критериями миастении являются: дебют заболевания в молодом возрасте, преобладание в клинической картине слабости мышц конечностей, высокая компенсация двигательных расстройств на фоне проводимых методов лечения. К критериям неблагоприятного прогноза миастении относятся: бульбарные и дыхательные нарушения, поздний дебют заболевания, резистентность к АХЭП, сопутствующая эндокринная патология (узловой зоб, сахарный диабет), наличие тимомы и перенесенные миастенические или холинергические кризы. При неблагоприятном типе течения миастении показано оперативное вмешательство на вилочковой железе (тимэктомия), в случае отсутствия противопоказаний к ее применению. Благоприятным прогностическим признаком успешно выполненной тимэктомии является более ранняя операция.
Качество жизни является важнейшим показателем состояния больных миастенией. Показатели качества жизни у больных миастенией наряду с клинической картиной заболевания являются критерием эффективности лечения. К факторам, ухудшающим качество жизни больных миастенией, относятся тяжелое и злокачественное течение миастении, средняя и тяжелая степень инвалидизации.
Случай связанной с тимомой миастении у пожилого мужчины
В конце августа 2018 года на приём в кабинет невролога обратился мужчина Б. 47 лет с просьбой разобраться с причинами его состояния. По его мнению, ранее установленный диагноз не объясняет возникающие болезненные ощущения.
Жалобы
Данные симптомы нарастали при разговоре и во время еды. Утром после ночного отдыха состояние улучшалось, но к вечеру после физической нагрузки вновь ухудшалось.
Анамнез
Мужчина заболел около месяца назад, когда после лёгкой ОРВИ и волнения появились вышеописанные симптомы. Был госпитализирован в неврологическое отделение с подозрением на стволовой инсульт. При обследовании диагноз инсульта не подтвердился. Пациента выписали с диагнозом "хроническая сосудисто-мозговая недостаточность в вертебро-базиллярном бассейне".
До выхода на пенсию мужчина работал шофёром. Наследственность по неврологическим заболеваниям не отягощена. Страдает гипертонической болезнью, наблюдается у кардиолога по месту жительства.
Обследование
Больной в сознании, на вопросы отвечает правильно. Наблюдается дефицит массы тела. Менингеальных симптомов, указывающих на раздражение мозговых оболочек, нет. Полуптоз век больше слева. Глазные щели слева уже, чем справа. Зрачки равны, реакция на свет сохранена. Мягкое нёбо провисает, нёбный язычок отклоняется влево, глоточный рефлекс сохранён. Наблюдается дизартрия (нарушение произношения). Глотание жидкой пищи несколько затруднено. Сила в руках достаточная. Сухожильные рефлексы с рук живые, коленные рефлексы оживлены, ахилловы рефлексы вялые. Статика и координация в норме. Глубокая и поверхностная чувствительность сохранена. Целенаправленно были проведены тесты для выявления признаков миастении (тяжёлой хронической болезни, которая сопровождается слабостью и быстрой утомляемостью мышц). Результаты тестов оказались положительными, в частности "манжеточная" проба и проба с 10-кратным сжиманием кистей рук.
Пациенту были назначены: ⠀•⠀электронейромиография (ЭНМГ) — для исключения миастенической реакции, а также (с учётом возраста) болезни мотонейронов (двигательных нервных клеток); ⠀•⠀МРТ головного мозга и краниовертебрального перехода; ⠀•⠀лабораторные обследования. На ЭНМГ выявлена выраженная миастеническая реакция с круговой мышцы глаза (уменьшение амплитуды на 48 %) и круговой мышцы рта (уменьшение амплитуды на 53 %), а также умеренная реакция дельтовидной мышцы (уменьшение амплитуды на 25 %). На МРТ краниовертебрального перехода и стволовых структур мозга патологии нет. В связи с выраженной миастенической реакцией больной был госпитализирован в неврологическое отделение краевой больницы. Проведено КТ органов грудной клетки: выявлено объёмное образование переднего средостения больших размеров (вероятно, тимома — опухоль вилочковой железы).
Диагноз
Лечение
Пациент переведён в торакальное отделение, где выполнена операция по удалению опухоли. Материал отправлен на гистологическое исследование. Заключение: иммуноморфологическая картина опухоли, соответствующая тимоме, тип В1 (низкий уровень риска). В отделении проведена консультация кардиолога. Диагностирована гипертоническая болезнь III ст. (риск 4) и хроническая сердечная недостаточность I функционального класса. Для купирования миастенических реакций больному были назначены: ⠀•⠀антихолинэстеразные препараты (АХЭ) — пиридостигмина бромид по 60 мг четыре раза в сутки; ⠀•⠀препараты калия; ⠀•⠀альдактон (верошпирон) — по 25 мг четыре раза в сутки.
К сожалению, реакция больного на АХЭ препараты была недостаточной. В дальнейшем были определены антитела к ацетилхолиновым рецепторам. Они оказались достаточно высокими — 14,7 нмоль/л (при норме меньше 0,45). В связи с этим пациенту были назначены кортикостероиды — метил преднизолон в дозе 20 мг в сутки. На третьей неделе лечения состояние больного улучшилось: он стал лучше глотать и говорить, увеличилась переносимость физической нагрузки.
В ходе лечения дозу АХЭ препаратов постепенно удалось снизить наполовину. В настоящий момент больной находится дома, чувствует себя удовлетворительно, полностью себя обслуживает, выполняет лёгкую работу по дому и хозяйству.
Заключение
Случай интересен тем, что в большинстве своём миастения проявляется в молодом возрасте и чаще встречается у женщин. Но нужно помнить, что есть и второй пик миастении в пожилом возрасте, причём чаще у мужчин. Важное значение имеет знание клинических проявлений этого заболевания, а также использования дополнительных методов исследования (в данном случае ЭНМГ).
Зубцовская центральная районная больница, Тверская область
Эктопическая тимома у больной с поздним дебютом миастении
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(7): 70‑73
Жданов Г.Н. Эктопическая тимома у больной с поздним дебютом миастении. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(7):70‑73.
Zhdanov GN. Ectopic thymoma in a female patient with late-onset myasthenia. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2012;112(7):70‑73. (In Russ.).
Миастения (myasthenia gravis, МА), или болезнь Эрба—Гольдфлама—Джоли, — тяжелое прогрессирующее аутоиммунное заболевание, характеризующееся нарушением нервно-мышечной передачи и клинически проявляющееся слабостью и патологической утомляемостью поперечнополосатых мышц.
Описанная более 100 лет назад под названием бульбарного паралича МА является относительно редким заболеванием: 0,5—5 случаев на 100 000 населения, дебют чаще всего приходится на 3—4-е десятилетие жизни [1, 7, 12, 14, 15, 21]. Согласно современным исследованиям [2—4, 8, 10, 13, 16, 17, 23], в основе патогенеза МА лежит явление аутоагрессии, направленной на холинорецепторы постсинаптической мембраны и пресинаптические структуры, приводящей к изменению функционального состояния ионных каналов. В свою очередь аутоиммунный процесс при МА обусловлен патологией вилочковой железы, ее гиперплазией с образованием лимфатических фолликулов и/или неоплазией, которая чаще проявляется в виде лимфоэпителиальной тимомы. Благоприятное влияние тимэктомии на состояние больных МА является существенным аргументом в пользу данной концепции [9, 11, 18, 24].
Тимомы относят к наиболее частым новообразованиям средостения, выявляя их у 10—60% больных МА. При этом опухоль вилочковой железы обнаруживают у 37,8% мужчин, заболевших в возрасте от 31 года до 40 лет, и 31,7% женщин этого же возраста, а в 41—50 лет — у 25,0% мужчин и 32,6% женщин [11, 18, 24].
Топографически тимомы могут встречаться в различных отделах средостения: в переднем — у 75,0% пациентов, в переднем верхнем — у 15,0%, в верхнем — у 6,0%, в шее, среднем и заднем средостении — у 5,0%. Согласно предложенной ВОЗ (1999 г.) последней гистологической классификации, основанной на гистологической и иммунофенотипической близости к клеткам кортикального или медуллярного слоев тимуса, все тимомы подразделяются на тип А — медуллярноклеточные, темноклеточные, веретеноклеточные, тип В — кортикальноклеточные, эпителиальные, плоскоклеточные, атипичные, высокодифференцированный рак тимуса и тип АВ — смешанные [9].
В 60% случаев, особенно на начальном этапе своего развития, тимомы клинически не проявляются и часто являются случайной рентгенологической находкой. В более поздний период опухоли тимуса могут проявляться в виде трех групп симптомов: общих, интраторакальных, паратимических. Общие симптомы представлены астеническим синдромом. Интраторакальные — выявляются при сдавлении или прорастании структур средостения опухолью и проявляются чувством стеснения, неприятными ощущениями и болью за грудиной, одышкой, кашлем, охриплостью голоса, перикардитом, плевритом, синдромом верхней полой вены. Респираторные нарушения особенно выражены у детей вследствие сдавливания относительно узкой податливой трахеи. Паратимические симптомы включают в себя ряд иммунологических и других расстройств, встречающихся при МА [11].
Несмотря на яркость и своеобразие клинических проявлений МА, позволяющих в большинстве случаев решать вопросы диагностики на основании результатов изучения анамнеза, осмотра и проведения медикаментозных тестов, правильный диагноз нередко устанавливается только после продолжительного наблюдения. Согласно данным литературы [5, 6, 21], у 32 из 44 больных правильный диагноз был поставлен только через 6—8 мес после появления первых признаков заболевания. Это объясняется малой выраженностью клинической картины МА в начальной стадии, недостаточной осведомленностью практических врачей, к которым впервые обращаются за помощью больные МА.
Примером дебюта генерализованной МА на фоне длительного бессимптомного течения атипично расположенной (внутрилегочной) тимомы может служить собственное наблюдение.
Пациентка К., 69 лет, пенсионерка. С 1997 г. наблюдалась онкологом по поводу периферической опухоли правого легкого, от хирургического лечения отказывалась. При очередном осмотре в областном онкологическом диспансере г. Твери в связи с отрицательной динамикой рентгенологической картины — ростом опухоли, появлением жалоб на одышку, общую слабость пациентка дала согласие на хирургическое лечение. При госпитализации 13.01.10 состояние больной удовлетворительное. Кожные покровы обычной окраски, периферические лимфатические узлы не увеличены, повышенного питания. В легких дыхание везикулярное, хрипы не выслушиваются. Частота дыхательных движений — 17 в покое. Артериальное давление 150/90 мм рт.ст., частота сердечных сокращений 72 в минуту. Лабораторные исследования: в общем анализе крови, мочи, биохимическом анализе крови — без особенностей. При рентгенографии органов грудной клетки в правом легочном поле в средней зоне выявлено округлое образование с четкими контурами, выполняющее всю долю. Из-за длительного существования периферического образования средней доли правого легкого было сделано заключение о его доброкачественном генезе. Однако из-за появления симптомов острой респираторной вирусной инфекции и гипертонического криза (АД 240/120 мм рт.ст.) было решено воздержаться от оперативного вмешательства с последующей явкой в областной онкологический диспансер через 1,5 мес.
В связи с ухудшением состояния, появлением жалоб на слабость в мышцах лица, шеи и конечностях, затрудненное дыхание, трудность при глотании твердой и жидкой пищи 09.06.10 больная была госпитализирована в неврологическое отделение. В неврологическом статусе отмечались птоз век, двусторонний офтальмопарез, слабость круговых мышц глаз, жевательной мускулатуры, бульбарный синдром, слабость мышц шеи, голова свисала вперед и не держалась без помощи рук, выявлялся тетрапарез преимущественно в проксимальных отделах конечностей, сила снижена до 2—3 баллов. Мышечный тонус низкий D=S, сухожильные рефлексы снижены D=S, патологические рефлексы не определялись. Ходьба была возможна только с посторонней помощью. Общие анализы крови и мочи нормальные. Биохимический анализ крови отклонений от нормы не выявил. Электрокардиограмма: синусовый ритм, отклонение электрической оси влево, блокада левой передней ветви пучка Гиса, гипертрофия левого желудочка. Магнитно-резонансная томография (МРТ) головного мозга (06.07.10): в белом веществе лобных и теменных долей определяются множественные очаги гиперинтенсивного МРТ-сигнала на Т2 ВИ и FLAIR, неправильной формы с нечеткими контурами, размером 0,5—0,7 см, без перифокального отека, объемного эффекта. Боковые и III желудочки не расширены. IV желудочек не изменен. Базальные цистерны не деформированы. Хиазмальная область без особенностей, ткань гипофиза имеет обычный сигнал. Определяется нерезкое расширение субарахноидального пространства конвекситальной поверхности и кортикальных борозд, периваскулярных пространств за счет церебральной атрофии. Срединные структуры не смещены. Миндалины мозжечка расположены обычно. На серии ангиограмм, выполненных в режиме TOF в аксиальной проекции с последующей обработкой по MIP-алгоритму и трехмерной реконструкцией, визуализированы внутренние сонные, основная, интракраниальные сегменты позвоночных артерий и их разветвления. Вариант развития виллизиева круга в виде отсутствия кровотока по задним соединительным артериям (виллизиев круг разомкнут). Просветы остальных сосудов равномерные, МРТ-признаков гемодинамически значимого стеноза и наличия аневризмы не найдено. Заключение: очаговые изменения субкортикальных отделов лобных, теменных долей, предположительно сосудистого генеза. Проявления церебральной атрофии. Убедительных данных за острое нарушение мозгового кровообращения и внутричерепной объемный процесс на момент исследования не найдено.
Учитывая развитие генерализованной мышечной слабости, была заподозрена МА и пациентке выполнена компьютерная томография (КТ) грудной полости (09.07.10). В нижних отделах правого легкого визуализируется округлое солидное образование диаметром около 75 мм, с четкими крупноволнистыми контурами, расположенное на неизмененном легочном фоне. В медиальных отделах образования видны кальцификаты. В паренхиме легких очаговых и инфильтративных изменений не обнаружено. В средостении дополнительных образований не обнаружено, лимфоузлы не увеличены. Заключение: признаков тимомы нет. Имеется образование в правом легком, судя по размерам длительно существующее (вероятно, доброкачественное), однако из-за невозможности оценить динамику процесса однозначно высказаться о его характере нельзя.
Существующая клиническая картина и наличие образования в правом легком неизвестного характера индуцировали проведение в этот период дифференциальной диагностики между МА и миастеническим синдромом Ламберта—Итона.
В течение 2 нед после возникновения первых симптомов заболевания у пациентки усугубились имеющиеся расстройства, появилась слабость в дистальных отделах конечностей, мимических и жевательных мышц, усилились нарушения речи, глотания, дыхания. Развился тяжелый миастенический криз с нарушением дыхания, потребовавший перевода больной в реанимационное отделение и проведения интенсивной терапии, включая антихолинэстеразные препараты, глюкокортикостероиды, плазмаферез. Отмечена положительная динамика в состоянии больной, улучшилась речь, наросла сила скелетных мышц, в мышцах лица, увеличился объем движений глазных яблок, уменьшился птоз. Больная была консультирована торакальным хирургом. Анализируя анамнез заболевания, результаты инструментальных исследований, наличие образования в правом легком и генерализованной МА было сделано предположение об атипично расположенной тимоме. После компенсации миастенических проявлений больной рекомендовано оперативное лечение.
07.10.10 пациентка была госпитализирована в Национальный медико-хирургический центр им. Н.И. Пирогова для хирургического лечения. При поступлении предъявляла жалобы на выраженную мышечную слабость в конечностях, больше в нижних, одышку при физической нагрузке, утомляемость. При осмотре общее состояние больной средней тяжести. Кожные покровы обычной окраски, лимфоузлы не увеличены. В легких дыхание везикулярное, с жестким оттенком, проводится во все отделы, хрипов нет. ЧДД — 16 в минуту. Область сердца не изменена, аускультативно тоны приглушены, ритмичные. ЧСС 78 в минуту. АД 130/80 мм рт.ст. Живот мягкий, безболезненный, печень и селезенка не увеличены. Отеков нет. Общий анализ крови, мочи, коагулограмма, биохимический анализ крови — без патологии. В неврологическом статусе слабость краниобульбарной мускулатуры, слабость в мышцах конечностей, больше в нижних, положительный синдром патологической мышечной утомляемости. КТ органов грудной клетки в правом кардиодиафрагмальном углу определяется опухоль неопределенной формы размерами 92x78x85 мм. Структура однородна со средним денситометрическим показателем 37 ед. Н. Опухоль имеет экспансивный тип роста.
После получения информированного согласия больной 07.10.10 проведена правосторонняя торакотомия, атипичная резекция средней доли легкого. При ревизии плевральная полость свободна от спаек. В правом кардиодиафрагмальном углу определяется опухоль в капсуле, исходящая из средней доли правого легкого, с бугристой поверхностью, каменистой плотности размерами 94x80x45 мм. Опухоль подрастает к медиастинальной плевре. Лимфатические узлы средостения и корня легкого не увеличены. Гистологическое исследование: неэпителиальная (стромальная) веретеноклеточная опухоль с мультицентрическим характером роста и неуточненным потенциалом злокачественности. Морфологически с учетом локализации и клинической картины не исключена метапластическая тимома с врастанием в легочную паренхиму. Макроскопическое описание: округлое образование размерами 10x8x7 см с прилежащим плоскостным фрагментом легкого 3 4 см (плоскость резекции 71—74) в четкой капсуле. На разрезах представлено студенистой тканью с множественными сливающимися узлами диаметром от 0,5 до 4x2,5 см, серо-розового цвета «мясистого» вида. Микроскопическое описание: в готовых препаратах и препарате, изготовленном с блока, кусочки опухолевой ткани из вытянутых и полигональных клеток, формирующих гемангиоперицитомоподобные структуры. Фибробластоподобные клетки формируют тяжи. Структура опухолевой ткани более свойственна тимоме А типа. Для уточнения диагноза на срезах с парафинового блока проведено иммуногистохимическое исследование с использованием антител к CD1a, CD3, CD5, CD20, CD57, BCL2, виментину, панцитокератину (AE1/AE3), EMA, K67. Опухолевые клетки экспрессируют виментин, панцитокератин, EMA, BCL2, CD20 (очаговая реакция). С остальными маркерами реакции в опухолевых клетках негативные. Единичные CD3+ Е-лимфоциты располагаются дискретно. Заключение: морфоиммуногистохимическая характеристика опухолевой ткани соответствует тимоме А типа.
Больная выписана в удовлетворительном состоянии. Послеоперационная рана зажила первичным натяжением. При катамнестическом наблюдении состояние больной остается стабильным в течение всего периода после выписки. Сохраняется умеренная слабость в мышцах верхних и нижних конечностей, жевательных мышцах. Постоянно принимает калимин в дозе 480 мг/сут.
В приведенном наблюдении заболевание дебютировало у пациентки в возрасте 69 лет на фоне бессимптомно протекающей внутрилегочной тимомы. Появление первых симптомов МА и предшествующая рентгенологическая, а затем и нейровизуализационная картина неизвестного образования в правом легком дали основание на раннем этапе провести дифференциальный диагноз МА с миастеническим синдромом Ламберта—Итона.
В соответствии с современными представлениями миастенический синдром Ламберта—Итона, как и МА, относится к аутоиммунным заболеваниям, патогенез которых связан с присутствием аутоантител к потенциалзависимым кальциевым каналам пресинаптической мембраны нервно-мышечного соединения [19, 20, 22, 25]. В 70% случаев миастенический синдром Ламберта—Итона развивается на фоне центрального бронхогенного рака легких (мелкоклеточная карцинома), реже — опухолей другой локализации (в том числе тимомы), которые, как полагают, и запускают аутоиммунный процесс. Необходимо отметить, что указанный синдром может задолго предшествовать выявлению опухоли [19].
Клинически миастенический синдром Ламберта—Итона проявляется мышечной слабостью и утомляемостью проксимальных мышц конечностей при относительной сохранности глазодвигательной и бульбарной мускулатуры. Нижние конечности поражаются в большей степени, чем верхние. Мышечная слабость может быть незначительной, а при повторных движениях сила увеличивается в противоположность тому, что наблюдается при МА. Типичные симптомы при миастеническом синдроме Ламберта—Итона: гипо- или арефлексия, а также нарушения со стороны вегетативной нервной системы (сухость во рту, снижение либидо, уменьшение потливости, ортостатическая гипотензия, изменение зрачковых рефлексов); частой жалобой являются парестезии [22].
Дальнейшее прогрессирование заболевания с вовлечением различных групп мышц, развитие миастенического криза, а также эффективность антихолинэстеразных препаратов позволили исключить миастенический синдром Ламберта—Итона и заподозрить у пациентки МА с атипично расположенной тимомой. Проведенное хирургическое вмешательство, гистологическое и патоморфологическое исследование подтвердили диагноз генерализованной МА и наличие внутрилегочной тимомы.
В литературе нами не обнаружено упоминаний о подобном случае. Представленное клиническое наблюдение свидетельствует о важности и необходимости всестороннего диагностического подхода и совместного наблюдения таких пациентов врачами разных специальностей с целью диагностики МА и миастенических синдромов и выбора адекватной терапии.
ГКБ №51, Московский миастенический центр
НИИ общей патологии и патофизиологии РАМН, Москва
Нейромиотония и миастения у больного с тимомой
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2010;110(5): 101‑103
Санадзе А.Г., Сиднев Д.В., Касаткина Л.Ф., Дедаев С.И., Карганов М.Ю. Нейромиотония и миастения у больного с тимомой. Журнал неврологии и психиатрии им. С.С. Корсакова. 2010;110(5):101‑103.
Sanadze AG, Sidnev DV, Kasatkina LF, Dedaev SI, Karganov MIu. Neuromyotonia and myasthenia in a patient with thymoma. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2010;110(5):101‑103. (In Russ.).
Нейромиотония - синдром постоянной активности мышечных волокон, клинически проявляющийся периодическими болезненными судорогами (крампи), ощущением постоянного напряжения в различных группах мышц, фасцикуляциями и миокимиями [8]. Она относится к группе болезней, связанных с патологией ионных каналов: с выявлением антител к потенциалзависимым калиевым каналам периферического аксона [10, 12]. На иммунный генез заболевания указывает его сочетание с другими аутоиммунными болезнями: миастения, хроническая воспалительная демиелинизирующая полинейропатия, воспалительные миопатии (полимиозиты), тиреотоксикоз, зоб Хасимото и др. [4, 5, 7, 9]. Свидетельством паранеопластического компонента синдрома является выявление у больных с нейромиотонией опухолей различного генеза и локализации, среди которых наиболее часто встречаются тимомы, бронхогенные и мелкоклеточные карциномы легких [2, 3, 8, 12].
Тимомы выявляются у больных миастенией и нейромиотонией примерно с одинаковой (около 20%) частотой, однако весь предшествующий многолетний опыт наблюдения за большим количеством больных миастенией не выявлял случаев сочетания этих болезней. Это обстоятельство вызывало определенное недоумение в связи с тем, что в литературе имелись отдельные публикации о сочетании нейромиотонии и миастении у больных как с наличием, так и отсутствием тимомы [1-3, 7, 11]. В связи с этим мы считаем необходимым поделиться собственным клиническим наблюдением.
Больной М., 50 лет, впервые обратился в декабре 2007 г. с жалобами на повышенную утомляемость и слабость, чувство скованности и напряжения в мышцах лица, туловища и конечностей, потерю массы тела. В июне-июле 2007 г. отметил быструю потерю массы тела - 15-20 кг за 2 мес при нормальном аппетите. С этого же времени отмечает выраженную общую слабость, утомляемость и субфебрильную температуру. Эти жалобы явились причиной детального обследования больного, выявившего при КТ грудной клетки объемное образование средостения. В октябре 2007 г. в МОНИКИ методом стернотомии была произведена операция - тимомтимэктомия. Удалена инкапсулированная опухоль, гистологически определяемая как кортикально-клеточная тимома типа В. Однако после операции состояние больного не изменилось.
Объективно при осмотре в декабре 2007 г.: пациент эмоционально лабилен, вегетативен, астенизирован, постоянно пытается лечь. Пониженного питания. «Страдальческое» выражение лица. В неврологическом статусе глазодвигательных и бульбарных нарушений нет. Сила в мимической и в туловищной мускулатуре - нормальная. Синдром патологической мышечной утомляемости после физической нагрузки отсутствует. Сухожильные рефлексы на руках и ногах несколько снижены, симметричны. Патологических знаков, нарушений чувствительности нет. Имеется тремор в руках и ногах, усиливающийся при напряжении. Клинически видимых фасцикуляций и миокимий не наблюдается.
При исследовании нервно-мышечной передачи методом непрямой ритмической стимуляции декремента амплитуды М-ответа при стимуляции частотой 3 имп/с выявлено не было.
Исследование скорости распространения возбуждения (СРВ) по моторным аксонам периферических нервов выявило признаки пронаторного (n. medianus) и фибулярного (n.peroneus) туннельных синдромов, а также снижение амплитуды М-ответа на n. peroneus и минимальное снижение СРВ на n. tibialis.
Таким образом, данные клинического и электрофизиологического исследования не выявляли признаков миастении, а указывали на наличие синдрома гиперактивности двигательных единиц скелетных мышц, которые были расценены как нейромиотония. В связи с этим больному было начато лечение карбамазепином (финлепсином) в дозе 200 мг 2 раза в день. Учитывая паранеопластический характер синдрома, к лечению добавили метипред в дозе 40 мг через день. Взят анализ крови на антитела к ацетилхолиновым рецепторам, потенциалзависимым кальциевым каналам и титин-белку.
На фоне проводимой терапии была отмечена отчетливая положительная динамика в виде уменьшения скованности, тремора и общей слабости. Больной прибавил в весе 5 кг. Вместе с тем стал отмечать повышенную потливость, сердцебиение, повышение артериального давления и ощущения жжения в стопах, особенно в день приема глюкокортикоидных препаратов. В неврологическом статусе никаких признаков слабости и патологической мышечной утомляемости не отмечалось.
При исследовании СРВ сохранялось снижение амплитуды М-ответа и СРВ на n. peroneus и n. suralis.
При исследовании ПДЕ и спонтанной активности отмечалось некоторое укрупнение параметров ПДЕ, значительное снижение выраженности потенциалов фасцикуляций. Однако сохранялась постоянная активность двигательных единиц и отдельные вспышки активности в виде ду- и триплетов, но удавалось добиться полного расслабления мышцы, которое продолжалось не более 2 с.
Антитела к ацетилхолиновым рецепторам не выявлены.
Концентрация антител к потенциалзависимым кальциевым каналам 12,7 Пмоль/л (норма до 20,0 Пмоль/л).
Уровень антител к титин-белку - 0,3 усл.ед. (норма до 1,0 усл.ед.).
С учетом данных клинического осмотра, динамического электромиографического исследования и отсутствия аутоантител было рекомендовано уменьшение дозы метипреда до 16 мг через день и увеличение дозы финлепсина до 200 мг 3 раза в день.
К июню 2008 г. пациент прибавил в весе 10 кг. В неврологическом статусе выявлялось лишь снижение коленных и практическое отсутствие ахилловых рефлексов, а также минимальный тремор пальцев рук.
При электромиографическом исследовании отмечалась нормализация параметров ПДЕ, сохранялась постоянная активность двигательных единиц, но продолжительность полного расслабления мышцы увеличилась до 4 с. Регистрировались лишь единичные потенциалы фасцикуляций, сохранялись дуплеты, но их частота значительно снизилась.
Исследование СРВ выявило ее снижение по n. suralis.
Непрямая ритмическая стимуляция дельтовидной мышцы не выявила признаков нарушения нервно-мышечной передачи.
Рекомендовано уменьшение дозы финлепсина до 200 мг 2 раза в день и метипреда до 8 мг через день.
В декабре 2008 г. неврологический статус без динамики. Результаты электромиографического исследования существенно не отличаются от данных июня 2008 г. КТ средостения - данных за рецидив тимомы нет. Рекомендовано уменьшение дозы финлепсина до 300 мг в сутки, а метипреда - до 4 мг через день.
Весной 2009 г. пациент самостоятельно прекратил прием глюкокортикоидных препаратов, после чего отметил ухудшение состояния в виде появления слабости и утомляемости, затруднений глотания пищи. В этой связи вновь начат прием метипреда в дозе 16 мг через день. На фоне лечения отмечает улучшение состояния в день приема метипреда, тогда как в другой день сохраняется слабость и умеренно выраженные бульбарные расстройства. Доза финлепсина - 100 мг 2 раза в день.
В июне 2009 г. на фоне продолжающегося лечения в неврологическом статусе: снижение силы в мимической мускулатуре - 3 балла. Затруднения при жевании. Появление гнусавости голоса при длительном разговоре. Эпизоды нарушений глотания. В туловищной мускулатуре отмечается снижение силы: шея - 4 балла, дельтовидная - 3 балла, трехглавая - 4 балла, пояснично-подвздошная - 4 балла. Синдром патологической мышечной утомляемости после физической нагрузки с увеличением слабости на 1 балл.
Через 40 мин после введения 1,5 мл 0,05% раствора прозерина отмечается уменьшение выраженности бульбарного синдрома и увеличение силы мышц на 1 балл. Проба расценена как положительная.
При исследовании нервно-мышечной передачи в дельтовидной мышце выявлен декремент амплитуды М-ответа - 16% с его усугублением в период постактивационной депрессии - 38%.
Повторный анализ сыворотки крови на антитела к ацетилхолиновому рецептору выявил увеличение титра - 13,7 Нмоль/л (норма до 0,4 Нмоль/л).
Таким образом, полуторагодичное наблюдение за больным с удаленной тимомой типа В выявило наличие синдрома постоянной активности двигательных единиц, расцененное как нейромиотония с последующей трансформацией в миастению с клиническими, электрофизиологическими и иммунологическими проявлениями болезни.
Антитела к потенциалзависимым калиевым каналам выявляются примерно у 40% больных с нейромиотонией [11]. Эти же антитела могут быть обнаружены и при других клинических формах синдромов гиперактивности двигательных единиц и мышечных волокон, таких как «cramp-fasciculation», «rippling muscle syndrome» и «facial myokymia» [6, 9]. У 20% больных нейромиотония сочетается с тимомой, а у 70% - с миастенией и повышением уровня аутоантител к ацетилхолиновым рецепторам. У 20% больных нейромиотонией увеличение концентрации антител к ацетилхолиновым рецепторам выявляется даже при отсутствии миастении [5, 8, 11]. Вместе с тем, несмотря на частое сочетание нейромиотонии с тимомой, увеличения уровня антител к поперечнополосатым мышцам отмечено не было [7, 11].
Особенностью представленного наблюдения является трансформация нейромиотонии в миастению с регрессом клинических проявлений синдрома гиперактивности двигательных единиц и появлением мышечной слабости и патологической мышечной утомляемости. Важным обстоятельством является и то, что в период манифестации нейромиотонии у больного не выявлялось никаких клинических, электрофизиологических и иммунологических признаков миастении. Несмотря на то что исследование антител к потенциалзависимым калиевым каналам не проводилось, никаких других антител, включая аутоантитела к ацетилхолиновым рецепторам, потенциалзависимым кальциевым каналам, ганглиозидам класса GM1, мышечной специфической тирозинкиназе (Musk) и титин-белку, выявлено не было. И только в период появления клинических и электрофизиологических проявлений миастении отмечено увеличение уровня антител к ацетилхолиновому рецептору.
Трудности диагностики миастении и полимиозита
В статье ставится задача привлечения внимания к проблемам диагностики миастении и полимиозита, и в чем конкретно заключаются ее трудности. Миастения и полимиозит — это миопатии, каждая из которых имеет свой собственный патогенез. В работе показано, что в клинической симптоматике пациентов с этими заболеваниями наблюдаются схожие признаки, и самыми главными из них являются повышенная утомляемость и выраженная мышечная слабость. Нередко встречается сочетание заболеваний миастения-полимиозит. При наличии данного комплекса крайне сложной становится выработка критериев отнесения больных к миастении или к полимиозиту. Чтобы наглядно понять, чем представлены сложности дифференциальной диагностики, в качестве примера будет разобран клинический случай.
Ключевые слова: миастения, полимиозит.
Миастения — это аутоиммунное заболевание с нарушением нервно-мышечной передачи и выработкой аутоантител, направленных против собственных никотиновых рецепторов ацетилхолина.
При миастении снижение уровня надежности нервно-мышечной передачи связано с уменьшением плотности холинорецепторов. Это уменьшает вероятность того, что молекула АХ найдет свободный рецептор для взаимодействия с ним прежде, чем она гидролизуется под действием АХЭ. Конечным результатом будет уменьшение потенциала концевой пластинки в ответ на нервный импульс.
В механизме развития миастении играют роль аутоиммунные процессы: антитела и аутореактивные Т-клетки поражают антигенные мишени полипептидной природы, расположенные на постсинаптической мембране и в мышечной клетке. К ним относятся: мышечный ацетилхолиновый рецептор, мышечная специфическая тирозинкиназа, рианодиновый рецептор, титин-протеин и другие белки миоцитов [1].
Провоцирующими факторами могут быть стресс, перенесённаяОРВИ, нарушение функции иммунной системы.
Часто миастения развивается на фоне других аутоиммунных заболеваний: ревматоидного артрита, системной красной волчанки и т. д.
При электронно-микроскопическом исследовании биоптатов мышц в нервно-мышечных синапсах выявляются расширение зоны синаптического контакта, удлиненная постсинаптическая мембрана, увеличенное количество лимфоцитов в области двигательной концевой пластинки [2].
Клинические проявления миастении: повышенная мышечная утомляемость, диплопия, птоз век, затруднения при глотании, дизартрия, «гнусавость голоса», нарушение дыхания, ощущение учащенного сердцебиения, склонность к запорам или, наоборот, к жидкому стулу [3].
Очень часто возникновение миастении связано с патологией вилочковой железы: увеличение числа зародышевых фолликулов, Т-лимфоцитов и тимических В-клеток, активно продуцирующих АТ к АХР [4].
Морфологическое исследование вилочковой железы, проведенное у 146 больных генерализованной миастенией, выявило гиперпластический иммунный процесс у 94 % больных с ювенильной миастенией и у 75 % взрослых пациентов. Частота выявления тимом у больных миастенией составляет 9-16 % (чаще наблюдается у женщин моложе 40 лет) [5]. Для миастении, сочетающейся с тимомой, характерен широкий спектр аутоантител к различным антигенным мишеням периферического нейромоторного аппарата [6].
Диагноз миастении является несомненным при её подтверждении по четырём критериям диагностики: клиническим, фармакологическим, электромиографическим и иммунологическим; достоверным — при трех критериях; вероятным — при двух критериях; сомнительным — при наличии одного критерия [7].
Показатели заболеваемости 2-10 случаев в год на 10000 населения, пик заболеваемости 30 лет. Женщины страдают чаще, соотношение Ж:М=3:2.
Полимиозит — системное аутоимунное заболевание мышечной ткани, при котором в скелетных мышцах происходит воспалительный процесс за счет инфильтрации лимфоцитов.
Одна из причин возникновения полимиозита — это вирусы, поэтому миозиты развиваются как вторичные поражения при инфекционных заболеваний. Провоцирующими факторами могут быть переохлаждение организма, инсоляции, хронические инфекции, травмы, лекарственная аллергия.
В патогенезе играет роль клеточно-опосредованный иммунный ответ против мышечных волокон. Происходит инвазия не подвергшихся некрозу мышечных волокон эндомизиальными воспалительными клетками (CD8+ Т-клетками и макрофагами).
Структурные изменения в пораженных мышцах сильно варьируют: некрозы, фагоцитоз, базофилия, отражающая регенеративную активность, большие везикулярные ядра и заметные ядрышки в клетках, атрофия мышечных волокон, лимфоцитарные инфильтраты в периваскулярных областях, гиперплазия соединительной ткани в эндомизии и перимизии.
Клиника полимиозита: симметричная мышечная слабость и боли в мышцах, парезы, снижение сухожильных рефлексов, маскообразность лица, дисфагии, диплопия, птоз, появление кальцификатов в мышечной ткани.
Заболеваемость 2,18-7,7 случая в год на 1 миллион населения, пик заболеваемости 40-60 лет. Женщины страдают чаще, Ж:М=1,5:1,0 [8].
Среди 2000 больных миастенией комплекс миастения-полимиозит выявлялся у 36, чаще у мужчин среднего возраста. При наличии данного сочетания сложной становится выработка критериев отнесения больных к миастении или к полимиозиту. На примере рассмотрим, в чем заключаются трудности диагностики [9].
Больная N в первый раз обратилась за помощью в феврале 2015. Тогда врачи поставили диагноз: миастения (3В) генерализованная форма с бульбарными расстройствами. Пройдя курс терапии, больной стало лучше. В октябре 2015 больная N снова поступает в клинику с жалобами на выраженную общую мышечную слабость в конечностях, невозможность самостоятельно передвигаться, нарушение дыхания, глотания, поперхивание при приеме пищи, слабость мышц шеи, мимической мускулатуры, гнусавость голоса. Вновь врачи ставят диагноз миастения. Однако состояние больной постепенно ухудшается, ее переводят в реанимацию. Проводимые исследования, которые помогли поставить диагноз: СКТ органов грудной клетки (признаки новообразования переднего средостения), ОАК (лейкоцитоз до 14,5×10 9 /л, палочкоядерный сдвиг формулы до 14 %), биохимический анализ крови, прозериновая проба (отрицательный результат), люмбальная пункция (без патологии), определение иммуноглобулинов в крови, общий анализ мочи (наличие белка в течение недолгого времени). При неврологическом осмотре наблюдалась слабость мышц до 1,5 баллов и снижение сухожильных рефлексов. Больной назначали глюкокортикостероиды, плазмаферез для устранения бульбарных нарушений, слабости дыхательных мышц, после чего из-за состояния пониженного иммунитета-иммуноглобулины. При исследовании мокроты дыхательных путей после долгого нахождения в реанимации были обнаружены грибы рода Candida. Позднее, паталогоанатом дает заключение по результатам аутопсии: генерализованная миастения, осложненная полимиозитом. В ходе анализа случая и изучения особенностей дифференциальной диагностики миастении и полимиозита было установлено:
1. Следует обращать особенное внимание на результаты поверхностной и игольчатой электромиографий.
2. Биопсия мышечной ткани является важным звеном в диагностике.
3. Ослабление сухожильных рефлексов дает еще один балл в пользу полимиозита.
4. Прозериновый тест. При миастении тест положителен, наблюдается динамика уменьшения двигательных расстройств. Но в случае с больной N заболевание миастении было осложнено полимиозитом, прозериновый тест был отрицательным, что и составляет трудность для диагностики заболеваний.
5. Анализ крови на антитела к собственным холинорецепторам.
6. ОАК, исследование крови на КФК, АЛТ, АСТ, ускоренное СОЭ и сдвиг лейкоцитарной формулы влево, увеличение количесва лейкоцитов будут указывать на наличие полимозита.
7. КТ\МРТ средостения (тимома, возникновение которой часто бывает связано с миастенией) и бедра (для опредения поражения мышечных волокон, связанных с полимиозитом).
8. Анализ ответной реакции на проводимую терапию.
Если диагностика полимиозита и миастении вызывает трудности, следует провести вышеперечисленные исследования и на основании полученных данных уточнить ранее поставленный диагноз. В качестве лечебных мероприятий можно использовать глюкокортикостероиды, цитостатики, антихолинэстеразные препараты, проводить внутривенное введение иммуноглобулинов, плазмоферез, тимэктомию.
Вывод: В ходе изучения материалов для написания данной статьи удалось выявить признаки заболеваний миастения и полимиозит, встречающиеся как отдельно, так и в качестве комплексного сочетания. Разбор клинического случая показал, с какими сложностями могут столкнуться врачи при дифференциальной диагностике заболеваний, и насколько актуальной является эта проблема в настоящее время.
- Гехт Б. М., Ланцова В. Б., Сепп Е. К. Роль аутоантител к АХР в патогенезе миастении // Неврологический журнал. — 2003. — Т. 8, Приложение № 1. — С.35-37.
- Поздняков О. М., Никулин В. Г. Морфометрия везикулярного аппарата нервно-мышечного соединения при различных режимах выделения передатчика // Бюл. экспер. биол. — 1988. — № 3. — С.359-362.
- Barohn R. J. How to administer the quantitative Myasthenia Gravis Foundation of America, Inc. — 1996 — Р. 41.
- Ветшев П. С., Санадзе А. Г., Сиднее Д. В. Животов В. А. Антитела к титину у больных с миастенической и не миастенической тимомой // Хирургия. — 2007. — № 6 —С. 42-48.
- Кветной И. М., Ярилин А. А., Полякова В. О., Князькин И. В. Нейроиммуноэндокрино- логия тимуса. //СПб.: Изд. ДЕАН. — 2005. — С. 85-86.
- Санадзе А. Т., Сиднее Д. В., Ветшев П. С., Ипполитов Л. И. Титин, тимома и миастения // Журнал Нейроиммунология. — 2006. — С. 65-69.
- Barohn R. J., Mclntire D„ Herbelin /Wolfe G. I., Nations S., Bryan W. W. Reliability testing of the quantitative myasthenia gravis score // Ann. N. Y. Acad. Sci. — 1998 — Р. 32-33.
- Алексеева А. М. Диагностика воспалительных миопатий. - 2013.
- Алексеева А. М. Диагностика и современная стратегия терапии воспалительных миопатий. - 2015.
Основные термины (генерируются автоматически): миастения, полимиозит, мышечная ткань, больной, вилочковая железа, выработок критериев отнесения больных, генерализованная миастения, нарушение дыхания, нервно-мышечная передача, пик заболеваемость.
Читайте также:
