Случай успешного лечения бесплодия на фоне миомы матки
Добавил пользователь Morpheus Обновлено: 21.01.2026
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова Минздрава России, Москва
Эффективность программы ЭКО у женщин с миомой матки
Журнал: Проблемы репродукции. 2012;(6): 43‑46
Мартынова А.Е., Смольникова В.Ю. Эффективность программы ЭКО у женщин с миомой матки. Проблемы репродукции. 2012;(6):43‑46.
Martynova AE, Smol'nikova VIu. THE EFFECT OF UTERINE FIBROIDS ON THE ART OUTCOMES (A REVIEW). Russian Journal of Human Reproduction. 2012;(6):43‑46. (In Russ.).
Влияние миомы матки на результаты программы ЭКО до сих пор изучено недостаточно. Подслизистые и интрамуральные миомы, деформирующие полость матки, снижают частоту наступления беременности в программе ЭКО. Тем не менее остается неопределенным влияние интерстициальных миом, не деформирующих полость матки, на результат программ ВРТ.
За последние 10 лет, несмотря на внедрение в практику более совершенных схем контролируемой стимуляции функции яичников с применением препаратов аналогов гонадотропин-рилизинг гормона (а-ГнРГ) и рекомбинантного фолликулостимулирующего гормона (рФСГ), методики интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ), результаты лечения бесплодия с помощью ВРТ кардинально не меняются, составляя в среднем 30% из расчета на один перенос эмбрионов [2].
Особую группу в программе ЭКО составляют женщины с миомой матки. В последние десятилетия многие женщины в силу ряда социальных причин откладывают деторождение на более поздний срок репродуктивного периода, что ведет к увеличению доли пациенток с гинекологической патологией [1].
Роль и место миомы матки в структуре бесплодия остается спорным вопросом в течение многих лет. Общепризнанно, что само наличие миомы матки далеко не всегда негативно влияет на наступление беременности. Попытки найти зависимость между числом, размером, суммарным объемом миоматозных узлов и частотой наступления беременности не привели к желаемым результатам. Большинство клиник придерживается внутренних протоколов подготовки пациентов с миомой матки к программам ВРТ, основанных на личном опыте, тогда как единого мнения до сих пор нет.
В настоящее время распространено суждение, что миомы, деформирующие полость матки, и подслизистые (субмукозные) миомы значительно уменьшают вероятность наступления беременности и должны быть удалены перед использованием методов ВРТ [8].
В то же время данные литературы относительно влияния интрамуральных и субсерозных миом на исход программ ВРТ неоднозначны.
Нами проведено исследование методом случай—контроль, целью которого явилось изучение результатов лечения бесплодия методом ЭКО и ПЭ у пациенток с интрамуральной миомой матки (в том числе в сочетании с субсерозной) и у пациенток, перенесших миомэктомию. Контрольную группу составили женщины с трубно-перитонеальным фактором бесплодия без патологии миометрия.
Материал и методы
В исследование включены 158 пациенток репродуктивного возраста с трубно-перитонеальным фактором бесплодия (обусловленным отсутствием маточных труб после оперативных вмешательств по поводу внематочных беременностей, воспалительных процессов или с полной непроходимостью маточных труб вследствие хронических воспалительных заболеваний органов малого таза), проходивших лечение методом ЭКО в отделении вспомогательных технологий в лечении бесплодия (рук. отделения д.м.н. Е.А. Калинина) ФГБУ «НЦ АГ и П им. акад. В.И. Кулакова Минздрава России». Сперма супругов была фертильна.
В зависимости от наличия миомы матки и данных анамнеза пациентки были разделены на три группы: 52 пациентки с интрамуральной миомой матки (или в сочетании с субсерозной миомой) до 4 см в диаметре без деформации полости матки (1-я группа); 53 пациентки после лапароскопической миомэктомии (по поводу интрамуральной миомы матки) без вскрытия полости матки (2-я группа). Контрольную (3-ю) группу составили 53 женщины с трубно-перитонеальным фактором бесплодия без патологии миометрия.
Всем проводилось ЭКО со стимуляцией функции яичников препаратами рФСГ по короткому протоколу с антагонистами ГнРГ. Результаты ЭКО оценивались по частоте имплантации, частоте наступления беременности, прерывания беременности и эктопической беременности, частоте рождения живого ребенка.
Результаты оценивались с использованием программы SPSS 15.0 (Statistics Package for Social Sciences). Для сравнения данных использовались t-критерий Стьюдента, χ 2 тест и тест Фишера.
Результаты
Средний возраст больных в группе с миомой матки составил 34,6±4,1 года, в группе пациенток, перенесших миомэктомию, — 35,8±3,9 года, в контрольной группе без патологии миометрия — 34,8±3,1 года. Средняя продолжительность бесплодия — 3,9±1,8; 4,8±1,9 и 3,7±1,6 года соответственно. Изучение репродуктивной функции женщин показало, что первичным бесплодием страдала каждая третья пациентка (36,5, 39,6 и 35,8% соответственно в 1, 2 и 3-й группах), вторичным — 2 /3 женщин (63,5, 60,4 и 64,2%). Анализ репродуктивного анамнеза пациенток с вторичным бесплодием показал, что наиболее частыми исходами предыдущих беременностей были искусственные аборты (90,9, 93,7 и 73,5% соответственно в 1, 2 и 3-й группах), частота самопроизвольных выкидышей по группам составила 24,2, 43,7 и 32,4%, доля внематочных беременностей — 33,3, 18,7 и 58,8% соответственно. Среднее количество неудачных циклов ЭКО статистически не различалось между исследуемыми группами и составило 2,7±0,3, 2,7±0,2 и 2,6±0,2 соответственно группам.
Всем пациенткам помимо стандартного клинико-лабораторного обследования проводилось ультразвуковое исследование (УЗИ) органов малого таза в первую фазу менструального цикла с оценкой количества и среднего размера всех узлов. УЗИ проводилось одним специалистом на аппарате Flex Focus 1202 (фирма «B-K Medical ApS», Дания) с использованием трансвагинального датчика с частотой 7,1 МГц.
Всем пациенткам с миомой матки проводилась соногистерография по стандартной методике с целью исключения деформации полости матки. По данным УЗИ, у них имела место единичная или множественная интрамуральная миома матки (или сочетание интрамуральной и субсерозной миомы) менее 4 см в диаметре, при этом расстояние от полюса наиболее близкого к полости матки миоматозного узла до границы с эндометрием было не менее 3 мм. Среднеe количество миоматозных узлов составило 2,3±0,9. Средний размер наибольшего миоматозного узла — 2,2±0,7 см.
У пациенток с миомэктомией в анамнезе на этапе подготовки к ЭКО была выявлена интрамуральная миома матки (или сочетание интрамуральной и субсерозной миомы) от 4 до 7 см в диаметре. Среднее количество миоматозных узлов составляло 3,0±1,4, средний размер наибольшего миоматозного узла — 4,8±0,8 см. Во всех случаях была выполнена лапароскопическая миомэктомия без вскрытия полости матки с ушиванием ложа удаленных узлов викриловыми швами в два этажа. Всем женщинам очередная попытка ЭКО предпринималась не раньше 6 мес после операции (после формирования полноценного рубца на матке).
Средние дозы рФСГ на стимуляцию составили 2719±1366 МЕ в группе с миомой матки, 2696±1407 МЕ в группе женщин с миомэктомией в анамнезе, 2680±1367 МЕ в контрольной группе и достоверно не различались, как и параметры фолликулогенеза и оогенеза. Среднее количество фолликулов в 1, 2 и 3-й группах составило 12±0,8, 11,6±0,7 и 11,7±0,7 соответственно, количество полученных ооцитов — 8,9±1,3, 8,3±0,6 и 7,9±0,6. Доля зрелых ооцитов (отношение среднего количества зрелых ооцитов к среднему количеству ооцитов) составила 80,9, 77,1 и 83,5% соответственно группам. Процент оплодотворяемости в трех группах колебался от 83,1 до 87,4. Общее количество полученных и перенесенных эмбрионов также статистически значимо не различалось между группами.
Таким образом, значимых различий между группами пациенток в отношении параметров фолликулогенеза, оогенеза и раннего эмбриогенеза выявлено не было.
Всем пациенткам производился перенос 1—2 эмбрионов в полость матки. Среднее число перенесенных эмбрионов составило 1,9±0,2, 1,9±0,3 и 1,7±0,4 соответственно в 1, 2 и 3-й группах.
Частота наступления беременности в 1-й группе составила 23,1%, во 2-й — 30,2%, в контрольной — 41,5%, при этом статистически достоверным было снижение частоты наступления беременности в группе с миомой матки по сравнению с контролем. Частота имплантации составила 11,9, 16,2 и 23,9% соответственно, при этом частота имплантации в контрольной группе была достоверно выше, чем в группах с миомой матки и после миомэктомии. Частота прерывания беременности и частота эктопической беременности составила 5,8, 1,9 и 5,7%; 1,9, 1,9 и 0% соответственно, достоверных различий между группами выявлено не было. Рождением живого ребенка завершились 15,4% беременностей в 1-й группе, 26,4% — во 2-й и 35,8% — в контрольной. При этом частота родов в 1-й группе была достоверно ниже, чем в контрольной (см.таблицу).
На сегодняшний день практически единогласным является мнение о необходимости миомэктомии перед программой ЭКО при субмукозной локализации узлов, независимо от их количества и размеров. В то же время нет достаточных данных, позволяющих сделать вывод о влиянии интрамуральной и субсерозной миомы матки на исход программ ВРТ. Результаты отдельных исследований весьма противоречивы. Систематические обзоры и метаанализы немногочисленны и также не дают окончательного ответа [12, 14, 20]. Исследования различаются между собой не только дизайном, когортой пациенток, анализируемыми параметрами, но и применяемыми методиками ВРТ, что значительно затрудняет обобщение данных. Наиболее дискутабельным является определение критерия «клинической значимости», т.е. соотношения числа, размеров, локализации узлов и других параметров, при которых миомэктомия перед программой ЭКО должна быть выполнена в обязательном порядке [10, 16, 19].
В настоящем исследовании мы опирались на данные F. Oliveira и соавт. [13], а также на опыт нашей клиники, согласно которым размер интерстициального и/или субсерозного миоматозного узла 4 см и более является показанием для миомэктомии перед программой ЭКО. Пациентки всех групп были сопоставимы по возрасту, паритету, числу предшествовавших попыток ЭКО.
Полученные нами данные свидетельствуют о негативном влиянии интрамуральной миомы матки (или сочетания интрамуральной и субсерозной миомы) на частоту наступления беременности, имплантации и родов в программе ЭКО по сравнению с пациентками без миомы матки (частота наступления беременности — соответственно 23,1 и 41,5%; частота имплантации — 11,9 и 23,9%; частота родов — 15,4 и 35,8%). В то же время наличие миомы матки не влияло существенным образом на частоту прерывания беременности и эктопической беременности (5,8 и 5,7%; 1,9 и 0%).
Результаты ЭКО у пациенток, перенесших миомэктомию, были сопоставимы с таковыми у женщин контрольной группы (частота наступления беременности — 30,2 и 41,5%; частота родов — 26,4 и 35,8%) за исключением частоты имплантации, которая была достоверно ниже (16,2 и 23,9%). Частота прерывания беременности и частота эктопической беременности также была сопоставима с контролем (1,9 и 5,7%; 1,9 и 0%).
Отметим, что частота имплантации в группе женщин с миомой матки, также как и в группе женщин после миомэктомии, была достоверно ниже, чем в контрольной группе (11,9, 16,2 и 23,9% соответственно).
Полученные нами данные согласуются с множеством проведенных клинических исследований [3, 4, 7, 22]. Так, данные, полученные E. Surrey и соавт. [21], также свидетельствуют об увеличении вероятности успешной имплантации и прогрессирующей беременности в программах ЭКО/ПЭ и донации ооцитов после выполнения миомэктомии у женщин с субмукозной или интрамуральной миомой, деформирующей полость матки, или интрамуральной миомой без деформации полости, прилежащей к эндометрию на 2 мм и ближе. Сходные данные были получены M. Seoud и соавт. [17] у женщин с неудачами ЭКО в анамнезе, которым перед очередной попыткой ЭКО была произведена миомэктомия преимущественно субсерозных узлов, при этом частота имплантации и прогрессирующей беременности в очередном цикле ВРТ была сопоставима с таковой у женщин контрольной группы, не имевших миомы матки. В исследованиях [5, 6] показан положительный эффект миомэктомии в отношении не только исходов программ ВРТ, но и естественной фертильности.
Существующие разногласия в результатах многочисленных исследований могут быть объяснены отсутствием понимания механизмов влияния различных миом матки на фертильность. В то время как негативное влияние субмукозных узлов вполне объяснимо за счет деформации полости матки, влекущей за собой ряд биохимических и иммунных сдвигов, механизм влияния интрамуральных миом остается неизученным. В литературе [7, 9, 11] обсуждется несколько теорий: негативное влияние на сократительную активность миометрия, снижение кровотока, провоспалительные изменения в эндометрии, теория «инородного тела». Однако убедительного подтверждения ни одна из этих теорий не получила.
Большой интерес представляют данные B. Rackow и соавт. [15], характеризующие рецептивность эндометрия при миоме матки в период «окна имплантации». Авторами было показано значительное снижение экспрессии HOX генов в эндометрии при субмукозной миоме, причем эти изменения носили не локальный, а глобальный характер и не были связаны с размерами узла. Перспективными являются подобные исследования при интрамуральной миоме матки.
Таким образом, представленные нами данные свидетельствуют о значимом негативном влиянии интрамуральной миомы матки (или ее сочетания с субсерозной миомой) на исходы программы ЭКО и ПЭ. Лапароскопическая миомэктомия улучшает прогноз наступления беременности в программе ЭКО, в том числе за счет увеличения частоты имплантации. Изучение молекулярных механизмов влияния миомы матки на репродуктивную функцию может играть решающую роль в определении тактики подготовки пациенток с данной патологией к программам ВРТ. В этой связи вспомогательные репродуктивные технологии представляют огромный интерес, поскольку позволяют создать модель пациента для изучения влияния опухоли на различные звенья процесса наступления беременности, в том числе на процесс имплантации эмбриона.
Случай успешного лечения бесплодия на фоне миомы матки
В августе 2021 года в Чебоксарскую клинику «Лекардо» обратилась 36-летняя женщина с жалобами на обильные кровянистые выделения из половых путей. Кроме того, женщина не могла забеременеть на протяжении двух лет.
Жалобы
Кровянистые выделения со сгустками стали возникать в последние три месяца после каждой менструации. Выделения были мажущие, тёмно-коричневые. Вместе с ними три месяца назад появились тянущие боли внизу живота.
Анамнез
Половое развитие больной соответствует возрасту: регулярная менструация началась с 14 лет по 4-5 дней, болезненная, обильная (по шкале Мэнсфилда - Водэ - Йогенсена), при которой полностью пропитанную прокладку меняют раньше чем через четыре часа. Менструальный цикл длится 28-30 дней. Последняя менструация прошла 8 августа 2021 года. Половую жизнь начала в 26 лет.
Половая жизнь регулярная, партнёр постоянный, контрацепцию не использует, так как планирует беременность. Беременностей, родов и абортов не было. На 12-й день последнего менструального цикла был получен положительный тест на овуляцию, на 16-й день фолликулометрия показала жёлтое тело размером 22 мм в левом яичнике.
Маточные трубы проходимы, спермограмма мужа в пределах нормы. Последнее УЗИ органов малого таза выявило подслизистый (субмукозный) узел на ножке до 14 мм в диаметре по задней стенке матки.
По словам женщины, хронического сальпингоофорита, псевдоэрозии шейки матки, заболеваний молочных желёз и госпитализаций у неё не было, операций не делала.
Туберкулёзом, гепатитом, инфекциями, передаваемых половым путём, ВИЧ, сахарным диабетом, ожирением, детскими и половыми инфекциями не болела. Злокачественных опухолей, травм и профессиональных заболеваний не было. Каких-либо заболеваний внутренних органов и систем, со слов пациентки, нет. Женщина не курит, алкоголь, наркотики и токсические вещества не употребляет.
Наследственность не отягощена. Врождённых патологий (хромосомных заболеваний), пороков развития, гемотрансфузий и аллергии нет.
Обследование
Женщина была в удовлетворительном состоянии и ясном сознании. Температура — 36,4 °C, рост — 167 см, вес — 66 кг, индекс массы тела — 23,7 кг/м 2 . Артериальное давление в норме (120/60 мм рт. ст.), частота сердечных сокращений — 84 раз в мин. Кожа розовая и чистая. Периферические лимфоузлы не увеличены и безболезненны.
При осмотре и прощупывании молочные железы мягкие, безболезненные, без деформаций или втяжений, с мягко-эластичными уплотнениями в серединных и боковых отделах, выделений из сосков нет.
Живот мягкий, безболезненный и симметричный, участвует при дыхании. Признаков раздражения брюшины и болезни почек нет. Вены на ногах нормальные, без сосудистых звёздочек. Стул и моча в норме. Педикулёза и чесотки нет.
Наружные половые органы сформированы правильно. Область вульвы розовая и чистая. Шейка матки чистая, коническая. Наружный зев точечный. Слизистая влагалища розовая с небольшим количеством слизистых выделений. Тело матки нормального размера, плотно-элластичное, подвижное и безболезненное. Придатки справа и слева не увеличены и безболезненны. Своды свободные.
Флюорография паталогии не выявила. УЗИ показало патологическую сокращаемость слизистой оболочки матки, связанную с субмукозным (подслизистым) узлом в её полости.
Диагноз
Лечение
Пациентке без общего наркоза удалили субмукозный узел при помощи офисной гистероскопии и отправили его на гистологическое исследование.
Через две недели после операции женщина пришла на плановый осмотр. За это время прошла необильная менструация. Жалоб не было.
Заключение
Данный клинический случай показывает, как важно не затягивать и обращаться к врачу при появлении первых, даже незначительных на первый взгляд, нарушений. Благодаря своевременному обращению и индивидуальному подходу к лечению пациентке удалось не только избавиться от беспокоящих симптомов с наименьшим вмешательством в организм, но и забеременеть.
Случай успешного вынашивания беременности после органосохраняющей операции по поводу гигантской миомы матки
В январе 2017 года в МОНИИАГ (институт акушерства и гинекологии, расположенный в Москве) обратилась молодая пациентка 38 лет с жалобами на слабость, обильные менструации со сгустками, увеличение живота в объёме, боли в поясничной области. Отмечено снижение гемоглобина до 78 г/л.
Всё вышеперечисленное беспокоит пациентку на протяжении последних трёх лет. В течение последнего года стало беспокоить ещё и частое мочеиспускание.
Приём противовоспалительных и обезболивающих препаратов имел временный эффект. Средства, повышающие гемоглобин, помогали временно, но после очередной обильной менструации гемоглобин значительно снижался, ухудшая самочувствие пациентки.
Семь лет назад была диагностирована миома матки небольших размеров 2*3*2 см, проводилось наблюдение. Пять лет обследуется в связи с бесплодием.
У мамы и у бабушки по материнской линии тоже были миомы матки. Мать в 50 лет перенесла операцию по удалению матки, у бабушки в пожилом возрасте (85 лет) обнаружили злокачественную опухоль матки. У пациентки есть один здоровый ребёнок, она планировала беременность.
При осмотре: кожный покров и видимые слизистые бледные, живот увеличен в объёме за счёт крупного образования, исходящего из полости малого таза. Образование размерами 30*23*18 см, бугристое, подвижное, безболезненное. При осмотре на гинекологическом кресле обнаружена множественная гигантская миома матки.
При УЗИ органов малого таза диагноз множественной гигантской миомы матки подтверждён. В клиническом анализе крови гемоглобин — 63 г/л. При гастроскопии и колоноскопии патологии нет.
Множественная гигантская миома матки с симптомом роста, кровотечения, сдавления мочевого пузыря и болевым симптомом. Анемия тяжёлой степени.
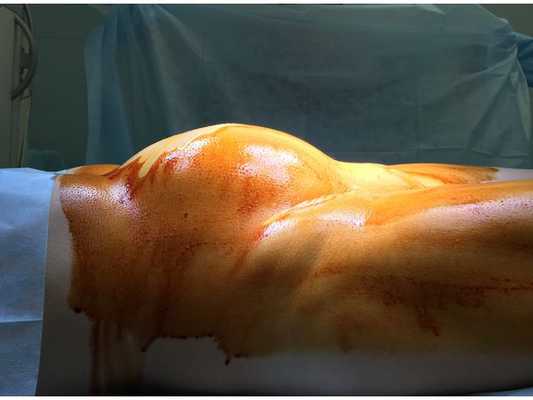
Пациентка на операционном столе (начало операции). Живот увеличен в размере за счёт гигантской миомы матки, соответствующей доношенному сроку беременности
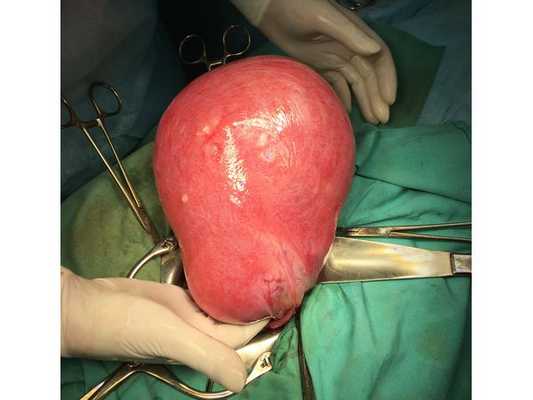
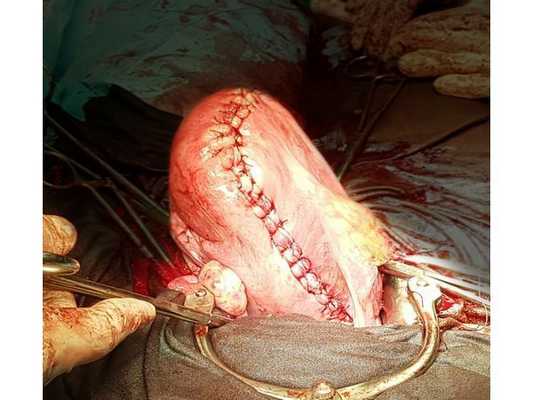
Проведена лапаротомия по Пфанненштилю (поперечный разрез над лобком). Бережно удалены все миоматозные узлы, послойно и аккуратно восстановлена матка, осмотрены придатки матки — патологии нет. На следующий день после операции пациентка была активизирована, сама ходила по отделению, без помощи медперсонала.
Через пять дней после операции при УЗИ органов малого таза — тело матки несколько больше нормы, швы на матке лежат хорошо, гематом и воспалений нет, полость матки без особенностей, придатки матки в норме. В этот же день пациентка в хорошем состоянии была выписана домой. УЗИ органов малого таза через три и шесть месяцев после операции — патологии нет. Тело и придатки матки без особенностей. Рубцы на матке не определяются.
В послеоперационном периоде пациентка соблюдала все рекомендации врачей, менструальный цикл восстановился, через три месяца после операции гемоглобин составил 105 г/л. Через шесть мес после операции на осмотре у врача была разрешена беременность, которая наступила спонтанно через восемь месяцев после операции. В июне 2018 года в МОНИИАГ в доношенном сроке беременности произведено кесарево сечение, родилась живая, доношенная девочка массой 3040 г, ростом 49 см, оценка по шкале Апгар 8 и 9 баллов. Через пять дней после операции женщина с ребёнком выписаны домой. Сейчас малыш растёт и развивается нормально. Рецидива миомы матки в настоящее время нет.
Удаление больших и гигантских миоматозных узлов с сохранением матки можно выполнять только при открытых (лапаротомных) операциях. В руках специалистов высокого уровня шанс сохранить матку и в последующем стать счастливой матерью очень велик, но необходим разумный подход и оценка всех "за" и "против" данной операции. Удаление миоматозных узлов с сохранением матки оправдано у пациенток молодого возраста, планирующих беременность, которые чётко понимают, что риск возобновления роста узлов миомы в дальнейшем очень велик.
Миома матки - симптомы и лечение
Что такое миома матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лубнина Дмитрия Михайловича, гинеколога со стажем в 22 года.
Над статьей доктора Лубнина Дмитрия Михайловича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Миома матки — это хроническое заболевание матки, проявляющееся образованием в ней единичных или множественных узлов различной локализации, ограниченное во времени репродуктивным периодом.
Как устроена женская репродуктивная система:
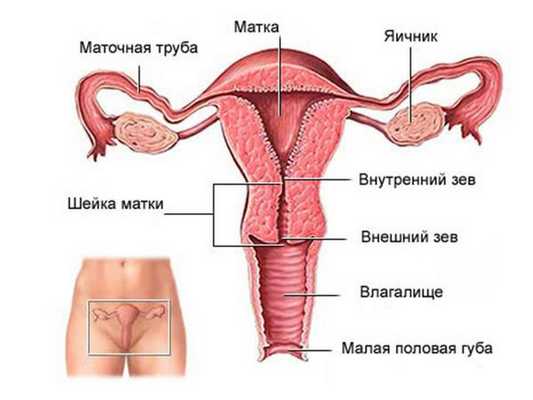
Миома матки не встречается до начала менструаций и регрессирует после менопаузы. Ранее миому матки считали истинной доброкачественной опухолью матки, однако в результате исследований было установлено, что она не в полной мере соответствует критериям опухоли, поэтому миому стали называть опухолеподобным образованием.
Миома матки — довольно распространенное заболевание, частота встречаемости достигает 70-80%, однако в большинстве случаев заболевание протекает бессимптомно. Только в 30-40% случаев наблюдаются клинические проявления миомы. [1] [2]
До сих пор неизвестны причины возникновения миомы матки. Ранее предполагалось, что к её развитию миомы приводят гормональные нарушения, однако эта теория была полностью опровергнута. Миома матки образуется в гормонзависимой ткани и поэтому чувствительна к влиянию половых гормонов, но её рост не запускается нарушением гормонального фона.
Кто подвержен наибольшему риску
Предполагается, что существует наследственная предрасположенность к развитию миомы матки. Миома матки никогда не превращается в злокачественную опухоль и не имеет никакого отношения к развитию злокачественных заболеваний матки.
Миома матки чаще всего диагностируется в возрасте 30-40 лет, однако может встречаться у более молодых женщин в 16-18 лет.
Чем миома отличается от фибромы
Фиброма матки и миома матки — два названия одного и того же заболевания. Если в миоме преобладает фиброзная ткань, такую миому могут называть фибромой, но термин "фиброма" в этом случае будет "просторечным", правильнее всего все миомы называть миомами, независимо от состава. Структура миомы никак не влияет на выбор метода лечения.
Чем опасна миома матки
К осложнениям миомы матки относятcя железодефицитная анемия, сложности с зачатием и вынашиванием, нарушение оттока мочи и повреждение почек.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы миомы матки
Симптомы на ранних стадиях:
В большинстве случаев на ранних стадиях миома матки никак себя не проявляет. Только в 30-40 % случаев она может нарушить качество жизни женщины.
Клиническая картина миомы матки:
- Обильные менструации.
- Чувство давления на мочевой пузырь (учащенное мочеиспускание), давление на прямую кишку (затруднения при дефекации).
- Боли в животе, спине, боли при половой жизни.
- Увеличение живота.
- Бесплодие (редко).
- Невынашивание беременности.
Патогенез миомы матки
Миома матки представляет из себя округлое образование различного размера, состоящее из разного сочетания гладкомышечных и соединительнотканных волокон. Крупные узлы миомы могут достигать 20 см, а сама матка с узлами — размера, соответствующего доношенной беременности.
Миома матки бывает единичной и множественной, то есть в матке может быть несколько небольших узлов или сочетание небольших узлов и нескольких больших или единичный большой узел.
Известно, что каждый узел в матке растет независимо друг от друга из одной-единственной клетки, которая получает дефект, запускающий процесс деления. Женские половые гормоны являются основным фактором роста миомы матки. Эстрогены стимулируют образование рецепторов прогестерона на клетках миомы, в то время как прогестерон запускает деление клеток. Другими словами, два женских гормона дополняют друг друга, но основным гормоном, стимулирующим рост узлов миомы матки, является прогестерон.
Узлы миомы матки растут с непредсказуемой скоростью: одни могут расти достаточно быстро — до нескольких сантиметров в месяц, другие очень медленно — 5-7 мм в год. Часть узлов может прекратить рост и несколько лет не увеличиваться в размере. Некоторые узлы способны самостоятельно нарушить свое кровоснабжение и вызвать некроз, в результате чего узел погибает, уменьшается в размере и больше не растет.
Нет никаких научных доказательств влияния внешних факторов на рост миомы матки. То есть бани, сауны, массажи, загар и физиопроцедуры не оказывают стимулирующего воздействия на рост миомы матки.
В целом поведение миомы матки непредсказуемо, известно лишь, что часть узлов начинает активно расти во время беременности, а после родов уменьшаются в размере, миома матки не растет после наступления менопаузы и подвергается обратному развитию и не встречается до начала менструаций (менархе).
Классификация и стадии развития миомы матки
В зависимости от локализации миома матки бывает:
- Интрамуральная (межмышечная) — растущая в толще стенки матки
- Субсерозная (подбрюшинная) — располагается снаружи матки;
- Субмукозная (подслизистая) — растущая в полости матки
- Шеечная - из шейки матки
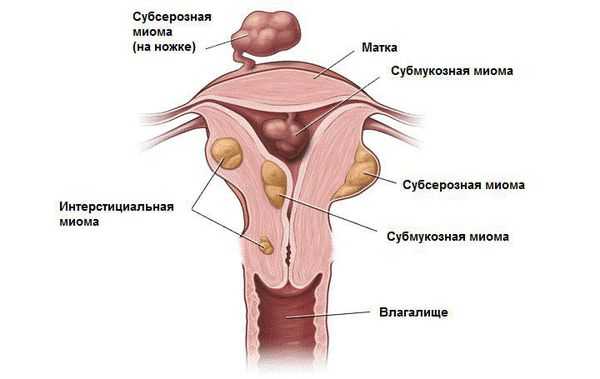
Существуют смешанные локализации, к примеру: интрамурально-субсерозная миома, то есть узел растет из стенки матки, но частично смещен наружу. Кроме этого у узлов описывают направление роста относительно полости матки. Так, миома матки может быть с центрипетальным ростом, то есть расти в сторону полости, или с центрифугальным, то есть наружу.
Узлы субмукозной (подслизистой) и субсерозной локализации также делят на типы в зависимости от их локализации по отношению к полости матки или наружному контуру. Если узел полностью расположен в полости матки — это 0 тип миомы, на 50% — 1-й тип, менее чем на 30% — 2 -й тип. Аналогично называют и субсерозные узлы. Нулевой тип субсерозного узла также называют “миомой на ножке”, при этом ножка может быть как тонкой, так и достаточно широкой.
До сих пор в нашей стране применяют классификацию миомы матки, основанную на соответствии размеров матки срокам беременности в неделях. К примеру, можно встретить такое заключение: “миома матки 11-12 недель”. Эта классификация крайне субъективна и совершенно не информативна. Матка с наличием нескольких мелких узлов или при наличии небольшого субмукозного узла может не увеличиваться в размере. Крупные узлы несимметрично увеличивают в размере матку, и разные доктора будут по-разному оценивать общий размер матки, что может привести к неправильной интерпретации динамики роста узлов. Эта классификация не описывает количество и локализацию узлов, что определяет тактику лечения заболевания.
Миома матки бывает единичной и множественной. От чего зависит, сколько узлов образуется, и с какой скоростью они будут расти — неизвестно. В целом динамика роста узлов непредсказуема. Кроме периода беременности, когда большая часть узлов начинает расти под воздействием прогестерона, нет ни одного научно доказанного фактора, влияющего на рост миомы матки. После наступления менопаузы миома матки подвергается обратному развитию — узлы должны начать уменьшаться в размерах, в них наступают дистрофические изменения.
Некоторые узлы могут самостоятельно погибнуть за счет нарушения своего кровоснабжения. Такого рода “суицид” узла следует рассматривать как благоприятный исход заболевания.
Осложнения миомы матки
Наиболее распространенным осложнением миомы матки является железодефицитная анемия, которая развивается на фоне постепенного увеличения объема менструальной кровопотери. Её проявления не всегда вовремя замечаются пациенткой. На фоне анемии нарастает слабость, снижается трудоспособность, когнитивные функции, ухудшается состояние кожи, ногтей, волос. Нередко именно с этими жалобами пациентка обращается к терапевтам, которые диагностируют анемию и отправляют ее на осмотр к гинекологу, где диагностируется миома матки.
Наличие миомы матки может осложнять реализацию репродуктивной функции. При локализации в полости матки или существенно деформируя ее, миома может препятствовать зачатию или вынашиванию беременности. При крупных узлах или множественной миоме увеличенная в размере матка может занимать большую часть брюшной полости, сдавливая мочеточники, что приводит к нарушению оттока мочи и повреждению почек.
Беременность с миомой матки в ряде случаев может сопровождаться отставанием в развитии плода, преждевременными родами, преждевременным разрывом плодных оболочек, низким весом плода, слабостью родовой деятельности.
Диагностика миомы матки
Диагностика миомы матки не представляет трудностей. Уже во время осмотра на кресле доктор может заподозрить наличие миомы матки, обнаружив увеличение матки и ее бугристость, но осмотр руками не информативен в плане количества, размера и локализации узлов. Золотым стандартом диагностики миомы матки является УЗИ.
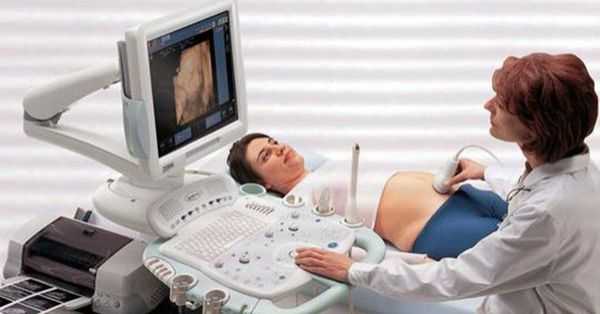
В подавляющем большинстве случаев этого метода бывает достаточно, чтобы описать заболевание. УЗИ обязательно следует выполнять двумя датчиками: влагалищным и абдоминальным (через живот), чтобы не пропустить субсерозные узлы, которые могут располагаться на небольшом удалении от матки. Помимо подробного описания размеров и локализации всех узлов необходимо выполнить графическое изображение расположения узлов миомы матки относительно стенок матки и ее полости, проще говоря, нарисовать, как эти узлы располагаются в матке. Это важно для выбора правильной тактики лечения заболевания, так как только словесное описание может быть истолковано по-разному.
Если размер матки настолько велик, что возможности УЗИ не позволяют полностью оценить ее — рекомендуется проведение МРТ малого таза. Этот метод подробно отображает всю картину заболевания и позволяет оценить размер и точную локализацию узлов.
В некоторых случаях для уточнения локализации узла прибегают к гистероскопии — эндоскопическому методу, при котором в полость матки вводят камеру и визуально оценивают полость матки.
Лечение миомы матки
Не во всех случаях миомы матки требуется проводить лечение. Бессимптомные миомы матки в лечении не нуждаются, но только при соблюдении следующих критериев:
- У пациентки нет признаков железодефицитной анемии
- Возраст пациентки старше 35 лет и нет планов на беременность
- Узлы или не растут, или скорость роста отдельных узлов (субсерозной или интрамурально-субсерозной локализации) не превышает 1 см в год
Во всех остальных случаях требуется лечение.
Какой врач лечит миому матки
Диагностикой и медикаментозным лечением миомы матки занимается гинеколог. Удаление миомы выполняется только эндоваскулярными хирургами, роль гинекологов заключается в определении показаний, подготовке и последующему ведению пациентов.
Так как сама по себе миома матки не опасна, еще раз повторю: она никогда не превращается в злокачественную опухоль.
Вот основные цели в лечении миомы матки:
- Прекратить кровопотерю во время менструации
- Прекратить давление матки на мочевой пузырь, прямую кишку, убрать увеличение живота
- Обеспечить возможность забеременеть и родить ребенка
- Прекратить прогрессивный рост узлов.
Таким образом, перед началом лечения миомы матки надо четко решить, какую задачу вы преследуете, так как от этого будет зависеть выбор метода лечения.
Для лечения миомы матки сегодня оптимально применять следующие методы:
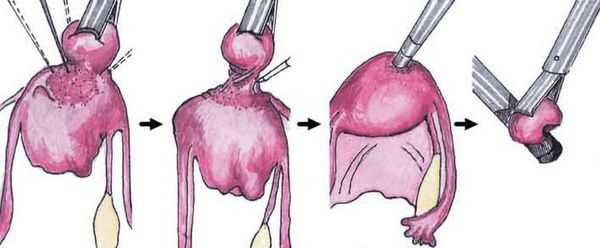
- Миомэктомия — хирургическое удаление узлов миомы матки.
- Эмболизация маточных артерий — метод, при котором прекращается кровоснабжение миоматозных узлов, в результате чего они погибают).
- Лечение миомы без хирургии — медикаментозная терапиямифепристоном.
Все остальные методы лечения или не имеют научных доказательств эффективности (пиявки, гомеопатия, фитотерапия, БАДы), или недостаточно эффективны, то есть эффект временный (ФУЗ аблация, агонисты ГнРГ ) или неэффективны совсем (спираль “Мирена”, контрацептивы).
При выборе метода лечения важно учитывать следующие данные:
- Возраст пациентки.
- Репродуктивные планы: желание забеременеть в настоящий момент (ближайшее время), когда-нибудь или нет планов на беременность.
- Поставленная цель (см. п.2).
Ультразвуковой метод, или ФУЗ (фокусированный ультразвук)
Когда метод только появился на него возлагали большие надежды, так как можно было воздействовать на миому без нарушения кожного покрова. Суть метода в фокусированном тепловом расплавлении узла. Однако в процессе использования оказалось, что метод себя не оправдал и от него сейчас практически отказались. После ФУЗ аблации практически во всех случаях возникают рецидивы, так как узел расплавляется не полностью, кроме этого существует множество ограничений для этого метода, которые не позволяют его использовать у большинства пациентов.
Хирургическое лечение миомы матки
Хирургическое лечение подразумевает удаление из матки миоматозных узлов различными способами: лапароскопически (под контролем камеры через несколько небольших проколов в животе), гистероскопически (так удаляются узлы, расположенные в полости матки. Инструмент и миниатюрная камера вводятся в полость матки через шейку со стороны влагалища) и лапаротомически (через разрез в животе, сейчас применяется все реже и реже). В зависимости от мастерства хирурга из матки можно удалить любое количество узлов практически любого размера, но само удаление узлов не является задачей в лечении миомы матки, так как во многих случаях наличие узлов в матке ничему не мешает.
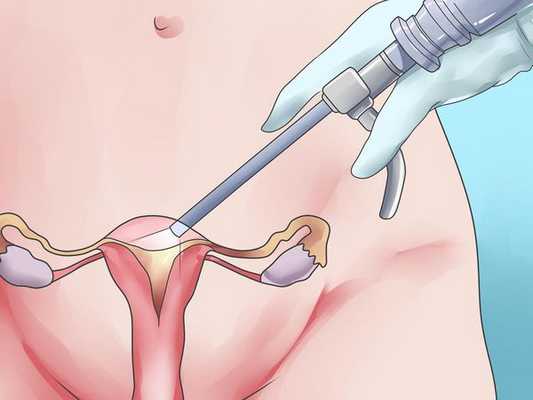
Применение хирургического удаления узлов оптимально только при наличии у пациентки в настоящий момент репродуктивных планов при условии, что миома матки мешает их реализации. При этом в результате удаления узлов матка не должна получить серьезных повреждений (множества рубцов). Как правило, для хирургического лечения подходят субсерозные или субмукозные узлы 0 типа, интрамурально-субсерозные узлы неглубокого залегания в стенку матки. Существенным и значимым недостатком хирургического лечения является высокий риск рецидива заболевания — 7-14% в год [6] , а также риск образования спаек вокруг маточных труб, что может привести к трубному фактору бесплодия или повысить риск внематочной беременности. Кроме этого, хирургическое лечение сопряжено с общими рисками полостной операции под общим наркозом. [6] [12]
Показания к операционному лечению миомы матки:
1. Наличие симптомов миомы матки — обильные менструации, анемия, выявленная в анализах крови, давление на смежные органы (мочевой пузырь, прямую кишку), увеличение живота.
2. Невозможность забеременеть или выносить беременность с имеющимися узлами.
3. Прогрессивный рост узлов.
4. Рост узлов после наступления менопаузы.
Противопоказания к оперированию миомы матки: воспалительные заболевания органов малого таза, пограничные или злокачественные заболевания органов малого таза, нарушения свёртывающей системы, нарушения функции почек, сердечная недостаточность.
Гистерэктомия
Полное удаление матки — гистерэктомия также относится к хирургическим методам лечения миомы матки. Удаление матки объективно показано только в случае гигантских миом, когда общий размер матки соответствует 20-25 неделям беременности, однако бывают исключения. Во всех остальных случаях миому матки можно вылечить без удаления органа, используя описанные выше три метода лечения.
Метод эмболизации маточных артерий (ЭМА)
Эмболизация маточных артерий — малоинвазивный метод лечения миомы матки, заключающийся в прекращении кровоснабжения всех миоматозных узлов в матке, что вызывает гибель этих узлов. Суть метода в следующем: под местным обезболиванием производится пункция бедренной артерии, в сосуд вводят катетер, через который под рентгеновским контролем поочередно вводят микрошарики (эмболы), размером 700-900 микрон, состоящие из инертного полимера, которые блокируют патологический кровоток в матке, в результате чего кровоснабжение узлов миомы матки прекращается и все узлы погибают. Эффективность данного метода составляет 94-96%, все узлы необратимо уменьшаются в размере на 30-60%, проходят обильные менструации и давление на мочевой пузырь.
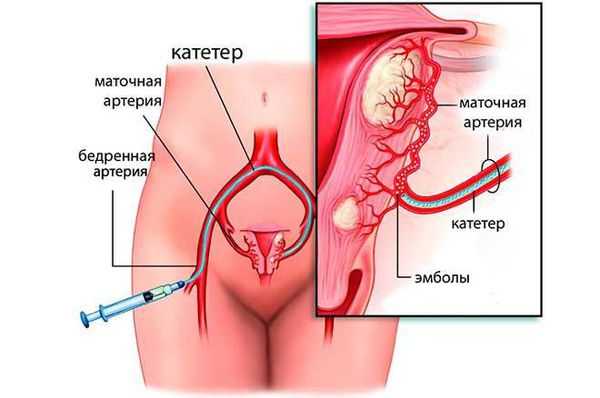
Появление новых узлов после ЭМА случается крайне редко, менее 0,1%. Эта процедура выполняется под местной анестезией, занимает не более 15-20 минут и требует не более 3х дней госпитализации. ЭМА способна решить любую из описанных выше задач в лечении миомы матки. Оптимально применять ЭМА при множественных узлах, узлах глубокого залегания в тело матки, крупных субмукозных узлах. ЭМА не влияет на репродуктивную функцию женщины, поэтому может быть рекомендована пациенткам, планирующим беременность, особенно если беременность планируется отсроченно. В этом отношении ЭМА имеет преимущество перед миомэктомией, так как не сопряжена с рецидивом заболевания и при ЭМА нет риска повреждения маточных труб спаечным процессом. [13] [17]
Прогноз. Профилактика
Прогноз у миомы матки в большинстве случаев благоприятный. Только при запущенных случаях не удается сохранить орган или восстановить репродуктивную функцию. Миома матки чаще всего растет медленно. Как правило, сами пациенты годами не посещают гинеколога, что не позволяет вовремя диагностировать заболевание на начальном этапе и провести лечение. В то же время нередко и сами доктора длительно наблюдают за постепенным ростом узлов, не предпринимая никаких мер, а после предлагают только удаление органа.
Так как причина развития миомы матки неизвестна, никаких профилактических мероприятий не предложено. Некоторые исследования показали, что прием гормональных контрацептивов снижает вероятность появления миомы матки на 24%. [18] Воздержание от массажа, загара, спорта и посещения бань не снижает вероятность заболеть миомой матки.
Если проходить УЗИ органов малого таза 1 раз в год начиная с 21 года, можно вовремя выявить начальную стадию заболевания и провести превентивное лечение.
Динамическое наблюдение (или выжидательная тактика), которое осуществляется 1 раз в 6 месяцев, оправдано только у больных миомой матки, незаинтересованных в наступлении беременности, без клинических проявлений заболевания, небольших размерах узлов и при отсутствие роста опухоли.
Активная тактика подразумевает раннее начало лечебных мероприятий и заключается в применение различных методов лечения.
Современными тенденциями в лечение лейомиомы матки являются:
• более активная тактика ведения больных;
• рост органосохраняющих операций;
• более широкое применение медикаментозного лечения;
• внедрение малоинвазивных технологий.
Возможные методы лечения:
- комбинированный - медикаментозная терапия с последующей операцией
- новый малоинвазивный метод - эмболизация маточных артерий.
Традиционным лечением лейомиомы матки до сих пор считается хирургическое. В большинстве случаев - это радикальное удаление матки.
Однако в настоящее время все чаще производятся реконструктивно-пластические операции (или миомэктомия), особенно у женщин, которые хотят сохранить возможность иметь детей.
Миомэктомия - это удаление только миоматозных узлов, при этом матка сохраняется. Она рекомендует при отсутствие беременности в течение года или при привычном невынашивании беременности на фоне миомы матки. Причем миоматозные узлы удаляются, независимо от их размеров.
Миомэктомия может производиться:
- через разрез брюшной стенки (лапаротомия)
- через небольшие разрезы в передней брюшной стенке. При этом вводится лапароскоп (небольшая металлическая трубка, через которую хирург может видеть и удалять миоматозные узлы).
Серьёзным ограничением применения этого метода является величина и количество миоматозных узлов.
- с помощью гистерорезектоскопии: через трубку введенную через шейку матки под контролем зрения.
Такой доступ возможен при локализации миоматозных узлов в полости матки (как правило, при этом расположении миомы женщина страдает тяжелыми маточными кровотечениями). В результате этой операции значительно сокращается длительность и объем кровопотери при менструациях.
Новые малоинвазивные и неинвазивные методы лечения были предложены в качестве альтернативы хирургическим в течение последних лет. К ним относятся - эмболизация маточных артерий и фокусированная ультразвуковая аблация миоматозных узлов.
Эмболизация маточных артерий проводится пациентам, желающим сохранить репродуктивную функцию, а также тем женщинам, которые категорически отказываются от хирургического вмешательства или которым противопоказаны оперативное лечение и (или) эндотрахеальный наркоз в связи с сопутствующей патологией различных органов.
После тщательного гинекологического обследования (УЗИ, магнитно-резонансной томографии, диагностического выскабливания стенок полости матки, гормонального исследования) решается вопрос о целесообразности проведения данного вида лечения.
Эмболизация маточных артерий выполняется в условиях рентгенооперационной, чаще всего под перидуральной анестезией.
Основная цель вмешательства - «блокировка» сосуда или сосудов, питающих миоматозные узлы. Причем эмболизация проводится всех сосудов, независимо от количества миоматозных узлов.
После успешной эмболизации (непосредственно самой процедуры), которую удается осуществить примерно у 90-100% пациенток, происходит клиническое улучшение состояния (уменьшается кровопотеря во время менструации, боли - у 80-92%), через 3-6 месяцев - уменьшаются размеры матки и миоматозных узлов примерно на 45-60%.
У всех женщин после эмболизации маточных артерий развивается так называемый постэмболизационный синдром, выражающийся в повышении температуры, боли внизу живота, тошноте, но в большинстве случаев (до 75-81 %) при адекватном лечении симптомы исчезают в течение 5-7 дней.
Количество осложнений, по сравнению с хирургическим методом лечения, значительно меньше (составляют не более 1%) и в основном это инфекционные процессы.
Подавляющее число женщин, перенесших эмболизацию маточных артерий, удовлетворены проведенным лечением и отмечают значительное улучшение качества жизни.
Количество новых методов лечения постоянно увеличивается.
Одним из наиболее современных неинвазивных методов лечения является фокусированная ультразвуковая аблация миоматозных узлов под контролем магнитно-резонансной томографии. Метод предназначен для лечения больных лейомиомой матки, заинтересованных в сохранении матки, путем теплового воздействия на клетки за счет высвобождения энергии звуковой волны и изменения локального кровотока в опухолевой ткани.
Для предоперационной подготовки к эндоскопической операции используют так называемых агонисты Гн-РГ.
Сочетание органосохраняющих операций с предоперационной медикаментозной подготовкой к ним позволяет снизить травматизацию и осложнения во время хирургического вмешательства, риск рецидива заболевания и способствует сохранению и повышению фертильности.
Медикаментозное лечение направлено на торможение роста опухоли, уменьшение размеров матки, регресс клинических симптомов, сохранение репродуктивной функции, улучшение качества жизни.
Выбор препаратов зависит от возраста больной, переносимости лекарственных средств, наличия сопутствующей гинекологической патологии и заболеваний внутренних органов.
Механизм действия препаратов, применяемых для лечения миомы матки, в основном, заключается во временном и обратимом угнетении функции яичников.
Существует точка зрения о том, что миома матки является гормонозависимой опухолью и на фоне естественной менопаузы происходит уменьшение размеров узлов. Это послужило основанием для использования так называемых агонистов Гн-РГ. Эти препараты блокируют действие гормонов-стимуляторов выработки половых стероидов (ФСГ, ЛГ).
Агонисты ГнРГ (бусерелин, золадекс, диферелин) широко используются для лечения миомы матки в качестве предоперационной подготовки и в виде длительной терапии (по определенным показаниям).
На фоне лечения этими препаратами временно прекращаются менструации, что приводит к повышению гемоглобина, к увеличению плотности микрососудов, что важно для пациентов с кровотечениями.
Механизм действия основан на создании «псевдоменопаузы». Длительность курса составляет 3 - 6 месяцев (возможно до 12 месяцев)
Даназол - перорально по 1 капсуле (100 или 200 мг) 4 или 2 раза в сутки (суточная доза 400 мг) в течение 3-6 мес, реже 12 мес.
Гестринон (неместран) - назначают перорально, стартовая доза по 2,5мг (в некоторых случаях 5мг) 2 раза в неделю. Продолжительность лечения составляет 3-6 месяцев.
Побочные эффекты андрогенного характера (у 40 - 72% больных) органичивают использование антигонадотропных средств.
Таким образом, не один из методов лечения не может быть единственным. Чаще всего врач комбинирует различные методы лечения, и тем самым достигается наилучший результат.
При этом врач учитывает несколько факторов и в первую очередь желание женщины иметь детей. В последние годы в мире увеличилось число женщин, родивших здоровых детей, после использования современных методов лечения миомы матки.
Для получения наилучшей информации обратитесь к врачу гинекологу. Не все пациентки с миомами матки похожи друг на друга и поэтому очень важно, чтобы ваша индивидуальная ситуация адекватно была оценена специалистом.
Самойлова Т.Е., врач гинеколог-эндокринолог, доктор медицинских наук.
Читайте также:
