Спорные вопросы операции по поводу толстокишечной непроходимости.
Добавил пользователь Alex Обновлено: 01.02.2026
2 ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России
Цель исследования: разработать и патогенетически обосновать оптимальную тактику ведения больных с острой тонкокишечной механической непроходимостью (ОТМН) в послеоперационном периоде. Материал и методы: проанализированы результаты лечения 68 (100%) больных с ОТМН, которым выполнена резекция нежизнеспособного участка кишки в зависимости от степени кишечной непроходимости. Выделены основная (I) группа - 40 (58,8%) больных, которым проводили отмывание тонкой кишки и энтеральное зондовое питание (ЭЗП) в раннем послеоперационном периоде, и контрольная (II) группа — 28 (41,2%) больных, которым динамическую кишечную непроходимость (ДКН) разрешали традиционными способами и осуществляли полное парентеральное питание до разрешения ДКН. Результаты: Сроки разрешения ДКН в I и II группах 30±9,8 и 46,3±13,85 ч соответственно; p
Спорные вопросы операции по поводу толстокишечной непроходимости.
Тбилисский государственный медицинский университет, Грузия
Желчнокаменная кишечная непроходимость (с комментарием)
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2012;(3): 65‑68
Деметрашвили З.М., Асатиани Г.А., Немсадзе Г.Ш., Кенчадзе Г.З. Желчнокаменная кишечная непроходимость (с комментарием). Хирургия. Журнал им. Н.И. Пирогова. 2012;(3):65‑68.
Demetrashvili ZM, Asatiani GA, Nemsadze GSh, Kenchadze GZ. The biliary intestinal obstruction. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2012;(3):65‑68. (In Russ.).
Представлено 3 наблюдения успешного хирургического лечения больных желчнокаменной тонкокишечной непроходимостью. Наиболее информативным методом диагностики такого заболевания считают компьютерную томографию. По мнению авторов, объем оперативного вмешательства должен ограничиваться устранением кишечной непроходимости и только в вынужденных ситуациях может быть произведена одномоментная ликвидация билиодигестивного свища.
Введение
Желчнокаменная кишечная непроходимость - редкое заболевание. Частота ее колеблется в пределах 1-4% общего числа механической кишечной непроходимости. Она является осложнением желчнокаменной болезни. Желчные камни попадают в желудочно-кишечный тракт через внутренние желчные свищи, образующиеся вследствие долгого консервативного лечения калькулезного холецистита, и вызывают обтурацию кишки [1-4, 10].
Это заболевание не характеризуется типичным клиническим течением, что обусловливает позднюю диагностику и запоздалую операцию. Если учесть, что желчнокаменная кишечная непроходимость встречается в основном в старческом возрасте, то становится ясным значение своевременной постановки диагноза. В связи с этим важную роль отводят современным методам рентгенологической и ультразвуковой диагностики. Среди них особое место занимает компьютерная томография (КТ) брюшной полости. Она считается «золотым стандартом» диагностики. С помощью этого метода можно с большой точностью обнаружить характерные рентгенологические симптомы (пневмобилия, обструкция тонкой кишки и наличие желчного камня в просвете кишки) и поставить точный диагноз [2-6, 11].
При желчнокаменной кишечной непроходимости следует предпринимать только экстренное хирургическое лечение. Спорным остается вопрос, можно ли одновременно ликвидировать кишечную непроходимость и желчно-кишечную фистулу или операция должна ограничиваться устранением причин непроходимости. При одномоментных радикальных операциях возрастает операционный риск, так как они технически более сложны. В связи с этим симультанные операции целесообразно производить в особых ситуациях - пациентам молодого возраста, при деструктивном холецистите, перфорации желчного пузыря и двенадцатиперстной кишки [2-4, 6, 8]. В последнее время с целью ликвидации этого заболевания широко используют лапароскопические операции [7, 9].
Материал и методы
В 2000-2009 гг. в клинике общей хирургии центральной клинической больницы Тбилисского государственного медицинского университета по поводу острой механической кишечной непроходимости были оперированы 317 больных. В 3 наблюдениях причиной непроходимости явилась обтурация тонкой кишки желчными камнями.
Результаты
Приводим наши наблюдения.
1. Больная И., 67 лет, поступила в клинику 02.06.2000. Предъявляла жалобы на боли в эпигастральной и мезогастральной области, тошноту, многократную рвоту, сухость во рту. В течение 2 дней не отходят газы и нет стула. На протяжении 22 лет болеет желчнокаменной болезнью. 26 лет назад больную оперировали в связи с внематочной беременностью. Объективно: пульс 104 в 1 мин, ритмичный, АД 130/80 мм рт.ст., температура тела 37,4 °С. Кожа и видимые слизистые нормальной окраски, подкожная клетчатка умеренно развита, язык сухой, с белым налетом. Живот умеренно вздут, мягкий, отмечается болезненность в эпигастральной и параумбиликальной области. Симптом Щеткина-Блюмберга положительный. Аускультативно выслушивается усиленный перистальтический шум. Общий анализ крови: Hb 120 г/л, эр. 3,7·10 12 /л, цв.пок. 0,9, тр. 68‰, л. 11,2·10 9 /л, ммц. 2%, п. 8%, с. 67%, э. 3%, лимф. 15%, мон. 5%; СОЭ 40 мм/ч. На обзорной рентгенограмме брюшной полости на фоне дилатированной тонкой кишки отмечается наличие горизонтальных уровней жидкости. Ультразвуковое исследование (УЗИ) брюшной полости: желчный пузырь размером 9,0×7,0×5,0 см с утолщенными стенками, деформирован, в просвете множественные конкременты разных размеров; тонкая кишка резко дилатирована, с большим количеством жидкого содержимого, наблюдается усиленная маятникообразная перистальтика. Поставлен диагноз острой механической кишечной непроходимости. 02.06 после предоперационной подготовки под эндотрахеальным наркозом произведена срединная лапаротомия. При ревизии в брюшной полости обнаружено до 300 мл мутного содержимого. Тонкая кишка вздута на всем протяжении, на расстоянии 30 см от илеоцекального угла в ее просвете пальпируется конкремент размером 4,0×4,0 см, который полностью обтурирует подвздошную кишку. В подпеченочной области пальпируется плотный инфильтрат, состоящий из желчного пузыря, большого сальника, желудка и двенадцатиперстной кишки. Ниже конкремента произведены энтеротомия, удаление камня, энтерорафия, назоинтестинальная интубация и дренирование брюшной полости. Послеоперационный период протекал без осложнений. Химический анализ конкремента подтвердил его желчный генез. Больная выписана в удовлетворительном состоянии 13.06.
2. Больной В., 56 лет, поступил в клинику 20.11.04. Предъявлял жалобы на схваткообразные боли в брюшной полости, тошноту, многократную рвоту. Заболел 4 дня назад. За это время не отходят газы и нет стула. В 1968 г. больного оперировали по поводу деструктивного аппендицита. Объективно: пульс 96 в 1 мин, ритмичный, АД 140/80 мм рт.ст., температура тела 37,7 °С. Кожа и видимые слизистые нормальной окраски, язык сухой, с белым налетом. Живот вздут, мягкий, отмечается диффузная болезненность. Симптом Щеткина-Блюмберга положительный. Аускультативно выслушивается ослабленный перистальтический шум, симптом «падающей капли» положительный. Общий анализ крови: Hb 108 г/л, эр. 3,2·10 12 /л, цв. пок. 0,9, тр. 78‰, л. 11,0·10 9 /л, п. 7%, с. 71%, э. 1%, лимф. 17%, мон. 4%; СОЭ 24 мм/ч. На обзорной рентгенограмме брюшной полости на фоне дилатации тонкой кишки отмечается наличие горизонтальных уровней жидкости. Поставлен диагноз острой механической кишечной непроходимости. 20.11 под эндотрахеальным наркозом произведена срединная лапаротомия. В брюшной полости обнаружено до 400 мл мутного содержимого без запаха. Тощая кишка резко вздута, на расстоянии 1 м от связки Трейтца в просвете пальпируется конкремент размером 5,0×4,0 см, который обусловливает полную обтурацию кишки. В подпеченочной области определяется плотный инфильтрат, состоящий из желчного пузыря, желудка, двенадцатиперстной кишки и большого сальника. Дистальнее камня произведены энтеротомия, удаление камня, энтерорафия, санация и дренирование брюшной полости. Послеоперационный период протекал без осложнений. Химический анализ камня подтвердил его желчный генез. Больной выписан в удовлетворительном состоянии 30.11.
3. Больная Г., 75 лет, поступила в клинику 19.12.09. Предъявляла жалобы на боли в брюшной полости, тошноту, рвоту. Болеет 3 дня, не отходят газы и нет стула. Объективно: пульс 112 в 1 мин, ритмичный, АД 160/95 мм рт.ст., температура тела 37,6 °С. Кожа и видимые слизистые нормальной окраски, язык сухой. Живот вздут, мягкий, отмечается диффузная болезненность. Симптом Щеткина-Блюмберга положительный. Общий анализ крови: Hb 100 г/л, эр. 3,1·10 12 /л, цв. пок. 0,9, тр. 65‰, л. 10,8·10 9 /л, п. 10%, с. 70%, э. 1%, лимф. 14%, мон. 5%; СОЭ 32 мм/ч. Сделана КТ брюшной полости, с помощью которой установлен диагноз острой желчнокаменной кишечной непроходимости (рис. а-г). Рисунок 1. Компьютерные томограммы. а - в желчном пузыре отмечается наличие конкрементов и воздуха (стрелки). Слева в просвете тонкой кишки маленький камень (стрелка). Рисунок 1. Компьютерные томограммы. б - в желчных протоках воздух - пневмобилия (стрелки). На вентролатеральной стороне печени свободная жидкость в малом количестве (стрелка). Рисунок 1. Компьютерные томограммы. в - дилатация тонкой кишки с горизонтальными уровнями жидкости (стрелки). Рисунок 1. Компьютерные томограммы. г - в просвете подвздошной кишки большой камень, вызывающий ее обтурацию (стрелка). 19.12 под эндотрахеальным наркозом произведена срединная лапаротомия. Тонкая кишка вздута на всем протяжении, на расстоянии 40 см от илеоцекального угла в просвете пальпируется камень размером 4,0×4,0 см, который польностью обтурирует кишку. В подпеченочной области определяется плотный инфильтрат, состоящий из желчного пузыря, двенадцатиперстной кишки, желудка и большого сальника. Произведена одномоментная радикальная операция: энтеролитотомия, энтерорафия, ликвидация холецистодуоденального свища (холецистэктомия, дуоденорафия) и дренирование брюшной полости. Послеоперационный период протекал тяжело, на 6-й день из подпеченочного дренажа появилось дуоденальное содержимое в количестве 500 мл; развилась несостоятельность швов двенадцатиперстной кишки без распространенного перитонита. Сформировался неполный трубчатый наружный дуоденальный свищ, который закрылся с помощью консервативного лечения на 50-й день. Больная выписана в удовлетворительном состоянии 21.02.10. Осмотрена через 6 мес, жалоб нет, считает себя здоровой.
Ретроспективный анализ приведенных историй болезни дает возможность сделать заключение, что в первом наблюдении можно было поставить диагноз желчнокаменной кишечной непроходимости, но должное внимание не обратили ни на анамнез, ни на данные УЗИ. Во втором наблюдении УЗИ не проводилось, больной не отмечал наличия желчнокаменной болезни. В обоих наблюдениях спаечная кишечная непроходимость являлась нашим предварительным диагнозом. В третьем наблюдении диагноз желчнокаменной кишечной непроходимости был поставлен до операции с помощью КТ. Ошибкой можно считать проведение одномоментной операции.
Приведенные наблюдения еще раз подтверждают, что желчнокаменная кишечная непроходимость относится к числу редких заболеваний. Лучшим методом диагностики является КТ. По нашему мнению, объем оперативного вмешательства должен ограничиваться устранением кишечной непроходимости, только при вынужденных ситуациях показана одновременная ликвидация билиодигестивной фистулы.
Комментарий
Желчнокаменная кишечная непроходимость действительно редкое заболевание, и не каждый хирург за свою профессиональную деятельность сталкивается с этим заболеванием. Тем же, кому «повезло» встретиться с данной ситуацией в своей практике, редко оперируют такую непроходимость несколько раз. В связи с этим трудно выработать какие-то общепринятые принципы хирургической тактики.
В журнале «Хирургия» периодически появляются статьи и описание наблюдений по этой теме, тем не менее нам кажется возможным внести несколько предложений. Первый вопрос, который надо решить, - вмешиваться или нет в радикальное излечение (одномоментно с ликвидацией непроходимости) холецистодуоденального свища. На наш взгляд, ответ однозначен - нет, и материалы данной статьи это тоже подтверждают. Авторы статьи справедливо указывают на возможности выполнения этого только в особых ситуациях. Обычно у этих больных (или даже всегда) в правом подреберье имеется плотнейший инфильтрат, разделение которого представляется крайне травматичным и неоправдано рискованным. Например, авторы статьи в единственном таком наблюдении получили дуоденальный свищ, и им еще повезло, что больная 75 лет перенесла это осложнение. Задача должна ставиться так: спасти жизнь и, если будет необходимо, в отсроченном периоде решать судьбу имеющегося холецистодуоденального свища. Обычно, как и указывается в статье, эти пациенты имеют весьма серьезный возраст и многочисленные сопутствующие заболевания, определяющие высокий риск оперативного лечения даже в плановом порядке. Вместе с тем опыт показывает, что после ликвидации непроходимости этот свищ себя не проявляет клинически вообще или эти пациенты имеют вполне удовлетворительный и приемлемый статус жизни.
Второй вопрос - как удалять конкремент. В статье авторы предлагают делать энтеротомию ниже конкремента. Целесообразно ли это? Вполне возможно, но надо бы обдумать некоторые нюансы. Во-первых, кишка ниже спавшаяся, и, извлекая камень через спазмированую или некомпрометированную часть кишки, мы расширяем зону поражения кишки. Во-вторых, выполняем энтеротомию на неизмененной части кишки, что может быть и плюсом. В любом случае у авторов на 3 наблюдения осложнений в зоне энтеротомии не было, значит, методику можно рекомендовать к применению. В идеале, конечно, надо бы было сместить конкремент на 20-30 см вниз и сделать энтеротомию на реально неизмененном отрезке тонкой кишки, но это практически никогда не удается.
Вполне возможна и альтернативная технология - сместить конкремент вверх по кишке на 30-40 см, что удается почти всегда, и сделать небольшую энтеротомию поперечно прямо над конкрементом. Размер энтеротомического разреза не должен превышать половины диаметра конкремента. При легком сдавлении кишки ниже конкремента он выходит через растягивающуюся стенку кишки в месте разреза, а энтеротомическое отверстие после удаления конкремента возвращается к исходному размеру, таким образом уменьшая объем травмы стенки кишки. Далее отверстие (обычно это всего 2 см или даже меньше) ушивается.
Третий вопрос - как минимизировать травматичность операции вообще, особенно учитывая тяжесть этого контингента больных. Прежде всего надо учесть, что обычно диаметр кишки выше конкремента чрезмерно не расширяется, острота непроходимости не такая большая, как при странгуляции. Судя по всему, конкремент медленно в течение нескольких суток опускается по кишке, не вызывая совсем уж полной непроходимости. Чем больший срок от начала заболевания, тем ниже мы находим конкремент, что также надо учитывать. При дооперационной клинической или инструментальной диагностике (как это и было в одном наблюдении у авторов статьи) вполне допустимо сделать небольшую средне-срединную лапаротомию, пропальпировать конкремент в кишке и вывести его в рану. Тонкая кишка с конкрементом всегда подвижна, конкремент легко находится, фиксируется рукой и выводится даже через небольшой разрез. Вместе с тем подкупает и такое предложение, как лапароскопически ассистированный доступ, который, очевидно, позволит достоверно подтвердить диагноз и произвести минилапаротомию с минимальной травмой для пациента.
Нам кажется полезным обсуждение на страницах журнала вопросов диагностики и лечения редких заболеваний, осложнений и ситуаций, так как создать обоснованные рекомендации по ведению таких больных возможно только на основе анализа результатов лечения, обобщенных из разрозненных редких публикаций и наблюдений за многие годы.
Отдаленные результаты хирургического лечения опухолевой толстокишечной непроходимости
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(9): 51‑56
Цель исследования - сравнение отдаленных результатов при двух вариантах этапного лечения опухолевой толстокишечной непроходимости. Материал и методы. В основную группу включены 105 больных, которым на первом этапе лечения выполнено формирование разгрузочной колостомы, на втором - радикальная операция совместно с ликвидацией стомы. В контрольную группу вошли 115 пациентов, им на первом этапе произведена обструктивная резекция толстой кишки с формированием одноствольной колостомы, определяемая первично как радикальное вмешательство, на втором - реконструктивно-восстановительная операция с ликвидацией колостомы. Результаты. Местные рецидивы в основной группе наблюдались у 5,1% больных, в контрольной - у 13,7%. Отдаленные метастазы возникли соответственно у 7,1 и 13,7% пациентов. Пятилетняя кумулятивная выживаемость в основной группе составила 69,4%, в контрольной - 50,9%, безрецидивная выживаемость - 65,3% в основной группе и 48,1% в контрольной. Вывод. Формирование разгрузочной колостомы и выполнение отсроченной радикальной операции с восстановлением целостности кишечного тракта дают лучшие отдаленные результаты по сравнению с экстренными радикальными вмешательствами.
Проблема лечения опухолевой толстокишечной непроходимости остается актуальной в неотложной абдоминальной хирургии. Это осложнение возникает в 7-47% случаев первичного рака ободочной и прямой кишки 1. Выбор тактики лечения при опухолевой кишечной непроходимости остается предметом дискуссий. Если при локализации опухоли в правых отделах толстой кишки большинство хирургов предпочитают выполнение правосторонней гемиколэктомии с наложением первичного анастомоза, то при левосторонних поражениях тактические варианты хирургического лечения довольно многообразны, что свидетельствует о нерешенности проблемы [4, 5].
Несмотря на появляющееся большое число публикаций, посвященных первичным радикальным операциям с одномоментным восстановлением пассажа по кишечному тракту в условиях левостороннего опухолевого поражения толстой кишки с непроходимостью [6, 7], наиболее распространенной тактикой остается выполнение этапных операций. Такой подход также не однороден. Не совсем решен вопрос о тактике в отношении опухоли на первом этапе ликвидации кишечной непроходимости. Выполнение первичной обструктивной резекции ободочной и прямой кишки с формированием одноствольной колостомы привлекательно как одномоментное избавление пациента от кишечной непроходимости и от опухоли. Вместе с тем операция Гартмана, выполняемая в условиях острой толстокишечной непроходимости при тяжелом состоянии пациента, может быть технически трудна, сопровождаться высокой частотой послеоперационных осложнений, в среднем составляющей 10-50%, и летальностью 4-30% [4, 8].
Альтернативной тактикой являются формирование разгрузочной колостомы на первом этапе операции и выполнение радикальной операции на втором, что, по материалам некоторых исследований, дает лучшие непосредственные результаты [3]. Актуален вопрос о влиянии некоторой задержки радикального оперативного лечения на частоту возникновения рецидивов опухоли и метастазирования.
Цель нашего исследования - сравнение отдаленных результатов при двух вариантах этапного лечения опухолевой толстокишечной непроходимости.
Материал и методы
В исследование были включены результаты лечения 220 пациентов, перенесших неотложные оперативные вмешательства по поводу обтурационной непроходимости при локализации опухоли в левых отделах ободочной кишки и в ректосигмоидном отделе. Все первичные операции выполняли в экстренном порядке в условиях хирургических стационаров неотложной помощи, в штате которых имеется абдоминальный хирург. Все повторные вмешательства, имевшие характер восстановительных, осуществляли в плановом порядке в условиях отделения колопроктологии, врачами соответствующей специализации. В исследование не вошли результаты лечения пациентов, перенесших перитонит вследствие диастатической перфорации толстой кишки или перфорации опухоли, а также больных, имеющих признаки отдаленного метастазирования при первичном вмешательстве.
В основную группу были включены 105 пациентов, которым на первом этапе лечения была сформирована разгрузочная двуствольная колостома проксимальнее стенозирующей опухоли без попыток ее мобилизации. В этой группе мужчин было 44, женщин - 61. Средний возраст пациентов составил 67,7±6,4 года. У 16 (15,2%) больных опухоль локализовалась в левой трети поперечной ободочной кишки и селезеночном изгибе, у 21 (20%) - в нисходящем отделе ободочной кишки, у 51 (48,6%) - в сигмовидной кишке и у 17 (16,2%) пациентов - в ректосигмоидном отделе. Трансверзостомию производили в 48 (45,7%) наблюдениях, сигмостомию - в 57 (54,3%). У 81 пациента при формировании стомы использовали минидоступ, у 24 - лапаротомный доступ. Распределение пациентов в зависимости от степени дифференцировки первичной опухоли (аденокарциномы), стадии заболевания показано в таблице.

Характеристика пациентов, включенных в исследование
Средний интервал между наложением разгрузочной стомы и радикальным оперативным вмешательством составил 32,7±4,5 дня. Во время этого периода проводили полноценное обследование толстой кишки, ультразвуковое исследование и компьютерную томографию брюшной полости и таза, коррекцию сопутствующих заболеваний. Радикальное оперативное лечение, выполняемое на втором этапе, включало удаление опухоли, устранение сопутствующих изменений толстой кишки и одномоментное восстановление целостности кишечного тракта с ликвидацией колостомы. Синхронные опухолевые поражения толстой кишки к моменту радикальной операции были выявлены у 3 (2,9%) больных, дивертикулярная болезнь - у 4 (3,8%) пациентов, что потребовало расширения объема операции. В 51 (48,5%) наблюдении выполнена левосторонняя гемиколэктомия, в 34 (32,4%) - резекция сигмовидной кишки, в 17 (16,2%) - передняя резекция прямой кишки, в 3 (2,9%) наблюдениях - субтотальная колэктомия при мультифокальной локализации опухолей.
В контрольную группу вошли 115 пациентов, которым на первом этапе произведена обструктивная резекция толстой кишки с формированием одноствольной колостомы, определяемая первично как радикальное вмешательство. Средний возраст пациентов составил 65,2±7,1 года. В эту группу были включены 51 мужчина и 64 женщины. Локализация первичной опухоли, распределение опухолей по стадиям было сопоставимо с этими показателями в основной группе (см. табл. 1). В 33 (28,7%) наблюдениях в качестве первого этапа выполняли левостороннюю гемиколэктомию, в 67 (58,3%) - резекцию сигмовидной кишки и в 15 (13,0%) - переднюю резекцию прямой кишки.
На втором этапе лечения оперативное вмешательство включало восстановительную операцию с ликвидацией колостомы, а также при необходимости удаление рецидивов опухоли и коррекцию выявленных к моменту второго этапа патологических изменений толстой кишки, органов брюшной полости и брюшной стенки. Средний интервал между операциями составил 196,3±17,2 дня. Метахронные опухолевые поражения толстой кишки к моменту повторной операции были выявлены у 4 (3,5%) больных, что потребовало расширения объема оперативного лечения - произведена дополнительная резекция толстой кишки.
Для статистической оценки достоверности полученных результатов использован критерий χ 2 или точный метод Фишера. Анализ выживаемости больных проводили по методу Каплана-Мейера. Различия считали достоверными при р
Результаты
У пациентов, направленных для проведения второго этапа лечения, краткосрочные результаты первичного вмешательства оценивали ретроспективно. В основной группе ранние послеоперационные гнойные процессы в лапаротомной ране зафиксированы только у 4 (3,8%) больных. Все они развились при формировании разгрузочной колостомы с использованием лапаротомного доступа. Более поздние осложнения, в том числе стомальные, вероятно, не успевали развиться в связи с относительно небольшим интервалом между этапами лечения.
В контрольной группе, в которой была выполнена операция Гартмана в качестве первого этапа, у 6 (5,2%) больных она сопровождалась гнойно-воспалительными процессами в брюшной полости и забрюшинном пространстве. Послеоперационные раневые осложнения имели место у 18 (15,7%) больных. К моменту восстановительной операции у 19 (16,5%) пациентов была послеоперационная вентральная грыжа, что потребовало дополнительного укрепления брюшной стенки. У 42 (36,5%) больных зафиксирована парастомальная грыжа.
При оценке отдаленных результатов в контрольной группе к моменту восстановительного оперативного лечения местный рецидив наблюдался у 9 (7,8%) больных. У 4 из них был внеорганный рецидив в ложе удаленной опухоли с вовлечением прилежащих петель кишечника, брюшной стенки или околокишечной клетчатки. У 2 пациентов отмечен ранний рецидив в дистальной культе резецированной кишки, у 1 больного - в стомированной кишке. У 2 пациентов обнаружены пораженные метастазами неудаленные регионарные лимфоузлы. Это потребовало расширения объема восстановительной операции с удалением рецидивных опухолей, ререзекции толстой кишки, дополнительной лимфодиссекции. При оценке качества выполненной лимфаденэктомии (уровня D1) при первичной операции Гартмана, по нашему мнению, явно неудаленная зона регионарного лимфооттока была обнаружена у 29 (25,2%) больных.
Послеоперационная летальность при выполнении второго этапа лечения в основной группе составила 0,9%. Умер один пациент вследствие перфорации тонкой кишки с развитием перитонита. В контрольной группе летальность составила 1,7%. У одной больной наблюдалась несостоятельность колоректального анастомоза и у одного пациента - перфорация десерозированного участка тонкой кишки вследствие тяжелого спаечного послеоперационного процесса в брюшной полости. В целом после операции Гартмана почти во всех наблюдениях отмечали спаечный процесс в брюшной полости. При этом у 19 (16,5%) пациентов было практически полное ее заращение, что создавало технические затруднения.
Отдаленные результаты удалось проследить у 98 больных основной группы и у 102 пациентов контрольной. Локальные рецидивы опухоли в период наблюдения выявлены у 5 (5,1%) больных основной группы. Местные рецидивы в контрольной группе с учетом пациентов, у которых он был выявлен на этапе восстановительной операции, наблюдались достоверно чаще - в 13,7% (14 больных). Та же тенденция прослеживалась при оценке частоты возникновения отдаленных метастазов: в основной группе она составила 7,1% (7 больных), в контрольной - 13,7% (14 больных) (р
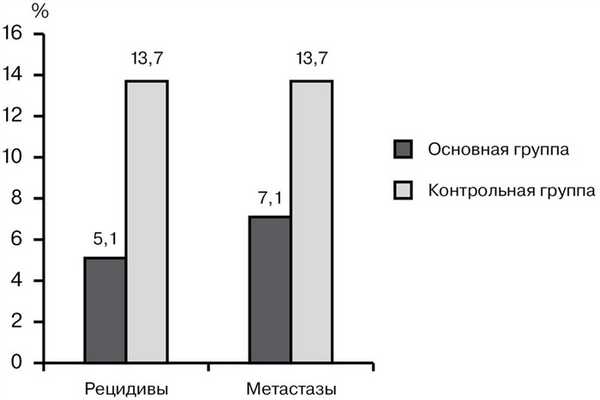
Рис. 1. Частота местных рецидивов и отдаленных метастазов.
Данные кумулятивной пятилетней выживаемости продемонстрированы на рис. 2. Со второго года наблюдения отмечена достоверная разница в отдаленных результатах. В основной группе достигнута значительно лучшая выживаемость. Через 3 года этот показатель был на уровне 81,6% в основной группе и 65,7% в контрольной (р<0,05). Через 5 лет кумулятивная выживаемость составила 69,4 и 50,9% соответственно (р<0,05). Та же закономерность прослеживалась при оценке безрецидивной пятилетней выживаемости в течение всего периода динамического наблюдения (рис. 3). Показатели пятилетней выживаемости были 65,3% в основной группе и 48,1% в контрольной (р<0,05).
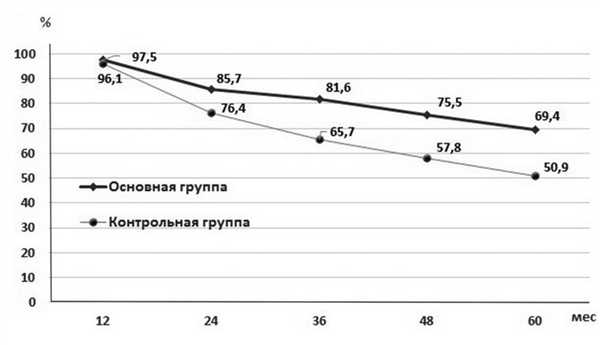
Рис. 2. Кумулятивная выживаемость.
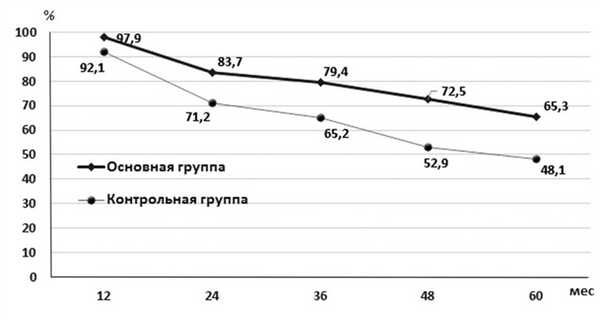
Рис. 3. Безрецидивная выживаемость.
В последнее время появился ряд работ, в которых доказываются преимущества резекции левой половины толстой кишки при ее опухолевой непроходимости с формированием первичного межкишечного анастомоза и использованием интраопрерационного лаважа толстой кишки для уменьшения риска его несостоятельности [6, 7]. Такое вмешательство, направленное на быстрое полное выздоровление пациентов, требует хорошей подготовки медицинского персонала, слаженной его работы и пока реально возможно в специализированных крупных учреждениях, как правило, имеющих большой опыт ургентной хирургии толстой кишки. В большинстве наблюдений при осложненных опухолях левой половины толстой кишки наиболее распространенной остается тактика этапного лечения.
Основным преимуществом операции Гартмана традиционно считается устранение кишечной непроходимости с одномоментным избавлением пациента от злокачественной опухоли. При этом вмешательстве, кроме высокого потенциального риска возникновения послеоперационных осложнений, большой проблемой остается возможность последующей восстановительной операции. Доля пациентов, у которых колостома, изначально планируемая как временная, превращается в постоянную, остается очень большой, составляя иногда 30-50% [1, 4]. Кроме того, пациенты, подлежащие восстановительным операциям, вынуждены ожидать ее в течение довольно продолжительного периода, что негативно влияет на качество их жизни.
Вариантом этапного лечения является наложение разгрузочной стомы с ликвидацией кишечной непроходимости и последующим радикальным вмешательством с восстановлением пассажа по толстой кишке. Это позволяет производить радикальную, при необходимости расширенную операцию у подготовленного к ней в плановом порядке пациента. Время существования колостомы значительно сокращается.
Традиционным объектом критики такой тактики является задержка радикального оперативного лечения, потенциально имеющая риск ухудшения отдаленных онкологических результатов. Во многих работах доказано, что резекция толстой кишки, выполняемая по поводу осложненных опухолей в неотложном порядке, приводит к ухудшению отдаленных результатов по сравнению с таковыми при плановых вмешательствах [9, 10]. Авторы связывают это с большей агрессивностью опухоли при осложненном течении заболевания, с увеличением потенциала внутрилимфатического и внутрисосудистого распространения опухолевых клеток вследствие повышенного внутрикишечного давления, возможно, с необходимостью больших манипуляций с опухолью, выполняемых хирургами.
В некоторых исследованиях, посвященных результатам первичных и отсроченных вмешательств при стенозирующих опухолях левой половины толстой кишки, показаны худшие отдаленные результаты после операций в условиях кишечной непроходимости [11]. Предполагается, что это связано с ограниченностью возможного объема операции при переполненной содержимым толстой кишке. Наши данные также подтверждают достоверно худшие результаты операции Гартмана по сравнению с результатами отсроченных операций. Во многом мы объясняем это выполнением неотложных операций общими хирургами, имеющими ограниченный опыт вмешательств на толстой кишке. Известны многоцентровые исследования, в которых достоверно доказана корреляция результатов радикальных операций на толстой кишке с личным опытом хирурга и числом выполняемых вмешательств в лечебном учреждении [12].
При анализе отдаленных результатов мы также склонны связывать ухудшение выживаемости при выполнении неотложных первичных резекций толстой кишки с относительно низким качеством проведения вмешательств. Об этом свидетельствует достаточно большая частота ранних местных рецидивов опухоли, выявленных уже к моменту восстановительной операции, и очень высокая частота некачественно выполняемых лимфодиссекций. Разнородность пациентов, которым произведены операции в разных учреждениях, не позволила нам получить объективные сравнительные данные относительно числа удаленных лимфоузлов при разных видах вмешательств. Возможно, влияние этого фактора было бы подтверждено при проведении объединенного исследования с возможностью сравнения качества операции по объективным данным углубленного гистологического исследования.
Таким образом, формирование разгрузочной колостомы при опухолевой непроходимости левой половины толстой кишки и выполнение отсроченной радикальной операции с одномоментным восстановлением целостности кишечного тракта дает лучшие отдаленные результаты по сравнению с экстренными радикальными вмешательствами.
Хирургия кишечной непроходимости
Существует несколько типов хирургических процедур, используемых для устранения непроходимости кишечника, которая представляет собой частичную или полную закупорку кишечника. Обструкцию кишечника можно лечить хирургической резекцией, стентированием, колостомией, удалением спаек или реваскуляризацией.
Обструкция кишечника может быть острой (внезапной и быстрой) или хронической (медленно ухудшающейся) и требует немедленной медицинской помощи, поскольку она может быстро стать опасной для жизни.
Показания к применению
Обструкция кишечника возникает в тонкой или толстой кишке, препятствуя прохождению непереваренной пищи и стула. Это может вызвать ряд серьезных осложнений, в том числе непоправимое повреждение кишечника, серьезные нарушения в жидкости и электролитах, а также кровотечение или утечка из кишечника. При отсутствии лечения артериальное давление может снизиться, что приведет к полиорганной недостаточности и смерти.
Обструкция кишечника может возникнуть в результате любого из следующих действий:
- Механическая обструкция, которая представляет собой закупорку внутри просвета (прохода) тонкой или толстой кишки, как правило, из-за рака, воспалительного заболевания кишечника, отека или инфекции
- Сжатие давления снаружи кишечника, как правило, из-за рака или рубцовой ткани (что часто является результатом предыдущих операций на брюшной полости или лучевой терапии)
- Скручивание самой кишки, которое может быть следствием рубцовой ткани, заболеваний мышц или заболеваний нервов
- Миопатия (заболевание мышц) или невропатия, которая может быть врожденной или приобретенной: эти состояния могут помешать правильному движению кишечных мышц, могут привести к коллапсу кишечника, сдавливанию просвета или могут привести к искаженным движениям (приводящим к скручиванию).
- Ишемический колит (потеря притока крови к отделу кишечника), как правило, в результате дефекта свертывания крови
Наиболее распространенные виды рака, ответственные за обструкцию кишечника, включают рак толстой кишки, рак желудка и рак яичников, хотя любой тип метастатического рака может вызвать обструкцию кишечника в тонкой или толстой кишке. Обструкции кишечника от рака толстой кишки, как правило, возникают в толстой кишке (толстой кишке).
Распознавание непроходимости кишечника
Сильная боль и дискомфорт в животе являются наиболее узнаваемыми симптомами непроходимости кишечника, хотя могут встречаться и более тонкие признаки, и симптомы.
Другие симптомы, которые могут возникнуть при непроходимости кишечника, включают:
- Периодические спазмы, колики в животе
- Уменьшение аппетита, тошнота, рвота
- Неприятный запах изо рта
- Изменения в испражнениях
- Хронический запор или отсутствие дефекации
- Вздутие живота (необычно расширяющийся вид)
- Жидкость в вашем животе
Предоперационное тестирование
Если у Вас есть симптомы непроходимости кишечника, Ваш врач проведет медицинское обследование, чтобы проверить живот и звуки в кишечнике.
Диагностическая оценка может включать рентген брюшной полости, компьютерную томографию (УЗИ) или ультразвук. Эти тесты могут включать или не включать клизму с барием, которая включает введение небольшого количества контрастного вещества в прямую кишку, чтобы лучше визуализировать структуры.
Если у Вас закупорка, Вам также может потребоваться сигмоидоскопия или колоноскопия, которые представляют собой инвазивные диагностические процедуры, при которых в толстую кишку вставляется камера для визуализации блокировки.
Параметры процедуры
Существует несколько вариантов хирургического лечения кишечной непроходимости. Хирургическое вмешательство обычно является неотложным, что означает, что Вы можете пройти хирургическое вмешательство в течение нескольких часов или нескольких дней после того, как у Вас диагностирована непроходимость кишечника. Некоторые лекарства могут помочь при тошноте, но они не предотвращают ухудшение или улучшение кишечной непроходимости.
В идеале Вы не должны есть или пить около восьми-десяти часов до операции такого типа, но из-за срочности предоперационное голодание не всегда возможно. Операция по поводу непроходимости кишечника обычно проводится под общим наркозом в операционной.
У Вас может быть открытая операция с большим разрезом или минимально инвазивная операция с несколькими небольшими разрезами и камерой для визуализации. Это зависит от местоположения, размера и причины непроходимости кишечника. Большие опухоли или широко распространенные спайки могут потребовать открытой процедуры, в то время как небольшая опухоль или инфекция могут лечиться с помощью минимально инвазивной хирургии.
Типы операций по поводу непроходимости кишечника включают в себя:
- Хирургическая резекция: удаление обструкции необходимо при наличии массы, такой как опухоль.
- Удаление спаек: если у Вас есть рубцовая ткань, сжимающая кишечник снаружи, часто требуется отрезать их, хотя рубцовая ткань может вернуться снова.
- Размещение стента: стент, представляющий собой трубку, которая удерживает кишечник открытым, может быть размещен внутри кишечника, чтобы обеспечить прохождение пищи и стула и предотвратить закупорку. Это может быть необходимо, когда непроходимость кишечника повторяется или когда кишечник сильно поврежден.
- Колостома / илеостомия: если Ваш кишечник поврежден или воспален, может потребоваться постоянная или временная илеостомия или колостомия, которая является искусственным отверстием в животе для удаления отходов или стула. Иногда это временные структуры, необходимые для предотвращения распространения тяжелой желудочно-кишечной инфекции по всему организму. Однако возможно, что концы кишечника не могут быть повторно соединены, и эти отверстия могут потребоваться в течение длительного времени.
- Реваскуляризация. При ишемическом колите может потребоваться реваскуляризация, то есть восстановление заблокированных кровеносных сосудов, которые поставляют кровь в кишечник.
Восстановление после операции на кишечнике
После операции по поводу непроходимости кишечника вашему желудку и кишечнику потребуется время, чтобы восстановить нормальную активность и выздороветь. Возможно, Вам не разрешат есть сразу. Ваша диета будет постепенной, от жидкости до мягкой и более объемной пищи.
Возможно, Вам понадобится обезболивающее в течение первой недели после процедуры. Некоторые лекарства, такие как опиоиды, могут мешать заживлению, вызывая тяжелые запоры и, таким образом, используются с осторожностью. Нестероидные противовоспалительные препараты могут вызывать кровотечение желудка или кишечника. Как правило, обезболивающие препараты тщательно вводятся и контролируются после операции по поводу непроходимости кишечника, а внутривенное введение фентанила, панадола или метадона является одним из распространенных методов обезболивания.
По мере того, как Вы меняете свою диету, Вам также может потребоваться рентген живота, чтобы подтвердить, что Вы лечитесь и что не осталось блокировки. В течение всего этого времени Вам понадобятся внутривенные жидкости для поддержания гидратации и питания. По мере изменения диеты у Вас должны начаться небольшие испражнения, и Вы можете ожидать нормальных испражнений, как только начнете есть твердую пищу.
Осложнения после операции на кишечнике
Осложнения операции по непроходимости кишечника могут включать инфекцию, кровотечение, перфорацию (отверстие в кишечнике) и движение стента. При распространенном раке толстой кишки или при воспалительных заболеваниях кишечника обструкции кишечника могут повторяться даже после лечения.
Артроскопия — хирургическая процедура, которую хирурги-ортопеды используют для визуализации, диагнос.

Современные и эффективные методики, в том числе безоперационное лечение атеросклероза нижних конечно.
Грыжа — выхождение органов или их частей из полости, занимаемой ими в норме, через нормально существ.
Грыжа межпозвонкового диска — также называемая выпадением диска, разрывом диска или проскальзыванием.
Случай кишечной непроходимости в связи с раковой опухолью купола слепой кишки
Пациентка жаловалась на боль в правом боку и пояснице, несколько учащённое и болезненное мочеиспускание, общую слабость, быструю утомляемость, нарушение отхождения газов и стула, которые чередовались запорами и диареей. Также отмечала дискомфорт в правой половине живота. Пациентку сначала принял врач-уролог, а после исключения урологической патологии её направили к хирургу.
Обезболивающие препараты и клизма облегчали состояние на некоторое время, хотя полностью не устраняли проблемы.
Анамнез
Указанные жалобы беспокоили пациентку в течение полугода, но за медицинской помощью она не обращалась, самостоятельно принимала обезболивающие препараты и применяла клизмы, что давало временный эффект. В настоящее время состояние пациентки резко ухудшилось, поэтому она решила обратиться к врачу для обследования и уточнения причины.
Пациентка росла и развивалась в соответствии со своим возрастом. Жилищно-бытовые условия удовлетворительные. Онкологические заболевания у родных и близких не может уточнить.
Обследование
При осмотре кожный покров и видимые слизистые бледно-розовой окраски. Периферические лимфатические узлы не увеличены, безболезненны. Дыхание и гемодинамические показатели (показатели кровотока) в пределах нормы. При пальпации живот несколько увеличен, ассиметричен, имеется умеренная болезненность в правой половине живота (мезогастрии), где пальпируется "инфильтрат" размерами 10 на 12 см, плотной консистенции, неподвижный, с ровными контурами.
Симптомы кишечной непроходимости (Склярова, Спасокукоцкого, Валя) отрицательны, т. е. при аускультации (выслушивании) отсутствуют "шум плеска", "падающей капли" и асимметрия живота. При ректальном осмотре обращает на себя внимание увеличенная ампула прямой кишки и скудное содержимое, т. к. пациентка не готовилась к осмотру прямой кишки. По результатам осмотра принято решение о госпитализации пациентки для инструментального обследования и решения вопроса о дальнейшей тактике лечения.
- В лабораторных показателях имеется анемия (гемоглобин — 89 г/л) и гипопротеинемия (низкий уровень белка в плазме крови — 55 г/л).
- Выполнено ультрасонографическое исследование брюшной полости и почек: почки и мочевыделительная система без особенностей. В правой подвздошной ямке имеется инфильтрат 8 на 10 см с полосками жидкости вокруг. Возможно, это гастростаз (нарушение прохождения пищи по желудку вследствие снижения сократительной активности мышечной стенки органа) или фитобезоар (камни из волокон растений).
- По данным рентгенографии грудной клетки и брюшной полости инфильтративных изменений в лёгких не выявлено. Свободного газа и уровней жидкости в брюшной полости нет.
- Данные КТ органов брюшной полости: заворот восходящего отдела ободочной кишки.
Диагноз
Лечение
Учитывая результаты обследования и данные осмотра, пациентке было показано оперативное вмешательство в экстренном порядке с целью профилактики осложнений (некротические изменения стенки кишечника с перфорацией и развитием распространённого калового перитонита) и повышения качества жизни.
В ходе операции: при ревизии брюшной полости данных за заворот кишечника не выявлено, имеется инвагинация (внедрение) купола слепой кишки в поперечный отдел ободочной кишки. При разрешении инвагинации выяснилось, что причиной данного клинического случая оказалась раковая опухоль купола слепой кишки с прорастанием и деформацией всей стенки кишечника.
Выполнена лапароскопически-ассистированная правосторонняя гемиколэктомия ( удаление правой половины толстого кишечника) с лимфодиссекцией в объёме D2 (удалением лимфатических узлов) с наложением первичного анастомоза (соустья) "бок в бок". Пациентка из операционной доставлена в отделение реанимации и интенсивной терапии для наблюдения в раннем послеоперационном периоде. При стабилизации состояния через 7 часов переведена в общее хирургическое отделение.
Назначена инфузионная заместительная терапия, профилактика гнойно-септических и тромбоэмболических осложнений, обезболивание. Пациентка активизирована. Выполнялись ежедневные перевязки и обработка ран антисептиками.
На фоне проводимого комплекса лечения состояние пациентки улучшилось, наблюдалась клиническая, лабораторная и инструментальная положительная картина. Раны заживали первичным натяжением, признаков воспаления и кровотечения не наблюдалось.
На восьмые сутки лечения болевой синдром купирован полностью, лабораторные показатели в норме, по данным УЗИ патологических изменений и жидкости (свободной и ограниченной) в брюшной полости нет, температура тела в пределах нормы, имеется самостоятельный стул, отходят газы — признаки состоятельности анастомоза. Сняты швы с ран. Пациентка выписана в относительно удовлетворительном состоянии с улучшением под наблюдение онколога по месту жительства.
Заключение
Данный клинический случай подтверждает известные затруднения в дифференциальной диагностике острой урологической и хирургической патологии. Интересной особенностью данного случая является отсутствие клинико-инструментальной картины кишечной непроходимости и быстрое восстановление и выписка пациентки при таком большом объёме оперативного вмешательства и тяжести состояния. Это связано с применением современных эндовидеохирургических технологий в ургентной хирургии.
Читайте также:
