Тампонада, печеночные дренажи при травме печени. Техника
Добавил пользователь Алексей Ф. Обновлено: 09.01.2026
Д.м.н., проф. Шапкин Ю.Г., д.м.н., проф. Чалык Ю. В., к.м.н., асс. Стекольников Н. Ю., Гусев К. А.
Цель.
- Провести сравнительный анализ эффективности различных хирургических подходов в лечении тяжелых повреждений печени.
- Провести анализ послеоперационных осложнений марлевой тампонады, а также наметить пути их профилактики.
Материалы и методы.
С 2009 по 2016 год в клинике общей хирургии СГМУ им. В. И. Разумовского, на базе городской клинической больницы № 6 г. Саратова было прооперировано 29 пострадавших с тяжелой закрытой травмой печени III-IVстепени.
В качестве группы сравнения были использованы результаты лечения пострадавших с аналогичными травмами, в период с 1967 по 1992 год и с 1993 по 2008 год.
Результаты и обсуждение.
В период с 1976 по 1992 год резекция печени была выполнена в 87,5% случаях (14 пациентов). Марлевая тампонада преимущественно использовалась как дополнительный метод гемостаза и применялась после резекций печени в 50%(8) случаях. Послеоперационная летальность при выполнении первичных резекций печени составляла 75% (12).
В связи с этим, с 1993 по 2008 год количество резекционных вмешательств снизилось до 25% (6). Марлевая тампонада использовалась в 45% случаев (11), но только в 12,5% (3) она носила первичный характер. Показатель летальности снизился до 54% (13).
С 2009 по 2016 год резекционные вмешательства были выполнены в 13,8% случаев (4). Марлевая тампонада использована в 89% случаев (26). У 21 пациента она носила первичный характер, и была единственным использованным методом гемостаза. Для профилактики послеоперационных осложнений у всех больных между печенью и салфеткой помещалась гемостатическая губка, а также выполнялось дренирование зоны операции. Показатель летальности составил 41% (12).
У 47,6% (10) больных удаление тампонов выполнялось путем релапаротомии. В 1 случае был отмечен рецидив кровотечения. В 33,3% (7) случаях удаление тампонов выполнялось без релапаротомии. Рецидивов кровотечения отмечено не было.
Структура послеоперационных осложнений: гемобилия - 3,4%(1), длительное желчеистечение - 10,3%(3), поддиафрагмальный абсцесс 3,4% (1).
Тампонада, печеночные дренажи при травме печени. Техника
Травмы паренхиматозных органов диагностируются у 12-50% больных с повреждениями органов брюшной полости, занимая 2-3-е место [1, 5, 11, 17]. Хирургическая тактика при повреждениях печени, селезенки определяется характером травмы и должна быть направлена в первую очередь на обеспечение гемостаза и холестаза 14. Для достижения окончательного гемостаза при ранениях печени и селезенки применяют прошивание, биологические и синтетические пленки, клеевые композиции, методы неконтактного воздействия (лазерная, плазменная, аргоновая и электро-коагуляции) [2-8, 13, 18, 19]. При обширных раневых дефектах печени, селезенки с размозжением ткани выполняют резекции с гемостазом по ходу и с иссечением нежизнеспособных участков паренхимы, по типу первичной хирургической обработки [11, 14]. При отдельных видах травмы печени возможно выполнение оменто- и френогепатопексии. Нередко развиваются некрозы паренхимы печени, селезенки в зоне швов, с развитием нагноений, вторичных кровотечений, желчных свищей, требующих повторных операций [3, 7, 9, 10, 12]. Одной из причин неудач хирургического лечения травм печени и селезенки является отсутствие четких рекомендаций по выбору метода достижения окончательного гемостаза и определения объема вмешательства в зависимости от тяжести повреждения. Совершенствование методов остановки кровотечения при травмах печени и селезенки, а также разработка критериев выбора рациональной тактики при их повреждениях остаются актуальными и по сей день.
Материал и методы
Травма печени и селезенки моделировалась в эксперименте на 138 беспородных собаках обоего пола весом от 7 до 20 кг. Смоделировано 268 травм печени и селезенки. Раны наносили с помощью скальпеля, снабженного ограничителем (68): резаные длиной 3 см и более, глубиной не более 2 /3 толщины органа (30) и колото-резаные (38). У 38 животных после обеспечения гемостаза первичной раны печени наносили рану селезенке. Тупую травму живота нанесли 26 животным с развитием подкапсульных (20) и внутриорганных (6) гематом. Из них у 13 животных нанесена тупая травма и печени и селезенки. Разрывы печени и селезенки моделировали интраоперационно путем раздавливания паренхимы зажимом по методике Е.С. Владимировой и соавт. [5] у 41 животного; разрывы диафрагмальной и висцеральной поверхностей печени у 20 и селезенки у 21. Размозженные раны доли и сегмента с повреждением интрапаренхиматозных структур смоделированы на 119 животных: селезенки (88) и печени (31) (когда выполняли резекцию органа). Травму ворот селезенки с повреждением ее сосудистой ножки и последующей спленэктомией нанесли 14 животным (см. таблицу).
Все операции выполняли под внутриплевральным тиопенталовым наркозом. Брюшную полость вскрывали верхнесрединным разрезом. Выводили в операционную рану селезенку, печень. При развитии профузного кровотечения накладывали специальное устройство на питающие сосуды соответствующего участка органа (патент РФ на полезную модель РФ №70622) или мягкий эластический жом (патент РФ №2014802) на паренхиму органа, проксимальнее раны или разрыва для обеспечения временного гемостаза. При травмах печени также применили маневр Прингла (пережатие печеночно-двенадцатиперстной связки) или накладывали эластический жгут на паренхиму органа, проксимальнее раны. Раны ушивали хромированным кетгутом (№2-3) или викрилом на атравматичных колющих иглах.
Техника шва при ранах глубиной до 2 /3 толщи органа: иглы вкалывали отступя от края раны (а) 1,0 см на расстоянии 1,0-1,5 см между ними, начиная с середины раны (в-в 1 ), с выколом на противоположной стороне под углом 45° (б) к длине раны, направляя иглы кнаружи и в разные стороны. Потом обе иглы переводили поверх раны на первоначальную сторону и строго напротив выкола еще раз на расстоянии 1,0 см от края раны делали вкол под углом 45° к длине раны, направляя иглы к центру раны, выводили их напротив первого вкола. Концы нитей связывали между собой (патент РФ №2346660) (см. рисунок). Рисунок 1. Схема ушивания резаных ран печени и селезенки. а - рана; в-в 1 - нити, последовательность проведения. Рисунок 1. Схема ушивания резаных ран печени и селезенки. б - угол, под которым проводится игла; в-в 1 - нити, последовательность проведения.
Предварительно шов был использован на изолированных макропрепаратах печени и селезенки с последующим контрастированием внутриорганных структур. Выявлено, что ушивание ран глубиной до 1 /3 толщины органа не приводит к выраженному нарушению архитектоники структур (сосудов и желчных протоков), а при ушивании ран глубиной от 1 /3 до 2 /3 толщины органа могут наблюдаться подобные изменения. Шов предотвращает прорезывание нитей при сближении краев раны и завязывании узлов и обеспечивает гемостаз.
Сквозные ранения органов ушивали следующим образом: проводили прядь сальника через рану на противоположную поверхность органа. Ушивали раны с помощью предложенного или П-образного шва с обеих сторон, захватывая и сальник (рацпредложение №95822).
При тупой травме с развитием подкапсульных гематом паренхиматозных органов малых размеров - диаметром до 3 см (печень - 10, селезенка - 10) и при отсутствии признаков продолжающегося кровотечения проводили миниинвазивное лечение (патент на изобретение РФ №2321427), из-за опасности вторичного разрыва гематом с последующим кровотечением. При гематомах больших размеров и внутриорганных производили атипичную резекцию соответствующего органа. При размозженных ранах, расположенных по краю органа и разрывах, занимающих целую долю или сегмент с повреждением крупных сегментарно-долевых интрапаренхиматозных структур, производили атипичную резекцию соответствующего участка.
При развитии массивной кровопотери наряду с инфузионной терапией осуществляли реинфузию крови. В большинстве наблюдений дренировали брюшную полость. Животные находились под наблюдением до 1 года.
В сроки от 1 нед до 12 мес проводили повторные операции. Макроскопически оценивали состояние селезенки, печени, их цвет, консистенцию. Селезенку удаляли, печень резецировали, проводили гистологическое исследование в сроки 7, 15, 30, 60, 120, 180, 360 сут после операций. Полученные препараты окрашивали гематоксилином и эозином.
Результаты и обсуждение
При ранах глубиной до 2 /3 толщи органа окончательный гемостаз достигнут в 13 наблюдениях из 15 ранений селезенки и в 12 из 15 ранений печени. Гемостаз удалось обеспечить в 16 из 23 и в 11 из 15 наблюдений при сквозных ранениях селезенки и печени соответственно. При продолжающемся кровотечении применяли дополнительные меры гемостаза. Поверхностные разрывы ушивали с захватом дна раны, но с проведением лигатур вне предполагаемой проекции сегментарных сосудов.
При обширных ранах и разрывах после иссечения нежизнеспособных участков паренхимы с целью гемостаза перевязывали (прошивали) сегментарнодолевые артерии и дополнительно накладывали швы с использованием пластических материалов в качестве подкладки у 8 животных с травмой печени и у 10 животных с травмой селезенки. При разрыве диафрагмальной поверхности селезенки в 6 наблюдениях (рацпредложение №05-1303) и печени в 5 наблюдениях на место разрыва укладывали рассасывающуюся гемостатическую марлю и фиксировали орган к брюшине, покрывающей диафрагму. Аналогично этому, при разрыве висцеральной поверхности селезенки у 3 собак на травмы укладывали гемостатическую марлю и фиксировали орган к большой кривизне желудка, проводя швы через его серозно-мышечный слой. У двух животных при разрыве нижнего полюса селезенки использовали метод «наружного сдавления прядью сальника», с фиксированием гемостатической марли с ушиванием.
При разрыве в проекции центральных сегментов печени глубиной около 2 /3 толщи органа производили «поэтажное» ушивание с использованием пластических материалов, перевязкой кровоточащих сосудов in situ и у 2 животных применили ушивание с «наружным сдавлением прядью сальника», рассасывающейся гемостатической марлей. При разрыве висцеральной поверхности печени у 3 животных применили ушивание с использованием гемостатической марли, ТахоКомба и у одного животного для достижения окончательного гемостаза пришлось перевязывать долевую артерию печени.
В общей сложности, резекцию селезенки произвели у 88 собак в 3 сериях. В первой серии резецировали верхний полюс и раневую поверхность укрывали сальником (30 собак). Во второй серии - нижний полюс и раневую поверхность укрывали париетальной брюшиной (23 собаки). В третьей серии резецировали 2 /3 органа и рану укрывали рассасывающейся гсмостатической марлей (35 собак). Резекцию печени произвели у 31 собаки также в трех сериях. В первой серии выполнили атипичную резекцию после предварительного прошивания паренхимы гемостатическим швом по границе резекции (8 собак). Во второй серии резекция печени произведена после выполнения маневра Прингла (8 собак). В третьей серии резецировали печень (15 животных), и среди них с использованием жома у 8 собак: предварительно прошивали паренхиму органа через прорези жома гемостатическим швом, отсекали удаляемую часть по краю жома и перитонизировали раневую поверхность органа. Резецированную поверхность укрывали сальником (15 наблюдений), париетальной брюшиной (6 наблюдений), рассасывающейся гемостатической марлей (10 наблюдений). Дополнительные швы вынуждены были наложить при резекциях селезенки у 12 животных и у 7 - перевязывали сосуды в плоскости резекции с помощью разработанного устройства (решение о выдаче патента на полезную модель РФ №2008124330/22(029510)). При резекции печени накладывали дополнительные швы и перевязывали сосудисто-протоковые структуры в плоскости резекции у 9 собак. Резекция печени в среднем занимала 15-18 мин, а селезенки 7-10 мин.
Окончательный гемостаз достигнут у 69 (78,4%) животных при резекциях селезенки (25, 18, 26 наблюдений) и 22 (71%) собак при резекциях печени (6, 5, 11 наблюдений) в первой, второй и третьей сериях соответственно.
При повреждении ворот селезенки и сосудистой ножки (14 животных) производили спленэктомию с аутотрансплантацией ткани селезенки в большой сальник (6), предбрюшинную клетчатку (2), забрюшинное пространство (2), в ложе прямых мышц живота (4). Для этого использовали фрагменты паренхимы органа размером 0,3×1,0×2,0 см.
У животных с ушитыми ранами селезенки и печени послеоперационный период характеризовался благоприятным течением. В послеоперационном периоде погибли 14 (10,4%) собак: вследствие невыхода из наркоза - 6 (резекция верхнего полюса селезенки (2), ушивание разрыва селезенки (1), резекция печени (2), ушивание разрыва печени (1)). Спаечная кишечная непроходимость развилась у 3 животных (резекция нижнего полюса селезенки (2), спленэктомия и аутотрансплантация в большой сальник (1)). Послеоперационный перитонит выявлен у 3 собак (резекция 2 /3 селезенки (1) резекция печени (1), ушивание разрыва висцеральной поверхности печени (1)). Кишечное кровотечение отмечено у одной собаки, она погибла на 50-й день после резекции 2 /3 селезенки. Одно животное погибло после ушивания разрыва диафрагмальной поверхности печени на 25-е сутки от поддиафрагмального абсцесса. Остальные животные перенесли операцию хорошо.
Морфологические данные, полученные в динамике после операции, свидетельствуют о хорошей регенерации в области оперированной раны.
Клинические наблюдения
Предложенный шов применили в клинической практике при ушивании:
- резаных ран печени (3 наблюдения): длиной до 5 см и глубиной до 2 /3 толщины паренхимы 3 и 4 сегментов печени (2 наблюдения), длиной 5,5 см диафрагмальной поверхности правой доли печени без повреждения интрапаренхиматозных структур (один больной);
- резаных ран диафрагмальной поверхности селезенки длиной до 5 см и глубиной до 2 /3 толщины органа (2 больных);
- сквозных ран 4 и 5-6 сегментов печени (2 больных) и селезенки (1 больной со сквозной раной, 1 больной с колото-резаной раной нижнего полюса селезенки);
- разрывов печени (4 больным): разрывы до 5,0 см левой доли диафрагмальной поверхности печени (2 пациента), до 5 см диафрагмальной поверхности 5-6 сегментов доли печени (2 наблюдения), из них с тампонадой сальником (3 больных) и рассасывающейся гемостатической марлей (1 больной);
- разрыва диафрагмальной поверхности селезенки размерами до 4,0 см выполнили ушивание с фиксацией к париетальной брюшине.
Атипичные резекции печени с наложением П-образных швов выполнили 2 больным (разрыв до 5,5 см, связанный с травмой живота и размозженная рана левой доли печени размером 4,5 см с повреждением сегментарных внутриорганных структур). Резекцию селезенки выполнили 4 больным (травмы селезенки (3 больных) и киста нижнего полюса (1 наблюдение)). Подкапсульные гематомы около 3,0 см при отсутствии признаков продолжающегося кровотечения лечили миниинвазивно: у 3 больных диафрагмальной поверхности печени (3 и 6 сегменты) и у 1 больной висцеральной поверхности 5 сегмента. Подкапсульные гематомы диафрагмальной поверхности селезенки размерами до 3 см при отсутствии признаков продолжающегося кровотечения лечили миниинвазивным методом у 4 больных (гематомы средней части селезенки - 2 и нижнего полюса - 2). Во всех наблюдениях удалось обеспечить надежный гемостаз.
Разнообразие повреждений печени и селезенки при травме живота определяет сложность выбора рациональной хирургической тактики. Многое зависит от данных интраоперационной ревизии поврежденного органа. После достижения временного гемостаза и эвакуации крови из брюшной полости решающее значение мы придаем оценке характера повреждений. Поверхностные разрывы печени, селезенки ушиваем с захватом дна раны, с проведением лигатуры вне предполагаемой проекции сегментарных сосудов и с фиксацией к линии шва пластического материала для предупреждения прорезывания.
При глубоких разрывах, более 2 /3 толщины органа, исключали возможное повреждение крупных долевых (сегментарных) сосудов и протоков [5]. Для достижения гемостаза при разрывах печени, селезенки наряду с ушиванием возможна и изолированная перевязка сегментарных артериальных сосудов. При краевых размозженных ранах и разрывах, занимающих долю или сегмент, производили соответствующую резекцию. При глубоких ранах в области ворот или множественных разрывах селезенки выполняли спленэктомию с имплантацией фрагментов селезенки. Обязательным условием является перитонизация резекционной поверхности печени, селезенки и дренирование зоны вмешательства.
Таким образом, проведенные исследования показали эффективность предложенных способов гемостаза, что позволит улучшить результаты органосохраняющих операций на печени, селезенке при повреждениях.
ХИРУРГИЧЕСКАЯ ТАКТИКА В ЛЕЧЕНИИ ТЯЖЕЛЫХ ЗАКРЫТЫХ ТРАВМ ПЕЧЕНИ
Ю.В.Чалык - ГОУ ВПО Саратовский ГМУ им В.И. Разумовского Росздрава, кафедра общей хирургии, профессор, доктор медицинских наук; А.Е. Катальников - МУЗ «Городская клиническая больница №6 им. академика В.Н. Кошелева», врач хирургического отделения.
Россия, г. Саратов, ГОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздравсоцразвития России, кафедра общей хирургии
Резюме
Проведен анализ хирургического лечения 208 больных с закрытой травмой печени. У 40 из них были повреждения 1V-V степени ( по E. Moore). У 50% больных в качестве средства окончательного гемостаза была применена марлевая тампонада. Показано, что уменьшение объема операции, в том числе резекционных вмешательств, приводит к значительному снижению летальности.
Ключевые слова
Введение
До настоящего времени повреждения печени относятся к числу наиболее опасных по прогнозу и трудных для хирургов. Летальность при закрытой травме печени в ведущих мировых центрах составляет 25-45%. Диагностика закрытого повреждения печени, его характера и степени в последние десятилетия вышли на качественно более высокий уровень. Применение УЗИ, КТ, ЯМРТ позволили выделять больных с повреждениями I - II степеней тяжести и вести их консервативно. Последнее особенно актуально для больных с множественной и сочетанной травмой. Однако, до настоящего времени лишь отдельные специализированные клиники могут позволить себе использовать метод компьютерного диагностического мониторинга. Среди других аспектов, влияющих на снижение летальности, можно выделить проблему хирургии тяжелых повреждений печени. В ней выделяют два основных аспекта: обеспечение временного и окончательного гемостаза. В литературе практически не освещена эффективность тампонады, как средства временного гемостаза, являющегося в то же время «классикой хирургии». В последние годы происходит очень медленное, по признанию самих авторов метода, внедрение в экстренную хирургию, в хирургию тяжелых сочетанных повреждений тактики DamageControl, главный принцип которой - этапность лечения. Задачей первого этапа является остановка кровотечения. Основным средством остановки кровотечения из обширных ран печени является марлевая тампонада.
Улучшение результатов хирургического лечения больных с травмой печени путем изменения алгоритма тактики при ее закрытых повреждениях.
Материал и методы
В основу работы положен опыт хирургического лечения 208 пациентов с закрытой травмой печени, оперированных в клинике в 1976 - 2008 гг. При анализе интраоперационных методов гемостаза и исходов операций были выделены две группы пострадавших. Большая группа (81%) была представлена повреждениями I - III степеней (здесь и далее используется классификация Е. Мооге, являющаяся международной). Применены следующие виды гемостаза: узловой шов (53), П-образный шов (9), ушивание с тампонадой сальником (27), лазеркоагуляция ран (74) и электрокоагуляция (5). Вторая группа была представлена повреждениями IV - Vстепеней. Всего оперировали 40 пациентов (19%). В анализируемом тридцатилетнем периоде работы были выделены два этапа. В 1976 - 1992 гг., активно используя лазерный гемостаз, мы стремились к радикальности выполняемых операций, выполнив у 14 из 16 пациентов резекционные методы обработки. Неудовлетворенность полученными результатами лечения, а также ряд объективных факторов привели в последующие годы к отказу от широкого использования резекционных методов операций. Было отмечено, что 40 пациентов поступило в клинику за 33 года работы. До 70% таких операций выполняется в вечернее и ночное время, что в совокупности не способствует формированию четких практических навыков у хирургов. Наиболее часто в качестве средства временного гемостаза у данной группы пациентов использовали марлевую тампонаду ран (35%), которая еще в 27% наблюдений дополнялась пережатием печеночно- двенадцатиперстной связки. Отмечено, что у 80% больных с IV - V степенями повреждения раны и зоны размозжения включают задне-диафрагмальную и дорсальную часть правой доли. Обязательным этапом операции в таких случаях являются мобилизация правой доли печени с возможным расширением разреза. Применение таких методов гемостаза как ушивание ран, резекционных методов обработки, лазерного излучения у 16 больных было не эффективно и в этих случаях как заключительный этап операции выполнено тампонирование. Еще у 4 больных, находящихся в крайне тяжелом состоянии, тампонирование явилось первым и окончательным средством обеспечения гемостаза.
Результаты
Таким образом, как показывают наши наблюдения, тампонирование реально выполняется у 50% больных с наиболее тяжелыми повреждениями печени. На наш взгляд, алгоритм действий хирурга в случаях тяжелой травмы печени должен заключаться в установлении зоны повреждения и, при наличии повреждений на задне-диафрагмальной и дорсальной поверхностях, их тугом тампонировании запеченочно без предварительной мобилизации печени и без расширения операционного доступа. Обязательным является трубчатое дренирование зоны вокруг тампонов. Ни в одном из наблюдений мы не оперировали больных повторно в ранние сроки (1-3 сутки) после оставления тампонов с целью их извлечения, что было обусловлено, прежде всего, тяжестью состояния пострадавших. Двенадцать из них умерли на первые сутки после операции, еще 2 - на вторые сутки. В 3 случаях тампоны извлекли на 2 - 3 сутки без лапаротомии. Во всех этих наблюдениях тампоны были подведены к ране через гемостатическую губку. Еще в 3 наблюдениях тампоны извлекали поэтапно с 3 по 14 сутки. Адекватное дренирование препятствовало распространению гнойного процесса. Таким образом, не менее чем у половины больных с наиболее тяжелыми повреждениями печени в качестве средства окончательного гемостаза реально использовали тугую марлевую тампонаду. Сроки извлечения тампонов определялись, прежде всего, тяжестью состояния пострадавшего. Адекватное дренирование и применение антибиотиков позволяли избежать тяжелых гнойных осложнений. За последние 16 лет количество резекционных вмешательств уменьшилось с 88% до 25%. Таким образом, в каждом конкретном случае уменьшилась травматичность операции и время ее выполнения. Все это привело к снижению летальности в сравниваемых группах с 75% до 54%. Показательно, что в первый период работы (1976 - 1992 гг.) все больные, которым было выполнено тампонирование, погибли, тогда как во втором (1993 - 2008 гг.) периоде из 10 больных погибли 4 (40%; р<0,05).В первый анализируемый период работы резекции печени в 7 случаях были вынужденно дополнены тампонадой. Все пострадавшие погибли. В тех же случаях, когда тампонада была применена первично либо дополняла минимальные по времени и объему операции (ушивание/лазеркоагуляция) из 12 больных выжило 6. Однако, летальность даже в группе пострадавших с повреждениями I — II степеней тяжести остается достаточно высокой, что обусловлено, прежде всего, множественными и сочетанными повреждениями.
Накопленный нами клинический и временной опыт позволяет высказаться в пользу унификации и сокращения времени операции при тяжелых травмах печени, что достигается путем тугого тампонирования ее ран и разрывов.
Предложенная тактика полностью соответствует тактике Damage Control, главный принцип которой этапность лечения и максимальное сокращение первого этапа, направленного на остановку кровотечения из поврежденной паренхимы. Возможность и необходимость повторной операции определяется как уровнем анестезиолого-реанимационных возможностей лечебного учреждения, так и тяжестью сочетанного повреждения и в каждом случае решение о релапаротомии должно приниматься индивидуально.
Заключение
1. Причинами смерти у больных с закрытой травмой печени являются геморрагический шок (34,7%), травматический шок (33,3%), черепно- мозговая травма (10,7%) и гнойно-септические осложнения (8%). 2. В качестве средства временного гемостаза у больных с закрытой травмой печени IV - V степеней тяжести наиболее часто применяется марлевая тампонада (35%), которая еще в 27% наблюдений дополняет пережатие печеночно-двенадцатиперстной связки. 3. Тампонада ран печени, расположенных на задне-диафрагмальной и дорсальной поверхностях печени, значительно сокращает время операции за счет исключения этапов мобилизации правой доли и расширения операционного доступа. У 50% больных с наиболее тяжелыми закрытыми повреждениями печени марлевая тампонада применена в качестве средства окончательного гемостаза. 4. Уменьшение числа резекционных вмешательств у больных с повреждениями IV - V степеней с 88% до 25% привело к снижению летальности с 75% до 54%.
Литература
Чалык Ю.В. Высоко- и низкоинтенсивные лазеры в хирургии травматических повреждений паренхиматозных органов живота. Автореф. дисс. докт. мед.наук. Саратов, 1993. 33с.
Чалык Р.Ю. Клиническое обоснование выбора хирургической тактики при повреждениячх печени. Автореф. дисс. канд.мед.наук. Саратов, 2009, 40с.
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
Одноэтапное хирургическое лечение тяжелой закрытой сочетанной травмы печени
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(2): 79‑81
Повреждения печени относятся к наиболее тяжелой, сложной для диагностики и лечения абдоминальной травме [1]. Частота закрытой травмы печени составляет 13,9 на 100 000 населения [7] и занимает первое место среди всех абдоминальных повреждений [2]. Пик травматизма (25,9 на 100 000 населения) приходится на возраст от 15 до 24 лет [7]. M. Saaiq и соавт. [21] диагностировали I степень травмы печени по Organ Injury Scaling (OIS) у 32,7% пострадавших, II - у 36,2%, III - у 25,6%, IV - у 6,1%; V степень травмы авторы не наблюдали. В другом исследовании [3] число пострадавших с III-V степенью травмы печени составило 16%. Травма печени IV-V степени приводит к внутрибрюшному кровотечению большей интенсивности, чем I-III степени [8]. Летальность при тяжелой травме печени достигает 50%, послеоперационные осложнения - 90% [3, 10], основной причиной смерти является продолжающееся кровотечение [3].
Выбор метода лечения основывается на тщательном клиническом осмотре [5] в сочетании с УЗИ или КТ [14]. Пострадавшим без признаков геморрагического шока и продолжающегося интенсивного внутрибрюшного кровотечения проводят консервативную терапию [6, 17, 22], причем сама по себе степень травмы печени не определяет необходимость лапаротомии [14]. По мнению N. Clemente и соавт., N. Parks и соавт. [9, 18], консервативная терапия наименее успешна у пострадавших с сочетанной травмой и при тяжелом повреждении печени. У тщательно отобранных пациентов для остановки продолжающегося кровотечения применяют эндоваскулярный гемостаз [16]. Гипотония в сочетании со свободной жидкостью в брюшной полости, по данным любого инструментального метода диагностики независимо от степени травмы печени, является показанием к экстренной лапаротомии [2, 14, 20]. Рецидив кровотечения или продолжающееся кровотечение у пострадавших, которых сначала лечили консервативно, также является показанием к лапаротомии [22]. При тяжелой травме печени лапаротомию выполняют в 62% наблюдений [3, 9].
Объем операции при тяжелой травме печени остается предметом дискуссий. Концепция этапного лечения тяжелой травмы, так называемая Damage Control Surgery, включает временный гемостаз за счет тампонирования печени и последующую релапаротомию для окончательного гемостаза [13, 20]. Эту методику применяют у пострадавших с травмой печени IV и V степени [10, 14] и при нестабильной гемодинамике [9]. Необходимо подчеркнуть, что H. Jiang и соавт. [14] считают недостаточный опыт хирурга одним из показаний к тампонаде печени. Лечение по методике Damage Control Surgery осложняется рецидивом внутрибрюшного кровотечения в 16,7-45,5% наблюдений [4], длительным истечением желчи по дренажам или желчным перитонитом в 72,7% [3], внутрибрюшными гнойными осложнениями или синдромом высокого внутрибрюшного давления [11]. В 47,8% наблюдений после тампонады печени в связи с развитием послеоперационных осложнений производят операцию три раза и более [3]. Печеночная недостаточность после травмы печени и ее оперативного лечения развивается почти у всех пострадавших [19], однако фатальная печеночная недостаточность, которая была показанием к ортотопической трансплантации печени, описана в единичных наблюдениях [12, 15].
Представляем наблюдение успешного одноэтапного лечения пострадавшей с тяжелой сочетанной травмой печени.
Больная С., 19 лет, доставлена в реанимационное отделение Института скорой помощи им. Н.В. Склифосовского через час после получения железнодорожной травмы. При поступлении состояние тяжелое. Жалобы на боль в животе и правой половине таза. Уровень сознания 15 баллов по шкале комы Глазго. Кожный покров бледно-розовый. Дыхание самостоятельное, адекватное. Частота дыхательных движений 30 в 1 мин. АД 90/60 мм рт.ст. Частота сердечных сокращений 140 в 1 мин. Живот не вздут, при пальпации болезненный в правом подреберье. Перитонеальные симптомы не вызываются. Моча, выведенная катетером, с геморрагическим окрашиванием. Правая нижняя конечность в вынужденном положении - согнута в тазобедренном и коленном суставах, ротирована медиально в тазобедренном суставе. Активные движения в этом суставе невозможны, пассивные резко болезненны.
Одновременно с реанимационными мероприятиями, которые включали катетеризацию правой внутренней яремной вены, постановку назогастрального зонда и катетеризацию мочевого пузыря, обезболивание и инфузионную терапию, проведено инструментальное обследование. На рентгенограмме костей таза задний вывих правой бедренной кости. При УЗИ брюшной полости отмечены большое количество свободной жидкости в брюшной полости, признаки разрыва правой доли печени, ушиба правой почки, правостороннего паранефрального кровоизлияния. Установлен диагноз: тяжелая закрытая сочетанная травма живота и таза. Разрыв печени, продолжающееся внутрибрюшное кровотечение. Ушиб правой почки. Правостороннее паранефральное кровоизлияние. Задний вывих правого бедра. Геморрагический шок II-III степени. Тяжесть состояния пострадавшей по шкале Revised Trauma Score составила 7,55.
Через час после поступления больная оперирована. Под комбинированным интубационным наркозом с миорелаксацией сначала был вправлен вывих правого бедра. Затем произведена верхнесредне-срединная лапаротомия. В правом поддиафрагмальном пространстве, по правому латеральному каналу, в малом тазу около 900 мл крови. Обнаружен "звездчатый" разрыв S4-5-6
печени по диафрагмальной и висцеральной поверхности (наибольшая глубина разрыва 8 см) с интенсивным венозным кровотечением из него. Временный гемостаз тампонадой марлевыми салфетками, продолжена ревизия. Обнаружено небольшое правостороннее паранефральное кровоизлияние с пропитыванием. Других повреждений органов брюшной полости нет.
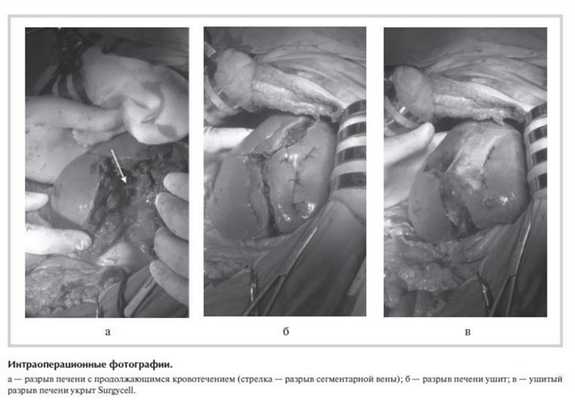
Разрез передней брюшной стенки расширен вправо с рассечением правой прямой мышцы живота, произведена коррекция доступа крючками Сигала. После удаления тампонов кровотечение возобновилось, в глубине разрыва обнаружены: 1) желчный проток S5 диаметром 3 мм с продольным разрывом длиной 4-5 мм и желчеистечением; 2) вена S5 диаметром 3 мм с разрывом овальной формы размером 4×2 мм (см. рисунок ). Выполнен прецизионный шов вены и желчного протока с использованием бинокулярной лупы с увеличением в 2,5 раза - соответственно восьмиобразным швом пролен USP 5/0 и непрерывным обвивным швом пролен USP 5/0 на атравматической игле.
Паренхиматозное кровотечение с поверхности печени остановлено электрокоагуляцией в биполярном режиме и "припудриванием" гемостатическим агентом Procol. С учетом перехода разрыва на висцеральную поверхность S4 печени близко от желчного пузыря выполнена холецистэктомия от шейки с раздельной перевязкой пузырного протока и артерии. Края разрыва печени сведены отдельными П-образными швами полигликолидом USP 0 на атравматической игле (см. рисунок б ), после чего линия швов укрыта гемостатическим агентом Surgycell (см. рисунок в ). Операция закончена дренированием брюшной полости и послойным ушиванием раны. Длительность операции 165 мин. Суммарная кровопотеря составила 1550 мл, собрано и реинфузировано аппаратом CellSaver 290 мл аутоэритроцитов.
Окончательный диагноз: тяжелая закрытая сочетанная травма живота и таза. Разрыв печени с повреждением сегментарной вены и желчного протока (IV степень по шкале OIS), продолжающееся внутрибрюшное кровотечение. Ушиб правой почки
(II степень по шкале OIS). Правостороннее паранефральное кровоизлияние. Задний вывих правого бедра. Геморрагический шок II-III степени. Суммарная тяжесть травмы составила 25 баллов по шкале Injury Severity Score.
После операции пострадавшая в стабильно тяжелом состоянии на продленной искусственной вентиляции легких переведена в реанимационное отделение. Продолжена инфузионно-трансфузионная, антибактериальная, антисекреторная, гепатопротекторная, противоанемическая, антацидная терапия. Течение послеоперационного периода без осложнений. Переведена на спонтанное дыхание и экстубирована в 1-е сутки после операции. Дренажи из брюшной полости удалены на 5-7-е сутки, послеоперационная рана зажила первичным натяжением. Контрольное лабораторное и инструментальное обследование (УЗИ, статическая сцинтиграфия печени) также продемонстрировало отсутствие послеоперационных осложнений и хорошую функцию печени. Пациентка активизирована и после проведения курса лечебной физкультуры в удовлетворительном состоянии выписана на 22-е сутки после операции.
Наше клиническое наблюдение демонстрирует успешное одноэтапное лечение пострадавшей с тяжелой сочетанной травмой печени, несмотря на соответствие тяжести травмы критериям Damage Control Surgery. Необходимым условием этого является достаточный опыт хирурга в гепатопанкреатобилиарной хирургии, наличие круглосуточной трасфузиологической и анестезиолого-реанимационной служб, хорошее техническое и лекарственное обеспечение стационара.
Тампонирование при тяжелых повреждениях печени
Доминирующей причиной смерти трудоспособного населения является травматизм, увеличение которого наблюдается во всем мире. Пациенты с повреждением органов брюшной полости относятся к наиболее тяжелой категории пострадавших, операционная активность в данной группе достигает 88%. В структуре абдоминальной травмы повреждения печени занимают ведущие позиции и являются одной из самых сложных патологий, в связи с особенностями анатомического расположения и строения, по тяжести течения, трудности диагностики, тактике лечения и высокой частоте осложнений. Для лечения такой категории пациентов была разработана концепция Damage control.
Цель. Анализ результатов применения тампонады при тяжелых повреждениях печени в рамках концепции Damage control.
Материалы и методы. Проанализированы результаты оперативного лечения 251 пациента с закрытой травмой печени, прооперированных на клинической базе кафедры общей хирургии СГМУ им. В. И. Разумовского с 1976 по 2020 гг. 74% пострадавших находились в возрасте от 20 до 50 лет.
Результаты. Среди всех пострадавших 70 имели тяжелые повреждения печени. Для изучения результатов лечения данной группы было выделено три периода: с 1976г. по 1992г.; с 1993г. по 2008г.; с 2009г. по 2020г. В первом периоде преобладали резекционные операции - 87,5%. Летальность в этом периоде составила 75%. В течение второго периода радикальные операции сменились на менее агрессивные методики в сочетании с тампонированием. Это позволило снизить частоту летальных случаев до 54%. В третьем периоде происходило активное применение тампонады с целью достижения первичного гемостаза, что позволило снизить летальность до 47%.
Вывод. Широкое внедрение первичного тампонирования в рамках концепции Damage control в хирургии тяжелых повреждений печени позволило улучшить результаты лечения.
Читайте также:
