Телерадиевая или телегамматерапия рака века глаза. Эффективность
Добавил пользователь Morpheus Обновлено: 31.01.2026
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России, 125284 Москва, 2-й Боткинский пр-д, д. 3, Российская Федерация
ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, Томск
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
Особенности терапии сопровождения лучевого лечения больных с опухолями головы и шеи
В публикации освещены основные вопросы переносимости при проведении одновременно лучевой и таргетной терапии больных с опухолями головы и шеи. На примере клинического наблюдения показано течение побочных эффектов и затронуты ключевые вопросы подготовки к лечению и терапии сопровождения. Представлено состояние пациента в поздние сроки и обсуждена связь между адекватным лечением ранних реакций, отсроченным состоянием и качеством жизни больных.
В настоящее время перед онкологами стоят связанные между собой задачи излечения от онкологического процесса, реабилитации, социальной адаптации и сохранения высокого качества жизни больных. Применение методов противоопухолевого воздействия нередко ограничивает состояние пациентов, требующее адекватной поддерживающей терапии на всех этапах лечения и реабилитации. Результаты лучевого и химиолучевого лечения больных с опухолями головы и шеи неотъемлемо связаны с адекватной сопроводительной терапией, в том числе нутритивной поддержкой, ранозаживляющей терапией, своевременной профилактикой и лечением вторичной инфекции, постоянным контактом и психологической поддержкой пациентов, а также с адекватным обезболиванием. Особое значение вышесказанное приобретает в свете внедрения все более агрессивных методов терапии и хирургии с целью снижения смертности, превышающей в мире 270 тыс. человек в год [1].
Большинство пациентов обращаются в специализированные онкологические учреждения уже на поздних стадиях процесса и с признаками нутритивной недостаточности. Энергозатраты постепенно растут, что без соответствующего увеличения калорийности пищи может приводить к потере 1—2 кг мышечной массы в месяц [2—4]. Важно отметить, что потеря массы тела на фоне опухолевой прогрессии врачей нередко не беспокоит, в то время как сам пациент не может адекватно скорректировать свою диету. В ряде исследований показано, что более чем у 50% больных облучение начинают на фоне нутритивной недостаточности, а к моменту завершения лечения частота ее проявления превышает 80% [5—7]. Как сама опухоль, так и лучевые реакции в виде мукозита могут препятствовать нормальному пероральному питанию. С другой стороны, следствием выраженной нутритивной недостаточности является раннее проявление и более тяжелое течение лучевых реакций, что приводит к вынужденному перерыву в курсе облучения и потере его эффективности [8, 9].
Важнейшее условие успешной лучевой терапии — сохранение жизнеспособности нормальных тканей, находящихся в зоне облучения. Современные методы подведения доз ионизирующего излучения направлены на минимизацию лучевых реакций и повреждений. Между тем воздействие ионизирующего излучения на окружающие здоровые ткани исключить полностью не удается [10—13]. В результате лучевая терапия может приводить к местным побочным эффектам облучения, выраженность которых в первую очередь зависит от суммарной поглощенной дозы ионизирующего излучения. Немаловажными факторами являются объем облучаемых тканей и распределение доз в этом объеме, а также методика фракционирования и сроки проведения лучевого лечения.
Общей особенностью местных лучевых побочных эффектов является наличие скрытого периода между облучением и появлением первых клинических проявлений. Чем больше интенсивность подведенного ионизирующего излучения, тем короче этот период. Важной особенностью местных лучевых повреждений является прогрессирование морфологических изменений с ухудшением клинических проявлений, приобретающих хронический характер. Наиболее распространенным побочным эффектом, возникающим в ходе лучевой терапии у больных орофарингеальным раком, является лучевой мукозит (эпителиит), развивающийся более чем у 60% пациентов при проведении стандартного режима фракционирования и практически у 100% больных при нетрадиционных режимах или химиолучевой терапии [14, 15]. Ведущие радиотерапевты свидетельствуют, что более чем в 40% случаев при проведении облучения с лекарственной модификацией развиваются побочные эффекты тяжелой степени [16—19]. Мукозит играет ключевую роль при лучевой терапии рака головы и шеи, а также значительно влияет на качество жизни больных в процессе лечения и после его завершения. Необходимо отметить, что спектр ранних побочных явлений значительно шире и также включает дерматит, ксеростомию, накопление вязкого секрета, дисгевзию, дисфагию, одинофагию, алопецию в области облучения, осиплость, присоединение вторичной инфекции в области облучения или в результате аспирации. Кроме того, дефекты слизистой оболочки могут стать входными воротами для оппортунистических инфекций, например кандидоза. Побочные эффекты во многом взаимосвязаны патогенетически и провоцируют друг друга, причем неадекватное ведение пациента с ранними лучевыми реакциями может приводить к поздним лучевым повреждениям. Через 1,5—2 нед после окончания лучевой терапии проявления реакции слизистых обычно купируются. Вкусовые ощущения восстанавливаются через 1—2 мес, а слюноотделение — через 2—5 мес, иногда и в более поздние сроки.
Лучевой дерматит кожи головы и шеи также представляет собой часто возникающий побочный эффект при лучевой терапии опухолей головы и шеи. Его проявления во многом недооценены, однако на самом деле значительно влияют на переносимость лечения и качество жизни пациентов [20, 21]. Местные лучевые реакции кожи челюстно-лицевой области проявляются в основном в виде эритемы и сухого эпидермита, возникающих при дозе более 20 Гр. При их возникновении перерыв в лечении не требуется, поскольку купируются они самостоятельно либо при местной ранозаживляющей терапии. При облучении метастатических узлов на шее и подведении суммарной очаговой дозы (СОД) 50 Гр дерматит бывает более выраженный и достигает степени влажного эпидермита. С момента проявлений лучевого дерматита и до полного стихания реакций показано применение ранозаживляющих местных средств (гели, метилурациловая мазь, рибофлавин), а также солнцезащитных средств. Кожу необходимо оберегать от трения и раздражения. Для борьбы с ксерозом используют крем с мочевиной, масляный раствор витамина А. Характерная черта развития тяжелых лучевых дерматитов - длительное, прогрессирующее и нередко рецидивирующее течение нарушений микроциркуляции, трофических и обменных процессов в облученных тканях. Как выяснилось в последнее время, существует ряд патофизиологических и клинических особенностей развития лучевого дерматита на фоне таргетной терапии, которые позволяют говорить об отдельной форме — биолучевом дерматите [22]. Такой вариант дерматита характеризуется более выраженным ксерозом, интенсивным воспалительным ответом, выраженным истончением эпидермиса, некрозом эпидермиса и поверхностных слоев дермы, а также выраженной экссудацией. .Биолучевой дерматит имеет раннее начало (на 1—2-й неделе), более острый характер течения и ранние сроки репарации. Дефекты кожи могут стать входными воротами для оппортунистических инфекций, например Staphylococcus aureus. Поэтому очевидно, что ранозаживляющая терапия является ключевым компонентом терапии сопровождения в рамках борьбы с лучевым мукозитом и дерматитом.
Таким образом, лучевое лечение больных с опухолями головы и шеи требует соответствующей сопроводительной терапии, в том числе нутритивной поддержки, ранозаживляющей терапии, своевременной профилактики и лечения вторичной инфекции, постоянного контакта и психологической поддержки пациентов, а также адекватного обезболивания. При этом аналгезирующую терапию используют как при болевом синдроме, формирующемся в результате опухолевого поражения, так и при возникающих в процессе терапии лучевых реакциях. Любой компонент терапии сопровождения одинаково важен, поскольку его отсутствие или неадекватное применение может сказаться не только на качестве жизни больного, но и на результатах лечения основного заболевания.
В постлучевом периоде нормальные ткани, подвергшиеся облучению, очень ранимы, поэтому к ним нужно относиться бережно. В ранние сроки не рекомендуется выполнять инвазивные диагностические процедуры и биопсию без крайней необходимости. Показан подбор диеты при необходимости в сочетании с противорефлюксными препаратами. Травмы, алкоголь, курение, раздражающая пища легко вызывают изъязвление слизистой оболочки, что нередко сопровождается обнажением кости нижней челюсти с последующим развитием остеомиелита. Пациенту должно быть рекомендовано продолжить контроль за массой тела, а также проводить оценку нутритивного статуса и степени нутритивной недостаточности при каждом контрольном обследовании. На усмотрение курирующего специалиста можно в дальнейшем назначать нутритивную терапию, предпочтительно сипинг.
Таким образом, вопрос об адекватности поддерживающей терапии и последующей реабилитации пациентов, получающих лучевое и химиолучевое лечение по поводу опухолей головы и шеи, остается одной из актуальных проблем в современной онкологии, что демонстрирует приведенное ниже клиническое наблюдение.
Клиническое наблюдение
Пациент К., 52 года, считает себя больным с декабря 2012 г., когда впервые обратил внимание на появление боли в горле, дискомфорт при приеме пищи, постоянную субфебрильную температуру. Гнусавость отмечал ранее в течение года. Обратился к врачу по месту жительства. Проводимая антибактериальная терапия эффекта не дала. Обратился в районный онкологический диспансер Пензы, где был заподозрен и верифицирован рак глотки. Направлен в МНИОИ им. П.А. Герцена, куда обратился в феврале 2013 г.
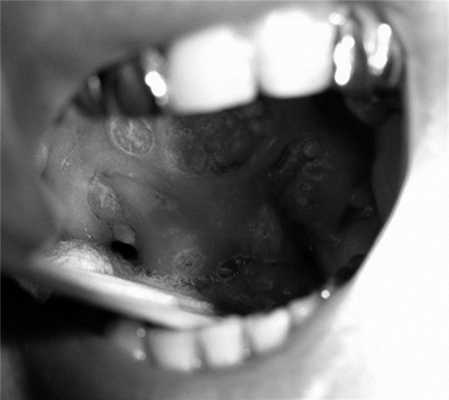
В беседе пациент предъявлял жалобы на чувство инородного тела в горле, гнусавость, выраженные боли в глотке, а также помеху при глотании пищи и жидкости. В анамнезе курение отрицал. При осмотре больного определялось опухолевое поражение ротоглотки, включая мягкое небо, с переходом за среднюю линию и на твердое небо, небную миндалину, дужки, стенку рото- и носоглотки. Просвет глотки был значительно сужен, а нижний полюс опухоли недостижим (рис. 1). Рис. 1. Картина распространения опухолевого процесса до начала лечения (описание в тексте). На шее с обеих сторон очаговой патологии не выявлено.
Данные МРТ: картина объемного образования носо-, рото- и гортаноглотки смешанного характера роста с выраженным экзофитным компонентом размером 51×38 мм, протяженностью не менее 66 мм. Верхний полюс опухоли ниже уровня левого слухового валика на 5—6 мм. С учетом ограничения интерпретации на фоне артефактов создавалось впечатление, что образование исходит из левой боковой стенки ротоглотки — зональность не прослеживается. Отмечалось пролабирование опухоли в клетчатку ретрофарингеального и сонного пространства с вовлечением нижнего отдела верхнего и среднего констрикторов глотки. На этом уровне задний контур образования плотно прилежал преимущественно к левой длинной мышце шеи с вовлечением ее фасции. Образование на визуализируемом уровне вовлекало левые отделы мягкого неба, дужки и миндаликовую нишу, несколько деформировало левые отделы корня. Латеральный контур на этом уровне вовлекал нижние отделы латеральной крылонебной мышцы. Нижний полюс опухоли располагался на уровне гортаноглотки по левой стенке в виде утолщения, в проекции плоскости, проведенной через апикальные отделы лепестка надгортанника. Визуализировались единичные лимфатические узлы левой подбородочной области (размер 12×9 мм), а также по ходу сосудов шеи в верхней трети с обеих сторон до 10 мм.
При гистологическом исследовании биопсийного материала опухоли правой небной миндалины выявлен инфильтративный рост плоскоклеточного рака с наклонностью к ороговению. Иммуногистохимическое исследование (АТ к белку р16) — положительная реакция в клетках опухоли.
На основании результатов проведенных исследований диагностирован рак ротоглотки IVA стадии, cT4N0M0. Тактика лечения обсуждена на междисциплинарном консилиуме с участием радиолога, хирурга и химиотерапевта, рекомендовано проведение одновременного химиолучевого лечения. Учитывая соматическое состояние пациента, сопутствующую патологию и показатели функции почек, в качестве лекарственного компонента лечения применялся цетуксимаб.
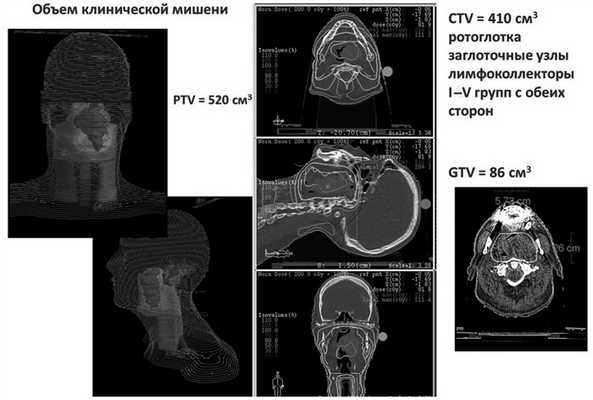
Риск нутритивной недостаточности по критериям MUST, опросникам NRS-2002 и ESMO был оценен как высокий. Учитывая соматическое состояние пациента, локализацию и объем опухолевого поражения, план биолучевого лечения по радикальной программе, в том числе объем облучения 520 см 3 , риск развития выраженных побочных эффектов лечения (мукозита, дерматита) также был оценен как высокий (рис. 2). Рис. 2. Дозное распределение при лучевом терапевтическом воздействии на локорегионарную область ротоглотки, включая заглоточные лимфатические узлы и лимфоколлекторы шеи Ib—IV групп с обеих сторон. PTV — планируемый объем облучения мишени; CTV — клинический объем мишени; GTV — макроскопический объем опухоли.
С 05.03.13 по 16.05.13 проведено одновременное химиолучевое лечение в разовой очаговой дозе (РОД) 2 Гр до СОД 70 Гр с цетуксимабом (стартовая доза 800 мг, далее 1 раз в неделю, поддерживающая доза 500 мг) (см. рис. 2). В процессе терапии имели место выраженные лучевые реакции в виде мукозита III степени RTOG, проявившиеся на ранних сроках (СОД 24 Гр), которые потребовали незапланированного перерыва в лечении в течение 14 календарных дней (СОД 40 Гр) (рис. 3). Рис. 3. Клиническая картина динамики мукозита в процессе лечения. Также отмечались характерные для таргетного препарата кожные реакции в виде папулезно-пустулезных высыпаний на коже лица, головы, груди, шеи, максимально выраженные до III степени через 2 дня после 4-го введения цетуксимаба, на фоне дерматита лица и шеи II степени в проекции полей облучения (рис. 4). Рис. 4. Клиническая картина динамики дерматита в процессе лечения. Пациенту проведены облучение в полном объеме, а также все запланированные введения цетуксимаба.
С 1-го дня лучевого лечения проведена профилактическая ранозаживляющая терапия гелем с деринатом с последующей интенсификацией обработок по мере проявления мукозита. Больному было рекомендовано ежедневно полоскать полость рта теплыми дезинфицирующими растворами, например отваром ромашки, шалфея и др. Назначена механически и химически щадящая богатая белком диета с исключением алкогольных напитков. Также пациенту на пике лучевых реакций потребовалась обезболивающая терапия, проведение которой позволило обеспечить удовлетворительное качество жизни и полноценное питание пациента per os на всем протяжении лечения и после его завершения. Нутритивную поддержку проводили, используя специализированное питание нейтрального вкуса, с расчетом объема по энергетическим затратам и потерям белка, а также подключением смесей с пищевыми волокнами при появлении запора. В рамках борьбы с дерматитом проводили увлажнение и обработку кожи кремом с витамином K, а также такие профилактические меры, как защита кожи от солнца и механических травм. Следует отметить, что пациент тщательно выполнял все назначения.
При осмотре через 1 нед после окончания химиолучевой терапии клинически экзофит опухоли не определялся. Отмечено стихание мукозита до I степени RTOG и дерматита до I степени RTOG (см. рис. 3, 4). Далее еще через 1 нед лучевые реакции стихли полностью. По данным контрольного обследования через 1,5 мес получены данные, подтверждающие полный эффект, признаков остаточной опухоли не выявлено. Пациент оставлен под наблюдением. В поздние сроки единственным негативным последствием являлась ксеростомия I степени RTOG, не мешающая пациенту жить и работать в привычном ему до болезни ритме. В настоящее время безрецидивный срок наблюдения пациента составляет 6 лет.
Таким образом, в рамках существующих подходов к лечению больных с опухолями головы и шеи требуются не только высокий уровень методик противоопухолевого воздействия, но и комплексная программа терапии сопровождения и реабилитации. При детальном рассмотрении переносимости биолучевой терапии обращает на себя внимание достаточно интенсивное течение лучевых реакций с ранним их развитием до III степени RTOG и быстрым стиханием по завершении лечения. Вынужденный 14-дневный перерыв в облучении не выходит за рекомендованные в мировой практике рамки сроков реализации радикального курса, позволяющие говорить о полноценной реализации противоопухолевого эффекта. Полученный результат лечения в полной мере подтверждает этот факт. Терапия сопровождения, если не обеспечивает отсутствие выраженных реакций в силу, видимо, их неизбежности на современном уровне развития лучевой и лекарственной терапии, все же позволяет оптимизировать сроки проведения специального лечения, максимально нивелировать проявления мукозита и дерматита как с точки зрения качества жизни пациентов, так и ускорения их реабилитации по завершении курса облучения. Это особенно важно в случае этапного комбинированного и комплексного лечения больных с опухолями головы и шеи. Таким образом, мультидисциплинарный подход к ведению этой сложной категории больных с применением адекватного сопроводительного лечения позволяет рассчитывать на достаточно хорошую переносимость агрессивных методик химиолучевого лечения даже при значительных объемах облучения и у соматически отягощенных больных. В последние годы это позволяет значительно чаще брать на лечение пациентов, которым ранее в нем было отказано либо план химиолучевой терапии которых не был бы реализован в полном объеме.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Органосохраняющее лечение увеальной меланомы и других внутриглазных опухолей у взрослых
Безоперационное лечение внутриглазных опухолей является важной частью клинической практики Онкологической клиники МИБС. Да, опухоли глаза, значительная доля которых приходиться на увеальную меланому, - немногочисленны. Но современные методы лечения позволяют, при своевременном обращении, сохранить не только глазное яблоко, но и остроту зрения. Поэтому вопрос информирования о возможностях органосохраняющего лечения - важен для общества. Подробнее - в материале МИБС…

Когда речь идет о лечении внутриглазных опухолей, целесообразно рассматривать его на примере увеальной меланомы, как наиболее часто диагностируемой первичной опухоли органов зрения.
Что такое увеальная меланома?
Увеальная меланома - злокачественное новообразование из клеток меланоцитов, растущее внутри глазного яблока, в одном из его слоев. Женщины более подвержены этому заболеванию, наиболее часто диагноз устанавливается у пациентов старше 50 лет.
От локализации опухоли в глазном яблоке зависит ее название:
- меланома хориоидеи (меланома сосудистой оболочки глаза) - наиболее распространенная внутриглазная опухоль взрослых; составляет до 85% увеальных меланом;
- меланома цилиарного тела - опухоль, расположившаяся в тканях “соединительного звена” между радужкой и сосудистой оболочкой, диагностируется в 10% всех случаев увеальных меланом;
- меланома радужной оболочки - наиболее редкая меланома радужки составляет около 5% всех увеальных меланом.
В связи с тем, что подавляющее большинство увеальных меланом приходится на меланому хориоидеи, целесообразно считать тождественными эти два понятия для упрощения понимания подходов к диагностике и лечению. Также справедливо рассматривать указанные подходы и для лечения других внутриглазных опухолей.
Увеальная меланома: лечение
Вся тяжесть выявления увеальной меланомы ложится на плечи офтальмолога, который по ряду симптомов может не только заподозрить наличие опухоли, но и указать на ее тип, проведя комплексную диагностику. Ключевое значение имеет опыт врачей, выполняющих визуальную (офтальмолог) и инструментальную (радиолог) диагностику, в первую очередь, МРТ - в России регистрируется всего около 1000 случаев опухолей глаза в год и возможность получить консультацию коллег, встречавшихся в своей практике с данным заболеванием, гарантирует более высокое качество медицинской помощи. Для того, чтобы повысить точность диагностики в любом регионе России, МИБС предлагает услугу “второе мнение”, заключающееся в дистанционном направлении имеющихся снимков МРТ, КТ, ПЭТ-КТ на рассмотрение специалистам МИБС с получением письменного заключения.
После того, как диагноз “увеальная меланома” будет подтвержден, пациенту совместно с врачом-офтальмологом предстоит ответить на крайне важный вопрос - какой метод лечения выбрать?
Энуклеация (полное удаление) глазного яблока до конца 70-х годов прошлого века являлась единственным действенным способом, которым проводили лечение меланомы хориоидеи. К сожалению, несмотря на развитие альтернативных методов, и сегодня лечение “меланомы глаза” в пределах офтальмологической клиники, в которую обратится пациент за установлением диагноза, во многих случаях будет означать удаление глазного яблока и сопутствующие ему физическую инвалидность и психологическую травму, значительно снижающие качество жизни. К тому же стоимость пластической реконструкции и индивидуального глазного протезирования после энуклеации, зачастую, превышает стоимость высокотехнологичного лечения, демонстрирующего сравнимую эффективность.
Современная офтальмология использует ряд методов, позволяющих избежать удаления глазного яблока: частичная резекция пораженных тканей органа (например, хирургическое лечение меланомы радужной оболочки глаза является наиболее оптимальным ввиду удобного доступа и возможности ранней визуальной диагностики), разрушение опухоли лазером (лазерная фотокоагуляция), термотерапия, криотерапия и лучевое лечение.
Наиболее сложным, с точки зрения принятия оптимального решения, является выбор в пользу лучевого лечения увеальной меланомы, которое при условии соблюдения современных протоколов, показывает эффективность на уровне хирургии. Если применение брахитерапии (контактного подведения радиоактивных элементов к опухоли) может быть предметом дискуссии об эффективности такого лечения, в особенности, при достижении опухолью значительного размера, то более современная радиохирургия на Гамма-ноже, а тем более, лечение увеальной меланомы протонами, демонстрируют показатели эффективности и безопасности, не уступающие даже хирургическому лечению.
Но, по объективным причинам - необходимо дорогостоящее оборудование, а также точное соблюдение протоколов радиохирургии и протонной терапии, - современное лучевое лечение увеальной меланомы не может быть выполнено в офтальмологической клинике. И выбор в пользу “лучей” будет означать не только передачу пациента в профильную клинику, но и оплату пациентом услуг в другом лечебном учреждении. К сожалению, очень часто финансовый интерес офтальмолога становится причиной неполного информирования о возможностях высокотехнологичного лечения внутриглазных опухолей в России.
Радиохирургия сохраняет не только глазное яблоко, но и зрение
Современные методы лучевого лечения опухолей (в т.ч. опухолей глаза) реализуются на сложном оборудовании в специализированных центрах, примерами которых является Онкологическая клиника МИБС и Центр протонной терапии МИБС. Многочисленные исследования подтвердили эффективность высокоточного облучения высокими дозами радиации в лечении меланомы хориоидеи, а опыт и технологии, находящиеся на вооружении специалистов МИБС, позволяют пациенту, независимо от типа и стадии опухоли, получить помощь согласно лучшим международным протоколам.
Чаще всего при увеальной меланоме проводится радиохирургия - управляемая подача тонких пучков элементарных частиц фотонов, из множества пересечений которых формируется зона однородно высокой, смертельной для злокачественных клеток, дозы, соответствующая форме опухоли. В таком случае остальные структуры глаза и находящиеся на пути каждого отдельного пучка излучения здоровые ткани (в т.ч. головного мозга) получают значительно меньшие дозы, размер которых задается исходя из подтвержденных значений толерантных доз (не вызывающих необратимых биологически нарушений).
В зависимости от расположения, формы и размера новообразования, радиохирургия увеальной меланомы может быть выполнена Гамма-ножом или Кибер-ножом. МИБС имеет в своем распоряжении обе этих системы, и выбор наиболее оптимальной технологии производится лечащим врачом после предварительной оценки клинического случая.
Протонная терапия в лечении увеальной меланомы не демонстрирует такого выдающегося преимущества, как при лечении других опухолей - особенность расположения глазного яблока позволяет безопасно подвести высокие дозы радиации и с помощью радиохирургии на Гамма-ноже. При этом стоимость лечения Гамма-ножом несравнимо ниже при одинаковом уровне достигаемой эффективности.
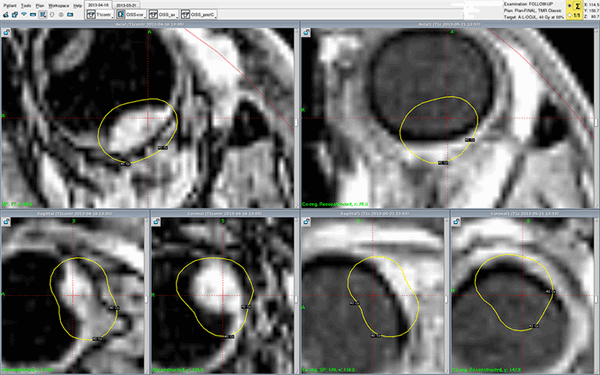
Реальный клинический случай - лечение меланомы хориоидеи Гамма-ножом Gamma-Knife Perfexion в Онкологической клинике МИБС. Снимки МРТ с контрастом (слева - до, справа - после лечения). Меланома хориоидеи на правом снимке, сделанном во время контрольного обследования всего через один месяц (!), не визуализируется - желтые контуры изначального расположения опухоли нанесены для сравнения. Опухоль исчезла. Без операции, с сохранением глазного яблока.
Благодаря органосохранности, оптимальной стоимости и высокой эффективности, количество пациентов МИБС, получивших современное безоперационное лечение увеальной меланомы на Гамма-ноже, составляет уже более трех десятков. Учитывая общую статистику заболеваемости, можно утверждать, что наши врачи и медицинские физики имеют одну из самых высоких компетенций по лечению увеальных меланом не только в России, но и в мире.
Безоперационное вторичных внутриглазных опухолей
Еще одной статистически значимой группой опухолей органов зрения являются метастазы первичных опухолей, расположенных в других частях тела. Метастазы в глазное яблоко чаще всего вовлекают хориоидею, и чаще всего это - метастазы рака легкого. В таком случае радиохирургия также может применяться для разрушения вторичных раков. Но такое решение должно учитывать возможность лечения первичной опухоли и комплексной терапии всех метастазов.
Имеет ли смысл протонная терапия в лечении увеальной меланомы и других внутриглазных опухолей?
В случае с лечением внутриглазных опухолей основное преимущество протонов - минимальное облучение здоровых тканей, - нивелируется тем, что аналогичного уровня безопасности можно достичь и при радиохирургии. И более высокая стоимость лечения протонами делает ее применение при увеальной меланоме нецелесообразным.
Эффективное лечение первичного очага, как профилактика метастазов меланомы хориоидеи
Независимо от того, какой метод был выбран, откладывать лечение увеальной меланомы не стоит - примерно половина пациентов с этим диагнозом погибают от метастазов. Это связано как с активным метастазированием через кровеносные сосуды, так и с низким вниманием к возможным органам-мишеням. Увеальная меланома чаще всего метастазирует в печень (более, чем в 90% случаев метастатического поражения) и легкие (24%). Реже поражаются головной мозг, кожа, кости, лимфоузлы, второй глаз и его орбита.
При своевременном выявлении крупных одиночных метастазов меланомы хориоидеи их лечение также может быть проведено методами радиохирургии и протонной терапии в стенах МИБС.
Если у Вас есть подтвержденный диагноз “увеальная меланома”, или имеются подозрения и Вы уже прошли первичную инструментальную диагностику по месту жительства, обратитесь в любой из Диагностических центров МИБС за “вторым мнением”. Если диагноз подтвердится, наши специалисты смогут дать заключение о возможности и целесообразности применения радиохирургии или протонной терапии, которые доступны пациентам в Онкологической Клинике МИБС и Центре протонной терапии МИБС.
Не дайте болезни шансов - обратитесь сейчас!

Иванов Павел Игоревич
Заведующий отделением нейрорадиологии.
Нейрохирург высшей категории, кандидат медицинских наук.
Действительный член Всемирного Общества пользователей Гамма-Ножа (LGKS).
Действительный член Европейского Общества функциональной и стереотаксической нейрохирургии (ESSFN).
Действительный член Образовательного комитета Международного Общества Стереотаксической Радиохирургии (ISRS) .
Доцент кафедры нейрохирургии Военно-Медицинской Академии им. С.М. Кирова.
Телерадиевая или телегамматерапия рака века глаза. Эффективность
У онкологических больных при сниженном иммунитете, на фоне специфического противоопухолевого лечения могут развиваться различные воспалительные заболевания век. Многие опухоли также могут протекать под видом воспалительных заболеваний век. В статье описываются клинические симптомы основных воспалительных заболеваний век в свете дифференциальной диагностики с опухолями век.
В пользу опухоли говорят нетипичная картина воспалительного заболевания, отсутствие болевого синдрома, неэффективность противовоспалительного лечения. Диагноз опухоли окончательно устанавливается после морфологического исследования биоптата.
При отсутствии уверенности в диагнозе воспалительного заболевания век целесообразно воздерживаться от назначения тепловых процедур, физиотерапии или инъекций глюкокортикоидов. Все подозрительные на опухоль образования должны подвергаться биопсии с обязательным морфологическим исследованием биоптата.
Ключевые слова: абсцесс век, флегмона век, Т-клеточная лимфома кожи век, халязион, аденокарцинома мейбомиевой железы, ячмень, саркома Капоши ве, блефарит, базальноклеточный рак, карцинома in situ.
Inflammatory eyelid diseases from an ophthalmic oncologist's perspective
Grishina E.E.
M.F. Vladimirsrky Moscow Regional Clinical and Research Institute
In cancer patients with reduced immunity, various inflammatory diseases of the eyelids can develop against the background of specific antitumor treatment. But many tumors can also occur as inflammatory diseases of the eyelids.
The article describes the clinical symptoms of the main inflammatory diseases of the eyelids in the light of differential diagnosis with tumors of the eyelids. The clinical picture of tumors of the eyelids, masked under inflammatory diseases, is highlighted. Particular attention is paid to the description of T-cell lymphoma of the skin of the eyelids, adenocarcinoma of the meibomian gland, Kaposi’s sarcoma, skin cancer with spread to the rib edge of the eyelid, and precancerous skin diseases.
An atypical picture of an inflammatory disease, a lack of pain syndrome, an ineffectiveness of anti-inflammatory treatment, "out-of-eye" manifestations of the disease (lymphoma, Kaposi's sarcoma) are the signs of the tumor. The diagnosis of the tumor is finally established after the morphological examination of the biopsy specimen.
Key words: abscess of the eyelids, phlegmon of the eyelids, T-cell lymphoma of the skin of the eyelids; chalyazion, adenocarcinoma of the meibomian gland; stye, Kaposi's sarcoma; blepharitis, basal cell carcinoma, carcinoma in situ.
For citation: Grishina E.E. Inflammatory eyelid diseases from an ophthalmic oncologist's perspective // RMJ. Clinical ophthalmology. 2017. № 3. P. 190-193.
Рассмотрены воспалительные заболевания век с позиции офтальмоонколога

Воспалительные заболевания век многообразны. В зависимости от этиологического фактора различают инфекционные и неинфекционные блефариты, мейбомииты, дерматиты и т. д. По течению заболевания они делятся на острые и хронические. По локализации процесса выделяют поражение всех тканей века, воспаление края век, воспаление желез века. Возможно изолированное воспаление кожи век - дерматит, чаще аллергического генеза.
Острое воспаление может распространяться на все ткани века и быть ограниченным или разлитым. Ограниченное острое гнойное воспаление века - абсцесс. Если острое гнойное воспаление приобретает разлитой характер, развивается флегмона. Острое гнойное воспаление возникает после различных повреждений кожи, укусов насекомых, эпиляции бровей, выдавливания ячменя. Острое гнойное воспаление век у маленьких детей нередко развивается при синуситах.
Веки богаты железами, имеющими различное строение и выполняющими разные функции. В толще хрящевой пластинки расположены многочисленные железы альвеолярного строения с длинными выводными протоками, идущими параллельно друг другу, - мейбомиевые железы. Через тарзальную конъюнктиву они просвечивают в виде желтоватых вертикальных полос. Устья выводных протоков видны у «серой линии» края века в виде мелких точек. Мейбомиевы железы представляют собой разновидность сальных желез. Основная функция мейбомиевых желез - формирование липидного слоя прекорнеальной пленки.
Для мейбомиевых желез характерен голокриновый тип секреции, т. е. продукция липидов мейбомиевыми железами сопровождается разрушением клеток железы. При закупорке выводного протока железы липиды попадают в хрящевую пластинку, вызывая хроническое гранулематозное воспаление с гигантоклеточной реакцией - халязион.
У ресниц располагаются сальные железы Цейса по две у каждого волосяного фолликула. Секрет желез Цейса выделяется в волосяной фолликул. При хроническом продуктивном воспалении железы Цейса развивается так называемый краевой халязион.
Острое гнойное воспаление сальных или потовых желез с формированием локального абсцесса называется наружным ячменем. Острое гнойное воспаление мейбомиевой железы приводит к развитию внутреннего ячменя.
Двустороннее воспаление краев век или блефарит, как правило, имеет хроническое течение. Стафилококковый блефарит сопровождается изъязвлением краев век, трихиазом и выпадением ресниц.
Хорошо известно, что под видом халязиона может скрываться рак мейбомиевой железы, однако и другие опухоли могут маскироваться под воспалительные заболевания век. На основании анализа диагностических ошибок позволим себе их описать и прокомментировать.
Как правило, диагноз рака мейбомиевой железы устанавливается после оперативного лечения «халязиона» и гистологического исследования удаленного материала. Если гистологическое исследование не проводится, то это приводит к многократному удалению «рецидивирующего халязиона» и позднему выявлению аденокарциномы мейбомиевой железы. Так, в нашем институте проходила лечение больная, которой в лечебном учреждении по месту жительства 4 раза проводили операции по поводу «халязиона» верхнего века правого глаза. Гистологическое исследование удаленного материала не проводилось! При поступлении больная предъявляла жалобы на боли в правом глазу, его легкое покраснение, уплотнение в толще верхнего века. При осмотре правого глаза обращали на себя внимание уплотнение в средней трети верхнего века без четких границ с деформацией утолщенного реберного края, трихиаз. Эрозии в верхней половине роговицы обусловили роговичный синдром: светобоязнь, слезотечение, боль. На конъюнктиве верхнего века в средней трети были видны рубцы. Пальпация и УЗИ периферических лимфатических узлов не выявили их увеличение. Была проведена биопсия образования верхнего века. Гистологическое исследование биоптата «халязиона» подтвердило предположение о раке мейбомиевой железы. Больная была направлена на локальную дистанционную лучевую терапию опухоли верхнего века правого глаза.
Аденокарцинома сальной железы встречается преимущественно на веках и чрезвычайно редко развивается на коже других областей. В основном страдают лица пожилого возраста, чаще женщины. Преобладают опухоли из мейбомиевых желез, реже развиваются опухоли из эпителия сальных желез Цейса и еще реже - из сальных желез слезного мясца и брови. Высокая степень злокачественности аденокарциномы мейбомиевой железы определяется быстрым метастазированием в регионарные лимфоузлы и отдаленные органы [1]. На ранних стадиях опухоль напоминает халязион. Это обстоятельство диктует необходимость обязательного гистологического исследования тканей при оперативном лечении любого халязиона, но особенно это важно в случаях его рецидивирующего течения. По мере роста аденокарциномы мейбомиевой железы, в отличие от халязиона, возникает не только уплотнение, но и деформация хряща. Отмечаются втянутость в межреберном пространстве века и трихиаз (рис. 1).
В межреберном пространстве появляются плотные массы желтоватого цвета. Иногда опухоль прорастает хрящ век с формированием на конъюнктиве серовато-красноватых кровоточащих разрастаний [2]. В большинстве случаев аденокарцинома мейбомиевой железы сопровождается односторонним конъюнктивитом, блефаритом, мейбомиитом и выраженным синдромом «сухого глаза». Возможны случаи мультицентрического роста опухоли. Основным методом лечения аденокарциномы мейбомиевой железы является дистанционная лучевая терапия [3].
Особого внимания требует установление диагноза халязиона у больных различными злокачественными опухолями в генерализованной стадии заболевания. У больных с ослабленным иммунитетом во время химиотерапии нередко развиваются дисфункция мейбомиевых желез, мейбомииты и блефариты, что способствует появлению халязиона. Однако нельзя исключить возможность метастатического поражения век. На ранних этапах метастаз в веко может выглядеть как обычный халязион. Опухоль быстро увеличивается в размерах, прорастает пальпебральную конъюнктиву с образованием сероватых, легко кровоточащих при прикосновении псевдогрануляций.
Клинические проявления метастатических опухолей придаточного аппарата глаза встречаются редко и изучены плохо. Чаще всего в веки метастазируют рак молочной железы, рак легкого, опухоли желудочно-кишечного такта, меланомы. Метастатическое поражение придаточного аппарата глаз часто сочетается с другими метастазами в глаз или орбиту, но, главное, всегда возникает на фоне поражения других органов, что определяет плохой прогноз для жизни. Если общее состояние больного позволяет провести хирургическое лечение халязиона, удаленный материал обязательно должен подвергаться гистологическому исследованию [4].
В последнее время участились ошибки в диагностике другой опухоли - саркомы Капоши. Для этой опухоли наиболее типичным является поражение кожи. Излюбленная локализация кожных опухолей: ноги, лицо и гениталии. На коже появляются безболезненные пятна или папулы разнообразных оттенков — от нежно-розового до ярко-красного цвета. Приблизительно у 20% больных саркомой Капоши в процесс вовлекаются веки и конъюнктива [5]. Такие изменения кожи век нередко диагностируют как ячмень (рис. 2, 3).
Так, мужчина, 30 лет, был направлен на консультацию в наш институт с диагнозом «ячмень верхнего века, резистентный к противовоспалительной терапии». Получал сухое тепло, 5 сеансов УВЧ-терапии. При осмотре на верхнем веке правого глаза диагностировано безболезненное образование кожи ярко-красного цвета около 1,5 см в диаметре. Образование появилось 1 нед. назад и быстро увеличилось в размерах. Три дня назад аналогичное образование возникло на правой щеке. При детальном расспросе больного выяснилось, что он ВИЧ-инфицирован и состоит на учете в противо-СПИДовом центре по месту жительства. Последние 4 мес. на прием не являлся. Лечения не получал. Было высказано предположение о саркоме Капоши. Диагноз опухоли подтвержден морфологически. Больной направлен на лечение основного заболевания к инфекционисту.
Изменения конъюнктивы при саркоме Капоши обычно локализуются в сводах и имеют вид мелких красноватых узелков. Реже развивается большой безболезненный узел мягкой консистенции, который ошибочно принимают за грануляционный полип при халязионе. Иногда появляется плоская опухоль конъюнктивы ярко-красного цвета, которая симулирует субконъюнктивальное кровоизлияние.
Саркома Капоши - редкое заболевание, которое, как правило, возникает на фоне иммунодефицита. Возраст больных — 30-40 лет. ВИЧ-инфицированные лица заболевают саркомой Капоши в 300 раз чаще, чем основное население [6]. К группе риска развития саркомы Капоши относят также больных, получающих иммуносупрессоры после пересадки органов.
Хочется подчеркнуть, что при появлении безболезненных кожных пятен и папул красного цвета у больных с иммунодефицитом необходимо прежде всего исключить саркому Капоши. Такие изменения кожи век редко бывают изолированными и сочетаются с поражением кожи на других участках тела [7].
Согласно современным представлениям о патогенезе саркомы Капоши, пусковым механизмом развития заболевания являются нарушение иммунного статуса и возникающая при этом повышенная продукция клетками многих цитокинов: ИЛ-6, ИЛ-1, ФНО и др. В отличие от нормальных мезенхимальных клеток, опухолевые клетки саркомы Капоши особенно чувствительны к воздействию клеточных ростовых факторов. Высокая продукция цитокинов вызывает экспрессию гена tat, который играет ключевую роль в патогенезе опухоли - обеспечивает миграцию опухолевых клеток. Кроме того, он стимулирует ангиогенез опухоли - эндотелиальные клетки начинают формировать новую капиллярную сеть.
Саркома Капоши у лиц, не страдающих ВИЧ-инфекцией, обычно имеет торпидное течение и не требует системной терапии. Саркома Капоши у ВИЧ-инфицированных больных развивается быстро и часто сопровождается поражением внутренних органов. Такие больные нуждаются прежде всего в лечении основного заболевания - ВИЧ-инфекции.
Большие сложности у офтальмологов вызывает диагностика Т-клеточной лимфомы век. Опухоль сопровождается такими изменениями, как отек и уплотнение века, гиперемия кожи. Такое состояние принимают за абсцесс века. Так, больному 47 лет с жалобами на отечность и несколько болезненное уплотнение обоих век правого глаза без флюктуации, резкую нечетко отграниченную гиперемию кожи век с поверхностным изъязвлением на отдельных участках провели вскрытие «абсцесса». Выделилось небольшое количество сукровичного отделяемого. В связи с неэффективностью местной и общей противовоспалительной терапии был направлен на консультацию к офтальмоонкологу. При первичном осмотре привлекало внимание несоответствие выраженности клинических симптомов, болевого синдрома и отсутствие общей реакции организма в виде повышенной температуры тела, лейкоцитоза и изменения лейкоцитарной формулы. Из анамнеза известно, что он страдает Т-клеточной кожной неходжкинской лимфомой. Несколько месяцев назад в области правого предплечья появились изменения кожи, аналогичные описанным выше. Начат курс противоопухолевого лечения Т-клеточной лимфомы. Была проведена биопсия новообразования кожи век правого глаза. Диагноз Т-клеточной кожной лимфомы века подтвержден морфологически.
В коже преобладают Т-лимфоциты, поэтому кожная лимфома часто бывает Т-клеточной. Для этого вида опухоли характерна инфильтрация дермы опухолевыми Т-лимфоцитами. На границе эпидермиса и дермы развиваются множественные микроабсцессы, которые обусловливают появление очагов болезненной гиперемии кожи и ее поверхностное изъязвление. Установление правильного диагноза у данного пациента стало возможным благодаря грамотно собранному анамнезу, осмотру «внеглазных» проявлений заболевания, оценке клинических симптомов заболевания века (рис. 4, 5). Считается, что поражение век при грибовидном микозе (варианте Т-клеточной лимфомы) ассоциируется с плохим витальным прогнозом [8].
Особый интерес представляет дифференциальная диагностика воспалительных заболеваний края век (блефарита и мейбомиита) и злокачественной опухоли кожи век с преимущественным ростом вдоль реберного края века. Такой рост опухоли встречается при базальноклеточном раке кожи (рис. 6), плоскоклеточном раке кожи и предраковых заболеваниях (болезни Боуэна). Морфологически эпителиома Боуэна имеет все признаки рака. Атипичные кератоциты объединяются в сосочкоподобные структуры. Возникают очаги паракератоза. Появляются клеточный полиморфизм, атипичные митозы, многоядерные клетки. Но процесс не распространяется глубже базальной мембраны эпидермиса. При отсутствии своевременного лечения опухоль трансформируется в плоскоклеточный рак [9].
Стафилококковый блефарит нередко проявляется изъязвлением кожи и неправильным ростом ресниц. Язвенный блефарит - двусторонний процесс, хотя выраженность симптомов может быть неодинаковой на разных участках век.
При локализации злокачественной опухоли кожи у края века обращает на себя внимание нарушение роста ресниц. Реберный край представляется утолщенным, наблюдается локальная гиперемия пальпебральной конъюнктивы. Нередко поверхность опухоли изъязвляется.
Карцинома in situ, или эпителиома Боуэна, на коже век встречается крайне редко. Клинически имеет вид бляшек небольших размеров (несколько мм в диаметре) темно-красного цвета с чешуйками на поверхности (рис. 7).
После снятия чешуек обнажается мокнущая бугристая поверхность опухоли. При локализации новообразования у ресничного края нарушается рост ресниц [10].
Таким образом, при локальном поражении одного века в виде изъязвления реберного края и локального выпадения ресниц, при отсутствии эффекта от противовоспалительного лечения необходимо исключить новообразование кожи века.
В заключение считаем важным отметить, что у онкологических больных при сниженном иммунитете, на фоне специфического противоопухолевого лечения могут развиваться различные воспалительные заболевания век. Но и многие опухоли могут протекать под видом воспалительных заболеваний век. Это так называемый «маскарадный синдром». В пользу опухоли говорят нетипичная картина воспалительного заболевания, отсутствие болевого синдрома, неэффективность противовоспалительного лечения. Диагноз опухоли окончательно устанавливается после морфологического исследования биоптата. При удалении халязиона гистологическое исследование удаленного материала является залогом успешного лечения.
При отсутствии уверенности в диагнозе воспалительного заболевания век целесообразно воздерживаться от назначения тепловых процедур, физиотерапии или инъекций глюкокортикоидов. Все подозрительные на опухоль образования должны подвергаться биопсии с обязательным морфологическим исследованием биоптата.
Список литературы Свернуть Развернуть
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Для цитирования: Роль лучевой терапии в комбинированном лечении заболеваний органа зрения. Клиническая офтальмология. 2002;3(4):164.
The role of radiotherapy in combined treatment of eye diseases
The role of radiotherapy in combined treatment
of eye diseases
A.M. Korytova,V.N. Alexeev,
N.V. Ilyin, Yu.N. Vinogradova
Review demonstrates an important role of various types of radiotherapy (distant photon, electronic, brachytherapy) in the treatment of malignant, benign tumor of the eye and also non-neoplastic diseases of the same localization (orbital pseudotumor, endocrine ophthalmopathies, terminal aching glaucoma).
With the increase of frequency of eye tumors in the last years, tactic and methodic questions of radiotherapy of malignant tumors of different eye structures according to their histologic belonging are widely covered.
Литература
1. Алексеев В.Н., Егоров Е.А., Мартынова Е.Б. О распределении уровней внутриглазного давления в нормальной популяции // Клин. офтальмология.-2001.-Т.2/2.-с.38-40.
2. Алексеев В.Н., Мартынова Е.Б., Усачев В.В. // Всероссийский съезд офтальмологов, 7-й: Тезисы докладов. - М.-2000. - Т.1. - с.96-97.
3. Белкина Б.М., Дурнов Л.А., Голдобенко Г.В. возможности органосохранного лечения ретинобластомы у детей. // Вопр. онкологии.-1992.-T.38/9.-с.1097-1103.
4. Бессмертный А.М., Червяков А.Ю., Лобыкина Л.В. // Всероссийский съезд офтальмологов, 7-й: Тезисы докладов. - М. - 2000. - Т.1.-с.105.
5. Балмуханова А.В. Облучение перед операцией при злокачественной меланоме сосудистого тракта. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.86-88.
6. Бровкина А.Ф. Актуальные вопросы офтальмоонкологии. // Вестник офтальмол.-1997.-№1.-с.5-7.
7. Бровкина А.Ф. Болезни орбиты. // М.-Медицина.-1993.-240с.
8. Бровкина А.Ф., Вальский В.В., Зарубей Г.Д. Метастатическое поражение печени у больных с увеальной меланомой. // Вестник офтальмологии.-1998.-T.114/1.-стр.21-23.
9. Бровкина А.Ф., Зарубей Г.Д., Фишкин Ю.Г. Обоснованность использования брахитерапии при увеальных меланомах юкстапапиллярной локализации. // Вестник офтальмологии. - 1991. - T. 107/6. - с.41-43.
10. Вайнштейн Е.С., Бровкина А.Ф., Бурдянская Е.И., Зарубей Г.Д. Опухоли защитного аппарата глаза, глазного яблока и глазницы. // Клиническая рентгенорадиология.-1985.-т.5.-с.134-162.
11. Вайнштейн Е.С., Бровкина А.Ф., Фридман Ф.Е. и др. Диагностика и лечение меланом глаза и его придатков.// Метод. рекомендации.-М.-1975.
12. Вальский В.В. Крупнофракционная брахитерапия злокачественных опухолей конъюнктивы. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.98-100.
13. Вальский В.В., Гришина Е.Е. Сравнение результатов дистанционной рентгенотерапии и брахитерапии лимфопролиферативных заболеваний конъюнктивы. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.100-101.
14. Волков В.В. Варианты лечебной тактики при опухолях наружных отделов глаза. // Вестник офтальмологии. - 1991. -T. 107/4. - стр. 34-39.
15. Егоров Е.А., Бабушкин А.Э. Клапанная трабекулотомия с аутосклеральным имплантатом в хирургии глаукомы. // Вестн. офтальмол.-1988.-№1.-с.7-9.
16. Зарубей Г. Д., Будкина Г.П., Бровкина А. Ф., Дмитровская И.П., Хватова А. В. // Методы контактной бета-терапии новообразований глаза. - Тез. докладов II Всесоюз. научно-технич. симпоз. проблем развития терапевтич. pадиац. техники. - М. - 1975. - с.166-168.
17. Индейкин Е.Н. Острый приступ первичной глаукомы и его лечение. // Автореф. дис. д-ра мед. наук.-Л.-1971.-35с.
18. Индейкина Г.В. Ретробульбарные инъекции аминазина при купировании острых приступов терминальной глаукомы. // Офтальмол. журнал.-1987.-№2.-с.122-123.
19. Краснов М.М., Акопян В.С., Ильина Т.С. и др. Лазерное лечение первичной глаукомы. // Вестн. офтальмол.-1982.-№5.-с.18-22.
20. Краснов М.М., Каспаров А.А., Мусаев П.И. О результатах интрасклеральной капсулопластики в лечении глаукомы. // Вестн. офтальмол.-1984.-№4.-с.12-13.
21. Левко М.А. Глубокая склерэктомия с ангулодилатацией в лечении глаукомы. // Автореф. дис. канд. мед. наук.-С-Петербург. - 2000. - 23с.
22. Либман Е.С., Шахова Е.В. Состояние слепоты и динамика слепоты и инвалидности вследствии патологии органа зрения в России // Всероссийский съезд офтальмологов, 7-й: Тезисы докладов.-М.-2000.-с.209-215.
23. Линник Л.Ф., Магарамов Д.А., Семикова Т.С., Яровой А.А. Методика комбинированного лечения меланомы хориоидеи брахитерапией и лазерной термотерапией. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.). -М.-2001.-с.122-124.
24. Лобанов Г.В., Голдобенко Г.В. Лучевая терапия двусторонней ретинобластомы. // Офтальмол. журнал.-1998. - №1. - стр. 15-17.
25. Нестеров А.П. Глаукома.-М.-Медицина.-1995.-255с.
26. Нестеров А.П., Егоров Е.А., Батманов Ю.Е., Колесникова Л.Н. Некоторые особенности хирургии глаукомы. // Вестн. офтальмол. - 1986.-№3.-с.6-8.
27. Нестеров А.П., Колесникова Л.Н. Фистулизирующая иридоциклоретракция. // Вестн. офтальмол.-1984.-№1.-с.10-12.
28. Офтальмоонкология: Руков-во для врачей под ред. А.Ф. Бровкиной. - М. - Медицина.- 2002.-424с.
29. Пантелеева О.Г. Метастатические опухоли орбиты. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.79-80.
30. Полякова С.И., Терентьева Л.С., Вит В.В. Особенности диагностики, клиники и лечения лимфом орбиты. // Офтальмол. журнал. - 1997.-№3.-с.173-178.
31. Рябцева А.А. Комбинированная глаукома. Автореферат дис. д-ра мед. наук.-М.-1996.
32. Саакян С.В. Отдаленные результаты лечения детей с ретинобластомой при помощи неоадьювантной химиотерапии. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.140-143.
33. Ушакова Т.Л., Белкина Б.М., Поляков В.Г., Дурнов Л.А. Подходы к лечению местнораспространенной ретинобластомы у детей. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.156-158.
34. Федоров С.Н., Иоффе Д.И., Ронкина Т.И. Антиглаукоматозная операция - глубокая склерэктомия. // Вестн. офтальмол. -1 982. - №4.-с.6-10.
35. Федоров С.Н., Козлов В.И., Тимошкина Н.Т. и др. Непроникающая глубокая склерэктомия при открытоугольной глаукоме // Офтальмохирургия.-1989.-№3.-с.52-55.
36. Фрадкин М.Я., Бунин А.Я., Чернявский Г.Я.-Уч. зап. МНИИ глазных болезней им. Гельмгольца.-М.-1961.-вып.6.-с.259-260.
37. Шеина А.И. Лучевая терапия эндокринной офтальмопатии // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.189-191.
38. Anteby I., Ramu N., Gradstein L. et al. Ocular and orbital complications following the treatment of retinoblastoma. // Eur. J. Ophthalmol.-1998.-8/2.-p.106-111.
39. Arthur D.W., Zwicker R.D., Garmon P.W. et al. Electron photon matched field technique for treatment of orbital disease. // Ynt. J. Radiat. oncol. biol. phys.-1997.-37/2.-p.496-474.
40. Ascaso F.J., Cascante J.M., Castillo J.M. et.al. Simultaneous bilateral primary choroidal melanoma. // Eur. J. Ophthalmol. - 1996. - 6/1. - p.87-89.
41. Augsburger J.J., Goel S.D. Visual function following enucleation or episcretal plague radiotherapy for posterior uveal melanoma. // Arch.Ophthalmol.-1994.-112/6.-p.786-789.
42. Caccialanza M., Piccinno R., Gnecchi L. et.al. Radiotherapy of carcinomas of the eyelids. // Skin Cancer.-1998.-13/2.-p.67-72.
43. Cains J. Trabeculoectomy // Amer. J. Ophthalmol. -1968. - V.66. - p. 673-679.
44. Castro J.R., Char D.H., Petti P.L. et.al. 15 years experience with helium ion radiotherapy for uveal melanoma. // Int. J. Radiat. Oncol. Biol. Phys.-1997.-39/5.-p.989-996.
45. Char D.H., Kroll S.M., Quivey J.M., Castro J. Long term’visual outcome of radiated uveal melanomas in eyes eligible for randomisation to enucleation versus brachytherapy. // Br. J. Ophthalmol. - 1996. - 80/2. - p.117-124.
46. Coleman D.J., Silverman R.H., Ursea R. et. al. Ultrasonically induced hyperthermia for adjunctive treatment of intraocular malignant melanoma. // Retina.-1997.-p.109-117.
47. Covington E.E., Lobes L. and Sudorsanam A. Radiathion therapy for exophthalmos: report of seven cases. // Radiology. - 1977. - 122. - p.797-799.
48. Daftari I.K., Char D.H., Verhey L.J. et.al. Anterior segment sparing to reduce charged particle radiotherapy complications in uveal melanoma. // Int. J. Radiat. Oncol. Biol. Phys. - 1997. - 39/5. - p.997-1010.
49. Debois J.M., Haustrate F.M. Breast cancer and the eye. // Oncologie.-1996.-19/5.-p.385-393.
50. Donaldson S.S., Bagshaw M.A., Kriss J.D. Supervoltage orbital radiotherapy for Grave’s ophthalmopathy. // J. Clin. Endocrinol. Metab.-1973.-37.-p.276-285.
51. Esik O., Iheda H., Muhai K., Kaneko A. A retrospective analysis of different modalities for treatment of primary orbital non-Hodgkin’s lymphomas. // Radiother. Oncol.-1996.-38/1.-p.13-18/
52. Fay A.M., Leib M.L., Fountain K.S. Multiple myeloma involving the orbit. // Ophthalmic Plast. Keconstr. Surg.-1998.-14/1.-p.67-71.
53. Finger P.T., Mieler W.F. Microwave thermoradiotherapy for uveal melanoma: Results of a 10-year study. // Ophthalmology. - 1997. - 104/11. - p.1794-1803.
54. Finger P.T. Radiation therapy for choroidal melanoma. // Surv. Ophthalmol.-1997.-42/3.-p.215-232.
55. Fontanesi J., Pratt C.B., Hustu H.O., Coffey D. Use of irradiation for therapy of retinoblastoma in children more than 1 year old: the st. Jude children’s research hospital experience and review of literature. // Medical and Pediatric Oncology.- 1995.-24(5).-p.321-326.
56. Foss A.J.E., Whelehan I., Hungerford J.L. et al. Predictive factors for the development of rubeosis following proton beam radiotherapy for uveal melanoma. // Br. J. Ophtalmol.-1997.-81/9.-p.748-754.
57. Gallie B.L., Budning A., Re Boer G. et al. Chemotherapy with focal therapy can cure intraocular retinoblastoma without radiotherapy. // Arch. Ophthalmol.-1996.-114/11.-p.1321-1328.
58. Giinalp I., Batioglu F. Effect of Pre-Enucleation irradiation on the survival of patients with uveal melanoma. // Ophthalmologica. - 1998. - 212.-p.231-235.
59. Granberg-Danielsen B. Die Behandlung des glaucoms mit Megaphen. // Ophthalmologica.-1955.-130.-p.403-405.
60. Greenwald M.J., Strauss L.C. Treatment of intraocular retinoblastoma with carboplatin and etoposide chemotherapy. // Ophthalmology.-1996.-103/12.-p.1989-1997.
61. Gunalp I., Gunduz K., Ozkan M. Causes of enucleation: a clinicopathological study. // Eur.J.Ophthalmol.-1997.-7/3.-p.223-228.
62. Gunduz K., Shields J.A., Shields C.L., Eagles R.C.Jr. Cutaneous melanoma metastatic to the vitreous cavity. // Ophthalmology.-1998.-105/4.-p.600-605.
63. Kennerdell J., Maroon J.,Melton M., Warren F. The management of optic nerve sheath meningioms // Amer. J. Ophthal. - 1988. - Vol. 106/4.-p.450-457.
64. Kingston J.E., Hungerford J.L., Madreperla S.A., Plowman P.N. Results of combined chemotherapy and radiotherapy for advanced intraocular retinoblastoma.// Arch. Ophthalmol. - 1996. - 114/11. - p.1339-1343.
65. Kreissing I., Rose D., Simader E. Longterm follow-up of iodina-125 brachytherapy for choroidal melanomas. Part II: Functional results (Germ).-Jod-125-brachytherapie des malignen aderhaut - melanoms. Teil II: funktionelle langzeitergebnisse. // Klin.Monatsbl. Augenheilkd. - 1996.-209/1.-p.7-12.
66. Lagreze W.-D.A., Wesendahl T.A., Kommerell G. Enophthalmos due to metastatic breast adenocarcinoma (Germ). // Klin. Monatsbl. Augenheilkd.-1997.-211/1.-p.68-69.
67. Lam D.S., Li C.K., Cheng L.L. et al. Primary orbital Ewing’s sarcoma: report of a case and review of the literature (see comments). // Eye.-13(Pf 1).-1999.-p.38-42.
68. Lee A.G., Woo S.Y., Miller N.R. et al. Improvement in visual function in an eye with a presumed optic nerve sheath meningioma after treatment with trec-dimensional conformal radiation therapy. // J. Neuro-Ophthalmol.-1996.-16/4.-p.247-251.
69. Logani S., Cho A.S., Ali B.H. et.al. Single-dose compared with fractionated-dose radiation of the OM431 choroidal melanoma cell line. // An.J.Ophthalmol.-1995.-120/4.-p.506-510.
70. Madreperla S.A., Hungerford J.L., Doughty D. et al. Treatment of retinoblastoma vitreous base seding.// Ophthalmology. - 1998. - 105/1. - p.120-124.
71. Mannor G.E., Rose G.E., Plowman P.N. et al. Multidiaciplinary management of refractory orbital rhabdomyosarcoma. // Ophthalmology. - 1997.-104/7.-p.1198-1201.
72. Margo C.E., Mulla Z.D. Malignant tumors of the orbit: Analysis of the Florida cancer registry.// Ophthalmology. - 1998. - 105/1. -p.185-190.
73. Martin K.R., Broadway D.C. Cyclodiode laser therapy for painful, blind glaucomatous eyes. // Br.J.Ophthalmol. - 2001. - 85(4). - p.474-476.
74. Meyer A., D’Hermies F., Korobelnik J.F. et.al. Ring reccurens of ciliary body melanoma after proton-beam therapy - Recidive annulaire d»un melanoma ciliare apres photontherapie. // J.Fr.Ophtalmol. - 1997. - 20/9.-p.697-700.
75. Missoten L., Dirven W., Van der Schueren A. et al. Results of treatment of choroidal malignant melanoma with high-dose-rate strontium-90 brachytherapy. // Graefe’s Arch.Clin.Exp. Ophthalmol. - 1998. - 236/3.-p.164-173.
76. Mombaerts I., Schlingemann R.O., Goldschmeding R., Koornnef L. Are systemic corticosteroids useful in the management of orbital preudotumors? // Ophthalmology.-1996.-103/3.-p.521-528.
77. Murphree A.L., Villablanca J.G., Deegan III W.F. et al. Chemotherapy plus local treatment in the management of intraocular retinoblastoma. // Arch. Ophthalmol.-1996.-114/11.-p.1348-1356.
78. Murray T.G., Roth D.B., O’Brien J.M. et al. Local carboplatin and radiation therapy in the treatment of murine transgenic retinoblastoma.// Arch. Ophthalmol.-1996.-114/11.-p.1385-1389.
79. Norregaard J.C., Gerner N., Jensen O.A., Prause J.U. Malignant melanoma of the conjunctiva: Occurrence and survival following surgery and radiotherapy in a Danish population. // Graefe’s Arch. Clin. Exp. Ophthalmol.-1996.-234/9.-p.569-572.
80. Notis C.M., Abramson D.H., Sagerman R.H., Ellsworth R.M. Orbital rhabdomyosarcoma: Treatment or overtreatment. // Ophthalmic Genet. - 1995.-16/4.-p.159-162.
81. Quivey J.V., Augsburger J., Snelling L., Brady L.W. 125I plaque therapy for uveal melanoma: Analysis of the impact of time and dose factors on local control. // Cancer.-1996.-77/11.-p.2356-2362.
82. Rudoler S.B., Shields C.L., Corn B.W. et.al. Functional vision is improved in the majority of patients treated with external-beam radiotherapy for choroidal metastases: A multivariate analysis of 188 patients. // J.Clin.Oncol.-1997.-15/3.-p.1244-1251.
83. Sanna M. Sull’azione dellu clorpromazina (4560 RP) per via retrobulbaire in oftalmologia. // Ann di Oftalm.-1957.-83.-p.545-554.
84. Schlienger P., Brunin F., Desjardins L. et al. External radiotherapy for carcinoma of the eyelid. // Int. J. Radiat. Oncol. Biol. Phys. - 1996. - 34/2.-p.277-287.
85. Schlienger P., Desjardins L. External electron irradiation in 2 cases of capillary hemangioma of the optic disk. // Bulletin du Cancer. Radiotherapie.-1995.-82/2.-p.306-310.
86. Seregard S., Lundell G., Lax I. et.al. Tumour cell proliferation after failed ruthenium plaque radiotherapy for posterior uveal melanoma. // Asta Ophthalmol.Scand.-1997.-75/2.-p.148-154.
87. Seregard S. Posterior uweal melanoma. The swedish perspective. // Acta Ophthalmol. Scand.-1996.-74/4.-p.315-329.
88. Shields C.L. Plaque radiotherapy for the management of uveal metastasis. // Curr.Opin.Ophthalmol.-1998.-9/3.-p.31-37.
89. Shields C.L., De Potter P., Himelstein B.P. et al. Chemoreduction in the initial management of intraocular retinoblastoma. // Arch. Ophthalmol. - 1996.-114/11.-p.1330-1338
90. Shields C.L., Shields J.A., Needle M. et al. Combined chemoreduction and adjuvant treatment for intraocular retinoblastoma.// Ophthalmology. -1997.-104/12.-p.2101-2111.
91. Signh A.D., Garway-Heath D., Love S., Plowman P.N. et al. Relationship of regression pattern to recurrence in retinoblastoma.// Br. J. Ophthalmol.-1993.-V.77/1.-p.12-16.
92. Sigurdsson H., Thorisdottir S., Bjornsson J.K. Enucleation and evisceration in Iceland 1964-1992. Study in a defined population. // Acta Ophthalmol Scand.-1998.-76/1.-p.103-107.
93. Summanen P., Immonen I., Kivela T. et.al. Radiation related complications after ruthenium plaque radiotherapy of uveal melanoma. // Br.J.Ophthalm.-1996.-80/8.-p.732-739.
94. Takahashi T., Mitsuhashi N., Nagashima H. et al. Clinical experience of radiation therapy for Graves’ophthalmopathy. // Radiat. Med.med. Jmaging. Radiat. Oncol.-1996.-14/6.-p.343-347.
95. Tellado M., Specht C.S., McLean I.W. et al. Primary orbital melanomas. // Ophthalmology.-1996.-103/6.-p.929-932.
96. Welde G., Sjosrand J. A clinical study of radiation cataract formation in adult life following (-irradiation of the lens in early childhood. // Br. J. Ophthalmol.-1997.-81/4.-p.261-266.
97. Wilson W.B., Prochoda M. Radiotherapy for thyroid orbitopathy. Effects on extraocular muscle bolance. // Arch. Ophthalmol. - 1995. - 113/11. -p.1420-1425.
98. Wong E.Y., Chew P.T., Chee C.K., Wong J.S. Diode laser contact transscleral cyclophotocoagulation for refractory glaucoma in Asian patients. // Am.J.Ophthalmol.-1997.-124/6.-p.797-804.
99. Yen M.T., Tse D.T., Wu X., Wolfson A.H. Radiation therapy for local control of of eyelid carcinoma: report of two cases and review of the literature. // Opthalmic Plastic and Reconstructive Surgery. - 2000. - 16/3.-p.211-215.
100. Zografos L., Baercher L., Chamot L. et.al. Cobalt-60 treatment of choraidal hemangiomas. // Am.J.Ophthalmol. - 1996. - 121/2. - p.190-199.
101. Zografos L., Egger E., Bercher L. et.al. Proton beam irradiation of choroidal hemangiomas. // Am.J.Ophthalmol. - 1998. - 126/2. - p.261-268.
Читайте также:
- Оценка строения синуса. Оценка капсулы лимфатического узла.
- Лекарственная тромбоцитопеническая пурпура
- Лапароскопия. Показания к лапароскопии. Показания к экстренной диагностической лапароскопии. Противопоказания к лапароскопии. Абсолютные и относительные противопоказания к лапароскопии.
- Источники инфекций. Распространение инфекционных болезней
- Мукоцеле орбиты глаза: причины, диагностика, лечение
