Тенденции операций на челюсти. Структура оперативных реконструкций челюсти
Добавил пользователь Alex Обновлено: 21.01.2026
Резекция челюстей рассматривается как единственно верный метод лечения пациентов с диагнозами: амелобластома, миксома, фиброзная дисплазия и др. [1, 2].
За последние 15 лет моделирование костных трансплантатов претерпело кардинальные изменения: от проведения моделирования «на глаз» до осуществления качественного предоперационного 3D-моделирования с виртуальным планированием и учетом множества факторов. Расположение сосудистой ножки, дизайн кожной площадки, количество и ориентация линий остеотомии, расположение будущей ортопедической конструкции — это основные составляющие в реконструкции нижней челюсти с использованием малоберцового лоскута. Однако для получения оптимальных функционального и эстетического результатов повышенное внимание стоит уделить деталям [1, 3].
В настоящее время «золотым стандартом» при реконструкции челюстей с использованием костных аутотрансплантатов является планирование оперативного вмешательства по принципу «от обратного», т. е. от конечной формы и положения зубов [1—3]. Однако протокол операции проходит по традиционному принципу лишь условно, без воплощения обратного планирования в операционной, поскольку интраоперационно зубные ряды не восстанавливаются одномоментно. Тем не менее методика моделирования и шаблоны остаются все же неизменными и традиционными. Стереолитографические шаблоны не имеют в своем составе навигационных направляющих для сверления и внедрения дентальных имплантатов в правильной позиции с одномоментной установкой ортопедической конструкции еще в донорской зоне. Без ортопедической (протетической) поддержки в отдаленном периоде происходит смещение костной части пересаженного аутотрансплантата под действием мышечных тяг и других факторов. Все это влияет на позицию костной части лоскута, которая зачастую тоже смещается, что может привести к функциональным ограничениям, повторному оперативному вмешательству для коррекции положения, сложности протезирования в отдаленном периоде, а также неудовлетворительным эстетическим результатам. Традиционно процедура полной реабилитации откладывается до полной консолидации костного аутотрансплантата, затем производится дентальная имплантация с ожиданием остеоинтеграции, и только потом выполняется финальный этап протезирования. Весь этап реабилитации пациента занимает около 1 года — 1,5 лет.
Развитие дентальной имплантологии и разработка подходов с немедленной нагрузкой на имплантаты дает возможность адаптировать эти знания в реконструктивной хирургии. И ранее кажущиеся невозможными идеи о внедрении дентальных имплантатов непосредственно в кости конечностей сейчас не являются авантюрными [4, 5].
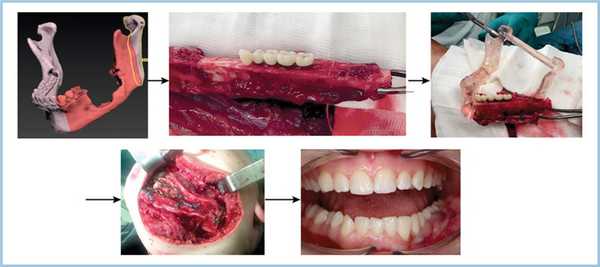
На данный момент точность методов компьютерного моделирования с использованием реваскуляризированной малоберцовой кости достаточна для осуществления одновременного междисциплинарного подхода и выполнения операции с высокой прецизионностью [10—13]. Метод заключается в одномоментном удалении новообразования в области верхней или нижней челюсти, подъеме малоберцового лоскута на сосудистой ножке, моделировании костной части, внедрении дентальных имплантатов, установке протетической конструкции, фиксации сложносоставного лоскута в реципиентную зону с введением протетической конструкции в прикус, а также микрохирургической реконструкции нижнелуночкового нерва (рис. 1). Рис. 1. Последовательность этапов субтотальной реконструкции нижней челюсти.
В настоящей статье представлен первый авторский хирургический опыт разработки модифицированного симультанного подхода в устранении обширных дефектов челюсти с одномоментной зубочелюстной реабилитацией.
Цель настоящего исследования — модернизация виртуального планирования и хирургического вмешательства для проведения одномоментной полной реабилитации пациентов, имеющих доброкачественные новообразования или дефекты в области челюсти.
Материал и методы
В период с августа 2018 г. по 2019 г. были прооперированы 4 пациента в возрасте от 17 лет до 41 года с доброкачественными образованиями (миксома, амелобластома) и дефектами (тотальный, односторонний) нижней челюсти. Во всех случаях был применен комплексный модифицированный подход с полной зубочелюстной реабилитацией. Отдаленные сроки наблюдения составили 1 год 2 мес.
Протокол предоперационного планирования включал:
— КТ-ангиографию головы и шеи, а также донорской зоны;
— фотопротокол: естественное положение головы, внутриротовая съемка;
— получение сканированных моделей зубов в формате STL и сопоставление с рентгеновским отображением зубного ряда;
— проведение 3D-реконструкции с виртуальным моделированием малоберцовой кости, проектирование шаблонов для остеотомий и имплантации (Amira viewer), моделирование протетической конструкции;
— применение методов стереолитографической 3D-печати и CAD-CAM-технологий для производства индивидуально смоделированных шаблонов и искусственных зубов.
Для операции использовали операционный микроскоп OPMI VARIO NC33 («Carl Zeiss», Германия), компьютерный томограф New Tom 3G, программное обеспечение Amira Software, дентальные имплантаты Astra tech implant system, набор микрохирургических инструментов, фиксирующие титановые мини-, микропластины и винты; имплантологическую портативную хирургическую установку ImplantMed, олигоэфирметилакрилат (материал интраоперационного шаблона).
Операция выполнялась 2 бригадами и состояла из следующих этапов:
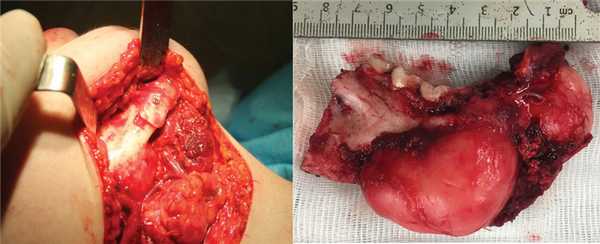
1. Резекция тела и ветви нижней челюсти слева, формирование воспринимающего ложа (рис. 2);
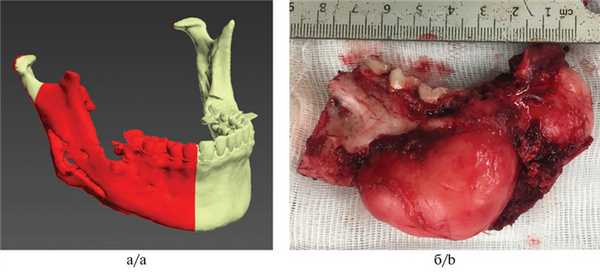
Рис. 2. Проектирование резекционных шаблонов (а) и резецированный фрагмент — миксома нижней челюсти (б).
2. Выделение реципиентных сосудов;
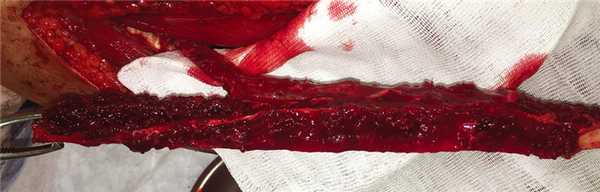
3. Подъем лоскута с включением малоберцовой кости (рис. 3); Рис. 3. Малоберцовый аутотрансплантат на питающей ножке (малоберцовые артерия и вены).
4. Моделирование костной части аутотрансплантата с одномоментным внедрением дентальных имплантатов (рис. 4); Рис. 4. Остеотомия малоберцового трансплантата (а), дентальная имплантация в зубосодержащий фрагмент (б).
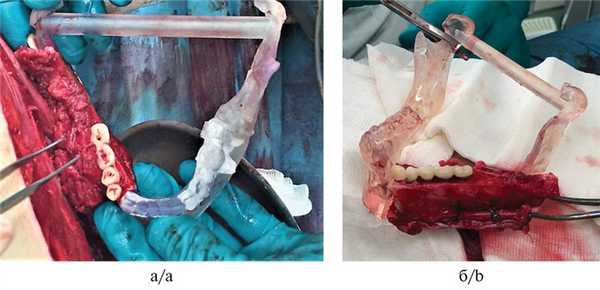
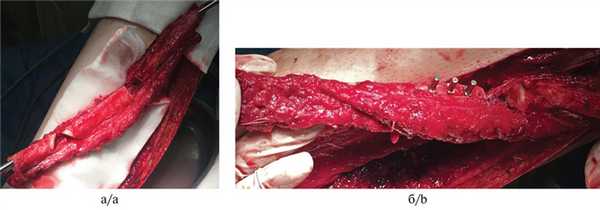
5. Фиксация временных искусственных зубов с опорой на дентальные имплантаты (рис. 5); Рис. 5. Временная конструкция с опорой на дентальные имплантаты в области голени.
6. Аноксия аутотрансплантата. Фиксация аутотрансплантата в реципиентную область с введением искусственных зубов в прикус (рис. 6); Рис. 6. Внутриротовая съемка. а — интраоперационно; б — через 4 сут после операции.
7. Реваскуляризация аутотрансплантата в реципиентной зоне;
8. Гемостаз, ушивание и дренирование ран.
В послеоперационном периоде выполнялась стандартная инфузионная, антиагрегантная, антибактериальная терапия.
Для поддержки окклюзии применялось ношение резиновых тяг средней силы.
Результаты и выводы
В настоящей работе описано применение принципиально нового подхода в планировании реконструкции дефектов челюстей, который заключается в создании нового протокола одноэтапной реабилитации пациентов с одномоментным устранением дефектов костей лицевого скелета при помощи реваскуляризированного малоберцового аутотрансплантата после резекций по поводу опухолевидных образований, травматических повреждений, выраженных атрофий альвеолярного отростка.
Представлены первые случаи реконструкции с полным восстановлением утраченных структур и немедленной установкой протезной конструкции по авторской методике.
Для наглядности приводятся клинические случаи.
Клинический случай № 1
Пациентка Б., 18 лет, поступила с диагнозом: амелобластома нижней челюсти слева (плексиморфная форма) (рис. 7). Рис. 7. Пациентка Б. (18 лет) до операции. а — внешний вид; б — внутриротовая съемка. План операции включал проведение тщательного планирования, интраоперационное удаление новообразования, подъем и моделирование реваскуляризированной малой берцовой кости с внедрением в зубосодержащий фрагмент дентальных имплантатов и протезной конструкции. Пациентке был выполнен забор фрагмента икроножного нерва. После аноксии лоскута аутотрансплантат фиксировался в реципиентной области с установкой зубов в окклюзию и осуществлялась реваскуляризация трансплантата через сосуды шеи (рис. 8). Рис. 8. Этапы реконструкции субтотального дефекта нижней челюсти пациентки Б. (18 лет).
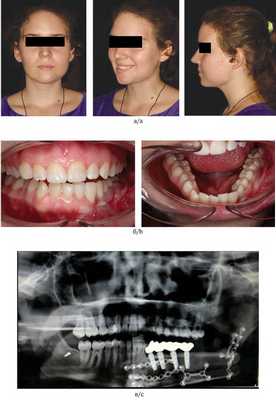
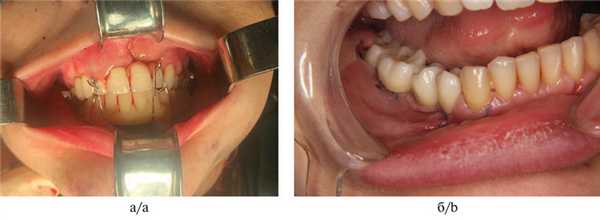
Пациентка Б. была эстетически и функционально реабилитирована с полным восстановлением зубочелюстной системы и чувствительности по ходу нижнелуночкового нерва (рис. 9). Рис. 9. Результат комплексного лечения пациентки Б. (18 лет) через 8 мес. а — внешний вид; б — внутриротовая съемка; в — рентгенография. Срок наблюдения составил 8 мес.
Клинический случай № 2
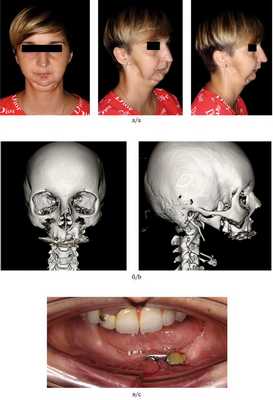
Пациентка Б., 34 лет. Диагноз: тотальный дефект нижней челюсти, декомпенсированная форма сонного апноэ за счет отсутствия поддержки мягких тканей в виде нижней челюсти (рис. 10). Рис. 10. Пациентка Б. (34 лет) до операции. а — внешний вид; б — КТ-ангиография; в — внутриротовая съемка.
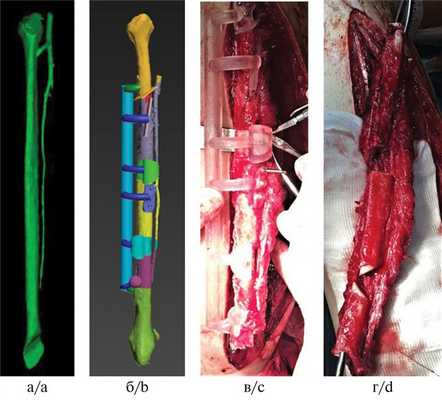
Было принято решение о хирургическом вмешательстве — тотальной реконструкции нижней челюсти. В качестве донорской зоны выбрали малоберцовый аутотрансплантат. Было выполнено предоперационное виртуальное 3D-планирование с применением метода «симультанного обратного планирования». На рис. 11 и 12 представлены момент предоперационного планирования и его интраоперационная хирургическая реализация.
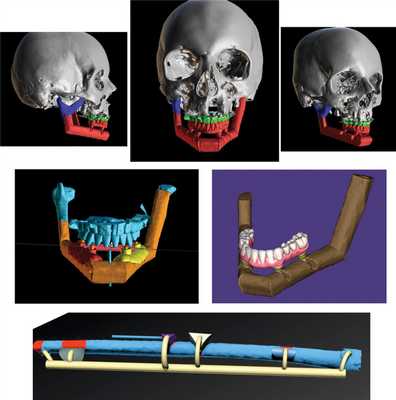
Рис. 11. Этапы 3D-моделирования тотального дефекта нижней челюсти пациентки Б. (34 лет).
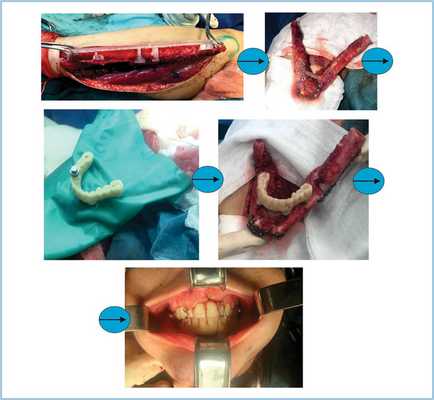
Рис. 12. Этапы осуществления плана операции у пациентки Б. (34 лет).
В настоящее время пациентка находится на динамическом наблюдении, ей назначены коррекция и стабилизация прикуса при помощи резиновых тяг (сроки наблюдения 1,5 мес).
Клинический случай № 3
Пациентка Д., 24 лет. Диагноз: миксома нижней челюсти справа.
После врачебного консилиума было принято решение об одномоментном удалении новообразования с полным одновременным восстановлением всех функций (рис. 13, 14). Рис. 14. КТ нижней челюсти пациентки Д. с гипо- и анэхогенными участками в области угла слева. Рис. 13. Пациентка Д. до оперативного вмешательства. а — фотографии лица в естественном положении; б — внутриротовая съемка в привычной окклюзии.
Были проведены предоперационное планирование и компьютерное 3D-моделирование, в ходе которых выполнили:
— определение границ резекции (рис. 14);
— виртуальное удаление новообразования с помощью шаблонов для резекции (рис. 15); Рис. 15. Проектирование резекционных шаблонов.

— моделирование малоберцового аутотрансплантата по типу «двустволки» для воссоздания высоты нижней челюсти, без ступеньки, с планированием установки 3 дентальных имплантатов (рис. 16); Рис. 16. 3D-реконструкция нижней челюсти пациентки Д. слева. а — вид сбоку слева; б — вид сверху.
— выбор трансплантата, изучение анатомических особенностей и будущего положения сосудистой ножки, проектирование шаблона для остеотомий и выполнения дентальной имплантации на малой берцовой кости (рис. 17); Рис. 17. КТ-ангиография голени пациентки Д. с визуализацией донорского участка (а, б), шаблон для выполнения остеотомий и дентальной имплантации (в, г).

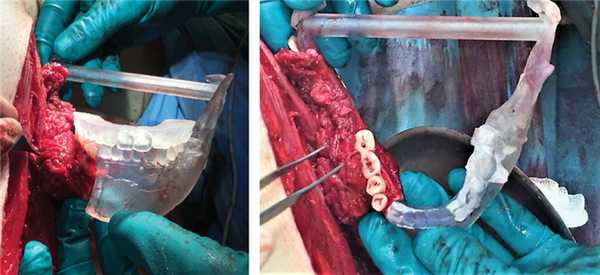
— 3D-проектирование шаблона для выполнения моделирования и дентальной имплантации, резекционного шаблона и зубного протеза из диоксида циркония с опорой на дентальные имплантаты (рис. 18). Рис. 18. Стереолитографические модели для выполнения операции.
В результате компьютерного моделирования получили шаблон для выполнения моделирования и дентальной имплантации, резекционные шаблоны и зубной протез с опорой на дентальные имплантаты. Операция состояла из ряда этапов:
— этап 1: резекция тела и ветви нижней челюсти слева, формирование воспринимающего ложа (рис. 19); Рис. 19. Резекция нижней челюсти пациентки Д.
— этап 2: моделирование костной части аутотрансплантата (рис. 20); Рис. 20. Пошаговое моделирование аутотрансплантата. а, б — компьютерное моделирование; б, в — интраоперационно.
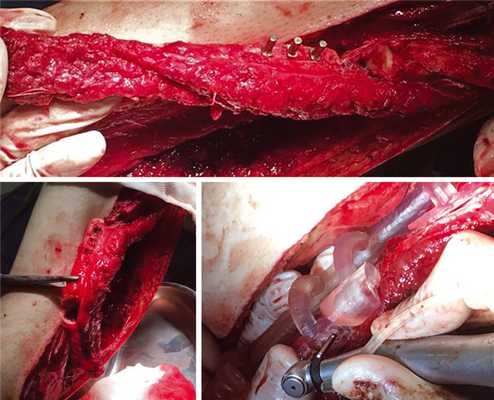
— этап 3: дентальная имплантация в фрагмент малоберцового трансплантата (рис. 21); Рис. 21. Дентальная имплантация в области голени.
— этап 4: установка протетической конструкции (рис. 22). Рис. 22. Припасование аутотрансплантата к моделям.
Далее пациентке были осуществлены аноксия и перенос аутотрансплантата в реципиентную зону с фиксацией его с помощью титановых мини-винтов и мини-пластин и реваскуляризацией.
Заключение
Модернизируя виртуальное планирование и протокол хирургического вмешательства, мы имеем возможность на сегодняшний день проводить одномоментную полную реабилитацию пациентов, имеющих доброкачественные новообразования или дефекты в области челюстей. Комплексный симультанный подход позволяет уменьшить сроки полной зубочелюстной реабилитации и улучшить качество жизни пациентов за счет полного излечения их от основного заболевания, улучшения внешнего вида и стабилизации прикуса.
Реконструкция ВНЧС аллопластическим протезом (анализ 4 клинических случаев)
Повреждения анатомических структур височно-нижнечелюстного сустава (ВНЧС) могут возникнуть в результате травмы, неопластического поражения, резорбции или анкилоза, которые, таким образом, аргументируют потребность в хирургическом вмешательстве, направленном на удаление пораженных тканей и реконструкцию сустава. Последняя манипуляция может проводиться с целью улучшения формы и функции нижней челюсти, уменьшения болевых ощущений и восстановления пораженной области, с целью реализации оптимального подхода к реабилитации в диапазоне обоснованных финансовых затрат, а также для профилактики возможных осложнений.
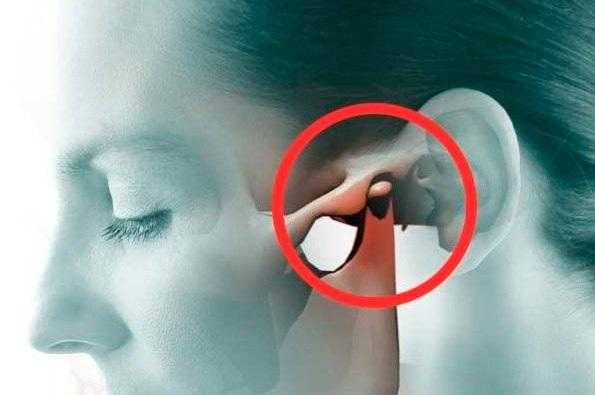
Тотальная реконструкция ВНЧС с использованием аллопластических материалов является вариантом лечения, направленным на восстановление анатомически и патологически скомпрометированных клинических случаев. Для реализации данной процедуры доступны такие хирургические системы как TMJ Concepts (Вентура, Калифорния, США), TMJ Implants (Golden, CO, США) и Biomet (Джексонвиль, Флорида, США). В отличие от индивидуально спроектированного протеза по типу TMJ Concepts, Biomet представляет собой стандартизированную систему, состоящую из двух компонентов: суставной ямки и компонентов нижней челюсти, которые доступны в нескольких размерах. Используя шаблоны, хирурги могут выбирать компоненты подходящего размера прямо во время операции. Стандартные протезы характеризуются более низкой стоимостью, обеспечивая еще и сокращение общего времени лечения, а также являются более универсальными в использовании. В последнее время значительно возросло использование именно аллопластической системы TMJ (Biomet), которая, по данным проведенных клинических исследований, демонстрирует стабильные и удовлетворительные результаты.
В данной статье представлены результаты лечения четырех пациентов, которым провели реконструкцию ВНЧС посредством системы Biomet в случаях травмы, опухоли, резорбции и анкилоза височно-нижнечелюстного сустава.
Клинический случай 1
52-летний мужчина обратился за помощью по причине нарушения прикуса после кондилэктомии. Он упал вниз по лестнице и сломал нижнюю челюсть в области шейки суставного отростка. В больнице ему провели открытую редукцию поврежденной области с фиксацией частей сустава. После операции произошло инфицирование области правого ВНЧС, из-за чего пришлось провести удаление суставного отростка. Через месяц после оперативного вмешательства он обратился за помощью в стоматологическую клинику Университета Йонсей. В состояние покоя его нижняя челюсть была смещена вправо, а окклюзионное соотношение челюстей было нарушено вследствие кондилэктомии (фото 1а).
Фото 1.
а) Смещение нижней челюсти вправо (зеленая линия) в результате кондилэктомии (желтый круг).
b) Панорамная рентгенограмма, полученная через 1 день после операции, продемонстрировала восстановление окклюзионного соотношения (зеленая линия). Для стабилизации окклюзии во время операции были использованы межчелюстные фиксационные винты.
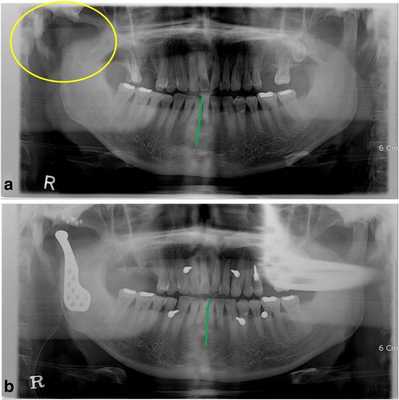
Диапазон раскрытия рта был ограничен расстоянием в 30 мм. После назначения пероральных антибиотиков с целью обеспечения инфекционного контроля была запланирована операция по реконструкции правого ВНЧС с использованием суставного протеза. Во время операции хирурги обеспечивали стабилизацию окклюзии путем межчелюстной фиксации для восстановления первоначального соотношения верхней и нижней челюстей. Установку суставного протеза проводили через два разреза: один - в околоушной области, другой - в подчелюстной по Risdon. Панорамная рентгенограмма, полученная через день после операции, подтвердила восстановление нормального окклюзионного соотношения (фото 1b). Через 3 дня пациента выписали без каких-либо осложнений послеоперационных осложнений, обеспечивая наблюдение на протяжении одного года. Протез функционировал достаточно хорошо, а восстановленная окклюзия оставалась стабильной, хотя максимальное открытие полости рта так и не удалось увеличить более чем до 30 мм.
Клинический случай 2
34-летнему мужчине был поставлен диагноз аденоидной кистозной карциномы правого внешнего слухового канала. Ему была проведена операция по удалению карциномы с кондилэктомией правого суставного отростка в отделении отоларингологии (фото 2а). После операции окклюзия стабилизировалась посредством межчелюстных фиксационных винтов и эластичных лент. Ограничений при открытии рта у данного пациента не наблюдалось, однако при открытии рта наблюдалось смещение челюсти в правую сторону. Для поддержки стабильной окклюзии без использования фиксационных межчелюстных винтов через 8 месяцев после первичного вмешательства планировалось провести реконструкцию ВНЧС. После хирургической коррекции сустава межчелюстные винты были удалены, а у пациента было подтверждено стабильное состояние межчелюстного соотношения (фото 2b).
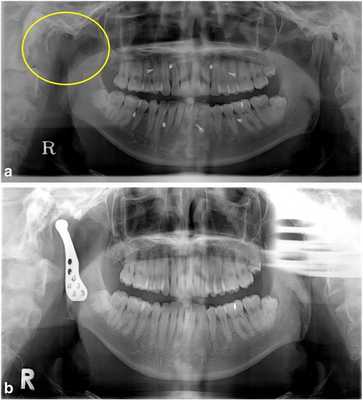
Фото 2.
а) Правый мыщелок был удален (желтый круг) из-за карциномы наружного слухового канала. Для поддержания окклюзии в течение 8 месяцев использовались межчелюстные фиксационные винты и эластичные ленты.
b) Через 1 месяц после реконструкции TMJ фиксационные винты были удалены, а окклюзия оставалась в стабильном состоянии.
Через три месяца в области вмешательства появились болевые ощущения и развилась небольшая припухлость. Несмотря на использование антибиотиков и НПВП, симптомы продолжали сохранятся. Была проведена компьютерная томография (КТ) интересующей области, однако из-за имеющихся артефактов, спровоцированных металлическим протезом, никаких нарушений обнаружить не удалось. Спустя четыре месяца магнитно-резонансная томография (МРТ) помогла диагностировать рецидив опухоли вдоль височной мышцы. В ходе дополнительных операций были удалены и опухоль, и протез, однако у пациента продолжают проявляться рецидивы неопластического поражения в височной области и на участке правого ВНЧС.
Клинический случай 3
53-летняя женщина с ревматоидным артритом руки, запястья и плеча, обратилась за помощью по причине болевых ощущений в обоих ВНЧС. Она страдала от ревматоидного артрита в течение 1 года и принимала противовоспалительные препараты. КТ-диагностика подтвердила ревматоидное поражение обоих ВНЧС (фото 3а). У пациентки отмечалось ограниченное открывание полости рта (максимально до 23 мм), а болевые ощущения усиливались при движениях нижней челюсти. Для облегчения болевых симптомов было начато изготовление шины и проведен артроцентез обоих ВНЧС. Симптомы улучшились, однако у пациентки медленно начал развиваться передний прикус. Вертикальное перекрытие изменилось от начальных -6 мм до 0 мм (фото 3b).
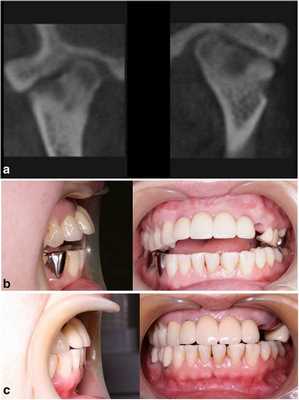
Фото 3.
а) КТ-срезы, демонстрирующие сплющивание суставных головок, нерегулярность суставной поверхности и сужение суставных пространств.
b) Передний открытый прикус, который раздвинулся во время лечения с использованием шины.
с) Закрытие переднего открытого прикуса без прогрессирования нарушения в будущем.
Чтобы предотвратить прогрессирование патологии, была запланирована реконструкция ВНЧС. Во время операции было выполнено заднее перемещение верхней челюсти посредством остеотомии по Le Fort I, поскольку верхние передние зубы пациентки находились в состоянии протрузии. После резекции обоих мыщелков реконструкция ВНЧС с использованием протеза проводилась посредством вращения нижней челюсти против часовой стрелки для закрытия переднего открытого укуса (фото 3с). С момента операции на данный момент прошло уже 2 года, и в данный период не было отмечено никаких признаков воспалительного поражения области вмешательства. Симптомов прогрессирования открытого прикуса также не наблюдалось.
Клинический случай 4
41-летний мужчина, страдающий анкилозирующим спондилитом с 31-летнего возраста, обратился за помощью по причине болевых ощущений в области правого ВНЧС и ограниченного открывания рта (до 25 мм), при котором также наблюдалось отклонение нижней челюсти вправо. В ходе анализа КТ-изображений был заподозрен анкилоз правого ВНЧС, вторичный по отношению к анкилозирующему спондилиту (фото 4).
Фото 4. Корональный КТ-срез, демонстрирующий анкилоз правого ВНЧС.
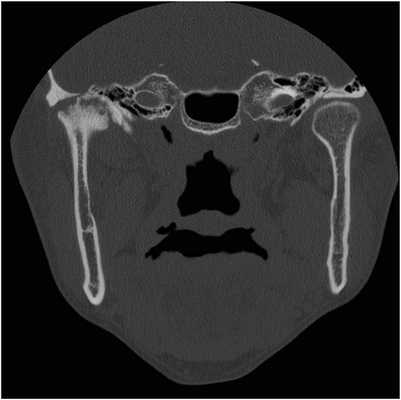
Для профилактики повторного анкилоза ВНЧС была запланирована реконструкция сустава. Во время операции удалили волокнистую ткань и анкилозированный суставной отросток, обрезали суставную ямку и провели установку протеза. Спустя три месяца после операции открывание рта увеличилось до 36 мм, но челюсть при этом все еще продолжала отклонятся в правую сторону. Ни симптомов воспаления, ни признаков гетеротопического формирования костной ткани в области правого ВНЧС в течение последующего года не отмечалось. Пациент находился под периодическим наблюдением с учетом риска развития анкилоза вокруг установленного протеза, а также вероятности появления патологического очага с левой стороны челюсти из-за анкилозирующего спондилита.
Реконструкция ВНЧС с использованием аллопластических протезов показана в случаях специфического поражения и при патологиях, которые провоцируют необоротное повреждение суставов. В данной статье представлен анализ четырех случаев реконструкции ВНЧС при различных патологиях.
В клиническом случае 1 пациент перенес травму, и после хирургического вмешательства с целью фиксации элементов зубочелюстного аппарата у него произошло инфицирование области вмешательства. Данный факт стал причиной проведения кондилэктомии. Перед установкой протеза обеспечили необходимое фоновый прием антибиотиков, что помогло снизить риск инфицирования участка операции, а значит - повысило успешность проводимых хирургических процедур. Основной жалобой пациента в данном случае было нарушение прикуса после кондилэктомии. Благодаря реконструкции ВНЧС, удалось восстановить нужное межоклюзионное соотношение, хотя открытие рта так и осталось ограниченным. Возможно, такой исход был спровоцирован инфицированием области вмешательства после первичной кондилэктомии.
В клиническом случае 2 ВНЧС был резецирован по причине карциномы наружного слухового прохода. Хотя реконструктивная хирургия сустава и прошла успешно, пациент продолжал страдать от рецидивов опухоли. Из-за металлических артефактов врачу не удалось провести первичную диагностику рецидива опухоли с помощью КТ.
Аллопластический протез является вариантом восстановления ВНЧС после резекции опухоли в смежных областях, но он не подходит пациентам, которым может понадобиться повторное проведение КТ или МРТ для диагностики дальнейших патологических изменений. Тяжелое воспалительное заболевание суставов является еще одним показателем для восстановления сустава с использованием аллопластических материалов.
В клиническом случае 3 тяжелое воспаление ВНЧС вызвало резорбцию суставов на фоне ревматоидного артрита. Планировалось, что аллопластическая реконструкция ВНЧС прекратит прогрессирование заболевания, которое усугубилось и проявилось в виде переднего открытого прикуса. Проведенные ранее исследования указывают на то, что аллопластическая реконструкция ВНЧС при тяжелых воспалительных заболеваниях суставов демонстрирует весьма успешные и прогнозируемые результаты реабилитации. Ротация нижней челюсти против часовой стрелки считается дестабилизирующим фактором в ортогенетической хирургии, однако, использование протеза помогает достичь стабилизации функции суставов с минимальным риском рецидива. В ходе двухгодичного мониторинга у пациента не отмечалось никаких признаков повторного поражения. Анкилоз ВНЧС также является одним из показаний для проведения реконструкции сустава, особенно у пациентов с рецидивирующим фиброзом и костным анкилозом.
В клиническом случае 4, учитывая наличие фоновой патологии англизирующего спондилоартрита, риск повторного анкилоза ВНЧС после артропластики оставался достаточно высоким. После тотальной реконструкции сустава удалось восстановить прежний диапазон открывания рта, но челюсть пациента при этом продолжала отклонятся в пораженную сторону. В отличие от естественного сустава, который функционирует как в ротационном, так и в трансляционном направлениях, протез может функционировать только по вращательной траектории из-за потери прикрепления боковой крыловидной мышцы.
Выводы
Реконструкция ВНЧС посредством аллопластического протеза показана при специфических поражениях и патологиях сустава, которые провоцируют необратимое изменение их структуры. При адекватном планировании хирургического вмешательства и понимании функциональных ограничений суставных протезов, аллопластический аналог ВНЧС является безопасным и эффективным вариантом реабилитации комплексной функции зубочелюстного аппарата.
Реконструкция верхней челюсти
Восстановление формы и функции верхней челюсти собственными тканями.
Чаще всего реконструкция верхней челюсти выполняется после резекции опухоли твёрдого нёба, носа, гайморовой пазухи и других опухолей, распространившихся на верхнюю челюсть. Намного реже реконструкция связана с травмами или врождёнными аномалиями.
Анатомия верхней челюсти
Верхняя челюсть - парная кость, располагается в центре лицевого скелета.
Верхняя челюсть участвует в жевательном процессе, в образовании полости носа, полости рта, глазниц, имеет сложную форму:
Через подглазничные отверстия выходят кровеносные сосуды и подглазничный нерв, отвечающий за чувствительность зубов верхней челюсти, кожи и слизистой оболочки рта, носа.
Верхняя челюсть отделяет полость рта от полости носа:
Варианты резекции верхней челюсти
В зависимости от локализации и размера опухоли выделяют 6 классов резекции в вертикальной плоскости (I-VI) и 4 класса - в горизонтальной плоскости (a-d):
Если не выполнять реконструкцию, то пациент столкнётся с рядом проблем:
- Асимметрия лица - без костной поддержки мягкие ткани проваливаются внутрь;
- Асимметрия положения глаз - при III и IV классе резекции глазное яблоко теряет опорность, проваливается внутрь и вниз;
- Трудности разговора и приёма пищи - между полостью рта и полостью носа после резекции может возникнуть сквозное отверстие, из-за которого голос становится гнусавым, а пища попадает из полости рта в полость носа.
В некоторых случаях реконструкция необходима по жизненным показаниям. Например, когда после операции остаются открытые кровеносные сосуды.
Варианты реконструкции верхней челюсти разными лоскутами. A - малоберцовый/лучевой лоскут, B - лопаточный лоскут, C - лоскут гребня подвздошной кости. Изображение: ©Lancet Oncol 2010; 11: 1001-08
Реконструкция может быть выполнена одновременно с резекцией опухоли верхней челюсти. Реконструктивный этап длится 8 часов.
Суть реконструкции - забираем кожно-костно-мышечный лоскут в одном месте и пересаживаем в другое. При этом возникают две проблемы:
- Откуда и как забрать лоскут;
- Как обеспечить питание пересаженного лоскута.
Для реконструкции верхней челюсти используются лоскуты с ноги, руки, лопатки или тазовой кости:
Тенденции операций на челюсти. Структура оперативных реконструкций челюсти
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
Способ замещения дефекта нижней челюсти с применением индивидуального комбинированного эндопротеза
Замещение дефектов нижней челюсти, возникающих в результате травм и воспалительных заболеваний кости, а также оперативных вмешательств по поводу опухолевых процессов, составляет важную медицинскую и научную проблему. В настоящей работе показаны результаты хирургического лечения 8 пациентов с применением комбинированного эндопротеза нижней челюсти, состоящего из индивидуальной титановой металлоконструкции и «титанового шелка». Данное решение обеспечивает возможность надежной фиксации мягкотканных структур нижней трети лица путем их подшивания, в том числе мимических и жевательных мышц, улучшая биологическую интеграцию эндопротеза. Комбинированная конструкция показала высокую эффективность восстановления как эстетических, так и функциональных характеристик нижней челюсти, а также хороший уровень «выживаемости» эндопротезов в отдаленном периоде наблюдения.
Нижняя челюсть является опорным органом, к которому крепится веер жевательной мускулатуры, участвующий в формировании диафрагмы ротовой полости, и единственной костью, имеющей в своем составе мощный сосудисто-нервный пучок. Указанному органу присуще участие в сложнейшем комплексе биомеханической деятельности, которая обеспечивает функцию жевания, глотания, а также речевой артикуляции [1, 2].
Этиологическими причинами, приводящими к дефектам нижней челюсти, служат тяжелые техногенные травмы, опухолевые процессы твердых и мягких тканей, а также применение ряда химиопрепаратов, приводящих к нарушению структуры костной ткани [1, 3—6].
Следует отметить, что, по данным разных авторов, подобная категория больных достигает 20% от общего числа лиц с челюстно-лицевой патологией, особенно в онкологии и при устранении обширных посттравматических дефектов и деформаций [7, 8].
Помимо анатомических пропорций нижней зоны лица, указанные дефекты нарушают функции жевания, речи, а также отрицательно влияют на психоэмоциональное состояние пациента [9, 10].
Реконструктивные операции должны заменять опорные элементы скелета, восстанавливать структуру и функциональные свойства мягких тканей, устранять свищи и обеспечивать возможность восстановления зубного ряда. Изогнутая горизонтальная опора, или дуга, нижней челюсти должна обеспечивать внедрение зубных имплантатов, служить для поддержки дна полости рта, создавая опору для мышц языка и мышц дна полости рта, обеспечивая таким образом жевание, артикуляцию, глотание и дыхание. Таким образом, реконструктивная хирургия нижней челюсти должна предвидеть необходимость дальнейшей функциональной реабилитации, которая принимает не только медицинский, но и социальный характер.
Цель исследования — разработка способа замещения дефекта нижней челюсти с применением индивидуального комбинированного эндопротеза нижней челюсти, состоящего из титановой металлоконструкции с модифицированным покрытием из диоксида титана (Анатаз) и «титанового шелка».
Исследование выполнено на базе отделения челюстно-лицевой хирургии Университетской клинической больницы № 4 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет) в период с 2013 по 2018 г. В представленной публикации обобщен опыт применения комбинированного индивидуального эндопротеза, состоящего из титановой металлоконструкции с модифицированным покрытием из диоксида титана (Анатаз) и «титанового шелка».
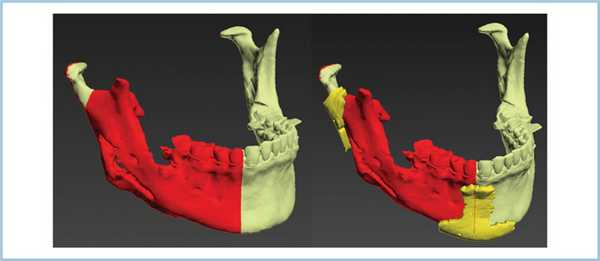
Среди прооперированных было 6 женщин и 2 мужчин, их средний возраст составил 45,9±7,1 года (от 35 до 56 лет). Распределение приобретенных дефектов нижней челюсти по этиологии было следующим: дефекты вследствие хирургического лечения амелобластомы — у 4 пациентов; дефект тела и ветви нижней челюсти (состояние после секвестрнекрэктомии при посттравматическом остеомиелите) — у 2; медикамент-ассоциированный остеонекроз нижней челюсти — у 2.
Следует отметить, что изучение качества жизни (КЖ) пациентов с указанной патологией, на наш взгляд, является актуальной и неотъемлемой составляющей на различных этапах реабилитации. С этой целью мы применяли опросник SF-36 (Medical Outcomes Study Short-Form 36) — наиболее распространенное стандартизованное средство для изучения КЖ в популяции, позволяющее оценить различные составляющие жизни пациента в условиях заболевания [11].

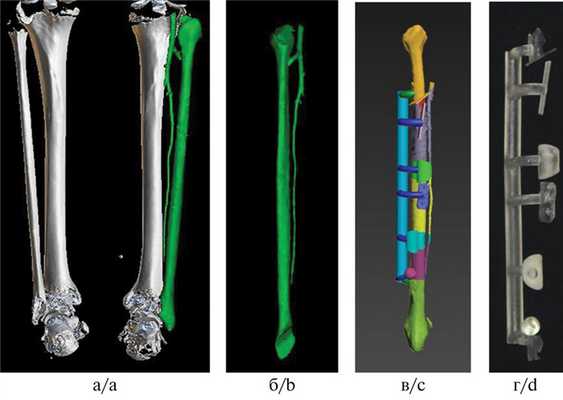
Для создания индивидуальной конструкции нами был использован алгоритм, который включал следующие этапы: 1) выполнение мультиспирального компьютерно-томографического (МСКТ) сканирования с шагом среза 0,5 мм; 2) обработка данных МСКТ и построение виртуальной 3D-модели нижней челюсти; 3) распечатка пластмассовой стереолитографической модели нижней челюсти в натуральную величину для оценки степени поражения и определения объема резекции; 4) создание цифровой модели имплантата (эндопротеза); 5) изготовление окончательной металлоконструкции. В результате получали индивидуальный титановый эндопротез, максимально близкий (идентичный) по своей анатомической форме и размерам утраченному фрагменту нижней челюсти или части нижней челюсти (рис. 1). Рис. 1. 3-D-моделирование (а) и стереолитографическая модель нижней челюсти с предполагаемыми границами резекции и фиксированным индивидуальным эндопротезом (б).
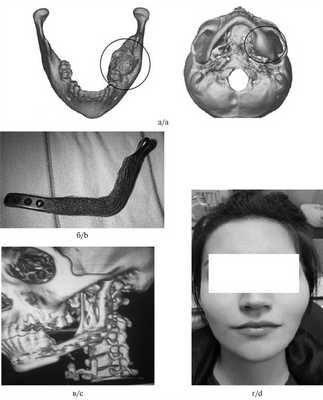
Техника операции. Все операции выполняли с применением классического внеротового доступа со скелетированием необходимого участка тела и ветви челюсти. Интраоперационно эндопротез нижней челюсти плотно оборачивали «титановым шелком», который дополнительно фиксировали нерезорбируемым шовным материалом [12]. В область дефекта нижней челюсти устанавливали комбинированный эндопротез и фиксировали с помощью винтов к дистальному и проксимальному концам челюсти. Жевательные мышцы послойно укладывали и подшивали к сформированному рукаву из «титанового шелка», восстанавливая их анатомическую целостность. Операционную рану послойно ушивали (рис. 2). Рис. 2. Результаты лечения пациентки А., 28 лет. Fig. 2. The results of treatment of рatient A., 28 years old. а — данные компьютерной томографии при оценке новообразования нижней челюсти (амелобластома); б — рукав из «титанового шелка», размещенный на поверхности эндопротеза, для фиксации жевательной мускулатуры к искомым анатомическим областям; в — данные МСКТ после операции: достигнуты надежная первичная фиксация имплантата, восстановление анатомической целостности нижней челюсти; г — состояние пациентки через 4 года после операции.
Результаты и обсуждение
В раннем послеоперационном периоде мы отмечали типичные последствия подобных хирургических вмешательств в виде эстетических нарушений, характеризующихся опущением угла рта, гиперсаливацией, затруднением приема пищи, речевыми нарушениями. Пациентов выписывали на 12—14-е сутки в удовлетворительном состоянии с явлениями остаточного послеоперационного отека мягких тканей. При повторных осмотрах отмечены сохранение симметричности и амплитуды движений нижней челюсти, а также анатомически правильная фиксация жевательных мышц. При внешнем и внутриротовом осмотре отмечается удовлетворительное состояние тканей вокруг имплантата, в том числе отсутствие признаков воспаления и прорезания. Наблюдается хорошая амплитуда движений нижней челюсти. Все прооперированные пациенты находятся под динамическим контролем, среди них 2 со сроком наблюдения 4,5 года. Хороший эффект в отношении функционального состояния жевательного аппарата отмечают большинство пациентов.
История вопроса эндопротезирования нижней челюсти насчитывает несколько столетий и проистекает с этапов использования нержавеющей стали, целлюлозы и даже слоновой кости [13, 14]. В настоящее время данные материалы имеют лишь историческое значение, так как с середины ХХ века в качестве основного аллопластического материала для изготовления металлоконструкций для нижней челюсти прочно вошли титановые сплавы [15, 16]. В настоящее время не возникает сомнения, что использование эндопротезов из металлов и некоторых полимеров обладает рядом существенных преимуществ [17, 18]. Тем не менее в современной клинической практике находят применение и альтернативные методики — ауто-, алло- и ксенопластика костной тканью [19].
Известно, что реконструктивные операции с применением ауто- и аллокости при относительных преимуществах имеют и ряд недостатков. Во-первых, для аллотрансплантатов — отсутствие централизованного банка костных тканей. Во-вторых, для аутотрансплантатов — необходимость проведения дополнительной операции, трудности замещения обширных дефектов из-за ограниченности размеров донорского участка. И наконец, риск развития тканевой несовместимости или ВИЧ-инфицирования [19].
В последнее десятилетие для замещения дефекта лицевых костей, в частности нижней челюсти, все чаще применяются индивидуально изготовленные эндопротезы, созданные на основе 3D-моделирования и 3D-печати. Имплантаты, созданные путем аддитивных технологий, обеспечивают высокую точность повторения анатомической формы замещаемых тканей конкретного пациента и хорошие результаты в послеоперационном периоде и на протяжении ближайших 2—7 лет. В связи с этим они несут возможность восстановления сложной анатомической структуры, прочности органа, биологической инертности [20].
Тем не менее следует понимать, что дальнейшее сохранение остеокондуктивной функции, стабильности установки, отсутствие прорезывания (обобщенно — «выживаемость эндопротеза») во многом зависит от адаптированности его биомеханических свойств. Недостаточно адаптированный в биомеханическом отношении имплантат способен провоцировать непрогнозируемую мышечную активность или содействует атрофии близлежащих тканей, а также формированию грубой рубцовой ткани вокруг имплантата. Воспалительные реакции, возникающие в ответ на имплантацию, способствуют различным осложнениям — вплоть до отторжения имплантата [21, 22].
Среди специфических побочных эффектов и осложнений, которые встречаются при применении титановых конструкций, следует выделить контурирование эндопротезов через кожные покровы и слизистую оболочку рта вследствие атрофии последних [23]. При этом в большинстве случаев осложнения возникают ввиду недостаточной биологической интеграции материала и конфликта с прилегающей тканью. Происходит «разбивание» окружающих тканей вследствие различного модуля упругости титана и близлежащих тканей [24]. Использование «титанового шелка», обернутого вокруг эндопротеза в качестве искусственной надкостницы, формирует буферную зону, которая уравнивает различие в физических параметрах эндопротеза и окружающих его мягких тканей. Отсюда следует, что у больных, нуждающихся в замещении дефекта нижней челюсти, имеется высокий риск анатомо-функциональных нарушений, поэтому вопрос о выборе имплантата и способе операции, а также о способах профилактики осложнений очень важен.
Следующим этапом развития данного метода является достижение биологической интеграции и адаптации биомеханических свойств модели эндопротеза за счет модификации его поверхности и придания ей биомеханических и физико-химических свойств, способствующих улучшению адгезии макромолекул внеклеточного матрикса и активных биокомпонентов жидкостной среды [25—29]. Ряд экспериментально-клинических работ в последние годы направлен на активизацию интеграционных процессов путем механических, химических и электрических воздействий на поверхность подобных имплантатов и эндопротезов. Как правило, данная модификация заключается в создании пористости и рельефа поверхности. Пористость увеличивает общую площадь соприкосновения эндопротеза с окружающими тканями, определяет скорость проникновения биологических жидкостей и интеграцию материала, является важным элементом, определяющим химические процессы на поверхности эндопротеза и процессы заселения имплантата фибробластами или остеобластами [30—32].
В современной литературе приводятся данные о наличии пор на поверхности эндопротезов размером от 20 мкм до 3 мм. Таким образом, в макропористых материалах возникает естественная конвекция жидкости за счет капиллярных процессов. Отсутствие сквозных пор и наличие замкнутых полостей затрудняют выход продуктов метаболизма, что задерживает биологическую интеграцию [31, 33]. Вместе с тем общие правила биомеханики при замещении мягких тканей таковы, что биомеханические свойства эндопротеза должны быть сопоставимы с биомеханическими свойствами тканей, в которых размещается эндопротез.
В клинической работе использовался титановый эндопротез, изготовленный путем механической обработки титановой заготовки по индивидуальным математическим расчетам, со сферической конструкцией мыщелкового отростка и вспомогательного устройства в виде трикотажного титанового рукава из легкой титановой сетки с поверхностной плотностью 60—80 г/м 2 и толщиной титановой нити 60 мкм [12]. Еще одной особенностью устройства были атензионные свойства металлотрикотажа. Атензионный металлотрикотаж получается при различных агрессивных способах обработки титанового сетеполотна (например, химическое травление). Высокая пластичность («мягкость») металлотрикотажа минимизирует пружинные свойства, снижает вероятность биомеханического конфликта между тканью и слизистой оболочкой и позволяет размещать материал под слизистой оболочкой без риска ее травматизации.
Данный материал был ранее использован в пластической хирургии лица для коррекции птоза тканей лица после инсульта, а также широко применялся при герниопластике [34, 35].
Использование муфты из «титанового шелка» вокруг эндопротеза позволяет создать дополнительный самообновляющийся фиброостеоинтегративный слой на поверхности титанового эндопротеза и обеспечить возможность надежной фиксации веера жевательной мускулатуры, что способствует дальнейшей физиологичной интеграции эндопротеза в окружающие его мягкотканные структуры.
Предложенное техническое решение выполняет 2 задачи: восстановление опорной зоны и восполнение дефицита объема мягких тканей, восполнение возможного дефицита соединительной ткани, а главное, устранение разницы модулей упругости при контакте мягких тканей и титанового эндпротеза. В итоге все это улучшает эргономику эндопротезированной зоны, способствует профилактике рубцовой контрактуры в зоне жевательной мускулатуры, способствует благоприятному ангиогенезу, сокращает время операции. Благодаря физиологичности комбинированного титанового эндопротеза в среднесрочном периоде происходит благоприятное заживление операционной раны, снижается риск развития осложнений в виде инфильтрации и воспаления операционной раны, формирования свищевых ходов, лимфореи.
Применение «титанового шелка» в сочетании с эндопротезом создает армирующий эффект при пластике мягких тканей и жевательной мускулатуры, позволяя получить стойкий функциональный результат хирургического лечения за счет формирования прочной, но в то же время тонкой и гибкой соединительнотканной капсулы вокруг эндопротеза, что уменьшает возможность контурирования эндопротеза.
В ходе исследования была проведена оценка КЖ пациентов по показателям физических компонентов здоровья (физическое функционирование, ролевое функционирование, обусловленное физическим состоянием, интенсивность боли, общее состояние здоровья), а также показателям психологических компонентов здоровья (жизненная активность, социальное функционирование, ролевое функционирование, обусловленное эмоциональным состоянием, психическое здоровье). Установлено, что у мужчин показатели шкал, относящиеся к психологическому компоненту, КЖ были выше, чем у женщин. Тем не менее в послеоперационном периоде отмечались стойкий косметический эффект, сохранение контуров нижней зоны лица, что в позволяло пациентам не испытывать затруднений при адаптации в социальной среде.
Предложенная методика устранения приобретенных дефектов нижней челюсти является достаточно перспективной и подлежит дальнейшему изучению.
Вывод
Использование комбинации эндопротез — «титановый шелк» позволяет в ближайшем и отдаленном послеоперационном периодах сохранить форму и объем нижней зоны лица, максимальную функциональную полноценность нижней челюсти и окклюзионные взаимоотношения на сохраненных после резекции зубах.
Предложенный способ обеспечивает формирование контуров нижней челюсти при помощи титановых имплантатов с сохранением и/или восполнением объема ротовой полости вследствие предотвращения дислокации мягких тканей, восстановления функции жевания и речи.
Формирование соединительнотканной капсулы на комбинированном эндопротезе обеспечивает дальнейшую жизнеспособность и «выживаемость», т. е. сохранность, его кондуктивной функции. Осуществляется профилактика таких осложнений, как истончение мягких тканей над поверхностью эндопротеза, его контурирование и прорезывание.
Отмечено улучшение психоэмоционального состояния больных, что обусловлено минимальными нарушениями конфигурации лица, непродолжительным периодом стационарного лечения, а также появлением ранней возможности рационального зубного протезирования.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
КАК ЦИТИРОВАТЬ:
Микрохирургические операции челюстно-лицевой хирургии
Микрохирургия - универсальный метод, применяемый практически во всех хирургических дисциплинах для устранения дефекта той или иной ткани. В организме человека существуют более 400 донорских участков с осевым типом кровоснабжения, откуда забрав ткань, не наносится никакого вреда дальнейшему кровоснабжению всего органа. В реконструкции челюстей основное место играет свойство лоскута с наличием такого количества и качества кости, которое позволит воссоздать анатомическую целостность твердых тканей и в дальнейшем возможность применения для дентальной имплантации и протезирования.
Для тотальных и субтотальных дефектов нижней челюсти предпочтителен малоберцовый кожно-костный лоскут. Малоберцовая кость обладает достаточно большими опорными свойствами, имея в наличие достаточно большое количество кортикального компонента, и легко поддается моделированию для воссоздания анатомических контуров. Подвздошный или по-другому паховый кожно-костный лоскут оптимален для реконструкции небольших дефектов нижней челюсти, в последних случаях возможно иногда применение свободной подвздошной кости.
Для тотальных и субтотальных дефектов верхней челюсти оптимальны лучевой кожно-костный и малоберцовый кожно-костный лоскуты. В тех случаях, когда дефект охватывает скуло-верхнечелюстной контрфорс в сочетании с дефектом альвеолярного отростка, возможно выполнить восполнение костного дефекта кортикально-губчатыми теменными трансплантатами и нижнечелюстными, взятыми с ветви и подбородочной области свободными трансплантатами, обладающими мезенхимальным происхождением, что оптимально для реконструкции средней зоны лица.
Безусловно, доминантной остается алгоритм, направленный на приживление лоскута на сосудистой ножке. Если приходится выбирать между удобством для последующей дентальной имплантации в виде наличия кортикальной пластинки костного компонента аутотрансплантата в области воссозданного альвеолярного отростка для последующей имплантации и от этого коим или иным образом снижается надежность работы сосудистого анастомоза, необходимо выбирать надежность приживления. Часто возникают споры между хирургами-имплантологами и реконструктивными хирургами о том, как должна располагаться в области дефекта подвздошная кость, однако опыт показывает, что компромиссов не может быть, поскольку при тромбозе сосудистого анастомоза, теряется весь лоскут. Необходимо также понимать, что расположение губчатого компонента в области альвеолярного отростка не мешает последующей имплантации, поскольку в течение 6 месяцев происходит образование новой.
Для возвращения и нормализации функции жевания и способности питаться необходимо наличие:
- 1. Губ и комплекса органов глотания.
- 2. Наличие челюстей.
- 3. Наличие зубов и прикус, обеспечивающий адекватное жевание.
- 4. Наличие контрфорсов.
- 5. Стабилизация ВНЧС.
- 6. Синхронность работы жевательных мышц.
- 7. Психическое равновесие пациента.
В литературе мы не нашли определенного алгоритма или подходов, направленных на возвращение таких жизненно важных способностей как сосание и глотание, жевание и нормализация речевой функции. Для нормализации питания пациента необходимо наличие губ, в противном случае происходит слюнотечение с последующей мацерацией кожи и невозможность приема и отправления пищи в пищевод. Пациенты с дефектами мягких тканей приротовой области постоянно страдают гастритами, воспалительными явлениями ротоглотки, поскольку вакуумное свойство эвакуации пищи в пищевод снижено, многие адаптируются глотать с открытым ртом, запрокидывая голову назад, у последних усвоение углеводов нарушено, поскольку слюна принимает участие в очищении полости рта от остатков пищи, налета и бактерий, благодаря буферным свойствам, она нейтрализует отрицательное действие сильных кислот и щелочей в пределах емкости буфера, обеспечивает поступление ионов, необходимых для реминерализации зубов, обладает противобактериальными, противогрибковыми и противовирусными свойствами. Клод Бернар доказал, что мы распознаем функции органа, выявляя последствия его отсутствия. С точки зрения функционального возвращения способности питаться второе место нашего алгоритма занимает наличие челюстей. Для устранения дефектов части или всей челюсти мы применяем предоперационное планирование.
Предоперационное планирование челюстей ведется при помощи 3D визуализирующих программ, позволяющих моделировать размеры и формы аутотрансплантатов с учетом позиционирования мыщелковых отростков нижней челюсти в височных ямках (в переднее-верхнее положение в суставных впадинах) по КТ-сканам. Несмотря на то, что мы выполняем реконструкцию в прежнем прикусе, чаще всего приходится сталкиваться с уже ремоделированным ВНЧС и нарушенным прикусом. Поэтому необходимо планирование с учетом последующего достижения центральной окклюзии в центральном соотношении. Функциональное исследование окклюзии заключается в сравнении центральной окклюзии (ЦО- окклюзия при которой наблюдается максимальный контакт между зубами верхней и нижней челюсти) и центрального соотношения (ЦС-состояние, при которой головки нижней челюсти занимают переднее-верхнее положение в суставных впадинах). В случае существенной разницы необходимо описание различий. Так существенная разница между этими состояниями чаще встречается при асимметричных деформациях и при деформациях II-го класса по Энглю. Определение ЦС важно для правильного составления операционного плана.
При планировании устранения верхнечелюстных дефектов, мы учитываем необходимость восстановления контрфорсов, а также воздухоносность верхней челюсти. Контрфорсы являются важнейшей составляющей для опоры альвеолярного отростка, в противном случае после протезирования возникает подвижность верхней челюсти.
Хотя восстановление утраченной гайморовой полости и слизистой выстилки не является возможным, необходимо восстановление анатомической близости, поэтому заполнение скуловерхнечелюстного контрфорса подвздошной костью является некорректным. Оптимально использование свободных расщепланных нижнечелюстных или теменных аутокостных блоков по форме в комбинации с костью на сосудистом питании. В дальнейшем, возможно, с развитием технологий применения стволовых клеток, мы научимся восстанавливать и истинную слизистую выстилку верхнечелюстных или околоносовых пазух.
В реконструкции верхней челюсти мы используем малоберцовый аутотрансплантат для реконструкции тотальных дефектов и лучевой при субтотальных. При использовании лучевого кожно-костного лоскута в последующем для постановки дентальных имплантатов возникает необходимость воссоздания второго кортикально-губчатого слоя альвеолярного отростка с лингвальной стороны, что возможно сделать при помощи теменных или нижнечелюстных свободных аутоблоков.
В челюстно-лицевой микрохирургии при необходимости воссоздания изгибов костей, в выборе трансплантатов с наличием кости мы ограничены подвздошным, малоберцовым, лучевым лоскутами, поскольку лишь последние позволяют 3 D моделирование костного компонента конгруентно дефекту.
Чаще всего даже при оптимальном выборе трансплантата, проведении всех диагностических мероприятий, мы сталкиваемся с дизокклюзией при устранении субтотальных дефектов челюстей, поскольку до сих пор в стране остается открытой проблема одномоментной реконструкции после резекции. Необходимо понимать, что если реконструкция выполняется не одномоментно с резекцией челюсти и даже не накладывается временная титановая конструкция для поддержания прикуса, происходит ремоделирование височно-нижнечелюстного сустава как со здоровой, так и со стороны патологии и нарушение трофики жевательной мускулатуры. В этих случаях до постановки дентальных имплантатов и до протезирования прижившегося трансплантата, выполняется ортодонтическая фиксация прикуса в виде применения брекет-систем и мини-имплантатов, а также миорелаксация жевательных мышц со стороны здоровой челюсти в применении Ботекс-терапии или миотроника.
Микрохирургическая аутотрансплантация в целях реконструкции челюстей в своем развитии на наш взгляд прошла несколько этапов:
1-й этап - качественное взятие аутотрансплантата, минимальное ее моделирование, и перенос в реципиентную зону. Основной задачей этого этапа было обеспечение приживления трансплантата (с 1978 - 1990 гг).
2-й этап - включал в себя более качественное моделирование аутотрансплантатов с использованием обычных рентгенограмм и восковых шаблонов. Основной задачей этого этапа являлось восстановление эстетики лица. Нарушенная функция нижней челюсти восстанавливалась после ряда дополнительных коррегирующих операций и съемного протезирования зубов (с 1990-1995 гг.).
3 этап - компьютерное моделирование нижней челюсти и восстановление жевательной функции при помощи протезирования с использованием дентальных имплантатов. Основной задачей этого этапа является восстановление эстетики лица и жевательной функции нижней челюсти без использования дополнительных корригирующих операций (с 1995 - 2011 гг.).
4 этап - восстановление не только идеального прикуса и стабилизации ВНЧС, но и устранение дисбаланса жевательной мускулатуры (собственно данная статья и открывает 4-й этап истории челюстно-лицевой микрохирургии).
Нами разработан алгоритм лечения пациентов с дефектами челюстей:
1. Предоперационное 3 D планирование и изготовление стереолитографических и накусных шаблонов. Планирование с учетом последующей дентальной имплантации и протезирования. Выбор оптимального лоскута.
2. Восстановление контрфорсов при возможности, анатомических контуров альвеолярного отростка челюстей при помощи свободных и на сосудистой ножке костных трансплантатов.
3. Ремоделирование ВНЧС при устранении субтотальных дефектов нижней челюсти.
4. Дентальная имплантация и протезирование.
Микрохирургическая операция: резекция нижней челюсти, пораженной опухолью с одномоментной реконструкцией малоберцовым трансплантантом на сосудистой ножке
7. Микрохирургический этап: под микроскопом ушиваются сосуды с голени и наружная сонная артерия, яремная вена, после сшивания сосудов снимаюются клипсы и ткани, взятые с ноги наполняются кровью, т.е. лоскут становится живым, но уже на челюсти.
В научно-клиническом отделе челюстно-лицевой и пластической хирургии ФГБУ НКЦО ФМБА России под руководством профессора Караяна А.С. и к.м.н. Назаряна Д.Н. выполняются уникальные операции по устранению дефектов челюстей. Подобные операции выполняются лишь в 3-х медицинских центрах России.
Читайте также:
- Техника восстановления общего желчного протока. Операции по восстановлению общего желчного протока.
- Трансфузионные реакции. Острая почечная недостаточность после трансфузионных реакций
- Доступ и ход операции резекции проксимальной холангиокарциномы с резекцией печени
- Причины износа протезов. Износостойкие стоматологические материалы
- Химиотерапия после удаления пузырного заноса
