Тепловая термоделюция. Методы исследования сердечного выброса
Добавил пользователь Алексей Ф. Обновлено: 01.02.2026
Сердечный выброс можно измерить с помощью следующих способов:
•оценки изменений импеданса грудной клетки,
•методов разведения индикатора,
•ультразвуковых методов,
•радионуклидных методов.
Изменения импеданса грудной клетки можно определять методами тетраполярной и интегральной реографии. Они оценивают изменения электрического сопротивления грудной клетки, возникающие при движении через нее потока крови. Методы являются неивазивными, и здесь заложен источник их достоинств и недостатков. Достоинство - возможность мониторинга сердечного выброса и оценки его относительных изменений. Недостаток - неточность в определении абсолютной величины сердечного выброса, поэтому лучше их комбинировать с другими методами оценки сердечного выброса.
Методики разведения индикатора основаны на принципе Фика. Суть принципа Фика состоит в следующем. Количество любого маркера, содержащегося в статическом объеме жидкости, является производным этого объема и концентрации маркера. На данном принципе основаны методы определения объема циркулирующей крови при помощи красителей или изотопов. Если известно количество введенного маркера, то по изменению его концентрации можно рассчитать, в каком объеме он распределился. Важно только, чтобы он в течение достаточно долгого промежутка времени не терялся из системы, как это происходит, например, при введении меченного изотопом I131 альбумина. В динамической системе, когда маркер постоянно добавляется и теряется из системы, изменения его концентрации зависят от скорости потока через регион потери и разницы концентраций «на входе и выходе» из этой области.
Если в качестве маркера используют кислород, то имеют ввиду следующие соображения. Потребление кислорода (VO 2 ) является производным от сердечного выброса и разницы между артериальной и смешанной венозной кровью. Для оценки оксигенации венозной крови пробы лучше брать из легочной артерии, то есть после того, как она прошла через правые отделы сердца. Если измерить VO 2 , то сердечный выброс рассчитывается как частное от деления потребления кислорода на артериовенозную разницу по кислороду:
СО = VO 2 / АVDO 2
В клинической практике измерение VO 2 производят нечасто в связи с невысокой распространенностью так называемых быстрых оксиметров, позволяющих оценивать конечно-инспираторную (FendInspO 2 ) и конечно-экспираторную (FendExpO 2 ) концентрации кислорода. Умножение разницы этих концентраций на минутный объем дыхания (MV) позволяет рассчитать VO 2 :
VO 2 = FendInspO 2 - FendExpO 2 / MV
Более широкое распространение получили термодилюционные методы. Классический метод термодилюции основан на разведении холодного раствора теплой кровью при прохождении его через правые камеры сердца (рис. 5.2). Чем меньше меняется температура раствора при прохождении им пути от места введения до места измерения температуры, тем больше сердечный выброс. Для корректного выполнения методики введение 10 мл раствора должно быть выполнено за 4 секунды. Температура вводимой жидкости не должна изменяться из-за согревания в руках исследователя и может быть комнатной. Для большей точности пользуются ледяным раствором. Необходима тщательная проверка катетерно-компьютерного коэффициента пересчета данных, зависящего от модели катетера. Нужно учесть, что кончик катетера с термистором может упираться в стенку легочной артерии или покрыться сгустком крови. Это приводит к изоляции его от холодного раствора и завышению результатов. Для контроля за данной ошибкой нужно эпизодически проверять форму кривой термодилюции. Адекватная кривая демонстрирует быстрый возврат к основанию волны и плавное затухание за 10-15 секунд. Если наблюдаются разрывы кривой, то ее следует исключить из анализа. Стандартом является двух-трехкратное повторение измерения.
Сейчас появились методики, основанные на анализе изменений температуры холодовой метки, прошедшей через все камеры сердца (монитор PiCCO). Измеряющий термистор располагается в бедренной артерии. Считается, что при этом по специальному алгоритму можно рассчитать потери тепла в легких и по ним - количество воды в их интерстициальном пространстве (рис. 5.3). Используют также методы разведения препаратов лития, специальных красителей, а также двойной метки - красителя и холодовой пробы.
При помощи ультразвуковых методов сердечный выброс рассчитывают на основе анализа размеров полостей сердца в конце систолы и диастолы. Можно также вычислить сердечный выброс по величине потока крови через клапаны сердца (допплерографически). Точность методов выше, чем импендансных, но ниже дилюционных. Большое значение имеет опыт исследователя в визуализации камер сердца.
Косвенными методами оценки сердечного выброса являются исследование сатурации смешанной венозной крови и рН-метрия желудка. Сатурация смешанной венозной крови отражает несоответствие между потребностями тканей и поступлением к ним кислорода. Условием корректной оценки является отсутствие шунтирования крови мимо регионов с нарушенной отдачей кислорода из-за спазма снабжающих их сосудов. Интересные данные можно получить при сравнении насыщения гемоглобина кислородом в верхней и нижней полых венах. В норме сатурация в нижней полой вене больше, чем в верхней. При шоке это отношение может инвертироваться.
Тепловая термоделюция. Методы исследования сердечного выброса
Кардиология:
Метод термодилюции для определения сердечного выброса при катетеризации сердца
Абсолютно точного метода измерения сердечного выброса (СВ) не существует, но он может быть определен с различными допущениями. Два наиболее часто используемых метода — метод Fick и метод термодилюции. В современной практике метод термодилюции применяют довольно редко. У пациентов сердечный выброс (СВ) часто соотносят с площадью поверхности тела, вычисляя сердечный индекс.
Метод термодилюции для определения сердечного выброса (СВ). При этом методе необходимо болюсно вводить жидкость (физиологический раствор или раствор декстрозы) в проксимальный порт катетера. Возникающее изменение температуры жидкости измеряют терморезистором, вмонтированным в дистальный конец катетера.
Изменение температуры в зависимости от времени можно отобразить графически. Затем вычисляют СВ, применяя уравнение, которое связывает температуру и силу тяжести вводимого раствора, температуру и силу тяжести крови с объемом вводимого раствора. СВ обратно пропорционален площади под термодилюционной кривой, которая является функцией температуры от времени. При этом меньшая площадь свидетельствует о большем СВ.
Колебания температуры в системе могут влиять на точность измерения, применение двух терморезисторов значительно повышает точность измерения.

Метод термодилюции имеет несколько преимуществ: нет необходимости в заборе артериальной крови; полученные данные меньше зависят от рециркуляции. Самое главное его преимущество состоит в быстром получении результатов. Однако у пациентов с тяжелой трикуспидальной регургитацией результаты часто недостоверны. У пациентов с низким СВ ( Термодилюционные кривые сердечного выброса.
Нормальная кривая имеет резкий подъем вслед за инъекцией раствора. Далее кривая медленно и плавно опускается до исходной линии.
Площадь под кривой обратно пропорциональна сердечному выбросу.
При низком сердечном выбросе кривая возвращается к исходной линии в течение более длительного времени, поэтому площадь под кривой увеличивается.
При увеличенном сердечном выбросе холодный раствор проходит через правые отделы сердца быстрее, и температура возвращается к исходной линии также быстро.
Площадь под кривой меньше, а сердечный выброс — больше.
ФГАБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России;
ГБУЗ города Москвы «Детская городская клиническая больница №9 им. Г.Н. Сперанского ДЗМ»
АО «Группа Компаний «Медси»
ФГАБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
Мифы и реальность транспульмональной термодилюции у детей
Журнал: Анестезиология и реаниматология. 2021;(1): 60‑64
Транспульмональная термодилюция — широко используемый метод оценки гемодинамических изменений у взрослых и детей, находящихся в критическом состоянии, но применение метода вне строгих показаний, неправильная интерпретация полученных данных могут привести к ошибочным клиническим решениям. Представленный обзор с критическим анализом демонстрирует историю применения метода транспульмональной термодилюции, клинические проблемы, ограничения при измерении параметров центральной гемодинамики у детей.
Дата принятия в печать:
В июне 2020 г. мы провели систематический поиск в электронных базах данных PubMed и Российского индекса научного цитирования (РИНЦ) и включили в обзор 45 источников, в которых авторы исследовали метод транспульмональной термодилюции у детей и взрослых. Всего поиск по запросу transpulmonary thermodilution в категории All child в период с 1994 г. индексирует 52 работы, по запросу «транспульмональная термодилюция», «дети» на платформе eLIBRARY — 5 работ.
История измерения сердечного выброса (СВ) берет свое начало с исследования Adolf Fick, когда 9 июля 1870 г. на заседании Физико-медицинского общества (Physikalisch-Medizinische Gesellschaft) в Вюрцбурге состоялась демонстрация способа определения сердечного выброса (СВ) у животного путем измерения уровня кислорода в артериальной и смешанной венозной крови, что отражает количество кислорода, поглощаемого единицей объема крови при прохождении через легкие [1].
В 1897 г. George Neil Stewart в эксперименте вводил болюс раствора хлорида натрия в центральную вену собак и кроликов в состоянии анестезии и затем исследовал концентрацию натрия в крови, полученной из бедренной артерии. Так появился метод «разведения индикатора» [2]. Однако G.N. Stewart не учел тот факт, что кровоток имеет ламинарный характер, при котором скорость прохождения индикатора различается в центре и на периферии сосуда, что продемонстрировали в 1928 г. W. Hamilton и соавт. [3].
Термодилюция в определенной степени напоминает данный метод, но обеспечивает получение аналогичных данных с помощью менее сложного механизма обнаружения индикатора. Автором идеи является George Fegler, ученый, представлявший Совет по сельскохозяйственным исследованиям института физиологии животных в Кембридже (Agricultural Research Council, Institute of Animal Physiology, Cambridge). В 1953 г. G. Fegler представил результаты эксперимента на собаках, в котором в качестве индикатора использовал холодный раствор Рингера. Точность этого метода установлена путем сравнения результатов, полученных методом термодилюции, с результатами измерений СВ in vitro и методом Фика, данные демонстрировали хорошую сопоставимость [4].
Дальнейшие исследования W. Ganz и соавт. [5], J. Forrester и соавт. [6] в начале 70-х годов прошлого столетия привели к применению метода термодилюции для клинической оценки показателей центральной гемодинамики у пациентов, находящихся в критическом состоянии, с использованием катетера, установленного в легочную артерию. Авторами метода стали Jeremy Swan и William Ganz [7]. Долгое время предложенная технология оставалась «золотым стандартом» для определения сердечного индекса у взрослых пациентов. Однако в педиатрической кардиохирургии использование катетера Swan—Ganz было крайне затруднительным, особенно у детей раннего возраста с массой тела до10 кг и у пациентов с измененной сердечно-легочной анатомией [8]. В ходе исследования Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness (ESCAPE) изучена эффективность лечения застойной сердечной недостаточности в зависимости от показателей гемодинамики, полученных при катетеризации легочной артерии [9]. Результаты этого исследования и клинических исследований острого респираторного дистресс-синдрома, проведенных ARDS Network, свидетельствуют о том, что катетеризация легочной артерии не снижает летальность или длительность пребывания пациентов в стационаре и может быть связана с большим числом осложнений [9, 10].
За последние несколько лет в качестве альтернативы катетеризации легочной артерии появилось несколько менее инвазивных методов гемодинамического мониторинга [11].
Транспульмональная термодилюция (ТПТД) является одним из тех методов, которые наиболее часто используются при ведении пациентов отделений интенсивной терапии. На сегодняшний день доступны два устройства: PiCCO (Pulsion Medical Systems, Германия) и VolumeView (Edwards Lifesciences, США), которые обеспечивают измерение не только СВ, но и других показателей, оценивающих преднагрузку, сократимость, уровень внесосудистой воды легких (ВСВЛ), проницаемость легочных капилляров, и разрешены для применения у детей, находящихся в критическом состоянии [12].
Формула расчета СВ с использованием метода ТПТД хорошо известна и имеет следующий вид:
(1)
где Tк — температура крови; Tи — температура вводимого раствора; Vи — объем вводимого раствора; ∫ΔTк⋅dt — площадь под кривой термодилюции; K — константа коррекции (зависит от массы и температуры).
Интерпретация показателей, полученных методом ТПТД, помогает врачу в принятии клинических решений у гемодинамически нестабильных пациентов, как у взрослых [13], так и у детей, находящихся в критическом состоянии [14]. Исследования, проведенные в конце ХХ века, демонстрируют необходимость мониторинга показателей центральной гемодинамики у детей, в них авторы подчеркивают, что низкий СВ сопровождается более высокими показателями летальности у детей, находящихся в состоянии шока [15, 16].
Измерения, полученные методом ТПТД, по сравнению с измерениями, полученными с помощью катетера, установленного в легочную артерию у детей, продемонстрировали удовлетворительную сопоставимость данных и хорошую корреляцию, авторы сообщили о небольшом завышении показателей сердечного индекса, полученных методом ТПТД, однако средняя разница составила только 4,4%, что в цифровом выражении исчисляется в 0,191 л/мин/м 2 [17].
R. Thiele и соавт. в своем обзоре, основываясь на анализе 1526 работ, констатируют, что термодилюция является точным методом для определения СВ как у животных, так и у взрослых и детей по сравнению с экспериментальными эталонными стандартами измерения [18]. Наши исследования подтвердили гипотезу о сопоставимости данных, полученных путем ТПТД и трансторакальной доплерографии (ТТДГ), при определении параметров центральной гемодинамики [19], однако необходимо отметить, что ни один из методов не является эталонным.
Наиболее важным нам представляется вопрос, являются ли нормальные показатели, рекомендованные для взрослых пациентов, идентичными для пациентов педиатрической когорты?
Различия в нормальных значениях традиционных показателей центральной гемодинамики у детей и взрослых, таких как сердечный индекс (СИ), ударный индекс (УИ), индекс общего периферического сосудистого сопротивления (иОПСС), хорошо известны, неоднократно опубликованы в литературе и представлены непосредственно в справочных материалах компаний-производителей [20, 21].
Однако ТПТД предоставляет гораздо больший набор показателей, которые необходимо интерпретировать, и особое внимание необходимо обращать на показатели индекса глобального конечного диастолического объема, а также индекса ВСВЛ (иВСВЛ).
Измерение количества ВСВЛ, которое представляет собой сумму интерстициального, внутриклеточного, альвеолярного и лимфатического объемов жидкости, исключая жидкость в плевральной полости, зачастую показывает результат выше референтных значений, приведенных в справочной литературе [22—24].
Окончательного объяснения данному феномену на сегодняшний день нет. Можно предположить, что у детей масса ткани легкого относительно массы тела значительно выше, чем у взрослых. Поскольку большая масса ткани легкого связана с большим объемом ВСВЛ, это, возможно, объясняет, почему у детей более высокий иВСВЛ (до 100%), чем у взрослых [25, 26].
Показатели иВСВЛ, полученные методом ТПТД, устойчиво коррелируют с посмертным измерением гравиметрическим методом [27]. Однако нормальный диапазон показателя у детей гораздо шире, чем у взрослых пациентов. Он составляет от 7 до 23 мл на 1 кг массы тела, изменяется в зависимости от возраста и при индексации к массе тела выглядит следующим образом: у детей до 1 года — 9—29 мл на 1 кг массы тела, от 1 до 5 лет — 7—25 мл на 1 кг массы тела и от 5 до 17 лет — 5—13 мл на 1 кг массы тела, но при индексации к росту показатель не изменяется с возрастом, его нормальная величина составляет до 315 мл/м роста [28]. У взрослых пациентов показатель иВСВЛ более 10 мл на 1 кг массы тела является критерием для диагностики отека легких [29]. Наши исследования у детей с тяжелой ожоговой травмой демонстрируют, что индексирование показателя ВСВЛ к росту является оптимальным у педиатрического контингента больных, особенно у пациентов младшей возрастной группы: уровни ВСВЛ более 315 мл/м при поступлении и более 330 мл/м на третьи сутки интенсивной терапии явились независимыми факторами риска развития не только острой дыхательной недостаточности, о чем свидетельствует работа коллег из клиники Bambino Gesu и Universita di Roma [30], но и синдрома полиорганной недостаточности (СПОН), причем статистически значимые корреляционные связи между уровнем иВСВЛ и наличием СПОН получены при индексации только к росту ребенка [31].
В противоположность смещения в большую сторону нормальных значений иВСВЛ показатель индекса глобального конечного диастолического объема (иГКДО) — гипотетический объем, который предполагает ситуацию, когда четыре камеры сердца одновременно находятся в диастолической фазе сердечного цикла, у детей имеет меньший по сравнению со взрослыми физиологический диапазон.
В таблице представлены данные зарубежных коллег, демонстрирующие нормальные показатели, полученные методом ТПТД у детей по сравнению со взрослыми пациентами [20, 23, 32, 33].
J. Lemson и соавт. [34] предложили формулы для коррекции показателей иГКДО и иВСВЛ, которые выглядят следующим образом:
где х — масса тела (кг);
где х — возраст (годы);
где х — возраст (годы).
Возможно, представленные J. Lemson и соавт. формулы могут быть включены в программное обеспечение устройств, обеспечивающих проведение ТПТД.
В этой же работе авторы демонстрируют, что, в отличие от иВСВЛ, иГКДО является виртуальным объемом, включая конечные диастолические объемы левого и правого предсердия и желудочков плюс объем центральных вен и аорты между местом введения и местом обнаружения индикатора. Поэтому иГКДО не имеет никакого анатомического аналога, который мог бы использоваться для индексации. Единственный сходный показатель, измеренный с использованием эхокардиографии или катетеризации левых отделов сердца, — это конечный диастолический объем левого желудочка, напоминающий иГКДО. Поскольку левый желудочек по отношению к общей площади поверхности тела увеличивается с ростом ребенка с 50 г/м 2 в 3 года до 80 г/м 2 в 17 лет [35], нельзя исключить, что именно поэтому у детей более низкий иГКДО по сравнению со взрослыми.
В исследовании G. Grindheim и соавт. у детей до 2 лет без заболеваний сердца и легких типичный диапазон для иГКДО составил 280—590 мл/м 2 и для иВСВЛ — 7—27 мл на 1 кг массы тела, это свидетельствует о том, что у детей младшей возрастной группы референтные показатели должны быть еще ниже [36].
Еще раз необходимо отметить, что ориентация на показатели иГКДО и иВСВЛ, рекомендованные для взрослых пациентов, может приводить к ошибочным клиническим решениям в оценке волемического статуса и методов его коррекции у детей, особенно у пациентов младшей возрастной группы.
По нашему мнению, клиническая интерпретация показателей ТПТД у детей с анатомическими аномалиями сердечно-сосудистой системы, наличием право-левых или лево-правых шунтов может быть затруднительной и приводить к неправильному выводу. Однако мы встречаем работы, в которых авторы проводят интерпретацию данных, полученных методом ТПТД, у пациентов после операций в условиях искусственного кровообращения [37], с лево-правым шунтом [38], с врожденными пороками сердца [39, 40].
К сожалению, попытка сделать процедуру ТПТД еще менее инвазивной с выполнением через катетер, установленный в центральную позицию из периферического доступа, что достаточно актуально в педиатрической практике, на сегодняшний день потерпела неудачу. Исследование демонстрирует статистически значимое завышение показателя СИ (средний — 4,5 по сравнению с 3,3 л/мин/м 2 ; pp<0,0001) [41].
Несмотря на тот факт, что традиционно 3 или 4 процедуры введения холодного раствора используются для получения усредненных показателей, W. Huber и соавт. из Technical University of Munich демонстрируют, что достаточно двух процедур введения и большое число введений существенно не повышает точности измерения [42]. Эти данные актуальны при ведении детей в аспекте профилактики перегрузки жидкостью.
Наши данные свидетельствуют о том, что применение методов расширенного инвазивного мониторинга является необходимым компонентом интенсивной терапии у детей с критическими состояниями, интерпретация данных сопровождается статистически значимым изменением характера интенсивной терапии, коррекцией темпа инфузионной терапии, подключением или исключением кардиотонических/вазопрессорных препаратов, средств β-адренергической блокады, что способствует стабилизации баланса между доставкой и потреблением кислорода [43].
Общие для детей и взрослых преимущества и ограничения метода ТПТД представлены в работе X. Monnet и J.-L. Teboul [44]. Необходимо отметить важные комментарии к данной публикации, сделанные M. Sánchez-Sánchez и соавт. [45], в которых авторы говорят об отсутствии конкретных целей при коррекции терапии на основе ТПТД. Со своей стороны следует добавить, что цели необходимо устанавливать индивидуально, особенно в практике детского анестезиолога-реаниматолога.
Таблица. Нормальные показатели гемодинамики у детей по сравнению со взрослыми
Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина Минздравсоцразвития России
ФГБУ «Национальный медицинский исследовательский центр им. академика Е.Н. Мешалкина» Минздрава России, 630055, Новосибирск, Россия
ННИИПК им. акад. Е.Н. Мешалкина Минздравсоцразвития России, Новосибирск
Состояние основных параметров гемодинамики по данным транспульмональной термодилюции у детей с массой тела менее 10 кг после коррекции врожденных пороков сердца с легочной гиперволемией
Журнал: Кардиология и сердечно-сосудистая хирургия. 2012;5(2): 98‑103
Струнин О.В., Перевозчикова А.А., Ломиворотов В.В., Горбатых Ю.Н., Прохоров С.Н., Князькова Л.Г. Состояние основных параметров гемодинамики по данным транспульмональной термодилюции у детей с массой тела менее 10 кг после коррекции врожденных пороков сердца с легочной гиперволемией. Кардиология и сердечно-сосудистая хирургия. 2012;5(2):98‑103.
Strunin OV, Perevozchikova AA, Lomivorotov VV, Gorbatykh IuN, Prokhorov SN, Kniaz'kova LG. Status of main hemodynamic indices according to transpulmonary thermodilution in children weighting up to 10 kg after correction of congenital heart diseases with pulmonary hypovolemia. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2012;5(2):98‑103. (In Russ.).
Проведен анализ основных гемодинамических параметров, влияющих на сердечный выброс после операций по поводу врожденных пороков сердца в условиях искусственного кровообращения. Обследованы 26 детей с врожденными пороками сердца с лево-правым сбросом в возрасте от 2 мес до 1 года (средний возраст 7 мес) и массой тела менее 10 кг (в среднем 6,6±1,3 кг), которым проведена радикальная коррекция порока сердца в условиях гипотермической перфузии. Гемодинамику изучали по данным, полученным при помощи прибора PiCCO-plus. Измеряли также уровень предсердного натрийуретического пептида (BNP) и стандартные клинические показатели. Обнаружено, что состояние основных факторов, влияющих на сердечный выброс в послеоперационном периоде, подвержено быстрым динамическим изменениям. Наиболее критическим для снижения функции сердца являлся период с 12-го по 24-й час после операции. Наибольшую прогностическую ценность в отношении длительности респираторной поддержки имела совокупность показателей сократимости левого желудочка (dPmax), индекса функции сердца (CFI) и индекс внесосудистой воды легких (ELWI), измеренных в период максимального напряжения компенсаторных механизмов - 12 ч после операции.
Основным стратегическим направлением современной кардиохирургии врожденных пороков сердца (ВПС) в последние десятилетия является максимально ранняя радикальная хирургическая коррекция. Хорошо известны особенности гемодинамики у детей раннего возраста, обусловленные низкими адаптивными резервами незрелого миокарда, тесной зависимостью сердечного выброса от частоты сердечных сокращений и общего периферического сосудистого сопротивления (ОПСС). После хирургической коррекции ВПС с гиперволемией малого круга кровообращения на состояние гемодинамики начинают влиять дополнительные факторы: резидуальная легочная гипертензия, лабильность легочного и системного сосудистого сопротивления в рамках стресс-реакции, отек миокарда в результате системного воспалительного ответа и дисфункции эндотелия и его повреждение (кардиоплегия, хирургическая травма). Достойным ответом на расширяющийся круг проблем являются, с одной стороны, быстрый прогресс технологий вспомогательного кровообращения, с другой — появление новых препаратов (например, левосимендан) и подходов к фармакологической коррекции. Перечисленные факторы предъявляют новые требования к дифференцированной динамической оценке основных гемодинамических параметров. Становится актуальной стратегия профилактики тяжелых гемодинамических сдвигов, а не их констатация с последующей терапией осложнений. Основной метод ультразвуковой диагностики и общеизвестные клинические диагностические методы, являющиеся «золотым стандартом» еще с прошлого столетия, не безупречно соответствуют этому подходу. Более релевантны указанным требованиям методы термодилюционного определения функции кровообращения и относительно недавно появившаяся в клинической практике технология PiCCO («pulse-induced contour cardiac output»), которая представляет собой метод мониторинга состояния гемодинамики, основанный на комбинации транспульмональной термодилюции и анализа формы пульсовой волны. Одними из основных его достоинств являются относительная малоинвазивность, безопасность и широкий диапазон измеряемых параметров. Сопоставимость получаемых данных с данными других методов подробно описана в литературе. Опыт применения данной технологии в педиатрии все еще ограничен. Нормальные показатели для детей различных возрастных групп находятся в стадии формирования [5]. В педиатрической кардиохирургии количество исследований, посвященных клинической эффективности данного метода, также ограничено. В имеющихся публикациях приведены результаты обследования небольшого числа детей (от 16 до 24) в широком возрастном диапазоне (от периода новорожденности до 14 лет) с различными типами ВПС как с гиперволемией малого круга кровообращения, так и со сниженным легочным кровотоком, объединявшихся в одну группу [3, 4]. В нашем исследовании мы сконцентрировали внимание на детях первого года жизни (за исключением периода новорожденности) с массой тела менее 10 кг и ВПС с гиперволемическим типом легочной гемодинамики.
Материал и методы
Все дети поступали для планового хирургического лечения. Операции проводили в условиях комбинированной эндотрахеальной анестезии. Индукцию выполняли с помощью масочной ингаляции севофлюрана в дозе 3—4% по объему. Перед интубацией использовали фентанил в дозе 2,5—5 мкг/кг, мидазолам в дозе 0,1—0,2 мг/кг. В дальнейшем анестезия поддерживалась внутривенной инфузией фентанила в дозе 5—10 мкг/кг/ч, ингаляцией севофлюрана 0,5—1,5% по объему, болюсными введениями мидазолама 0,1—02 мг/кг/ч. Искусственное кровообращение (ИК) проводили с использованием систем Lilliput-1 или Lilliput-2. В качестве компонентов заполнения использовали отмытые эритроциты, донорскую плазму. Средняя длительность ИК составила 106±42 мин, окклюзии аорты — 59±30 мин. Измеряли стандартный набор параметров гемодинамики: инвазивное артериальное давление, центральное венозное давление, частота сердечных сокращений. Адекватность сердечного выброса (СВ) определяли по насыщению кислородом смешанной венозной крови и уровню лактата. Наряду с этим дополнительно определяли содержание мозгового натрийуретического пептида (BNP) в периферической крови методом иммунохемилюминесцентного анализа с помощью наборов реагентов фирмы «Abbot» (США) на автоматическом анализаторе Architect i2000sr (США). Измеряли уровень pro-BNP (реагенты фирмы «Biomedica», Словакия) методом иммуноферментного анализа (ELISA) на микропланшетном ридере ELX-800 (США).
При помощи прибора PiCCO-plus оценивали основные показатели преднагрузки, функции миокарда и посленагрузки. Термодилюционный катетер 3F PULSIOCATH (диаметр 0,9 мм, рабочая длина 7 см, дистальный просвет 0,018'') для измерения устанавливали пункционно по Сельдингеру в левую бедренную артерию и использовали для постоянного мониторинга артериального давления и взятия проб артериальной крови. Пробы и измерения осуществляли на следующих этапах: 1-й этап — до хирургического вмешательства (в операционной, сразу после интубации и катетеризации артерии и вены); 2-й этап — сразу после окончания ИК, выполнения ультрафильтрации и введения протамина; 3-й этап — через 12 ч после операции в отделении интенсивной терапии; 4-й этап — через 24 ч; 5-й этап — через 48 ч.
Статистическую обработку полученных данных осуществляли при помощи программ M. Excel, Biostat. Для сравнения зависимых измерений на этапах исследования применяли непараметрический критерий Вилкоксона. Для определения суммарного воздействия изучаемых величин на клинически значимые показатели проводили многофакторный анализ, рассчитывали коэффициент корреляции Спирмена. Статистически значимыми считали результаты при р
Результаты
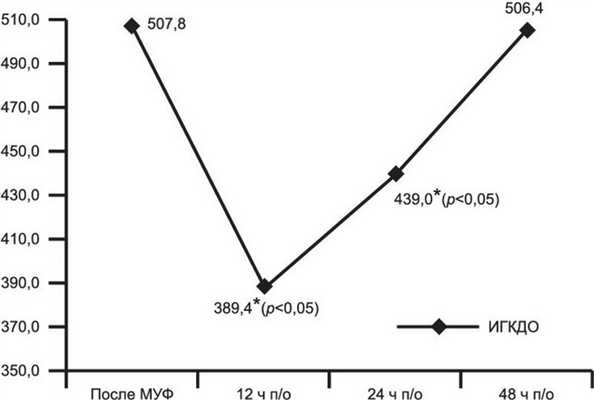
Программное обеспечение прибора PiCCO осуществляет корректировку результатов измерения при наличии у пациента внутрисердечного шунтирования справа налево. Однако у всех обследованных нами пациентов имелась ранняя стадия развития легочной гипертензии, при которой давление в легочной артерии и правых камерах сердца хотя и повышается, но остается ниже, чем давление в левых отделах. В этих условиях внутрисердечное шунтирование крови осуществляется по градиенту давления слева направо. В этой связи данные метода термодилюции, полученные на первом этапе исследования, не могут быть признаны корректными и в этой публикации не приводятся. Последующие измерения проводились после коррекции порока, включавшего хирургическое устранение внутрисердечного шунтирования. После окончания ИК и удаления избыточной жидкости при помощи модифицированной ультрафильтрации (МУФ) измеряли гемодинамические показатели. О состоянии преднагрузки можно было судить по уровню центрального венозного давления, равного 8,0±2,2 мм рт.ст., и грудному конечному диастолическому объему (ГКДО), являющемуся суммой конечных диастолических объемов всех камер сердца. В этот момент ГКДО составлял 225,6±160,1 мл, а его индекс (ИГКДО) — 507,8±190,7 мл/м 2 . Оба показателя были максимальными за весь период исследования. При этом ИГКДО максимально приближался к величине 556±428 мл/м 2 , полученной в качестве эталонной для этого показателя J. Lopez-Herce и соавт. [5] у 9 критически больных пациентов массой тела менее 20 кг. Максимальным также был такой показатель преднагрузки, как индекс внутригрудного объема крови (ИВГОК), состоящий, как принято считать, на 80% из конечных диастолических объемов камер сердца и на 20% из легочного объема крови. Вариабельность ударного объема левого желудочка — ЛЖ (SVV), зависит как от наполнения сосудистого русла, так и от способности сердца отвечать на внезапное изменение преднагрузки. При этом SVV составил 12,5±4,7%, что соответствует данным J. Lopez-Herce (12,9±5,8%) [5]. При «норме» около 10% увеличение SVV свидетельствует о состоянии гиповолемии. Таким образом, посленагрузка сразу после ИК, несмотря на только что проведенную МУФ, характеризовалась максимальными за все этапы исследования показателями, которые, однако, только приближались к нижним границам оптимальных уровней для детей со сходными весовыми характеристиками. На следующем этапе (через 12 ч после операции) отмечалось, напротив, максимальное за весь период обследования снижение рассмотренных показателей преднагрузки. Так, ИГКДО снижался до 389,4±90,4 мл/м 2 (р=0,48). Только к 24 ч после операции он начинал вновь повышаться и к 48 ч достигал показателей 1-го этапа (рис. 1). Рисунок 1. Динамика индекса глобального конечного диастолического объема (ИГКДО, мл/м 2 ) на этапах исследования. МУФ — модифицированная ультрафильтрация; п/о — после операции.
Состояние посленагрузки оценивали по индексу системного сосудистого сопротивления (ИССС). Нормальные его величины при определении аппаратом PiCCO находятся в диапазоне 1200—2000 дин·с·см -5 ·м 2 [5]. Динамика данного показателя отражена на рис. 4. Рисунок 4. Динамика системного сосудистого сопротивления (ССС) и его индекса (ИССС) на этапах исследования. Минимальной за весь период исследования посленагрузка была сразу после окончания ИК и проведения МУФ. Сочетание низкого сосудистого сопротивления с адекватной преднагрузкой и хорошей сократимостью обеспечивало в этот момент максимальный сердечный индекс (СИ) — 5,1±2,2 л/мин/м 2 . В пользу данного предположения свидетельствует и относительно невысокий уровень pro-BNP, равный 125,5±256 пг/мл сразу после МУФ и резко повышавшийся только на следующих этапах. Максимальным ИССС становился к 12 ч после операции. К этому моменту он превышал границы нормы и составлял 2175,5±796 дин·с·см -5 ·м 2 . Как показано выше, этот этап исследования сопровождался относительной гиповолемией и хорошими показателями сократимости dPmax. Взаимодействие этих факторов, тем не менее, приводило к снижению СИ до 3,4±2,5 л/мин/м 2 (р=0,02). Уровень лактата в этот момент достигал в среднем 2,8±1,6 ммоль/л (рис. 5). Рисунок 5. Изменение сердечного индекса (СИ) и уровня лактата на этапах исследования. К 24 ч послеоперационного периода СИ оставался сниженным (3,34±1,69 л/мин/м 2 ). Преднагрузка в этот период статистически значимо (р=0,05) повышалась на 12% (см. рис. 1), появлялась тенденция к снижению посленагрузки (до 1830,3±715 дин·с·см -5 ·м 2 ; р=0,07). Следует напомнить, что к этому моменту снижалась и dPmax до 566,1±210,1 мм рт.ст./с (р=0,05). Таким образом, через 24 ч после операции происходило относительное снижение СВ, обусловленное снижением сократимости миокарда на фоне относительно сниженной преднагрузки и сохраняющегося высокого сосудистого сопротивления. Повышенное сосудистое сопротивление, по-видимому, компенсировало уровень артериального давления, так как клинически уже только 50% этих больных к данному моменту требовалась кардиотоническая поддержка (допамин) в средней дозе 2,8±1,18 мкг/кг/мин. Уровень лактата крови в этот момент составлял в среднем 1,7±0,5 ммоль/л, что демонстрировало адекватность механизмов компенсации СВ и отсутствие выраженной гипоксии тканей. Однако о выраженном напряжении механизмов компенсации свидетельствовало максимальное повышение уровней BNP и pro-BNP до 569,3±427 пг/мл и 394±197 фмоль/мл соответственно. По сравнению с исходными значениями (BNP 80,0±77,6 пг/мл, pro-BNP 86,6±92,6 фмоль/мл) содержание данных маркеров увеличилось в 7,1 и 4,5 раза (p
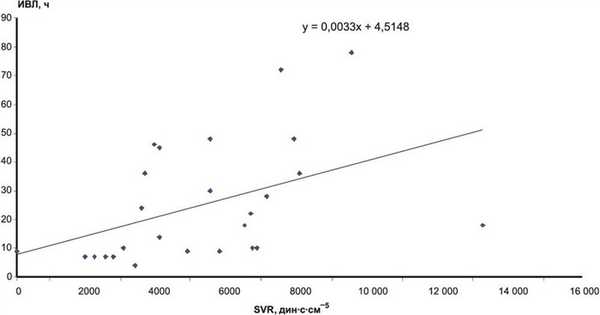
Для оценки влияния измеряемых показателей на интегральный клинический показатель, каковым является время искусственной вентиляции легких (ИВЛ), изучали корреляционные связи между ними. Статистически значимые корреляции обнаружены на этапе исследования, соответствовавшем 12 ч послеоперационного периода. Длительность ИВЛ в послеоперационном периоде находилась в тесной положительной корреляции с системным сосудистым сопротивлением SVR — rs=0,61; ps=-0,65; p<0,05), ударным объемом (rs=-0,65; p<0,05), СВ (rs=-0,66; p <0,05) (рис. 6). Рисунок 6. Корреляция длительности искусственной вентиляции легких (ИВЛ) и системного сосудистого сопротивления (SVR) через 12 ч после операции.
Для определения суммарного воздействия изучаемых показателей на длительность ИВЛ в послеоперационном периоде проводили анализ трехфакторной статистической зависимости вида X=c0+c1z1+c2z2+c3z3+e, где X — показатель ИВЛ (часы), z1, z2, z3 — изучаемые показатели, c0 — константа, c1, c2, c3 — коэффициенты при соответствующих показателях, e — ошибки регрессии. Установлено, что к 12 ч после операции (3-й этап исследования) определяющими факторами, влияющими на необходимость респираторной поддержки, являлись индекс сократимости ЛЖ (dP-3), индекс функции сердца (CFI-3) и индекс внесосудистой воды легких (ELWI-3). Наилучшие статистические результаты, которые позволяют максимально точно объяснить наблюдаемые изменения, получены в приведенной регрессии:
[Длительность ИВЛ]=14,2 — 0,05[dP-3]+2,74[CFI-3]+0,83[ELWI-3], R2=66%.
Анализ двухфакторной статистической зависимости вида: X=c0+c1z1+c2z2+e позволил выявить, что непосредственно после операции и завершения МУФ (2-й этап исследования) длительность ИВЛ находилась в обратной зависимости от индекса системного сосудистого сопротивления (SVRI-2) и такого показателя преднагрузки, как глобальный конечный диастолический объем (GEDV-2):
[ИВЛ] = 68,3-0,02[SVRI-2]-0,076[GEDV-2], R2=44%.
Выводы
1. У детей с массой тела менее 10 кг после кардиохирургических операций состояние основных факторов, влияющих на СВ в послеоперационном периоде, подвержено быстрым динамическим изменениям. Управление гемодинамикой должно базироваться на комплексном анализе показателей пред-, посленагрузки, СВ и накопления внесосудистой воды в легких с динамическим контролем эффективности проводимой терапии.
2. После кардиохирургической коррекции ВПС у детей наиболее критическим в плане снижения функции сердца являлся период с 12-го по 24-й час после операции. Снижение СВ с повышенным уровнем лактата, BNP и pro-BNP обусловливалось высоким индексом системного сосудистого сопротивления и относительной гиповолемией на фоне удовлетворительных показателей сократимости.
3. Наибольшую прогностическую ценность в отношении длительности респираторной поддержки имела совокупность показателей сократимости ЛЖ, индекса функции сердца и внесосудистой воды легких, измеренных в период максимального напряжения компенсаторных механизмов — 12 ч после операции. Самостоятельную прогностическую ценность имело системное сосудистое сопротивление.
Оценка сердечного выброса методом термоделюции
Катетер Сван-Ганца - это специализированное медицинское оборудование, позволяющее оценивать центральную гемодинамику легочной артерии. Исследование выполняется в стационарных условиях и именуется измерение сердечного выбора. Сама аппаратура обладает сложной структурой и высокими требованиями к точности, надежности.
История создания

Разработка специализированного устройства началась в 70-х годах прошлого столетия при этом связывается с именами Гарольд Джереми Сван и Уильямом Ганцем. Именно они предложили проводить катетеризацию легочной артерии. Это оказалось революционным методом мониторинга состояния больных, которые находились в критическом состоянии. Следует отметить, что сама методология обследования начала появляться еще в 50-х. Форма катетера появилась из обычной жизни.
По стечению обстоятельств и при длительной работе удалось выполнить несколько экспериментов. Последние оказались удачными, так как работать с катетером можно было без сопровождения рентгена. Также интересным фактом считается отсутствие осложнений, что стало доказательством эффективности нового метода. С течением времени устройство дорабатывалось и представлено в современном виде. Оно получило улучшенные характеристики безопасности и точности, что является важным при лечении больных.
Показания к использованию
Показания к катетеризации легочной артерии сопряжены со следующими проблемами и нарушениями деятельности организма:
- Заболевания сердечной мышцы (дисфункция ЛЖ, перенесенный инфаркт, порок сердца, сердечная недостаточность).
- Заболевания легких (легочная недостаточность, хронические заболевания дыхательной системы).
- Предоперационный период (коронарное шунтирование, с нарушениями миокарда, операции на сердечный клапан, сложные поражения сердечной мышцы).
Специальный катетер устанавливается и при возрастных ограничениях. При достижении возраста от 65 лет считается необходимостью. Существует необходимость установки оборудования и при проведении других видов операций, к примеру, на аорте. Имеются и ограничения, которые предполагают отказ от применения метода.
Суть методики и клинические возможности

Понятие «термоделюция» в полной мере раскрывает сущность методологии. Основной критерий оценки состояния больного считается температура крови, которая контактирует со специальным термистром. В зависимости от степени колебания температурного режима зависит сердечный выброс. На основании этого выстраивается график на компьютере, что позволяет контролировать состояние больного. Для снижения негативных факторов важно регулировать подачу раствора, а также правильно вводить сам катетер.
Клинические возможности из вышесказанного выражаются в возможности определения индексов выброса крови. Последние свидетельствует о правильности функционирования кровообращения. Без использования метода невозможно правильное воздействие на сократимость миокарда.
Доступность оборудования
Медицинское оборудование от компании «НПП Монитор» представлено в широком многообразии и отличается высоким качеством. Продукция поставляет по всем регионам отечественного государства и за границу. Условия и нюансы прописаны на сайте. Также некоторые моменты можно уточнить по контактным телефонам или через другие средства связи.
Читайте также:
