Тиреоидная орбитопатия у ребенка - клиника, диагностика, лечение
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Причины возникновения эндокринной офтальмопатии
Единого мнения относительно причин развития ЭОП не существует до сегодняшнего дня. Однако большинство суждений сходятся на том, что некие изменения тканей орбиты вызывают в организме патологический иммунный ответ, в результате чего, в эти ткани проникают антитела, что вызывает их воспаление и отек, а в спустя 1 или 2 года, и рубцевание поверхности. По одной из гипотез, клетки ткани щитовидной железы, а также ретроорбитального пространства имеют общие фрагменты антигенов (эпитопы), которые, вследствие некоторых причин, начинают восприниматься иммунной системой, как чужеродные. В качестве аргумента, авторы выдвигают тот факт, что ЭОП в 90% случаев сопутствует диффузному токсическому зобу, при достижении эутиреоза выраженность глазных симптомов снижается, а уровень антител при данном сочетании заболеваний к рецептору тиреотропного гормона высок. По другой версии, ЭОП представляется самостоятельным заболеванием с преимущественным поражением орбитальных тканей. Аргументом, свидетельствующим в пользу этой теории является отсутствие дисфункции щитовидной железы примерно в 10% случаев ЭОП.
И все же, причина ЭОП, кроется не в поражении щитовидной железы, поэтому и регуляция ее функций, не способна обратить развитие данного заболевания вспять. Скорее всего, аутоиммунный процесс может затрагивать эндокринную железу вместе с мышцами глаза и клетчаткой орбиты. Правда, восстановление естественного гормонального уровня щитовидной железы способен облегчить течение эндокринной офтальмопатии, хотя в ряде случаев это не помогает затормозить ее прогрессирование.
Большинство пациентов с ЭОП отмечают гипертиреоидное состояние, но в 20% случаев может отмечаться эутиреоз. Кроме того, изредка даже выявляются патологии, сопровождающиеся снижением уровня тиреоидных гормонов, такие как тиреоидит Хашимото или рак щитовидной железы. Глазные симптомы, при наличии гипертиреоза, как правило, развиваются в течение 1,5 лет.
Заболеваемость в среднем составляет примерно 16 случаев женщин и 2,9 случаев мужчин из 100 тыс. человек в популяции. Таким образом, у женщин предрасположенность к этому заболеванию гораздо выше, но более тяжелые случаи отмечались у мужчин. Болезнь проявляется к возрасту 30-50 лет, а тяжесть проявлений обычно нарастает с возрастом (после 50 лет).
Проявления эндокринной офтальмопатии
Симптомокомплекс ЭОП, как правило, обусловлен наличием сопутствующих патологий щитовидной железы, добавляющих свои характерные проявления. При этом, глазными проявлениями эндокринной офтальмопатии принято считать ретракцию века (подтянутость кверху), чувство сдавления и боль, нарушение цветовосприятия, сухость глаз, экзофтальм (выступание кпереди глазного яблока), отек конъюнктивы (хемоз), периорбитальный отек, ограничение движений глазным яблоком, приводящее к значимым функциональным, а также косметическим нарушениям. Подобные симптомы могут быть односторонними или наблюдаться на обоих глазах. Проявление их и выраженность напрямую связаны со стадией заболевания.
Множество симптомов ЭОП, названы именами авторов, которые впервые их описали, так:
- Симптом Гифферда-Энроса - это отек век;
- Симптом Дальримпля - ретракция века, сопровождающаяся широким раскрытием глазных щелей;
- Симптом Кохера - это видимость участка склеры между радужкой и верхним веком при взгляде вниз;
- Симптом Штельвага - редкое мигание;
- Симптом Мебиуса-Грефе-Минза - это отсутствие согласованности в движениях глазных яблок;
- Синдром Похина - загиб век при закрытии;
- Симптом Роденбаха - это дрожание век;
- Симптом Еллинека - пигментация век.
Подавляющее большинство случаев эндокринной офтальмопатии к потере зрения не ведут, но они вызывают его ухудшение, вследствие развития диплопии, кератопатии, компрессионной оптиконейропатии.
Диагностика
Выраженная клиническая картина ЭОП не требует для ее диагностики специальных исследований, достаточно офтальмологического осмотра. Он включает: исследование оптических сред, визометрию, периметрию, проверку цветового зрения и согласованности движений глаз. Измерение степени экзофтальма проводят экзофтальмометром Гертеля. При затруднениях, а также с целью оценки состояния двигательных мышц глаза и тканей в ретробульбарной области могут быть назначены УЗИ, МРТ или КТ. При сочетании ЭОП и тиреоидной патологии исследуется гормональный статус (лабораторные исследования уровня общих Т3, Т4 и связанных Т3, Т4 и ТТГ). На наличие ЭОП также может указывать повышение экскреции гликозамингликанов с мочой, присутствие в крови антитиреоглобулиновых или ацетилхолинэстеразных антител, экзоофтальмогенного Ig и офтальмопатического Ig, альфа-галактозил -АТ, АТ к микросомальной фракции, AT к глазному протеину.
Классификация
Сегодня для ЭОП существует несколько классификаций. Самая простая, выделяет два типа заболевания, которые, впрочем, друг друга не исключают. К первому типу относят ЭОП, сопровождающуюся минимальными признаками рестриктивной миопатии и воспаления, ко второму - ЭОП, сопровождающуюся значительными их проявлениями.
Зарубежные специалисты используют классификацию NOSPECS.
В России принято применять классификацию Баранова.
Степени
- 1 Экзофтальм незначительный (15,9 ± 0,2мм), веки имеют припухлость, периодически возникает ощущение «песка», изредка слезотечение. Нарушений со стороны функции двигательных мышц глаз нет.
- 2(средняя тяжесть) Экзофтальм умеренный (17,9 ± 0,2мм), наблюдаются нерезкие изменения со стороны конъюнктивы, легкое либо умеренное нарушение функции экстраокулярных мышц, стойкое ощущение «песка», нестойкая диплопия, слезотечение, светобоязнь.
- 3(тяжелая) Экзофтальм резко выражен (22,2 ±1,1мм), наблюдается нарушение смыкания век, стойкая диплопия, изъязвление роговицы, выраженные нарушения функции двигательных мышц глаза, признаки атрофии ЗН.
Вместе с тем, существует классификация Бровкиной, включающая три формы ЭОП: отечный экзофтальм, тиреотоксический экзофтальм, эндокринную миопатию. Каждая из выделенных форм со временем переходит в последующую более тяжелую.
Лечение эндокринной офтальмопатии
Метод лечение ЭОП обусловлен стадией процесса и наличием сопутствующих патологий щитовидной железы. Однако существуют и общие рекомендации, придерживаться которых следует в обязательном порядке:
- Отказ от курения.
- Применение средств увлажнения глаза (капли, глазные гели);
- Поддержание нормальной функции щитовидной железы.
Наличие нарушений функции щитовидной железы, требует проведения ее коррекции под контролем эндокринолога. В случае гипотиреоза, применяется терапия тироксином, при гипертиреозе, назначаются тиреостатические препараты. При отсутствии эффективности консервативного лечения, может быть назначено хирургическое удаление части либо всей щитовидной железы.
Лечение ЭОП консервативными методами. Для устранения признаков воспаления и отека, зачастую системно назначают глюкокортикоиды либо стероидные препараты. Они призваны снизить продукцию мукополисахаридов клетками-фибробластами, занимающих важное место в иммунных реакциях. Для применения глюкокортикоидов (метилпреднизолон, преднизолон) существует много различных схем, которые рассчитаны на курсы от нескольких недель и до нескольких месяцев. Альтернативным вариантом применения стероидов может быть циклоспорин. Нередко его используют и в комбинациях с ними. Тяжелое воспаление или компрессионная оптиконейропатия может потребовать проведения пульс-терапии (введение в короткое время сверхвысоких доз). Оценку ее эффективности проводят спустя 48 часов. При отсутствии таковой, целесообразно проведение хирургической декомпрессии.
В странах СНГ до сих пор довольно широко применяют ретробульбарные введения глюкокортикоидов. Однако за рубежом от подобного метода лечения данной патологии уже отказались по причине его высокой травматичности и риска образования рубцов в месте введения раствора. Кроме того, эффективность глюкокортикоидов больше связана с системным действием, а не с местным. Две эти точки зрения давно являются предметом дискуссий, именно поэтому применение данного метода введения целиком остается на усмотрении врача.
При лечении умеренного или тяжелого воспаления, диплопии и снижения зрения возможно применение лучевой терапии. Ее действие оказывает повреждающий эффект на лимфоциты и фибробласты. Ожидаемый результат проявляется спустя несколько недель. Так как рентгеновское излучение на время может усиливать процесс воспаления, пациентам в первые недели облучения, назначают стероидные препараты. Наилучший эффект от лучевой терапии достигается при стадии активного воспаления, терапия которого начата в сроки до семи месяцев от начала заболевания, или в комбинации с глюкокортикоидными средствами. К его возможным рискам можно отнести развитие катаракты, лучевой оптиконейропатии, лучевой ретинопатии. Так, одно из исследований при облучении, зафиксировало образование катаракты у 12% пациентов. Применение лучевой терапии не рекомендовано у больных сахарным диабетом вследствие риска прогрессирования ретинопатии.
Хирургическое лечение ЭОП. Примерно 5% пациентов с данным заболеванием нуждаются в хирургическом его лечении. Нередко хирургия ЭОП проводится в несколько этапов. При отсутствии серьезных осложнений заболевания, таких как компрессионная оптиконейропатия и тяжелое поражение роговицы, операция должно быть отложена до затихания активного процесса воспаления либо проводиться на стадии рубцовых изменений. Не менее важен и порядок выполнения вмешательств.
Декомпрессию орбиты, нередко проводят и в качестве первого этапа хирургического лечения компрессионной оптиконейропатии, и при отсутствии эффективности консервативной терапии. Возможными осложнениями ее могут стать: кровотечение, потеря чувствительности периорбитальной зоны, диплопия, синусит, смещение век, смещение глазного яблока, слепота.
Хирургия косоглазия, как правило, выполняется в периоде ремиссии ЭОП, при стабильности угла отклонения глаза не менее полугода. Лечение проводят, в первую очередь, для минимизации диплопии. Достижение постоянного бинокулярного зрения, как правило, бывает затруднительно, или одного вмешательства просто недостаточно.
С целью уменьшения легкого или умеренного экзофтальма, зачастую назначают операцию по удлинению век. Она является альтернативой введению в толщу верхнего века ботокса и триамцинолона субконъюнктивально. Не исключено также проведение боковой тарзоррафии - сшивания латеральных краев, которая позволяет уменьшить ретракцию века.
На заключительном этапе хирургического лечения ЭОП, обычно выполняют блефаропластику и пластику слезных точек.
Перспективные направления лечения ЭОП. На сегодняшний момент уже разрабатываются новые препараты и методы для успешного лечения ЭОП. Исследуется эффективность приема микроэлемента селена, являющегося антиоксидантом, противоопухолевого средства ритуксимаба, ингибиторов фактора опухолевого некроза - этанерцепта, инфликсимаба, даклизумаба.
Существуют и методы лечения ЭОП, не являющиеся основными, но способные с успехом в некоторых ситуациях применяться. К примеру, введение никотинамида и пентоксифиллина, которые блокируют синтез мукополисахаридов в ретроорбитальной области.
Один из потенциальных медиаторов патологических процессов в орбите - это инсулиноподобный фактор роста-1. Поэтому, при лечении ЭОП начинают применять аналог соматостатина - октреотид, к которому в ретробульбарных тканях имеются рецепторы. В последнее время проходит последние клинические исследования длительно действующий аналог соматостатина - ланреотид.
Роль плазмофереза или внутривенного введения иммуноглобулина при лечении ЭОП до настоящего времени изучены недостаточно. Применение последнего, при сравнении с пероральным приемом преднизолона, показало в одном из последних исследований аналогичный эффект при значительно меньшем количестве побочных действий.
В медицинском центре «Московская Глазная Клиника» все желающие могут пройти обследование на самой современной диагностической аппаратуре, а по результатам - получить консультацию высококлассного специалиста. Клиника консультирует детей от 4 лет. Мы открыты семь дней в неделю и работаем ежедневно с 9 ч до 21 ч. Наши специалисты помогут выявить причину снижения зрения, и проведут грамотное лечение выявленных патологий.
Эндокринная офтальмопатия ( Аутоиммунная офтальмопатия , Офтальмопатия Грейвса , Тиреоидная офтальмопатия )
Эндокринная офтальмопатия - это органоспецифическое прогрессирующее поражение мягких тканей орбиты и глаза, развивающееся на фоне аутоиммунной патологии щитовидной железы. Течение эндокринной офтальмопатии характеризуется экзофтальмом, диплопией, отечностью и воспалением тканей глаза, ограничением подвижности глазных яблок, изменениями роговицы, ДЗН, внутриглазной гипертензией. Диагностика эндокринной офтальмопатии требует проведения офтальмологического обследования (экзофтальмометрии, биомикроскопии, КТ орбиты); исследования состояния иммунной системы (определение уровня Ig, Ат к ТГ, Ат к ТПО, антиядерных антител и др.), эндокринологического обследования (Т4 св., Т3 св., УЗИ щитовидной железы, пункционной биопсии). Лечение эндокринной офтальмопатии направлено на достижение эутиреоидного состояния; может включать медикаментозную терапию или удаление щитовидной железы.
МКБ-10
Общие сведения
Эндокринная офтальмопатия (тиреоидная офтальмопатия, офтальмопатия Грейвса, аутоиммунная офтальмопатия) - аутоиммунный процесс, протекающий со специфическим поражением ретробульбарных тканей и сопровождающийся экзофтальмом и офтальмоплегией различной степени выраженности. Впервые заболевание было подробно описано К. Грейвсом в 1776 г.
Эндокринная офтальмопатия - проблема, представляющая клинический интерес для эндокринологии и офтальмологии. Эндокринной офтальмопатией страдает примерно 2 % всего населения, при этом среди женщин заболевание развивается в 5-8 раз чаще, чем среди мужчин. Возрастная динамика характеризуется двумя пиками манифестации офтальмопатии Грейвса - в 40-45 лет и 60-65 лет. Эндокринная офтальмопатия также может развиваться в детском возрасте, чаще у девочек первого и второго десятилетия жизни.
Причины
Факторы, инициирующие эндокринную офтальмопатию, до сих пор окончательно не выяснены. В роли пусковых механизмов могут выступать:
- респираторные инфекции,
- малые дозы радиации,
- инсоляция,
- курение,
- соли тяжелых металлов,
- стресс,
- аутоиммунные заболевания (сахарный диабет и пр.), вызывающие специфический иммунный ответ.
Отмечена ассоциация эндокринной офтальмопатии с некоторыми антигенами HLA-системы: HLA-DR3, HLA-DR4, HLA-B8. Мягкие формы эндокринной офтальмопатии чаще встречаются среди лиц молодого возраста, тяжелые формы заболевания характерны для пожилых людей.
Патогенез
Предполагается, что вследствие спонтанной мутации Т-лимфоциты начинают взаимодействовать с рецепторами мембран клеток глазных мышц и вызывают в них специфические изменения. Аутоиммунная реакция Т-лимфоцитов и клеток-мишеней сопровождается высвобождением цитокинов (интерлейкина, фактора некроза опухолей, γ-интерферона, трансформирующего фактора роста b, фактора роста тромбоцитов, инсулиноподобного фактора роста 1), которые индуцируют пролиферацию фибробластов, образование коллагена и выработку гликозаминогликанов. Последние, в свою очередь, способствуют связыванию воды, развитию отека и увеличению объема ретробульбарной клетчатки. Отек и инфильтрация тканей орбиты со временем сменяются фиброзированием, в результате чего экзофтальм становится необратимым.
В развитии эндокринной офтальмопатии выделяют фазу воспалительной экссудации, фазу инфильтрации, которая сменяется фазой пролиферации и фиброза. С учетом выраженности глазной симптоматики выделяют три формы эндокринной офтальмопатии:
- Тиреотоксический зкзофтальм. Характеризуется незначительной истинной или ложной протрузией глазных яблок, ретракцией верхнего века, отставанием века при опускании глаз, тремором закрытых век, блеском глаз, недостаточностью конвергенции.
- Отечный экзофтальм. Об отечном экзофтальме говорят при выстоянии глазных яблок на 25-30 мм, выраженном двустороннем отеке периорбитальных тканей, диплопии, резкой ограниченности подвижности глазных яблок. Дальнейшее прогрессирование эндокринной офтальмопатии сопровождается полной офтальмоплегией, несмыканием глазных щелей, хемозом конъюнктивы, язвами роговицы, застойными явлениями на глазном дне, болями в орбите, венозным стазом. В клиническом течении отечного экзофтальма выделяют фазы компенсации, субкомпенсации и декомпенсации.
- Эндокринную миопатию. При эндокринной миопатии имеет место слабость чаще прямых глазодвигательных мышц, приводящая к диплопии, невозможности отведения глаз кнаружи и кверху, косоглазию, отклонению глазного яблока книзу. Вследствие гипертрофии глазодвигательных мышц прогрессирующе нарастает их коллагеновая дегенерация.
Для обозначения выраженности эндокринной офтальмопатии в России обычно используются классификация В. Г. Баранова, согласно которой выделяют 3 степени эндокринной офтальмопатии.
- Критериями эндокринной офтальмопатии 1 степени служат: невыраженный экзофтальм (15,9 мм), умеренная отечность век. Ткани конъюнктивы при этом интактны, функция глазодвигательных мышц не нарушена.
- Эндокринная офтальмопатия 2 степени характеризуется умеренно выраженным экзофтальмом (17,9 мм), значительным отеком век, выраженным отеком конъюнктивы, периодическим двоением.
- При эндокринной офтальмопатии 3 степени выявляются выраженные признаки экзофтальма (20,8 мм и более), диплопия стойкого характера, невозможность полного смыкания век, изъязвление роговицы, явления атрофии зрительного нерва.
Симптомы эндокринной офтальмопатии
К ранним клиническим проявлениям эндокринной офтальмопатии относятся преходящие ощущения «песка» и давления в глазах, слезотечение либо сухость глаз, светобоязнь, отечность периорбитальной области. В дальнейшем развивается экзофтальм, который вначале носит асимметричный или односторонний характер.
На стадии развернутых клинических проявлений названные симптомы эндокринной офтальмопатии становятся постоянными; к ним добавляется заметное увеличение выстояния глазных яблок, инъекция конъюнктивы и склеры, припухлость век, диплопия, головные боли. Невозможность полного смыкания век приводит к образованию язв роговицы, развитию конъюнктивита и иридоциклита. Воспалительная инфильтрация слезной железы усугубляется синдромом сухого глаза.
Осложнения
При выраженном экзофтальме может возникать компрессия зрительного нерва, приводящая к его последующей атрофии. Механическое ограничение подвижности глазных яблок приводит к увеличению внутриглазного давления и развитию, так называемой, псевдоглаукомы; в некоторых случаях развивается окклюзия вен сетчатки. Вовлечение глазных мышц нередко сопровождается развитием косоглазия.
Диагностический алгоритм при эндокринной офтальмопатии предполагает обследование пациента эндокринологом и офтальмологом с выполнением комплекса инструментальных и лабораторных процедур.
1. Эндокринологическое обследование направлено на уточнение функции щитовидной железы и включает исследование тиреоидных гормонов (свободных Т4 и Т3), антител к ткани щитовидной железы (Ат к тиреоглобулину и Ат к тиреопероксидазе), проведение УЗИ щитовидной железы. В случае выявления узлов щитовидной железы диаметром более 1 см, показано выполнение пункционной биопсии.
2. Функциональное офтальмологическое обследование при эндокринной офтальмопатии преследует цель уточнения зрительной функции. Функциональный блок включает:
- визометрию
- периметрию
- исследование конвергенции
- электрофизиологические исследования
- биометрические исследования глаза (экзофтальмометрия, измерение угла косоглазия) - позволяют определить высоту выстояния и степень отклонения глазных яблок
3. Методы визуализации направлены на морфлогическую оценку структур глаза. Включают следующие исследования:
- осмотр глазного дна (офтальмоскопия) производится для исключения развития нейропатии зрительного нерва
- биомикроскопия - с целью оценки состояния структур глаза
- тонометрия - выполняется для выявления внутриглазной гипертензии
- УЗИ, МРТ, КТ орбит) позволяют дифференцировать эндокринную офтальмопатию от опухолей ретробульбарной клетчатки.
4. Иммунологическое обследование. При эндокринной офтальмопатии чрезвычайно важным представляется обследование иммунной системы больного. Изменения клеточного и гуморального иммунитета при эндокринной офтальмопатии характеризуется снижением числа CD3+ T-лимфоцитов, изменением соотношения CD3+ и лимфоцитов, уменьшением количества CD8+T-cynpeccopoв; возрастанием уровня IgG, антиядерных антител; повышением титра Ат к ТГ, ТПО, АМАb (глазным мышцам), второму коллоидному антигену. По показаниям выполняется биопсия пораженных глазодвигательных мышц.
Экзофтальм при эндокринной офтальмопатии следует дифференцировать с псевдоэкзофтальмом, наблюдаемым при высокой степени близорукости, орбитальном целлюлите (флегмоне глазницы), опухолях (гемангиомах и саркомах орбиты, менингиомах и др.).
Патогенетическая терапия
Лечебная тактика определяется стадией эндокринной офтальмопатии, степенью нарушения функции щитовидной железы и обратимостью патологических изменений. Все варианты лечения направлены на достижение эутиреоидного состояния.
- Иммуносупрессивная терапия. Включает назначение глюкокортикоидов (преднизолон), оказывающих противоотечное, противовоспалительное и иммуносупрессивное действие. Кортикостероиды применяются внутрь и в виде ретробульбарных инъекций. При угрозе потери зрения проводится пульс-терапия метилпреднизолоном, рентгенотерапия орбит. Использование глюкокортикоидов противопоказано при язвенной болезни желудка или двенадцатиперстной кишки, панкреатите, тромбофлебитах, артериальной гипертензии, нарушении свертываемости крови, психических и онкологических заболеваниях.
- Экстракорпоральная гемокоррекция. Методами, дополняющими иммуносупрессивную терапию, служат плазмаферез, гемосорбция, иммуносорбция, криоаферез.
- Коррекция функции ЩЖ. При наличии нарушений функции щитовидной железы проводится ее коррекция тиростатиками (при тиреотоксикозе) или тиреоидными гормонами (при гипотиреозе).
- Хирургическая тактика. При невозможности стабилизации функции щитовидной железы может потребоваться выполнение тиреоидэктомии с последующей ЗГТ.
Офтальмологическое лечение
Симптоматическая терапия при эндокринной офтальмопатии направлена на нормализацию метаболических процессов в тканях и нервно-мышечной передачи. В этих целях назначаются инъекции актовегина, прозерина, инстилляции капель, закладывание мазей и гелей, прием витаминов А и Е. Из методов физиотерапии при эндокринной офтальмопатии используется электрофорез с лидазой или алоэ, магнитотерапия на область орбит.
Возможное хирургическое лечение эндокринной офтальмопатии включает три типа офтальмологических операций:
- Декомпрессия орбиты. Направлена на увеличение объема глазницы и показана при прогрессирующей нейропатии зрительного нерва, выраженном экзофтальме, изъязвлениях роговицы, подвывихе глазного яблока и др. ситуациях. Декомпрессия орбиты (орбитотомия) достигается путем резекции одной или нескольких ее стенок, удаления ретробульбарной клетчатки.
- Операции на глазодвигательных мышцах. Показаны при развитии стойкой болезненной диплопии, паралитического косоглазия, если его не удается скорригировать призматическими очками.
- Операции на веках. Представляют большую группу разнообразных пластических и функциональных вмешательств, выбор которых диктуется развившимся нарушением (ретракцией, спастическим заворотом, лагофтальмом, пролапсом слезной железы, грыжей с выпадением орбитальной клетчатки и пр.).
Прогноз
В 1-2 % случаев наблюдается особо тяжелое течение эндокринной офтальмопатии, приводящее к тяжелым зрительным осложнениям или остаточным явлениям. Своевременное медицинское вмешательство позволяет добиться индуцированной ремиссии и избежать тяжелых последствий заболевания. Результатом терапии у 30% больных служит клиническое улучшение, у 60% - стабилизация течения эндокринной офтальмопатии, у 10% - дальнейшее прогрессирование заболевания.
Гипертиреоз у детей
Гипертиреоз у детей — это клинический синдром, который характеризуется повышенной выработкой тиреоидных гормонов. Возникает при диффузном токсическом зобе, аденоме гипофиза, на начальных стадиях тиреоидитов. Основные симптомы: ускорение обмена веществ, психоэмоциональные нарушения, дисфункция пищеварительной и сердечно-сосудистой системы. Диагностика синдрома предполагает УЗИ и сцинтиграфию щитовидной железы, развернутый анализ тиреоидного гормонального профиля и специфических антител. Лечение состоит из тиреостатической терапии, препаратов радиоактивного йода и бета-адреноблокаторов.
Гипертиреоз встречается с частотой до 20-25 больных на 100 тыс. детского населения. В основном болеют дети предпубертатного и пубертатного возраста, причем девочки в 6-8 раз чаще мальчиков. У младенцев и детей раннего возраста симптомы гипертиреоза определяются не чаще 8 случаев на 1 млн населения. Термины гипертиреоз и тиреотоксикоз обычно используются как синонимы, хотя первый обозначает гиперфункцию щитовидной железы (ЩЖ), а второй — токсические эффекты тиреоидных гормонов на ткани. Зачастую у ребенка развиваются оба состояния, но иногда гипертиреоз может быть изолированным.
У новорожденных гиперфункция ЩЖ зачастую связана с наличием токсического зоба у матери. При этом в организме беременной вырабатываются специфические антитела, которые проникают через плаценту к плоду, присоединяются к рецепторам тироцитов и усиливают синтез гормонов. У старших детей гипертиреоз провоцируется следующими причинами:
- Болезнь Грейвса.Диффузный токсический зоб составляет до 90% причин патологии в детском возрасте. Вследствие постоянной стимуляции ТТГ-рецепторов тироцитов щитовидная железа равномерно увеличивается, а ее гормональная функция усиливается. Изредка гипертиреоз формируется при многоузловом токсическом зобе.
- Тиреоидит Хашимото. Усиление синтеза и выделения тиреоидных гормонов наблюдается в гипертиреоидной фазе, которая чаще возникает у детей в начале заболевания. Аутоиммунные процессы стимулируют щитовидную железу и частично разрушают клетки, усиливая выход гормональных биомолекул в кровоток.
- Другие виды тиреоидитов. Иногда симптомы тиреоидной гиперфункции выявляются у детей с острым тиреоидитом, вызванным бактериальной флорой. Тиреоидная гиперфункция также возможна при подостром тиреоидном воспалении, которое спровоцировано вирусными агентами.
- Аденома гипофиза. При гормонально активной опухоли центрального эндокринного органа усиливается синтез ТТГ, который стимулирует тироциты и увеличивает продукцию тироксина и трийодтиронина. Подобные нарушения бывают и при патологии гипоталамуса, секретирующего тиролиберины.
Усиление выработки тиреоидных гормонов в щитовидной железе вызвано либо тиреостимулирующими антителами, либо повышением концентрации гормональных регуляторов (ТТГ и тиролиберинов) в крови. В результате этих механизмов в системный кровоток поступает неадекватное количество Т3 и Т4, которые связываются с клеточными рецепторами в разных тканях и оказывают негативные физиологические эффекты.
В норме тиреоидные гормоны участвуют во многих биохимических процессах, поэтому их избыток сопровождается системными нарушениями. У детей возникают патологические катаболические процессы, нарушается углеводный и липидный обмен. Гормоны оказывают токсическое влияние на сердечно-сосудистую и нервную систему, в период детства негативно воздействуют на психику.
В зависимости от локализации патологии выделяют 3 типа гипертиреоза: первичный, который обусловлен поражением на уровне щитовидной железы, вторичный, характеризующийся нарушениями работы гипофиза, и третичный, связанный с заболеваниями гипоталамуса. В практической детской эндокринологии важна классификация синдрома по клиническим проявлениям, в которой различают 3 варианта:
- Субклинический. Представляет собой легкую степень тяжести гипертиреоза. Клинические симптомы отсутствуют или минимально выражены. Диагноз устанавливается только на основании изменений гормонального профиля.
- Манифестный. Классическое течение гипертиреоза, которое относится к среднетяжелой степени, характеризуется развернутой клинической картиной в сочетании с лабораторными изменениями.
- Осложненный. Неблагоприятный вариант течения, когда типичные симптомы гипертиреоза дополняются признаками поражения сердца, нервной системы и паренхиматозных органов.
Симптомы гипертиреоза у детей
У младенцев клинические проявления возникают в первый месяц жизни. Они включают кишечные расстройства (рвоту, диарею), проблемы с грудным вскармливанием, повышенное беспокойство и нарушения сна. Иногда у новорожденного видна увеличенная щитовидная железа. Зачастую при неонатальном гипертиреозе отмечается регресс симптоматики в течение первого полугодия жизни.
По завершении периода новорожденности среди ведущих признаков гипертиреоза преобладают психоэмоциональные симптомы. У детей появляется беспричинная раздражительность, гиперактивность, капризность и склонность к агрессии. Школьники хуже успевают в учебе, поскольку им становится сложно прилагать волевые усилия и длительно концентрироваться на одном деле.
Физиологические симптомы представлены непереносимостью жары и духоты, усиленным потоотделением, дрожанием пальцев рук. Многие дети жалуются на неприятное чувство сердцебиения, головные боли, которые вызваны повышением артериального давления. Кишечные признаки включают учащение дефекации, периодически спазмы в кишечнике. Ребенок стремительно худеет, хотя аппетит у него не нарушен.
Еще одна группа клинических проявлений включает симптомы основной патологии, которая спровоцировала тиреоидную гиперфункцию. При остром тиреоидите — фебрильная лихорадка, сильные боли по передней поверхности шеи, нарушения глотания, при подострой форме — субфебрильная температура, умеренная болезненность в проекции органа. Выпячивание глаз (экзофтальм) встречается только при гипертиреозе, вызванном болезнью Грейвса.
У детей, страдающих неонатальным гипертиреозом с тиреотоксикозом, риск негативных последствий варьирует в пределах 10-15%. У младенцев возникают нарушения психомоторного развития, задержка роста, а также краниосиностоз — слишком раннее окостенении черепных швов, из-за чего формируется микрокрания. Несовременно диагностированный гипертиреоз у новорожденного может иметь летальный исход.
Во всех возрастных группах самым тяжелым осложнением заболевания является тиреотоксический криз, который без экстренной медицинской помощи может закончиться смертью ребенка. Неотложное состояние проявляется жизнеугрожающими аритмиями, гипертензивным кризом, острой сердечной недостаточностью. Затем начинается делирий, который переходит в кому и смерть.
При физикальном осмотре детский эндокринолог обращает внимание на увеличение щитовидной железы, появление функциональных шумов сердца при аускультации, наличие патологических глазных симптомов. При оценке неврологического статуса врач, как правило, выявляет снижение мышечной силы и тонуса. Затем проводится инструментальная и лабораторная диагностика гипертиреоза:
- УЗИ щитовидной железы. При аутоиммунном тиреоидите и диффузном зобе визуализируют увеличенную железу с неоднородной структурой. Для многоузлового зоба характерны отдельные патологические очаги на фоне нормальной паренхимы органа. Неблагоприятным признаком считается гипоэхогенное образование с нечеткими контурами и кальцификатами.
- Сцинтиграфия щитовидной железы. Исследование выполняется для детальной оценки функциональной активности органа. При гипертиреозе наблюдается повышенный захват радиофармпрепарата, изредка на результатах сцинтиграфии видны отдельные «горячие узлы».
- ЭКГ. Данные электрокардиографии необходимы, чтобы оценить, как функционирует сердечно-сосудистая система и выявить ее вторичное поражение. Если эндокринолог видит патологические признаки на ЭКГ, он дополнительно назначает ЭхоКГ, консультацию детского кардиолога.
- Гормональные исследования. При гипертиреозе в крови повышены уровни свободного Т3, Т4, увеличен титр антител к тиреопероксидазе (ТПО), тиреоглобулину (ТГ), рецепторам ТТГ. Уровень гипофизарного гормона ТТГ снижен при первичной форме расстройства, повышен при вторичном и третичном гипертиреозе.
Лечение гипертиреоза у детей
Консервативная терапия
При тиреотоксикозе ограничивают физическую активность, чтобы не усугублять нарушения терморегуляции и не создавать чрезмерную нагрузку на сердечную мышцу. Детям запрещено давать кофе и крепкий чай, подросткам категорически нельзя употреблять энергетики и спиртные напитки. До нормализации гормонального фона ограничивают поступление в организм йода с контрастными веществами. Медикаментозное лечение гипертиреоза включает:
- Тиреостатики. Препараты используются для подавления гормональной продукции и нормализации состояния здоровья ребенка. Терапия проводится 1-1,5 года. Лечение предполагает постоянный контроль уровня свободного Т4 и постепенное введение заместительного лечения левотироксином.
- Радиоактивный йод. Такая схема используется после длительного и безуспешного применения терапии тиреостатиками. Назначение йода возможно у детей старше 5 лет с выраженным гипертиреозом и тиреотоксикозом.
- Бета-адреноблокаторы. Лекарства нормализуют частоту сердечных сокращений и повышают эффективность работы миокарда. Они устраняют симптомы, предупреждают развитие тяжелых кардиальных осложнений гипертиреоза.
Хирургическое лечение
Оперативное вмешательство (тиреоидэктомия) выполняется детям с рецидивирующим гипертиреозом, при неэффективности медикаментозной терапии на протяжении 12-18 месяцев, наличии крупных узловых новообразований. Перед хирургическим лечением ребенку рекомендована терапия тиреостатиками до достижения состояния эутиреоза. После операции проводят контроль паратгормона и кальция, по показаниям назначают витамин D.
Прогноз и профилактика
При своевременном начале лечения стойкая ремиссия наступает у 75% детей. Прогноз зависит от причины и степени повышения уровня тиреоидных гормонов, скорости уменьшения зоба и наличия у пациента сопутствующих заболеваний. Первичная профилактика гипертиреоза заключается в предупреждении эндокринных болезней, сопровождающихся нарушением функции щитовидной железы.
4. Антитела к рецептору ТТГ в дифференциальной диагностике гипертиреоза/ А.В. Кияев, Л.И. Савельев, Л.Ю. Герасимова// Клиническая и экспериментальная тиреоидология. — 2006.
Аутоиммунный тиреоидит у ребенка
Аутоиммунный тиреоидит у ребенка — это воспалительное заболевание щитовидной железы, которое возникает при ее повреждении аутоантителами. Патология формируется при наличии генетической предрасположенности под действием провоцирующих факторов: избытка йода, гормональных перестроек, радиации. Аутоиммунный тиреодит обычно протекает бессимптомно, но может проявляться зобом, клиническим гипотиреозом или гипертиреозом. Диагностика болезни включает УЗИ и пункцию щитовидной железы, анализы на тиреоидные гормоны и антитела. Лечение состоит из изменения образа жизни, ликвидации триггеров, назначения заместительных (гормональных) и симптоматических медикаментов.
Аутоиммунный тиреоидит (АИТ) имеет синонимичное название тиреоидит Хашимото в честь врача H. Hashimoto, который в 1912 году впервые выделил симптомы в отдельную нозологическую единицу. Распространенность патологии раннем детстве, дошкольном и младшем школьном возрасте составляет 0,17-0,5%. Частота воспаления повышается в период пубертата (до 2% от всех подростков), девочки болеют в 4-5 раз чаще мальчиков. Частое бессимптомное течение и сложность своевременной диагностики болезни объясняют высокую актуальность аутоиммунного тиреоидита в педиатрической практике.
Факторы риска
Помимо генетических особенностей, большое значение имеют экзогенные факторы риска и негативные воздействия, запускающие патологический процесс. У детей основным фактором называют избыточное потребление йода, если семья живет в эндемическом регионе, либо родители дают им специальные йодсодержащие продукты. Другие триггеры воспаления включают:
- вирусные инфекции (корь, грипп, краснуха);
- неблагоприятный радиационный фон;
- травмы и операции на щитовидной железе (ЩЖ).
Если на ребенка действуют провоцирующие факторы, наследственные нарушения работы иммунной системы вызывают срывы механизмов клеточной и гуморальной защиты. В организме начинается синтез антител к тиреоглобулину, рецепторам тиреотропного гормона гипофиза, микросомальной фракции щитовидной железы. Роль этих молекул в патогенезе недостаточно ясна, поскольку они не имеют прямого цитотоксического действия на тиреоидную ткань.
Установлено, что аутоиммунное воспаление сопровождается повышением содержания фактора некроза опухолей и других веществ, которые запускают каскад биохимических реакций, ответственных за апоптоз тироцитов. Как следствие, функциональная активность органа снижается, формируется гипотиреоз. Морфологически в железистой ткани выявляют инфильтрацию лимфоцитарными и плазматическими клетками.
По размеру железы различают гипертрофическую форму (до 95%) и атрофическую форму аутоиммунного тиреоидита. По течению тиреоидит бывает латентным и клиническим. По нозологической форме выделяют АИТ как самостоятельное заболевание либо как компонент аутоиммунного полиэндокринного синдрома. В детской эндокринологии наиболее важна систематизация по функциональной активности органа, согласно которой различают 3 типа болезни:
- Гипотиреоз. Характеризуется снижением продукции тиреоидных гормонов (Т3 и Т4), вследствие чего у ребенка возникают типичные клинические симптомы. Зачастую сопровождается зобом.
- Эутиреоз. Основной вариант детского аутоиммунного тиреодита, при котором функциональность железистой ткани не страдает. В таком случае течение болезни является бессимптомным.
- Гипертиреоз. При одновременном повреждении большого числа тиреоцитов возможен массивный выброс гормонов в кровь, что вызывает симптомы тиреотоксикоза. Эта фаза кратковременная, затем она сменяется гипотиреозом.
Симптомы
У многих детей аутоиммунное тиреоидное воспаление не сопровождается неприятными проявлениями и выявляется случайно при гормональном обследовании по другим показаниям. Если возникает клиническая форма тиреоидита, у пациентов диагностируют увеличение размеров щитовидной железы (зоб) и/или симптомы нарушения ее секреторной активности (гипер- или гипотиреоз). Болезнь чаще манифестирует у подростков на фоне полового созревания.
На начальной стадии тиреоидита у детей типична тиреотоксическая форма (хашитоксикоз). У ребенка ускоряется метаболизм, поэтому он постоянно хочет есть, однако не набирает или даже теряет вес. Наблюдаются эмоциональные нарушения: повышенная возбудимость, капризность, агрессивность или истеричность. Физические симптомы тиреодита, протекающего с гипертиреозом, включают дрожание пальцев рук, усиление потоотделения, тахикардию и симптоматическую гипертензию.
После гипертиреоза уровень гормонов быстро снижается, нарастают признаки гипотиреоза. Кожа становится сухой, шершавой и холодной на ощупь, появляются умеренные отеки, из-за нарушения метаболизма ребенок постоянно мерзнет. Неврологические симптомы проявляются чувством ползания «мурашек» в конечностях, снижением мышечного тонуса и силы. Часто пациент становится вялым, апатичным, хуже успевает в школе и перестает общаться со сверстниками.
При аутоиммунном воспалении щитовидная железа увеличивается в размерах, но на начальных стадиях тиреоидита родителям сложно это заметить. При массивном зобе становится видна выпуклость по передней поверхности шеи ребенка. Значительное увеличение органа сопровождается легкой болезненностью, неприятными ощущениями при глотании. При ощупывании шеи родители ощущают равномерно плотное гладкое образование.
В детском возрасте при несвоевременно диагностированном аутоиммунном тиреоидите уровень тиреоидных гормонов снижается на 3-5% ежегодно. Если болезнь длительное время протекает без симптомов, то у ребенка формируется стойкий гипотиреоз, который требует пожизненной заместительной терапии. Распространенность необратимых нарушений работы железистой тиреоидной ткани у страдающих аутоиммунным тиреоидитом составляет в среднем 1-2 случая на 1000 больных детей.
Ребенок с подозрением на аутоиммунное поражение ЩЖ проходит обследование у детского эндокринолога. При первичном осмотре врач устанавливает размеры и степень увеличения органа, выявляет физические и психоэмоциональные симптомы изменения уровня тиреоидных гормонов. Доктор уточняет семейный анамнез для оценки генетических факторов риска. Затем эндокринолог назначает план диагностики, в который входят следующие методы:
- УЗИ щитовидной железы. При эхографическом исследовании определяют увеличение (чаще) или уменьшение (реже) размеров органа, нарушения его морфологической структуры.
- Тонкоигольная биопсия тиреоидной ткани. Гистологическое исследование биоптатов — наиболее информативный метод для верификации аутоиммунного типа поражения, оценки степени инфильтрации и развития соединительной ткани.
- Гормональный профиль. Патогномоничный признак аутоиммунного тиреоидита — повышение в крови уровня антител к тиреопероксидазе (антиТПО). Также врач оценивает концентрацию тироксина, трийодтиронина и регуляторных гормонов (ТТГ, тиреолиберина).
- Дополнительные исследования. В гемограмме обнаруживают увеличение уровня лимфоцитов, в биохимическом анализе крови возможно повышение острофазовых показателей. Иммунограмма показывает рост уровня специфических антител.
Лечение аутоиммунного тиреоидита у детей
При эутиреоидной фазе АИТ специфическое лечение не проводится. Врач рекомендует изменить образ жизни ребенка: сократить количество йода в ежедневном рационе, по возможности переехать в регион с благоприятной экологической ситуацией, уменьшить количество стрессовых факторов. Инфекции выступают как триггер АИТ, поэтому больному выполняют санацию хронических очагов (кариеса, тонзиллита).
При клиническом или субклиническом гипотиреозе ребенку назначается длительная поддерживающая терапия левотироксином, доза которого рассчитывается по возрасту и весу. Лечение тиреоидита замедляет патологические изменения в щитовидной железе и предотвращает нежелательные симптомы гипотиреоза. Для снижения уровня аутоантител применяют препараты селена. При тиреотоксической фазе показан короткий курс мерказолила.
При выраженных субъективных проявлениях аутоиммунного тиреоидита необходимо симптоматическое лечение. Чтобы уменьшить боль и дискомфорт в области железы, используются препараты из группы нестероидных противовоспалительных средств, а при активном воспалении рекомендованы короткие курсы глюкокортикоидов. Для ликвидации симптоматики гипертиреоза эффективны бета-адреноблокаторы и седативные медикаменты.
У 25% детей с аутоиммунным тиреоидитом наблюдается спонтанное восстановление тиреоидной гормональной функции, а у остальных удается контролировать состояние заместительной терапией. В большинстве случаев прогноз благоприятный, но при несвоевременности обращения к врачу есть риск развития тяжелого гипотиреоза. Профилактика включает рациональную по содержанию йода диету, исключение вредных факторов среды, предупреждение вирусных инфекций у ребенка.
1. Хронический аутоиммунный тиреоидит у детей/ А.Е. Абатуров, Л.Л. Петренко, О.Н. Герасименко, И.Л. Высочина// Здоровье ребенка. — 2009.
2. Аутоиммунный тиреоидит у детей. Попробуем взглянуть по-иному?/ А.В. Кияев// Клиническая экспериментальная тиреоидология. — 2008.
Орбитопатия (пучеглазие), вызванная патологией щитовидной железы, лечится у эндокринолога

Орбитопатия, вызванная патологией щитовидной железы, также известная как офтальмопатия / орбитопатия Грейвса (OG), является выражением аутоиммунного процесса, нацеленного на ткани вокруг глазного яблока.
Важные факты о пучеглазии. Почему при этом состоянии нужно срочно идти к эндокринологу
Наиболее распространенное название этой патологии — офтальмопатия — неточно, потому что сам орган зрения (Ophthalmos — глаз) не повреждается напрямую. OG — пучеглазие — наиболее частая причина окулярного проптоза (экзофтальмологии). Это состояние встречается примерно у каждого второго пациента с нарушением работы щитовидной железы.
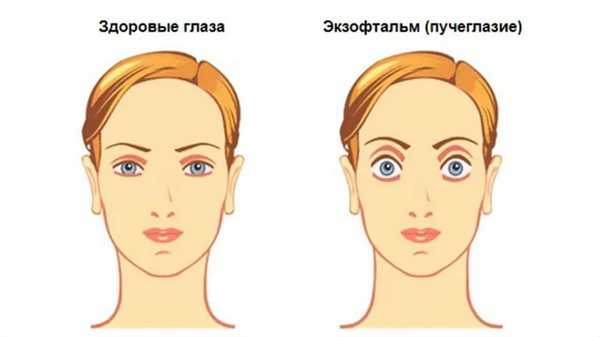
Пучеглазие
Пациенты с болезнью Грейвса, пациенты, обращающиеся за медицинской помощью по поводу увеличения глаз (особенно реципрокного), должны быть сначала обследованы у эндокринолога на предмет патологии щитовидной железы. Являясь следствием заболеваний щитовидной железы болезнь Грейвса обычно приводит к поражению глаз (отсюда и название офтальмопатия / орбитопатия Грейвса).
Но также следует учитывать, что офтальмопатия может возникать как при отсутствии в анамнезе гипертиреоза (глазная или эутиреоидная болезнь Грейвса), так и у пациентов с хроническим аутоиммунным заболеванием при гипотиреозе.
Лечение пациентов с ОГ является комплексным не только для лечения орбитопатии, но и для контроля функции щитовидной железы (поддержание эутиреоза). Назначаются йод для профилактического применения, пероральные глюкокортикоиды и различные варианты терапии для облегчения симптомов — искусственное слезотечение или мазь, призматические очки для слепоты, сон с высоко поднятой головой, инъекции ботулотоксина в верхнее веко.
Патогенез орбитопатии
Патогенез пучеглазия не совсем ясен. Глаза считаются уязвимыми, потому что глазные мышцы и фибробласты в ретробульбарном пространстве имеют на поверхности человеческие лейкоцитарные антигены класса II, точно такие же, как у пациентов с аутоиммунным заболеванием щитовидной железы. Из-за этих антигенов клетки могут быть антигенпрезентирующими и инициировать аутоиммунный процесс активации Т-лимфоцитов, местных дендритных клеток. Основным антигеном, с помощью которого клетки инициируют дальнейший аутоиммунный процесс, является рецептор тиреотропного гормона (ТТГ).
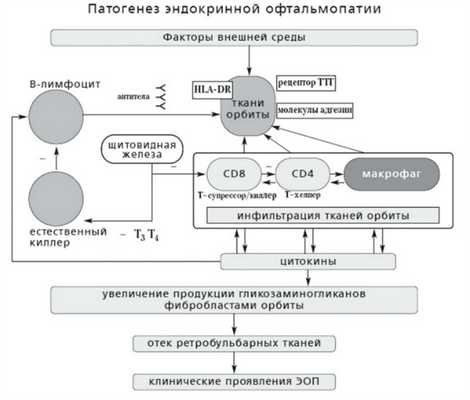
Патогенез эндокринной офтальмопатии
Активированные Т- лимфоциты проникают в мышцы, управляющие глазами, и соединительную ткань за глазом и секретируют цитокины (фактор некроза опухоли альфа, интерферон гамма), которые стимулируют фибробласты производить больше гликозаминогликанов.
Гликозаминогликаны гидрофильны, что приводит к накоплению жидкости в тканях, увеличению объема мышц, которые двигают глаза, и увеличению соединительной и жировой ткани за глазным яблоком. Повышенное внутриглазное давление толкает глазное яблоко вперед, сдавливает зрительный нерв и ухудшает функцию глаза и венозный кровоток из структур глаза. Воспаление длится до 1-2 лет, затем сменяясь соединительной тканью.
Диагностика пациентов с пучеглазием
Орбитопатия — наиболее частая причина проптоза (экзофтальма) у взрослых пациентов. Клинически заболевание обычно легко заподозрить, особенно если оно начинается с тиреотоксикоза (или тиреотоксикоза в анамнезе), двустороннего экзофтала и острого или подострого отека структур вокруг глазного яблока.
- У 40% пациентов глазные симптомы возникают в сочетании с клиникой тиреотоксикоза.
- У 20% больных глазные симптомы впервые появляются до начала тиреотоксикоза.
- У 10% пациентов глазные симптомы развиваются в течение 6 месяцев от начала тиреотоксикоза.
Глазные симптомы у пациентов возникают и после лечения тиреотоксикоза (обычно после лечения радиоактивным йодом). У 10%. у пациентов с ГО может развиться дисфункция щитовидной железы.
Таким образом, больного нужно обследовать, назначая целую группу анализов:
- тироксин;
- LT3 (свободный трийодтиронин);
- тесты на антитела: anti-TTHR (антитела к рецептору TTH);
- анализы на ATPO (антитела к тироидпероксидазе).
В зависимости от стадии и степени воспаления пациент может иметь различные глазные симптомы.
В случае объективного осмотра необходимо исследовать конъюнктиву — оценивается:
- отечность тканей глаза — хемоз;
- наличие видимых мелких кровеносных сосудов конъюнктивы;
- отека тканей вокруг глаза — наличие промежутка между краями верхнего и нижнего века (ретракция века).
Также проводится исследование движений глазного яблока — обычно нарушение конвергенции, дисфункция глазных мышц, зрение часто становится двойным.
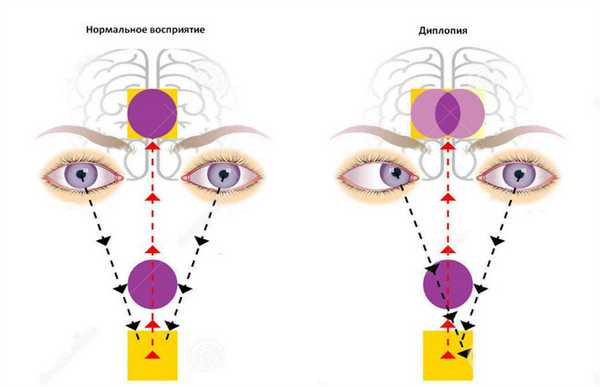
Двойное зрение
Экзофтальмометром измеряется степень проптоза — расстояние от латерального края костного мозга до воображаемой перпендикулярной линии, проведенной в наиболее выступающей точке роговицы.
В случае односторонней офтальмопатии без нарушения функции щитовидной железы в первую очередь целесообразно провести инструментальные исследования, чтобы исключить объемный процесс на орбите. Содержимое глазниц лучше всего визуализируется с помощью магнитно-резонансной томографии (МРТ) глазницы — можно оценить отек движущихся мышц глаза, увеличение ретробульбарной жировой и соединительной ткани, визуализировать зрительный нерв, применяя режим подавления жира, оценить воспалительную активность в глазных лунках.
Когда МРТ невозможна, может быть выполнена компьютерная томография (лучшая визуализация структур костного мозга) или ультразвуковое исследование глаза .
Ультразвуковое исследование глаза
Общие рекомендации по ведению пациентов с пучеглазием
В дополнение к специальному лечению орбитопатии, все пациенты, независимо от тяжести заболевания, должны лечиться от дисфункции щитовидной железы, если таковая имеется. Рекомендуется избегать отягчающих факторов и, при необходимости, оказывать симптоматическое облегчение.
Течение ОГ более тяжелое, если функция щитовидной железы не корректируется, поэтому важно как можно скорее достичь и поддерживать эутиреоз — необходимо лечить как гипотиреоз, так и гипертиреоз.
- назначить высокие дозы тиреостатиков и постепенно снижать их до достижения эутиреоза;
- назначить высокие дозы тиреостатиков, влияющих на гипотиреоз, с добавлением левотироксина;
- выполнить частичную или полную тиреоидэктомию или лучевую терапию.
Однако данных клинических испытаний, подтверждающих, что один метод превосходит другие, недостаточно. В настоящее время считается, что все методы приемлемы. Возможно даже лечение радиоактивным йодом в сочетании с пероральными глюкокортикоидами.
Известно, что у курящих пациентов заболевание протекает более тяжело, и эффективность конкретного лечения у таких больных хуже, чем у некурящих. Влияние курения на степень тяжести орбитопатии также напрямую коррелирует с количеством выкуриваемых сигарет в день. Таким образом, всех пациентов следует проинформировать о влиянии курения на офтальмопатию и побудить их бросить курить.
Средства, облегчающие симптомы орбитопатии Грейвса, включают капли, заменяющие слезотечение или мазь (больше подходит для ночного увлажнения), призматические очки для коррекции бликов, инъекции ботулотоксина в верхнее веко (подходящий выбор для ретракции сетчатки, эти процедуры должны выполняться только специалистом, который есть опыт в этом). Больной должен спать на высокой подушке, носить темные очки.
Специфическое лечение пучеглазия
Тактика лечения орбитопатии определяется 3-мя основными критериями:
- тяжестью заболевания;
- степенью активности заболевания;
- качеством жизни пациента.
Для определения степени тяжести заболевания оцениваются следующие признаки:
- разрыв между краями верхнего и нижнего века;
- отек век;
- покраснение век;
- покраснение вокруг глаз;
- припухлость вокруг глаз;
- наличие воспаления;
- экзофтальмологические факторы;
- субъективное ощущение слепоты у пациента и его степень;
- повреждение мышц, двигающих глаза;
- повреждение роговицы;
- повреждение зрительного нерва.
Лечение, которое будет назначено пациенту, определяется путем оценки степени тяжести заболевания.
При очень сложном пучеглазии (эта форма заболевания описывается как угрожающая зрению) необходимо срочное лечение.
Если обнаружено повреждение зрительного нерва, рекомендуется лечение высокими дозами глюкокортикоидов внутривенно. При отсутствии терапевтического эффекта или неудовлетворительном эффекте в течение 1-2 недель, или когда требуется более быстрый эффект, или когда необходимо избежать побочных реакций на глюкокортикоиды, рекомендуется операция по декомпрессии глаза. Как лечение высокими дозами внутривенных пульсовых глюкокортикоидов, так и декомпрессионная операция должны проводиться в специализированных центрах с таким опытом лечения.
В случае повреждения роговицы следует немедленно начать лечение:
- постоянное увлажнение поверхности роговицы;
- если нужно, может быть проведена временная (до поражения роговицы) блефарорафия (ушивание век) или тарсафафия (ушивание бровей и век);
- если описанные меры не помогают, можно рассмотреть возможность лечения системными глюкокортикоидами или декомпрессионной хирургии глаза;
- при перфорации роговицы или очень глубоком поражении назначается лечение антибиотиками.
Может потребоваться имплантация амниотической мембраны или трансплантация роговицы.
После заживления повреждения роговицы важно принять профилактические меры для предотвращения рецидива. Может потребоваться имплантация амниотической мембраны или трансплантация роговицы.
При средней / тяжелой форме орбитопатии выбор метода лечения зависит от активности заболевания. Расчет индекса активности заболевания основан на том факте, что иммуносупрессивная терапия будет эффективной только при наличии активного заболевания (острое воспаление, классически характеризующееся покраснением, отеком, болью). И неэффективной, если воспаление уже разрешено.
Лечение иммунодепрессантами (если заболевание активно) или хирургическое вмешательство (если заболевание неактивно) также рекомендуется после оценки того, что риски лечения оправдывают неблагоприятное воздействие пучеглазия на повседневную жизнь пациента.
Таким образом, лечение первой линии умеренного / тяжелого активного ГО — это внутривенные глюкокортикоиды. Чтобы избежать побочных реакций на такое лечение, рекомендуется не превышать кумулятивную дозу метилпреднизолона в 8 г на курс лечения.
Другим подходящим лечением для активного ГО средней / тяжелой степени является лучевая терапия. Она разрушает Т- лимфоциты, скопившиеся в ретробульбарной ткани. Этот метод особенно подходит для пациентов, которые испытывают головокружение или ограниченные движения глазного яблока. Не рекомендуется превышать кумулятивную лечебную дозу.
Отмечено, что лучевая терапия может привести к временному ухудшению глазных симптомов. Состояние можно облегчить с помощью глюкокортикоидов. В результате клинических испытаний появляется все больше доказательств того, что лучший эффект активного лечения ОГ средней / тяжелой степени достигается при сочетании лечения пероральными глюкокортикоидами с лучевой терапией.
Если процесс орбитопатии неактивен в умеренной / тяжелой степени, рекомендуется хирургическое лечение. Его можно применять при отсутствии активности заболевания не менее 6 месяцев. Последовательность операций следует тщательно спланировать, их рекомендуется выполнять в следующем порядке: декомпрессия глазниц для коррекции экзофтальма, коррекция бликов, пластика век (возможно, бровей).
При легкой форме пучеглазия специальное лечение не показано, поскольку риски лечения не считаются оправданием потенциальных преимуществ. Специальное лечение может быть назначено, если в результате заболевания значительно ухудшается качество жизни. В этой ситуации очень полезен вопросник о качестве жизни, связанный с заболеванием. Имеются данные о том, что может уменьшить повреждение мягких тканей вокруг глаза и улучшить качество жизни, селен, вводимый при легкой форме пучеглазия (100 мкг 2 м.т. / день, 6 месяцев).
Курс лечения пучеглазия индивидуален и не следует забывать об оценке эффективности лечения. Со временем состояние у некоторых пациентов изменяется незначительно, у некоторых симптоматика неуклонно улучшается или ухудшается, а иногда наблюдается волнообразное течение болезни, когда улучшения и обострения повторяются.
Другие методы лечения OG
Притормозить прогрессирование заболевания у некоторых пациентов с ГО средней / тяжелой степени может Ритуксимаб. Это лекарство для биологической терапии, моноклональное антитело, направленное против антигена CD20 на В-лимфоцитах. Ритуксимаб вызывает гибель В-лимфоцитов, в случае орбитопатии — снижает количество антител к рецепторам ТТГ и количество В-лимфоцитов, накопленных в ретробульбарных тканях.
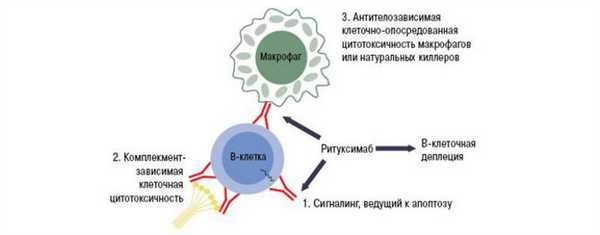
Механизм действия ритуксимаба
Однако одной из наиболее важных побочных реакций при лечении ритуксимабом является иммуносупрессия, что ограничивает применение препарата. Более того, пока нет надежных данных клинических испытаний, подтверждающих эффективность такого лечения. Поэтому лечение ритуксимабом считается целесообразным только у отдельных пациентов с умеренным / тяжелым и недавним началом пучеглазия.
Как возможная альтернатива лечению орбитопатии предлагаются аналоги соматостатина, учитывая, что фибробласты в ретробульбарных тканях имеют рецепторы соматостатина и активность патологии коррелирует с результирующей интенсивностью люминесценции в сцинтиграммах октреотида. Но клиническая эффективность аналогов соматостатина не показала значительного отличия от плацебо в клинических испытаниях и, следовательно, не показана для лечения пучеглазия.
Выводы
Орбитопатия Грейвса — это выражение аутоиммунного процесса, нацеленного на ткани вокруг глазного яблока. Заболевание обычно легко заподозрить клинически, особенно если оно начинается с тиреотоксикоза или тиреотоксикоза в анамнезе, двустороннего экзофтальма и острого или подострого отека структур вокруг глазного яблока.
Специфическое лечение ОГ назначается в зависимости от тяжести и активности заболевания. Очень тяжелое пучеглазие лечится с помощью внутривенных глюкокортикоидов, выполняется декомпрессионная операция, и при обнаружении повреждения роговицы проводится постоянная гидратация поверхности роговицы с соответствующей терапией антибиотиками. Может потребоваться хирургическое вмешательство.
Внутривенное введение глюкокортикоидов является лечением первой линии при умеренном / тяжелом активном заболевании, а декомпрессия или корректирующая операция могут быть выполнены при умеренно / тяжелой неактивной форме.
При легкой форме заболевания специфическое лечение не рекомендуется. Глазные симптомы можно облегчить с помощью общих мер, рекомендуемых при более тяжелых формах заболевания. Необходимо: лечить основное заболевание, отказаться от курения, провести инъекции токсина в верхнее веко, практиковать сон с поднятой головой, носить темные очки.
Читайте также:
