Точки установки лапароскопических портов при операции на кишечнике
Добавил пользователь Евгений Кузнецов Обновлено: 08.01.2026
Положение больного на столе, места введения троакаров, расположение операционной бригады и монитора должны максимально обеспечивать комфортные условия для работы хирурга, качественную визуализацию операционного поля и возможность проведения необходимых манипуляций в зоне вмешательства. Естественно, что на вышеперечисленные установки оказывает влияние состояние конкретного пациента (вес, характер заболевания, наличие послеоперационных рубцов на брюшной стенке и т. д.), привычки оператора и особенности хирургической школы.
Лапароскопические оперативные вмешательства по поводу язвенной болезни ДПК, грыжи пищеводного отверстия диафрагмы и рефлюкс-эзофагита мы обязательно проводим под интубационным наркозом с применением миорелаксантов.
В нашей клинике используется следующее положение больного на операционном столе: пациент лежит на спине, с разведенными и полусогнутыми в коленных суставах ногами.
Головной конец стола приподнимаем до 30-40º. Отведенную левую руку помещаем на подставку, другую руку закрепляем вдоль туловища. Высота операционного стола определяется ростом хирурга и должна обеспечивать его работу без физического напряжения в области плечевого пояса. Спина должна быть прямая, а плечи опущены. Следует отметить, что за счет изменения положения стола на 30 градусов после введения троакаров брюшная стенка дополнительно опускается на 15-20 см.
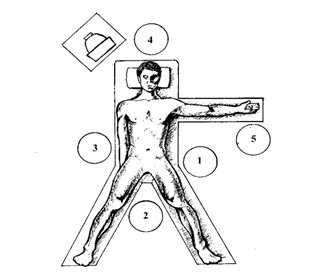
Рис. 1. Положение больного на операционном столе и расположение операционной бригады. 1 - хирург, 2 - 1-й ассистент (видео оператор), 3 - 2-й ассистент, 4 - анестезиолог, 5 - операционная сестра.
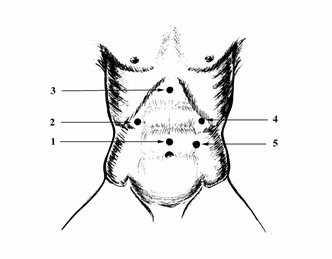
Рис. 2. Оптимальные точки для введения троакаров при выполнении лапароскопической операции при ЯБДПК и ГПОД.
Рис. 3. Положение больного на операционном столе (вид сбоку), положение Фовлера (30°).
Рис 4. Начальный этап мобилизации пищеводно-желудочного перехода, пересечение первых ветвей переднего вагуса и выделение передней стенки пищевода.
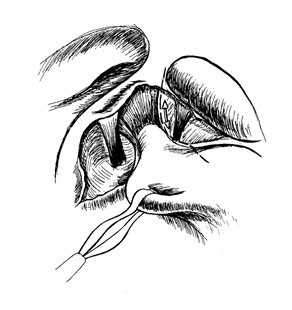
Рис. 5. Рассечение фундально-диафрагмальной связки.
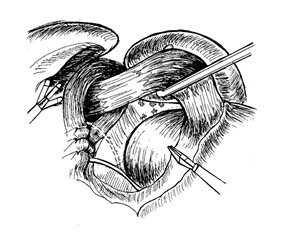
Рис. 6. Ретрактором осуществляется тракция кардиального отдела желудка влево. Этап лигирования коротких желудочных сосудов под пищеводом.

Рис. 7. Этап лапароскопической селективной проксимальной ваготомии - пересечение веточек переднего блуждающего нерва.
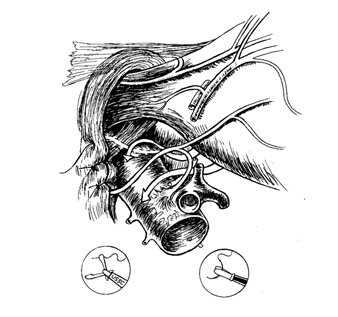
Рис. 8. Лапароскопическое сшивание ножек диафрагмы (крурорафия) и варианты расположения заднего блуждающего нерва после нее.
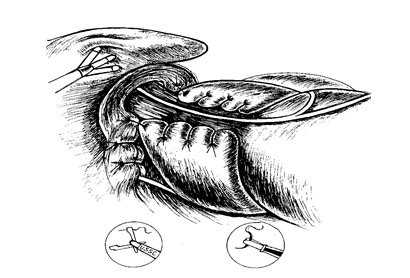
Рис. 9. Окончательный вид физиологической 2-х сторонней фундопликации по Toupet в нашей модификации.
Располагается операционная бригада следующим образом: хирург стоит у левой ноги пациента, 1-й ассистент - между ног, 2-й ассистент - справа от больного, эндоскопическая стойка с оборудованием - у его правого плеча. Анестезиолог и наркозно-дыхательная аппаратура располагаются у головы пациента, а анестезиологическая медицинская сестра с инструментальным столиком - у его левой руки. Операционная сестра и инструментальный столик находятся справа от хирурга, так как это позволяет менять хирургические инструменты без поворота по своей оси, не вовлекая левую руку оператора (Рис.1).
Для четкого разделения рабочей зоны между анестезиологической и операционной сестрами дополнительно натягиваем стерильную простыню, которую фиксируем бельевыми цапками к анестезиологической дуге и стойке для внутривенной инфузии у левой руки пациента.
Такое положение операционной бригады, по нашему мнению, является наиболее удобным, так как глаза хирурга, руки, лапароскоп, зона оперативного вмешательства и монитор находятся на одной линии, а ассистент, манипулируя оптикой, не мешает оператору.
Следует отметить, что максимальные возможности данного расположения операционной бригады проявляются при использовании 30 градусной оптики, способной помочь ассистенту визуализировать объект с любой стороны.
После интубации выполняем обработку операционного поля, границами которого являются среднеподмышечные линии с двух сторон, средняя треть грудины и лонный бугор. Места введения троакаров отграничиваем стерильным бельем и приступаем к соединению аппаратуры с инструментами.
На рисунке показаны оптимальные точки для введения троакаров при выполнении оперативного вмешательства по поводу грыжи пищеводного отверстия диафрагмы (Рис. 2): 1 - 10 мм - для лапароскопа, 2- 10 мм - дополнительный порт для введения печеночного ретрактора, 3 - 5 мм - для введения мягкого зажима (для работы хирурга левой рукой), 4 - 10 мм - основной рабочий порт для введения ножниц, диссектора, клипсаппликатора, иглодержателя, инструмента EndoStitch, инструмента LigaSure, 5 - 10 мм - дополнительный порт для введения инструмента ЭндоБебкок и фиксации желудка и введения пищеводного ретрактора.
Отметим, что места введения троакаров могут варьировать, но всегда остается необходимость отводить печень, натягивать фундальный отдел желудка, вводить оптику и выполнять основные приемы двумя руками. Для решения этих задач необходимо пять доступов.
Оперативное вмешательство начинаем с инсуфляции углекислого газа в брюшную полость через иглу Вереша, введенную в параумбиликальную область. Скорость подачи газа - 1,5 литра в минуту, давление - 12 мм. рт. ст. Критерием проникновения иглы в брюшную полость является характерный щелчок выскочившей защиты. Для точного определения положения иглы Вереша всегда выполняем водную пробу. Затем вводим первый 10 мм троакар(стальной «Karl Storz»). Для большей безопасности мы фиксируем брюшную стенку в области прокола двумя бельевыми «цапками». Направление введения троакара должно быть строго вертикальным. Очень важно, чтобы стилет у первого из них имел пирамидальную, а не коническую форму, в этом случае при фиксированной брюшной стенке ткани легко рассекаются и отсутствует не контролируемый эффект «провала» в брюшную полость. С целью контроля за «провалом» в брюшную полость следует также вдоль троакара выпрямлять указательный палец правой руки, который будет ограничивать продвижение стилета по тканям брюшной стенки.
При выполнении симультанных операций на верхнем этаже брюшной полости, связанных с извлечением органов (например - лапароскопическая холецистэктомия с фундопликацией и ваготомией), мы используем поперечный разрез по вворачивающемуся краю пупка длиной 10 мм для возможного его расширения до необходимого размера с соблюдением элементов косметики. Если оперативное вмешательство не сопровождается извлечением органов из брюшной полости, более удобным будет выполнение разреза для введения оптики на 4-5 см выше пупка по средней линии (особенно это важно у высоких пациентов с большим расстоянием от мечевидного отростка до пупка).
У пациентов, перенесших ранее лапаротомные оперативные вмешательства, как правило, органы брюшной полости оказываются припаянными к послеоперационному рубцу, что может сопровождаться их повреждением при введении иглы Вереша или первого троакара. В этой ситуации мы обычно используем оптический троакар VISIPORT компании Covidien (Швейцария), который позволяет под контролем зрения строго дозировано (по 1 мм) послойно рассекать ткани брюшной стенки. При отсутствии подобного инструмента может быть использована методика «открытой» лапароскопии по Hasson.
После введения лапароскопа в брюшную полость выполняем обзорную лапароскопию для получения дополнительной информации о состоянии органов брюшной полости и наличия спаечного процесса. Для улучшения изображения торцевой конец лапароскопа должен быть согрет до 50 градусов в стерильном физиологическом растворе или обработан салфеткой, смоченной специальным составом Anti-Fog (KARL STORZ). Далее операционный стол переводим в положение Фовлера (30°), в желудок вводим толстый зонд диаметром - 20 - 24 мм (Рис. 3).
Под контролем зрения устанавливаем остальные троакары, начиная их введение с левого подреберья по часовой стрелке. После установки второго троакара в брюшную полость помещаем печеночный ретрактор, которым отводим круглую связку печени вправо для облегчения введения третьего, 5- мм троакара. Затем поочередно вводим четвертый и пятый 10 мм троакары, обязательно учитывая ход крупных сосудов для профилактики их повреждения.
Как правило, для работы в первом и четвертом доступах мы используем стальные троакары «Karl Storz», во втором и пятом - пластиковые троакары Covidien (Швейцария). В третьем доступе очень удобен пластиковый троакар компании Covidien (Швейцария) с фиксатором.
При введении инструментов следует соблюдать ряд рекомендаций. Выполнение лапароскопической СПВ и фундопликации осуществляется главным образом через два основных манипуляционных троакара - в третьем и четвертом доступах. Операционный угол между двумя инструментами, введенными через них, при сближении в области абдоминального отдела пищевода должен быть не менее 80 - 70 градусов. Направление троакаров при их введении - строго радиальное по отношению к зоне оперативного действия. Это, с одной стороны, облегчит подведение инструментов «вслепую» к месту операции, а с другой - не будет изменять тактильное ощущение хирурга, связанное с приложением усилия по коррекции неправильного выбранного угла.
После установки троакаров через второй доступ мы вводим печеночный ретрактор и отводим левую долю печени вверх и вправо. Через пятый доступ инструментом «ЭндоБебкокк» захватываем фундальный отдел желудка. В третий доступ вводим мягкий 5 мм зажим, а через 4 - 5 мм ножницы. Использование пластиковых 5 мм мягких зажимов с фиксатором значительно облегчает работу на тонких структурах малого сальника, так как, с одной стороны, эти инструменты имеют удобные кремальеры для экстренного захвата кровоточащего сосуда, а с другой - их малый вес позволяет выпустить инструмент из рук, не боясь отрыва тканей в зоне оперативного вмешательства. В области малого сальника очень удобно использование изогнутых пластиковых ножниц компании Covidien (Швейцария), так как длина бранш соответствует размеру выделенных тканей под средне-большие клипсы или инструмент LigaSure, а их кривизна позволяет выделять сосуды без применения диссектора.
Для обеспечения легкой и безопасной работы в области пищеводно-желудочного перехода и малого сальника необходимо адекватное натяжение тканей, которое создается инструментом «Эндобебкокк» через пятый доступ.
В отличие от техники селективной проксимальной ваготомии, выполняемой открытым способом, когда скелетирование малой кривизны желудка начинается от «вороньей лапки» нерва Летарже и продолжается вверх, при лапароскопической ваготомии мобилизацию малой кривизны желудка лучше начинать с пищевода и продолжать вниз (Рис. 4).
В этом случае структуры, подлежащие лигированию и пересечению, постоянно находятся в состоянии натяжения. Пищевод мобилизуем медиально от левого блуждающего нерва с использованием LigaSure Atlas, и после вскрытия сальниковой сумки и рассечения фундально-диафрагмальной связки (рис. 5) под пищеводом ретрактором осуществляем тракцию кардиального отдела желудка влево (Рис. 6).
Этим приемом мы значительно облегчаем манипуляции в области малого сальника. Далее сверху вниз послойно выполняем диссекцию нервно-сосудистых образований между левым блуждающим нервом и желудочной стенкой, используя мягкий 5 мм зажим, ножницы и 5 мм аппарата LigaSure (Рис.7).
По мере продвижения к «вороньей лапке» для сохранения натяжения структур в зоне оперативного действия, зажим «ЭндоБебкокк» передвигаем вниз по малой кривизне. Отсутствие клипс, надежный гемостаз и одновременное рассечение тканей на этом этапе делают преимущества аппарата LigaSure очевидными.
После окончания селективной проксимальной ваготомии выполняем диссекцию тканей в области правой и левой диафрагмальных ножек, крурорафию (Рис. 8) и фундопликацию (Рис. 9).
Ушивание десерозированного участка малой кривизны желудка не целесообразно. Далее проводим смену желудочных зондов и лаваж брюшной полости стерильным физиологическим раствором. Мы крайне редко оставляем страховой дренаж, так как в этом нет необходимости. Раны брюшной стенки ушиваем послойно иглой Endo close.
Список работ опубликованных профессором Пучковым К.В. по теме хирургия желудка и двенадцатиперстной кишки
Отзывы пациентов
06.07.2020 09:25:00 Владимир и Ольга Литовченко
Точки установки лапароскопических портов при операции на кишечнике
ФГБУ ГНЦ колопроктологии Минздрава РФ, Москва, Россия
Единый лапароскопический доступ в колоректальной хирургии
Журнал: Эндоскопическая хирургия. 2015;21(2): 53‑58
В последнее время лапароскопическая хирургия широко применяется в лечении заболеваний толстой кишки. Исследования показали хорошие краткосрочные результаты лапароскопического подхода в колоректальной хирургии, а именно, уменьшение послеоперационного болевого синдрома, ускорение восстановления функции желудочно-кишечного тракта, уменьшение длительности пребывания больных в стационаре в послеоперационный период, снижение частоты возникновения раневых осложнений [1, 2]. Дальнейшее развитие лапароскопической хирургии было продиктовано стремлением уменьшить операционную травму, связанную с необходимостью выполнения нескольких разрезов передней брюшной стенки для введения портов и извлечения удаленного препарата. Установлено, что уменьшение количества разрезов сказывается не только на косметическом аспекте, но и ведет к снижению болевого синдрома в послеоперационном периоде, уменьшению риска развития осложнений в области послеоперационной раны: нагноения, формирования послеоперационных грыж, а также спаек в брюшной полости [3].
В прошедшем десятилетии основным трендом в развитии оперативных методик, безусловно, являлся принцип «хирургии без шрамов», который привел к появлению совершенно новых оперативных методик — хирургии через естественные отверстия организма (Natural Orifise Transluminal Endoscopic Surgery — NOTES) и вмешательств из единого лапароскопического доступа (ЕДЛ; singl-incision laparoscopic surgery — SILS) [4]. Несмотря на всю привлекательность, технология NOTES технически сложна, обусловливает необходимость наличия дорогостоящего специализированного оборудования, что в настоящий момент практически исключает возможность применения ее в повседневной практике.
Освоение новой методики в колопроктологии начиналось с операций по поводу доброкачественных заболеваний кишечника. F. Remzi и соавт. из кливлендской клиники в 2008 г. была выполнена правосторонняя гемиколэктомия пациентке в возрасте 67 лет по поводу полипа слепой кишки. Доступ был осуществлен через трансумбиликальный разрез длиной 3,5 см, в который был установлен порт. Авторы отметили несомненную важность наличия навыков выполнения стандартных лапароскопических операций и использования специальных устройств и инструментов для успешного выполнения операций через единый доступ (ЕД) [8].
Со временем в научной литературе все чаще стали появляться описания случаев использования ЕД в хирургии толстой кишки, в том числе в России [9]. Как сообщается в публикациях, косметический эффект — одно из наиболее значительных достижений новой методики [10, 11]. В другом исследовании D. Ramos-Valadez [12] была продемонстрирована безопасность и экономическая эффективность правосторонней гемиколэктомии из единого лапароскопического доступа (ЕЛД). D. Gandhi [13] установил, что ЕЛД является реальной альтернативой методу ручной ассистенции. Продолжительность операций в группе ЕД оказалась больше, но, по мнению авторов, компенсировалась меньшей длиной разреза передней брюшной стенки, снижением болевого синдрома после операции и уменьшением длительности пребывания больных в стационаре в послеоперационный период.
Несмотря на положительные результаты, продемонстрированные авторами, сразу стало ясно, что использование ЕЛД связано с рядом проблем. В отличие от стандартной мультипортовой техники хирургического вмешательства использование ЕД сопряжено со сложностями при манипуляции прямыми инструментами параллельно с лапароскопом. Кроме того, происходит значительное уменьшение амплитуды движения инструментов хирурга, усложняется работа ассистента с камерой. Для преодоления этих трудностей был создан специальный хирургический инструментарий и порты доступа. Ригидные изогнутые устройства и инструменты с изменяемым углом наклона рабочей части были призваны преодолеть одну из основных проблем однопортовой лапароскопической хирургии, возникающую при работе в условиях параллельной плоскости — недостаточную триангуляцию, т. е. невозможность расположить инструменты и камеру достаточно широко для осуществления адекватной тракции тканей и выполнения диссекции. На этапе внедрения новой методики такие проблемы решались при помощи установки дополнительного троакара, реже — путем подвешивания кишки к передней брюшной стенке при помощи трансабдоминальных швов или фиксирующего магнита. В литературе появился новый термин «SILS+», при этом количество знаков плюс обозначало количество использованных дополнительных троакаров [14]. В последующем накопление опыта позволило отказаться от введения дополнительных троакаров.
Операции из ЕД получили распространение при лечении доброкачественных заболеваний кишечника. Это связано, прежде всего, с отсутствием необходимости соблюдения принципов онкологического радикализма. В журнале Surgical Endoscopy были опубликованы результаты 10 колопроктэктомий с формированием резервуарно-анального анастомоза у пациентов с язвенным колитом (ЯК), выполненных с 2009 по 2010 г. Длительность операции составила в среднем 185 мин. Ни в одном случае не потребовалось конверсии доступа или установки дополнительного троакара. Осложнение возникло у одного пациента, в виде эмфиземы подкожной клетчатки, сопровождавшейся повышением температуры тела. В последующем у 9 пациентов илеостома была закрыта. Средняя частота дефекации у этих пациентов составила 4 за сутки, включая 1 раз в течение ночи. Авторы сделали вывод, что выполнение операций при ЯК с использованием новой методики безопасно, позволяет достичь хороших функциональных результатов. В отечественной литературе также появляются описания единичных случаев выполнения подобных вмешательств [15]. В 2013 г. в журнале «Колопроктология» опубликована статья об успешном применении ЕД в многоэтапном хирургическом лечении больного, страдающего гормонорезистентной формой ЯК [16]. Первым этапом была выполнена колэктомия с установкой порта ЕД в правой подвздошной области на месте будущей превентивной илеостомы. Вторым этапом через 6 мес была удалена оставшаяся часть прямой кишки, сформирован резервуарно-анальный аппаратный анастомоз. Как и во время первой операции, порт ЕД был установлен в правой подвздошной области на месте ранее выведенной илеостомы, установки дополнительных троакаров не потребовалось. Через 3 мес илеостома была закрыта.
Помимо ЯК технология ЕЛД используется в лечении пациентов с болезнью Крона, при локализации поражения в илеоцекальном отделе кишечника. Так, K. Maeda (2012) сообщил о выполнении 11 илеоцекальных резекций из ЕЛД. Среднее время операции, кровопотеря и частота конверсии не отличались от результатов мультипортовых операций. Несмотря на приемлемые результаты, полученные у тщательно подобранной группы пациентов, и лучший по сравнению с мультипортовыми операциями косметический эффект, авторы считают необходимым проведение дальнейших сравнительных исследований [17].
Разработка современных портов ЕЛД с возможностью введения в брюшную полость до 4 манипуляторов, новых инструментов расширила спектр выполняемых хирургических вмешательств [18]. В статье, опубликованной в 2013 г., проанализировано 20 лапароскопических резекций из ЕД, выполненных по поводу осложненного дивертикулеза, по сравнению с таким же количеством операций, выполненных мультипортовым лапароскопическим методом. Продолжительность операций, частота конверсии, величина интраоперационной кровопотери, осложнения в области послеоперационной раны в обеих группах были схожими. Средняя длина кожного разреза в обеих группах оказалась одинаковой — 5 см. У пациентов, оперированных через ЕЛД, отмечено уменьшение послеоперационного болевого синдрома и продолжительности нахождения в стационаре [19].
Эффективность традиционной лапароскопической хирургии в лечении онкологических заболеваний толстой кишки в настоящее время ни у кого не вызывает сомнений [21, 22]. В то же время хирургия ЕД, с одной стороны, способна снизить операционную травму, с другой, технически более сложная, что может отразиться на качестве выполняемой резекции. Для того чтобы понять, оправдано ли использование технологии ЕЛД при онкологических операциях, проведены исследования, целью которых явилось в том числе изучение параметров, характеризующих качество удаленного препарата. Так, в клинике Леверкузена (Германия) проанализированы результаты 507 резекций толстой кишки с использованием технологии ЕД, 87 из которых были выполнены по поводу рака прямой или ободочной кишки [23]. Среднее количество лимфатических узлов (ЛУ) в удаленных препаратах составило 18, что сопоставимо и даже превышает результаты традиционной лапароскопической хирургии, приведенные в исследованиях COLOR (10 ЛУ) [24], CLASSIC (12 ЛУ) [2], COLOR II (13 ЛУ) [22]. Таким образом, по мнению авторов, метод ЕД может быть применен в хирургии рака толстой кишки.
P. Bucher в 2008 г. впервые сообщил о выполнении правосторонней гемиколэктомии из ЕД у пациента с раком восходящей ободочной [25]. В 2012 г. в статье, опубликованной в журнале Colorectal Disease [26], продемонстрированы результаты 25 правосторонних гемиколэктомий, выполненных из ЕД, по поводу злокачественных новообразований правой половины толстой кишки. Длительность операции составила в среднем 110 мин, длина кожного разреза 35 мм. Во всех случаях осложнений не наблюдалось, резекция была осуществлена в объеме R0, среднее количество ЛУ в препарате — 13,5. Авторы пришли к выводу, что выполнение правосторонней гемиколэктомии из ЕЛД опытным лапароскопическим хирургом безопасно и осуществимо.
Технология ЕЛД применяется также при локализации опухоли в левой половине ободочной кишки. В сравнительном проспективном исследовании, выполненном D. Ramos-Valadez (2012), приведены результаты 20 сигмоидэктомий по сравнению с таким же количеством мультипортовых вмешательств [27]. Техника при традиционном лапароскопическом методе отличалась только по числу установленных троакаров. Мобилизация кишки выполнялась в медиально-латеральном направлении. В обеих группах конверсии не было. В одном случае в группе ЕД потребовалась установка 2 дополнительных троакаров. Не различались продолжительность операций и частота послеоперационных осложнений, среднее число удаленных лимфатических узлов; не было различий по продолжительности послеоперационного периода. Таким образом, по мнению авторов, методика ЕЛД при операциях на левой половине толстой кишки не уступает традиционной лапароскопической, в большинстве случаев позволяет избежать установки дополнительных троакаров, не влияя при этом на продолжительность пребывания пациента в стационаре и частоту осложнений.
В 2011 г. впервые выполнена трансвагинальная резекция сигмовидной кишки через ЕЛД. Порт доступа был установлен через разрез в задней стенке влагалища. После мобилизации сигмовидной кишки, выделения и пересечения сосудов, брыжейки и самой сигмовидной кишки препарат был извлечен через разрез во влагалище. Произведено его отсечение по запланированной проксимальной границе резекции с введением головки сшивающего аппарата, сформирован аппаратный сигморектальный анастомоз. Эта операция стала возможна благодаря освоению навыков и накоплению опыта однопортовой хирургии, которые были использованы в принципиально новой гибридной оперативной методике — с использованием естественных отверстий организма [28].
Наиболее сложной и спорной областью применения ЕД в колоректальной хирургии, несомненно, являются операции при низкой локализации опухоли прямой кишки. В мировой литературе не так много публикаций по этой теме [31]. В Scandinavian Journal of Surgery в 2013 г. опубликованы непосредственные результаты 25 операций, выполненных с использованием методики ЕЛД при раке прямой кишки [32]. В 4 операциях был использован трансумбиликальный доступ. В остальных случаях в месте предполагаемого выведения стомы. При исследовании макропрепарата установлено, что количество удаленных ЛУ составило в среднем 13, границы резекции во всех случаях были соблюдены адекватные. Выделение мезоректума признано полным или почти полным в 92% случаев. Авторы заключают, что выполнение операций с использованием ЕЛД безопасно и осуществимо опытным хирургом у тщательно подобранной группы пациентов. При этом для хирурга процедура сложна и утомительна, занимает гораздо больше времени в отличие от традиционной лапароскопической техники.
Прошло уже более четверти века с момента выполнения первых лапароскопических операций. За этот период метод вошел в арсенал хирургов практически всех специальностей, в том числе колопроктологов. Технология ЕЛД также получила широкое распространение при операциях на кишечнике, однако ее место в современной колоректальной хирургии в настоящий момент окончательно не определено.
Использование ЕЛД требует повторного обучения даже опытных лапароскопических хирургов из-за того, что навыки, необходимые для выполнения операций по технологии ЕД, значительно отличаются от тех, что используются в мультипортовой хирургии. Манипулирование прямыми инструментами параллельно с лапароскопом через один небольшой разрез уменьшает свободу движений для хирурга и затрудняет работу ассистента с камерой. Движение камерой часто приводит к непреднамеренному перемещению смежного инструмента, затрудняет выполнение даже относительно простой операции, а также может негативно повлиять на безопасность вмешательства. Кроме того, отсутствие в брюшной полости триангуляции приводит к недостаточной тракции и контртракции кишки, что ухудшает визуализацию, ориентирование и, следовательно, усложняет выполнение операции.
Вместе с тем технология ЕЛД привнесла значительные изменения в хирургию прямой кишки, одним из которых следует назвать появление трансанальных миниинвазивных вмешательств (TAMIS), благодаря которым появился новый вид оперативного вмешательства — ретроградная проктэктомия. Этот интенсивно развивающийся метод хирургического лечения был изначально использован для удаления ворсинчатых образований и полипов прямой кишки. Техника выполнения операций не отличалась от методики, используемой при трансанальных эндоскопических вмешательствах (TEM) и предполагала удаление опухоли с пересечением всей толщи кишечной стенки в пределах здоровой ткани с последующим интракорпоральным ушиванием образовавшегося дефекта [33]. Возможность применения TAMIS в хирургии прямой кишки была подтверждена другими исследователями, которые первоначально планировали использовать новый метод для выполнения трансанальных NOTES [34, 35]. Несмотря на интригующую оригинальность метода техника трансанальных NOTES была связана с рядом серьезных проблем, таких как необходимость использования гибких оптических устройств для визуализации анатомических образований, располагающихся выше уровня промонториума, замене в ходе операции ректоскопов на более длинные, а при наличии у больного узкого таза или большого объема удаляемой кишки, возникали трудности во время экстракции препарата [36]. В работах A. Lacy из университетской клиники Барселоны и S. Atallah из клиники Флориды, опубликованных в 2013 г., представлены результаты лечения в общей сложности сорока пациентов, у которых был применен гибридный подход, заключающийся в комбинации трансанального выделения прямой кишки и трансабдоминальной мобилизации проксимальных отделов толстой кишки [35, 37]. По мнению A. Lacy, выделение прямой кишки «снизу» намного легче. Авторы сходятся во мнении, что трансанальная TME является подходящим способом для выполнения онкологических резекций при раке прямой кишки; кроме того, этому методу следует отдавать предпочтение у больных с узким тазом и абдоминальным ожирением [35].
Резюмируя проведенный анализ литературы, можно отметить, что в мире в настоящее время все большее предпочтение отдается методикам, развивающимся в направлении уменьшения операционной травмы, повышения косметического эффекта операции, обеспечения минимальной потери качества жизни. Большие надежды хирургов во всем мире возлагались на новую, в чем-то даже революционную методику. Однако накопление опыта и проведенные сравнительные исследования позволяют утверждать, что никаких преимуществ, которые стоили бы усилий хирурга, выполняющего операцию из ЕЛД, эта операция не демонстрирует. Однако технология ЕЛД привнесла немало полезного в хирургию XXI века: продемонстрировала возможность использования ограниченного доступа в организм человека (через влагалище или задний проход), на основе этого метода родилось совершенно новое хирургическое вмешательство — ретроградная проктэктомия. Кроме того, именно технология ЕЛД побудила инженеров и хирургов к созданию новых инструментов и оптических устройств — меньшего размера и с изгибающейся рабочей частью.
Скорее всего, в том виде, в каком она существует сейчас, технология ЕЛД не получит широкого распространения в колопроктологии. Однако этот метод открыл целое направление в современной хирургии, изменил технику хирургических вмешательств, наше мировоззрение, в частности о необходимости ушивания брыжейки кишки и дренирования брюшной полости, дал толчок к развитию принципиально нового инструментария.
Таким образом, можно констатировать, что внедрение технологии ЕЛД в клиническую практику — это одно из по-настоящему значимых событий в эволюции хирургии конца XX — начала XXI века.
Резекция толстой кишки лапароскопическим методом (Laparoscopic Colectomy Surgery)
Операция по удалению - частичному или полному - толстой кишки производится с целью удаления первичных или вторичных раковых опухолей (рака, который начался в толстом кишечнике, или метастазов, которые распространились из другого органа, соответственно), в связи с воспалительным (Inflammatory Bowel Disease) или каким-либо другим заболеванием кишечника, нарушением кровоснабжения кишечника (ишемией), кровотечением или кишечной непроходимостью.
В большинстве случаев операция будет выполнена в рамках лечения рака толстой кишки, который на сегодняшний день считается вторым по распространенности злокачественным онкологическим заболеванием среди мужчин и женщин. Средний возраст больных раком толстой кишки - 70 лет, однако частота заболевания данной болезнью увеличивается с возрастом. Люди, страдающие воспалительными заболеваниями кишечника (например, колитом или болезнью Крона), страдающие от полипов или имеющие историю заболевания раком толстой кишки в семье, находятся в группе повышенного риска для данного заболевания.
Проявления болезни зависят от местоположения опухоли в толстой кишке, и они могут включать в себя: кровотечение, кровь в кале, понос или запор (иногда оба этих явления возникают у одного и того же пациента попеременно), непроходимость кишечника, образование отверстия в стенке кишечника (перфорация), необъяснимое снижение веса (вследствие нарушения способности толстой кишки к всасыванию питательных веществ), боли в животе и спазмы внизу живота, общее плохое самочувствие.
Общепринятое направление лечения рака толстой кишки включает в себя операцию по удалению опухоли. Объем операции, а также необходимость в удалении толстой кишки будут установлены в соответствии с размером опухоли и ее местоположением в толстой кишке. Можно выполнить полное или частичное удаление толстой кишки. При частичном удалении будет удалена только та ее часть, в которой расположена опухоль. В большинстве случаев будет удалена сигмовидная кишка или слепая кишка (цекум). Сигмовидная кишка - это заключительная часть толстой кишки, ведущая в прямую кишку (ректум). Удаление этой части называется сигмоидэктомией (Sigmoidectomy). Слепая кишка - это верхняя часть толстой кишки, соединяющая ее с тонкой кишкой. От слепой кишки также отходит аппендикс. Удаление слепой кишки называется цекэктомией (Cecectomy).
Когда речь идет об особенно крупной или труднодоступной опухоли, пациенту будет предложено провести нео-адъювантную терапию (neo-adjuvant therapy) -предоперационное лечение, которое в большинстве случаев включает в себя облучение (радиотерапию) в сочетании с химиотерапией. Целью этого лечения является уменьшение размеров опухоли перед операцией, сокращение объема самой операции, а иногда и объема необходимого удаления кишки.
Как на практике выполняется данная процедура?
Операция полного или частичного удаления толстой кишки будет проводиться под общим наркозом, суть которого заключается в том, что пациент спит глубоким сном, не чувствует никакой боли и не осознает своего состояния. Можно выполнять операцию полного или частичного удаления толстой кишки открытым методом, включающим в себя разрез брюшной стенки, или лапароскопическим методом. Вид и объем операции будет установлен в соответствии с размерами опухоли, ее характеристиками и местоположением в кишечнике.
Если принято решение о проведении лапароскопической операции, хирург выполнит 2-3 маленьких разреза на животе, через которые будут введены операционные инструменты. Лапароскоп, на конце которого расположена камера, будет введен через дополнительное отверстие в районе пупка. За операционным полем можно будет наблюдать во время операции при помощи экрана, находящегося в операционной комнате. Для того чтобы облегчить доступ к толстой кишке, хирург введет в брюшную полость углекислый газ (как бы надует живот). Толстая кишка будет отключена от кровоснабжения и удалена.
Подобно операции, производимой открытым способом, в конце лапароскопической операции также будет принято решение о выполнении илеостомии или колостомии, в зависимости от состояния пациента.
По окончании операции разрезы будут зашиты или заклеены и на них наложат повязки.
При всех достоинствах лапароскопического метода, среди которых: меньшие разрезы и, соответственно, меньшее количество рубцов и болевых ощущений после операции, а также более короткие сроки госпитализации и восстановления сил после операции, - эта операция не подходит для любого случая и для любого пациента. Пациенты, страдающие тяжелым ожирением, а также пациенты, которые страдали в прошлом от спаек в тазовой области (вследствие болезни, операций или инфекции), не подходят для этих операций.
В некоторых случаях в ходе лапароскопической операции может возникнуть необходимость перевести операцию в открытую, смысл которой заключается в выполнении разреза больших размеров. Решение об изменении типа операции на открытую будет принято непосредственно в ходе операции - в зависимости от состояния пациента и если хирург посчитает это необходимым (например, если возникло массивное кровотечение или если доступ к толстой кишке лапароскопическим методом затруднен).
Какой наркоз будет использоваться в ходе проведения операции?
Сколько времени обычно длится операция?
Как подготовиться к операции и госпитализации в больницу?
Для того чтобы определить точное местоположение и объем опухоли, необходимо пройти полную колоноскопию или виртуальную колоноскопию (включающую в себя компьютерную томографию (КТ) кишки после приема внутрь контрастного вещества и после выполнения бариевой клизмы с контрастным веществом), а также МРТ пищеварительной системы или КТ кишечника.
Если существует подозрение на метастазы в других органах тела и на то, что в процесс вовлечены лимфатические узлы, от пациента потребуется пройти дополнительные обследования методами визуализации - например, ПЭТ-КТ.
Необходимо выполнить анализы крови, которые включают в себя общий и биохимический анализ крови, анализ крови на свертываемость.
Лицам старше 40 лет необходимо выполнить и представить результаты ЭКГ-исследования.
Перед операцией требуется провести подготовку кишечника при помощи слабительных препаратов. Целью подготовки является опорожнение кишечника от кала и бактерий.
Непосредственно в день операции, за 6 часов до ее начала, нужно полностью отказаться от приема пищи и воды.
Что произойдет после операции?
По окончании операции пациента приблизительно на два часа переведут в послеоперационное отделение, для того чтобы обеспечить ему медленное и безопасное пробуждение после операции. После этого пациента переведут в другое отделение, в котором ему помогут встать с кровати или сесть в кресло. Данная операция требует госпитализации в течение ок. 7 дней.
В первые дни после операции пациент может страдать от болей, которые можно облегчить лекарственными средствами, в зависимости от желания и потребностей пациента.
Сразу после операции пациенту будет предложена мягкая пища. Примерно через четыре дня после операции можно снова начать употреблять обычную пищу. Рекомендуется как можно раньше начать вставать с кровати и ходить, для того чтобы избежать респираторных осложнений.
Что произойдет после выписки из больницы?
В течение 6-8 недель после операции рекомендуется воздерживаться от физической нагрузки и половых контактов. В том случае, если пациент страдает от слабости или головокружения, рекомендуется воздерживаться от вождения автомобиля.
Необходимо тщательно следить за тем, чтобы послеоперационная область оставалась сухой и чистой.
Медсестра, работающая в отделении, проверит у пациентов, перенесших илеостомию или колостомию, состояние стом и калоприемников на протяжении периода госпитализации и проинструктирует пациента на предмет самостоятельного ухода за стомой после выписки домой. В случае если была проведена илеостомия, пациенту понадобится через некоторое время (от нескольких недель до нескольких месяцев) пройти дополнительную операцию с целью соединения оставшихся концов кишки.
Примерно через две недели после операции пациент будет приглашен к хирургу в клинику при отделении на контрольный визит и для снятия швов. Пациента направят в онкологическую клинику для продолжения лечения.
В случае любого повышения температуры тела выше 38 градусов можно позвонить в отделение и проконсультироваться с дежурным врачом. В случае необходимости нужно обратиться в приемное отделение, с тем чтобы продолжить выяснение состояния.
Первое хирургическое отделение Дорожной клинической больницы на ст. Ростов-главный, Ростов-на-Дону
ГБОУ ВПО «МГМСУ им. А.И. Евдокимова» Минздрава России, Москва, Россия
ГБУ РО «Онкодиспансер», Ростов-на-Дону, Россия
Кабардино-Балкарский государственный университет им. Х.М. Бербекова, Нальчик, Россия
НУЗ «ДКБ на станции Ростов-Главный» ОАО РЖД, Ростов-на-Дону, Россия
Использование лапароскопического мануально-ассистированного комбинированного доступа при операциях на левой половине ободочной и на прямой кишке у пациентов со сложной хирургической анатомией
Журнал: Эндоскопическая хирургия. 2016;22(1): 4‑11
Возможность лапароскопического метода удаления опухолей левой половины толстого кишечника затрудняет сложная хирургическая анатомия: ожирение, узкий таз, низкая локализация опухоли. Нами разработана методика с использованием лапароскопического мануально-ассистированного комбинированного бокового и спинального доступа. В статье дано подробное описание методики. Представлены результаты 71 операции по поводу опухолей левой половины толстого кишечника и прямой кишки со сложной анатомией данной области. Предложенная методика минимально травматична, что выражается в низкой кровопотере, незначительном повышении гормонов стресса после операции, уменьшении сроков восстановления моторно-эвакуаторной функции кишечника.
Рак толстой кишки занимает 4-е место в мире в структуре онкологической заболеваемости. Ежегодно в мире регистрируется более 800 тыс. вновь выявленных случаев колоректального рака [1]. Заболеваемость колоректальным раком в настоящее время составляет 56,4-58,0 на 100 тыс. населения [1]. Пятилетняя выживаемость при данном заболевании невысока - примерно 60% в развитых странах и менее 40% в государствах с ограниченными ресурсами [1, 2].
В последние годы стремительно развивается хирургическая колопроктология. Отмечается тенденция расширения показаний к сфинктерсохраняющим операциям, трансанальному удалению ранних форм рака прямой кишки, выполнению тотальной мезоректумэктомии для лечения больных раком средне- и нижнеампулярного отделов; распространяется внедрение лапароскопических технологий в колоректальную хирургию.
Лапароскопическая техника позволяет выполнять операции при различной патологии толстой кишки, в том числе и при раке. С технических позиций лапароскопические операции не разрушают сложившихся онкологических принципов при лечении начальных форм рака. Работа на тканях при большом увеличении позволяет дифференцировать тончайшие структуры и при высоком уровне визуального контроля проводить выделение кишки с опухолью четко в межфасциальных пространствах, выявлять и удалять лимфатические узлы [1, 3].
К бесспорным преимуществам малоинвазивного вмешательства относятся: отсутствие широких разрезов брюшной стенки; хороший визуальный контроль; тщательная лимфодиссекция и более точные манипуляции с микроструктурами; меньшая травматичность; уменьшение послеоперационного болевого синдрома; снижение кровопотери и возможность ее точного учета; качественно лучшая реабилитация пациентов; улучшение косметических результатов [1].
По мере увеличения числа выполенных лапароскопических операций при колоректальном раке были получены данные об отдаленных результатах: при соблюдении онкологических принципов хирургии не выявлены достоверные различия между показателями выживаемости, частотой отдаленных метастазов и качеством жизни после лапароскопических и открытых вмешательств [1, 4-10]. Многоцентровые исследования демонстрируют эффективность лапароскопических вмешательств, сопоставимую с традиционной «открытой» хирургией на основании оценки отдаленных результатов и уровня качества жизни [6].
Однако не во всех случаях возможно выполнить хирургическое вмешательство лапароскопическим методом. К таким случаям относят: ожирение, когда индекс массы тела (ИМТ) более 30 кг/м 2 ; узкий таз, особенно у мужчин; низкая локализация опухоли - до 10 см от входа в анальный канал; значительное укорочение брыжейки тонкого и толстого кишечника; высокая фиксация селезеночного изгиба ободочной кишки и интимная фиксация к селезенке; плохая подготовка кишечника при частичной кишечной непроходимости; большие размеры опухоли; выраженное перифокальное воспаление.
По причине перечисленных ограничений нарастает необходимость в разработке новых методик, применяемых при сложной хирургической анатомии у пациентов с опухолями левой половины толстого кишечника и прямой кишки.
В нашей клинике для пациентов со сложной хирургической анатомией разработана гибридная полипозиционная мануально-ассистированная техника, которая представляет собой поэтапное использование традиционного лапароскопического метода в боковой позиции и мануально-ассистированной техники в спинальной позиции.
Преимуществами такого подхода являются:
- обеспечение тактильной чувствительности;
- улучшение контроля над сосудами и значимыми анатомическими структурами, способными быть ориентирами при проведении вмешательства;
- улучшение эргономики операции на этапе мезоректумэктомии, сокращение продолжительности операций.
Отметим особенности предложенной методики. В ходе операции проводится изменение положения пациента на операционном столе: 1-м этапом выполняются лапароскопическое выделение селезеночного угла и диссекция нисходящей сигмовидной и прямой кишки в боковой позиции, 2-м этапом - удаление опухоли с использованием мануально-ассистированной техники в спинальной позиции.
Цель - разработать оптимальную методику удаления опухолей левой половины ободочной и прямой кишки у пациентов со сложной хирургической анатомией и изучить особенности периоперационного периода.
Материал и методы
С 2012 по 2014 г. в хирургическом отделении НУЗ «Дорожная клиническая больница на станции Ростов-Главный» ОАО РЖД по поводу опухолей левой половины ободочной и прямой кишки со сложной анатомией данной области прооперирован 71 пациент. Всем выполнена разработанная в клинике методика лапароскопической мануально-ассистированной операции.
Пациенты в зависимости от величины ИМТ разделены на две группы: с ИМТ до 30 кг/м 2 - 1-я группа (52 пациента - 73,2%) и с ИМТ >30 кг/м 2 - 2-я группа (19 пациентов - 26,8%) .
По полу и возрасту статистически значимых отличий не имелось. Данные пациентов представлены в табл. 1.

Таблица 1. Данные прооперированных пациентов
Перед операцией пациентам проводилось обследование:
1) колоноскопия с биопсией и верификацией опухоли;
2) МРТ органов таза для оценки размеров опухоли, отношения к собственной фасции мезоректума, прорастания в соседние органы, наличия увеличенных лимфоузлов и признаков инвазии сосудов мезоректума;
3) МРТ малого таза - наиболее значимое исследование для дооперационного стадирования процесса при раке прямой кишки;
4) эндоректальное УЗИ в целях дифференциальной диагностики прорастания опухоли в подслизистый и мышечный слои;
5) сонография и КТ брюшной полости для исключения метастазов в печени и других органах, выявления сопутствующих заболеваний, требующих хирургической коррекции;
6) сфинктерометрия для оценки тонуса анального сфинктера в покое и напряжении для прогнозирования и послеоперационной оценки функции анального удержания.
Показанием к операции считали: опухоль нисходящей, сигмовидной и прямой кишки T1−3N0−2 M0, опухоли средне- и нижнеампулярного отделов прямой кишки T4 M0. По локализации опухолей 1-я и 2-я группы не имели статистически значимых различий (табл. 2).

Таблица 2. Количественный состав больных в зависимости от локализации опухоли
В ходе работы оценивались параметры, характеризующие степень травматичности операции:
1) операционная травма: объем рассекаемых тканей, длительность операции, кровопотеря;
3) оценка биохимических, иммунологических критериев травматичности: изменение газового обмена, повышение уровня гормонов стресса, изменение маркеров катаболизма.
Методика гибридной полипозиционной мануально-ассистированной техники удаления опухолей
Начинается операция в лапароскопическом варианте с положением больного на правом боку (рис. 1). Первый троакар устанавливается на 3 см левее пупочного кольца, второй - по среднеключичной линии в левом подреберье, третий - в левой подвздошной области (рис. 2). В этом положении производим мобилизацию поперечной ободочной кишки до уровня средней трети большой кривизны желудка, выделяем мезоректум по левой задней боковой поверхности, пересекаем левую среднюю прямокишечную артерию, намечаем линию рассечения брюшины дугласова кармана.
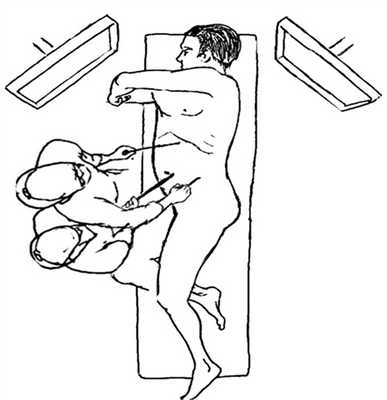
Рис. 1. Положение больного на операционном столе.
Рис. 2. Места установки троакаров в боковой позиции.
Мануально-ассистированная техника
В левой подвздошной области разрезом до 5-6 см выполняем лапаротомию и устанавливаем порт «Нandportsystem» (рис. 3, 5). Операционный стол переводится в положение Тренделенбурга (положение больного с опущенным головным концом и приподнятым тазовым) с наклоном вправо (рис. 4). Четкий контроль над опасными анатомическими структурами делает этот этап операции достаточно быстрым. При мануально-ассистированной технике устье нижней брыжеечной артерии и ее восходящая ветвь становятся основными ориентирами границы выполнения лимфодиссекции (рис. 5 и 6).
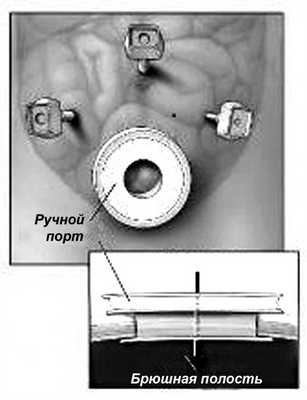
Рис. 3. Внешний вид и принцип работы устройства для ручного порта «Handportsystem».
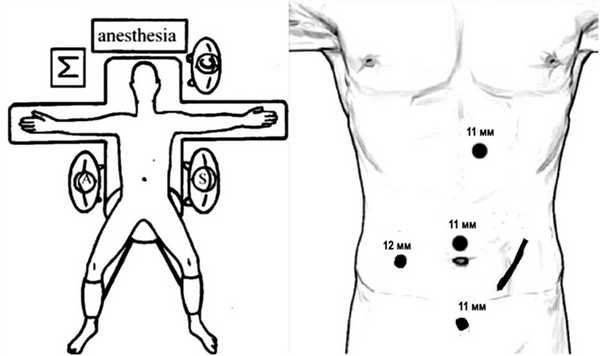
Рис. 4. Положение больного, расположение операционной бригады и места установки троакаров и порта для ручной ассистенции в спинальной позиции.
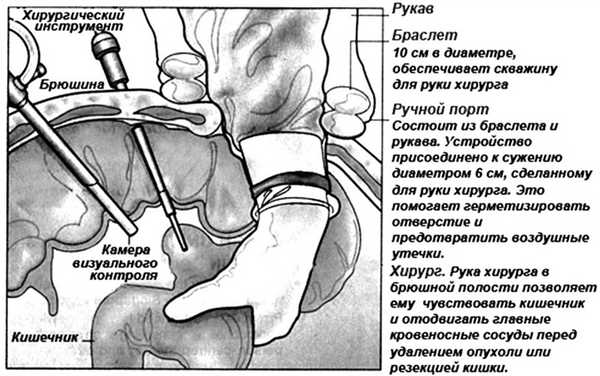
Рис. 5. «Handportsystem».
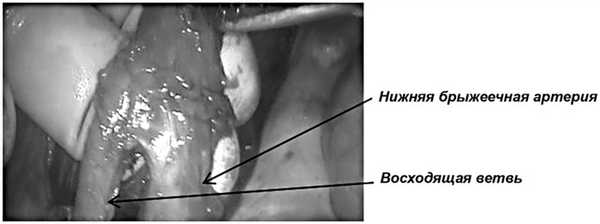
Рис. 6. Мануальный контроль достаточности лимфодиссекции апикальных лимфоузлов, пальпация устья нижней брыжеечной артериии аорты.
Тазовый этап операции
На этом этапе рука хирурга отводит прямую кишку спереди и диссекция проводится в плоскости фасции Вальдейера ориентировочно до 3-го крестцового позвонка. Мочевой пузырь у мужчин и матку у женщин, соблюдая принцип тракции и антитракции, отводят ретрактором кпереди, а рука хирурга отводит прямую кишку кзади и влево (рис. 7), что создает условия для пересечения брюшины дугласова пространства в 1 см кпереди от его глубинной точки и последующей острой диссекции передней поверхности прямой кишки в плоскости фасции Денонвилье.
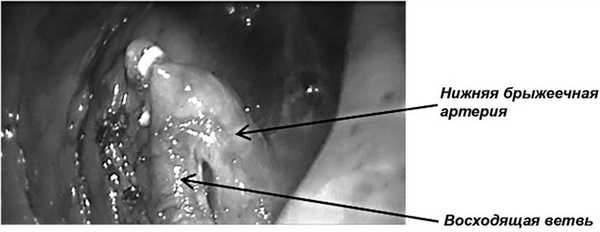
Рис. 7. Пересеченная нижняя брыжеечная артерия выше отхождения ее восходящей ветви.
Заднебоковое выделение мезоректума
На этом этапе мануально-ассистированная техника имеет преимущества, особенно у тучных пациентов, при узком тазе и значительных размерах опухоли, помогает понять истинные размеры опухоли, ее протяженность, подвижность, возможность выполнения сфинктерсохраняющей операции. При опухолях малых и умеренных размеров веерообразный ретрактор и рука хирурга поочередно создают «каньон» для лапароскопа с 30-градусной оптикой и инструмента для бескровной диссекции тканей в плоскости собственной фасции мезоректума со всех сторон (рис. 8).
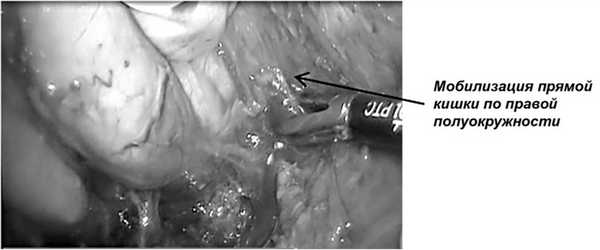
Рис. 8. Выделение правой полуокружности мезоректума с использованием мануально-ассистированной техники.
Работа в этой плоскости обеспечивает одновременно адекватную границу боковой диссекции мезоректума. У пациентов с большим размером опухоли и узким тазом может возникнуть проблема карниза, когда анатомическая ситуация не позволяет проводить дальнейшую лапароскопическую диссекцию под визуальным контролем и необходимо решить вопрос о целесообразности конверсии. Также этот вопрос целесообразно поставить при прорастании опухоли в соседние органы и необходимости выполнения комбинированной операции. При благоприятном варианте хода операции мануально хирург определяет окончание выделения мезоректума до тазового дна. Контроль этого момента можно осуществлять бимануальной пальпацией: ассистентом - со стороны промежности и хирургом - со стороны тазового дна.
Мануально-ассистированная тотальная и частичная мезоректумэктомия
Мануально-ассистированная частичная мезоректумэктомия выполняется при раке сигмовидной кишки и верхнеампулярном раке прямой кишки.
К преимуществам данного доступа относятся: значительная экономия времени; улучшение эргономики мобилизации селезеночного изгиба и латерально-медиальной диссекции левой половины ободочной кишки; беспрепятственная визуализация левого мочеточника и подвздошных сосудов, особенно у лиц с ИМТ >30 кг/м 2 , обеспечение анатомически более оптимальной диссекции мезоректума по левой боковой поверхности и создание условий для последующей переднебоковой диссекции мезоректума в плоскости фасции Денонвилье. При низких опухолях прямой кишки, их относительно больших размерах, узком тазе и возможности выполнить ультранизкую переднюю резекцию прямой кишки с формированием анастомоза на 1-2 см выше зубчатой линии удобно использовать дополнительный доступ через заднюю кольпотомию у женщин и трансперинеальный разрез у мужчин. Последний целесообразно осуществлять с учетом анатомических ориентиров, таких как дорсальные нервы промежности и проекция на промежность фасции Денонвилье, определяемых при сонографии тканей промежности. Анатомический спектр выполненных операций представлен в табл. 3.

Таблица 3. Операции, выполненные по поводу опухолей различных отделов кишечника
Всем пациентам проводилось гистологическое исследование опухоли. В обеих группах преобладала высокодифференцированная аденокарцинома. Результаты гистологического исследования представлены в табл. 4.

Таблица 4. Гистологическое строение опухолей
Оценка операционного стресса показала различия между 1-й и 2-й группами (табл. 5). Средний уровень кортизола и адреналина после операции статистически достоверно отличался у пациентов с ИМТ >30 кг/м 2 .

Таблица 5. Показатели уровня гормонов операционного стресса у пациентов 1-й и 2-й групп
Наибольшая кровопотеря - 282 мл - была у пациента с экстирпацией прямой кишки. Наименьшая - 70,5 мл - при выполнении операции на левой половине ободочной и сигмовидной кишке и верхнеампулярном отделе прямой кишки. Объем кровопотери в ходе удаления опухолей различной локализации показан в табл. 6.
Таблица 6. Кровопотеря в результате операций, мл
Продолжительность операции по экстирпации прямой кишки оказалась наибольшей и составила 321,9 мин. Наименьшей - 151,2 мин - оказалась продолжительность операции на левой половине ободочной и сигмовидной кишке и верхнеампулярном отделе прямой кишки. Продолжительность операций в 1-й и 2-й группах показана в табл. 7.
Таблица 7. Продолжительность операций у больных 1-й и 2-й групп, мин
Из ранних послеоперационных осложнений чаще всего встречался перитонит - в 4,2% случаев. В табл. 8 представлены послеоперационные осложнения.

Таблица 8. Осложнения после операций по поводу опухолей толстого кишечника, выполненных комбинированным доступом с лапароскопическим мануальным ассистированием, %
Длительность восстановления эвакуаторной функции кишечника (появление самостоятельного стула) достоверно меньше в 1-й группе пациентов независимо от ИМТ.
В 21,1% случаев первый стул появлялся уже через 36 ч после операции, в большинстве случаев время восстановления эвакуаторной функции в 1-й группе составляло 48 ч (в 46,5% случаев). Сроки восстановления моторно-эвакуаторной функции кишечника указаны в табл. 9.

Таблица 9. Сроки восстановления моторно-эвакуаторной функции кишечника
1. Представленная техника лапароскопической мануально-ассистированной операции в боковой и спинальной позиции при удалении опухолей левой половины толстого кишечника оптимальна у пациентов со сложной хирургической анатомией.
2. Эффективность предложенной малоинвазивной техники у больных с опухолями левой половины толстого кишечника доказана низкой кровопотерей во время операции, незначительным приростом гормонов стресса, коротким периодом восстановления моторно-эвакуаторной функции кишечника.
Читайте также:
- Частота резекции легкого с пневмоперитонеумом. Пневмоперитонеум в дооперационном периоде
- Исход бронхэктатической болезни. Консервативное лечение бронхэктазов
- Виды ячеек сосцевидного отростка. Пороговые ячейки сосцевидного отростка
- Спинномозговая жидкость. Оценка спинномозговой жидкости
- Антиметаболиты
