Тромбоз при ретроградной артериальной катетеризации. Перемежающаяся хромота после артериальной катетеризации
Добавил пользователь Владимир З. Обновлено: 21.01.2026
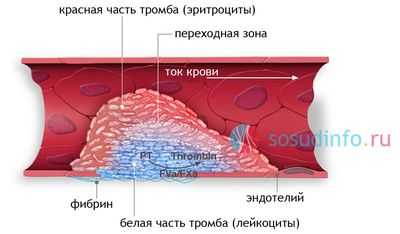
Реканализация тромба — это процесс восстановления проходимости сосуда путем лизиса сгустка, естественного врастания в тромб соединительной ткани и эндотелия либо посредством хирургического или медикаментозного воздействия.
Тромбоз представляет собой естественный физиологический процесс, направленный на остановку кровотечения, однако в ряде случаев этот защитный механизм приобретает патологические черты, а образованный сгусток не только мешает току крови сквозь закупоренный сосуд, но и грозит смертельной эмболией. Для предотвращения опасных осложнений и восстановления кровотока природой придуман механизм реканализации тромба, эффективность которого во многом зависит от размеров кровяного свертка, состояния свертывающей и фибринолитической активности крови, сопутствующей патологии. Чем меньше сверток, тем выше вероятность его полного растворения. С увеличением объема тромба шансы на самостоятельное рассасывание снижаются, и возникает вероятность прорастания его соединительной тканью.
Тромбоз возникает как в венах, так и в артериях, однако в сосудах с более медленным кровотоком вероятность создания благоприятных условий для тромбообразования несколько выше. Кроме того, распространению тромбоза среди населения способствует большое число случаев варикозной болезни, особенно, у представительниц слабого пола и лиц отдельных профессий.
пример артериального тромбоза
Венозный или артериальный тромбоз несет риск полной окклюзии сосуда, и тогда в тканях возникнут ишемические и дистрофические изменения, отек, а при закрытии просвета артерии — некрозы по причине недостатка питания. Реканализация же дает возможность уменьшить симптоматику хронических нарушений кровотока из-за тромбоза и даже полностью их устранить, если кровяной сверток небольшой или закупорил относительно мелкий сосуд.
Реканализация тромба может происходить естественным путем за счет фибринолиза, а также хирургически или медикаментозно. Лечение, направленное на реканализацию, позволяет минимизировать острые проявления тромбоза, предотвратить хроническую сосудистую недостаточность и тромбоэмболические осложнения.
Разновидности реканализации и их особенности
В зависимости от условий, в которых происходит восстановление просвета сосуда после тромбоза, выделяют:
- Естественную реканализацию;
- Медикаментозную;
- Хирургическую.
Естественное растворение тромбов возможно только при относительно маленьких их размерах, в противном случае организм пытается хоть как-то восстановить кровоток, превращая крупный тромб в подобие сита, пронизанного сосудистыми каналами, пропускающими кровь.
Фибринолитическая система активируется вместе с системой свертывания, что предотвращает избыточное тромбообразование и способствует разрушению микротромбов. Фибрин растворяется плазмином, активизируемым седьмым фактором свертывания крови.
Лизис тромба системой фибринолиза можно считать идеальным развитием событий, так как после этого происходит полная реканализация сосуда, а тромботические массы растворяются ферментами, однако при внутриартериальных, венозных и сердечных тромбах больших размеров он малоэффективен, и восстановление кровотока возможно разве что за счет частичной реканализации.
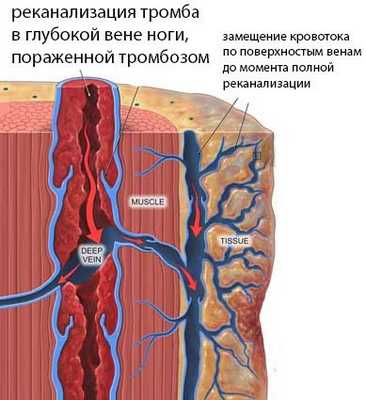
Преобразование крупного тромба начинается с его организации, то есть прорастания соединительнотканными волокнами. Этот процесс начинается с головки тромба — места, где он крепится к сосудистой стенке и куда со стороны внутренней выстилки артерии или вены проникает соединительная ткань. Начальные признаки реканализации можно заметить уже в конце первых 1-2 недель с момента тромбирования.
По мере того, как тромботические массы замещаются фиброзной тканью, в них возникают узкие щели и каналы, в которые внедряется эндотелий — происходит реканализация сосудов. Каналы внутри тромба становятся подобием сосудов с соответствующей выстилкой, стенка приобретает черты артериальной или венозной (в зависимости от локализации тромбоза), сквозь полости начинает циркулировать кровь, и тогда говорят о васкуляризации тромба. Описанные изменения происходят на протяжении нескольких недель.
Видео: пример естественной реканализации тромба в синусе икроножной мышцы
Медикаментозная реканализация
Консервативным путем проводить реканализацию сосудов допустимо в тех случаях, когда тромбоз не угрожает жизни пациента. Такая терапия проводится в первые трое суток с момента тромбоза, и чем раньше она будет начата, тем выше вероятность благоприятного исхода. Оптимально начинать вводить препараты в первые 6 часов.
Для восстановления кровотока применяют:
- Антикоагулянты;
- Антиагреганты;
- Тромболитики;
- Ангиопротекторы.
Тромболитическая терапия проводится препаратами, растворяющими тромботические массы в просвете сосуда. Фибринолитическое лечение назначается только в условиях стационара и под контролем врача, поскольку имеет противопоказания, игнорирование которых может привести к тяжелым осложнениям.
Фибринолитические средства призваны растворить кровяной сверток в просвете артерии или вены. Они применяются для реканализации артерии при острых расстройствах кровообращения в сердце (инфаркт, острый коронарный синдром), острой артериальной непроходимости в конечностях и др.
В настоящее время используются фибринолитики трех поколений:
- Первое поколение — стрептокиназа, урокиназа — довольно эффективны, но дают частые аллергические реакции, повышают риск кровотечения в процессе тромболизиса;
- Второе поколение — альтеплаза, актилаза — действуют избирательно на тромботические массы, кроверазжижающий эффект меньше выражен нежели у препаратов первого поколения, поэтому и риск кровотечений ниже;
- Третье — тенектеплаза, ретаплаза.
В целях растворения свертка при артериальном тромбозе используется фибринолизин, вводимый в вену капельно вместе с гепарином на протяжении 2-3 суток. После окончания лечения фибринолизином необходимо продолжить применение антикоагулянтных средств. Недостатком препарата считается его быстрая инактивация антиплазмином крови пациента, что не характерно для более эффективных средств — стрептаза и урокиназа.
Фибринолитическая терапия проводится в стационаре, пациенту назначается постельный режим, а внутривенное введение лекарств может продолжаться часами, итогом чего станет полная или частичная реканализация тромба.
Традиционно для лечения тромбоза применяются антикоагулянты прямого и непрямого действия. Они ограничивают увеличение тромба, стабилизируя его размеры. Непрямые антикоагулянты уменьшают выработку витамина К печенью, из-за чего замедляется продукция тромбина, и рост тромба прекращается. К этой группе лекарств относят дикумарин, синкумар, варфарин, фенилин и другие. Их назначают с третьих суток от момента закупорки сосуда.
Прямые антикоагулянты — гепарин, фраксипарин, клексан — воздействуют на факторы свертывания крови и прекращают местное тромбообразование, однако при их применении есть вероятность аллергических реакций и повышения кровоточивости, что особенно выражено при введении гепарина.
Острые артериальные тромбозы требуют незамедлительной и комплексной терапии, включающей введение анальгетиков, спазмолитиков (дротаверин, галидор) и антикоагулянтов прямого действия в первые 1-2 дня (гепарин внутривенно, а затем — внутримышечно).
Непрямые антикоагулянты начинают действовать спустя примерно сутки, поэтому начинать лечение тромбоза с них нельзя, но целесообразным считается комбинировать их с гепарином и его производными. Курс лечения продолжается 2-3 недели, то есть до момента организации и реканализации просвета сосуда.
Антиагреганты препятствуют склеиванию тромбоцитов в просвете сосудов и на их стенках, предотвращая рост тромба. Наиболее доступный антиагрегант — аспирин, который широко применяется в кардиологической практике для лечения и профилактики тромбозов коронарных сосудов.
Сосудистые протекторы и венотоники применяют при венозном застое с тромбозом, так как они способны повышать тонус вен и уменьшать проницаемость капилляров. Улучшение микроциркуляции и реологических характеристик крови способствует снижению риска тромбообразования и восстановлению сосудистой проходимости. Используются пентоксифиллин, трентал, пармидин.
Антикоагулянты уменьшают свертываемость, однако практически не влияют на фибринолиз, поэтому цель их назначения — профилактика повторных тромбозов и роста уже имеющегося свертка. Для реканализации вен после тромбоза или артерий все же необходима фибринолитическая терапия.
При хронических окклюзиях артерий и вен применяют сулодексид, оказывающий ангиопротективное и профибринолитическое действие. Препарат улучшает реканализацию при тромбозе глубоких вен голеней, снижая выраженность посттромбофлебитического синдрома.
Сулодексид улучшает реологические показатели крови, нормализует структуру эндотелиальной выстилки сосудов, способствует прекращению роста тромба и его стабилизации, улучшает микроциркуляцию и обладает венотонизирующими свойствами. Принимать его можно перорально, при этом не требуется постоянного контроля гемостазиограммы.
Важным преимуществом сулодексида можно считать не только остановку тромбообразования и реканализацию пораженных сосудов, но и возможность его применения для профилактики повторных тромбозов и лечения хронической венозной недостаточности.
Добиться более полной реканализации вен ног после тромбоза помогает препарат Ксарелто (ривароксабан). Он эффективнее непрямых антикоагулянтов, может применяться одновременно с венотониками и является довольно безопасным в плане развития геморрагических осложнений.
Хирургическая реканализация
В случае тяжелых тромбозов, закупорки артерий жизненно важных органов, когда либо нет времени на ожидание естественной реканализации и проведение консервативного лечения, либо сам тромб несет угрозу жизни, врачи проводят хирургическую реканализацию, восстанавливая проходимость сосуда при операции. Оперативное лечение может проводиться в случае отсутствия результата от медикаментов, а перед операцией гепарины и другие антикоагулянты отменяются.

пример стентирования артерии при атеросклерозе или атеротромбозе
В целях реканализации артерии или вены производят:
- Хирургическое удаление тромба из просвета сосуда при эндоваскулярных вмешательствах, когда внутрисосудисто вводится катетер, захватывающий и выводящий сверток крови наружу;
- Шунтирующие операции при невозможности извлечения тромба в месте его образования, когда накладывается обходной путь кровотока с использованием собственных тканей (вены) или синтетических материалов;
- Перевязку сосуда выше и ниже зоны обструкции, после чего «включаются» коллатерали и налаживается кровообращение в обход пораженной вены или артерии;
- Установку стентов — специальная трубка или пружина, расширяющая просвет сосуда в месте тромбирования (при поражении коронарных, мозговых, шейных артерий).
Помимо описанных способов реканализации, важно личное участие пациента в лечении патологии и предупреждении повторных эпизодов тромбообразования. Нужно не только следовать назначениям врачей, но и изменить образ жизни, характер питания, избавиться от вредных привычек.
В случае хронических тромботических поражений вен ног, что нередко сопутствует варикозу, могут применяться сразу несколько подходов: медикаментозное лечение, компрессионный трикотаж и двигательная активность, хирургическая коррекция по показаниям.
Катетер-ассоциированные инфекции кровотока ( Ангиогенные инфекции , Катетерные инфекции )
Катетер-ассоциированные инфекции кровотока (КАИК) - это нозокомиальные инфекционные осложнения, связанные с использованием внутрисосудистых катетеров. Клинически проявляются местными воспалительными изменениями (отек, болезненность, гиперемия в области катетера) или генерализованной инфекцией (фебрильная лихорадка, озноб, бактериемия). Для лабораторного подтверждения КАИК осуществляется посев крови на гемокультуру и микробиологическое исследование сосудистого катетера. При первых признаках КАИК производится удаление катетера, назначается антибактериальная, инфузионная терапия.
МКБ-10

Общие сведения
Катетер-обусловленные инфекции кровотока (ангиогенные, «катетерные» инфекции) - группа внутрибольничных инфекций, развивающихся вследствие катетеризации сосудов. Частота возникновения ангиогенных инфекций в отделениях ОРИТ составляет от 3 до 7 случаев на 1000 катетеро-дней. В Европе и США ежегодно регистрируется более 500 тыс. подобных осложнений. Потребность в центральном сосудистом доступе высока в отделениях реанимации, гемодиализа, онкологии, гематологии и др., что делает катетер-ассоциированные инфекции мультидисциплинарной проблемой, актуальной для различных медицинских сфер.

Причины
Установка внутрисосудистого устройства (ВСУ) - инвазивная манипуляция, сопряженная с нарушением целостности кожных покровов и сосудистой стенки, внедрением и оставлением в просвете сосуда инородного предмета. Катетерные инфекции кровотока в большинстве случаев ассоциированы с установкой центрального венозного катетера (ЦВК), инфузионной порт-системы, периферической венозной канюли. Чаще КАИК развиваются при катетеризации бедренной вены, реже - подключичной и внутренней яремной.
Развитию ангиогенных инфекций предшествует контаминация сосудистого устройства патогенными или условно-патогенными микроорганизмами. Источниками и причинами обсеменения могут стать:
- инфекции кожи в области сосудистого протеза (пиодермии);
- несоблюдение требований асептики при манипуляциях с ЦВК (ненадлежащая обработка операционного поля, рук врача);
- неадекватный выбор доступа, размера, типа и материала катетера;
- частые пункции сосудистого русла;
- плохой уход за сосудистым протезом.
Среди этиологических агентов, вызывающих КАИК, преобладают возбудители, которые являются самой частой причиной ВБИ: стафилококки (47%, из них золотистый стафилококк ‒ 25%), энтеробактерии (27%), ацинетобактеры (13%), синегнойная палочка (9%), кандиды (5%), энтерококки (3%) и др. Большую роль в возникновении внутрисосудистых инфекций, играет срок катетеризации: по опубликованным данным, через 7 дней нахождения катетера в вене КАИК развивается у 5%пациентов, через 1 месяц и более - у 36%.
Факторы риска
Инфицированию внутривенных катетеров способствуют сопутствующие состояния: сахарный диабет, иммунодефициты и иммуносупрессия, гипоальбуминемия. В группу повышенного риска по развитию катетер-ассоциированных инфекций кровотока входят пациенты, имеющие значительную катетеризационную нагрузку (длительную и неоднократную пункцию центральных вен):
- находящиеся на гемодиализе;
- получающие массивную инфузионно-трансфузионную терапию;
- проходящие химиотерапию;
- требующие проведения эфферентных методов детоксикации;
- нуждающиеся в парентеральном питании.
Патогенез
Механизм развития КАИК реализуется тремя основными путями. Чаще всего инфекция проникает в кровоток с обсемененных кожных покровов по наружной поверхности катетера (экстралюминально). Такой путь наиболее актуален в ранние сроки после постановки катетера (первые 10-15 суток). В последующем увеличивается доля интралюминального инфицирования, когда инфекция распространяется по внутренней стороне протеза через контаминированные инфузионные среды, канюли шприцев и систем для переливания. Также возможно гематогенное инфицирование, при котором возбудители оседают на катетере, разносясь с током крови из других источников (при пневмонии, панкреатите и пр.).
Внутрисосудистое устройство является инородным телом, поэтому в ответ на его введение организм вырабатывает различные белковые вещества, отграничивающие его от собственных тканей. В их числе ‒ фибрин и фибронектин, к которым легко прикрепляется коагулаза - фермент, продуцируемый многими патогенами, в частности, золотистым стафилококком и кандидой.
В результате такой адгезии внутри сосудистого протеза образуется биопленка, защищающая микробные колонии от воздействия антибиотиков и клеток иммунной системы. Это способствует переходу инфекции в персистирующую хроническую форму. Микробные биопленки образуются на внутренней поверхности имплантируемых устройств в 40% случаев.
Наличие биопленки снижает чувствительность патогенов к антибиотикам в сотни раз, способствует увеличению в структуре ВБИ доли антибиотикорезистентных штаммов, устойчивых практически ко всем известным противомикробным препаратам. Рост колоний микроорганизмов сопровождается фрагментацией биопленки и попаданием патогенов в кровоток, что приводит развитию бактериемии и сепсиса.
Классификация
В настоящее время в медицинских кругах используется классификация катетер-ассоциированных инфекций кровотока, рекомендованная Комитетом по контролю за госпитальными инфекциями (США). Согласно ей, различают следующие формы КАИК:
- Колонизация катетера, подтвержденная микробиологическим исследованием, при отсутствии любых клинических проявлений.
- Флебит: эритема, уплотнение, болезненность катетеризированной вены при пальпации.
- Ограниченная инфекция в месте установки катетера: инфильтрат, болезненность тканей, гиперемия, наличие гнойного отделяемого, очаг не более 2 см.
- Инфекция подкожного кармана, содержащего установленную порт-систему: гиперемия и некроз кожи над имплантируемым устройством, гнойное отделяемое в подкожном кармане.
- Туннельная инфекция: признаки воспаления, распространяющегося по ходу катетера более 2-х см от места его установки.
- Инфекции кровотока: бактериемия, фунгемия, сепсис, при которых один и тот же возбудитель высевается из кровотока и из удаленного ВСУ.
- КАИК, ассоциированные с инфузионной средой: контаминированными растворами, гемокомпонентами.
Симптомы КАИК
Катетер-асоциированные инфекции кровотока могут быть локальными (37%) и генерализованными (63%). Первые из них ограничены местом установки сосудистого протеза, вторые характеризуются бактериемией и системным поражением. Местные инфекции представлены инфильтратами, абсцессами, флебитами, непосредственно связанными с установленным внутрисосудистым устройством. Генерализованные КАИК проявляются сепсисом.
На высокую вероятность КАИК указывает появление признаков воспаления вокруг сосудистого катетера: уплотнение и покраснение кожи, боли, отделение гнойного экссудата, нарушение проходимости протеза. Общие симптомы инфекционного процесса ‒ лихорадка с ознобом ‒ обычно возникают через 20 минут-1,5 часа после использования катера (забора крови, вливания растворов). В тяжелых случаях лихорадка становится фебрильной и практически постоянной, снижается АД, нарастают признаки интоксикации. Развивается катетер-ассоциированный ангиогенный сепсис.
Осложнения
Длительное нахождение катетера в сосудистом просвете повышает риск развития тромбофлебита, тромбоза глубоких вен. КАИК могут осложниться септикопиемией ‒ формированием метастатических гнойных отсевов различной локализации. Среди них - бактериальный эндокардит, абсцедирующая пневмония, септический артрит, гематогенный остеомиелит и др. Причиной гибели пациентов становится септический шок, полиорганные нарушения, фатальные тромбоэмболии.
Диагностика
Клиническим критерием КАИК считается появление у пациента симптомов инфекции кровотока спустя 48 часов и более после установки ЦВК при отсутствии других источников инфекции. Однако из-за низкой специфичности клинических данных диагноз катетер-ассоциированной инфекции требует обязательного лабораторного подтверждения. Для этого производится парный посев:
- крови из периферической вены и дистального конца внутрисосудистого катетера (либо смыва из него). КАИК считается достоверной при одновременном выделении одной и той же гемокультуры из периферической крови и сосудистого зонда (>15 КОЕ полуколичественно и >102 КОЕ количественно);
- крови из сосудистого протеза и вены. На КАИК указывает более чем 3-кратное превышение количества колоний в образце крови из катетера по сравнению с венозным образцом.
Забор крови необходимо производить двукратно, до начала антибиотикотерапии, на высоте лихорадки. Для уточнения осложнений осуществляются инструментальные исследования. При подозрении на гнойный тромбофлебит выполняется УЗДС сосудов, флебография. Исключить или подтвердить септический эндокардит помогает трансторакальная ЭхоКС. Методами диагностики гнойных процессов костно-суставной системы является рентген, УЗИ суставов.
Ангиогенные инфекции дифференцируют с бактериемией, ассоциированной с другими первичными источниками: пневмонией, гнойными ранами, интраабдоминальными абсцессами и др.
Лечение катетер-ассоциированных инфекций кровотока
В случае отсутствия локальной инфекции предпринимают попытку санации катетера методом «антибактериального замка» ‒ в просвет ЦВК вводят раствор антибиотика и оставляют на несколько часов. При наличии выраженных признаков местного воспаления необходимо незамедлительное удаление инфицированного внутрисосудистого устройства. При локальных формах КАИК может потребоваться наложение антисептических и мазевых повязок, вскрытие абсцессов и гнойных затеков с последующим ведением гнойной раны согласно принятому протоколу.
Системную антибиотикотерапию начинают, не дожидаясь результатов бакпосева, при необходимости в дальнейшем ее корректируют с учетом выделенной флоры и чувствительности. Обычно используются пенициллины, цефалоспорины, гликопептиды, аминогликозиды длительностью не менее 14 дней. Для терапии грибковой инфекции назначают амфотерицин В, флуконазол. При явлениях тромбофлебита показано введение антикоагулянтов, фибринолитиков. В отношении флегмон, гнойного артрита, остеомиелита, абсцессов различной локализации применяется соответствующая хирургическая тактика.
Прогноз
Катетер-ассоциированные инфекции кровотока являются серьезным вызовом современной медицине ввиду их распространенности и антибиотикорезистентности. Они удлиняют сроки госпитализации, утяжеляют исход основного заболевания, требуют значительных финансовых затрат для лечения. Неосложненные ангиогенные инфекции обычно разрешаются в течение нескольких суток. КАИК, осложненные местным нагноительным процессом или бактериемией, имеют серьезный прогноз и высокую летальность.
Профилактика
Современные протоколы четко регламентируют правила установки и ухода за ВСУ. Наибольшее внимание при этом уделяется соблюдению норм асептики и антисептики (дезинфекция операционного поля и рук персонала, хранение крышек катетеров в растворе хлоргексидина, обработка кожи и смена повязок вокруг ВСУ). Необходимо правильно осуществлять выбор внутрисосудистого устройства и места для катетеризации, максимально ограничивать срок эксплуатации внутривенных зондов, использовать гепариновые и антибактериальные замки.
1. Профилактика катетер-ассоциированных инфекций кровотока и уход за центральным венозным катетером (ЦВК). Клинические рекомендации. - 2017.
2. Комплексная клинико-этиологическая и эпидемиологическая характеристика катетер-ассоциированных инфекций кровотока/ Квашнина Д. В., Ковалишена О.В., Белянина Н.А.// Медицинский альманах. - 2017.
3. Распространенность и критерии диагностики катетер-ассоциированных инфекций кровотока/ Везирова З.Ш.// Вестник хирургии Казахстана. - 2014.
4. Инфекции, связанные с внутрисосудистыми устройствами: терминология, диагностика, профилактика и терапия/ Багирова Н.С.// Злокачественные опухоли. - 2014.
Перемежающаяся хромота
Перемежающаяся хромота - это дискомфорт, судороги, боли и другие неприятные ощущения, которые появляются в мышцах ног вследствие недостаточного кровоснабжения при физических нагрузках и исчезают в состоянии покоя. Развивается на фоне облитерирующих заболеваний артерий нижних конечностей. Является промежуточной стадией между бессимптомным течением и тяжелой ишемией, сопровождающейся трофическими расстройствами. Наличие, причину и тяжесть перемежающейся хромоты устанавливают на основании опроса, осмотра, тестов и дополнительных исследований. Лечение - специальные комплексы ЛФК, медикаментозная терапия, оперативные вмешательства.



Перемежающаяся хромота (ПХ) - проявление целого ряда облитерирующих болезней артерий. Распространенность таких патологий, в среднем, составляет 2-3%, увеличивается с возрастом. Наличие симптома отмечается лишь у 11-33% больных. Половина людей, страдающих перемежающейся хромотой, не обращаются за медицинской помощью, поскольку расценивают нарушение, как естественное следствие старения или других заболеваний. У мужчин ПХ обнаруживается вдвое чаще, чем у женщин.
Перемежающаяся хромота провоцируется следующими патологиями нижних конечностей:
- Облитерирующий атеросклероз. Диагностируется у 80-90% больных с данным симптомом. Преимущественно выявляется у мужчин старше 40 лет. Является проявлением системного атеросклероза. Чаще поражает артерии крупного и среднего калибра: подвздошные, бедренные, большеберцовые, подколенные. Развивается на фоне дислипидемии, изменений стенок сосудов.
- Облитерирующий эндартериит. Обнаруживается у мужчин в возрасте 20-40 лет. У женщин практически не встречается. По клиническим проявлениям напоминает атеросклероз, но поражает более мелкие артерии стоп и голеней. Причины точно не установлена. Предположительно, имеет место полиэтиологический характер заболевания.
- Облитерирующий тромбангиит. Чаще страдают взрослые мужчины, болезнь также может встречаться у подростков. Характерно вовлечение артерий и вен мелкого и среднего калибра. Причиной изменений сосудов является воспалительный процесс на фоне повреждений стенок артерий и иммунных нарушений.
- Врожденные ангиодисплазии. Изолированные артериальные дисплазии встречаются редко, чаще выявляются сочетанные гипоплазии или аплазии артерий и вен. Дефект сосуда обуславливает недостаточность кровоснабжения. Патология манифестирует в детском возрасте. Провоцируется хромосомными и генетическими аномалиями, вредными воздействиями на плод в период беременности.
- Неспецифический аортоартериит (болезнь Такаясу). Чаще страдают мужчины до 30 и женщины до 40 лет. Перемежающаяся хромота может возникать только при втором и третьем типах заболевания (с поражением брюшной аорты и ее ветвей). Причины достоверно не установлены, предположительно, существует связь с инфекциями и аутоиммунными нарушениями.
- Диабетическая ангиопатия. Осложнение развивается на фоне длительно текущего сахарного диабета, появляются через 10-15 лет с момента начала заболевания. Обнаруживается у 10% от общего числа больных. Вовлекаются преимущественно артерии стопы, задняя и передняя большеберцовые артерии, глубокая артерия бедра.
- Локальные окклюзии. Нарушение проходимости обусловлено заболеваниями и травматическими воздействиями. Перемежающаяся хромота формируется на фоне сдавления сосуда опухолями или рубцами после травм и гнойных процессов, формируется при посттромботических и постэмболических изменениях артерий. В отличие от других заболеваний, для которых более типично двустороннее поражение, страдает одна нога.
Перемежающаяся хромота появляется при перекрытии 60-70% диаметра артерий. В норме при физической нагрузке кровоток в мышцах увеличивается. При появлении симптома сосуды, напротив, спазмируются. Это объясняется сопутствующими нарушениями функций вегетативной нервной системы и гуморальными воздействиями (изменением уровня адреналина). Окклюзия и спазм взаимно усугубляют друг друга, что обуславливает появление боли и неприятных ощущений после прохождения некоторого расстояния.
Перемежающаяся хромота рассматривается в рамках классификации ишемии нижних конечностей. Наиболее популярными вариантами являются систематизации Фонтейна и Покровского, которые почти полностью совпадают друг с другом. Различают следующие степени ишемии:
- I(асимптомная). Жалобы отсутствуют, нарушения кровотока определяются только по данным аппаратных исследований.
- IIа (легкая ПХ). Боль или дискомфортные ощущения возникают после прохождения дистанции в 200-1000 метров.
- IIб (умеренная ПХ). Неприятные симптомы наблюдаются при ходьбе на дистанцию менее 200 метров.
- III(боли в покое). Пациент отмечает болезненные ощущения при отсутствии движений, нередко - в ночное время.
- IV(трофические нарушения). На пораженной конечности обнаруживаются гиперкератоз, атрофия подкожной клетчатки, другие изменения. При дальнейшем усугублении ишемии формируются трофические язвы, развивается гангрена.
Из-за незначительной выраженности симптоматики больные редко обращаются к специалисту на этапе легкой перемежающейся хромоты. В большинстве случаев диагноз облитерирующего заболевания впервые выставляется на IIб, III или IV стадиях.

Симптомы
Признаками перемежающейся хромоты являются боли, дискомфортные ощущения или судороги в мышцах, возникающие на фоне движения и исчезающие в покое. Чаще страдают икроножные мышцы, реже - мускулатура стопы, бедра, ягодичной зоны. Вначале симптом развивается только после прохождения значительных дистанций, в последующем «безболевое» расстояние постепенно сокращается, пациент вынужден останавливаться через каждые 50 или 100 метров. Проявление усиливается при повышении интенсивности нагрузки на ноги, например, подъеме на лестницу, ходьбе в гору.
Еще до появления перемежающейся хромоты больного какое-то время могут беспокоить ранняя усталость ног при ходьбе, онемение пальцев, парестезии, зябкость, судороги в мышцах. Кожа на начальных этапах становится более бледной, на поздних стадиях - багрово-синюшной. Объем конечностей в зоне поражения постепенно уменьшается из-за атрофии подкожно-жировой клетчатки.
Волосы на голенях и бедрах выпадают. Кожа утолщается. Ногтевые пластины гипертрофируются, становятся слоистыми. При дальнейшем прогрессировании патологии боли возникают в покое. В области дистальных отделов конечностей образуются трофические язвы. Их развитие может сопровождаться тромбофлебитом и лимфангитом. Раны, царапины и ссадины крайне плохо заживают, любое повреждение кожи может спровоцировать развитие гангрены.
Перемежающаяся хромота не обязательно переходит в глубокую декомпенсированную ишемию. У ряда больных, особенно, при надлежащем лечении, изменения стабилизируются или незначительно усугубляются с течением времени. Быстрое нарастание симптомов и высокая вероятность гангрены более характерны для облитерирующего эндартериита и сахарного диабета, могут встречаться при облитерирующем атеросклерозе.
Диагностические мероприятия проводятся сосудистым хирургом. При наличии сопутствующей ИБС, обусловленной системным атеросклерозом, пациенту необходима консультация кардиолога. Больным сахарным диабетом показано комплексное обследование с участием диабетолога, эндокринолога, невролога, кардиолога. В ходе опроса устанавливают момент появления симптома, скорость его прогрессирования.
В процессе осмотра оценивают пульс на периферических артериях. Измеряют артериальное давление, определяют лодыжечно-плечевой индекс. Производят специальные пробы (термометрическую, Самюэлса, Гольдфлама и пр.), обнаруживают симптомы, свидетельствующие об ишемии конечности (прижатия пальца, плантарной ишемии Опеля). Выявляют трофические нарушения. План дополнительных диагностических мероприятий включает следующие процедуры:
- Ультразвуковые методики.Допплерография и дуплексное сканирование осуществляются для оценки кровоснабжения конечностей, определения проходимости сосудов, уточнения локализации и протяженности окклюзии.
- Периферическая ангиография. Производится путем катетеризации бедренной артерии. Катетер подводят к исследуемым сосудам, после чего вводят контраст и делают серию снимков. Селективный метод позволяет точно определять окклюзии и стенозы, оценивать степень развитости коллатералей.
- МР-ангиография. Методика дает возможность детально изучить анатомические особенности сосудистой сети, характер кровотока, ширину просвета и состояние стенок артерий. Проводится на заключительном этапе диагностического поиска для уточнения результатов других исследований, выбора тактики лечения.
- Прочие аппаратные методики. Перечень методов зависит от характера облитерирующей патологии. Могут назначаться реовазография, сцинтиграфия, капилляроскопия, термография. Для обнаружения спазма сосудов по показаниям выполняются паравертебральная или паранефральная блокада. Пациентам с атеросклерозом и диабетической ангиопатией производят ЭКГ.
- Лабораторные анализы. При сахарном диабете определяют глюкозу и инсулин, проводят специальные пробы. При атеросклерозе оценивают уровень холестерина. При тромбангиите в ходе иммунологических тестов выявляют соответствующие антигены, по результатам коагулограммы подтверждают агрегацию тромбоцитов и повышенную свертываемость крови.

Лечение перемежающейся хромоты
Программа терапевтических мероприятий составляется с учетом выраженности перемежающейся хромоты, локализации и тяжести поражения артерий, сопутствующих заболеваний и других факторов. Основными методами являются лечебная физкультура, медикаментозное лечение, воздействие на провоцирующие и усугубляющие обстоятельства. По показаниям проводятся открытые и эндоваскулярные операции на сосудах.
Традиционно при асимптомном течении ишемии и на легкой стадии перемежающейся хромоты применяются консервативные методики. При переходе болезни на более тяжелые стадии консервативные способы дополняют реваскуляризирующими хирургическими вмешательствами. При этом практикуется индивидуальный подход. Так при быстром прогрессировании болезни и стремительном развитии предкритических форм ишемии оптимальным вариантом может быть раннее начало оперативного лечения. И, напротив, при стабильном течении болезни лучшие перспективы открываются при использовании консервативных методик.
Немедикаментозные методы
Устранение предрасполагающих и провоцирующих факторов включает коррекцию режима. Пациентам следует отказаться от курения. При избытке массы тела необходима консультация диетолога для составления рациона питания, предусматривающего снижение веса. Состояние сосудов и общие метаболические процессы улучшаются при достаточной подвижности, поэтому частью немедикаментозных мероприятий становится борьба с гиподинамией.
Лечебная физкультура играет ведущую роль среди консервативных методов, является обязательной частью терапии перемежающейся хромоты. Больным рекомендуют ходить в таком темпе, при котором симптом появляется через 3-5 минут от момента начала движения. Затем следует продолжать ходьбу до умеренной боли или дискомфорта, после чего останавливаться до исчезновения неприятных ощущений, а потом идти снова.
Общая продолжительность одного занятия на начальном этапе составляет не менее 35 минут, в последующем постепенно увеличивается до 1 часа. Занятия проводят 3 или более раза в неделю. Для достоверной оценки эффективности метода в лечении конкретного больного курс ЛФК должен составлять не менее 3 месяцев. При наличии трофических язв на пальцах и подошвах ходьбу заменяют педальным тренажером или велотренажером.
Медикаментозная терапия
Поскольку абсолютное большинство случаев перемежающейся хромоты связано с системным атеросклерозом, на первый план выходят средства, влияющие на проявления и скорость прогрессирования атеросклеротического процесса. Больным назначают препараты следующих групп:
- Гиполипидемические медикаменты. Наибольшая эффективность отмечена у статинов. Лекарства замедляют прогрессирование ишемии и обеспечивают увеличение дистанции, проходимой без появления дискомфортных ощущений. Кроме того, у больных атеросклерозом средства этой группы снижают риск развития тяжелых осложнений со стороны сердца.
- Антиагреганты. Вне зависимости от особенностей анамнеза всем больным с перемежающейся хромотой показан постоянный прием антиагрегантов для профилактики сердечно-сосудистых заболеваний. Доказана связь между применением медикаментов и снижением частоты инфарктов и инсультов.
- Гипотензивные средства. Оптимальным вариантом являются бета-блокаторы и ингибиторы АПФ. Наряду с антигипертензивным эффектом некоторые лекарства из этих групп обеспечивают существенное увеличение продолжительности безболевой ходьбы.
Медикаментозная терапия проводится в постоянном режиме, корректируется врачом при выявлении факторов риска или недостаточной результативности лечения. Самовольное прекращение приема после улучшения состояния недопустимо. Кроме перечисленных препаратов пациенты с сахарным диабетом должны получать инсулинотерапию. Для обеспечения наиболее полной компенсации используются пролонгированные инсулины в сочетании с медикаментами короткого и промежуточного действия.
Для улучшения кровообращения в зоне поражения применяют ингибиторы фосфодиэстеразы, вазодилататоры. При незначительных и умеренных проявлениях ишемии эффективны простаноиды. В рамках метаболической терапии назначаются средства на основе гемодиализатов крупного рогатого скота, однако мнения относительно этого метода лечения варьируются из-за недостатка масштабных клинических исследований. Перспективным направлением считается разработка генотерапевтических препаратов для стимуляции ангиогенеза.
Хирургическое лечение
Критерии желательности и необходимости оперативного лечения несколько разнятся. Наиболее распространен подход, при котором стадия умеренной перемежающейся хромоты считается относительным показанием для вмешательства, а боли покоя и трофические нарушения - абсолютным. В пользу применения оперативного пособия при наличии относительных показаний свидетельствуют жалобы больного на ограничение трудоспособности. Представителям профессий, предусматривающих длительную ходьбу, операции иногда проводят при легкой степени ПХ.
В зависимости от клинической ситуации и других обстоятельств могут применяться открытые и эндоваскулярные хирургические вмешательства для реваскуляризации пораженного сегмента.
- эндартерэктомия;
- дилатация и стентирование сосудов;
- профундопластика;
- артериализация вен стопы.
Шунтирующие методики включают аорто-бедренное, бедренно-подколенное другие варианты шунтирования. В рамках паллиативного лечения для стимуляции коллатерального кровообращения выполняются реваскуляризирующая остеотрепанация, поясничная или периартериальная симпатэктомия. При развитии гангрены показана ампутация конечности.
Исход в определенной степени зависит от причины ПХ. Так, атеросклероз зачастую протекает более благоприятно, чем эндартериит. В большинстве случаев при адекватном лечении и соблюдении рекомендаций лечащего врача прогноз относительно благоприятный. У 75% пациентов даже при продолжении курения заболевание протекает достаточно стабильно, прогрессирование до критической ишемии отмечается у 25% больных. При отказе от курения этот показатель снижается до 8%. Операции требуются в 12% случаев, ампутация конечности - в 2,4%.
Первичные профилактические мероприятия включают нормализацию веса, отказ от курения, достаточную двигательную активность, контроль уровня холестерина, адекватную терапию сахарного диабета. Пациентам с перемежающейся хромотой важно выполнять все врачебные рекомендации, в том числе - относительно приема лекарств и занятий ЛФК. Необходимо носить удобную обувь, предупреждать травмы стопы, регулярно осуществлять профилактический и гигиенический уход за ногами.
1. Перемежающаяся хромота: лечебная тактика практикующего врача/ Калинин Р.Е., Мжаванадзе Н.Д., Деев Р.В.// Лечащий врач - 2013 - №8.
2. Современные принципы лечения перемежающейся хромоты/ Гамзатов Т.Х., Светликов А.В.// Хирургия. Журнал им. Н.И. Пирогова -2016 - №12.
Методы лечения пульсирующих гематом и ложных аневризм периферических артерий после рентгенэндоваскулярных вмешательств
В работе проведен анализ методов лечения 87 больных с ложной аневризмой и пульсирующей гематомой периферических артерий после рентгенэндоваскулярных вмешательств. Всем пациентам с пульсирующей гематомой лечение начиналось с локальной компрессии давящей по
Methods of treatment of pulsating hematoma and false aneurysm peripheral arteries after endovascular interventions Yu. A. Vinogradova, L. S. Kokov, I. P. Mikhailov, V. P. Kiryuschenkov, E. V. Troshkina
87 cases of peripheral artery false aneurysm and pulsating hematoma after endovascular interventions were analyzed. For all patients with pulsating hematoma, the treatment began with local compression with a pressure bandage. The compression efficiency was 89.2%. Attempts of local compression in patients with false aneurysms were not successful and all the patients were operated. Surgical treatment was effective in 100% of false aneurysm cases. The effectiveness of treatment was influenced by: the patient’s intake of anticoagulant and disaggregant drugs, constitutional features of the patient, arterial hypertension, localization and diameter of the post-puncture artery defect. Definitions of pulsating hematoma and false aneurysm of peripheral arteries are formulated.
Эндоваскулярные вмешательства, несмотря на ряд преимуществ перед открытым хирургическим лечением, являются инвазивными методиками и предполагают такие осложнения, как пульсирующие гематомы и ложные аневризмы периферических сосудов, причем их количество увеличивается пропорционально распространению ангиографических методов диагностики и лечения [1, 3-7]. По данным литературы в структуре местных осложнений после пункции артерии ложные аневризмы занимают 60-80% [5]. Для снижения частоты осложнений в настоящее время чаще используют трансаксиллярный, трансбрахиальный и трансрадиальный доступы, ушивающие инструменты. Однако и при таких доступах и развитии эндоваскулярных технологий отмечены повреждения пунктируемой артерии 6. На сегодняшний день актуальными видами лечения пульсирующих гематом и ложных аневризм являются хирургический и компрессионный методы с различными их модификациями [1, 3-5].
Цель работы: проанализировать результаты хирургического и компрессионного методов лечения ложных аневризм и пульсирующих гематом периферических артерий после эндоваскулярных вмешательств.
Материалы и методы исследования
Проанализированы результаты лечения 87 больных с пульсирующими гематомами и ложными аневризмами, находившихся в институте им. Н. В. Склифосовского с 2010 г. по январь 2018 г., в возрасте от 40 до 83 лет. У всех пациентов причиной патологии являлись эндоваскулярные вмешательства, 69 (79,3%) из которых выполнены в других лечебных учреждениях, с последующим поступлением по экстренным показаниям в сроки после манипуляций от 4 суток до 2 месяцев. Большая часть ложных аневризм (23 (88,5%) из 26 случаев) выявлена у пациентов с выполненными эндоваскулярными вмешательствами на коронарных артериях, причем у 14 (53,8%) больных с ложной аневризмой из 23 пациентов было выполнено стентирование коронарных артерий на фоне приема дезагрегантных препаратов (клопидогрел (Плавикс)).
Локализация повреждения: бедренная артерия в 75 случаях (86,2%), подмышечная артерия — 9 (10,3%), плечевая артерия — 2 (2,3%), в одном случае лучевая артерия. Из подтвержденной сопутствующей патологии артериальная гипертензия отмечена у 79 пациентов (90,8%); ожирение II-III степени у 21 (24,1%); сахарный диабет 2 типа средней тяжести у 25 (28,7%); атеросклеротический постинфарктный кардиосклероз у 44 пациентов (50,6%). Атеросклероз артерий нижних конечностей (гемодинамически значимые стенозы/окклюзия поверхностной бедренной артерии) выявлен у 38 больных (43,7%). Прием антикоагулянтных (варфарин, Ксарелто) и дезагрегантных препаратов (клопидогрел (Плавикс, Зилт)) до эндоваскулярных вмешательств отмечен у 61 (70,1%) пациента из 87.
Диагноз ложной аневризмы был установлен 26 (29,9%) больным, пульсирующей гематомы — 61 (70,1%).
При опросе пациентов при поступлении и первичном осмотре обращали внимание на наличие болезненности и припухлости в области выполненной пункции, пульсирующего образования и изменения кожных покровов над ним, систолического шума в области образования. При анализе анамнеза каждого пациента уделяли внимание таким моментам, как давность и объем эндоваскулярного вмешательства; сроки пребывания в стационаре. Ультразвуковое исследование было первым и основным этапом инструментального обследования пациентов. Исследование проведено на ультразвуковой системе Philips iU 22 мультичастотными линейными датчиками L9 — 3 МГц, L15 — 7 МГц.
Под пульсирующей гематомой понимали пульсирующее опухолевидное образование (до 3,0 см в диаметре) в области пункции с экхимозом и болью в области пункции в сроки от 2-5 суток после вмешательства или ограниченное/диффузное выпячивание сосудистой стенки либо полость, образовавшуюся около стенки сосуда, сообщающуюся с ее просветом в сроки от 2 до 5 суток после манипуляции. Постпункционной ложной аневризмой считали патологическую полость в окружающих тканях, образовавшуюся путем организации околососудистой гематомы вследствие дефекта артериальной стенки и сообщающейся с просветом артерии, в сроки после 17 дней с момента манипуляции.
Результаты исследования
Открытое хирургическое лечение выполнено 31 (35,6%) больному, из них 26 пациентов с ложной аневризмой (рис. 5-6) и 5 с пульсирующей гематомой. Сроки выполнения реконструктивной сосудистой операции варьировались от 1 часа до 7 суток. Структура оперативных вмешательств: сосудистый шов артериального дефекта — 28 (90,3%); реконструкция артерии — 3 (9,7%). У всех пациентов удалось добиться восстановления целостности сосуда.
На исход лечения влияли: прием дезагрегантных и антикоагулянтных препаратов и их дозировка до и после эндоваскулярных вмешательств; конституциональные особенности больного, артериальная гипертензия, атеросклеротическое поражение артерии. Положительный исход компрессионного лечения зависел также от величины дефекта артерии, который оценивали по данным ультразвукового метода. При размере дефекта 1-2 мм положительный результат у 46 (92%), при размере 2,1-3 мм — у 4 больных (8%). Эффективность оперативного лечения составила 100%. В послеоперационном периоде был один летальный исход вследствие декомпенсации основного заболевания на фоне до- и интраоперацонной кровопотери; у одного пациента развилась ишемическая гангрена нижней конечности (декомпенсированное кровообращение при поступлении (сахарный диабет)); у трех пациентов отмечалась кожная гиперестезия с последующим регрессом симптоматики через один месяц. Несостоятельности кожных швов, нагноений, лимфорреи, кровотечения из послеоперационной раны не было.
Выводы
- Основным и первым методом лечения пульсирующих гематом является локальная компрессия в течение суток с последующим ультразвуковым контролем.
- На эффективность локальной компрессии влияет прием пациентом антикоагулянтных и дезагрегантных препаратов, конституциональные особенности больного, артериальная гипертензия, локализация и диаметр постпункционного дефекта артерии, комплаентность больного.
- Компрессионное лечение эффективно у больных с пульсирующей гематомой при размере дефекта стенки артерии до 2 мм; при размере дефекта артерии более 2 мм результативно хирургическое лечение.
- Открытое хирургическое лечение эффективно в 100% случаев и является основным методом в лечении ложных аневризм периферических артерий.
Литература
- Гавриленко А. В., Синявин Г. В. Лечение ложных ятрогенных артериальных аневризм // Ангиология и сосудистая хирургия. 2005; 135-138.
- Бочаров С. М. Ангиографическая диагностика и эндоваскулярное лечение при травме артерий. Автореф. дис. … канд. мед. наук. М., 2009. 24 с.
- Seidel A. C., Miranda F. Jr., Fregadolli L. V. Atrogenic pseudoaneurysm of axillary artery // Arg. Bras. Cardiol. 2006; 86 (4): 303-305.
- Houlind K., Jepsen J M., Saicu C. et al. Current management of inguinal false aneurysms//J. Cardiovascular. Surg. 2017; 58 (2): 278-283.
- Панфилов Д. С., Козлов Б. Н., Панфилов С. Д. и др. Проблема лечения постпункционных ложных аневризм: компрессионный, хирургический, пункционный подходы // Сибирский мед. журнал. 2012; 27 (1): 39-44.
- Фокин А. А., Киреев К. А., Москвичева М. Г., Киреева Т. С. Профилактика постпункционных ятрогенных ложных аневризм бедренных артерий после коронарных вмешательств при инфаркте миокарда // Ангиология и сосудистая хирургия. 2016; 22 (2): 139-144.
- Михайлов И. П., Исаев Г. А., Коков Л. С. и др. Использование системного тромболизиса для лечения острой ишемии конечностей // Неотложная медицинская помощь. 2015; 2: 32-34.
Ю. А. Виноградова 1
Л. С. Коков, доктор медицинских наук, профессор, член-корреспондент РАН
И. П. Михайлов, доктор медицинских наук, профессор
В. П. Кирющенков
Е. В. Трошкина
ГБУЗ НИИ СП им. Н. В. Склифосовского ДЗМ, Москва
Методы лечения пульсирующих гематом и ложных аневризм периферических артерий после рентгенэндоваскулярных вмешательств/ Ю. А. Виноградова, Л. С. Коков, И. П. Михайлов, В. П. Кирющенков, Е. В. Трошкина
Для цитирования: Лечащий врач № 7/2018; Номера страниц в выпуске: 21-24
Теги: периферические артерии, осложнения, диагностика, стентирование
Тромбоз при ретроградной артериальной катетеризации. Перемежающаяся хромота после артериальной катетеризации
Центральная клиническая больница с поликлиникой Управления делами Президента РФ, Москва, Россия
Центральная клиническая больница с поликлиникой Управления делами Президента РФ, Москва
Учебно-научный медицинский центр Управления делами Президента РФ, Москва
ФГБУ ДПО «Центральная государственная медицинская академия» УД Президента РФ, Москва, Россия
Трудности катетеризации центральной вены, обусловленные аномальным развитием сердечно-сосудистой системы
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(1): 65‑67
Пункция и катетеризация центральных вен являются одной из наиболее частых манипуляций в практике врача анестезиолога-реаниматолога. Показанием к этой процедуре является необходимость проведения объемной и длительной инфузионной терапии, инвазивного мониторинга внутрисердечной гемодинамики, введения препаратов, раздражающих стенку периферических вен, и средств для парентерального питания, эндокардиальной электрокардиостимуляции, обеспечения венозного доступа при неконтурируемых периферических венах и др. В критическом состоянии больных, как правило, имеется хотя бы одно из перечисленных выше обстоятельств, что обусловливает частое применение доступа к центральным венам в отделениях реанимации и интенсивной терапии, а также при проведении анестезии. Однако эта манипуляция сопряжена с риском серьезных осложнений, таких как воздушная эмболия и тромбоэмболия, гематома, пневмоторакс, гидроторакс, повреждение близлежащих нервов и артерий, тампонада сердца, аритмия, септические осложнения.
Выделяют две группы причин перечисленных осложнений. Во-первых, это, конечно, недостаточно хорошее владение методикой катетеризации, нарушение техники проведения манипуляции и контроля за ее результатом. Эту группу причин можно условно отнести к устранимым. Ко второй группе относят осложнения ввиду измененной топографии пунктируемых элементов, например сосудистого пучка. В таких клинических ситуациях, знакомых большинству врачей-интенсивистов, даже ординарное расположение наружных анатомических ориентиров не гарантирует удачную пункционную катетеризацию центральной вены с первого раза. Не погрешив против истины, можно утверждать, что попытки объективизировать эту процедуру, проводимую по сути вслепую, предпринимали на заре зарождения методики.
В последнее время во многих клиниках набирает популярность ультразвуковой (УЗ) контроль при катетеризации центральных сосудов, особенно при катетеризации внутренней яремной вены. Такая методика значительно снижает риск неудачной пункции вены, пункции артерии и возникновения других осложнений. Так, по результатам исследования F. Gualtieri и соавт. [6], применение УЗ-контроля позволило снизить количество осложнений и неудачных пункций до 4%. За последние годы сразу несколько обществ и ассоциаций, включая Американское общество анестезиологов (ASA), опубликовали рекомендации по проведению катетеризации под УЗ-контролем [1]. К сожалению, на данном этапе развития медицины ни одна методика не может полностью исключить риск осложнений при столь часто применяемых манипуляциях ввиду неоптимального сочетания таких свойств инструментов мониторирования, как простота использования, оперативность и информативность.
Приводим клиническое наблюдение.
Больная Н., 45 лет, поступила в стационар для оперативного лечения по поводу опухоли левой почки с метастазами в оба надпочечника. 08.04.13 больной была выполнена плановая двусторонняя адреналэктомия под комбинированной эндотрахеальной анестезией. Наркоз и операция протекали без особенностей, после чего больная доставлена в отделение анестезиологии и реанимации. Поступила в послеоперационную палату в состоянии медикаментозной седации (6 баллов по шкале Ramsay) для продленной искусственной вентиляции легких при SO 2 100%, АД 110/50 мм рт.ст., ЧСС 74 в 1 мин. С учетом предполагаемой в дальнейшем длительной инфузионной терапии было принято решение о катетеризации центральной вены. Во время процедуры возникли технические сложности. Предпринимали несколько попыток катетеризации правой подключичной и правой внутренней яремной вен. Каждый раз получали пунктат венозной крови, но завести проводник на необходимую длину не удавалось. В конечном итоге с применением УЗ-контроля была произведена пункция и катетеризация левой внутренней яремной вены из медиального доступа и катетер проведен на 15 см.
Сразу после постановки катетера было измерено центральное венозное давление (ЦВД), которое превышало норму и составило 25 см вод.ст. При этом у больной отсутствовали проявления сердечной недостаточности. Обращало на себя внимание поступление из катетера при аспирации шприцем крови алого цвета. Ввиду признаков артериализации венозной крови катетер перекрыли и дальнейшую инфузионную терапию проводили по катетеру, установленному в правую кубитальную вену, образец крови был отправлен в лабораторию для анализа газового состава и кислотно-щелочного равновесия (КЩР). Также была выполнена рентгенография грудной клетки.
При анализе газов крови и КЩР получены результаты, приведенные в табл. 1. Очевидно, что имевшиеся наибольшие различия показателей напряжения кислорода и углекислого газа в изучаемых пробах могли быть связаны как с витральными диффузионными потерями во время транспортировки проб, так и с примешиванием артериальной крови в пробе из катетера.
В контрольных анализах газов крови и КШР на спонтанном дыхании (табл. 2), взятых в начале 2-х суток пребывания в послеоперационном отделении, прослеживаются признаки уменьшения количества примешиваемой артериальной крови, что с уверенностью можно считать следствием успешной рентгеноскопической дислокации катетера.
Аномальный дренаж легочных вен - врожденный порок, при котором часть легочных вен или все легочные вены впадают в правое предсердие или магистральные вены большого круга кровообращения [1]. Частичный аномальный дренаж легочных вен (ЧАДЛВ) характеризуется тем, что порочные связи с правым предсердием имеют одна или несколько легочных вен, но не все. При тотальном аномальном дренаже легочных вен (ТАДЛВ) они не имеют связи с левыми отделами сердца и вся кровь, поступающая из малого круга кровообращения, возвращается в правое предсердие. Необходимо отметить, что в большинстве наблюдений такой тип порока развития сочетается с дефектом межпредсердной перегородки и в изолированном виде встречается редко.
Некорректная позиция дистального конца катетера, по разным данным, может встречаться в каждом пятом случае катетеризации центральных вен. Чаще ее отмечают при катетеризации подключичной вены (в 14,6% наблюдений), реже -
при катетеризации внутренней яремной вены (2,4%) [3].
УЗ-контроль, по видимому, не способствует снижению вероятности атипичной катетеризации, однако достоверно уменьшает процент неудачных катетеризаций и других осложнений, связанных с повреждением паравенозных структур. Недостаточная удовлетворенность клиницистов принятыми методиками мониторирования пункции центральных вен стимулирует поиск новых методов такого контроля. В последнее время становится популярным ЭКГ-контроль позиции катетера. Метод заключается в том, что J-образный проводник используется в качестве внутрипредсердного электрода с применением адаптера, переключающего один из электродов монитора на проводник катетера. Появление на мониторе (в I либо во II стандартном отведении) предсердного зубца P служит критерием попадания проводника в правое предсердие [4]. Рентгенологический контроль является стандартом контроля позиции центрального венозного катетера, из недостатков стоит отметить его громоздкость и ретроспективность.
Представленное наблюдение является казуистическим, подобные патологические изменения в изолированном виде, в отсутствие комбинированных кардиологических заболеваний, встречаются крайне редко. Частичный аномальный дренаж легочных вен явился диагностической находкой у больной без кардиологического анамнеза, не предъявлявшей никаких жалоб, которые могли послужить поводом для углубленного кардиологического исследования. Описанное клиническое наблюдение лишний раз иллюстрирует важность контроля позиции центрального венозного катетера в рутинной практике. Контроль ЦВД, аспирация крови из катетера и рентгенография грудной клетки должны проводиться после каждой катетеризации центральной вены с целью диагностики возможных осложнений и контроля позиции дистального конца катетера. Ультразвуковой контроль при выполнении пункции и катетеризации центральной вены достоверно уменьшает количество неудачных попыток пункции и осложнений, но не снижает вероятности атипичной катетеризации. В диагностически неясных ситуациях ангиография может быть целесообразна для уточнения локализации катетера и правильной его установки.
Читайте также:
