УЗИ, ЭхоКГ при тотальном аномальном дренаже легочных вен у плода
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Эхокардиография и врожденная корригированная транспозиция магистральных артерий
Несмотря на то, что этот врожденный порок сердца, который мы определяем на эхокардиографии, назван из-за поражения, связанного с ненормальным соединением и положением крупных артерий (аорта и легочная артерия), лучше рассматривать патологию как отклонение развития и положение желудочков. Эмбриональная петля желудочка у больных с врожденной корригированной транспозицией магистральных артерий является патологической. Это приводит к тому, что морфологически правый желудочек (ПЖ) формируется на левой стороне сердца и становится связанным с легочной артерией и легочными венами. Морфологически левый желудочек (ЛЖ) развивается на правой стороне сердца и становится связанным с легочной артерией и системными венами. Это обратное соединение предсердий с желудочками хорошо определяется на эхокардиографии и называется дискордантным расположением предсердий желудочков.
Хотя врожденная корригированная транспозиция магистральный артерий (КТМС) и полная транспозиция магистральных артерий имеют схожие названия, их анатомические и физиологические особенности очень различны. Несогласованные соединения, присущие КТМС, приводят к тому, что венозные потоки направляются в соответствующие артерии, но через «неправильные» желудочки. На эхокардиографическом исследовании видно, как неправильно размещен морфологически ПЖ, на анатомически ЛЖ, который, в свою очередь, вразнобой подключен к аорте. Справа соединения сердца точно так же неверные, к легочному венозному потоку, проходящему через легочную артерию, присоединен морфологически ЛЖ.
В части случаев, находка данного порока на эхокардиографии бывает случайной. При отсутствии других аномалий эти пациенты не являются цианотическими. В действительности, если никакие другие дефекты не присутствуют, то часто нет условий для клинических проявлений и порок не может быть диагностирован у многих пациентов до взрослого возраста. Проблемы возникают у этих пациентов, когда неадекватный желудочек (морфологический ПЖ) перестает адекватно поддерживать аортальную циркуляцию. Морфологические ПЖ и трикуспидальный клапан не очень хорошо переносят нагрузки аортального давления, как морфологически сформированный ЛЖ и митральный клапан, расположенный со стороны венозной циркуляции. Следовательно, наиболее распространенными поздними осложнениями у пациентов с врожденной корригированной транспозицией магистральных артерий являются системная регургитация атриовентрикулярного клапана и дисфункция желудочков.
Кроме находок на эхокардиографии, пациенты с врожденной корригированной транспозицией магистральных артерий также имеют повышенную частоту полной атривентрикулярной блокады (как врожденного, так и приобретенного характера). Аномальное перемещение желудочков при развитии плода создает аномалию системы проводимости (переднее отклонение АВ узла). Аномалия петли желудочка, наблюдаемая при КТМС, часто связана с аномальным развитием перегородки или магистральных артерий и области конотрункуса. В классическом случае изначально корригированная транспозициия магистральных артерий приводит ко второй диссонирующей связи с неправильным артериальным корнем. Аортальный клапан находится спереди и слева от легочного клапана и соединен с левосторонним морфологическим ПЖ. Эта позиция кпереди и влево от аорты является причиной данного дефекта является сокращенно «L-КТМС». Таким образом, кроме эхокардиографии, на ЭКГ возникает как результат порока фибрилляция предсердий и желудочковая блокада (синдром Фредерика), что является четкой отличительной чертой этого порока.
Синдром гипоплазии левых отделов сердца
Синдром гипоплазии левых отделов сердца - группа морфологически близких дефектов сердца, включающих недоразвитие его левых отделов, атрезию или стеноз аортального и/или митрального клапанного отверстия, резкую гипоплазию восходящей аорты или комбинацию этих дефектов. Проявления синдрома развиваются по мере закрытия артериального протока, в первые сутки жизни новорожденного и характеризуются признаками кардиогенного шока: тахипноэ, одышкой, слабым пульсом, бледностью и цианозом, гипотермией. Диагноз синдрома гипоплазии левых отделов сердца можно предположить на основании двухмерной эхокардиографии, катетеризации сердца, рентгенографии, ЭКГ. Ведение больных с синдромом гипоплазии левых отделов сердца предполагает инфузию простагландина Е1; проведение ИВЛ, коррекцию метаболического ацидоза; поэтапную хирургическую коррекцию порока (операция Норвуда - операция Гленна или Геми-Фонтена - операция Фонтена).

Общие сведения
Синдром гипоплазии левых отделов сердца (СГЛОС) - термин, используемый для обозначения критического врожденного порока сердца, характеризующегося резким недоразвитием его левых камер и восходящей части аорты, а также митральным или аортальным стенозом. Синдром входит в пятерку наиболее часто встречающихся в кардиологии ВПС, наряду с дефектом межжелудочковой перегородки, транспозицией магистральных сосудов, тетрадой Фалло и коарктацией аорты. СГЛОС составляет 2-4% от всех встречающихся врожденных аномалий сердца, являясь ведущей причиной гибели новорожденных в первые дни и недели жизни. Мальчики страдают данным сочетанным пороком сердца в 2 раза чаще, чем девочки.

Причины СГЛОС
Причины гипоплазии левых отделов сердца достоверно неясны. Предполагается возможность аутосомно-рецессивного, аутосомно-доминантного и полигенного типов наследования. Наиболее вероятной является теория мультифакториальной этиологии порока.
Различают два морфологических варианта СГЛОС. Первый (наиболее тяжелый) вариант включает гипоплазию левого желудочка и атрезию устья аорты, которые могут сочетаться с атрезией либо стенозом митрального отверстия; при этом полость левого желудочка щелевидна, ее объем составляет не более 1 мл. При втором (наиболее распространенном) варианте порока имеет место гипоплазия левого желудочка, стеноз устья аорты и гипоплазия ее восходящего отдела в сочетании с митральным стенозом; объем полости левого желудочка равен 1-4,5 мл.
Оба варианта гипоплазия левых отделов сердца сопровождаются наличием широкого открытого артериального протока и открытого овального окна, расширением правых отделов сердца и ствола легочной артерии, гипертрофией миокарда правого желудочка; нередко - фиброэластозом эндокарда.
Особенности гемодинамики
Тяжелые расстройства кровообращения при гипоплазии левых отделов сердца развиваются вскоре после рождения и характеризуются в литературе как «гемодинамическая катастрофа». Сущность нарушения гемодинамики определяется тем фактом, что кровь из левого предсердия не может поступить в гипоплазированный левый желудочек, а вместо этого попадает через открытое овальное окно в правые отделы сердца, где происходит ее смешение с венозной кровью. Эта особенность приводит к объемной перегрузке правых отделов сердца и их дилатации, которые наблюдаются с момента рождения.
В дальнейшем основной объем смешанной крови из правого желудочка поступает в легочную артерию, остальная же часть недонасыщенной кислородом крови через открытый артериальный проток устремляется в аорту и большой круг кровообращения. Ретроградным путем небольшое количество крови поступает в гипоплазированную часть восходящей аорты и венечные сосуды.
Фактически правый желудочек берет на себя двойную функцию, перекачивая кровь в легочный и системный круг кровообращения. Попадание крови в большой круг кровообращения возможно только по артериальному протоку, в связи с чем гипоплазия левых отделов сердца рассматривается как порок с дуктус-зависимым кровообращением. Прогноз для жизни ребенка зависит от сохранения артериального протока открытым.
Тяжелейшие расстройства гемодинамики приводят к выраженной легочной гипертензии вследствие высокого давления в системе сосудов малого круга; артериальной гипотонии, обусловленной неадекватным наполнением большого круга; артериальной гипоксемии, связанной со смешением крови в правом желудочке.
Симптомы СГЛОС
Клинические признаки, указывающие на гипоплазию левых отделов сердца, проявляются в первые часы или сутки после рождения. По своим проявлениям они схожи с респираторным дистресс-синдромом или кардиогенным шоком.
Как правило, дети с СГЛОС рождаются доношенными. У новорожденных наблюдается адинамия, сероватый цвет кожных покровов, тахипноэ, тахикардия, гипотермия. При рождении цианоз выражен незначительно, однако вскоре нарастает и становится диффузным либо дифференцированным, только на нижней половине туловища. Конечности наощупь холодные, периферическая пульсация на них ослаблена.
С первых дней жизни нарастает сердечная недостаточность с застойными хрипами в легких, увеличением печени, периферическими отеками. Характерно развитие метаболического ацидоза, олигурии и анурии. Нарушение системной циркуляции сопровождается неадекватной церебральной и коронарной перфузией, что приводит к развитию ишемии головного мозга и миокарда. В случае закрытия артериального протока ребенок быстро погибает.
Диагностика
Во многих случаях диагноз синдрома гипоплазии левых отделов сердца ставится еще до рождения ребенка при проведении ЭхоКГ плода. При объективном обследовании новорожденного ребенка определяется слабый пульс на руках и ногах, одышка в покое, усиленный сердечный толчок и видимая эпигастральная пульсация; выслушивается систолический шум изгнания, ритм галопа и одинарный II тон.
На ЭКГ отмечается отклонение ЭОС вправо, признаки резкой гипертрофии правых отделов сердца и левого предсердия. Фонокардиография фиксирует наличие низко- или среднеамплитудного систолического шума. Рентгенография грудной клетки при синдроме гипоплазии левых отделов сердца выявляет высокую степень кардиомегалии, шарообразные контуры сердечной тени, усиление легочного рисунка.
Эхокардиография обнаруживает следующие характерные признаки гипоплазии сердца: стеноз устья аорты и ее восходящего отдела, уменьшение размеров левого желудочка и увеличение правого желудочка, грубые изменения митрального клапана.
Зондирование полостей сердца обнаруживает пониженное насыщение крови кислородом в периферических артериях, лево-правый сброс крови на уровне предсердий, повышенное давление в правом желудочке и легочной артерии. Ангиокардиография позволяет визуализировать открытый артериальный проток, гипоплазированную восходящую аорту, резко дилатированный правый желудочек, расширенный легочный ствол и легочные артерии.
Дифференциальный диагноз при синдроме гипоплазии левых отделов сердца необходим с гипоплазией правого желудочка, единственным желудочком сердца, аномальным дренажем легочных вен, транспозицией магистральных сосудов, изолированным аортальным стенозом. Из внесердечных аномалий необходимо исключить острую дыхательную недостаточность, травму черепа, кровоизлияние в мозг.
Лечение СГЛОС
Наблюдение за новорожденными осуществляется в отделении реанимации. Для предупреждения закрытия или попытки открытия артериального протока осуществляется инфузия простагландина Е1. Необходимо проведение ИВЛ, коррекция метаболического ацидоза, введение диуретиков и инотропных препаратов.
Хирургическая коррекция гипоплазии левых отделов сердца проводится поэтапно и последовательно. Первый этап лечения - паллиативный; проводится в первые 2 недели жизни и заключается в выполнении операции Норвуда для уменьшения нагрузки на легочную артерию, и в то же время, для обеспечения кровоснабжения аорты. На втором этапе, в возрасте 3-6 месяцев ребенку выполняется операция Геми-Фонтена (или операция Гленна по наложению двухстороннего двунаправленного кава-пульмонального анастомоза). Окончательная гемодинамическая коррекция порока проводится примерно через год путем выполнения операции Фонтена (наложения тотального кавопульмонального анастомоза), позволяющей полностью разобщить круги кровообращения.
Прогноз
Порок является крайне неблагоприятным в отношении прогноза. В первый месяц жизни погибает около 90% детей с гипоплазией левых отделов сердца. Выживаемость после 1-го корригирующего этапа составляет 75 %, после 2-го - 95 %, после 3-го - 90 %. В целом через 5 лет после полной коррекции порока в живых остаются 70% детей.
Если гипоплазия левых отделов сердца выявляется у ребенка внутриутробно, ведение беременности и родоразрешение проводится в условиях специализированного перинатального медицинского центра. С первых дней жизни ребенок должен находиться под наблюдением неонатолога, детского кардиолога и кардиохирурга для проведения как можно более ранней коррекции порока.
Аномальный дренаж легочных вен
Аномальный дренаж легочных вен - это врожденная патология сердца, морфологическую основу которой составляет аномальное впадение легочных вен в правое предсердие либо входящие в него полые вены. Аномальный дренаж легочных вен проявляется утомляемостью, отставанием в физическом развитии, болями в сердце, одышкой, повторными пневмониями. Для диагностики аномального дренажа легочных вен проводится рентгенография, ЭКГ, УЗИ сердца, зондирование сердца, ангиопульмонография, атрио- и вентрикулография, МРТ. Варианты хирургической коррекции аномального дренажа легочных вен различаются в зависимости от типа порока.
МКБ-10



Аномальный дренаж легочных вен - врожденный порок сердца, при котором имеет место впадение устьев всех или отдельных легочных вен в правое предсердие, венечный синус или полые вены. Аномальный дренаж легочных вен составляет 1,5-3% всех ВПС в кардиохирургии с преобладанием у лиц мужского пола.
Чаще всего аномальный дренаж легочных вен сочетается с дефектом межпредсердной перегородки (ДМПП) и открытым овальным окном; в 20% случаев - с общим артериальным стволом, ДМЖП, транспозицией магистральных сосудов, тетрадой Фалло, стенозом легочной артерии, гипоплазией левых отделов сердца, единственным желудочком сердца, декстрокардией. Из экстракардиальной патологии у пациентов с аномальным дренажом легочных вен встречаются дивертикулы кишечника, пупочные грыжи, поликистоз почек, гидронефроз, подковообразная почка, а также различные пороки развития костной и эндокринной систем.

Причины
Общие причины, формирующие аномальный дренаж легочных вен, не отличаются от таковых при других ВПС. Непосредственное разобщение легочных вен с левым предсердием может быть связано с двумя факторами:
- отсутствием их соединения;
- ранней атрезией общей легочной вены.
В первом случае под воздействием неблагоприятных условий левопредсердный вырост не связывается должным образом с венозными сплетениями зачатка легкого, что приводит к формированию аномального венозного дренажа. При ранней атрезии имеет место первоначальное соединение общей легочной вены и легочного сосудистого ложа, однако в дальнейшем происходит облитерация их просвета, поэтому венозный легочный возврат начинает осуществляться через другие доступные коллатеральные пути.
Патогенез
В антенатальном периоде порок обычно не имеет гемодинамических проявлений, поскольку внутрисердечное кровообращение у плода подразумевает поступление крови из правого предсердия в левое (через открытое овальное окно) и в боталлов проток. После рождения выраженность гемодинамических нарушений определяют форма (полная или частичная), вариант аномального дренажа легочных вен, а также сочетание порока с другими дефектами сердца.
При частичной форме аномального дренажа легочных вен гемодинамические нарушения аналогичны таковым при межпредсердных дефектах. Определяющая роль среди них принадлежит патологическому артерио-венозному сбросу крови, приводящему к увеличению объема крови в легочном круге кровообращения.

Классификация
При впадении устьев всех легочных вен в венозную систему большого круга кровообращения или правое предсердие говорят о полном (тотальном) аномальном дренаже легочных вен. Если в правое предсердие или большой круг дренируется одна или несколько легочных вен, такая форма порока называется частичной. Чаще всего (в 97% случаев) аномально дренируются вены, отходящие от правого легкого.
На основании уровня впадения легочных вен аномальный дренаж классифицируется на 4 анатомических типа (варианта).
- I вариант - супракардиальный (надсердечный). Легочные вены общим коллектором или по-отдельности дренируются в верхнюю полую вену или ее ветви (непарную вену, левую безымянную либо добавочную верхнюю полую вену).
- II вариант - интракардиальный (сердечный). Аномальный дренаж легочных вен происходит в правое предсердие или венечный синус.
- III вариант - субкардиальный, инфракардиальный (подсердечный). Легочные вены впадают в нижнюю полую или воротную вену (редко - в лимфатический проток).
- IV вариант - смешанный. Аномальный дренаж легочных вен в венозную систему осуществляется на различных уровнях в разных сочетаниях.
Симптомы
В основе клинических проявлений аномального дренажа легочных вен лежат анатомо-гемодинамические особенности: уровень общелегочного сопротивления, степень обструкции венозного возврата, размеры межпредсердной коммуникации, функционирование миокарда правого желудочка. При отсутствии дефекта в межпредсердной перегородке или его чрезвычайно маленьком размере порок несовместим с жизнью - в этом случае спасти ребенка позволяет только экстренная эндоваскулярная баллонная атриосептостомия по Рашкинду.
У детей с аномальным дренажом легочных вен отмечаются частые повторные пневмонии и ОРВИ, малая прибавка в массе, одышка, легкий цианоз, кашель, быстрая утомляемость, отставание в физическом развитии, боли в сердце, тахикардия. При выраженной легочной гипертензии уже в раннем детстве развиваются выраженный цианоз, сердечный горб и сердечная недостаточность.
Аускультативная картина аномального дренажа легочных вен напоминает ДМПП и характеризуется негрубым систолическим шумом в проекции легочной артерии, расщеплением II тона. После консультации кардиохирурга проводится:
- Электрокардиография. Данные ЭКГ свидетельствуют о перегрузке правых отделов, неполной блокаде правой ножки пучка Гиса; ЭОС отклонена вправо. Фонокардиография соответствует всем признакам ДМПП.
- Рентген. При анализе результатов рентгенографии грудной клетки обращает внимание расширение границ сердца вправо, выбухание дуги легочной артерии, усиление легочного рисунка. Достоверным признаком аномального дренажа легочных вен в нижнюю полую вену является симптом «турецкой сабли».Правая атриография, вентрикулография, ангиопульмонография, флебография ВПВ позволяют проследить движение контраста через малый круг кровообращения в правое предсердие или полые вены.
- УЗИ сердца. По данным ЭхоКГ устья легочных вен в левом предсердии не обнаруживаются; выявляется дилатация правого желудочка, уменьшенные размеры левых отделов сердца и другие косвенные признаки аномального дренажа легочных вен. Старшим детям и взрослым проводится чреспищеводная ЭхоКГ.
- Инвазивная диагностика. При зондировании полостей сердца катетер из правого предсердия или полой вены проводится в легочную вену. На данном этапе диагностики возможно установить локализацию впадения и количество аномально дренирующихся легочных вен.
У пациентов с аномальным дренажом легочных вен в дифференциально-диагностическом плане необходимо исключить атрезию митрального или аортального клапана, митральный стеноз, изолированный ДМПП, трехпредсердное сердце, стеноз легочных вен, транспозицию магистральных сосудов, лимфангиоэктазию.

Лечение аномального дренажа легочных вен
Естественное течение тотального аномального дренажа легочных вен неблагоприятно: 80% детей погибает в первый год жизни. Пациенты с частичным дренажом легочных вен могут дожить до 20-30 лет. Гибель больных связана с тяжелой сердечной недостаточностью или легочными инфекциями. Результаты хирургической коррекции аномального дренажа легочных вен удовлетворительные, однако среди новорожденных интра- и послеоперационная летальность остается высокой.
2. Сравнительный анализ отдаленных результатов коррекции частичного аномального дренажа правых верхних легочных вен в верхнюю полую вену/ Связов Е.А.// Сибирский журнал клинической и экспериментальной медицины. - 2017.
3. Восстановление синусового ритма после коррекции частичного аномального дренажа легочных вен/ Сабирова Д.Р.// Казанский медицинский журнал. - 2009.
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки (ДМЖП) - отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки - наиболее часто встречающийся врожденный порок сердца (9-25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Дефект межжелудочковой перегородки может быть единственной внутрисердечной аномалией (изолированный ДМЖП) или входить в структуру сложных пороков (тетрады Фалло, общего артериального ствола, транспозиции магистральных сосудов, атрезии трехстворчатого клапана и др.). В ряде случаев межжелудочковая перегородка может отсутствовать полностью - такое состояние характеризуется как единственный желудочек сердца.
Причины дефекта межжелудочковой перегородки
Чаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки (20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность митрального клапана (2%), реже - аномальный дренаж легочных вен, стеноз легочной артерии и др.
В 25-50% случаев дефект межжелудочковой перегородки сочетается с пороками развития внесердечной локализации - болезнью Дауна, аномалиями развития почек, расщелиной твердого неба и заячьей губой.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
Межжелудочковая перегородка образует внутренние стенки обоих желудочков и составляет примерно 1/3 площади каждого из них. Межжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь, мышечный отдел состоит из 3-х частей - приточной, трабекулярной и отточной (инфундибулярной).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова-Роже), средний - равен примерно 1/2 диаметра аортального отверстия, большой - равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
- перимембранозные дефекты межжелудочковой перегородки - 75% (приточные, трабекулярные, инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться самопроизвольно;
- мышечные дефекты межжелудочковой перегородки - 10% (приточные, трабекулярные) - расположены в мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
- надгребневые дефекты межжелудочковой перегородки - 5% - расположены выше наджелудочкового гребня (мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не закрываются.
Симптомы дефекта межжелудочковой перегородки
Клинические проявления больших и малых изолированных дефектов межжелудочковой перегородки различны. Малые дефекты межжелудочковой перегородки (болезнь Толочинова—Роже) имеют диаметр менее 1 см и встречаются в 25-40% от числа всех ДМЖП. Проявляются нерезко выраженной утомляемостью и одышкой при нагрузке. Физическое развитие детей, как правило, не нарушено. Иногда у них определяется слабо выраженное куполообразное выпячивание грудной клетки в области сердца - «сердечный горб». Характерным клиническим признаком малых дефектов межжелудочковой перегородки служит аускультативно выявляемое наличие грубого систолического шума над областью сердца, который фиксируется уже на первой неделе жизни.
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое, повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки - частые респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Эхокардиография при аномальном дренаже легочных вен
Аномальные соединения легочных вен на эхокардиографии
На эхокардиографии аномальный дренаж легочных вен (AДЛВ) устанавливается, когда некоторые или сразу все легочные вены не соединяются непосредственно с левым предсердием. При этом, если только некоторые вены аномально соединяются, то состояние на УЗИ сердца описывают как частичный АДЛВ, а если все вены аномально впадают не в левое предсердие, то устанавливается диагноз полный (тотальный) АДЛВ. Существует множество возможных аномальных соединений из легких вен с сердечными камерами или экстракардиальными сосудами.
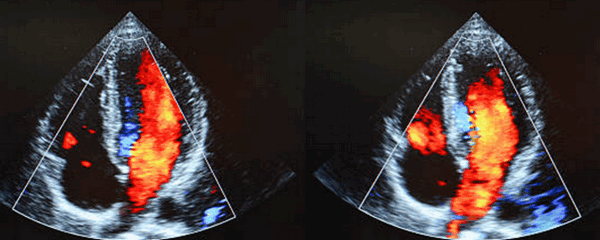
Полный аномальный дренаж легочных вен на УЗИ сердца
ПАДЛВ обычно присутствует в раннем детстве. Такая патология обычно проявляется сразу, так как патологическое соединение всех вен проявляется в качестве критического состояния у больных новорожденных с дыхательной недостаточностью и отеком легких. Физиологические особенности в этих случаях схожи с особенностями очень тяжелого стеноза митрального клапана. Беспрепятственные соединения ведут себя, как большой шунт на уровне предсердий, и пациенты, сильные шумы или сердечную недостаточность, чаще всего в течение первого года жизни. ПАДЛВ обычно классифицируются в зависимости от положения аномальных соединений по отношению к сердцу. Супракардиальная связь возникает, когда общая легочная вена соединяется с более высоким системным венозным кровообращением (верхней полой или непарной веной). Связь между легочными венозными сосудами и системным венозным кровообращением обычно описывается как вертикальная вена или вертикальная дренирующая вена. Эту связь может быть затруднительно определить на эхокардиографии, когда левая вертикальная вена перемещается между левой легочной артерией и левым магистральным бронхом и сжимается этими структурами, что создает так называемую сосудистую петлю.
ПАДЛВ при кардиальном соединении происходит, когда общая легочная вена соединяется сразу с сердечной камерой или коронарным синусом. Эти связи почти никогда не бывают стенотическими. Напротив, инфракардиальные связи практически всегда являются обструктивными. Общая легочная вена соединяется обычно с нижней полой веной, которая пересекает диафрагму и соединяется с печеночной циркуляцией через венозный проток. Эти соединения всегда обструктивны на уровне диафрагмы или ниже.
Смешанные соединения не имеют общего венозного слияния. В этих случаях отдельные легочные вены соединяются с различными участками в системной венозной цепи. Соединения происходят в различных комбинациях из трех перечисленных выше типов. Из-за смешанных связей, необходимо во время обследования на эхокардиографии определить индивидуально каждую из вен, которые стекают пять основных сегментов легких. Эти пять сегментов-правая верхняя, средняя и нижняя доли, а левая верхняя и нижняя доли.
Частичный аномальный дренаж легочных вен на эхокардиографии
Частичный аномальный дренаж легочных вен может сосуществовать с ДМПП или это может произойти в изоляции. В любом случае размер шунта слева направо меньше, чем в ПАДЛВ. В результате, у этих пациентов с симптомы и находки подобны тем, что присутствуют при изолированном ДМПП в более позднем временном отрезке жизни. Обструктивные связи редко встречаются при ЧАДЛВ. Большинство пациентов имеют аномальную связь с участием только одного из двух легких. Общие модели частичного аномального дренажа легочных вен на эхокардиографии включают следующее:
- Правый верхний и средний вены впадают в ВПВ или обе в правое предсердие — это часто связано с ДМПП типа sinus venosus.
- Правой нижняя легочная вена дренируется в нижнюю полую вену (НПВ), как при синдроме Ятагана. Эти пациенты обычно имеют гипоплазию правого легкого с интактной межжелудочковой перегородкой. Некоторые пациенты также имеют неполное соединение нижней доли бронха с центральным дыхательным путем и аномальное артериальное снабжение этой области (бронхолегочная секвестрация).
- Изолированная левая легочная вена дренируется в левостороннюю вертикальную вену (остаток эмбриональной левой передней кардинальной вены). Вертикальная вена соединяется с ВПВ и шунтирующий поток достигает сердца. В качестве альтернативы, одна или обе из левых легочных вен могут подключаться непосредственно к коронарному синусу в этом случае.
Особенности эхокардиографии при аномальном дренаже легочных вен
Адекватную визуализацию легочных венозных соединений необходимо получить из нескольких плоскостей визуализации. У младенцев и детей, надгрудинная коронарная плоскость сканирования с задней ангуляцией может продемонстрировать позицию «краб», из которой можно посмотреть, что происходит с соединениями из четырех легочных вен у корпуса левого предсердия (или венозном впадение при ПАДЛВ). Однако, потенциал для множественных соединений сосуществует в таком пациенте, что делает усердный поиск легочных вен довольно трудным, поэтому врач на эхокардиографии использует все имеющиеся плоскости, обязательные в этих случаях.
В нормальном сердце, апикальная четырехкамерная позиция на УЗИ сердца показывает связи правой и левой нижних легочных вен на задней и нижней области левого предсердия (ЛП). Субкостальная четырехкамерная и сагиттальное сканирование позволяет визуализировать соединения правой верхней легочной вены в ЛП. Кроме того, из этих позиций, может быть визуализирован дефект венозного синуса. Левую верхнюю легочную вену часто можно увидеть в парастернальной короткой оси или из надгрудинного сканирования, описанного выше. У пациентов с увеличением правого сердца, сканирование с правой паразитарной области часто обеспечивают четкое изображение предсердий перегородки и легочных вен.
Если вход всех легочных вен в ЛП не визуализируется уверенно, необходимо провести исчерпывающий поиск для оценки возможных аномальных связей. Это часто одна из самых сложных задач при врожденных пороках сердца в эхокардиографии. Чреспищеводная эхокардиография (ЧПЭХОКГ) полезна в определении дренажа правых легочных вен, даже когда они аномальны. ЧПЭХОКГ должна быть использована в случаях необъяснимого расширения правого предсердия для того, чтобы исключить ЧАДЛВ.
Аномальное соединение легочных вен в вертикальную вену чаще всего проявляется при трансторакальной эхокардиографии при проверке в области яремной ямки или левом надключичном пространстве. Аномальные левые вены могут быть пропущены при ЧПЭХОКГ из-за акустических помех от левого бронхиального дерева. Когда изменения на трансторакальной эхокардиографии наводят на мысль, но не диагностируют аномальное левое легочное венозное соединение, то магнитно-резонансная томография (МРТ) часто является наиболее эффективным неинвазивным методом, доступным для демонстрации это патологии.
Читайте также:
