Этапы и техника селективной проксимальной ваготомии
Добавил пользователь Владимир З. Обновлено: 08.01.2026
Положение больного на столе, места введения троакаров, расположение операционной бригады и монитора должны максимально обеспечивать комфортные условия для работы хирурга, качественную визуализацию операционного поля и возможность проведения необходимых манипуляций в зоне вмешательства. Естественно, что на вышеперечисленные установки оказывает влияние состояние конкретного пациента (вес, характер заболевания, наличие послеоперационных рубцов на брюшной стенке и т. д.), привычки оператора и особенности хирургической школы.
Лапароскопические оперативные вмешательства по поводу язвенной болезни ДПК, грыжи пищеводного отверстия диафрагмы и рефлюкс-эзофагита мы обязательно проводим под интубационным наркозом с применением миорелаксантов.
В нашей клинике используется следующее положение больного на операционном столе: пациент лежит на спине, с разведенными и полусогнутыми в коленных суставах ногами.
Головной конец стола приподнимаем до 30-40º. Отведенную левую руку помещаем на подставку, другую руку закрепляем вдоль туловища. Высота операционного стола определяется ростом хирурга и должна обеспечивать его работу без физического напряжения в области плечевого пояса. Спина должна быть прямая, а плечи опущены. Следует отметить, что за счет изменения положения стола на 30 градусов после введения троакаров брюшная стенка дополнительно опускается на 15-20 см.

Рис. 1. Положение больного на операционном столе и расположение операционной бригады. 1 - хирург, 2 - 1-й ассистент (видео оператор), 3 - 2-й ассистент, 4 - анестезиолог, 5 - операционная сестра.
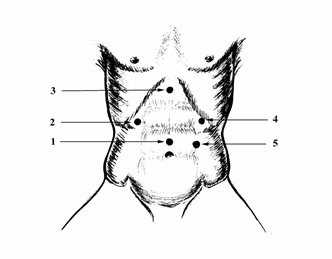
Рис. 2. Оптимальные точки для введения троакаров при выполнении лапароскопической операции при ЯБДПК и ГПОД.
Рис. 3. Положение больного на операционном столе (вид сбоку), положение Фовлера (30°).
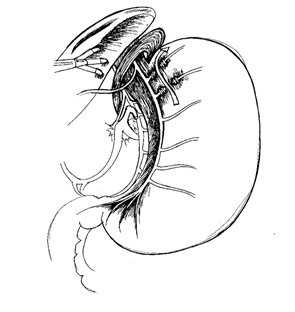
Рис 4. Начальный этап мобилизации пищеводно-желудочного перехода, пересечение первых ветвей переднего вагуса и выделение передней стенки пищевода.

Рис. 5. Рассечение фундально-диафрагмальной связки.

Рис. 6. Ретрактором осуществляется тракция кардиального отдела желудка влево. Этап лигирования коротких желудочных сосудов под пищеводом.
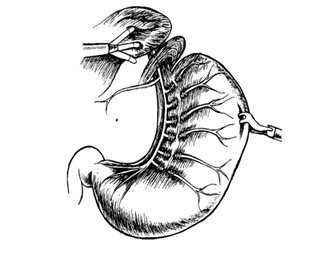
Рис. 7. Этап лапароскопической селективной проксимальной ваготомии - пересечение веточек переднего блуждающего нерва.

Рис. 8. Лапароскопическое сшивание ножек диафрагмы (крурорафия) и варианты расположения заднего блуждающего нерва после нее.

Рис. 9. Окончательный вид физиологической 2-х сторонней фундопликации по Toupet в нашей модификации.
Располагается операционная бригада следующим образом: хирург стоит у левой ноги пациента, 1-й ассистент - между ног, 2-й ассистент - справа от больного, эндоскопическая стойка с оборудованием - у его правого плеча. Анестезиолог и наркозно-дыхательная аппаратура располагаются у головы пациента, а анестезиологическая медицинская сестра с инструментальным столиком - у его левой руки. Операционная сестра и инструментальный столик находятся справа от хирурга, так как это позволяет менять хирургические инструменты без поворота по своей оси, не вовлекая левую руку оператора (Рис.1).
Для четкого разделения рабочей зоны между анестезиологической и операционной сестрами дополнительно натягиваем стерильную простыню, которую фиксируем бельевыми цапками к анестезиологической дуге и стойке для внутривенной инфузии у левой руки пациента.
Такое положение операционной бригады, по нашему мнению, является наиболее удобным, так как глаза хирурга, руки, лапароскоп, зона оперативного вмешательства и монитор находятся на одной линии, а ассистент, манипулируя оптикой, не мешает оператору.
Следует отметить, что максимальные возможности данного расположения операционной бригады проявляются при использовании 30 градусной оптики, способной помочь ассистенту визуализировать объект с любой стороны.
После интубации выполняем обработку операционного поля, границами которого являются среднеподмышечные линии с двух сторон, средняя треть грудины и лонный бугор. Места введения троакаров отграничиваем стерильным бельем и приступаем к соединению аппаратуры с инструментами.
На рисунке показаны оптимальные точки для введения троакаров при выполнении оперативного вмешательства по поводу грыжи пищеводного отверстия диафрагмы (Рис. 2): 1 - 10 мм - для лапароскопа, 2- 10 мм - дополнительный порт для введения печеночного ретрактора, 3 - 5 мм - для введения мягкого зажима (для работы хирурга левой рукой), 4 - 10 мм - основной рабочий порт для введения ножниц, диссектора, клипсаппликатора, иглодержателя, инструмента EndoStitch, инструмента LigaSure, 5 - 10 мм - дополнительный порт для введения инструмента ЭндоБебкок и фиксации желудка и введения пищеводного ретрактора.
Отметим, что места введения троакаров могут варьировать, но всегда остается необходимость отводить печень, натягивать фундальный отдел желудка, вводить оптику и выполнять основные приемы двумя руками. Для решения этих задач необходимо пять доступов.
Оперативное вмешательство начинаем с инсуфляции углекислого газа в брюшную полость через иглу Вереша, введенную в параумбиликальную область. Скорость подачи газа - 1,5 литра в минуту, давление - 12 мм. рт. ст. Критерием проникновения иглы в брюшную полость является характерный щелчок выскочившей защиты. Для точного определения положения иглы Вереша всегда выполняем водную пробу. Затем вводим первый 10 мм троакар(стальной «Karl Storz»). Для большей безопасности мы фиксируем брюшную стенку в области прокола двумя бельевыми «цапками». Направление введения троакара должно быть строго вертикальным. Очень важно, чтобы стилет у первого из них имел пирамидальную, а не коническую форму, в этом случае при фиксированной брюшной стенке ткани легко рассекаются и отсутствует не контролируемый эффект «провала» в брюшную полость. С целью контроля за «провалом» в брюшную полость следует также вдоль троакара выпрямлять указательный палец правой руки, который будет ограничивать продвижение стилета по тканям брюшной стенки.
При выполнении симультанных операций на верхнем этаже брюшной полости, связанных с извлечением органов (например - лапароскопическая холецистэктомия с фундопликацией и ваготомией), мы используем поперечный разрез по вворачивающемуся краю пупка длиной 10 мм для возможного его расширения до необходимого размера с соблюдением элементов косметики. Если оперативное вмешательство не сопровождается извлечением органов из брюшной полости, более удобным будет выполнение разреза для введения оптики на 4-5 см выше пупка по средней линии (особенно это важно у высоких пациентов с большим расстоянием от мечевидного отростка до пупка).
У пациентов, перенесших ранее лапаротомные оперативные вмешательства, как правило, органы брюшной полости оказываются припаянными к послеоперационному рубцу, что может сопровождаться их повреждением при введении иглы Вереша или первого троакара. В этой ситуации мы обычно используем оптический троакар VISIPORT компании Covidien (Швейцария), который позволяет под контролем зрения строго дозировано (по 1 мм) послойно рассекать ткани брюшной стенки. При отсутствии подобного инструмента может быть использована методика «открытой» лапароскопии по Hasson.
После введения лапароскопа в брюшную полость выполняем обзорную лапароскопию для получения дополнительной информации о состоянии органов брюшной полости и наличия спаечного процесса. Для улучшения изображения торцевой конец лапароскопа должен быть согрет до 50 градусов в стерильном физиологическом растворе или обработан салфеткой, смоченной специальным составом Anti-Fog (KARL STORZ). Далее операционный стол переводим в положение Фовлера (30°), в желудок вводим толстый зонд диаметром - 20 - 24 мм (Рис. 3).
Под контролем зрения устанавливаем остальные троакары, начиная их введение с левого подреберья по часовой стрелке. После установки второго троакара в брюшную полость помещаем печеночный ретрактор, которым отводим круглую связку печени вправо для облегчения введения третьего, 5- мм троакара. Затем поочередно вводим четвертый и пятый 10 мм троакары, обязательно учитывая ход крупных сосудов для профилактики их повреждения.
Как правило, для работы в первом и четвертом доступах мы используем стальные троакары «Karl Storz», во втором и пятом - пластиковые троакары Covidien (Швейцария). В третьем доступе очень удобен пластиковый троакар компании Covidien (Швейцария) с фиксатором.
При введении инструментов следует соблюдать ряд рекомендаций. Выполнение лапароскопической СПВ и фундопликации осуществляется главным образом через два основных манипуляционных троакара - в третьем и четвертом доступах. Операционный угол между двумя инструментами, введенными через них, при сближении в области абдоминального отдела пищевода должен быть не менее 80 - 70 градусов. Направление троакаров при их введении - строго радиальное по отношению к зоне оперативного действия. Это, с одной стороны, облегчит подведение инструментов «вслепую» к месту операции, а с другой - не будет изменять тактильное ощущение хирурга, связанное с приложением усилия по коррекции неправильного выбранного угла.
После установки троакаров через второй доступ мы вводим печеночный ретрактор и отводим левую долю печени вверх и вправо. Через пятый доступ инструментом «ЭндоБебкокк» захватываем фундальный отдел желудка. В третий доступ вводим мягкий 5 мм зажим, а через 4 - 5 мм ножницы. Использование пластиковых 5 мм мягких зажимов с фиксатором значительно облегчает работу на тонких структурах малого сальника, так как, с одной стороны, эти инструменты имеют удобные кремальеры для экстренного захвата кровоточащего сосуда, а с другой - их малый вес позволяет выпустить инструмент из рук, не боясь отрыва тканей в зоне оперативного вмешательства. В области малого сальника очень удобно использование изогнутых пластиковых ножниц компании Covidien (Швейцария), так как длина бранш соответствует размеру выделенных тканей под средне-большие клипсы или инструмент LigaSure, а их кривизна позволяет выделять сосуды без применения диссектора.
Для обеспечения легкой и безопасной работы в области пищеводно-желудочного перехода и малого сальника необходимо адекватное натяжение тканей, которое создается инструментом «Эндобебкокк» через пятый доступ.
В отличие от техники селективной проксимальной ваготомии, выполняемой открытым способом, когда скелетирование малой кривизны желудка начинается от «вороньей лапки» нерва Летарже и продолжается вверх, при лапароскопической ваготомии мобилизацию малой кривизны желудка лучше начинать с пищевода и продолжать вниз (Рис. 4).
В этом случае структуры, подлежащие лигированию и пересечению, постоянно находятся в состоянии натяжения. Пищевод мобилизуем медиально от левого блуждающего нерва с использованием LigaSure Atlas, и после вскрытия сальниковой сумки и рассечения фундально-диафрагмальной связки (рис. 5) под пищеводом ретрактором осуществляем тракцию кардиального отдела желудка влево (Рис. 6).
Этим приемом мы значительно облегчаем манипуляции в области малого сальника. Далее сверху вниз послойно выполняем диссекцию нервно-сосудистых образований между левым блуждающим нервом и желудочной стенкой, используя мягкий 5 мм зажим, ножницы и 5 мм аппарата LigaSure (Рис.7).
По мере продвижения к «вороньей лапке» для сохранения натяжения структур в зоне оперативного действия, зажим «ЭндоБебкокк» передвигаем вниз по малой кривизне. Отсутствие клипс, надежный гемостаз и одновременное рассечение тканей на этом этапе делают преимущества аппарата LigaSure очевидными.
После окончания селективной проксимальной ваготомии выполняем диссекцию тканей в области правой и левой диафрагмальных ножек, крурорафию (Рис. 8) и фундопликацию (Рис. 9).
Ушивание десерозированного участка малой кривизны желудка не целесообразно. Далее проводим смену желудочных зондов и лаваж брюшной полости стерильным физиологическим раствором. Мы крайне редко оставляем страховой дренаж, так как в этом нет необходимости. Раны брюшной стенки ушиваем послойно иглой Endo close.
Список работ опубликованных профессором Пучковым К.В. по теме хирургия желудка и двенадцатиперстной кишки
Отзывы пациентов
06.07.2020 09:25:00 Владимир и Ольга Литовченко
Селективная проксимальная ваготомия
Селективная проксимальная ваготомия — хирургическая операция, один из вариантов операций ваготомии, заключающейся в пересечении блуждающего нерва (вагуса) или его отдельных ветвей, стимулирующих секрецию соляной кислоты в желудке. Селективная проксимальная ваготомия, как и другие варианты ваготомии, применяется для лечения язвы желудка и двенадцатиперстной кишки, рефлюкс-эзофагита и других кислотозависимых заболеваний. Код селективной проксимальной ваготомии (без дренирования) A16.16.018.002.
Селективная проксимальная ваготомия по сравнению с другими вариантами ваготомий дает минимальное число осложнений. В современных условиях часто выполняется в комбинации с другими операциями на органах желудочно-кишечного тракта, вы том числе малоинвазиным доступом, лапароскопически, а также медикаментозно-термическим способом.
Отличие селективной проксимальной ваготомии от других типов ваготомий
Важным недостатком классического варианта ваготомии, является то, что перерезаемые вагусные нервы иннервируют не только кислотопродуцирующие поля желудка, но и другие его области и другие органы пищеварительной системы. Поэтому, после их денервации часто возникает так называемый постваготомический синдром, заключающийся в расстройстве моторики желудка и других органов, часто проявляющееся в виде сильной диареи, а также другие серьезные осложнения.
С целью уменьшения влияния денервации областей желудка, не содержащих секретирующих кислоту париетальные клетки, была разработана операция селективной проксимальной ваготомии, при которой осуществляется парасимпатическая денервация только кислотопродуцирующих зон — дна желудка и тела желудка. Важным является сохранение иннервации антральной части желудка, благодаря чему не нарушается механизм регулирования кислотонейтрализации.
Ограничения применения селективной проксимальной ваготомии
Селективная проксимальная ваготомия находит ограниченное применение при хирургическом лечении "сложных" язв луковицы двенадцатиперстной кишки, так как у таких пациентов достаточно редко встречается сочетание всех необходимых условий: отсутствие выраженной гиперсекреторной активности желудка (до 30 ммоль/л); наличие неизмененной слизистой оболочки антрального и фундального отделов желудка; отсутствие суб- и декомпенсированной формы дуоденостаза. Селективную проксимальную ваготомию обязательно следует дополнять удалением язвы и дуоденопластикой, если отсутствует органическая несостоятельность пилорического жома, либо пилоропластикой, если имеет место органическая или функциональная несостоятельность пилорического сфинктера (В.В. Сахаров).
Лапароскопическая селективная проксимальная ваготомия методом скелетирования является длительным, технически сложным, дорогостоящим оперативным вмешательством и может успешно выполняться в специализированных лечебных учреждениях (О.В. Ооржак).
Контроль полноты ваготомии
Для интраоперационной рН-метрии используется специальный рН-зонд с каналом для аспирации желудочного содержимого и ацидогастрометр интраоперационный АГМИ-01. Из предоперационной подготовки исключаются препараты, оказывающие влияние на желудочную секрецию. После лапаротомии и ревизии брюшной полости внутривенно вводится пентагастрин в дозе 0,006 мг на кг массы больного или гистамин в дозе 0,024 мг/кг. На фоне стимуляции секреции измеряются исходные показатели рН в желудке. При определении гипо- и анацидности тест считается неинформативным и не проводится.
Через 3-45 минут после введения пентагастрина (гистамина) стимуляция секреции продолжается в течение всей операции. Во время ваготомии и после ее окончания проводится тщательная аспирация желудочного содержимого через зонд. После выполнения селективной проксимальной ваготомии измерение кислотности слизистой оболочки достигается хирургом путём прижатия сурьмяного электрода к стенке желудка без чрезмерного давления по четырем основным линиям — малой и большой кривизне, передней и задней стенке. При наличии секретирующих полей проводится дополнительное пересечение интактных волокон нерва и повторный контроль ваготомии. Ваготомия считается полной при возрастании рН по всей поверхности слизистой желудка до 5 и больше (Ю.М. Панцырев, С.А. Чернякевмч, И.В. Бабкова, 1999).
Станулис А.И., Кузеев Р.Е., Гольдберг А.П., Наумов П.В., Кузина О.А. Новый способ селективной проксимальной ваготомии в лечении язвенной болезни двенадцатиперстной кишки // Здравоохранение и медтехника. - 2004. - № 4. - с. 22-23.
Последние десятилетия отмечены значительными успехами в консервативном лечении язвенной болезни двенадцатиперстной кишки (ДПК) за счет разработки и применения новых противоязвенных препаратов. Вместе с тем, на фоне повышения заболеваемости язвенной болезнью в Российской Федерации отмечается неуклонный рост ее осложненных и резистентных к медикаментозной терапии форм, что свидетельствует о сохраняющейся актуальности вопроса хирургического лечения дуоденальной язвы. Развитие новых технологий в хирургии, и прежде всего эндохирургического направления, позволяет переосмыслить некоторые аспекты хирургического лечения больных язвенной болезнью ДПК и особенно ее резистентных к медикаментозному лечению форм. В клинике факультетской хирургии МГМСУ разработан и апробирован новый способ селективной проксимальной ваготомии (СПВ), который заключается в медикаментозно-термической (МТ) деструкции кислотопродуцирующих ветвей блуждающего нерва, характеризуется простотой и малой продолжительностью выполнения.
Анализ экспериментальных данных показал, что при МТ-воздействии в указанном режиме ветви блуждающего нерва, идущие к кислотопродуцирующей зоне желудка, подвергаются выраженным деструктивным изменениям: фрагментации и дезориентации. Проведенные спустя один месяц гистологические исследования свидетельствуют о длительном сохранении деструктивных изменений в нервных волокнах. В то же время изменения других тканей были невыраженными или носили обратимый характер. Так, при длительности электротермического воздействия 10 секунд отмечавшиеся через 7 суток незначительные морфологические изменения в малом сальнике, слизистом, подслизистом и внутреннем мышечном слоях спустя 1 месяц полностью исчезли.
Техника селективной медикаментозно-термической проксимальной ваготомии (МТСПВ) состоит в следующем. После ревизии брюшной полости по малой кривизне желудка идентифицируется нерв Латерже, веточки которого иннервируют антральный отдел. В бессосудистом участке малого сальника тупым путем делается "окно", малая кривизна захватывается и оттягивается вверх. После этого, отступая 1 - 1,5 см от малой кривизны в сторону и проксимально от гусиной лапки нерва Латерже, в пространство между малой кривизной и идущими параллельно ей магистралями блуждающего нерва по игле в направлении к эзофагокардиальному переходу под давлением вводится спирт-новокаиновый раствор и поэтапно создается инфильтрат. В результате этого магистрали блуждающего нерва оттесняются от малой кривизны и его ветви, идущие к кислотопродуцирующей зоне желудка, оказываются в толще инфильтрата. Таким образом, обрабатывается вся малая кривизна по передней и задней стороне желудка. В той же последовательности в созданный инфильтрат вводится экранированный электрод в непосредственной близи от веточек блуждающего нерва и производится монополярная электрокоагуляция. Затем идентифицируются ветви блуждающего нерва по передней стенке кардиального отдела желудка и, отступая 3-4 см дистальнее эзофагокардиального перехода в области данных ветвей, субсерозно создаются инфильтраты, которые впоследствии обрабатываются электротермически. Это завершающий этап МТСПВ.
Осложнений ни в одном из экспериментов не наблюдалось. Отсутствие механического рассечения тканей исключает возможность кровотечения, позволяет сохранить кровоснабжение желудка и его связочный аппарат. Способ в исполнении технически прост и не требует высокой квалификации хирурга. Применение этого способа позволило значительно сократить продолжительность операции: время выполнения собственно МТСПВ во всех случаях не превышало 7-12 мин. Для оценки эффективности ваготомии исследовали динамику изменения рН желудка до и после электротермического воздействия. Установлено, что МТСПВ способствует значительному повышению этого показателя: в теле желудка рН увеличился с 1,55±0,2 до 4,6±0,3, в аптральном отделе - с 3,9±0,4 до 6,2±0,2. На основании результатов рН-метрии желудка мы сделали вывод, что МТ-воздействие на блуждающий нерв обеспечивает выраженную и достаточно стойкую парасимпатическую денервацию органа и снижение его кислотопродуцирующей функции.
Для определения сохранности моторно-эвакуаторной функции желудка после МТСПВ проводили прямую электрогастромиографию. У всех животных до и после МТСПВ регистрировали биоэлектрическую активность антрального отдела желудка. После операции амплитуда быстрого компонента (АБК) составила 3,75±0,15 мэВ, амплитуда медленного компонента (АМК) - 1,55±0,11 мэВ, частота комплексообразования достигла 4,7±0,25 цикла в минуту (табл. 1).
Таблица 1. Показатели электрогастромиографии (в мэВ) до и после МТСПВ в эксперименте
Момент исследования
Клинические испытания способа проведены в клинике факультетской хирургии № 2 МГМСУ на базе отделений хирургии Городской клинической больницы № 70. Операция была выполнена 43 больным. Для выполнения видеолапароскопической медикаментозно-термической селективной проксимальной ваготомии использовалась видеоэндоскопическая установка фирмы "Karl Storz" (Германия), включающая в себя эндовидеокамеру, видеопроцессор, монитор, автоматический инсуфлятор углекислого газа, автоматический осветитель,- систему ирригации/аспирации, электрохирургический блок, видеомагнитофон. Применялись операционные наборы лапароскопического инструментария фирм "Аксиома" (Россия), "Auto Suture" (США), "Karl Storz" (Германия).
Были задействованы следующие виды эндоскопических инструментов: троакары со шторковыми клапанами, гильзами диаметром 5 мм и 10 мм с винтовыми фиксаторами; зажим диаметром 5 мм с двумя активными тонкими браншами, поворотным механизмом и накидной кремальфой; ножницы диаметром 5 мм с поворотным механизмом; диссектор диаметром 5 мм с поворотным механизмом; электрохирургический крючок для монополярной коагуляции диаметром 5 мм; зажим Babcock диаметром 10 мм с поворотным механизмом; ретрактор пятилепестковый диаметром 10 мм с поворотным механизмом.
Использовали 4 торакопорта, вводя их в брюшную полость в параумбиликальной области (один), по краю прямых мышц живота на 2-3 см выше пупка (два) и по передней аксиллярной линии слева на уровне пупка (один). Для тракции желудка и малого сальника применяли мягкие зажимы. Медикаментозную смесь вводили стандартной пункционной иглой, электрокоагуляцию осуществляли описанным выше электродом. Клиническая апробация нового способа вмешательства экспериментально подтвердила его положительные стороны, упомянутые ранее: малую травматичность, быстроту выполнения, техническую простоту. При определении оптимальных параметров электротермического воздействия в клинике брали за основу данные, установленные в эксперименте. Необходимо отметить, что ни в одном из случаев применения видеолапароскопической МТСПВ осложнений не возникло. Во всех наблюдениях время выполнения собственно видеолапароскопической МТСПВ не превышало 15-25 минут. Течение послеоперационного периода в целом было благоприятным. У большинства больных отмечено раннее восстановление функций желудочно-кишечного тракта. Изучение желудочной секреции в послеоперационном периоде свидетельствовало о стойком угнетении кислотопродукции желудка (табл. 2).
Таблица 2. Секреторная функция МТСПВ
| Отдел желудка | Мужчины (n=10) | Женщины (n=30) | |
| 10 дней | Антральный | 7,3±0,2 | 7,4±0,3 |
| Тело | 5,6±0,1 | 5,4±0,2 | |
| Дно | 2,8±0,3 | 2,7±0,2 | |
| 1 месяц | Антральный | 7,3±0,1 | 7,4±0,2 |
| Тело | 5,3±0,2 | 5,1±0,3 | |
| Дно | 2,7±0,4 | 2,7±0,1 |
Примечание: ВПК - базальная, МПК - максимальная продукция кислоты.
Внутрижелудочную рН-метрию проводили с помощью ацидогастрометра посредством трехканального рН-зонда с сурьмяными электродами. Результаты исследования рН желудка приведены в таблице 3.
Таблица 3. Результаты рН-метрии желудка после МТСПВ
| Показатель | Мужчины | Женщины | |
| 10 дней | БПК МПК | 1,1±0,1 9,6±0,6 | 1,07±0,12 9,42±0,55 |
| 1 месяц | БПК МПК | 1,2±0,12 9,8±0,73 | 1,15±0,31 9,59±0,65 |
| 1 год | БПК МПК | 1,4±0,15 11±0,92 | 1,35±0,21 9,87±0,97 |
| 2 года | БПК МПК | 1,35±0,18 11,2±0,78 | 1,31±0,15 10,4±0,82 |
Ближайший послеоперационный период у больных с язвенной болезнью ДПК, осложненной кровотечением, протекал в целом благоприятно. Результаты операции оценивали по шкале Visick. Сроки наблюдения составили от 1 месяца до 2 лет. Отличный результат получен у 20 (46,5%) оперированных, хороший - у 19 (44,2%), удовлетворительный - у 4 (9,3%). Наблюдений с неудовлетворительным результатом не отмечено.
Таким образом, полученные данные говорят об эффективности применения видеолапароскопической МТСПВ в лечении резистентной к медикаментозной терапии язвенной болезни ДПК. Разработанный способ прост в техническом исполнении и требует мало времени. Если на выполнение классической СПВ по общепринятой методике требуется в среднем 1,5 часа, то на МТСПВ - всего 15-25 минут. Проведенные эксперименты и первый опыт применения в клинике свидетельствуют о малой травматичности разработанного способа и надежном снижении после операции кислотопродуцирующей функции желудка при сохранении его моторно-эвакуаторной деятельности. На предложенный способ получено положительное решение по заявке на изобретение №99108493/14 (009336) Госкомизобретений России от 29.04.99. Дальнейшее повышение эффективности и расширение возможностей способа связаны с накоплением опыта его применения и совершенствованием техники вмешательства.
Новый способ селективной проксимальной ваготомии в лечении язвенной болезни двенадцатиперстной кишки.
Станулис А.И., доктор медицинских наук, профессор,
Кузеев Р.Е., доктор медицинских наук, профессор (кафедра факультетской хирургии № 2 Московского государственного медико-стоматологического университета, зав. каф. д.м.н., проф. A.M. Станулис),
Гольдберг А.П., Наумов П.В., Кузина О.А. (городская клиническая больница №70 г. Москвы, глав. врач к.м.н. А.П. Гольдберг).
Синтетические шовные материалы в хирургии и гинекологии
Прежде, чем приступить к рассмотрению реакции тканей на отдельные синтетические рассасывающиеся шовные материалы, хотелось бы остановиться на общих положениях, касающихся взаимодействия нити и биологической ткани, а так¬же отметить отличие реакции тканей на имплантацию как таковую и при наложении швов на полые органы с целью формирования кишечных соустий.
Прохождение хирургической иглы и нити через ткани вызывает повреждение и некроз клеток. Эти факторы представляют собой пуско¬вой механизм воспаления (Рис.1), развивающегося в присутствии инородного тела - нити.

Рис.1. Зона воспаления вокруг нити.
Первоначально в очаге воспаления появляются нейтрофильные лейкоциты, затем моноциты и фибробласты. Моноциты выполняют макрофагальную функцию, резорбируя и поглощая инородный материал. Вместе с тем, макрофаги переводят реакцию в фибробластическую стадию, активируя пролиферацию фибробластов, синтезирующих внеклеточный матрикоколлаген. При применении нерассасывающихся шовных материалов (шелк, капрон, лавсан и т.д.) фибробластическая реакция носит выраженный характер, и вокруг нити формируется зона обширного фиброза и хронического воспаления. Степень проявления воспалительной реакции окружающих тканей на шовный материал может быть выражена относительным показателем, полученным путем деления диаметра воспалительных изменений в тканях на диаметр шовного канала.
В абдоминальной хирургии при формировании кишечных соустий важным фактором, влияющим на реакцию тканей вокруг шовного материала, является вид шва: узловой или непрерывный, проникающий в просвет полого органа или нет, а также расположение узла по отношению к слизистой оболочке.
Одним из самых распространенных природных рассасывающихся шовных материалов, используемых хирургами, и по сей день является кетгут. Опыт показал, что он обладает существенными недостатками, обусловленными самой его природой. Кетгут готовится из животного сырья и представляет собой нить из коллагеновых волокон со значительной примесью неколлагеновых белков, в связи с чем он оказывает на окружающие ткани аллергизирующее действие, особенно при повторном применении у одного и того же больного. Прочность кетгута ниже, чем у большинства синтетических рассасывающихся шовных материалов, а разрывная нагрузка в узле небольшая и значительно колеблется. В мокром виде прочность узла может быть критической вследствие набухания нити. Кетгут имеет очень высокий модуль Юнга, поэтому он жесткий, обладает плохими манипуляционными свойствами и прорезает ткани.
Быстрое падение прочности «in vivo» приводит к невозможности его применения в условиях натяжения тканей. Сроки рассасывания кетгута не только не регулируются, но и не предсказуемы, поскольку зависят от очень многих факторов. Воспалительная реакция на кетгут носит выраженный экссудативный характер, заканчивается в более поздние сроки обширным, в 3-4 диаметра шовного канала, фиброзом, иногда с гранулематозной реакцией. Экссудативное воспаление протекает с аллергическим компонентом, в его зоне отмечается большое количество лимфоцитов, эозинофилов. Длительно сохраняются отек тканей и присутствие полиморфно-ядерных лейкоцитов даже в те сроки, когда сама нить в шовном ка¬нале уже не определяется. Подобная бурная воспалительная реакция связана с белковой природой кетгута и плохой возможностью его стерилизации. Бактериальному загрязнению способствует также полифиламентное строение кетгутовой нити: межфиламентные пространства заполняются экссудатом, который служит питательной средой для бактерий.
Первый синтетический рассасывающийся хирургический шовный материал - полигликоевая кислота (дексон) появился на мировом рынке в 1968 г., в 1972 г. - полиглактин-910 (викрил), в 1980 г. - полидиоксанон, далее - политриметиленкарбонат (максон), в 1991 г. - лактомер 9-1 (полисорб) (Рис.2).

Рис.2. Плетение у Полисорба и Викрила.
Поскольку целью настоящего обзора является ознакомление коллег с новыми доступными синтетическими рассасывающимися шовными материалами, а также сравнительная оценка реакции окружающих тканей на шовный материал при формировании кишечных соустий, рассмотрению под¬лежат, в основном, дексон, викрил, полидиоксанон, максон, полисорб и биосин.
Выше было отмечено, что на реакцию окружающих шовный материал тканей оказывают влияние все его свойства.
Физико-механические свойства нити определяются следующими характеристиками:
— максимально достижимая прочность на разрыв; это позволяет использовать минимальную массу нити для наложения шва и, соответственно, снизить объем имплантируемого инородного материала, что приводит к минимуму тканевой реакции организма и скорейшему заживлению раны «без следа»;
— прочность узла в сухом и мокром состоянии, максимально приближенная к первому показателю;
— при наложении шва узел пропитывается тканевой жидкостью, что, как правило, резко снижает его прочность. Так, например, прочность узла кетгута в мокром состоянии составляет всего 28% разрывной прочности сухой нити. Мононити требуют большего количества захлестов для удержания нити в узле, что значительно увеличивает массу имплантированного шовного материала;

Рис. 3. Вид узла у различных СРШМ.
— относительное удлинение 25±10%; важным условием полноценного заживления раны считается сближение без натяжения здоровых тканей с хорошим кровоснабжением. Вследствие механической травмы и отека тканей происходит натяжение раны в области наложенных швов. Поэтому умеренное удлинение нити считается положительным фактором. По мнению одних авторов, удлинение должно составлять 7-10%, других — 30-35%, иначе происходит прорезание тканей;
— модуль Юнга, минимально возможный при сохранении высокой прочности нити; нить должна обладать хорошими манипуляционными свойствами, быть достаточно гибкой, послушной в руках хирурга. Гибкость нити большинство зарубежных исследователей характеризуют модулем Юнга, который особенно высок для современных мононитей, что делает эти нити очень жесткими;
— атравматичность нити, которая характеризуется состоянием поверхности нити, модулем Юнга и способом соединения нити с иглой;
— поверхность, с одной стороны, должна быть не очень гладкой, чтобы не наблюдалось проскальзывание узла, с другой стороны, необходимо отсутствие «шероховатости», вызывающей повреждение тканей за счет «пилящего эффекта». Использование обычных игл приводит к разрыву тканей вследствие несоответствия размеров прокольного канала и шовной нити, которая его заполняет, поэтому применение атравматичных игл сопровождается резким снижением осложнений в области шва,
— гидрофильность нити, т.е. ее способность при соприкосновении с тканевой жидкостью набухать и терять прочность.
Вторая группа требований, предъявляемых к шовному материалу, включает в себя следующие характеристики:
— соизмеримость скорости падения прочности нити со скоростью заживления раны и восстановления прочности тканей в месте наложения шва; считается, что значительная потеря прочности может допускаться не ранее 10-14 суток, хотя на практике для многих нитей этот процесс происходит быстрее. В значительной мере биодеструкция полимера связана с особенностью его химической природы, видом плетения нити, гидрофильностью, характером покрытия;
— полная резорбция или рассасывание шовной нити; резорбция или рассасывание должны происходить до полного исчезновения нити, причем необходимо, чтобы продукты распада были не токсичными, не кумулировались в паренхиматозных органах и полностью выводились из организма;
— минимальная тканевая реакция при наложении шва: она зависит, прежде всего, от химических групп, от механизма рассасывания имплантата, от возможности проникновения микроорганизмов в рану, чему во многом способствует «фитильный» эффект нити, который тем больше, чем выше капиллярность и гидрофильность нити.
При сравнении физико-механических свойств нитей следует отметить, что максимально достижимая прочность на разрыв у синтетических рассасывающихся шовных материалов (СРШМ). Она в 6-7 раз выше, чем у кетгута и равняется прочности капроновой нити, причем, прочность полидиоксанона несколько уступает дексону и викрилу в силу его монофиламентности, а прочность полисорба несколько выше последних в связи с более мелким плетением и наличием корда в составе нити. Оценивая модуль Юнга, следует отметить, что плетеные полифиламентные нити (дексон, викрил, полисорб, максон) имеют более низкий модуль Юнга по сравнению с мононитями, напри¬мер, полидиоксаноном. При этом, авторы единодушно отмечают, что полисорб является наиболее мягким, эластичным и послушным в руках хирурга, по ощущениям приближаясь к шелку. Далее следует дексон-плюс и покрытый викрил, затем — дексон. дексон-с и полидиоксанон. Причем, отмечено, что полидиоксанон сильно травмирует ткани, оказывая «пилящий эффект», а при завязывании нити узел получается очень грубым. Прочность в узле для всех нитей оказалась очень высокой и практически не зависела от мокрого состояния, поскольку синтетические рассасывающиеся шовные материалы обладают очень слабой гидрофильностью и не увеличивают своего диаметра при имплантации в ткани. Все перечисленные выше свойства СРШМ составляют понятие атравматичности нити и оказывают, в той или иной степени, повреждающее действие при проведении нити через ткани, что является пусковым механизмом воспалительной реакции. Таким образом, эти критерии являются важными при выборе шовного материала.
Благодаря тому, что синтетические рассасывающиеся шовные материалы получают путем химического синтеза, они обладают целым рядом положительных свойств. Мономеры соединены между собой эфирными связями, которые в организме расщепляются гидролизом. Распад и рассасывание происходят путем гидролиза и фагоцитирования, тогда как кетгут, например, в организме расщепляется вследствие ферментативных реакций. Продукты распада синтетических рассасывающиеся шовных материалов не являются токсичными для животных и человека. Использование синтетических рассасывающихся шовных материалов не вызывает изменений в человеческом организме, а также не оказывает канцерогенного или тератогенного эффектов.
Одним из главных преимуществ синтетических рассасывающихся шовных материалов является их высокая биологическая инертность — в тканях они практически не вызывают ответной реакции. Поскольку все перечисленные синтетических рассасывающиеся шовных материалов по химическому строению являются полимерами гликоевой кислоты или сочетания гликоевой и молочной кислот в разных соотношениях, то различия в реакции тканей определяются, в основном, физико-механическими свойствами нити, из них изготовленной: особенностью плетения, наличием покрытия, филаментностью и пр.
Наложение первого ряда швов при анастомозе на толстой кишки после ее резекции по поводу опухолевых или воспалительных заболеваний нитями из полигликоевой кислоты вдвое уменьшает частоту развития недостаточности анастомоза по сравнению с использованием для этих целей кетгута. При создании толсто-толстокишечного анастомоза наложение однорядного шва с использованием полиглактина-910 послужило причиной недостаточности анастомоза в 9,6% наблюдений. При эндоскопическом исследовании трудно было найти место анастомоза со стороны слизистой из-за отсутствия заметной вос¬палительной реакции и сужения просвета. Применение нитей из полигликоевой кислоты при создании толсто-толстокишечного анастомоза не вызывало недостаточности швов. При использовании полидиоксанона для создания анастомозов на ободочной кишке с помощью однорядного шва недостаточности соустья не наблюдалось, однако сравнительно часто развивались стриктуры.
В тканях мочевого тракта синтетические рассасывающиеся шовные материалы вызывают слабую реакцию, однако вследствие плетеной структуры нить из полигликоевой кислоты и полиглактина-910 может стать очагом для камнеобразования. Тем не менее, благодаря биологической инертности, инкрустация швов солями происходит очень редко, реже, чем при использовании кетгута и, тем более, нерассасывающихся шовных материалов. Преимущества нитей из полигликоевой кислоты по сравнению с кетгутом ярко выявляются при зашивании ран мочевого пузыря у облученных животных: на 15 сутки прочность зашитой кетгутом раны намного меньше, чем раны, зашитой нитями из полигликоевой кислоты. На возможность сохранения функционирующей почечной паренхимы при использовании синтетических рассасывающиеся шовных материалов указывают некоторые авторы, которые отмечают, что лучшими качествами обладает полисорб, так как наряду с минимальной тканевой ре¬акцией, он обладает большей мягкостью и лучшими манипуляционными свойствами.
Минимально реагируют на имплантацию синтетических рассасывающиеся шовных материалов ткани матки и ее придатков: на 80 день после им¬плантации вокруг тонких нитей полиглактина-910 и полидиоксанона в матке у кроликов не обнаруживалось фиброзной ткани. Синтетические рассасывающиеся шовные материалы (викрил, полисорб, биосин) вызывают минимальную экссудативную реакцию (особенно биосин) в пределах шовного канала, быстро переходящую в пролиферативную стадию воспаления и заканчивающуюся фиброзом в пределах 1,5 диаметра ШК для викрила, 1-1,5 диаметра для полисорба и 0,5-1,0 диаметра для биосина. При этом нить просматривается до 80 суток у викрила и биосина, у полисорба — до 60 суток в виде остаточных гранул. Динамику выраженной экссудативной фазы воспаления, в зависимости от характера шовного материала и времени с момента его имплантации, наглядно демонстрирует рис. 1.
Выраженность развития фиброза в зоне анастомоза маточных труб напрямую зависит от применяемого шовного материала. В наблюдениях с кетгутовой нитью процесс рубцевания в зоне анастомоза заканчивался на 30 сутки, и при сальпингографии маточная труба была сужена на 2/3 окружности. Применение синтетических рассасывающиеся шовных материалов сопровождалось минимальным фибропластическим процессом. Рубец в зоне анастомоза был мягким.
При сальпингографии рубцовое сужение анастомоза при использовании полисорба и викрила отмечается на 1/4 часть просвета трубы, в случае применения биосина на сальпингографии определяется лишь деформация стенки в зоне анастомоза.
Данные морфологического и рентгенологического исследования подтверждаются результатами тензометрии.
При этом установлено, что на 8 сутки происходит резкое снижение механической прочности анастомоза в группе животных с кетгутом — в основном, за счет выраженных воспалительных изменений в шовной полосе, а также размягчения и фрагментации кетгутовой нити. Применение синтетических рассасывающиеся шовных материалов не сопровождалось выраженной воспалительной реакцией, и нить сохраняла длительное время свои первоначальные свойства. Уже к 19 суткам разрыв трубы происходил не в шовной полосе, а в области интактной стенки. У 50 % животных при использовании кетгута в эти сроки разрыв трубы происходил в зоне соустья, что говорит о незрелом соединительнотканном рубце. К 30-м суткам показатели тензометрии во всех группах сближались, и разрыв маточной трубы происходил вне зоны анастомоза.
По мнению многих хирургов, для зашивания всей брюшной стенки или отдельных ее слоев синтетических рассасывающиеся шовных материалов могут применяться без опасения: инфицирование и расхождение краев раны после операции происходят очень редко, и причиной их, в основном, является не шовный материал, а другие обстоятельства. Кроме того, невелико число послеоперационных грыж. По некоторым данным, оно ниже статистического показателя.
Таким образом, результаты использования синтетических рассасывающиеся шовных материалов позволяют сделать вывод об их несомненном преимуществе перед биологическими и природными рассасывающимися нитями как с точки зрения минимальной реакции тканей на эти материалы, так и с позиции их прочностных характеристик, а также полного выведения из организма продуктов деструкции нитей после выполнения ими соединительной функции.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ИСПОЛЬЗОВАНИЕ СИНТЕТИЧЕСКИХ ШОВНЫХ МАТЕРИАЛОВ В ХИРУРГИИ

Лапароскопическая селективная проксимальная ваготомия и фундопликация при ГПОД (оперирует профессор К.В. Пучков, ноябрь 2009 года ( г. Москва).

Когда вы пишете письмо, знайте:
оно попадает мне на мою личную электронную почту .
На все ваши письма я отвечаю всегда только сам. Я помню, что вы доверяете мне самое ценное — свое здоровье, свою судьбу, свою семью, своих близких и делаю все возможное, чтобы оправдать ваше доверие. Каждый день я по нескольку часов отвечаю на ваши письма. Направляя мне письмо с вопросом, вы можете быть уверены, что я внимательно изучу вашу ситуацию, при необходимости запрошу дополнительные медицинские документы. Огромный клинический опыт и десятки тысяч успешных операций помогут мне разобраться в вашей проблеме даже на расстоянии.
Многим пациентам требуется не хирургическая помощь, а правильно подобранное консервативное лечение, в то время как другие нуждаются в срочной операции. И в том, и в другом случае я намечаю тактику действий и при необходимости порекомендую прохождение дополнительных обследований или неотложную госпитализацию. Важно помнить, что некоторым больным для успешной операции требуется предварительное лечение сопутствующих заболеваний и правильная предоперационная подготовка.
В письме обязательно (!) укажите возраст, основные жалобы, место проживания, контактный телефон и адрес электронной почты для прямой связи. Чтобы я мог детально ответить на все ваши вопросы, прошу высылать вместе с вашим запросом сканированные заключения УЗИ, КТ, МРТ и консультаций других специалистов. После изучения вашего случая, я направлю вам либо подробный ответ, либо письмо с дополнительными вопросами.
В любом случае я постараюсь вам помочь и оправдать ваше доверие, которое является для меня наивысшей ценностью.
Способ селективной проксимальной ваготомии
Изобретение относится к медицине, в частности хирургии. Оно может быть использовано при хирургическом лечении язвенной болезни. Выполняют сочетанное медикаментозно-термическое воздействие. Для чего создают инфильтрат в малом сальнике от уровня гусиной Лапки нерва Латарже до уровня пищеводно-желудочного перехода, вводя спиртновокаиновую смесь по переднему и заднему листкам малого сальника. Затем электрокоагулируют веточки блуждающего нерва, вводя электрод в созданный инфильтрат. Создают точечные инфильтраты по передней стенке кардиального отдела желудка дистальнее пищеводно-желудочного перехода в области ветвей блуждающего нерва. Электрокоагулируют эти ветви, вводя электрод в созданные инфильтраты. Используют оригинальный состав спиртновокаиновой смеси и режим электрокоагуляционного воздействия. Способ позволяет произвести атравматичную селективную проксимальную ваготомию. 5 з.п. ф-лы.
Изобретение относится к медицине, хирургии, может быть использовано при хирургическом лечении язвенной болезни двенадцатиперстной кишки.
Среди современных методов оперативного лечения язвенной болезни ваготомия прочно заняла одно из ведущих мест. Особого интереса заслуживает селективная проксимальная ваготомия как изолированная, так и сопровождающаяся дренирующими желудок операциями, как операция, сопровождающаяся наименьшим числом постваготомических осложнений.
Известны способы денервации желудка с помощью только медикаментозных средств, например спиртновокаиновой смеси (SU 1147361 A, 30.03.85), оказывают временное действие, блокада блуждающих нервов наступает лишь на непродолжительный срок.
Известны способы, позволяющие произвести деструкцию ветвей вагуса при лечении язвенной болезни с помощью физических факторов, например криовоздействия (SU, 1388006 A1, 15.04.88).
Однако использование криоаппликатора осложняется нередко необратимыми повреждениями сосудов и других окружающих веточки блуждающего нерва тканей.
Нами поставлена задача разработать малотравматичный, технически простой, не требующий длительного времени для своего выполнения эффективный метод селективной проксимальной ваготомии, который мог бы быть использован при лечении язвенной болезни двенадцатиперстной кишки, в том числе и в ургентной хирургии у больных дуоденальной язвой, осложненной желудочно-кишечным кровотечением.
В результате использования заявленного способа селективной проксимальной ваготомии достигается надежная денервация кислотопродуцирующей зоны желудка и исключаются интра- и послеоперационные осложнения, связанные с полным скелетированием малой кривизны желудка за счет сохранения анатомических структур малого сальника при деструкции веточек блуждающего нерва.
Предложенная нами методика сочетанного медикаментозно-термического воздействия позволяет избирательно создавать необратимые дегенеративные изменения веточек блуждающих нервов, не повреждая соседние кровеносные сосуды, клетчатку малого сальника, а также магистрали блуждающих нервов, идущие параллельно малой кривизне желудка. При этом последние как бы отодвигаются от малой кривизны желудка.
Предварительное формирование инфильтрата между листками малого сальника обеспечивает блокаду и частичный лизис ветвей вагуса, что позволяет уменьшить "агрессию", то есть интенсивность и продолжительность последующего электротермического воздействия. Достаточный коагулирующий эффект электромагнитного поля, в создании которого участвуют и ионы одного из компонентов лекарственной смеси (NaCl), достигается уже при температуре 70 o C, при средних параметрах мощности (75-85 Вт), небольшой продолжительности (5-10 секунд) действия переменного модулированного тока.
Способ осуществляется следующим образом.
Выполняют верхнесрединную лапаротомию. По малой кривизне желудка идентифицируют нервы Латарже. В бессосудистом участке малого сальника тупым путем проделывают окно. Малую кривизну желудка оттягивают вверх. Отступив 1,5-2,0 см от малой кривизны желудка от уровня гусиной лапки нерва Латарже до уровня пищеводно- желудочного перехода поэтапно в область малого сальника, вводят спиртновокаиновую смесь, создавая инфильтрат. Расстояние между вколами иглы составляет 3-4 см. Из одного вкола вводят 3-7 мл смеси. Используют спиртновокаиновую смесь следующего состава (мас.%): этиловый спирт 20,0, новокаин 0,5, NaCl 2,0, вода - остальное. Для введения спиртновокаиновой смеси используют одноразовую иглу малого диаметра, например иглу U-100 Insulin 29 Gauge Needle 32 8431 H 8290. Последовательные вколы осуществляют в направлении от гусиной лапки нерва Латарже до пищеводно- желудочного перехода. Таким образом, поэтапно обрабатывают всю переднюю и заднюю стенки желудка по малой кривизне. Затем в созданный инфильтрат вводят экранированный электрод в непосредственной близости от веточек блуждающего нерва и проводят их монополярную электрокоагуляцию. Используют следующие параметры электротермического воздействия переменного модулированного тока: мощность 75-85 Вт, продолжительность 5-10 с. Обычно вводят электрод в места вколов иглы при проведении спиртновокаиновой блокады. Электрод представляет собой гибкий стальной стержень, оканчивающийся тупо, с высокой электропроводностью, диаметром до 1 мм. Конструкция используемого электрода предполагает его изоляцию на всем протяжении за исключением 2-3 мм конечной части в области электротермического воздействия. При введении электрода размещают его экранированную часть глубже уровня поврежденной серозной оболочки в месте вкола.
После проведения экспериментального изучения методика предполагаемого сочетанного электротермического воздействия была использована у 12 пациентов с язвенной болезнью двенадцатиперстной кишки, осложненной желудочно-кишечным кровотечением различной степени тяжести. Больные наблюдались от 1 месяца до 2 лет после операции. Летальных исходов, послеоперационных осложнений, а также рецидива язвенной болезни не наблюдалось. У всех пациентов отмечалась редукция кислотообразования: базальная кислотопродукция уменьшилась на 80- 85%, стимулированная - на 60-65%, наблюдали стойкое повышение абсолютных значений pH.
Конкретный клинический пример.
Больная N. (история болезни N 19953, операция N 681), 58 лет, поступила в клинику в экстренном порядке с жалобами на боли в эпигастрии и правом подреберье, слабость, головокружение, тошноту, рвоту "кофейной гущей", сухость во рту, черный жидкий стул. Язвенной болезнью двенадцатиперстной кишки страдает более 10 лет, сезонное обострение - 1-2 раза в год. Общее состояние тяжелое, кожа бледной окраски, частота сердечных сокращений - 106 в 1 минуту. Артериальное давление 100/60 мм рт. ст. При промывании желудка получены остатки пищи, слизь, "кофейная гуща". При ректальном исследовании - "мелена". По клинико-лабораторным показателям определена тяжелая кровопотеря (Hb-76, Ht-21, Эр-2,2, ОЦК-1127, ГО-2037, ПО+910).
При экстренной эзофагогастродуоденоскопии (ЭГДС) - по задней стенке глубокий язвенный дефект до 2 см в диаметре, глубиной до 0,8 см, в центре которого сосуд до 0,5 мм в диаметре с умеренным кровотечением. Произведена попытка эндоскопической остановки кровотечения раствором азотнокислого серебра, тромбином - без эффекта.
После кратковременной интенсивной предоперационной подготовки, включающей гемостатическую и инфузионную терапию, произведена операция через два часа от момента поступления. Под эндотрахеальным наркозом произведена верхняя срединная лапаротомия. Желудок несколько увеличен, его стенка гипертрофирована, особенно антральный отдел. В области двенадцатиперстной кишки сразу ниже пилоруса грубый рубец, деформирующий кишку. На задней стенке пальпируется язвенный инфильтрат до 1,5 см в диаметре. В области желчного пузыря спаечный процесс. Тонкая и толстая кишки заполнены кровью. Произведена дуоденотомия: на задней стенке луковицы двенадцатиперстной кишки язвенный кратер с сосудом в центре, который прикрыт сгустком, активного кровотечения не отмечено. Выполнено иссечение язвы по задней стенке луковицы, пилороплатика по Финнею. После этого по малой кривизне желудка идентифицировали нервы Латарже. В малый сальник ввели одноразовую иглу малого диаметра, не повреждая кровеносные сосуды. По этой игле по направлению к эзофаго-кардиальному переходу под давлением ввели раствор указанного состава и создали инфильтрат. Таким образом, поэтапно обработали всю переднюю и заднюю стенки желудка по малой кривизне. Затем в той же последовательность в созданный инфильтрат ввели экранированный электрод в непосредственной близости от веточек блуждающего нерва и произвели монополярную электрокоагуляцию. Затем, отступив на 3-4 см дистальнее эзофаго- кардиального перехода, создали точечные инфильтраты в области веточек блуждающего нерва, которые впоследствии обработали электротермически. Время выполнения медикаментозно-термической СПВ составило 11 мин. Послеоперационное течение - гладкое.
На 12 сутки при исследовании желудочной секреции выявлена умеренная гипоацидность, нормальная ощелачивающая функция антрального отдела желудка. Выписана на 17 сутки после операции в удовлетворительном состоянии.
Через 1 месяц после операции чувствует себя хорошо. Жалоб со стороны пищеварительной системы не предъявляет, диету не соблюдает, отмечает увеличение массы тела. При контрольной ЭГДС - послеоперационная деформация желудка и луковицы двенадцатиперстной кишки. При pH-метрии и исследовании желудочной секреции изменения уровня кислотности, а также абсолютных значений базальной продукции кислоты и максимальной продукции кислоты не наблюдалось.
Больная осмотрена также через 6 месяцев и через 1 год после операции. Данных за рецидив язвенной болезни нет. Значения базальной и максимальной продукции кислоты без существенных изменений.
1. Способ селективной проксимальной ваготомии, включающий денервацию кислотопродуцирующей зоны желудка, отличающийся тем, что для проведения денервации используют сочетанное медикаментознотермическое воздействие, при этом сначала создают инфильтрат в малом сальнике, отступив 1,5 - 2 см от малой кривизны желудка, путем введения спиртновокаиновой смеси от уровня гусиной лапки нерва Латарже до уровня пищеводно-желудочного перехода по переднему и заднему листкам малого сальника, а затем электрокоагулируют веточки блуждающего нерва, вводя электрод в созданный инфильтрат, после чего создают точечные инфильтраты по передней стенке кардиального отдела желудка, отступив 3 - 4 см дистальнее пищеводно-желудочного перехода, вводя спиртновокаиновую смесь субсерозно в области ветвей блуждающего нерва, и электрокоагулируют их, вводя электрод в созданные инфильтраты.
2. Способ по п. 1, отличающийся тем, что в качестве спиртновокаиновой смеси используют смесь при следующем содержании компонентов, мас.%: Этиловый спирт - 20,0 Новокаин - 0,5 NaCl - 2,0 Вода - Остальное 3. Способ по пп.1 и 2, отличающийся тем, что при электрокоагуляции воздействуют переменным модулированным током мощностью 75 - 85 Вт в течение 5 - 10 с.
4. Способ по пп.1 - 3, отличающийся тем, что для введения спиртновокаиновой смеси используют одноразовую иглу малого диаметра и при создании инфильтра в области малой кривизны желудка вводят смесь в направлении от нерва Латарже до пищеводно-желудочного перехода с расстоянием между вколами 3 - 4 см в количестве 3 - 7 мл.
5. Способ по пп. 1 - 4, отличающийся тем, что при электрокоагуляции вводят электрод в места вколов иглы при введении спиртновокаиновой смеси, размещая экранированную часть электрода глубже уровня поврежденной серозной оболочки в месте вкола.
6. Способ по пп.1 - 5, отличающийся тем, что при электрокоагуляции используют экранированный электрод, обеспечивающий его изоляцию, за исключением 2 - 3 мм конечной части в области воздействия.
Читайте также:
- Этапы развития абсцессов мозга. Морфология отогенных абсцессов мозга
- Диагностика опухоль-ассоциированной кисты по КТ, МРТ
- Причины дегенеративных заболеваний межпозвонкового диска (остеохондроза)
- Гипофизарный нанизм. Поражение глаз при гипофизарном нанизме
- Диагностика острой субдуральной гематомы по КТ, МРТ
