УЗИ, МРТ при аномалии предшественника аллантоидного стебелька у плода
Добавил пользователь Валентин П. Обновлено: 02.02.2026
Что представляют собой ВПР (врожденные пороки развития)? Врожденные пороки развития - это одна из основных причин перинатальной смертности и инвалидности детского населения. Среди аномалий развития особую значимость имеют пороки развития, затрагивающие центральную нервную систему плода.
Поэтому важнейшей задачей настоящего времени является максимально раннее выявление врожденных пороков развития. Своевременное диагностирование патологий развития плода позволяет контролировать процесс уже на ранних этапах беременности, выбирать необходимую тактику ее ведения, уточнять сроки и способ родоразрешения, при необходимости проводить хирургическую или терапевтическую коррекцию, а в тяжелых случаях решать вопрос о прерывании беременности.
Что выбрать: УЗИ или МРТ плода? Основным методом диагностики врожденных пороков развития в современном акушерстве является УЗИ - диагностика.
Зачем и как проводится гинекологическое УЗИ? Рассказывает врач ультразвуковой диагностики «Клиника Эксперт Оренбург» Поскребышева Анна Викторовна
Проведение скрининговых исследований играет важнейшую роль в выявлении аномалий развития. Однако в тех случаях, когда возможности сонографии ограничены (ожирение матери, олигогидрамнион, ягодичное предлежание плода, редкая патология плода и др.), дополнительным методом исследования состояния плода является МРТ-исследование.
Зачем делают МРТ беременным? Читать далее
Метод МРТ: обладает высокой разрешающей способностью в визуализации структур головного мозга, позволяет получить мультипланарные изображения с большим полем обзора, не связан с ионизирующим излучением - безвреден; МРТ плода позволяет не только уточнять характер аномалий, заподозренных на УЗИ, но и выявлять ту патологию, определение которой находится за пределами возможностей сонографии.
В каких случаях МРТ противопоказано? Рассказывает исполнительный директор «Клиника Эксперт Оренбург» Подлевских Юрий Андреевич
Рассмотрим несколько примеров МРТ-исследования плода.
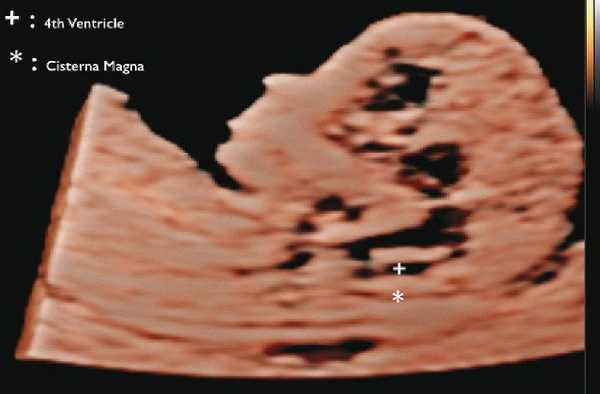
На рисунке - тазовое предлежание плода, 26 недель. Нормальная анатомия головного мозга
На рисунке - плод, 38 недель. Структурные изменения головного мозга плода не выявлены. Определяется однократное обвитие пуповиной
На рисунке - плод, 39 недель. Двукратное обвитие пуповиной
На рисунке - плод, 34 недели. Головное предлежание, гипоплазия мозжечка
Диагностика мальформаций мозолистого тела по данным УЗИ часто представляет сложности. При этом результаты МРТ-исследования уже на 20 неделе гестации сравнимы с данными МРТ в постнатальный период.
На рисунке - плод, 29 недель. Агенезия мозолистого тела. Асимметричная гидроцефалия
МРТ плода позволяет диагностировать такие нарушения нейрональной миграции, как лисэнцефалия, гетеротопия, шизэнцефалия, мало доступные для диагностики при других методах исследования.
На рисунке - плод, 32 недели; поперечное положение плода. Шизэнцефалия
Методом УЗИ-скрининга также возможно выявление черепно-мозговых грыж плода. Но при этом точно определить содержимое грыжевого мешка возможно только при МРТ-исследовании.
На рисунке - плод, 23 недели. Теменно-затылочное энцефалоцеле, заполненное спинномозговой жидкостью без признаков вовлечения мозговой ткани
Метод МРТ имеет большое значение в выявлении не только пороков развития ЦНС, но и при заболеваниях и аномалиях паренхиматозных органов брюшной полости и малого таза плода, его опорно-двигательного аппарата, крупных сосудов и др.
На рисунке - плод, 22 недели. Энтерогенная киста
На рисунке - врожденная диафрагмальная грыжа
На рисунке - мультикистоз почки
На рисунке - плод, 28 недель. Атрезия пищевода
На рисунке - пупочная грыжа
Таким образом, МРТ является дополнительным способом визуализации структур головного мозга плода. Он дополняет ультразвуковое исследование в тех случаях, когда применение сонографии технически ограничено, либо ее результаты сомнительны и противоречивы.
Скрининг и диагностика патологии плода в I триместре с помощью УЗИ
Перевод статьи: "First Trimester Fetal Ultrasound Scan as a Screening and Diagnostic Tool".
С появлением новых технологий ультразвуковое исследование в I триместре беременности кардинально изменилось. Можно отметить удивительный прогресс методов сканирования от "базового", с функцией подтверждения беременности, оценки ее жизнеспособности и локализации, установления гестационного возраста, до более "сложного", с получением дополнительных биометрических и морфологических данных, а также оценки рисков для матери и плода. Эта статья посвящена только вопросам оценки состояния плода без определения рисков для матери.
Биометрия плода
Некоторые ультразвуковые измерения в I триместре обязательны для выполнения. В большинстве случаев гестационный возраст до 15 нед с определенной степенью точности оценивают по показателям бипариетального размера (БПР) и копчико-теменного размера (КТР) (рис. 1). В дальнейшем эту информацию дополнять не будут, а использовать будут в основном для установления задержки внутриутробного развития, при планировании обследования по поводу врожденных аномалий и послеродовых осложнений. УЗИ на сроках между 11 нед 0 дней и 13 нед 6 дней необходимо постоянно сравнивать с данными обследования на сроках между 7 и 10 нед. Таким образом, УЗИ в I триместре должно помочь обнаружить ряд аномалий развития плода, например триплоидию [1].
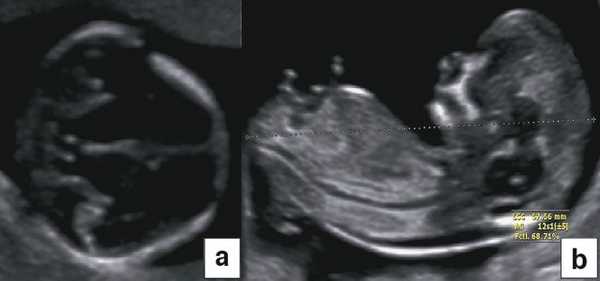
Воротниковое пространство
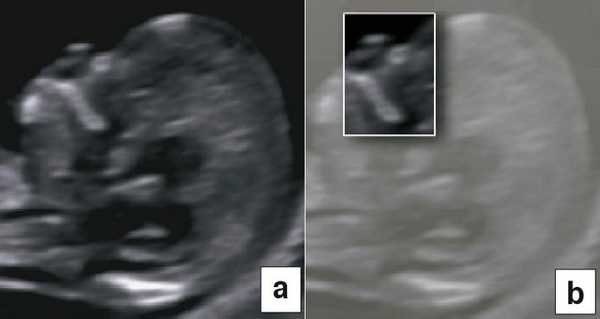
В начале 90-х годов прошлого века в практику был внедрен метод измерения толщины воротникового пространства (ТВП) в I триместре беременности, и к настоящему времени его считают показателем не только анеуплоидии, но и широкого спектра наследственных синдромов и пороков развития [2]. K. Николаидес (K. Nicolaides) с группой исследователей предложили новую модель скрининга на анеуплоидию и установили правила использования этого метода, в частности необходимость применения кривой обучения, проведения аудита, качественного (процедура оценки качества изображений) и количественного (медиана, дельты-ТВП и т.д.). Фонд медицины плода (Fetal Medicine Foundation) стандартизировал предложенный ими клинический протокол и установил правила сертификации для повышения качества медицинской помощи и уменьшения изменчивости результатов данных скрининга [3, 4]. Измерение ТВП можно проводить вручную (рис. 2a) или полуавтоматически (рис. 2b), чтобы результаты измерений были более воспроизводимыми. Кроме того, компания Samsung разработала дополнительный метод измерения показателей ТВП - 5D NT, позволяющий точно выявить срединно-сагиттальную плоскость и улучшить оценки по шкале Германа (Herman score).
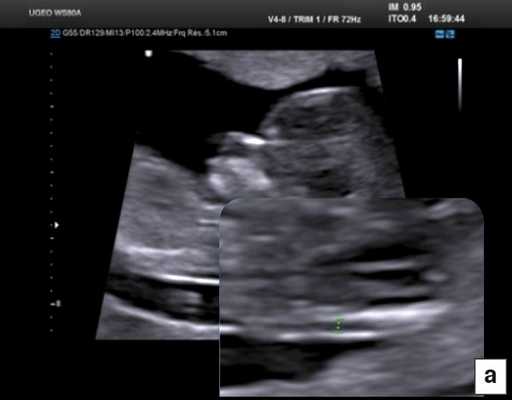
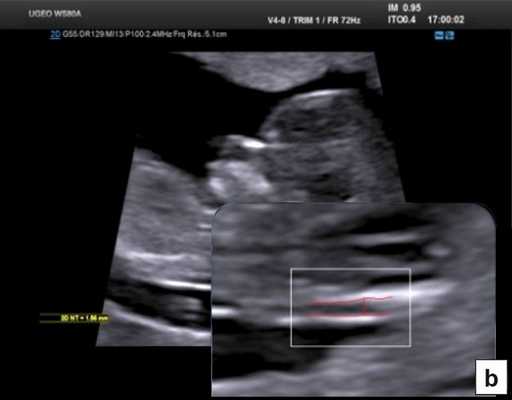
Анатомическая оценка
Описанные в литературе величины частоты выявления дефектов в I триместре беременности значительно различаются в зависимости от изученных популяций, методов и периодов [5]. По мере развития методов ультразвуковой диагностики усовершенствовался и анатомический анализ для I триместра беременности. Международное общество по применению УЗИ в акушерстве и гинекологии (International Society of Ultrasound in Obs tetrics and Gynecology - ISUOG) в 2013 г. предложило руководство для клинической практики, предполагающее проведение оценки анатомии плода между 11 нед 0 дней и 13 нед 6 дней беременности (рис. 3) [6].
Метод УЗИ позволяет выявлять в I триместре ряд аномалий развития плода:
- Видимые аномалии - анэнцефалия, алобарная голопрозэнцефалия, гастрошизис, омфалоцеле, аномалия предшественника аллантоидного стебелька, гидронефроз и некоторые несовместимые с жизнью остеохондродисплазии.
- Невидимые аномалии мозга, пищеварительной системы, урологические и скелетные аномалии.
- Некоторые аномалии, требующие анализа, - аномалии сердца, лица, конечностей, spina bifida.
Не так давно качество УЗИ в I триместре удалось повысить до уровня, позволяющего при рутинном ультразвуковом скрининге проводить полноценное диагностическое УЗИ. Достижения 3D/4D-методов и автоматизированные технологии измерения обеспечивают дополнительные возможности проведения точной анатомической оценки.
Диагноз хориальности и количества амнионов
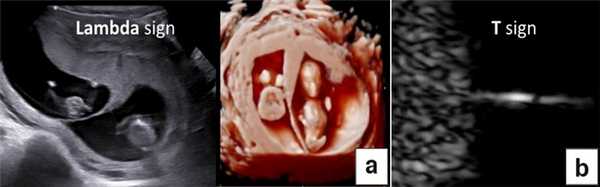
УЗИ при двойне в основном должно выявить хориальность (ди- или монохориальность) и для монохориальных беременностей (моно- или диамниотических) - количество амнионов. При многоплодной беременности эта информация необходима для соответствующего ведения дискордантной мальформации, замедления роста, внутриутробной гибели плода или получения образцов ткани плода. Точность этой диагностики в течение I триместра может достигать 100%, а затем на протяжении беременности она уменьшается [7]. Дихориальность подтверждают выявлением лямбда-признака (рис. 4a). Наоборот, монохориальность диагностируют при отсутствии визуализации лямбда-признака или выявлении T-признака (рис. 4b) в межамниотической мембране, расположенной перпендикулярно хорионической пластине.
Рис. 4. Диагностика хориальности и количества амнионов в I триместре путем оценки лямбда-признака (a) и T-признака (b).
Оценка риска для плода
УЗИ в I триместре также позволяет охарактеризовать несколько рисков для плода, таких как анеуплоидии, врожденные пороки сердца, расщелина позвоночника (spina bifida).
Анеуплоидии
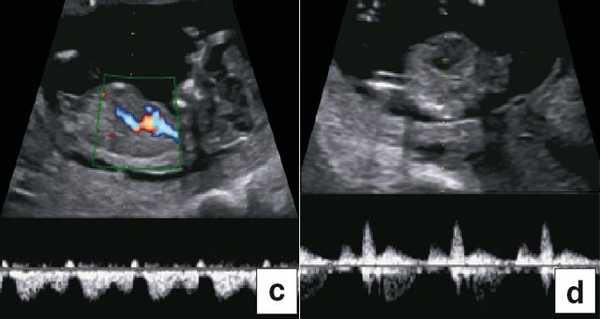
В 90% случаев крупные анеуплоидии у плодов можно обнаружить с помощью комбинированной оценки возраста матери, измерений ТВП и сывороточных маркеров у матери (РАРР-А и свободный бета-ХГЧ) [8]. Результат такого скрининга можно улучшить, исследуя сывороточные маркеры раньше, на сроках от 9 до 10 нед, и проводя УЗИ на 12-й неделе для выявления дополнительных маркеров, таких как носовая кость плода, кровоток в венозном протоке и через трехстворчатый клапан (рис. 5) [9]. Кроме того, выявлять часто встречающиеся хромосомные аномалии у плода позволяет неинвазивное пренатальное тестирование (Non Invasive Prenatal Testing - NIPT).
Рис. 5. Оценка анеуплоидии по ультразвуковым маркерам: толщина воротникового пространства (a), носовая кость (b), венозный проток (c), кровоток через трехстворчатый клапан (d).
Врожденные пороки сердца
В группах с высоким риском развития врожденных пороков сердца (ВПС) эхокардиографию плода можно проводить на ранних сроках. Обычно исследование выполняет специалист, хорошо знакомый с пренатальной диагностикой ВПС. Высокий риск развития ВПС у плода выявляют не только по данным анамнеза пациентки и семейного анамнеза или воздействия токсических факторов, но и по увеличению ТВП и изменению кровотока в венозном протоке и через трехстворчатый клапан [9]. "Подробную" эхокардиографию плода обычно проводят только в группе высокого риска, а проводить "базовую" эхокардиографию в общей популяции в настоящее время не рекомендовано.
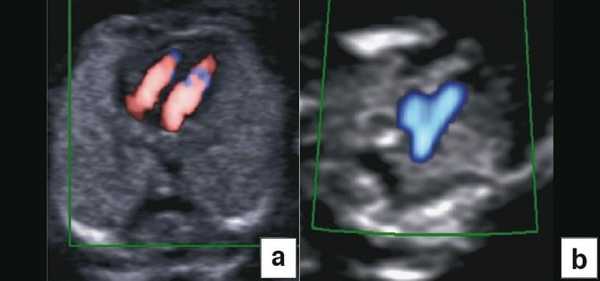
Тем не менее "базовое" УЗИ обычно дополняют исследованием в цветовом энергетическом допплеровском режиме с тщательным анализом для выявления атриовентрикулярного кровотока в четырех камерах сердца (рис. 6a) и в срезе через три сосуда и трахею (рис. 6b). Получив эти срезы, обычно можно успокоить родителей, исключив наличие тяжелых пороков сердца, таких как единственный желудочек, гипоплазия желудочков, полный дефект предсердно-желудочковой перегородки (atrioventricular septal defect - AVSD), атрезия аорты или легочной артерии, а также ряд аномалий расположения артерий.
Рис. 6. Эхокардиография плода на ранних сроках в цветовом энергетическом допплеровском режиме - визуализируются четыре камеры (a) и срез через три сосуда и трахею (b).
Расщепление позвоночника (spina bifida)
В прошлом лечащие врачи и врачи ультразвуковой диагностики проводили ультразвуковой скрининг для выявления дефектов нервной трубки, главным образом открытого расщепления позвоночника (spina bifida), во II триместре. В последние годы предложены ранние ультразвуковые маркеры на 11-14-й неделе беременности (внутричерепное пространство, использование БПР и соотношения БПР/ПРЖ (поперечный размер живота)), которые позволяют выявить у некоторых плодов высокий риск открытого расщепления позвоночника (рис. 7) 11.
Рис. 7. Внутричерепное пространство при ультразвуковом скрининге по поводу открытого расщепления позвоночника.
I триместр беременности имеет ключевое значение для оценки риска для матери и плода, проведения персонализированных консультаций и последующего наблюдения. Вероятно, методика УЗИ в I триместре будет и далее активно развиваться и совершенствоваться, поскольку имеет для скрининга и диагностики ключевое значение.
Современные подходы к изучению плодового фенотипа в эру генетического ультразвука
Медико-генетическое отделение Московского областного НИИ акушерства и гинекологии, Москва.
Курс пренатальной диагностики, ФГБОУ ДПО РМАПО Минздрава России, Москва.
УЗИ сканер HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Настоящая работа посвящена изучению плодового фенотипа при ультразвуковом исследовании в различные сроки беременности при помощи новейших технологий Samsung, оптимизирующих диагностику многих врожденных пороков развития, аномалий, нарушений строения, особенностей развития с оценкой значимости отдельных ультразвуковых патологических маркеров в качестве потенциальных признаков генетических синдромов и ассоциаций.
Одной из ведущих причин детской и младенческой смертности являются врожденные пороки развития (ВПР), среди которых в 20% случаев встречаются множественные ВПР (МВПР) с установленной частотой 1:250 новорожденных [1]. Особое значение в профилактике МВПР имеет пренатальная диагностика - современный и высокоэффективный метод диспансеризации плода, направленный на своевременное выявление патологии, впоследствии определяющий выбор адекватной акушерской тактики при данной беременности и специфических мер профилактики болезни в данной семье в дальнейшем [2]. Современные ее возможности позволяют из комплекса патологических нарушений у плода выделить достоверно значимые ультразвуковые маркеры для постановки диагноза генетических синдромов различной этиологии. Сегодня пренатальная синдромология активно развивается, как в плане расширения спектра возможных лабораторных исследований, так и описания значимых, ключевых, таргетных ультразвуковых признаков многих наследственных синдромов различного происхождения.
Группа МВПР включает сотни нозологических форм, различных по этиологии, фенотипическим проявлениям и прогнозу. В силу огромной гетерогенности МВПР представляют собой сложную проблему для постановки окончательного диагноза. Основными этиологическими факторами, приводящими к возникновению синдромов с множественными пороками развития, являются генные, хромосомные мутации и действие на плод неблагоприятных факторов внешней среды [3, 4].
Любые наследственные или врожденные генетические болезни являются результатом повреждения генетической информации на геномном, хромосомном или генном уровне. В 60% всех случаев МВПР встречаются хромосомные синдромы, достаточно широко изученные и хорошо диагностируемые. Для лабораторной диагностики этих повреждений разработаны разнообразные и хорошо известные методы: цитогенетический, молекулярно-цитогенетический и молекулярно-генетический. МВПР нехромосомного генеза встречаются в 40% случаев. Среди них выделяют синдромы, ассоциации и неклассифицированные комплексы. Применительно к нехромосомным синдромам цитогенетическое исследование позволяет лишь отвергнуть хромосомную природу данного комплекса пороков развития, но не установить диагноз.
Сегодня имеется определенное количество публикаций о выявлении некоторых синдромов и ассоциаций при пренатальной эхографии [6, 7]. Однако дородовая идентификация нозологических форм нехромосомных синдромов пока не вошла в рутинную практику врачей в области пренатальной диагностики и носит случайный характер. В литературе отсутствуют четкие рекомендации о системном подходе к диагностике наследственных синдромов различной этиологии, нет диагностических алгоритмов и определенных схем взаимодействия врачей ультразвуковой пренатальной диагностики, генетиков, акушеров-гинекологов.
Использование эхографии делает возможным пренатальное выявление не менее 80% врожденных дефектов во II, III триместрах беременности и свыше 50% значимых нарушений анатомии плода уже в I триместре начиная со сроков 11-12 нед. Весь комплекс диагностированных пороков развития и различных микроаномалий в совокупности составляет фенотипический спектр синдрома, который состоит из «ядерных» (главных, ключевых) признаков и дополнительных аномалий, наличие которых не является обязательным для диагностики клинической нозологии синдрома.
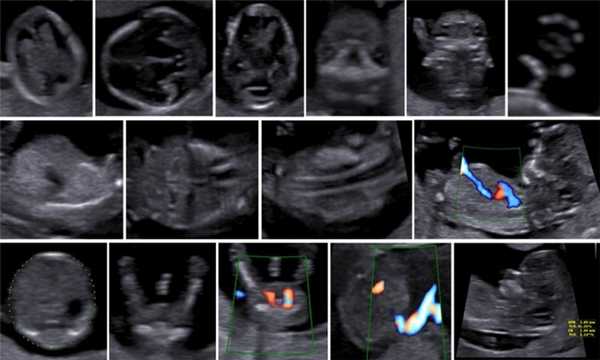
Революцией в пренатальной ультразвуковой диагностике явилось появление объемной эхографии, которая, обладая такими качествами, как неинвазивность, безопасность и возможность многократного применения у одной пациентки, имеет высокую информативность в исследовании анатомии плода и изучении его фенотипа. При применении различных режимов объемной эхографии абсолютно очевидно их преимущество по сравнению с обычным сканированием. Детально можно изучить лицо плода (рис. 1-4) в различные сроки беременности, начиная со сроков первого пренатального скрининга в 11-14 нед, конечности плода, причем не только их наличие и положение (рис. 5, 6), но и состояние и количество пальцев (рис. 7-9) как на руках, так и на ногах. Также можно изучить позвонки плода (рис. 10), состояние твердого нёба (рис. 11, 12), строение наружного уха (ушной раковины) (рис. 13), состояние основных швов черепа и родничков, исключая их преждевременное закрытие при кранисиностозах (рис. 14, 15).
Патологии позвоночника у плода, выявляемые на УЗИ
Патологии позвоночника у плода встречаются в 1 случае на 1000 беременностей. Часто нарушения касаются не только самого позвоночного столба, но и спинного мозга. В основном плод с аномалией позвоночника гибнет внутриутробно или сразу после рождения, поэтому очень важно установить проблему как можно раньше, чтобы женщина обдуманно приняла решение о прерывании беременности.
Причины возникновения внутриутробных аномалий позвоночника
В большинстве случаев аномалия возникает в поясничном отделе, реже — в шейном, и совсем нечасто — в области крестца и грудном отделе.
Причины столь сложной патологии до сих пор не ясны. Но среди факторов, провоцирующих нарушение формирования спинного мозга, совершенно определенно можно выделить:
- TORCH-инфекцию;
- токсическое воздействие лекарств;
- сложные условия работы;
- употребление наркотиков и алкоголя;
- многолетний стаж курения.
Когда можно обнаружить патологии позвоночника у плода
Расщепление нервной трубки происходит в период с 19 по 30 день гестации (дня последней менструации у беременной). Аномалию позвоночника можно выявить уже на первом скрининге, который проводится на 11-й неделе беременности. Второй скрининг обычно подтверждает результаты 1-го скрининга и выявляет новые нарушения.
Миеломенингоцеле
75% всех случаев аномалий позвоночника у плода занимает миеломенингоцеле (spina bifida cystica). Патология выражается в выпячивании спинного мозга за пределы позвоночной дужки. Иногда мозговая ткань защищена кожей, но чаще выходит наружу вместе с нервными отростками. В последнем случае плод рождается с параличом нижних конечностей, проблемами с кишечником и мочевым пузырём. В 90% случаев у плода диагностируется гидроцефалия (водянка головного мозга).
Характерные признаки миеломенингоцеле на УЗИ:
- на задней поверхности позвоночника визуализируется жидкость;
- через позвоночную щели видно образование с жидкостью внутри;
- черепная ямка имеет меньшие размеры;
- ткани мозжечка смещены;
- выражено искривление позвоночника;
- размеры плода меньше нормы;
- диагностируется гидроцефалия из-за низкого расположения спинного мозга и блокировки спинномозговой жидкости.
При подозрении на патологию женщина сдаёт кровь на специфические ферменты. У неё повышен уровень альфа-фетопротеина, как и при других аномалиях плода. Затем беременную отправляют на 4D сканирование, во время которого можно увидеть объёмное изображение плода. Однако это становится возможным только с 20-й недели беременности.
Миеломенингоцеле — тяжёлая форма расщепления позвоночника, поэтому при подтверждении диагноза на УЗИ женщине рекомендуют сделать аборт. Даже если малыш родится живым, он не сможет ходить, у него будут проблемы с внутренними органами.
Операция по перемещению вышедшего за пределы позвоночного столба спинного мозга со спинномозговыми нервами проводится в течение 48 часов с момента рождения. Выпячивающаяся капсула помещается обратно в позвоночный канал, сверху нашиваются мышцы и кожа.
Такие дети нуждаются в особом лечении, которое существенно не улучшит их качество жизни. Очень низкий процент детей в будущем смогут ходить, но большинство будет нуждаться в инвалидной коляске, потому что нервные окончания повреждаются и не позволяют спинному мозгу нормально функционировать.
Синдром Клиппеля-Фейля
Синдром Клиппеля-Фейля встречается очень редко, в 1 случае из 120 000 беременностей, и имеет особенность передаваться по наследству.
Патология заключается в аномальном строении шейного отдела позвоночника, при котором позвонки сращиваются между собой. Шея практически отсутствует и, в зависимости от разновидности синдрома, патология имеет и другие нарушения. Наиболее опасна разновидность KFS3, при которой сращены не только шейные позвонки, но и грудные, а также поясничные. Из-за незаращения дужек позвоночника образуются дополнительные рёбра.
Помимо этого у плода визуализируются лишние пальцы, их недоразвитие или сращивание, гипоплазия почек, заращение мочеиспускательного канала, заболевания сердечно-сосудистой системы, отсутствует лёгкое, сбои в работе ЦНС. При любой форме синдрома у плода формируется искривление позвоночника (сколиоз).
Причина патологии — мутация гена GDF6. Выявляется аномалия не раньше 20-й недели беременности. При ультразвуковом исследовании на экране УЗИ заметно следующее:
- укорочение шеи;
- плод не поворачивает голову;
- низкая линия роста волос на затылке;
- асимметрия лица;
- отсутствие одного лёгкого;
- гипоплазия почки;
- срастание или недоразвитие пальцев на руке;
- лишние количество пальцев;
- сращение позвонков в различных отделах позвоночника.
Первые две разновидности синдрома Клиппеля-Фейля поддаются коррекции. Ребёнку проводят операцию, затем он проходит сложную восстановительную терапию. На сегодняшний день полностью восстановить позвоночник не удастся, однако человек сможет жить обычной жизнью, потому что умственные способности не затрагиваются.
При третьей форме патологии женщине предложат прерывать беременность, потому что при срастании позвонков ущемляются нервные корешки, из-за чего развиваются различные заболевания внутренних органов. Дети с формой KFS3 требуют особый уход за собой и всё-равно умирают в раннем возрасте.
Spina bifida
Spina bifida или неполное закрытие позвоночного канала, возникающее на ранних сроках беременности в связи с неправильным формированием нервной рубки. Помимо проблем с позвоночником, при Spina bifida имеется недоразвитие спинного мозга. 95% детей с такой патологией рождается у совершено здоровых молодых родителей.
Самой лёгкой формой патологии является Spina bifida occulta — небольшая щель в позвоночном столбе, не сопровождающаяся выпячиванием наружу спинного мозга и повреждением нервных корешков. Дефект внешне практически не заметен, и со стороны сложно сказать, что есть какая-то проблема.
Иногда у новорождённого наблюдаются проблемы с кишечником и мочевым пузырём, имеется сколиоз и слабый тонус ног. Единственным способом диагностики патологии является рентгенография. На скрининговом УЗИ она практически не видна, только при 4D УЗИ можно увидеть неполное сращение дужек позвоночного столба на поздних сроках беременности. Аномалия не требует коррекции, и прерывать беременность женщине не надо.
Кистозная гигрома шеи
Гигрома на шее у плода (лимфангиома) — это доброкачественная опухоль, которая образуется в результате нарушения формирования лимфасистемы в области шейных позвонков в период эмбрионального развития. Если нарушается лимфаток в месте соединения яремного мешка с яремной веной, образуется киста или несколько кист, заполненных фиброзно-серозной жидкостью. Опухоль локализуется возле шейных позвонков, влияя на развитии плода.
Патологию на УЗИ можно увидеть уже на 1-м скрининге на срок 11-12 недель. Главным показателем будет увеличение толщины воротникового пространства. Гигрома шеи у плода возникает как в результате хромосомных нарушений, так и под влиянием внешних причин — механической внутриутробной травмы, курение и употребление алкоголя матерью, перенесённые во время беременности инфекции.
На 2-м скрининге гигрома визуализируется как ассиметричное новообразование с плотной оболочкой, иногда имеющее перегородки внутри, расположенное в проекции шейного отдела позвоночника. Сама по себе опухоль не представляет угрозы для жизни плода.
Если этого не произойдёт, то у малыша после рождения вероятно наличие следующих отклонений:
- парез лицевого нерва — обездвиживание мускулатуры лица по причине длительного сдавливания гигромой нервного волокна;
- деформация позвоночника (чаще всего встречается кривошея — искривление шейного отдела из-за воспалительного процесса в шейных мышцах вследствие перенапряжения постоянного давления опухоли);
- деформация затылочной кости и челюсти;
- нарушение глотательной функции;
- обструкция дыхательных путей (непроходимость дыхательного канала из-за перекрытия трахеи гигромой).
Лечится гигрома консервативно после рождения ребёнка. Если причиной патологии не являются хромосомные нарушения, прогноз для малыша благоприятен.
Выводы
Чтобы исключить любые патологии позвоночника у плода, нужно уже на ранних сроках проходить скрининг с помощью хорошего УЗИ-аппарата. Аномалии позвоночника видны даже при первом обследовании, что позволяет, в случае тяжелых нарушений, своевременно прервать беременность.
Возможности эхографии для диагностики дефектов позвоночника плода
Spina bifida - дефект развития нервной трубки, представляющий собой расщепление спинномозгового канала (спинальный дизрафизм), часто с формированием грыж спинного мозга.
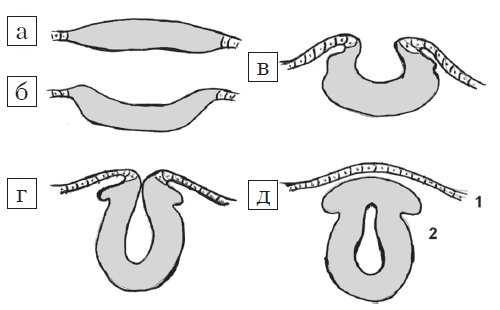
Рис. 1. Стадии эмбриогенеза нервной трубки: поперечный схематических разрез.
а) Медуллярная пластинка.
б, в) Медуллярная бороздк.
г, д) Нервная трубка: 1 - роговой листок (эпидермис); 2 - нейральные гребни.
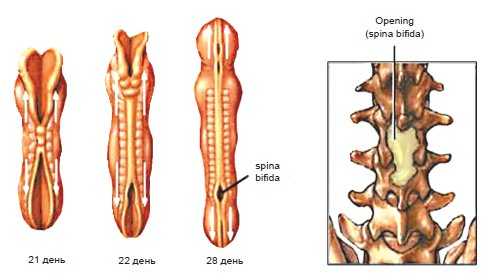
Рис. 2. Формирование дефекта нервной трубки.
Типичным для всех видов и форм спинальных дизрафий является их заднее расположение с дефектом заднего полукольца позвоночного канала. Крайне редко (менее 1% случаев) незаращение формируется на переднебоковой поверхности канала, и возникают передние спинномозговые грыжи.
Передняя и задняя расщелины позвонка могут проходить по срединной линии, а также располагаться асимметрично. В ряде случаев щель располагается косо. Если расщепление позвонков происходит по срединной линии, то деформация позвоночника может быть незначительной или вовсе не выражена. Однако при асимметричном и косом расположении щели в сочетании с другими аномалиями развития позвонков (например, односторонней микроспондилией половины позвонка, аномалией суставных отростков) развивается выраженная деформация позвоночника.
Наиболее часто (до 70% случаев) spina bifida локализуется в пояснично-крестцовой области, в 21% - в грудном отделе и в 9% - прочей локализации [1].
- Spina bifida occulta. Этот вариант еще называют "скрытым", так как видимого наружного дефекта нет. Скрытые незаращения позвоночника обычно локализуются в пояснично-крестцовой области и, как правило, клинически ничем не проявляются. Часто они являются случайной "находкой" при рентгенологическом исследовании позвоночника или МРТ. Анатомическая сущность скрытой расщелины позвоночника состоит в неполном заращении дужки позвонка. Это наиболее благоприятный вариант spina bifida. Иногда в области дефекта имеются "маркеры" или кожные стигмы в виде липом, кистозных и/или солидных масс, участков аномального оволосения, гиперпигментации. При закрытых дефектах также встречаются аномалии позвонков, деформации стоп и аномально низкорасположенный конус. Закрытый вариант spina bifida не сопровождается синдромом Арнольда Киари II, вентрикуломегалией и другими интракраниальными изменениями [2].
- Meningocele. Менингоцеле представляет собой расщепление позвоночника с выпячиванием в дефект твердой мозговой оболочки, но без вовлечения в процесс нервных структур (рис. 3). Содержимое грыжевого мешка - мозговые оболочки и ликвор, форма его - обычно стебельчатая с суженной ножкой. Костный дефект захватывает обычно два-три позвонка. Клинические проявления заболевания вариабельны и колеблются от бессимптомного течения до нарушения функции тазовых органов, двигательных и чувствительных расстройств. Данный вариант spina bifida встречается редко.
- Myelomeningocele. Это наиболее тяжелая форма spina bifida, с вовлечением в грыжевой мешок оболочек, спинного мозга и его корешков. Костный дефект обычно широкий и протяженный, захватывает от 3 до 6-8 позвонков. Степень неврологического дефекта всегда тяжелая параплегия нижних конечностей, чувствительные расстройства, нейрогенный мочевой пузырь и парез кишечника. Именно эта форма спинномозговых грыж встречается наиболее часто - около 75% всех форм 4. Почти во всех случаях миеломенингоцеле сочетается с синдромом Арнольда - Киари II. Таким образом, обнаружение признаков аномалии Арнольда - Киари II у плода является маркером наличия spina bifida. Кроме того, в 70-80% случаев у плода развивается гидроцефалия [5, 6].
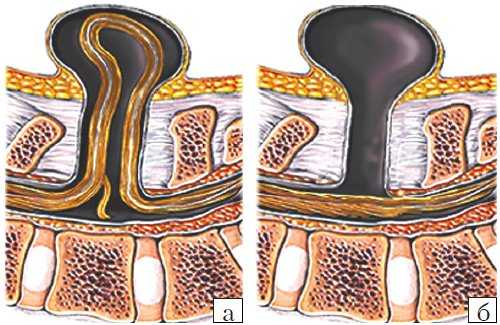
Рис. 3. Схема дефектов позвоночника плода.
а) Meningomyelocele.
б) Meningocele.
Представляем клинические наблюдения, демонстрирующие возможности эхографии в диагностике дефектов позвоночника плода.
Клиническое наблюдение 1
Пациентка К., 26 лет, обратилась в клинику в 23 нед беременности. Беременность первая. Исследование проводилось на аппарате Accuvix-XQ (Samsung Medison) с использованием режима поверхностной объемной реконструкции 3D/4D. Показатели фетометрии полностью соответствовали сроку беременности. В процессе сканирования позвоночника во фронтальной и сагиттальной плоскостях выявлена угловая деформация позвоночника в грудном отделе, протяженностью около трех позвонков. В поперечной плоскости сканирования нарушения структур и целостности тканей не было обнаружено. В режиме 3D/4D реконструкции было выявлено асимметричное расхождение ребер правой и левой стороны грудной клетки (рис. 4).
Рис. 4. Эхографическая картина асимметрии ребер в режиме 3D реконструкции.
Ребра левой стороны были сближены, межреберные промежутки уменьшены по сравнению с противоположной стороной (рис. 5, 6). Другой патологии у плода не было выявлено. Заподозрен врожденный сколиоз, основой которого является наличие боковых полупозвонков (hemivertebrae) или боковых клиновидных позвонков. В 26 нед ультразвуковая картина сохранялась. При проведении трехмерной эхографии получено отчетливое изображение асимметрии реберных дуг и сколиотическая деформация позвоночника.
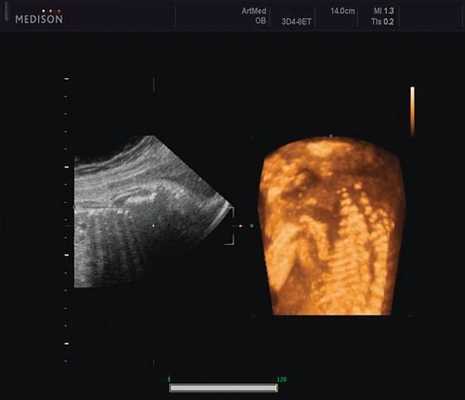
Рис. 5. Асимметрия межреберных промежутков в режиме 3D реконструкции.
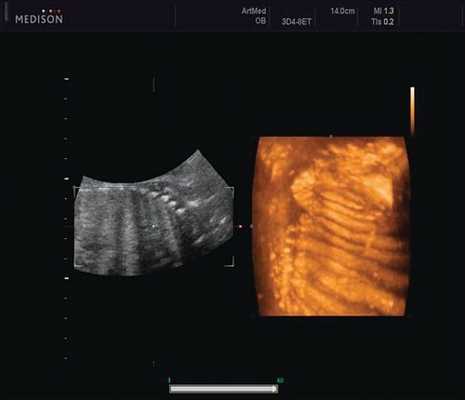
Рис. 6. Асимметрия межреберных промежутков в режиме 3D реконструкции.
В 30 нед фетометрические показатели плода соответствовали сроку беременности. Сколиотическая деформация позвоночника сохранялась. Дополнительно выявлена оболочечная грыжа, исходящая из грудного отдела позвоночника, в области деформированных позвонков. Грыжа представляла собой стебельчатой формы образование с суженной ножкой (рис. 7, 8). Концевая часть ее была расширена в виде петли и заполнена анэхогенным содержимым (ликвором), которое отчетливо дифференцировалось на фоне "мутных" околоплодных вод (рис. 9). Таким образом, диагноз был уточнен: spina bifida - менингоцеле.
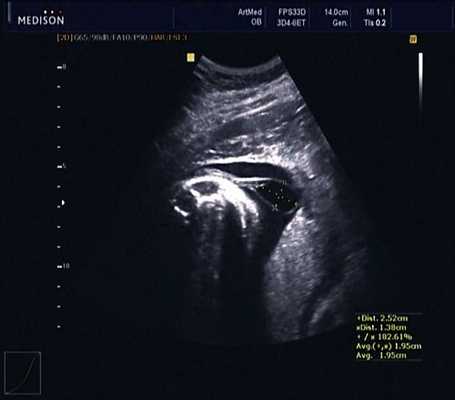
Рис. 7. Беременность 30 нед. Стебельчатая форма менингоцеле.
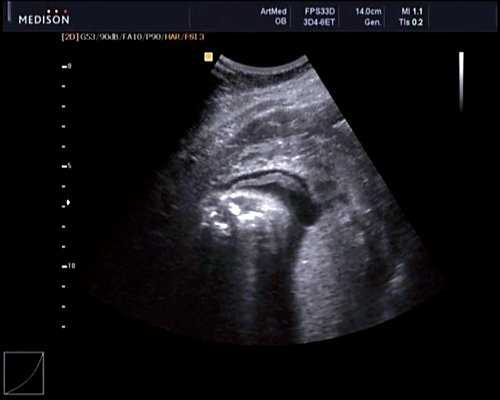
Рис. 8. Место выхода мозговой оболочки.
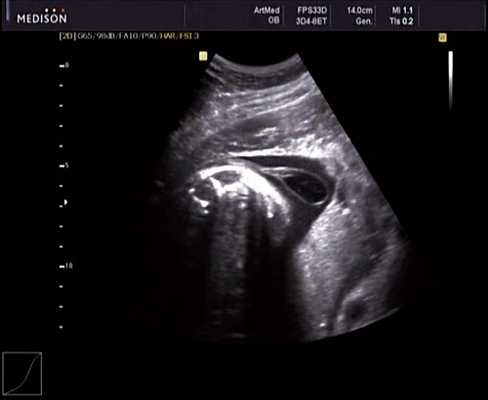
Рис. 9. Беременность 30 нед. Эхогенность ликвора ниже эхогенности околоплодных вод.
Дальнейшее наблюдение не выявило значительной динамики обнаруженных изменений.
После рождения диагноз spina bifida - менингоцеле подтвержден. Ребенок успешно оперирован, у него отсутствуют какие-либо неврологические расстройства.
В данном случае, локальная угловая деформация позвоночника в грудном отделе и асимметрия ребер явились начальными ультразвуковыми признаками открытой формы spina bifida - менингоцеле во II триместре беременности. Манифестация грыжи возникла только в III триместре.
Клиническое наблюдение 2
Беременная М., 21 года. Впервые обратилась в клинику в срок 20 нед беременности. Исследование проводилось на аппарате SonoAce-R7 (Samsung Medison) с использованием режима поверхностной объемной реконструкции 3D/4D. При изучении позвоночника плода в трех плоскостях костных деформаций не выявлено. В грудном отделе позвоночника обнаружено тонкостенное кистозное образование с анэхогенным содержимым, стебельчатой формы (рис. 10-12). Степень "прозрачности" содержимого была выше околоплодных вод, что позволяло идентифицировать его как ликвор. В проекции грыжевого выпячивания располагалась петля пуповины, дифференциальную диагностику которой без труда удалось провести с помощью ЦДК (рис. 13).
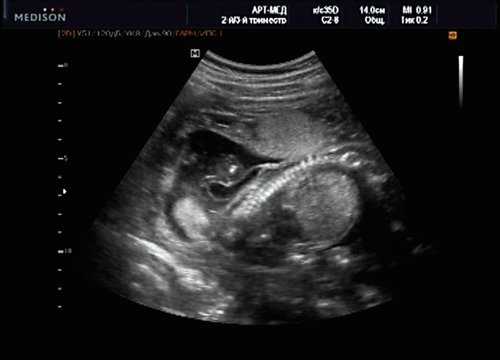
Рис. 10. Беременность 20 нед. Менингоцеле: типичное кистозное образование стебельчатой формы.
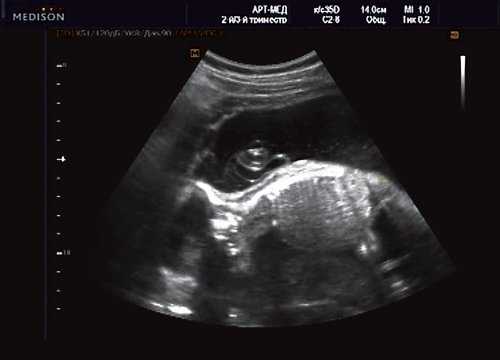
Рис. 11. Беременность 20 нед. Менингоцеле.
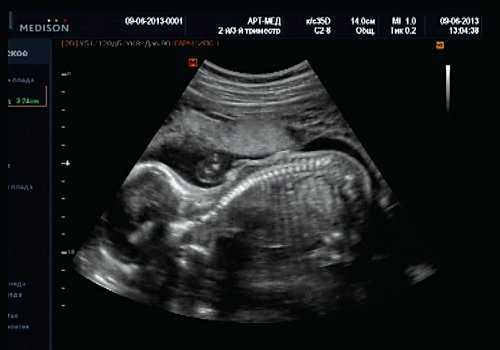
Рис. 12. Менингоцеле. В сагиттальном срезе видна неровность кожи в проекции расщелины.
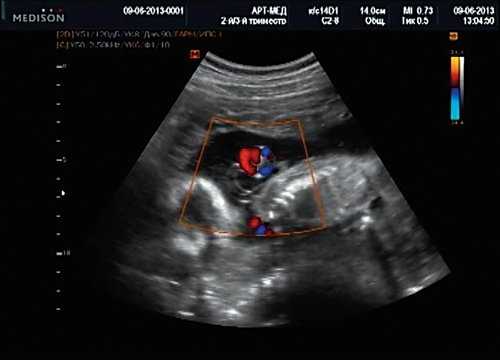
Рис. 13. Петля пуповины в режиме ЦДК.
У плода наблюдалась выраженная гидроцефалия, обусловленная синдромом Аронольда - Киари II (рис. 14, 15).
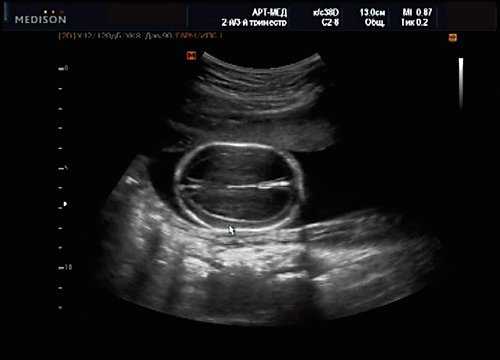
Рис. 14. Беременность 20 нед. Гидроцефалия.
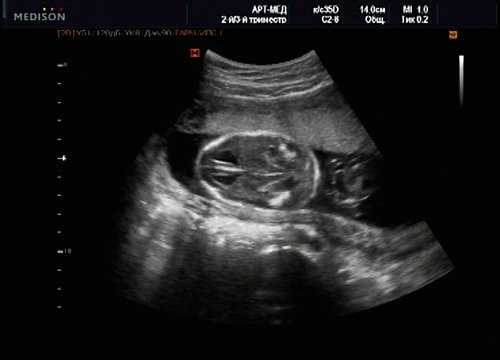
Рис. 15. Беременность 20 нед. Удлинение ножек мозга и вклинение мозжечка в затылочное отверстие при синдроме Арнольда - Киари II.
Учитывая типичную форму грыжевого выпячивания и отсутствие элементов нервной ткани, было высказано предположение о наличии у плода менингоцеле (рис. 16). Женщина приняла решение о прерывании беременности.
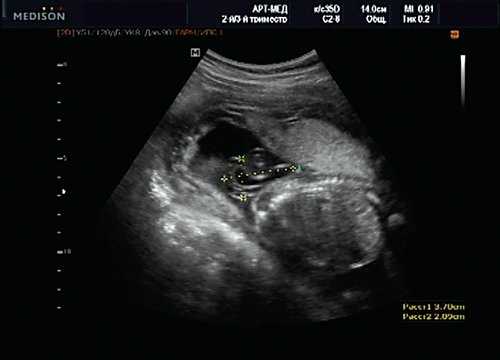
Рис. 16. Беременность 20 нед. Менингоцеле размером 37х21 мм.
Клиническое наблюдение 3
Беременная 27 лет, обратилась в клинику в 18 нед. При эхографии обнаружен синдром Арнольда - Киари II, умеренно выраженная гидроцефалия (рис. 17).
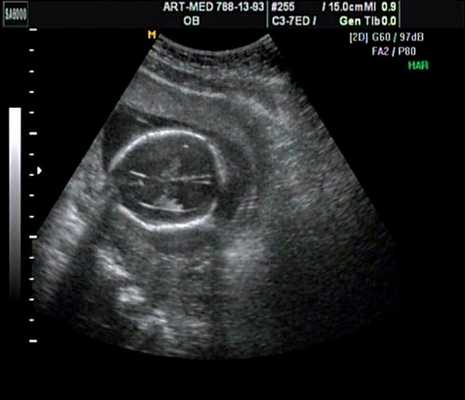
Рис. 17. Беременность 18 нед. Гидроцефалия.
В крестцовом отделе позвоночника выявлена spina bifida cysticа (рис. 18).
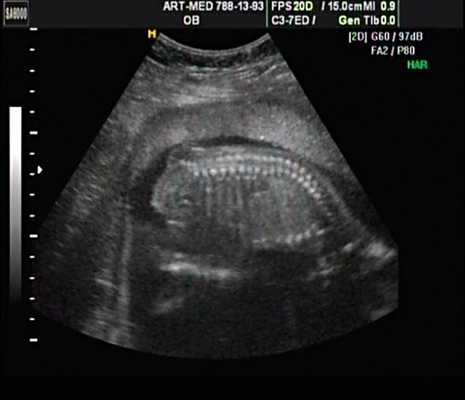
Рис. 18. Беременность 18 нед. Spina bifida в крестцовом отделе.
Женщиной принято решение о прерывании беременности.
Клиническое наблюдение 4
Беременная 25 лет, обратилась в клинику в срок 18 нед. При эхографии выявлена грубая кифотическая деформация позвоночника в поясничном отделе (рис. 19).
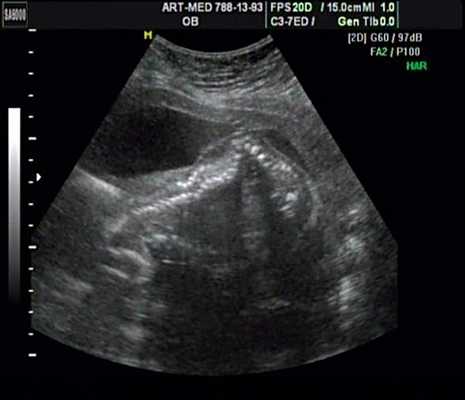
Рис. 19. Деформация позвоночника.
В проекции деформации определяется миеломенингоцеле (рис. 20).
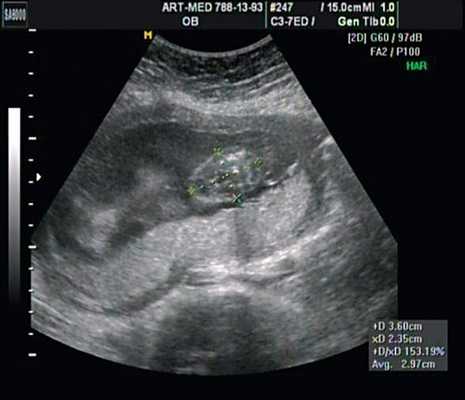
Рис. 20. Миеломенингоцеле.
Обнаружение типичных эхографических признаков позволило установить диагноз миеломенингоцеле.
Заключение
Диагностика открытых форм spina bifida не является трудной задачей во II триместре беременности. Обнаружение таких изменений, как синдром Арнольда - Киари II и дефект позвоночника с формированием грыжевого выпячивания не оставляют сомнений в диагнозе. Исключение составляют лишь те случаи, когда ультразвуковая манифестация порока представлена только деформацией позвоночника. В настоящее время наибольший интерес представляет выявление данного порока в I триместре беременности. Изучаются такие ультразвуковые критерии, как отсутствие интракраниальной "прозрачности" (intracranial translucency), сглаженность угла ствола мозга, уменьшение бипариетального размера ниже 5-го процентиля и т.д. Таким образом, диагностика spina bifida остается важной задачей пренатальной диагностики.
Литература
- Amari F., Junkers W., Djalali S., Hartge D.R. et al. Fetal spina bifida - prenatal course and outcome in 103 cases // J. Ultrasound in Obstetrics & Gynecology. 2009. N 34. P. 82.
- Pugash D., Irwin B., Lim K., Thiessen P., Poskitt K., Cochrane D. Prenatal diagnosis of closed spinal dysraphism // J Ultrasound in Obstetrics & Gynecology. 2006. N 28. P. 547.
- Tortori-Donati P., Rossi A., Cama A. Spinal dys-raphism: a review of neuroradiological features with embryological correlations and proposal for a new classification // Neuroradiology. 2000. N 42. P. 471-491.
- Van den Hof M.C., Nicolaides K.H., Campbell J., Campbell S. Evaluation of the lemon and banana signs in one hundred thirty fetuses with open spina bifida // Am J Obstet Gynecol. 1990. N 162. P. 322-327.
- Ghi T., Pilu G., Falco P., Segata M., Carletti A., Cocchi G., Santini D., Bonasoni P., Tani G., Rizzo N. Prenatal diagnosis of open and closed spina bifida.Ultrasound Obstet Gynecol. 2006. N. 28. P. 899-903.
- D'Addario V., Rossi A.C., Pinto V., Pintucci A., Di Cagno L. Comparison of six sonographic signs in the prenatal diagnosis of spina bifida // J Perinat Med. 2008. N 36. P. 330-334.
УЗИ сканер HS70
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Читайте также:
