УЗИ, МРТ при атрофии эндометрия матки
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
Московский областной НИИ акушерства и гинекологии
Гиперплазия эндометрия в пери- и постменопаузе
Журнал: Российский вестник акушера-гинеколога. 2020;20(3): 35‑40
Большая клиническая значимость гиперпластических процессов в эндометрии заключается в том, что они являются одной из самых распространенных причин маточных кровотечений у женщин в возрасте 45—55 лет и их госпитализации в стационар. Гиперплазия эндометрия, особенно с атипией, является значительной клинической проблемой, поскольку может предшествовать раку эндометрия. За последние несколько лет оценка состояния эндометрия изменилась в признании того, что патология эндометрия не всегда носит глобальный характер. Толщина эндометрия не может быть единственным признаком гиперплазии эндометрия.
Введение
Гиперпластические процессы в эндометрии представляют большую медико-биологическую и социально-экономическую проблему и занимают значительное место в структуре гинекологической заболеваемости [1—6]. Высокая распространенность гиперпластических процессов в эндометрии, отсутствие должной эффективности от гормональной терапии, а также вероятность озлокачествления ставят гиперплазию эндометрия (ГЭ) в ряд наиболее актуальных проблем современной медицины. По данным Е.М. Вихляевой, гиперплазией эндометрия страдают почти 50% женщин позднего репродуктивного возраста и в период перименопаузы [7].
Большая клиническая значимость гиперпластических процессов в эндометрии заключается в том, что они являются одной из наиболее частых причин маточных кровотечений у женщин в возрасте 45—55 лет и их госпитализации в стационар [8—12]. Другая причина пристального внимания к ГЭ — это возможность их злокачественной трансформации. По данным статистики РФ, рак эндометрия (РЭ) занимает 3-е место в структуре онкологической заболеваемости женского населения [13, 14]. Малигнизация железистой гиперплазии и полипа эндометрия встречается в 2—5% и достигает 10% в постменопаузе [15—17]. Атипическая гиперплазия прогрессирует в инвазивный рак с частотой до 50% наблюдений [18, 19]. Однако, по данным разных авторов, РЭ по результатам гистологического исследования подтверждается у 1—10% женщин, имеющих кровотечение в постменопаузе. Практически в 60% наблюдений выявляется атрофия эндометрия и примерно с одинаковой частотой — полипы эндометрия, ГЭ и другие доброкачественные изменения эндометрия [20, 21]. Таким образом, в большинстве случаев причиной кровотечений в постменопаузе служат изменения эндометрия доброкачественного характера.
Факторами риска развития РЭ являются пожилой возраст пациенток (старше 50 лет), ожирение, поздняя менопауза, сахарный диабет, длительная эстрогеновая стимуляция, прием тамоксифена [22, 23].
При ожирении и индексе массы тела (ИМТ) более 25 кг/м 2 повышается риск развития РЭ на 200—400% [24]. Так как более 50% женщин в постменопаузе имеют избыточную массу тела, необходима онконастороженность в данной возрастной группе.
Диагностика патологии эндометрия
В скрининговой диагностике патологии эндометрия наиболее информативным неинвазивным методом обследования является лучевой — ультразвуковое исследование (УЗИ) — неинвазивный, легко выполнимый и высокоинформативный метод обследования больных для выявления количественных и качественных характеристик всех слоев эндометрия с оценкой их кровоснабжения, что позволяет современная аппаратура [25, 26]. Методами лучевой диагностики, в отсутствие клинических проявлений заболевания, могут выявляться различные признаки диффузных (гиперплазия) или очаговых (полипы) изменений эндометрия [27, 28].
В настоящее время согласно клиническим рекомендациям Министерства здравоохранения РФ [29] и международным протоколам [30] за верхнюю границу нормы толщины М-эха принимают 4 мм. Если она ниже этой границы, то вероятность РЭ составляет менее 1% [31—34], в таких случаях биопсия эндометрия не требуется. В ряде случаев увеличение толщины эндометрия по данным УЗИ выявляется у женщин в постменопаузе в отсутствие симптомов заболевания. Однако тактика ведения в таких случаях окончательно не определена. Последнее обстоятельство особенно важно, поскольку в настоящее время среди исследователей прочно укоренилось мнение, что толщина эндометрия является ведущим признаком гиперплазии [35]. Однако в литературе появляются данные о необходимости изменения ультразвуковых критериев толщины эндометрия для определения дальнейшей тактики ведения женщин в отсутствие клинических проявлений в постменопаузе, так как выбор метода лечения и его применение порой ограничены из-за сопутствующей соматической патологии больных. Особые трудности возникают при лечении больных с ГЭ старше 60 лет ввиду высокого риска развития осложнений при оперативном вмешательстве и применении анестезиологического пособия. Поэтому необходимо разграничить группы пациенток с утолщенным эндометрием (по УЗИ в отсутствие клинических проявлений), которым обязательно должны проводиться дальнейшая диагностика и лечение, и группы пациенток, которые могут находиться под динамическим наблюдением (без риска развития РЭ) в связи с возрастом, наличием соматической патологии или нежеланием (отказом) пациентки от дальнейшего лечения (диагностического обследования).
Современные данные литературы о дифференциальной диагностике и тактике ведения женщин в пери- и постменопаузе с патологией эндометрия
В исследовании A. Lev-Sagie и соавт. [36] под наблюдением находились 82 женщины в постменопаузе со случайно выявленным при УЗИ утолщением эндометрия, всем выполнена гистероскопия с выскабливанием стенок полости матки. По результатам гистологического исследования, у 67 (82%) пациенток выявлены неактивные полипы, у 7 — субмукозные узлы, у 6 — атрофия эндометрия, у 1 — простая гиперплазия, еще у 1 — полип с простой гиперплазией. Ни одного случая сложной гиперплазии или РЭ не было. При этом частота развития осложнений оперативного вмешательства составила 3,6%: 2 перфорации матки, 1 осложнение интубации.
R. Ozelci и соавт. [37] проанализировали истории болезни 266 женщин в постменопаузе, которым были выполнены гистероскопия и биопсия эндометрия. В исследование были включены пациентки с отсутствим симптомов, у которых, по данным трансвагинального ультразвукового исследования (ТВУИ), толщина эндометрия равна или превышает 6 мм. По результатам гистологического исследования, наиболее часто выявляемыми очаговыми поражениями у пациенток в отсутствие симптоматики были полипы эндометрия, диагностированные в 168 (63,1%) наблюдениях. У 24 (9%) пациенток была диагностирована простая гиперплазия, у 4 (1%) — атипичная гиперплазия и у 8 (3%) — аденокарцинома эндометрия. По мнению авторов обзора, при толщине эндометрия ≥10,5 мм рекомендованы гистероскопия и кюретаж стенок полости матки.
Другие исследователи [38] провели ретроспективный анализ (с января 2006 г. по январь 2017 г.) медицинских карт 488 женщин в постменопаузе, не имевших клинических проявлений, у которых при ТВУИ выявили эндометрий толщиной ≥5 мм и провели гистероскопию с последующей биопсией эндометрия. Наиболее частыми патологическими находками были полипы (51,0%) и нормальный эндометрий (34,2%). У 15 (3,1%) и 10 (2,0%) больных имелась интраэпителиальная неоплазия и карцинома соответственно. Однако пациентки с карциномой обладали более толстым эндометрием, в котором чаще определялся кровоток при цветовом допплеровском картировании (ЦДК). В исследовании отмечено, что при злокачественных новообразованиях толщина эндометрия была ≥12 мм, и при ЦДК определялись локусы кровотока в эндометрии.
J. Alcázar и соавт. [39] изучили результаты исследований, опубликованных в период с января 1990 г. по декабрь 2016 г., и оценили корреляцию между толщиной эндометрия, измеренной с помощью ТВУИ, и гистологическими находками у женщин, не имевших клинических проявлений в постменопаузе. Научные работы, включавшие исследования у пациенток, которые принимали заместительную гормональную терапию, тамоксифен или ингибиторы ароматазы, были исключены. Было выявлено 289 исследований, и оценены данные по 4751 женщине. Распространенность РЭ или ГЭ с атипией составила 2,4%. В результате исследователи пришли к выводу, что риск развития РЭ или ГЭ с атипией был в 2,6 раза выше у женщин с толщиной эндометрия ≥11 мм в отличие от такового у женщин с толщиной эндометрия 5—10 мм, хотя имелись значительные расхождения в разных исследованиях.
A. Ghoubara и соавт. в своем исследовании [40] также пришли к выводу, что использование порога толщины эндометрия ≥10 мм у женщин без клинических симптомов позволяет не упустить ни одного случая атипичной ГЭ или РЭ.
Целью исследования M. Louie и соавт. [41] было уточнение частоты внутриматочной патологии у 462 женщин с бессимтомно протекающей постменопаузой, не имевших клинических ее проявлений, и обеспечение оптимального порога для взятия у них биоптата эндометрия. В исследование включали женщин без симптомов заболевания эндометрия, если при ТВУИ у них была выявлена толщина эндометрия выше 4 мм.
Среди 462 женщин карцинома была выявлена у 9 (1,9%), атипичная гиперплазия — у 7 (1,5%). Толщина эндометрия, равная или превышающая 14 мм, достоверно ассоциировалась с типичной гиперплазией (отношение шансов — ОШ 4,29; 95% доверительный интервал — ДИ 1,30—14,20; p=0,02), с отрицательным прогностическим значением 98,3%. Толщина более 15 мм была ассоциирована с карциномой (ОШ — 4,53; 95% ДИ — 1,20—17,20; p=0,03), с прогностической значимостью отрицательного результата теста 98,5% и риском развития рака 0,06%. Таким образом, исследователи пришли к выводу, что случайно обнаруженное утолщение эндометрия менее 15 мм не может служить основанием для взятия биопсии эндометрия у женщин в постменопаузе, не имеющих вагинального кровотечения.
W. Wolfman и соавт. [42] изучили материалы публикаций, вышедших с 1970 по 2009 г., о результатах обследования женщин в постменопаузе без аномальных маточных кровотечений, у которых при УЗИ обнаружено утолщение эндометрия. При детальной оценке информативности, рисков и стоимости диагностического выскабливания авторы пришли к выводу, что применение инвазивных методов исследования только на основании увеличения показателя М-эхо является излишней (неоправданной) процедурой.
Однако некоторые исследователи придерживаются другой точки зрения. Целью исследования M. Genc и соавт. [43] было уточнение частоты внутриматочной патологии у 283 женщин в постменопаузе, госпитализированных в гинекологическое отделение для проведения гистерэктомии по причинам, не связанным с патологией эндометрия. По результатам гистологического исследования, у 75,6% из 209 пациенток, не имевших кровотечения в постменопаузе, обнаружена патология полости матки, о которой не подозревали на этапе предоперационной подготовки: ГЭ, полипы, миома матки, аденомиоз — в 1 (0,5%) наблюдение, аденокарциномы. У 87,8% из 74 женщин с кровотечением в постменопаузе обнаружена внутриматочная патология, в том числе 13 (17,6%; p=0,0001) наблюдений РЭ. Таким образом, патология полости матки может иметься и у женщин в постменопаузе, не имеющих симптомов заболевания, поэтому авторы настаивают на ежегодном скрининге и консультировании пациенток пожилого и старческого возраста, не дожидаясь у них эпизода кровотечения.
Л.В. Адамян и соавт. [44] в своем исследовании пациенток без клинических проявлений внутриматочных заболеваний в постменопаузе с подозрением на патологию эндометрия по данным ТВУЗ (толщина эндометрия более 4 мм), чаще всего выявляли полипы эндометрия (63,9%), атрофию эндометрия (30,5%), а частота аденокарциномы составила 2,1%. Авторы исследования акцентируют внимание на том, что риск возникновения злокачественных новообразований достаточно высок, что свидетельствует о важности адекватного обследования и своевременного лечения женщин этой возрастной группы, а также о необходимости скринингового обследования с применением УЗИ.
По данным литературы, у пациенток без клинических проявлений заболевания матки в постменопаузе с утолщеным эндометрием (по данным УЗИ) наиболее часто при гистероскопии и гистологическом исследовании выявляются полипы эндометрия. Однако частота РЭ у женщин с полипами эндометрия составляет 0,3—4,8% [45]. Большинство исследователей настаивают на обращении особого внимания на пациенток в постменопаузе с полипами, проявляющимися маточным кровотечением. Так, E. Ricciardi и соавт. [46] изучали распространенность полипов с атипией у пациенток в постменопаузе. В ретроспективном исследовании проанализированы данные 1027 женщин с полипами эндометрия в пери- и постменопаузе. Доброкачественные полипы выявлены в 95,8% случаев, предраковые — в 2,67% и с атипией — в 1,54% случаев. У женщин в постменопаузе (старше 60 лет) и старческом возрасте риск развития РЭ был выше (ОШ 3,05; 95% ДИ 1,54—6,19; pp≤0,003 соответственно). У пациенток с кровотечением в постменопаузе риск развития РЭ повышался более чем в 30 раз (ОШ 31,1; 95% ДИ 10,3—111; p<0,001). По мнению авторов, на пациенток с кровотечением в постменопаузе следует обращать особое внимание, а женщины без симптомов заболевания в постменопаузе относятся к группе промежуточного риска, поэтому к ним необходим индивидуальный подход.
P. Gambadauro и соавт. [47] при анализе данных 1390 пациенток в постменопаузе с подозрением на полип эндометрия (по данным УЗИ) после гистероскопии установили, что все случаи неоплазии отмечены лишь у пациенток с кровотечением. У 40,6% женщин без кровотечения гистологически подтверждена доброкачественная структура полипа эндометрия. Пациентки, у которых диагностирован РЭ, были значительно старше пациенток с доброкачественной патологией, а также имели более высокий индекс массы тела. По мнению авторов, большое число женщин в постменопаузе без симптомов заболевания с подозрением на полип по данным УЗИ направляют на гистероскопию, хотя риск неоплазии в таких случаях крайне невысок.
E. Ferrazzi и соавт. [48] наблюдали 1152 женщины без симптомов заболевания в постменопаузе, у которых по данным УЗИ и соногистерографии выявлены полипы эндометрия, всем женщинам выполнены гистероскопия и кюретаж стенок полости матки. По данным гистологического исследования, выявлен 1 (менее 0,1%) случай РЭ в полипе диаметром более 4 мм, при этом частота неоплазии была в 10 раз ниже, чем у пациенток с кровотечением. Частота атипических гиперпластических полипов составила 1,2% у пациенток без симптомов заболевания и 2,2% — при наличии кровотечения. Выявлены 3 (0,3%) случая РЭ (не в полипе), которые в ходе гистероскопии визуализировались в виде полипоидных изменений. Риск выявления неоплазии у пациенток без клинических проявлений зависел от диаметра полипа (более 18 мм, ОШ 6,9; 95% ДИ 2,2—21,4 мм). При этом среди осложнений было 3 перфорации, 7 разрывов шейки матки, 3 ложных хода.
Заключение
У пациенток в пери- и постменопаузе патологические процессы в эндометрии протекают чаще всего бессимптомно, однако риск возникновения злокачественных новообразований выше общепопуляционных показателей, особенно при наличии кровотечений и рецидивов патологических процессов в эндометрии. Следует отметить, что диагноз может быть установлен на основании ультразвукового скрининга. При отсутствии единого мнения о рацио- нальных диагностике и наблюдении данного контингента женщин эта проблема требует дальнейшего изучения.
Гиперплазия эндометрия: причины, симптомы, диагностика и лечение
Гиперплазия эндометрия - это диффузное или очаговое избыточное увеличение толщины внутренней оболочки полости матки, которое может стать причиной для маточного кровотечения или нарушения менструального цикла. Заболевание возникает у женщин в детородном возрасте и в период пременопаузы. Частота возникновения гиперплазии эндометрия составляет около 5-6%. Значимость гинекологической проблемы обусловлена следующими факторами:
- гиперпластические процессы эндометрия могут стать основой для злокачественного перерождения;
- обильные менструации приводят к анемии и ослаблению организма женщины;
- гормональные нарушения провоцируют общие эндокринные и метаболические изменения;
- эндометриальная гиперплазия сопутствует гинекологическим болезням - миоме, эндометриозу и кистам яичников;
- гиперплазия эндометрия является одной из болезней, приводящих к репродуктивным потерям и бесплодию.
Предотвратить предраковые изменения эндометрия и создать условия для успешного наступления желанной беременности можно при своевременной диагностике патологии: нерегулярный цикл и увеличение маточного кровотечения является поводом для обращения к врачу. На первом этапе обследования необходимо использовать наиболее простой и доступный метод — ультразвуковое сканирование, которое поможет понять причины менструальных нарушений и обнаружить проблемы в матке. Однако часто бывает так, что только УЗИ недостаточно для установки верного диагноза. В таких случаях врачи рекомендуют пройти магнитно-резонансную томографию органов малого таза для того
Нормальный эндометрий
Внутренняя оболочка матки подчиняется гормональному воздействию яичников, которые работают в циклическом двухфазном режиме. В первой половине цикла происходит нарастание толщины эндометрия, во 2 - изменяется качество эндометриальной ткани, необходимое для возникновения полноценной беременности.
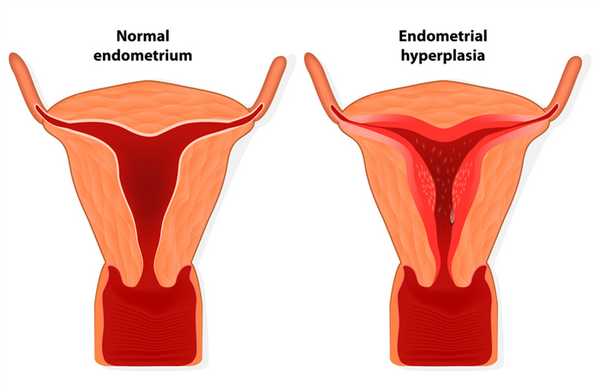
Норма и гиперплазия эндометрия
Критерии нормальной менструации:
- продолжительность цикла — от 21 до 35 дней (в среднем 28);
- длительность месячных — от 2 до 7 суток;
- примерный объем кровопотери - не более 80 мл.
Не считается патологией следующие варианты кровянистых выделений:
- нерегулярные месячные в течение 1,5-2 лет у девочек после первого прихода менструации или у женщин перед климаксом;
- кровомазанье в момент овуляции (овуляторное кровотечение);
- скудные кровянистые выделения через неделю после зачатия (имплантационное кровотечение).
Нормально приходящие месячные - это критерий гормонального и репродуктивного здоровья женщины. Гиперпластический процесс появляется на фоне эндокринного дисбаланса, возникающего по разным причинам, поэтому при любых проблемах с менструациями необходимо обращаться к врачу для обследования и лечения.
Причины появления патологии
Наиболее важным и прогностически опасным причинным фактором является дисбаланс между основными женскими гормонами - эстрогенами и гестагенами. Длительная и монотонная эстрогенная стимуляция эндометрия возникает на фоне следующих состояний:
- отсутствие овуляции (ановуляция);
- персистенция или атрезия фолликула (изменения в яичниках, при которых не выходит яйцеклетка и повышается выработка эстрогена);
- снижение количества прогестерона из-за недостаточности желтого тела.
Большое значение имеют общие и гинекологические заболевания, провоцирующие возникновение патологии в эндометрии:
- метаболический синдром с нарастающим ожирением и высоким артериальным давлением;
- эндокринная патология (болезни щитовидной железы, диабет);
- хроническое воспаление в полости матки (эндометрит);
- интерстициальная миома матки;
- аденомиоз или любой вариант генитального эндометриоза;
- кистозные опухоли яичников;
- длительное бесплодие с безуспешными попытками лечения.
Гиперпластические процессы в полости матки могут привести к раку эндометрия. Подобная ситуация возможна на фоне следующих факторов риска:
- синдром поликистоза яичников (СПКЯ);
- нарушения месячных, которые продолжаются 12 и более лет;
- длительное отсутствие беременностей у женщины при отказе от применения оральных контрацептивов;
- сочетание выраженного ожирения и артериальной гипертензии;
- сахарный диабет.
Злокачественное перерождение гиперплазированных клеток эндометрия при наличии факторов риска возникает в тех случаях, когда вовремя не проводится обследование, и нет никакого лечения. Любой вариант утолщения внутренней оболочки матки требует правильного подхода к диагностике и лечению, что является эффективным методом профилактики онкологической патологии.
Классификация гиперплазии
Гиперпластические процессы эндометрия разделяют на 2 группы:
| Эндометриальная гиперплазия | Полип матки |
| Железистая | Фиброзный |
| Железисто-кистозная | Железистый |
| Атипическая | Железисто-фиброзный |
| Аденоматозный |
Огромное значение для будущего лечение имеет риск злокачественного перерождения: обнаружение атипических клеток в эндометрии является первым признаком онкологической патологии. Любой вариант атипической гиперплазии указывает на высокую вероятность развития рака эндометрия в ближайшее время.
По распространению гиперплазии выделяют:
- очаговое поражение;
- диффузный вариант патологии.
Полип тела матки может рассматриваться, как очаговое утолщение эндометрия или опухолевидное образование внутренней оболочки матки. Аденоматозный полип - это предраковый процесс, требующий хирургического вмешательства.
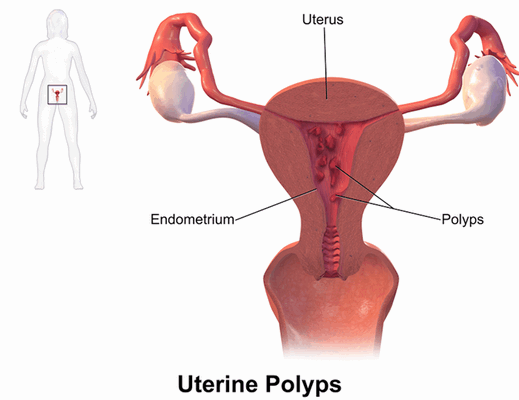
Симптоматика
Основными проявлениями гиперплазии эндометрия будут следующие варианты нарушения менструального цикла:
- обильные регулярные месячные - меноррагии (длительность более 7 дней, кровопотеря больше 80 мл);
- нерегулярные менструации разной степени выраженности — метроррагии (бессистемный приход скудных и обильных критических дней);
- ациклические маточные кровотечения - менометроррагии (обильные нерегулярные месячные);
- кровянистые выделения после интимной близости - посткоитальные кровотечения;
- выделения крови из влагалища в климаксе - постменопаузальные кровотечения.

Эндометриальный полип может стать причиной для обильных и длительных месячных. Редким симптомом является спастическая боль, связанная с сокращениями матки на фоне доброкачественного новообразования в полости органа. Важный признак гиперпластического процесса - бесплодие или невынашивание беременности. Именно внутренние изменения в полости матки становятся существенным фактором неудачной беременности или неспособности зачать малыша. Поэтому всем женщинам с репродуктивными проблемами необходимо оценить состояние матки и выявить причину бесплодия.
Диагностика
Первый этап - трансвагинальное ультразвуковое сканирование. Врач будет оценивать толщину эндометрия и соответствие структурных изменений фазе менструального цикла. УЗ критерии гиперплазии эндометрия:
- утолщение эндометрия в 1 фазе более 9 мм;
- величина внутренней оболочки во 2 фазе выше 16 мм;
- толщина эндометрия в климаксе более 5 мм;
- изменение контуров эндометрия (многослойность, обнаружение кистозных включений).
УЗ критерии эндометриального полипа:
- обнаружение новообразования в полости, которое изолировано от стенки матки;
- расширенная маточная полость;
- выявление специфических ультразвуковых эффектов - эхонегативный ободок вокруг образования, акустическая тень;
- обнаружение при ультразвуковой допплерометрии кровеносных сосудов, питающих полип.
Если при УЗИ врач сомневается или по каким-либо причинам не может точно оценить состояние эндометрия, то оптимальным выходом станет проведение МРТ исследования.
На 2 этапе обследования необходимо подтвердить диагноз гистологическим заключением. Для этого надо сделать гистероскопию: эндоскопический осмотр полости матки поможет визуально оценить состояние эндометрия и взять прицельно небольшую часть ткани для биопсии. Гистология является единственным достоверным методом исключить рак эндометрия и подтвердить гиперпластический процесс эндометрия. Полип матки при гистероскопии врач удалит и отправит на гистологическое исследование.
МРТ при гиперплазии эндометрия
При простой неосложненной гиперплазии эндометрия вполне достаточно сделать ультразвуковое исследование. Магнитно-резонансная томография показана в следующих случаях:
- подозрение на гиперпластический процесс у женщин с лейомиомой матки, требующей оперативного лечения;
- сочетанная гинекологическая патология, когда имеется эндометриоз, кистозная опухоль в яичниках и гиперплазия эндометрия;
- исследование матки при синдроме поликистоза яичников;
- высокий риск рака эндометрия;
- маточное кровотечение у женщин в климактерическом возрасте.
МРТ при гиперплазии
С помощью МРТ можно быстро оценить толщину и состояние эндометрия. Безопасность, информативность и точность МР диагностики поможет врачу выбрать оптимальный метод лечения патологии. На нашем сайте можно по телефону или онлайн записаться на МРТ, сделать исследование в удобное время и в ближайшей клинике, получив в кратчайшие сроки точный диагноз.
Лечение
Терапия гиперплазии эндометрия проводится после получения гистологического результата. Возможны 2 варианта лечения:
- медикаментозный;
- хирургический.
- Консервативная терапия
Основная цель медикаментозной терапии - предотвратить очередное маточное кровотечение и восстановить менструальный цикл. Для женщин, мечтающих о рождении ребенка, важными факторами лечения являются нормальные менструации и наличие овуляции. Восстановление гормонального баланса достигается применением следующих препаратов:
- гестагенов;
- комбинированных гормональных контрацептивов.

Медикаментозное лечение гиперплазии
Схему терапии врач подбирает индивидуально, учитывая возраст, гормональный фон, вид гиперплазии, результат гистологического исследования и желание женщины родить малыша. Применять народные методы в составе комплексной терапии можно только после консультации у врача.
Маточное кровотечение, возникшее на фоне гиперплазии эндометрия, надо остановить с помощью удаления избыточного эндометрия. Чаще всего выполняется операция по выскабливанию маточной полости. Оптимальными вариантами могут стать современные методики — лазерная и электрохирургическая аблация эндометрия. При подтверждении предраковых изменений или выявлении рака необходимо удалить матку (гистерэктомия).

Последствия
Любой вариант гиперпластического процесса в полости матки угрожает женщине следующими неприятными последствиями:
- постоянные маточные кровотечения приводят к выраженной анемии, ухудшают общее состояние и снижают иммунную защиту;
- желанное зачатие на фоне гиперплазии эндометрия может стать причиной замершей беременности или самопроизвольного выкидыша;
- полип тела матки является важным фактором бесплодия;
- гиперпластический процесс эндометрия — это фон для злокачественной опухоли матки, что особенно актуально у женщин в климаксе.
Возрастные особенности терапии
Важный критерий выбора метода лечения - возраст женщины.
| Период | Особенности терапии |
| Репродуктивный | Предпочтение отдается медикаментозным методикам, которые позволяют сохранить менструальную и детородную функцию. Даже при атипической гиперплазии начинать надо с гормонотерапии. |
| Пременопаузальный | При выявлении гиперплазии эндометрия без онкологического риска можно применять консервативный метод. Если обнаружена атипическая форма или аденоматозный полип необходимо удалить матку. |
| Постменопаузальный | Любой вариант гиперплазии при отсутствии менструальной функции - это показание для гистерэктомии, потому что эта ситуация может привести к раку матки. |

Гиперплазия в климаксе
Гиперплазия и беременность
При правильном подходе к терапии гиперпластических процессов у молодых женщин шансы на успешное зачатие и удачное вынашивание плода очень высоки. После полного обследования, включающего УЗИ, МРТ и гистероскопию, врач при простых вариантах эндометриальной гиперплазии назначит лечение, обеспечивающее 2 эффекта:
- восстановление гормонального баланса;
- создание условий для зачатия.
При полипе матки потребуется предварительно удалить доброкачественное образование из полости, чтобы затем начать терапию. После наступления беременности врач назначит сохраняющее лечение, которое поможет женщине выносить и вовремя родить здорового малыша.

Беременность после гиперплазии
В послеродовом периоде нельзя отказываться от кормления грудью, стараясь максимально долго сохранить лактацию. С приходом первой менструации после родов необходимо продолжить наблюдение у врача, чтобы своевременно выявить первые признаки гиперплазии.
Особенности ультразвуковой картины органов репродуктивной системы у женщин в постменопаузальном периоде
Постменопаузальный период начинается с момента стойкого прекращения менструальной функции, которое в среднем наступает в возрасте 50,8 лет и длится до смерти женщины. Данный период жизни женщины характеризуется прогрессированием инволютивных
Постменопаузальный период начинается с момента стойкого прекращения менструальной функции, которое в среднем наступает в возрасте 50,8 лет и длится до смерти женщины. Данный период жизни женщины характеризуется прогрессированием инволютивных процессов: во всех органах репродуктивной системы происходят атрофические изменения, которые и обуславливают специфику ультразвуковой картины органов малого таза.
В постменопаузальном периоде отмечается уменьшение массы матки. Уменьшение размеров матки наиболее интенсивно протекает в первый год менопаузы. За это время матка уменьшается в длину и ширину на 1 см, переднезадний размер — на 0,5 см. Средние колебания размеров матки у здоровой женщины в зависимости от длительности менопаузы представлены в таблице.
Вторая важная эхоморфологическая характеристика матки в постменопаузе — изменение эхоструктуры миометрия. При ультразвуковом исследовании визуализируется неоднородная эхоструктура миометрия за счет точечных или линейных гиперэхогенных включений (рис. 1). Данные изменения УЗИ-картины обусловлены процессами инволюции: атрофией дифференцированных тканей с последующей заменой соединительной тканью.
При физиологическом течении постменопаузального периода толщина эндометрия при ультразвуковом исследовании в среднем составляет 3,1 мм. По мнению большинства специалистов, толщина М-эхо в постменопаузе не должна превышать 5 мм. При УЗИ у большинства женщин в постменопаузе М-эхо визуализируется в виде тонкой гиперэхогенной полоски толщиной 0,1-0,2 см (рис. 2).
В отдельных наблюдениях у здоровых женщин в постменопаузе можно визуализировать расширенную полость матки до 0,2-1 см. Согласно мнению Schresel P., данное наблюдение обусловлено функциональной окклюзией цервикального канала и скоплением серозной жидкости. Это подтверждается тем, что периодически происходит частичное или полное опорожнение серозометры (рис. 3). Измерение толщины эндометрия заслуживает особого внимания у женщин в постменопаузе, поскольку именно в этот период наиболее часто встречается рак эндометрия (по данным Бохмана Я. В., пик заболевания раком матки приходится на 59 лет, и только в 16% случаев он встречается в репродуктивном возрасте).
Яичники в постменопаузе постепенно уменьшаются в размерах за счет развития соединительной ткани. Объем яичников в постменопаузальный период составляет в среднем 3 см 3 , после пяти лет менопаузы — около 2,5 см 3 , свыше 10 лет — около 1,5 см 3 (объем яичников у женщин репродуктивного возраста равен 8,2 см 3 ). Следует подчеркнуть, что выявление у женщин в постменопаузе яичников объемом более 5 см 3 является признаком патологии. Разница в объеме правого и левого яичника не должна превышать 1,5 см 3 . Во время УЗИ необходимо обращать внимание на асимметричное увеличение одного из яичников более чем в два раза, так как в постменопаузе это является одним из признаков малигнизации. В связи с постепенным угасанием гормональной функции яичников наличие единичных маленьких фолликулов в течение первых пяти лет менопаузы не должно расцениваться как патологический процесс. После пяти лет менопаузы фолликулы не выявляются, а их персистенция должна вызывать определенную настороженность.
Методом выбора для проведения УЗИ органов малого таза в постменопаузе является трансвагинальное сканирование. Используя только трансабдоминальный доступ обследования, нельзя достоверно оценить толщину и эхоструктуру эндометрия, к тому же на 30-50% снижается возможность визуализации постменопаузальных яичников.
При трансвагинальном исследовании частота визуализации уменьшенных яичников может достигать 80-90%, а если это же исследование проводить при частично наполненном мочевом пузыре, то точность выявления яичников возрастает до 93,5%. Актуальность вопроса о выявлении яичников при УЗИ определяется тем, что у женщин старше 40 лет возрастает частота возникновения рака яичников.
Врач УЗ-диагностики, проводящий обследование женщин в постменопаузе, должен понимать важность правильной интерпретации выявленных изменений и четко различать, какие особенности ультразвуковой картины относятся к физиологическим процессам, а какие к патологическим.
Диагностическая и лечебная тактика у пациенток с патологией эндометрия в периоде перименопаузы
Какие методы исследования применяются на первом диагностическом этапе при обследовании женщин с отягощенным онкоанамнезом в перименопаузе? Какие дополнительные методы исследования можно применять для уточнения диагноза? Рисунок 1. Железиста
Какие методы исследования применяются на первом диагностическом этапе при обследовании женщин с отягощенным онкоанамнезом в перименопаузе?
Какие дополнительные методы исследования можно применять для уточнения диагноза?
| Рисунок 1. Железистая гиперплазия эндометрия климактерического периода (трансабдоминальное сканирование) |
На современном уровне развития медицинской науки удается регистрировать самые незначительные отклонения в «нормальном» течении данного процесса с позиции обнаружения патологических изменений, требующих своевременной медицинской коррекции для профилактики предшественников и рака эндометрия.
До сегодняшнего дня в гинекологии не удается радикально изменить онкоэпидемиологическую ситуацию и разработать стратегию, которая позволила бы решить проблему ранней диагностики и эффективного лечения рака эндометрия — опухоли, уносящей ежегодно более 5 тыс. жизней. При этом нельзя не отметить, что вопросы ранней диагностики рака эндометрия в менопаузе решаются достаточно эффективно ввиду разработки и внедрения оптимального алгоритма диагностического исследования.
Между тем возникновение патологических состояний эндометрия начинается задолго до наступления менопаузы, чему предшествует не только широкий спектр доброкачественных заболеваний органов женской половой системы, но и определенный, наследуемый по родительской линии генетический фон, что в совокупности позволяет создать диагностический алгоритм раннего обнаружения предшественников и начального рака эндометрия.
Период перименопаузы остается еще недостаточно изученным по совокупности оценки нейрогуморальных процессов, происходящих в организме женщины и проявляющихся в органах-мишенях, одним из которых является матка и собственно эндометрий.
Нельзя не отметить, что различные аспекты проблемы перименопаузального периода постоянно находятся в зоне повышенного внимания онкологов. Это касается и вопросов выяснения причин аномальных маточных кровотечений этого периода, изучения состояния эндометрия с помощью современных диагностических методов — УЗИ, гистероскопии, МРТ и морфологического исследования, а также определения терапевтической тактики при сопутствующих перименопаузе симптомах и заболеваниях, включая тонкие методы генного анализа и др.
Поэтому важно формирование индивидуализированной концепции клинического подхода к признакам патологических состояний этого периода, и в частности аномальных маточных кровотечений, доминирующими причинами развития которых являются гиперпластические процессы и рак эндометрия.
Диагностическое выскабливание, традиционно выполняемое при аномальных маточных кровотечениях, оказывается малоэффективным в диагностике начальных форм рака эндометрия, провоцирует развитие внутреннего эндометриоза, миомы матки, усугубляя и осложняя их течение, что экономически обременительно для гинекологических стационаров.
Вместе с тем практически повсеместное назначение гормонотерапии при гиперпластических процессах, сопровождающихся аномальными маточными кровотечениями, в свою очередь не всегда оправданно, так как существенно повышает стоимость лечения и может оказывать отрицательное влияние на психосоматическое состояние больных, обострять течение хронических заболеваний органов сердечно-сосудистой системы и свертывающей системы крови.
Поэтому сегодня необходимо совершенствование традиционных подходов к диагностике и лечению больных с гиперпластическими процессами эндометрия в перименопаузальном периоде, сопровождающимися аномальными маточными кровотечениями, в строгом соответствии с возрастными характеристиками обследуемых и учетом факторов риска.
Научное рассмотрение данной проблемы, в частности, стало возможным благодаря привлечению современных подходов к оценке реальной клинической ситуации с использованием возможностей компьютерного анкетирования, трансабдоминальной/трансвагинальной сонографии, цветного доплеровского картирования, гистероскопии с прицельной биопсией и морфологического изучения картины эндометрия в периоде перименопаузы в сочетании с анализом результатов остеоденситометрии.
На основе привлеченного клинического материала, обобщающего наблюдения за 392 женщинами в возрасте 45-55 лет в перименопаузальном периоде, нами изучены признаки, характеризующие состояние эндометрия в перименопаузальном периоде в сочетании с оценкой показателей минеральной плотности костной ткани.
Рассматривая ультразвуковое исследование основным, неинвазивным и безвредным, что позволяет применять метод многократно, исследовали объем и качество диагностической информации, предоставляемой с его помощью у женщин перименопаузального периода. При проведении этих работ были выявлены следующие моменты, касающиеся больных с клиникой аномальных маточных кровотечений.
1. Традиционное трансабдоминальное сканирование должно являться первым диагностическим этапом при появлении каких-либо симптомов в течение перименопаузального периода и обязательным для пациенток данной возрастной группы (45-55 лет), особенно при наличии положительных онкоанамнестических данных.
Этот метод позволил установить без диагностического выскабливания подслизистую миому (27,6%), внутренний эндометриоз (9,2%) и в сочетании с аспирационной биопсией — атрофию эндометрия (36,2%), а также осуществлять динамическое наблюдение за больными в рамках диагностического центра.
2. Стойкое увеличение размеров срединных маточных структур (М-эхо) более 7 мм с эхографическими признаками нечеткости М-эхо (появление гиперэхогенных структур и утрата визуализируемой границы эндометрий — миометрий) у 19,3% обследованных потребовало подключения уточняющих современных ультразвуковых технологий — трансвагинального УЗИ, доплеровского цветного картирования. Это позволило уточнить размеры и структуру эндометрия, обнаружить наличие полипов эндометрия (14,3%), а также зон эндометрия, наиболее подозрительных с позиции пролиферативных процессов, не свойственных данному периоду жизни женщины, — атипическая гиперплазия — у 3%, рак эндометрия — у 2% обследованных.
Эффективность трансабдоминального УЗИ в перименопаузальном периоде составила по критерию точности 82,5%, чувствительности — 78,4% и специфичности — 87,3%. Эти показатели выявили целесообразность использования примерно у 15% больных перименопаузального периода возможностей трансвагинального и доплеровского УЗИ, подтвердивших, что размеры М-эхо, устойчиво определяемые при динамическом УЗИ в перименопаузе 6-8 мм с утратой четкости контура эндометрий/миометрий свидетельствуют о вероятности злокачественной трансформации, что особенно согласуется с динамическим снижением индекса резистентности с 0,6-0,8 до 0,4-0,5 при доплеровском сканировании.
По данным морфологического исследования, причинами кровотечений в перименопаузальном периоде была и атрофия эндометрия — 5,1%, и полипоз эндометрия — 14,3%, а в части случаев — рак эндометрия — 2%. Однако у большинства больных имели место гиперпластические процессы эндометрия, среди которых потенциальная опасность, по нашим данным, связана с морфологическими признаками эстрогенной стимуляции — 98 (25%) обследованных. Наличие повышенной минеральной плотности костной ткани у таких больных (7,4% из числа обследованных) явилось одной из причин их включения в группу риска по онкопатологии эндометрия.
Таким образом, для периода перименопаузы характерны следующие признаки состояния эндометрия:
- по данным УЗИ, при нормальном течении перименопаузы М-эхо имеет размеры в диапазоне 4-7 мм, однородную структуру и четкие границы «эндометрий/миометрий» в поперечной и продольной плоскости;
- стойкое увеличение размеров М-эхо свыше 7-8 мм при динамическом контроле с прослеживаемой гетерогенностью и утратой четкости границы в сочетании с морфологической картиной прогрессирующей гиперплазии эндометрия без признаков наступления атрофических изменений требует прицельной биопсии эндометрия для исключения злокачественной трансформации;
- появление при цветном доплеровском картировании зон гиперваскуляризации с тенденцией к снижению индекса резистентности с 0,8 до 0,5-0,4 является неблагоприятным показателем состояния эндометрия и свидетельствует о возникновении атипической гиперплазии эндометрия (иногда начального рака эндометрия).
Морфологические признаки атипической гиперплазии, обнаруживающиеся в процессе мониторинга при длительном приеме прогестагенов, также свидетельствуют о персистенции патологического процесса, особенно в конце перименопаузального периода.
На основе анализа полученных данных были разработаны индивидуальные диагностические маршруты, позволившие с привлечением соответствующих современных методов исследования уточнить состояние эндометрия у каждой конкретной больной на основе принципов функционально щадящего лечения, исключив применение инвазивных и агрессивных методик при отсутствии объективных медицинских показаний к их использованию.
Интерпретация полученных нами клинико-диагностических данных дала возможность распределить всех обследуемых в перименопаузе пациенток, как обращающихся впервые, так и направленных специалистами других областей, на три самостоятельных потока:
1. Благоприятный анамнез и показатели УЗИ, морфологического исследования аспирата и минеральной плотности костной ткани (М-эхо менее 7 мм, четкие границы; морфология аспирата — атрофия, гиперплазия эндометрия с децидуоподобной реакцией; нормальная или сниженная минеральная плотность костной ткани) ограничивают объем диагностических мероприятий ежегодным трансабдоминальным УЗ-контролем;
2. У женщин до 50 лет с благоприятным онкоанамнезом и показателями трансабдоминального и трасвагинального УЗИ и денситометрии (остеопения, остеопороз, норма) с морфологически верифицированной железистой, железисто-кистозной гиперплазией эндометрия с/без микрофокусов атипической гиперплазии эндометрия в начале перименопаузального периода возможно консервативное ведение с УЗ-контролем в условиях цветного доплеровского картирования с гистероскопией и прицельной биопсией эндометрия;
3. УЗ-признаки увеличения М-эхо с появлением его гетерогенности, снижением индекса резистентности менее 0,5 и атипической гиперваскуляризацией в сочетании с морфологической картиной атипической гиперплазии 2-3-й степени и повышением минеральной плотности костной ткани — специальное лечение.
Была разработана индивидуальная терапевтическая тактика для пациенток перименопаузального периода с различными показателями комплексного динамического диагностического исследования:
1. При благоприятном онкоанамнезе, УЗ-признаках нормального течения перименопаузы или атрофии эндометрия специальное лечение не показано;
2. УЗ-признаки симптомной миомы матки и симптомного внутреннего эндометриоза (неэффективное гормональное лечение) не требуют диагностического выскабливания, а состояние эндометрия оценивают по результатам аспирационной биопсии (по показаниям после гистероскопии) — хирургическое лечение в гинекологическом стационаре;
3. УЗ-признаки гиперплазии эндометрия у больных моложе 50 лет при благоприятном онкоанамнезе и морфологической картине железистой гиперплазии с фокусами атипической гиперплазии 1-й степени и индексом резистентности более 0,5 позволили на I этапе, после терапевтической аблации эндометрия, ограничиться гормонотерапией прогестагенами и ультразвуковым контролем каждые три месяца в условиях диагностического центра;
4. Ультразвуковые морфологические признаки прогрессирующей атипической гиперплазии эндометрия перименопаузального периода требуют хирургического лечения в специализированном стационаре.
Таким образом, данная стратегия позволяет повысить эффективность обнаружения доброкачественных и злокачественных заболеваний эндометрия с обоснованным привлечением современных диагностических методов, а также индивидуализировать тактику ведения женщин перименопаузального периода с патологическими процессами эндометрия.
Современные методы лечения хронического эндометрита (обзор литературы)
Хронический эндометрит встречается у женщин преимущественно в репродуктивном возрасте и ведет к нарушению менструальной, секреторной и генеративной функций. На сегодняшний день продолжается активный поиск оптимального и эффективного комплекса мероприятий
Chronic endometritis is common among women in their reproductive age and leads to malfunction of menstrual, secretory and generative function. Currently, active search of optimal and efficient complex of measures for the treatment of this disease is proceeded. All the well-known, including the most modern methods of treatment of chronic endometritis, are presented in this article.
Хронический воспалительный процесс в эндометрии является одной из основных причин невынашивания беременности, бесплодия, неудачных попыток экстракорпорального оплодотворения (ЭКО). Лечение хронического эндометрита представляет собой достаточно сложную, но очень важную задачу, особенно у женщин с бесплодием и репродуктивными потерями в анамнезе [1].
Лечение хронического эндометрита — непростая задача. Сложности ведения больных связаны со следующими причинами. Преобладание стертых форм заболевания и отсутствие специфических клинических симптомов. Хроническое воспаление в любой ткани имеет волнообразно-прогрессирующий характер, поэтому при отсутствии адекватного лечения повреждение ткани во времени (за счет каскада вторичных повреждений) всегда имеет нарастающий характер. Сложности идентификации микробных агентов в эндометрии, особенно при вирусной инвазии, приводят к проблеме выбора этиотропных препаратов. В ходе лечения возможна смена ведущего микробного фактора (например, на представителя условно-патогенной микрофлоры). Элиминация повреждающего агента из эндометрия часто не приводит к самовосстановлению ткани, особенно при длительности заболевания более 2 лет, поэтому с целью устранения каскада вторичных повреждений ткани необходимы целенаправленные терапевтические мероприятия. Контроль эффективности лечебных мероприятий на основании динамики клинических симптомов и неинвазивных методов исследования не дает точных представлений о восстановлении рецептивности эндометрия [2].
Таким образом, лечение хронического эндометрита (ХЭ) должно быть комплексным, этиологически и патогенетически обоснованным, поэтапным и базироваться на результатах максимально тщательного и точного обследования состояния эндометрия. Большинство ученых сходятся во мнении о целесообразности проведения комплексной терапии ХЭ в два этапа [3].
Сущность первого этапа заключается в элиминации повреждающего эндометрий микробного фактора и/или снижении активности вирусной инвазии посредством проведения этиотропной терапии антибиотиками широкого спектра действия, анаэробными средствами и/или противовирусными препаратами [4, 5]. При стерильных посевах эндометрия или невозможности проведения микробиологического исследования у пациенток с признаками ХЭ допустимо проведение эмпирической антибактериальной и противовирусной терапии препаратами широкого спектра действия со сменой групп препаратов в течение нескольких курсов в случае необходимости.
Столкнувшись с проблемой лекарственной резистентности и роста числа нежелательных лекарственных реакций, в последние годы возобновился интерес клиницистов во многих странах мира к использованию фагов с лечебной и профилактической целью. Некоторые предлагают вводить в полость матки поливалентный бактериофаг в сочетании с инфракрасным лазером накожно, что позволяет реализовать антимикробный эффект путем специфического направленного действия на большой спектр возможных возбудителей воспалительного процесса в полости матки в отсутствие значительного системного влияния, а также добиться иммуномодулирующего эффекта, улучшить гемодинамику в органах малого таза и стимулировать рецепторную активность эндометрия [6].
Цель второго этапа лечения ХЭ заключается в восстановлении морфофункционального потенциала эндометрия путем устранения результатов вторичных повреждений ткани — коррекции фиброзирующих и склеротических процессов, последствий ишемии, восстановлении гемодинамики и активности рецепторного аппарата эндометрия. Характер терапии ХЭ на данном этапе зависит от морфологического состояния эндометрия и наличия сочетанной гинекологической патологии. Первый аспект сводится к выраженности воспалительной реакции и наличию обширных участков склероза и/или атрофии в эндометрии, что определяется длительностью течения ХЭ и приводит к нарушению рецептивности эндометрия при продолжительности заболевания более 2 лет.
Научно доказаны морфофункциональные изменения эндометрия у всех женщин с неудачными попытками ЭКО в анамнезе. При обнаружении у таковых совпадений в 3 и более локусах системы генов тканевой совместимости (HLA) II класса целесообразным является проведение подготовительных мероприятий с использованием иммуноглобулинотерапии [7].
Второй этап терапии нередко является продолжительным (2-3 мес), но очень важным, так как позволяет добиться завершения воспалительного процесса — регенерации поврежденной слизистой оболочки тела матки. Для этого используют различные варианты метаболической терапии, преформированные физические и бальнеологические факторы, гормональные препараты, иммуномодуляторы 9. Многие авторы отмечают важность включения в данный этап лечения препарата Лонгидаза, что значительно повышает эффективность терапии и купирование клинической симптоматики [11, 12].
Традиционно в комплексной терапии ХЭ применяются физические факторы [13]. Наиболее часто в комплексной терапии ХЭ применяют электроимпульсную терапию, интерференционные токи, переменное магнитное поле низкой частоты, ток надтональной частоты [14]. Подробно изучено применение низкочастотной электроимпульсной терапии при абдоминально-вагинальном расположении электродов, которая позволяет улучшить имплантационный потенциал эндометрия и увеличить частоту наступления беременности у женщин с «тонким» эндометрием в 3,4 раза [15].
Возможно применение низкоинтенсивного импульсного лазерного излучения красного спектра в комплексной терапии хронического эндометрита с помощью аппарата «Матрикс» по оригинальной методике. Данный вид физического воздействия оказывает противовоспалительный, иммунокоррегирующий, вазоактивный эффекты [16].
Задачами физиотерапии при ХЭ являются улучшение гемодинамики органов малого таза, стимуляция функции рецепторов, ускорение процессов регенерации эндометрия, повышение иммунологических свойств.
В литературе имеются данные о высокой эффективности использования экзогенного оксида азота в комплексном лечении хронического эндометрита. Доказано, что NO-терапия нормализует нарушенную микроциркуляцию, снижает микробную обсемененность, активирует фагоцитоз и функцию макрофагов, усиливает рост фибробластов, сосудов. Работой Н. Г. Грищенко доказана эффективность внутривлагалищного введения оксида азота с целью оптимизации подготовки пациенток с ранее безуспешными программами ЭКО на фоне «тонкого» эндометрия [17].
Кроме оксида азота в практической медицине нашло применение газовой смеси (СО2 и N2) в процессе подготовки «тонкого» эндометрия к программе ЭКО. Углекислый газ оказывает сосудорасширяющее действие, которое сопровождается усилением метаболизма и восстановлением рецепторной чувствительности. Азот — один из основных химических элементов биологически активных веществ, необходим для обеспечения дыхания и жизнедеятельности клеток. Методика предусматривает проведение трех орошений в течение первой фазы менструального цикла и демонстрирует положительный эффект в отношении роста эндометрия, достигающего приемлемой величины к моменту переноса эмбриона. Применение метода орошения газовой смесью в период одного менструального цикла у женщин с «тонким» эндометрием позволяет существенно увеличить толщину эндометрия. Данный способ можно рекомендовать для подготовки эндометрия к последующим переносам эмбрионов у пациенток с неуспешными попытками ЭКО, причиной которых было нарушение имплантации, обусловленное «тонким» эндометрием [18].
Зарубежные авторы отмечают высокую эффективность в лечении гипопластичного эндометрия внутриматочным введением гранулоцитарного колониестимулирующего фактора (Г-КСФ), препарата Филграстим 20. Механизм его действия в отношении пролиферации и дифференцировки клеток эндометрия до конца не ясен. По имеющимся на сегодняшний день данным, Г-КСФ повышает концентрацию в эндометрии тромбоцитарного фактора роста эндотелиальных клеток, играющего ключевую роль в стимуляции ангиогенеза [22, 23]. Такая же положительная корреляция наблюдалась при изучении концентраций интегрина альфа-V/бета-3. Как известно, интегрины задействованы во всех стадиях имплантации, наибольшая концентрация интегрина альфа-V/бета-3 совпадает с максимальной рецепторной активностью эндометрия. Данный гликопротеин выделяется железистыми эпителиальными клетками после 19?го дня цикла при открытии окна имплантации. В нескольких работах было показано, что недостаток интегрина альфа-V/бета-3 характерен для женщин с тонким эндометрием и встречается также у пациенток, перенесших многочисленные безуспешные попытки ЭКО [24]. Внутриматочные перфузии Г-КСФ сопровождаются увеличением толщины эндометрия в течение 72 часов после применения, что определяет кратность его введения в первой фазе менструального цикла вплоть до овуляции 26.
Исследованиями М. Malinova и соавт. уставлен положительный эффект на рост эндометрия в циклах ЭКО у бесплодных женщин вагинального или орального приема вазодилятаторов типа силденафила цитрата совместно с кломифеном цитратом [28, 29].
С целью подготовки эндометрия к программе вспомогательных репродуктивных технологий (ВРТ) и преодоления проблемы недостаточной толщины и рецептивности эндометрия в клиниках мира используются разные методики лечения, такие как гистероскопия с адгезиолизисом, эстрогены, агонисты гонадотропин-релизинг-гормона, Аспирин, витамин Е, пентоксифиллин, L-аргинин, β-блокаторы типа атенолола, глюкокортикоиды и дигидроэпиандростендион [30, 31]. Крайне интересны работы последних лет, связанные с применением антагонистов рецепторов окситоцина, индол-3 карбинола и интерферона [32, 33].
Некоторыми авторами с целью увеличения толщины эндометрия при низком уровне сосудисто-эндотелиального фактора роста (СЭРФ) в сыворотке крови предложено в состав комплексной предгестационной подготовки вводить метилпреднизолон в дозировке 8 мг в сутки с 1?го по 25?й день менструального цикла, что ведет к увеличению уровня СЭРФ и соответственно толщины эндометрия [34].
В последние годы широко изучаются возможности клеточной терапии стволовыми клетками в регенеративной медицине. Одними из наиболее перспективных являются мезенхимальные стволовые клетки, происходящие из костного мозга, пуповинной крови, жировой ткани. Описан новый источник таких клеток — менструальная кровь. Среди преимуществ их использования: доступность, неинвазивный способ получения исходного материала, а также отсутствие иммунных реакций при аллогенном применении. Отсутствие спонтанной трансформации при длительном культивировании клеток — важный фактор, подтверждающий безопасность использования метода.
Мезенхимальные стволовые клетки секретируют ряд цитокинов (интерлейкины-6, 7, 8, 11, 12, 14, 15, 27, фактор, угнетающий лейкемию (leukemia inhibitory factor), фактор роста стволовых клеток (stem cell factor), макрофагальный колониестимулирующий фактор (macrophage colony stimulating factor)). Некоторые из них обеспечивают критическое взаимодействие «клетка-клетка», приводя к ускорению дифференцировки гемопоэтических стволовых клеток. По другим данным, мезенхимальные стволовые клетки in vitro синтезируют различные ростовые факторы, включая СЭРФ, интерлейкины-1 и 6, фактор некроза опухоли, а также гепатоцитарный фактор роста (hepatocyte growth factor), который индуцирует митогенную и антиапоптогенную активность в различных системах, ускоряет заживление ран. Мезенхимальные стволовые клетки обладают рецепторами эпидермального фактора роста (epidermal growth factor), инсулиноподобного фактора роста 1 (insulin-like growth factor 1) и др., иммуномодулирующими эффектами, индуцируют Т-регуляторные клетки, косвенно способствуя переключению Th1 клеточного иммунитета на Th2 гуморальный ответ. При этом описываются антибактериальные свойства мезенхимальных стволовых клеток, а их системное введение значительно уменьшает персистенцию хронической инфекции, снижает циркуляцию нейтрофилов по отношению к макрофагам.
Появляются работы, посвященные применению эндометриальных мезенхимальных стволовых клеток в лечении синдрома Ашермана. После их введения наблюдалась неоваскуляризация стенки матки, сопровождающаяся утолщением эндометрия, достаточным для успешной имплантации и вынашивания беременности. В случаях отсутствия ответа эндометрия на гормональную терапию внутриматочное введение мезенхимальных стволовых клеток в начале менструального цикла непосредственно после кюретажа может решить задачу роста эндометрия и в последующем способствовать наступлению беременности в программе ЭКО. Подобные публикации пока носят характер описания единичных случаев. Тем не менее следует признать высокий потенциал клеточных технологий в преодолении невосприимчивости тонкого эндометрия и связанных с ней бесплодия и невынашивания беременности.
Важным методом коррекции нарушения трофики является применение прямых метаболических активаторов, что приводит к усилению тканевого обмена, активации энергетических процессов в клетках, устранению последствий гипоксии в ткани, в том числе угнетению анаэробного гликолиза и стабилизации цикла Кребса в аэробных параметрах функционирования. С этой целью используются комплексные метаболические препараты, длительность приема которых должна составлять не менее 3-4 недель. Ярким представителем данной группы препаратов является депротеинизированный гемодериват крови телят.
Аутоплазменное лечение хронического эндометрита нашло широкое применение как в России, так и за рубежом. В нашей стране применяется парацервикальное введение аутоплазмы. Иностранные авторы сообщают об успешном лечении хронического эндометрита при внутриматочном введении PRP-плазмы (Platelet Rich Plasma) [35, 36].
Из нетрадиционных методов лечения хронического эндометрита применяют контрастный массаж, иглорефлексотерапию, йоготерапию. Кроме положительного воздействия последнего метода лечения на эндометрий авторы отмечают снижение депрессии и уровня стресса, что очень важно, так как сам по себе стресс способен провоцировать гемодинамические нарушения, способствовать поддержанию высокого уровня провоспалительных цитокинов в эндометрии [37, 38].
Дискуссионными остаются вопросы о целесообразности использования в комплексном лечении ХЭ циклической гормональной терапии. В настоящее время считается, что при ХЭ оправдано только дифференцированное назначение гормонотерапии при наличии гипофункции яичников или ановуляции [39]. Потенциал к патологической регенерации ткани, который таит в себе хроническое воспаление, при назначении циклической заместительной гормональной терапии может быть усилен и реализован [40]. Хотя некоторые авторы отмечают успешность лечения гипопластичного эндометрия циклическими гормональными препаратами 42.
В предполагаемом фертильном цикле, особенно при проведении стимуляции функции яичников, обосновано применение эстрогенных препаратов. При этом трансдермальные формы эстрогенов обладают рядом преимуществ перед оральным приемом эстрадиола ввиду высокой по сравнению с оральным приемом биодоступности, создания постоянной концентрации в кровотоке, отсутствия конверсии в неактивные метаболиты и возможности легкого варьирования дозы. Справедливости ради надо отметить, что препараты эстрадиола могут назначаться и на этапе подготовки к фертильному циклу в случаях, когда причиной тонкого эндометрия является овариальная недостаточность. Эстрогены назначаются по 21?дневной схеме, в течение последних десяти дней их сочетают с прогестинами (дидрогестерон 10-20 мг/сут, микронизированный прогестерон 200 мг/сут, раствор прогестерона 1% — 2 мл или 2,5% — 1 мл внутримышечно через день). Реакция эндометрия в индивидуальных случаях значительно отличается, поэтому возможность увеличивать или уменьшать дозу становится принципиальным фактором успеха подготовки эндометрия к фертильному циклу и обусловливает предпочтение в пользу трансдермальных форм эстрогенов 46.
Недостаточная эффективность гормональной терапии эстрогенами объясняется сниженной рецептивностью тонкого эндометрия и сохраняет актуальность поиска дополнительных путей увеличения его роста.
Задача улучшения ростовых функций эндометрия оказывается непростой для решения, так как экзогенные эстрогены усиливают пролиферативные процессы с одновременной активацией воспалительной реакции, что неблагоприятно для последующего наступления и течения беременности.
Альтернативные способы ускорения процессов созревания эндометрия активно изучаются, но универсального средства для решения этой задачи пока не найдено. Соблюдение принципа «пролиферация без воспаления» возможно при системном действии лекарственных средств, в состав которых входит набор цитокинов и факторов роста, обеспечивающих активацию Th2 клеточного иммунитета и рост слизистой оболочки матки. В этой связи представляет интерес использование гидролизата плаценты человека в виде раствора для внутривенных инъекций Лаеннека [47].
Критериями эффективности проведенной терапии являются: купирование клинических симптомов заболевания при их наличии, восстановление эхографической картины эндометрия, улучшение васкуляризации эндометрия при допплерометрии сосудов матки, элиминация или снижение активности инфекционного агента, восстановление морфологической структуры эндометрия, восстановление функционального состояния эндометрия, нормализация менструального цикла с полноценной лютеиновой фазой [48].
Проводится контрольная аспирационная биопсия эндометрия на 7-11 день менструального цикла не ранее чем через 2-3 мес после лечения с последующим морфологическим и бактериологическим исследованиями состояния эндометрия.
Хронический эндометрит является клинически значимой нозологической формой с позиций репродуктологии и требует обязательной диагностики и лечения у женщин с патологией репродуктивной системы, а также при использовании программ вспомогательных репродуктивных технологий. Комплексная этиопатогенетическая терапия хронического эндометрита позволяет восстановить нарушенный тканевый гомеостаз и рецептивность эндометрия, что приводит к восстановлению репродуктивной функции.
Литература
Е. В. Козырева* , 1 , кандидат медицинских наук
Л. Ю. Давидян**, доктор медицинских наук, профессор
* ГУЗ УОКБ, Ульяновск
** ФГБОУ ВПО УлГУ, Ульяновск
Читайте также:
- Доступ и ход операции дренирования псевдокисты поджелудочной железы в желудок
- Теории (причины) развития остеохондроза
- Значение зиготности. Значение хориальности многоплодной беременности
- Вальпроевая кислота (VPA) и бортезомиб в лечении миелодиспластического синдрома (МДС)
- Функциональные кисты яичников
