УЗИ печени при гамартоме
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
1 НМИЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева МЗ РФ, Москва.
2 Тульская областная детская клиническая больница, Тула.
Введение
Заболевания печени нередко проявляются неспецифическими жалобами и в ряде случаев выявляются случайно. Это относится, прежде всего, к детям, у которых доля врожденной патологии выше, чем у взрослых. Резервные возможности печени высоки, поэтому задача врача - выявить патологию, прежде чем она станет клинически значимой.
Клиническая анатомия печени
Известно высказывание, сравнивающее ультразвуковые исследования (УЗИ) с волшебным фонариком, позволяющим заглянуть в темную комнату и рассмотреть ее содержимое. УЗИ представляют нам "живую анатомию" органа, позволяя поставить топический диагноз при очаговом поражении печени или объективно охарактеризовать динамику диффузного процесса.
Правая и левая доли печени отделены бороздой, идущей от дна желчного пузыря к нижней полой вене. В каждой доле печени 4 сегмента: в левой доле первые четыре, в правой - с V по VIII. Сегменты выделяются на основе веточки воротной вены в их центре и печеночной вены на периферии. I сегмент (рис. 1) известен как хвостатая доля (доля Шпигеля).
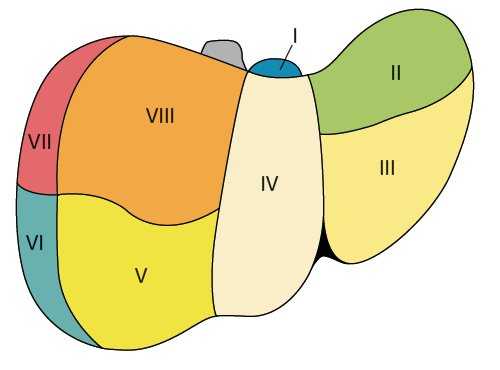
а) Вид с диафрагмальной поверхности.
б) Вид с абдоминальной поверхности.
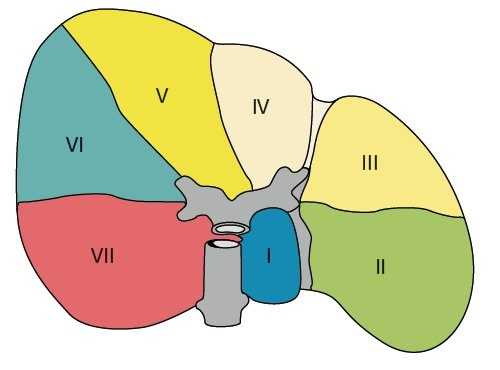
Ветви воротной вены отходят в форме, напоминающей две лежащие на боку буквы "Н", одна из которых снабжает левую долю (сегменты I-IV), другая - правую (сегменты V-VIII). "Н" левой доли лучше всего визуализируется при косом субксифоидальном доступе (рис. 2). К этой лежащей на боку "Н" прикрепляются серповидная и венозная (малый сальник = печеночно-желудочная связка) связки. Венозная связка - фиброзный остаток венозного протока, по которому у плода осуществляется сброс крови из левой пупочной в нижнюю полую вену. Венозная связка отграничивает I сегмент от II, серповидная - III от IV. I сегмент (хвостатая доля печени) располагается позади от нижней полой вены, сбоку от венозной связки и впереди левой ветви воротной вены. Особенность I сегмента - кровоснабжение правой и левой ветвями воротной вены (из-за малого диаметра плохо визуализируются при УЗИ) и дренаж непосредственно в нижнюю полую вену, минуя 3 основные большие печеночные вены. Портальная вена, снабжающая II сегмент - непосредственное продолжение левой ветви воротной вены, образует нижнюю "палочку" горизонтально расположенной "Н". Другую горизонтальную линию образуют ветви к сегментам III и IV. Сегменты II и III располагаются слева от венозной и серповидной связок. Сегмент IV, квадратная доля, располагается справа от серповидной связки и отделен от I сегмента левой ветвью воротной вены [1].
а) Левая доля печени.
б) Правая доля печени.
Правая часть воротной вены и ее ветвление к сегментам визуализируются при сагиттальном или косом среднеаксиллярном межреберном доступе. У детей и грацильных субъектов возможен субкостальный доступ. Правая ветвь воротной вены располагается косо вперед или вертикально. Ветви правой доли воротной вены, направляющиеся к сегментам, также формируют фигуру расположенной на боку буквы "Н" (рис. 2). Перемычку между ножками буквы "Н" образует правая ветвь воротной вены, ветви к сегментам V и VIII - верхнюю ножку, ветви к VI и VII сегментам расположены косо. Поэтому для визуализации VI сегмента датчик надо направлять в сторону правой почки. Средняя печеночная вена отграничивает V и VIII сегменты от IV, правая - V и VIII сегменты от VI и VII. V сегмент располагается медиальней от желчного пузыря. Правая ветвь воротной вены служит границей между V и VIII сегментами. Сегмент VIII отделен от VII правой печеной веной, от IV - средней печеночной веной. VI и VII сегменты отделяются от V и VIII правой печеночной веной. VI сегмент непосредственно прилежит к почке, его латеральной границей является грудная клетка. VII сегмент отделен от VIII правой печеночной веной, примыкая латерально к ребрам, каудально - к куполу диафрагмы.
Печеночные вены при косом субксифоидальном коронарном доступе напоминают букву "W", располагающуюся своим основанием на нижней полой вене. Левая печеночная вена является границей между II и III сегментами, средняя отграничивает IV сегмент от V и VIII, правая - V и VIII сегменты от VI и VII. При косом субксифоидальном доступе хорошо визуализируется правая печеночная вена, что позволяет отграничить поверхностный V сегмент от глубокого VIII.
Полноценное УЗИ подразумевает неукоснительную визуализацию ветвей воротной вены, их сегментарных ветвей, печеночных вен. Это позволяет диагностировать не только очаговые поражения печени, но и обнаружить тромбозы, сдавление сосудов объемным образованием или прорастанием опухоли в сосуд. Допплеровское исследование завершает диагностическую процедуру, определяя наличие и направление кровотока в сосудах. Рядом с сосудистым пучком (печеночная артерия и воротные вены) располагаются желчные ходы. Они становятся видны при блокаде оттока желчи [2].
Клинические проблемы
Желтухи новорожденных могут быть результатом паренхиматозных процессов (гепатоцеллюлярные) обструктивного характера, гемолитического и септического происхождения.
Диагноз должен быть установлен на самых ранних сроках. Если лечение обструкции желчевыведения или метаболических нарушений не начнется в течение ближайших 2 мес жизни, развивается фатальный цирроз печени. Эхография - важнейший метод диагностики причин гипербилирубинемий новорожденных. Методика позволяет ускорить дифференциальную диагностику внутри- и внепеченочной обструкции желчных протоков, включая кисты холедоха, спонтанную перфорацию желчного протока, атрезию внутрипеченочных ходов. Другие причины обструкции желчевыводящей системы (камни, опухоли, врожденный стеноз общего желчного протока) в периоде новорожденности встречаются редко. Внутрипеченочные нарушения могут быть при внутрипеченочной атрезии желчных ходов, редко - при развитии фиброзной ткани вокруг желчных ходов за счет гомозиготной мутации гена циррина CIRH1A на хромосоме 16q22. Кроме того, желтуха новорожденного может быть гепатоцеллюлярной (гепатиты вирусные, бактериальные, грибковые, паразитарные) или метаболической (непереносимость фруктозы, дефицит α1-антитрипсина, муковисцидоз). С холестазом протекают гемолиз, сердечная недостаточность, шок, сепсис, волчанка новорожденных [3, 4].
УЗИ сканер WS80
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
УЗИ при доброкачественных опухолях печени
Доброкачественные опухоли печени при ультразвуковой диагностики
Большинство доброкачественных опухолей печени обнаруживаются на УЗИ случайно. Большинство не требуют лечения; отсюда и интерес к конкретному диагнозу. Ожидается, что каждое достижение в области визуализации - ультразвуковая допплерография, компьютерная томография, а теперь и МРТ - решит эту сложную диагностическую проблему. И действительно, каждый раз, когда появляются новые конкретные данные, сожалению, большинство аномалий перекрываются, и ни один из них не присутствует в каждом конкретном случае опухоли. Это означает, что правильно будет идентифицировано большинство опухолей, но редко диагностика обходиться только одной процедурой. Часто, несмотря на множество дополнительных исследований, тонкоигольная биопсия становиться необходима в качестве последнего средства идентификации, при этом биопсия имеет свои собственные ограничения. Гепатоцит очаговой узловой гиперплазии (ОУГ) - это просто нормальный гепатоцит, как внутри аденомы, так и в нормальной ткани вне очага поражения. Эритроцит в гемангиоме - это просто эритроцит, как в кровеносном сосуде. И выделенный раковый гепатоцит в гемангиоме может быть очень похож на нормальный гепатоцит, что делает биопсию неубедительной, если только не настоящий фрагмент опухоли доступно, а не только несколько клеток.

Аденома печени на УЗИ
Аденомы приводят к хорошо очерченным округленным образованиям печени на УЗИ, которые могут быть гипоэхогенными или гиперэхогенными. Случаи множественной аденомы подтверждают вариабельность эхогенности. Количество внутри опухолевого жира, вероятно, является причиной большинства этих морфологических изменений; Центральный жир может вызывать появление центральной эхогенной линии в образовании на УЗИ. Допплеровские сигналы обычно обнаруживаются в аденомах, но без какой-либо специфичности. При КТ аденомы усиливаются быстро и диффузно после болюсной инъекции йода; то же самое верно для МРТ с гадолинием. Из-за роли гормонов (оральная контрацепция) в патогенезе аденом, большинство из них обнаруживаются у женщин.
Последующее наблюдение на ультразвуковом исследовании после прерывания гормонального приема может показать уменьшение объема и даже исчезновение поражения. Это очевидно в случае нескольких представленных аденом. Поскольку современные оральные контрацептивы менее концентрированы, возникновение аденом должно быть реже, но этот вопрос продолжает изучаться.
Фокальная (очаговая) нодулярная (узловая) гиперплазия печени на УЗИ
Очаговые узловые гиперплазии (ОУГ) печени не являются настоящими опухолями. Тем не менее, их специфический диагноз важен, поскольку, как и гемангиомы, они никогда не вырождаются и в большинстве случаев не требуют какого-либо лечения. ОУГ обычно хорошо очерчены и гиперэхогенные. Некоторые изоэхогенные и проявляются с тонким градиентом эхогенности при проведении УЗИ высокого разрешения или во время периоперационной УЗИ. Многие Очаговые узловые гиперплазии имеют центральный «рубец», содержащий соединительную ткань и сосуды. Как упоминалось выше, изображения рубцов не являются полностью специфичными для ОУГ. Были изучены серии из 930 случаев очаговых узловых гиперплазий. 82% пациентов были женщинами, а 91% из них без каких-либо симптомов. 58% ОУГ были субкапсулярными, 32% были внутрипеченочными, и 9% были на ножке. Средний диаметр составлял 5,9 см. Тщательно проведенная ультрасонография обнаружила образования в 93% случаев, но не обнаружила других узлов в 13%. (ОУГ может быть множественным процессом). При этом, эффективность КТ была сопоставимой. При контрастировании на КТ ОУГ также можно увидеть, что быстро и диффузно усиливается кровоток в образовании.
Цветная допплеровская визуализация неспецифична. Цветное картирование хорошо выявляет сосуды, которые часто расположены, с артериальным спектром при импульсноволновой допплерографии. Сдвиг скорости кровотока может быть высоким. Центральная васкуляризация более специфична, особенно если выявлена афферентная вена. Исключительно периферические артериальные сигналы воспроизводят картину «колеса со спицами» как на УЗИ, так при селективной ангиографии. В аденомах при очаговой узловой гиперплазии ядерная медицина может показать нормальное накопление нуклеидов.
Гамартомы на ультрасонографии
Как упоминалось в предыдущей главе, у взрослых гамартомы возникают как множественные узловые образования, которые могут напоминать любой тип поражения, включая метастазы. Однако последующие обследования не показывают эволюционных изменений, и это приведет к управляемой под ультразвуковым контролем пункции.
Цистоаденомы при ультразвуковом сканировании
Я описал выше пример цистаденом и цистаденокарцином, но считаю необходимым еще раз подчеркнуть, что морфологического анализа недостаточно, чтобы исключить злокачественную опухоль. Это означает, что, по-видимому, доброкачественные, бессимптомные цистаденомы требуют, по крайней мере, последующего наблюдения. Даже тонкоигольная биопсия может вводить в заблуждение, так как мультилокулярная архитектура увеличивает количество мест потенциальной дегенерации.
Липомы и ангиомиолипомы на ультрасонографии
Липомы и ангиомиолипомы вызывают гиперэхогенные узловые образования и, таким образом, напоминают ангиомы. Акустическое затенение позади узла на УЗИ говорит в пользу неангиоматозного поражения. Липома может встречаться в рамках болезни Бурневилля (туберозный склероз Бурневилля). КТ-денситометрия или флэш-последовательности для подавления жира при МРТ позволяют поставить диагноз еще до исследования с контрастным усилением. Как мы видели выше, некоторые гепатокарциномы богаты жиром, но они гораздо менее однородны, чем липомы, и имеют гиперваскуляризированные участки.
Клиническая трактовка результатов ультразвуковых исследований печени
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Ультразвуковые исследования (УЗИ) - часто первые в ряду диагностических поисков при подозрении на патологию печени, определяя выбор других методик. Совершенствование ультразвуковых диагностических технологий привело к тому, что в ряде случаев стало возможным отказаться от других радиологических исследований. Но это же повышает ответственность специалиста, требует клинически интерпретировать полученные результаты, не сводя описание к фиксации "эхопозитивных" и "эхонегативных" образований. Основная доля УЗИ в поликлинических условиях приходится на органы брюшной полости. И печень - первое, что в этом случае пытается визуализировать специалист. Заболевания печени могут быть заподозрены по предъявляемым жалобам, клинической картине, лабораторным данным, но нередко они выявляются случайно. Последнее относится, прежде всего, к детям, у которых доля врожденной патологии выше, чем у взрослых. Резервные возможности печени невероятны, поэтому задача врача - выявить патологию, прежде чем она станет клинически значимой.
Общие положения
Эмбриогенез печени и ее сосудов, анатомия. В раннем онтогенезе печень, желчный пузырь и желчный проток возникают как единый вырост (печеночный дивертикул) в каудальном отделе переднего отдела протокишки. Это образование растет вентрально в septum transversum, представляющую собой мезодерму между развивающимся сердцем и средним отделом кишки. Зачаток печени растет очень быстро, в первые 10 нед занимая бoльшую часть брюшной полости. В этот период размеры правой и левой долей печени одинаковые, но за счет оксигенированной крови из печеночной вены правая доля быстро обгоняет в размерах и массе левую. С 6-й недели печень является органом кроветворения, а с 12-й недели синтезирует желчь. Маленький каудально расположенный отросток на печеночном дивертикуле дает начало желчному пузырю, а его ножка - пузырному протоку. Из тяжика, идущего от печеночного и пузырного протока к двенадцатиперстной кишке, формируется общий желчный проток. В эмбриональный период кровь поступает в печень по пупочной вене, проходящей по свободному краю ligamentum falciforum в левую ветвь воротной вены. Эта часть v. portae соединяется с печеночной веной через ductus venosus, далее кровь поступает в правое предсердие. Таким образом, ductus venosus представляет собой большой венозный шунт в обход печени, благодаря которому основная часть крови из плаценты поступает непосредственно в сердце. Это единственный путь, по которому может быть проведен катетер. Если катетер при зондировании пупочной вены попадает в правую ветвь воротной вены, развиваются тромбоз, облитерация и портальная гипертензия. После рождения ребенка пупочная вена облитерируется и превращается в круглую связку печени (ligamentum teres). Ductus venosus трансформируется в ligamentum venosum. В первые часы после рождения эти структуры можно визуализировать как каналикулярные. Позднее ligamentum teres видна как плотная структура, распространяющаяся от левой части воротной вены. Если возрастает внутрипеченочное давление (при циррозе), круглая связка печени реканализируется. Портальная кровь начинает оттекать от печени к пупку, в результате чего варикозно расширяются околопупочные вены (caput medusae). Возможны аномалии нижней полой вены, но они крайне редки. Среди этих редких пороков чаще встречается леворасположенная нижняя полая вена, самостоятельно впадающая в правое предсердие через коронарный синус. Возможно недоразвитие печеночного сегмента нижней полой вены с дренажом крови через систему vv. azygos et hemiazygos. Печеночная вена самостоятельно дренируется в правое предсердие. Возможно удвоение нижней полой вены, при этом левая вена значительно меньше по диаметру, чем правая. Знание этих особенностей особенно важно в детской практике, так как существенная часть педиатрической патологии является врожденной.
Особенности локации (автор выражает благодарность компании Medison за предоставленную аппаратуру. Рис. 2-4 также предоставлены этой компанией). Начиная рабочий день, проверьте состояние аппаратуры. Убедитесь, что набор датчиков позволяет вам выполнить все исследования. Добейтесь, чтобы в направлении были приведены показания к проведению исследования, сформулированы цель и задачи, представлены основные клинические, лабораторные и инструментальные результаты. В беседе с родителями и ребенком (если он может формулировать свои проблемы) уточните все неясные моменты. Посмотрите на пациента как врач, а не как исполнитель при аппарате. Критически оцените прежние данные, сформулируйте свои показания. Имейте четкий план работы: период, в течение которого ребенок спокоен и позволяет выполнять процедуры, недолог.
Для УЗИ печени, селезенки, верхней части живота наиболее приемлем конвексный датчик. Угол обзора при этом большой, а деформация ближнего поля минимальная. Линейный датчик применим для визуализации мелких структур. Допплерография необходима при подозрении на сосудистые аномалии, гемангиомы.
Сканирование лучше проводить в положении ребенка на спине при максимальном вдохе или выдохе (в зависимости от особенностей ребенка). При вдохе легкие оттесняют печень, желчный пузырь и селезенку ниже реберной дуги, смещают толстую кишку, увеличивая акустическое окно. У детей старшего возраста иногда требуется осмотр через межреберные промежутки или в боковой проекции. Межкостальный доступ является оптимальным при расположении печени глубоко в подреберье. Чтобы избежать ложных заключений при нестандартных доступах, исследователь должен помнить об изменяющейся топографии органа, нарушениях обычного соотношения с ним почек, нижней полой вены, кишечника. Если в процессе осмотра печени возникли сомнения относительно состояния желчного пузыря или желчевыводящих путей, а ребенок подготовлен недостаточно, лучше закончить исследование и повторить его после подготовки. Важнейшее преимущество УЗИ перед другими методами неинвазивной визуализации (рентгенография, магнитнорезонансная - МРТ или компьютерная томография - КТ, ретроградная холангиопанкреатография - РХПГ) состоит в возможности повторять исследование так часто, как это диктуется клиникой.
Эхографическая картина нормальной печени. В норме печень ребенка гомогенна. Характер обработки сигнала выбирают в зависимости от цели исследования (рис. 1а, 1б). Капсула печени тонкая, эхогенная. Эхогенность паренхимы печени выше, чем паренхимы коры почек. Медуллярная ткань почек темнее паренхимы печени. Вентральный край печени тонкий, острый. При увеличении размеров печени он закругляется. Частым показанием к проведению УЗИ является подозрение на увеличение размеров печени. Существует много формул для расчета размеров печени, в том числе волюметрические. Последние используются в основном в научных целях или в специализированных клиниках. Размеры и конфигурация печени достаточно вариабельны. При рутинных исследованиях размеры печени можно оценивать качественно. Правая доля печени распространяется до нижнего полюса почки, но если существует риделевская долька (вариант нормы), то несколько ниже. У детей 1 года жизни левая доля при поперечном сканировании распространяется за срединную линию, у старших детей - до аорты. При гепатомегалии левая доля простирается вплоть до селезенки, сдвигая ее вниз. Смещение селезенки может служить причиной ошибочного заключения о спленомегалии. Таким образом, печень состоит из правой и левой долей. Кроме того, имеется и хвостатая доля. Доли печени делятся на сегменты. Упрощенно - правая доля имеет передний и задний сегменты (граница - правая печеночная вена). Левая доля состоит из медиального и латерального сегментов (граница - левая печеночная вена). Каждый сегмент имеет свое кровоснабжение. Поэтому при синдроме Бадда-Хиари (обструкция печеночных вен) сегменты увеличиваются в размерах, их эхогенность возрастает. Знание сегментов печени важно и для точной локализации объемных образований.
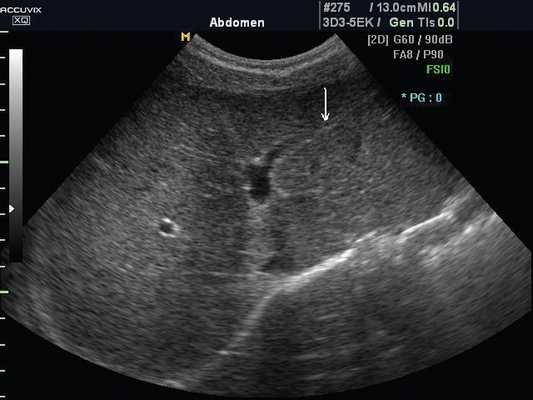
а) Эхограмма печени 12-летнего подростка в обычном режиме. Обратите внимание, что даже в 12-летнем возрасте круглая связка печени (стрелка), отходящая от левой части воротной вены, имеет каналикулярный вид (просвет внутри).
Ультразвуковая диагностика гамартомы селезенки
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
К очаговым образованиям селезенки традиционно относят злокачественные и доброкачественные опухоли, истинные, ложные и паразитарные кисты, а также абсцессы. Эти заболевания встречаются достаточно редко и составляют от 0,5 до 2% всех ее поражений 1. L. Morgenstern даже назвал очаговые изменения селезенки казуистикой [4].
По данным 72 237 аутопсий, выполненных в медицинском центре университета в Южной Калифорнии за период с 1950 по 1974 г., было выявлено 32 случая (1:2257) образований селезенки [5]. На основании анализа более чем 42 000 аутопсий L. Morgenstern пришел к выводу, что частота образований селезенки составляет 0,07% [4], а, по мнению N. Borner, частота очаговых образований селезенки достигает 3,2-4,2% на 100 000 населения [6].
S. Natsugoe и соавт. привели данные W.L. Bostick (1945), который на основании аутопсий и интраоперационных ревизий (более 8000 наблюдений) выявил, что доброкачественные опухоли селезенки встречаются у 0,007% населения [7].
Обращает на себя внимание частота диагностических ошибок, которая даже при использовании современных методов диагностики достигает 75-80% [8]. Правильный диагноз нередко устанавливается только во время операции с использованием срочного морфологического исследования. Ошибки диагностики во многом связаны с недостаточным знанием практическими врачами особенностей обследования подобных больных. В работах, основанных на единичных наблюдениях, нет достаточного описания признаков, характерных для соответствующих патологических образований селезенки, которые выявляются современными методами исследования.
Гамартома (спленаденома, спленома) - термин, используемый для обозначения узловых поражений селезенки, состоящих исключительно из элементов красной пульпы [2, 9]. Чаще гамартома трактуется как неопухолевое образование, состоящее из различных сочетаний нормальных компонентов селезенки [10, 11]. Считается, что это врожденное состояние, однако убедительных данных, подтверждающих это, пока недостаточно [12]. В некоторых случаях гамартома селезенки может сочетаться с подобными образованиями любой локализации [10].
Гамартома образуется в результате нарушения морфогенеза и гистологически представлена пролиферирующими фиброзно-мышечными элементами в сочетании с эпителиальными включениями с частичной метаплазией без признаков атипии [15, 16]. Выделяют два подтипа гамартом: образования белой пульпы, состоящие из абберантной лимфоидной ткани, и образования красной пульпы, состоящие из аббератных комплексов синусов [10]. Однако большинство гамартом содержат оба типа элементов. При гистологическом исследовании определяеться отсутствие атипичных фигур митозов и клеток Reed-Sternberg. Важно отметить, что компрессия окружающей селезеночной паренхимы, а не ее инвазия позволяет дифференцировать гамартому от лимфомы селезенки [10].
Гамартома встречается у больных обоего пола, но чаще у женщин [10] пожилого возраста [17]. Клинически практически всегда отмечается бессимптомное течение [2, 10, 11], либо гамартома проявляется последствиями увеличения органа или гиперспленизмом (анемия, тромбоцитопения) [11, 14, 18]. При тяжелых осложнениях - разрыв селезенки, развитие внутрибрюшного кровотечения - появляются соответствующие клинические признаки. Обращает на себя внимание тот факт, что в литературе, несмотря на редкость подобного поражения, описано уже несколько случаев спонтанного разрыва селезенки с гамартомой [13]. Таким образом, специфических синдромов гамартомы селезенки нет.
При ультразвуковом исследовании гамартома выглядит как солидное гомогенное образование с четкими контурами, реже отмечаются кистозная деформация и кальцификация. При дуплексном сканировании имеет место повышенная васкуляризация [19, 20].
При лучевом исследовании гамартому следует дифференцировать с лимфомой, метастатическим поражением, воспалительной миофибробластической опухолью, распространенной грибковой и микобактериальной инфекцией, саркоидозом и сосудистыми опухолями селезенки, такими как гемангиома, "прибрежноклеточная" ангиома (littoral cell angioma), лимфангиома, гемангиоэндотелиома, склерозирующие ангиоматозные узлы и ангиосаркома [4, 19].
Макроскопически патологический очаг выглядит в виде четко отграниченного узла более темного цвета, выбухающего над поверхностью органа, отмечается компрессия окружающей ткани селезенки без ее инфильтрации [14]. В отличие от лимфомы гамартома селезенки красного цвета, часто с геморрагическими проявлениями [21]. Обычно это единичный очаг, который редко может содержать кальцинаты [22], однако описаны наблюдения нескольких патологических узлов в селезенке [14].
При гистологическом исследовании обращают на себя внимание отсутствие фолликулов и дендритических клеток, слабо развитые фиброзные трабекулы, могут наблюдаться очаги экстрамедуллярного кроветворения.
При иммуногистохимическом исследовании клетки сосудистых структур экспрессируют эндотелиальные маркеры, такие как CD-31 и фактор VIII, а также CD-8 и виментин. Реакция на CD-21 и CD-68 в этих клетках отрицательная, хотя CD-68 положителен в рассеянных тромальных макрофагах [23].
Методом лечения больных с данными образованиями является хирургический. Кроме общепризнанного объема операции - спленэктомии, описаны единичные наблюдения резекций селезенки [7, 10].
Материалы и методы
В Институте хирургии им. А.В. Вишневского накоплен опыт диагностики и лечения более 300 пациентов с различными очаговыми образованиями селезенки, но с гамартомами столкнулись лишь в 3 наблюдениях.
Характеристика пациентов: 2 мужчин и 1 женщина в возрасте 50, 54 и 58 лет с образованиями селезенки размерами 6,6x7,5x8,3 см. Из клинических проявлений все трое больных отмечали лишь периодические тянущие боли в правом подреберье.
Всем пациентам предоперационно выполняли УЗИ в полном объеме: исследование в В-режиме, дуплексное сканирование в режимах цветового допплеровского картирования (ЦДК), энергии отраженного допплеровского сигнала (ЭОДС) и импульсной допплерографии.
Во всех случаях проведено оперативное лечение, а образования морфологически верифицированы.
Результаты
При УЗИ во всех случаях отмечали увеличение селезенки в размерах и наличие в разной степени васкуляризированного образования с частично внеорганным расположением. Данные предоперационного УЗИ были представлены следующим образом.
Наблюдение 1
При УЗИ больного Т. селезенка увеличена (площадь - 68 см²), контуры ее неровные, четкие, структура паренхимы неоднородная за счет наличия в средней трети образования, деформирующего латеральный контур селезенки, однако не доходящего до ее ворот. Образование округлой формы, по структуре солидное, гипоэхогенное, с четкими ровными контурами, размером 65x60x53 мм (рис. 1).
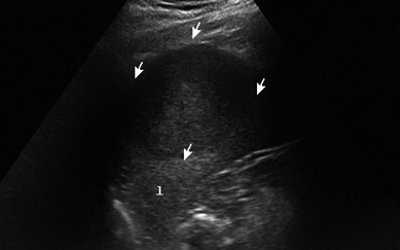
Рис. 1. Эхограмма гамартомы селезенки (В-режим), гамартома указана стрелками.
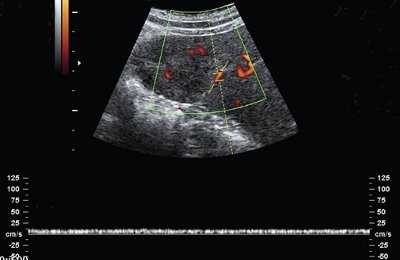
При дуплексном сканировании образование по контуру огибают селезеночные сосуды без локальных изменений скоростных показателей (рис. 2).
В структуре образования лоцируются два венозных сосуда диаметром 1,5-2,0 мм (рис. 3).
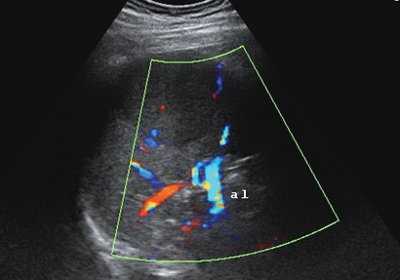
Рис. 3. Дуплексное сканирование селезенки. Кровоток в структуре образования и в паренхиме селезенки (режим ЦДК, al - селезеночная артерия).
Заключение: опухоль селезенки средней степени васкуляризации, наиболее вероятно, гемангиома.
Наблюдение 2
При УЗИ больной М. селезенка увеличена в размерах (площадь - 45 см²), контуры ровные, четкие, структура паренхимы неоднородная за счет наличия в проекции нижнего полюса округлого образования размером 61,3x52,5 мм, расположенного частично экзоорганно. Структура его солидная, гипоэхогенная, незначительно неоднородная, контуры четкие, ровные (рис. 4).
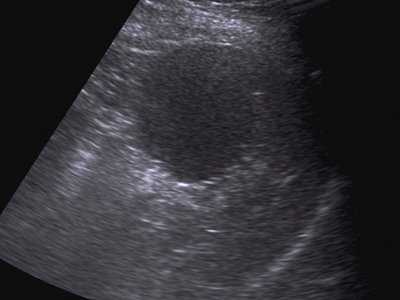
Рис. 4. Эхограмма гамартомы селезенки, В-режим.
При дуплексном сканировании в структуре образования определяются сосуды (рис. 5, а): регистрируются артерии (линейная скорость кровотока - ЛСК - от 0,33 до 0,47 м/с) и вены (ЛСК от 0,08 до 0,12 м/с) (см. рис. 5, б). Вокруг образования отмечается некоторое обеднение сосудистого рисунка, наиболее вероятно, за счет компрессии окружающей ткани селезенки.
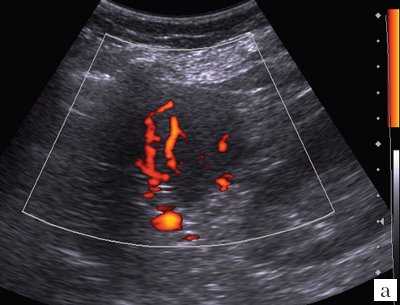
Рис. 5. Дуплексное сканирование гамартомы селезенки.
а) Режим энергетического допплера.
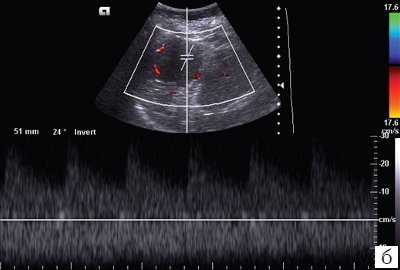
б) Режим цветового допплеровского картирования и импульсной допплерографии с регистрацией спектра допплеровских частот.
Заключение: солидное гиперваскулярное образование нижнего полюса селезенки, наиболее вероятно, гемангиома.
Наблюдение 3
При УЗИ больного С. селезенка увеличена (площадь - 80 см²). В области верхнего полюса селезенки определяется образование с четкими, несколько неровными контурами. Образование распространяется до ворот селезенки и частично экзоорганно, достигая места деления селезеночной артерии на ветви 1-го порядка. Размер образования составляет 70x56x64 мм. Капсула не прослеживается. Структура образования преимущественно однородная, повышенной эхогенности, с наличием лишь небольших отдельных гипоэхогенных зон (рис. 6).
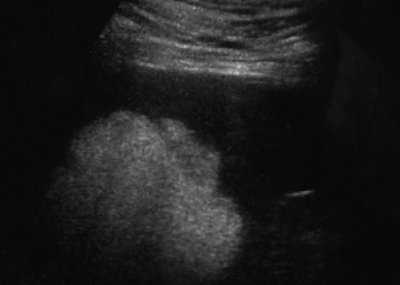
Рис. 6. Эхограмма гамартомы селезенки, В-режим.
В структуре образования по периферии регистрируются два сосуда с венозным спектром кровотока (рис. 7). К медиальному контуру образования тесно прилежит сегментарная селезеночная вена без признаков экстравазальной компрессии. Далее в области ворот селезенки визуализируется анатомический ход еще двух сегментарных вен, которые сопровождают одноименные артерии 2-го порядка.
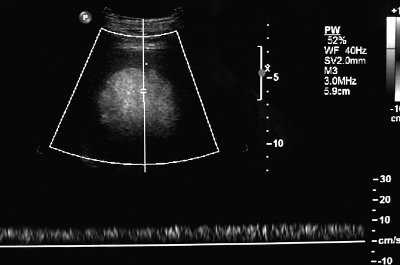
Заключение: солидная опухоль селезенки умеренной степени васкуляризации.
Таким образом, в двух случаях (см. рис. 1-5) предположительно диагностировали гемангиому, в одном диагноз был сформулирован следующим образом: солидное образование умеренной степени васкуляризации (см. рис. 6, 7). Обращала на себя внимание выраженная гиперваскуляризации образования в одном случае и нетипичная картина солидного образования в другом, вследствие чего в 2 из 3 случаев, нельзя было полностью исключить злокачественную природу очагового поражения селезенки. Эти предположения были также подтверждены по данным компьютерной томографии с контрастным усилением.
Все 3 больных были оперированы. В первом наблюдении (больной Т.), учитывая локализацию образования, произвели спленэктомию. При морфологическом исследовании выявлена гамартома селезенки (рис. 8). Ткань гамартомы характеризовалась стертым рисунком, была нормального гистологического строения за счет утолщения межсинусоидальных пространств с убылью лимфоидной ткани и очаговыми скоплениями призматических клеток.
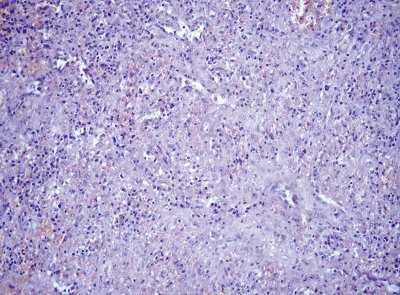
Рис. 8. Микропрепарат гамартомы. Окраска гематоксилином и эозином, x200.
Во втором наблюдении (больная М.) выполнили резекцию селезенки из традиционного доступа в объеме удаления нижней доли вместе с образованием (рис. 9).
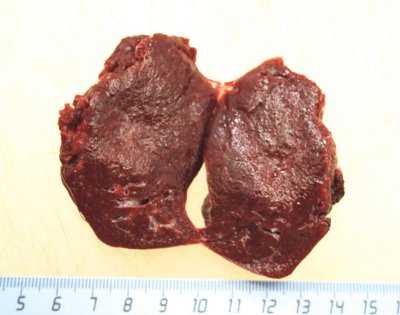
Рис. 9. Макропрепарат, удаленная нижняя доля селезенки вместе с образованием.
При морфологическом исследовании также была выявлена гамартома селезенки (рис. 10). Структура образования напоминала строение красной пульпы селезенки с наличием большого числа сосудистых каналов, выстланных эндотелиоподобными клетками. Выявлялись небольшие участки некроза, четкой границы с нормальной тканью селезенки не определялось, лимфоидные фолликулы отсутствовали.
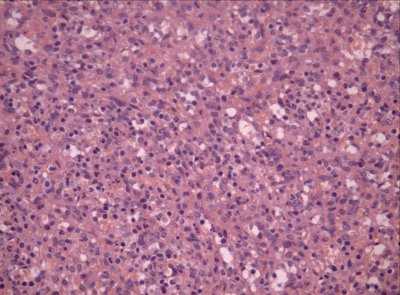
Рис. 10. Микропрепарат гамартомы. Окраска гематоксилином и эозином, x200.
В третьем случае (больной С.) произвели спленэктомию (рис. 11) дополненную с учетом данных срочного гистологического исследования, гетеротопической аутотрансплантацией селезеночной ткани. В нижнем полюсе удаленной селезенки выявили очаг в хорошо выраженной капсуле. Центр образования практически полностью был замещен плотными белесоватыми массами.
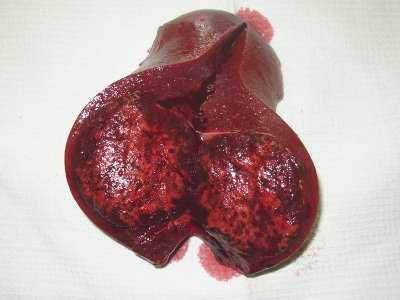
Рис. 11. Макропрепарат, удаленная селезенка вместе с образованием.
При морфологическом исследовании выявлена липоматозная гамартома (рис. 12).
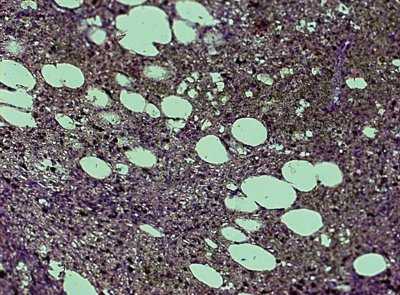
Рис. 12. Микропрепарат липоматозной гамартомы. Окраска гематоксилином и эозином, x200. Определяются группы липоцитов, располагающихся среди измененной полнокровной ткани селезенки.
Образование селезенки в последнем наблюдении представляло наибольший интерес, так как, по данным обследования, макро- и микроскопически отличалось от двух первых. Наличие жировых включений позволило нам установить диагноз - липоматозная гамартома. В медицинской литературе лишь однажды был описан случай первичной липомы селезенки [24], по-видимому, то образование отличалось от описанного в данной статье.
У больного Т. (самый молодой в представленной группе) после спленэктомии, по данным обследования, отмечены выраженные изменения в системе как иммунной защиты, так и гемостаза. Со времени выполнения спленэктомии прошло менее 1 года, за это время были отмечены появление тромбоза вен нижних конечностей, два эпизода пневмонии.
Пациентка М. после резекции селезенки полностью вернулась к привычному образу жизни. При контрольных обследованиях - без особенностей.
Больной С., перенесший спленэктомию, дополненную гетеротопической аутотрансплантацией селезеночной ткани, был вынужден перейти на более легкую работу, в настоящее время продолжает вести активный образ жизни.
Оценивая ретроспективно данные предоперационных обследований и результаты интраоперационной ревизии, можно сказать, что во всех наблюдениях пациентам могли быть выполнены резекционные вмешательства на селезенке (при условии срочного морфологического исследования), что обеспечило бы более высокое качество жизни.
Заключение
Приведенные наблюдения представляют интерес в связи с редким выявлением гамартомы селезенки, что во многом объясняет возникшие трудности дооперационной диагностики. Дважды были заподозрены злокачественные образования селезенки, что в итоге определило объем и характер выполненных хирургических вмешательств. Селезенка была сохранена лишь в одном случае. Срочное морфологическое исследование, исключившее злокачественную природу опухоли, в одном наблюдении позволило произвести гетеротопическую трансплантацию селезеночной ткани. По-видимому, несмотря на редкость гамартомы, вероятность такого поражения селезенки следует учитывать при проведении дифференциально-диагностического поиска.
Литература
УЗИ сканер HS60
Нодулярная гиперплазия печени
Нодулярная гиперплазия печени - очаговое образование в паренхиме печени, морфологически представляющее собой разрастание нормальных гепатоцитов вокруг сосудистой мальформации. Причины развития данной патологии неизвестны, определенная роль отводится сосудистым аномалиям, приему гормональных препаратов. В течение длительного времени заболевание может никак не проявляться; при достижении опухолью определенных размеров беспокоит болевой синдром, диспепсические явления. Диагностика включает проведение УЗИ печени, КТ, МРТ, обязательна биопсия. Лечение при малых размерах гиперплазии не требуется, при крупном образовании с тенденцией к росту проводится энуклеация опухоли или сегментарная резекция печени.
Общие сведения
Нодулярная гиперплазия печени (очаговый цирроз, паренхиматозная гамартома) является второй по частоте доброкачественной опухолью печени после гемангиомы. Согласно данным аутопсий, распространенность нодулярной гиперплазии составляет около 2%. Диагностироваться данная патология может в любом возрасте, но в 95% случаев выявляется у женщин 30-40 лет. Чаще всего это одиночное образование, не имеющее капсулы и не превышающее в диаметре 5 см; крайне редко встречается множественное поражение.
В гастроэнтерологии выделяют два типа нодулярной гиперплазии печени: классический (диагностируется в 80% случаев) и неклассический. Классический тип характеризуется наличием трех признаков: аномальной структуры дольки, извилистых толстостенных сосудов и гиперплазии желчных протоков; в 60% наблюдений обнаруживается центральный рубец с измененными сосудами разного калибра. При неклассическом типе всегда есть гиперплазия протоков, а один из оставшихся признаков (измененные сосуды или аномальная узловая архитектура) может отсутствовать. Неклассический тип подразделяют на три подтипа: аденоматозный гиперпластический, телеангиэктатический и нодулярную гиперплазию печени с клеточной атипией.
Причины нодулярной гиперплазии печени
Нодулярная гиперплазия печени макроскопически представляет собой плотный узел серо-коричневого цвета, четко отграниченный от окружающих тканей. Его размеры могут быть различными: от 1 до 25 сантиметров в диаметре. На разрезе определяется центральный рубец - фиброзная ткань, которая распространяется к периферии и разделяет образование на дольки. Микроскопическими признаками нодулярной гиперплазии печени являются дезорганизация печеночных долек: имеют место воспалительные клеточные инфильтраты, пролиферированные протоки, утолщенные сосуды и фиброзная ткань.
Симптомы нодулярной гиперплазии печени
В большинстве случаев данная патология протекает бессимптомно и выявляется при проведении обследования по поводу других заболеваний. Клинические признаки имеют место менее чем у половины пациентов, при этом они неспецифичны. Наиболее частый симптом - боль в животе, локализованная в правом подреберье. Чаще боль постоянная, ноющего характера, возможно чувство тяжести. Болевой синдром при нодулярной гиперплазии является следствием растяжения капсулы печени или сдавления соседних органов.
При нодулярной гиперплазии печени пациента также могут беспокоить диспепсические явления: тошнота, снижение аппетита. В случае больших размеров образования возможна его пальпация через переднюю брюшную стенку. Не установлена связь между размером опухоли и наличием симптомов, поскольку более важна локализация образования относительно окружающих органов. Крайне редко развиваются такие осложнения нодулярной гиперплазии печени, как механическая желтуха, кровотечение из опухоли и малигнизация.
Диагностика нодулярной гиперплазии печени
Консультация гастроэнтеролога обычно выявляет неспецифические признаки заболевания: диспепсические явления, болевой синдром малой интенсивности. При объективном обследовании пациента опухоль большого размера может быть обнаружена пальпаторно, в случае нарушения оттока желчи определяется желтушность кожи и склер. Лабораторные методы исследования не выявляют никаких специфических для нодулярной гиперплазии печени признаков. Редко обнаруживается некоторое повышение уровня аланинаминотрансферазы, билирубина. С целью дифференциальной диагностики со злокачественными новообразованиями печени обязательно проводится определение онкомаркеров: альфа-фетопротеина, СА 19-9, СЕА.
Диагностика нодулярной гиперплазии печени основана на инструментальных методиках. Характерным признаком данной патологии является «звездчатый шрам» в центре образования, но он выявляется не у всех пациентов, кроме того, может быть обнаружен при фиброламеллярной карциноме, внутрипеченочной холангиокарциноме и других заболеваниях. Это диагностическое ограничение относится ко всем методикам визуализации: УЗИ печени, КТ и МРТ печени. При проведении УЗИ органов брюшной полости единственным признаком нодулярной гиперплазии печени может быть смещение сосудов, иногда определяется гипоэхогенный ободок опухоли (сдавленные образованием сосуды и паренхима). Более информативно исследование в режиме допплеровского сканирования, при котором визуализируется гипертрофированная центральная артерия.
При проведении компьютерной томографии выявляется хорошо отграниченное образование, накопление контрастного вещества в области гиперплазии. МРТ дает аналогичные результаты: гиперинтенсивность контрастирования в артериальную фазу и гипоинтенсивность - в венозную. Неинвазивные методики обладают специфичностью только при классическом типе нодулярной гиперплазии печени. Высокой информативностью при проведении дифференциальной диагностики с другими гиперваскулярными образованиями обладает сцинтиграфия печени. В затруднительных случаях может быть выполнена ангиография, но данный метод также неспецифичен.
При невозможности установить диагноз в ходе неинвазивных исследований проводится биопсия, при этом большими критериями диагностики является наличие толстостенных сосудов, фиброзной прослойки, пролиферирующих протоков, узловой вид опухоли; малыми критериями - перисинусоидальный фиброз и синусоидальная дилатация. Диагноз достоверен при наличии трех больших критериев, вероятный - при определении двух больших и 1-2 малых.
Дифференциальная диагностика нодулярной гиперплазии проводится с другими доброкачественными и злокачественными образованиями печени, крупноузловым циррозом, а также с регенеративной гиперплазией при системных заболеваниях соединительной ткани.
Лечение и прогноз нодулярной гиперплазии печени
В большинстве случаев лечение нодулярной гиперплазии печени не требуется. Если опухоль не достигла больших размеров, не сдавливает соседние органы, не имеет тенденции к увеличению, основной целью является устранение этиологического фактора (если он известен). Отмены гормонального контрацептива, снижения дозировки системных глюкокортикостероидов может быть достаточно для уменьшения размеров образования и его полной регрессии. Однако пациент должен регулярно проходить обследование с целью контроля размеров опухоли и своевременного выявления показаний к хирургическому лечению.
Если нодулярная гиперплазия печени крупная, нарушает отток желчи, препятствует кровообращению или сдавливает соседние органы, проводится энуклеация опухоли или сегментарная резекция печени. Оперативное лечение также требуется в случаях, когда диагноз окончательно не установлен, и опухоль имеет тенденцию к увеличению (в такой ситуации удаление образования проводится даже при нормальных результатах биопсии).
Прогноз при нодулярной гиперплазии печени благоприятный. Заболевание в течение длительного времени может никак не беспокоить пациента, а осложнения развиваются крайне редко. Специфической профилактики не существует. Необходимо обоснованное назначение гормональных препаратов, а при установленном диагнозе обязательно регулярное проведение УЗИ печени для контроля над течением заболевания.
Читайте также:
