УЗИ при муковисцидозе у плода
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
Наш организм состоит из множества клеток, каждая из которых выполняет определенную функцию, в правильном темпе делится, функционирует и умирает. Слаженная работа этих клеток управляется генами. Генная информация содержится внутри каждой нашей клетки и упакована в хромосомы — специальные хранилища информации.
В каждой нашей клетке 46 хромосом — 23 материнские и 23 отцовские. При аутосомно-доминантном способе передачи достаточно хотя бы одного мутантного родительского гена, чтобы у ребенка проявилось заболевание. При аутосомно-рецессивном наследовании заболевание проявляет себя, если ребенок получает по мутантному гену от каждого родителя. Но если при таком типе наследования ребенок получит только один мутантный ген, болезнь, скорее всего, не проявит себя, а человек будет всю жизнь носить в себе генетическую поломку, даже не подозревая об этом.
Проблема в том, что, если два человека с одинаковой мутацией встретятся, вероятность рождения больного ребенка составит 25 %, а вероятность, что ребенок будет здоровым носителем болезни, — 50 %.
По статистике, человек в среднем имеет от семи до двадцати генетических мутаций, связанных с моногенными заболевания и не проявляющих себя клинически, поэтому обследоваться желательно всем парам, которые планируют ребенка, говорит врач и основатель Центра генетики и репродуктивной медицины Genetico Артур Исаев.
Если вовремя сделать генетические тесты, можно избежать множества наследственных заболеваний, таких как, например, муковисцидоз. В случае если анализы покажут достаточно высокую вероятность какого-либо генетического заболевания, семья может прибегнуть к одному из двух путей решения проблемы — либо к ведению беременности под более тщательным контролем врачей, с пренатальными скринингами, направленными на поиск конкретной проблемы, либо к ЭКО (экстракорпоральному оплодотворению). При ЭКО существует возможность провести генетическое исследование непосредственно самого эмбриона перед подсадкой.
Скрининги во время беременности
Генетическая мутация может произойти у ребенка совершенно случайно или под воздействием внешних факторов, даже если оба родителя не являются носителями или клинически здоровы. Поэтому обследования до наступления беременности, к сожалению, недостаточно. Приходится находиться под постоянным контролем специалистов на протяжении всех девяти месяцев.
Каждая беременная женщина, стоящая на учете в женской консультации, проходит через три скрининга, каждый из которых включает в себя УЗИ и анализ крови.
Первый оптимально делать на 12-й или 13-й неделе. Во время этого скрининга оценивают размеры плода, а также уровень b-ХГЧ (хорионического гонадотропина человека) и PAPP-A (протеина А-плазмы). Эти факторы оцениваются только вместе. УЗИ второго скрининга проводят в период с 16-й по 20-ю неделю, и врач оценивает такие показатели, как объем околоплодных вод, место крепления пуповины, положение плода и состояние внутренних органов. Анализ крови определяет множество показателей, позволяющих сделать выводы о возможности выкидыша, аномалий развития или генетических патологий. Третий скрининг проводится между 30-й и 34-й неделями, и по его итогам принимают решение о необходимости кесарева сечения.
По словам Артура Исаева, пренатальные скрининги необходимы в период беременности, однако они не всегда дают однозначную информацию. В случае если врач подозревает у плода повышенный риск того или иного заболевания, назначаются инвазивные обследования.
Инвазивные методы диагностики
Инвазивные методы диагностики применяют в случае сочетания негативных факторов. Например, если скрининг показал повышенный риск развития патологии, на который накладывается фактор возраста женщины или случаи генетических патологий в семье.
К инвазивным методам относят:
- Амниоцентез (исследование амниотической жидкости, то есть околоплодных вод); биопсию хориона (исследование клеток, из которых формируется плацента);
- Кордоцентез (исследование пуповинной крови) и многое другое.
Хотя риски при проведении данных анализов выше, чем при неинвазивных методах, высокоточное оборудование и хорошо обученные врачи делают даже эти риски незначительными — всего около 0,5 % женщин испытывают серьезные осложнения после таких исследований.
В России инвазивную диагностику проводят тем женщинам, которые по сумме факторов анамнеза и результатов скрининга имеют высокую вероятность родить больного ребенка.
Возможности эхографии в диагностике аутоиммунного гепатита у детей
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Введение
В настоящее время в связи с развитием высокоразрешающей ультразвуковой диагностической аппаратуры значительно повышается интерес к возможностям эхографии в дифференциальной диагностике диффузных болезней печени. В работах ряда авторов [l,2] представлены эхо- и доплерографические критерии оценки печени при вирусных гепатитах и циррозах печени. Однако в России в структуре хронических гепатитов у детей 2% приходится на долю аутоиммунного гепатита, что составляет значительную величину и привлекает активное внимание гепатологов [3].
Аутоиммунный гепатит - прогрессирующее гепатоцеллюлярное воспаление неясной этиологии, характеризующееся наличием перипортального гепатита, гипергаммаглобулинемии, печеночноассоциированных сывороточных аутоантител и положительным ответом на иммуносупрессивную терапию [4]. Девочки и женщины составляют 75% больных [5]. Этиология аутоиммунного гепатита неизвестна, а патогенез изучен недостаточно. В качестве возможных пусковых факторов возникновения заболевания обсуждается роль вирусов Эпштейна-Барр, гепатитов А и С, а также лекарств. Не исключается возможность возникновения аутоиммунного гепатита вследствие первично обусловленного нарушения иммунного ответа, когда появление "запрещенных клонов" аутореактивных клеток происходит без воздействия триггерных факторов [6]. Обязательным для постановки диагноза аутоиммунного гепатита является наличие аутоантител в сыворотке крови: антинуклеарных (ANA), и/или антигладкомышечных (SМА) антител при аутоиммунном гепатите I типа; аутоантител к микросомам печени и почек (anti-LKM I) при аутоиммунном гепатите II типа, гипергаммаглобулинемии, а также отсутствие признаков вирусных и метаболических болезней печени [7]. В исходе аутоиммунного гепатита не редко формируется цирроз печени в относительно короткие сроки после первой манифестации процесса. У детей цирроз печени встречается в 74% при аутоиммунном гепатите I типа и в 44% случаев при аутоиммунном гепатите II типа [5]. У взрослых ситуация об ратная: при аутоиммунном гепатите II типа чаще развивается цирроз печени, чем при аутоиммунном гепатите I типа (82% против 43%, со ответственно) [6].
Учитывая актуальность проблемы и отсутствие в доступной литературе данных о возможностях ультразвуковой диагностики в распознавании аутоиммунного гепатита, целью работы явилось определение эхографических изменений печени при аутоиммунном гепатите у детей.
Материалы и методы
Наблюдались 36 детей (31 девочка и 5 мальчиков) в возрасте от 7 до 15 лет с диагнозом аутоиммунный гепатит. Средняя продолжительность наблюдения 31,4±19,8 месяцев. К моменту поступления продолжительность заболевания была от 1 месяца до 8 лет.
Всем детям проводили лабораторное об следование, включающее общий анализ крови, биохимический анализ крови, определение содержания иммуноглобулинов (Ig) классов А, М, G, маркеров вирусных гепатитов А, В, С (anti-HAV IgM, HbsAg, anti-HBc, anti-HBe, anti-HBs, anti-HCV) методом ИФА, ДНК вируса гепатита В и РНК вируса гепатита С методом полимеразной цепной реакции (ПЦР). Были выявлены нарушения пигментного обмена, признаки цитолиза и изменений иммунологической активности. У 33 пациентов (91,7%) диагностирован аутоиммунный гепатит I типа, характеризующийся наличием ANA и SMA, но отсутствием anti-LKM I в сыворотке крови и у 3 (8,3%) детей - аутоиммунный гепатит II типа.
Пункционная биопсия печени проведена у 27 из 36 больных. Морфологическое исследование ткани печени свидетельствовало о наличии хронического гепатита у 8 больных; признаки цирроза печени были выявлены у 19 больных. У 9 больных в связи с отказом от проведения пункционной биопсии печени формирование цирроза печени было установлено на основании клинико-лабораторных данных. Таким образом, у 28 из 36 детей с аутоиммунным гепатитом был цирроз печени. Эндоскопическое исследование при поступлении в клинику выявило варикозное расширение вен пищевода 12 степени у 19 пациентов с циррозом печени и еще у 6 больных через 1-1,5 года с момента начала наблюдения.
Контрольную группу составили 25 здоровых сверстников. В качестве группы сравнения обследовано 56 детей с вирусным гепатитом В и 42 ребенка с вирусным гепатитом С в возрасте от 7 до 15 лет. Всем проводили ультразвуковое исследование органов брюшной полости и забрюшинного пространства. Использовались датчики частотой 3,5-5,0 МГц. Выполнялась обще принятая методика эхографической оценки печени и кровотока в цветовом и импульсном режимах. Исследование печени включало измерение левой доли (переднезадний, медиально-латеральный и верхненижний размеры), правой доли (верхненижний размер).
Доплерографическое исследование сосудов портальной системы и чревного ствола проводилось по воротной вене - в области ствола, по печеночным и селезеночным артериям - в месте их выхода из чревного ствола, по селезеночной вене - в области ворот селезенки, по средней печеночной вене - отступая 2-3 см от места ее впадения в нижнюю полую вену. Основными критериями оценки кровотока являлись показатели объемного кровотока, индекса резистентности по артериям и пульсового индекса по печеночной вене. Полученные результаты обрабатывались статистически по общепринятым методикам вариационнй статистики. Достоверность различий изучаемых показателей определяли по критерию Стьюдента.
Результаты исследований
У всех детей с аутоиммунным гепатитом на стадии хронического гепатита наблюдалось диффузное увеличение печени. Четкой зависимости от активности процесса или давности заболевания не прослеживалось. Увеличение правой доли составило в среднем 20%, а левой доли - 8% по верхненижнему и 20% по медиально-латеральному размерам по сравнению с нормальными возрастными показателями. Контур печени был ровный, но с выраженной дольчатостью. Углы долей соответствовали нормальному контуру печени. Отмечалась гиперэхогенность паренхимы. Неоднородность ее была обусловлена гипер- и гипоэхогенными участками сред них размеров (3-5 мм), гиперэхогенной тяжистостью по ходу ветвей воротной вены, что создавало впечатление сетчатости печеночного рисунка (рис. 1 а). Визуализировались единичные печеночные вены с небольшой протяженностью от места впадения в нижнюю подую вену, тонкие, горизонтально направленные, с ровным контуром (косой срез печени). Ослабления ультразвука не наблюдалось, и паренхима печени хорошо прослеживалась до заднего контура. Диаметр ствола воротной вены оставался в пределах допустимых значений. Имела место гиперэхогенность стенок как ствола, так и мелких ветвей воротной вены. У одного ребенка определялось не большое раскрытие пупочной вены (до 2 мм) без признаков кровотока в ней.
Лучевая диагностика поражений печени, желчного пузыря и поджелудочной железы при муковисцидозе у детей
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Муковисцидоз - тяжелое моногенное заболевание, обусловленное мутацией гена (7q31), регулирующего синтез белка, - трансмембранного канала транспорта хлора. Итогом данного нарушения является избыточное поступление в клетки натрия, играющего роль насоса. Внеклеточный секрет сгущается, нарушается его транспорт, возникает обструкция протоков всех внешнесекреторных желез. Это приводит к реактивному воспалению, наслоению вторичной флоры, развитию фиброза. Хотя течение муковисцидоза определяется в значительной мере поражением бронхолегочной системы, но на состоянии больных сказываются и нарушения со стороны желудочно-кишечного тракта, гепатобилиарной системы. Так, 5-10% больных муковисцидозом погибают от поражения печени [4]. Неинвазивная интраскопическая оценка состояния печени, желчного пузыря, поджелудочной железы существенно определяет тактику лечения пациентов.
Обследовано 210 больных в возрасте от 3 месяцев до 18,5 лет. Наряду с полным клиническим исследованием в динамике выполнены обзорные рентгенограммы брюшной полости, эхограммы поджелудочной железы, печени, желчного пузыря. В ряде случаев проведена рентгеновская компьютерная томография (КТ).
Методики визуализации были стандартными [1; 11].
ЭХО-визуализация поджелудочной железы иногда была затруднена метеоризмом. Степень его выраженности в целом соответствовала гастроинтестинальным расстройствам у ребенка и значительно уменьшалась при назначении адекватной дозы заместительных панкреатических ферментов.
Эхографически изменения печени, желчного пузыря и поджелудочной железы обнаруживались у всех больных, но степень их выраженности варьировала. Обычно регистрировалось уплотнение паренхимы печени, увеличение ее размеров. У 23 детей (10,9%) эти изменения трактовались как начинающийся цирроз. Еще у 21 ребенка (10,2%) можно было говорить об истинном циррозе печени, что проявлялось на эхограмме значительным уплотнением паренхимы с утерей обычной архитектоники, уменьшением просвета внутрипеченочных сосудов, признаками портальной гипертензии (рис.1).
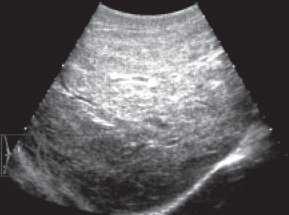
Рис. 1. Печень ребенка с муковисцидозом. Паренхима плотная, сосудистый рисунок обеднен.
Изменения желчного пузыря также свойственны всем детям с муковисцидозом. Это выглядело как уплотнение стенок желчного пузыря, появление сладж-феномена. У 5 пациентов (2,4%) обнаружен холелитиаз (рис.2). В 1,3% случаев наблюдался микропузырь, а в 7% он полностью отсутствовал и был представлен в виде соединительнотканного тяжа; также имели место разнообразные деформации желчного пузыря (25%).
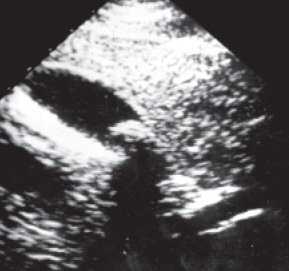
Рис. 2. Желчный пузырь с большим конкрементом в пришеечном отделе.
Поджелудочная железа была уплотнена (рис. 3). Тяжелое течение муковисцидоза приводило к ее тотальному перерождению, при котором орган выглядел как плотный грубый тяж. У 15 больных (7,1%) размеры железы были уменьшены. Вирсунгов проток прослеживался с трудом.
Рис. 3. Уплотненная и бугристая поджелудочная железа при муковисцидозе.
При традиционной обзорной рентгенографии изменения органов гепатобилиопанкреатической системы выявляются сравнительно редко и только в случаях кальцификации [9, 10, 12]. Но конкременты в желчном пузыре у детей с муковисцидозом лишь в 58,8% случаев рентгенпозитивны [5]. Кальцинаты формируются в местах воспаления паренхимы поджелудочной железы или аневризматически расширенных участках вирсунгова протока; могут быть локальными или диффузными. Эта картина присуща пациентам с выраженной панкреатической недостаточностью. При современном лечении адекватными дозами панкреатических ферментов указанные изменения практически не встречаются.
Значительно большие изменения выявляются при эхогграфии [8]. Желчный пузырь может содержать камни. Частота холелитиаза достигает 20% [13]. В наших наблюдениях камни желчного пузыря встречались существенно реже (2,4%), чем в публикациях прежних лет, что обусловлено внедрением в клиническую практику холелитической терапии [2, 15].
Печень уплотнена вплоть до феномена аттенуации ультразвукового сигнала. Плотность печени в определенной степени отражает тяжесть течения муковисцидоза. При формировании так называемого легочного сердца сосуды печени расширяются. Как отражение развивающего цирроза появляется нерегулярность края печени, расширение воротной и селезеночной вен, увеличение селезенки и, наконец, асцит. Результаты эхографии хорошо коррелируют с радионуклидными тестами [14].
Частота изменений поджелудочной железы колеблется от 80 до 95% и варьирует от застоя секрета в мелких протоках до полной обструкции крупных протоков с жировой дистрофией паренхимы, фиброзом, развитием кальцинатов [12]. Поражение поджелудочной железы при муковисцидозе коррелирует с определенными мутациями и мужской инфертильностью [7]. Эхографически поджелудочная железа во всех случаях уплотнена. Плотность ее может быть столь высокой, что возникают большие сложности в дифференцировке органа от окружающих тканей [6].
Вначале она увеличена в размерах. Как отражение задержки экзокринного секрета неравномерно расширяется вирсунгов проток, появляются микрокисты в паренхиме [10].
Несмотря на то, что признаки панкреатита всегда сопутствуют нарушениям эвакуации секрета, клинически и/или эхографически выраженных форм воспаления поджелудочной железы мы ни разу не встретили. В итоге прогрессирующего фиброза железы ее размеры уменьшаются [16]. Обычно радиологическое обследование поджелудочной железы у пациентов с муковисцидозом начинается и завершается на этапе эхографии.
Компьютерную томографию целесообразно применять только в диагностически неясных случаях или для выявления клинически значимых осложнений. При этом выявляется уменьшение поджелудочной железы в размерах, ее уплотнение и признаки жировой дистрофии, микрокальцинаты и микрокисты, расширение вирсунгова протока [8].
Наиболее выраженные изменения печени, желчного пузыря и поджелудочной железы свойственны детям с умеренной легочной симптоматикой и преимущественно кишечной формой заболевания. Циррозы очень редко встречаются у детей младшего возраста, пик их приходится на подростковый возраст [3].
Литература
УЗИ сканер HS60
Актуальные вопросы диагностики муковисцидоза
Е.И. Кондратьева, д. м. н., профессор, В.Д. Шерман, к. м. н., Н.И. Капранов, д. м. н., профессор, Н.Ю. Каширская, д. м. н., профессор, НКО муковисцидоза ФГБНУ «МГНЦ», ГБУЗ «ДГКБ № 13 им. Н.Ф. Филатова ДЗМ», г. Москва
Муковисцидоз (МВ), или кистозный фиброз (cysticfibrosis), - одно из наиболее частых моногенных наследственных заболеваний с полиорганной патологией, резко сокращающее продолжительность и качество жизни пациентов без адекватного комплексного лечения в течение всей жизни. МВ распространен среди населения всей Земли, но наиболее часто поражает европеоидов: в среднем с частотой 1 на 2500-4500 новорожденных. Еще совсем недавно больные муковисцидозом умирали в раннем детском возрасте или даже на первом году жизни от пневмонии и истощения, обусловленными мальабсорбцией.
Ключевые слова: диагностика, генетика, мутации, неонатальный скрининг, потовая проба, эластаза кала.
Key words: cystic fibrosis, diagnosis, genetics, mutation, newborn screening, sweat test, fecal elastase.
Болезнь прежде всего характеризуется повышенной продукцией вязкого бронхиального секрета, частыми легочными инфекциями и обструкцией дыхательных путей. По мере прогрессирования легочной болезни образуются участки ателектазов, развивается эмфизема, постепенно разрушается паренхима легких с развитием бронхоэктазов и участков пневмосклероза, а больной имеет высокий риск погибнуть от легочно-сердечной недостаточности. В финальной стадии заболевания пересадка комплекса «сердце-легкие» остается для больного единственной надеждой. Помимо бронхолегочной системы у большинства больных муковисцидозом поражается поджелудочная железа, при этом это происходит внутриутробно. Недостаточность панкреатических ферментов обусловливает нарушение всасывания жиров и белков, развитие нутритивной недостаточности. В результате больные отстают в росте и страдают гипотрофией. Продукция инсулина также может быть нарушена, что ведет к развитию диабета. К частым осложнениям течения муковисцидоза относят остеопороз, а также жировой гепатоз с переходом в цирроз. При наличии «мягкой» мутации клинические проявления развиваются постепенно, преобладают моносимптомы, диагноз «муковисцидоз» устанавливается поздно или случайно.
Своевременная диагностика муковисцидоза, обеспечивающая в большинстве случаев раннее начало терапии, в том числе на доклиническом этапе, улучшает прогноз заболевания, повышает эффективность лечения, позволяет предупредить развитие тяжелых осложнений, значительного отставания в физическом развитии, а в ряде случаев и необратимых изменений в легких. Ранняя диагностика позволяет семье вовремя решить необходимые вопросы, связанные с рождением здорового ребенка (генетическое консультирование, пренатальная диагностика МВ в последующие беременности).
Диагностика делится на:
1) пренатальную диагностику;
2) диагностику по неонатальному скринингу (до клинических проявлений или при их дебюте);
3) диагностику при клинических проявлениях:
4) диагностику среди родственников больных.
Клинические признаки
1. Диагностика классической формы МВ обычно не представляет сложностей. Классический фенотип больного является результатом наличия двух мутантных копий гена муковисцидозного трансмембранного регулятора (CFTR) и характеризуется хронической бактериальной инфекцией дыхательных путей и придаточных пазух носа, стеатореей из-за внешнесекреторной недостаточности поджелудочной железы, мужским бесплодием из-за обструктивной азооспермии, а также повышенной концентрацией хлоридов потовой жидкости.
2. Проблемы диагностики МВ, как правило, связаны с фенотипическим разнообразием его форм, обусловленным генетическим полимор-
В ряде случаев атипичного течения МВ возможна его диагностика во взрослом возрасте. Как правило, в этой группе больных отмечается более мягкое течение болезни в связи с сохранностью функции поджелудочной железы и нетяжелым поражением органов дыхания.
В абсолютном большинстве случаев МВ может быть диагностирован в раннем детском возрасте (в 90% случаев - на первом году жизни). К сожалению, нередки случаи диагностики МВ у взрослых с классическим фенотипом.
Диагностика МВ у носителей «мягких» генотипов (актуально для детей, рожденных до 2006-2007 гг., и взрослых):
В настоящее время выделяют несколько групп риска по МВ.
Основной группой риска по заболеванию в РФ в настоящее время являются новорожденные с неонатальной гипертрипсиногенемией. Учитывая возможность получения ложноотрицательных результатов неонатального скрининга, а также то обстоятельство, что в РФ неонатальный скрининг на МВ проводится с 2006-2007 гг., не теряет своей актуальности анализ групп риска, включающих пациентов с патологией желудочно-кишечного тракта, бронхолегочными нарушениями, патологией других органов и родственников больных МВ (табл. 1).
Таблица 1.
Группы риска для дифференциальной диагностики муковисцидоза
| I. Бронхолегочные нарушения |
| 1. Повторные и рецидивирующие пневмонии с затяжным течением, особенно двусторонние 2. Бронхиальная астма, рефрактерная к традиционной терапии 3. Рецидивирующие бронхиты, бронхиолиты, особенно с высевом Ps. aeruginosa 4. Двусторонние бронхоэктазы |
| II. Изменения со стороны желудочно-кишечного тракта |
| 1. Синдром нарушенного кишечного всасывания неясного генеза 2. Мекониальный илеус и его эквиваленты 3. Гиперэхогенность кишечника плода 4. Желтуха обструктивного типа у новорожденных с затяжным течением 5. Цирроз печени 6. Сахарный диабет 7. Гастроэзофагеальный рефлюкс 8. Выпадение прямой кишки |
| III. Патология со стороны других органов |
| 1. Нарушение роста и развития 2. Задержка полового развития 3. Мужское бесплодие 4. Хронический синусит 5. Полипы носа 6. Электролитные нарушения |
| IV. Члены семей больных муковисцидозом |
Среди клинических проявлений, характерных для МВ, можно выделить высоко-и менее специфичные (табл. 2). Состояния, представленные в левой колонке таблицы, в абсолютном большинстве случаев встречаются у больных МВ. Причиной состояний из правой колонки могут быть другие заболевания, например первичная цилиарная дискинезия, гуморальный иммунодефицит и т. д.
Таблица 2.
Клинические проявления, характерные для МВ
В таблице 3 представлены особенности проявлений МВ в разные возрастные периоды. Знание этих особенностей помогает специалистам, наблюдающим пациента с теми или иными симптомами, включить МВ в перечень заболеваний для дифференциальной диагностики. Особенно это касается детей раннего возраста, когда клиническая картина еще может быть неполной, но на себя будут обращать внимание некоторые проявления, например мекониальный илеус при рождении или синдром потери солей, не имеющий связи с патологией почек. Диагноз в этом случае может быть установлен еще до рождения ребенка. В то же время этот признак не является высоко специфичным для МВ, может быть транзиторным явлением, а также связанным с другими патологическими состояниями.
Таблица 3.
Клинические особенности проявлений МВ в различные возрастные периоды
Диагностические критерии МВ
Для решения проблем диагностики МВ, в том числе и его атипичных форм, были разработаны критерии, согласно которым обязательным для МВ является наличие характерного клинического синдрома плюс доказательство какого-либо нарушения функции хлорного канала.
Учитывая все научные достижения в понимании природы муковисцидоза и МВ-зависимых заболеваний за последние 10 лет, в 2013 году группа экспертов Европейского общества муковисцидоза (European Cystic Fibrosis Society) под руководством Carlo Castellani подготовила новые стандарты диагностики в редакции Alan R. Smyth и Scott Bell (схема).
Схема.
Диагностические критерии муковисцидоза ECFS 2013
| Положительная потовая проба и/или две мутации МВТР, вызывающие МВ (согласно базе CFTR-2) | И | Неонатальная гипертрипсиногенемия или характерные клинические проявления, такие как диффузные бронхоэктазы, высев из мокроты значимой для МВ патогенной микрофлоры (особенно синегнойной палочки), экзокринная панкреатическая недостаточность, синдром потери солей, обструктивная азооспермия |
Неонатальный скрининг
Проводится на основании Методических рекомендаций по проведению неонатального скрининга в РФ с использованием Европейских рекомендаций по неонатальному скринингу. 90% новорожденных без клинических проявлений муковисцидоза диагноз может быть установлен на основании скрининга в возрасте до 6 недель. В 5-10% случаев возникают трудности с диагностикой муковисцидоза (Cystic Fibrosis Foundation Patient Registry, 2005 Annual Data Report to the Center Directors. Bethesda, MD: CFF).
Проблемы неонатального скрининга:
Потовая проба
Показания:
1. При положительном результате неонатального скрининга (двукратном повышении уровня иммунореактивного трипсиногена в крови в течение первого месяца жизни ребенка).
2. При наличии у пациента каких-либо характерных клинических проявлений МВ.
3. Случаи МВ в семье.
Потовая проба является надежным методом диагностики МВ у 98% больных. Исследование можно проводить всем детям через 48 часов после рождения, хотя у новорожденных могут быть проблемы с набором пота. Несмотря на то, что «золотым стандартом» диагностики МВ считается количественное определение хлоридов в потовой жидкости (классический метод Гибсона - Кука), метод определения проводимости на аппаратах «Макродакт» и «Нанодакт» («Вескор», США) показал хорошую с ним корреляцию в многочисленных исследованиях.
Оценка результата
При положительном результате потовой пробы (хлориды > 60 ммоль/л при классическом методе Гибсона - Кука и/или проводимость > 80 ммоль/л NaCl) диагноз подтверждается.
Генетическое исследование
Генетическое исследование проводится после потовой пробы. Однако в связи с ограниченными возможностями ДНК-диагностики в России данный метод не является обязательным, однако применяется с исследовательской целью и для окончательного подтверждения диагноза.
На первом этапе ДНК-обследования наиболее часто используется панель, включающая 28 мутаций, как наиболее частых в мире, так и специфичных для России: F508del, CFTRdele2,3(21kb), 3849+10kbC>T, W1282X, 2143delT, 2184insA, 1677delTA, N1303K, G542X, R334W, E92K, L138ins, 394delTT, 3821delT, S1196X, 2789+5G>A, G85E, 2183AA>G, 604insA, 621+1G>T, R117H, R347P, R553X, 3667insTCAA, G551D, I507del, 1717-1G>A, 2184delA. По данным лаборатории генетической эпидемиологии ФГБУ «Медико-генетический научный центр» (МГНЦ) РАМН, при использовании данной панели удается обнаружить лишь около 82,5% мутантных аллелей у больных МВ. В случае когда при положительной потовой пробе не будет найдено ни одной мутации гена (что само по себе маловероятно), может потребоваться секвенирование гена МВ, позволяющее идентифицировать примерно 98% мутаций в гене CFTR.
Рекомендации:
1. На основании данных национального регистра больных МВ по ДНК-диагностике гена CFTR установлены особенности характера и частоты мутаций в регионах страны. На основе данных регистра рекомендуется создание региональных рекомендаций по определению мутаций со ссылкой на регистр (последнюю версию).
2. Отсутствие мутациий без проведения секвенирования - недостаточно для исключения МВ.
3. Некоторые мутации МВТР (3849+10 kb C>T) ассоциированы с нормальным или пограничным результатом потового теста.
4. «Мягкие» мутации характеризуются поздним дебютом заболевания, пограничным значением потовых проб, выявляются чаще при секвенировании.
5. Пациенты с пограничными результатами потовых проб (хлориды 30-60 ммоль/л и/или проводимость 50-80 ммоль/л), единственной мутацией гена представляют реальные трудности для диагностики.
Для диагностики МВ или его исключения при пограничных результатах пробы необходимо:
В европейских странах для подтверждения дефекта ионного транспорта применяется метод определения разности назальных потенциалов или измерение электрического тока в биоптате кишки, отражающие нарушение функции хлорного канала. Оба метода основаны на электрическом характере транспорта ионов и являются высокоинформативными для диагностики МВ.
Диагностика панкреатической недостаточности включает:
У больных МВ показатель эластазы может снижаться в течение первых лет жизни, поэтому определяется в динамике. Низкий уровень панкреатической эластазы расценивается как один из признаков МВ. Приблизительно 1% пациентов с МВ имеет пограничный результат потового теста в комплексе с сохранной функцией поджелудочной железы и хроническим бронхитом.
Диагностика хронического бронхолегочного процесса:
В качестве дополнительных диагностических маркеров могут быть использованы азооспермия в постпубертатном возрасте, идентификация МВ-ассоциированных патогенов из респираторного тракта, рентгенологические признаки синусита.
ЛИТЕРАТУРА
Аномалии и патологии органов пищеварительной системы плода, выявляемые на УЗИ
Патологии органов пищеварительной системы встречаются у плода нередко как самостоятельно, так и в комплексе с другими аномалиями внутренних органов. На них приходится до 21% пороков у новорождённых и 34% случаев младенческой смертности.

Причины нарушений формирования органов ЖКТ у плода, статистика
Аномалии строения органов ЖКТ связаны с нарушением эмбриогенеза на стадии 4-8 недель беременности, когда идёт образование отверстия пищеварительной трубки. Изначально она заканчивается с обоих концов, однако к концу 8 недели происходит образование каналов, а слизистый эпителий закрывает просвет кишечной трубки.
Среди наиболее часто встречающихся патологий можно выделить стенозы (сужения или растяжки стенок) или атрезии (сращивания).
Больше всего страдает 12-перстная кишка, что связано с особенностями её эмбриогенеза. 1/2 случаев сопровождается пороками других внутренних органов — сердца, сосудов, прямой кишки, печени, желудка. Некоторые случаи настолько тяжёлые, что малышу при жизни придётся сделать множество операций, и они не будут являться гарантом его нормального существования.
Аномалии органов ЖКТ на УЗИ видны на сроке 11 недель. Ультразвуковая диагностика не является 100% гарантией того, что у малыша будут серьёзные отклонения, поэтому её результаты являются основанием для более детального обследования женщины.
Беременной делают кариотипирование на выявление хромосомных нарушений. Также она проходит анализ амниотической жидкости, и по результатам обследования (если они плохие и диагноз подтвердится) ей рекомендуют прервать беременность
Патологии кишечника
К аномалиям 12-перстной кишки относятся:
Атрезия. Встречается в 1 случае из 10 000. Заключается в полной непроходимости кишечника вследствие патологического сращения стенок органа. В 37% случаев сопровождается другими аномалиями — конской стопой, слиянием шейных позвонков, несимметричным положением рёбер и пр.
Ещё в 2% случаев атрезия кишечника сопровождается атрезией пищевода, гигромой заднего прохода, незавершённом поворотом желудка и т.п. В основном это типично для плода с хромосомными нарушениями, в частности с трисомией по 21 хромосоме.
90% беременностей заканчиваются выкидышем или замиранием развития в течение первых 2-х триместров. Остальные 10% беременностей с патологией 12-перстной кишки завершаются рождением детей, страдающих различными пороками: у 31% имеется обструкция дыхательных путей (закупорка инородным телом вроде кисты, опухоли), 24% — парез лицевого нерва (нарушением функциональности мимических мышц).
Только 1% малышей ведёт относительно нормальный образ жизни после проведения сложнейшей операции при условии отсутствия хромосомных нарушений.
Внутрикишечная мембрана . Это плёнка, перекрывающая просвет кишечника, появившаяся в результате нарушения разрастания внутреннего слоя 12-перстной кишки. Встречается в 1 случае из 40 000. На УЗИ визуализируется как слабоэхогенное образование. Просвет кишечника при этом сужен на несколько миллиметров, контуры слизистой оболочки чёткие.
Патология не является показанием для прерывания беременности. В зависимости от расположения мембраны она удаляется после рождения малыша методом дуоденотомии (вскрытием просвета кишечника с последующим удалением мембраны).
Мальротация. Заключается в нарушении нормального вращения и фиксации 12-перстной кишки. Если средняя кишка совершила полный оборот на кровоснобжающей ножке, это может привести к прекращению кровоснабжения и отмиранию средней кишки.
Пренатальный диагноз можно поставить с 24 недели, причём в 61,5% беременностей наблюдалось многоводие. На УЗИ выявляется анэхогенный double-buble 3 следствие расширение кишки и желудка.
Хотя даже незначительное расширение на сроке 16-22 недели должно вызывать тревогу. В норме 12-перстная кишка видна на УЗИ только с 24 недели. Дополнительно в 62% случаев выявляются у плода пороки развития сердца, мочеполовой системы, других органов ЖКТ. После исследования на кариотип в 67% случаев выявляются хромосомные отклонения, из которых на 1 месте стоит синдром Дауна.
Стеноз. Выявляется у 30% новорождённых, в основном у мальчиков. Это частичная непроходимость 12-перстного кишечника, локализованная в одном месте. В основном наблюдается в верхних отделах и сопровождается аномалиями поджелудочной железы. На УЗИ отчётливо виден на сроке от 24 недель при использовании допплеровского метода в изучении кровотока кишечника.
Стеноз успешно устраняется и имеет более благоприятные перспективы, чем атрезия. Не требует прерывания беременности.
Megaduodenum . Это увеличение размеров 12-перстной кишки до размеров, иногда превышающих размеры желудка. Встречается в 1 случае из 7500. Может являться следствием кольцевидной поджелудочной железы, когда головка органа кольцом окручивает кишечник, либо атрезии или стеноза 12-перстной кишки. На УЗИ диагностируется на 24 неделе. Верхняя часть брюшной полости вздута очень сильно, в то время как нижняя часть впалая.
Гиперэхогенность кишечника. Чем выше плотность исследуемой ткани, тем больше будет эхогенность. На УЗИ эхогенность кишечника плода должна быть ниже эхогенности костей, но выше, чем у таких пористых органов, как печень, лёгкие или почки. Когда эхогенность кишечника равна по плотности эхогенности костной ткани, говорят о гиперэхогенности.
Патология выявляется не ранее чем на 16 неделе. Она свидетельствует об отклонении в развитии плода. Повышенная эхогенность случается при преждевременном старении плаценты, внутренних инфекциях, несоответствии размеров плода сроку беременности, эндокринном заболевании муковисцидозе, кишечной непроходимости (стенозе).
УЗИ следует пройти в нескольких разных клиниках во избежание ошибки специалиста. Только при окончательном подтверждении диагноза женщину отправляют на более детальное обследование — биохимический скрининг, анализ на ТОРЧ-инфекции, кордоцентез и анализ амниотической жидкости. Окончательный диагноз ставится на основе комплексного анализа, а не только УЗИ обследования.
Дивертикулы (кисты). Они имеют разные названия — дупликационные кисты, удвоенная кишка, энтерогенная дивертикула. Заключается в отпочковании от стенок кишки образования в эмбриональный период. Образуются не только в кишечнике, но и по всему ЖКТ от гортани до ануса.
Считается, что причиной раздвоения стенок служит нарушение кровоснабжения пищеварительной трубки плода. Кисты на УЗИ гипоэхогенны, бывают как однокамерными, так и многокамерными. Стенки кист двухслойны и имеют повышенную перистальтику, имеют гиперэхогенность, если содержат кровь.
Визуализируются кисты кишечника на 2 триместре и часто сочетаются с другими патологиями. Точность визуализации кист кишечника у плода составляет 66,6%. Данная патология не является показанием к прерыванию беременности, потому что в неосложнённых случаях оперируется и устраняется.
Аномалия формы, размера, положения и подвижности кишечника. Ко 2 триместру беременности должен обратиться вокруг брыжеечной артерии против часовой стрелки на 2700. При нарушении эмбриогенеза можно выделить следующие патологии: отсутствие поворота, несостоявшийся поворот и неполный поворот.
На УЗИ при аномалиях поворота кишечника у плода отмечается многоводие и расширение петель кишечника без перистальтики. В случае перфорации кишечника возникает микониевый перитонит — заражение вследствие выхода наружу содержимого кишечника. Обнаруживается патология поздно, только на 3 триместре, что требует немедленной подготовки женщины к родоразрешению.
Патологии печени у плода
Печень визуализируется на ультразвуковом обследовании уже на 1-м скрининге. На сроке 11-14 недель можно увидеть в верхней части брюшной полости гипоэхогенное образование в виде месяца. К 25 неделе эхогенность повышается и становится такой же, как у кишечника, а перед родами превышает по плотности кишечник.
Очень важна оценка состояния кровотока печени. Вена пуповины плода входит в печень, во 2 триместре визуализируется воротная вена. Её диаметр в норме равен 2-3 мм, а к родам увеличивается до 10-11 мм. Желчные протоки в норме визуализироваться у плода не должны.
Одна из часто встречающихся патологий плода — гепатомегалия печени — увеличение размеров органа. Для выявления аномалии применяется 3D датчик, способный визуализировать срез в продольном, поперечном и вертикальном срезах. Также можно увидеть увеличение размеров печени и на обычном УЗИ аппарате по выступающему животику, охват которого значительно превышает норму.
Одновременно с этим на экране видны различные гиперэхогенные включения. Как правило, аномалия дополняется увеличением селезёнки.
Среди причин, приводящих к увеличению размеров органов пищеварения, выделяют скрытые инфекции (токсоплазмоз, сифилис, ветрянка), а также хромосомные мутации (синдромы Дауна, Зельвегера, Беквета-Видемана).
- При синдроме Зельвегера видны аномалии конечностей, искажение грудной клетки, кисты почек. Анализ амниотических вод выявляет нехватку дигидрокси-ацетон-фосфат-ацил-трансферазы.
- Ветряная оспа, герпес, цитомегаловирус вызывают кальцинирование тромбов печёночной вены, что отражается на экране УЗИ монитора гиперэхогенными кальцинатами круглой формы. Также они образуются при мекониевом перитоните — отравлении содержимым кишечника плода, которое попадает в результате повреждения стенок.
В 87,5% случаев причиной увеличения печени и образования кальцификатов являются внутриутробные инфекции. Также у большинства беременных диагностируется гиперэхогенный кишечник, изменение структуры плаценты, а также большие размеры селезёнки. Патология на 3 триместре возникает в случае резус-конфликта между матерью и ребёнком.
Также не исключены и метаболические нарушения. Увеличение печени встречается при галактоземии (генетическое нарушением углеводного обмена, из-за которого галактоза не преобразуется в глюкозу), трипсинемии (отсутствия выработки пищеварительного гормона трипсина), метилмалоновой ацидемии (отсутствии превращения D-метилмалоновой кислоты в янтарную кислоту), нарушениях выделения мочевины.
Одиночные гиперэхогенные включения большого размера гораздо лучше, чем множественные разрозненные образования в сочетании с другими патологиями. Практически в 100% случаев гиперэхогенные включения большого размера устраняются до рождения малыша или в первый год жизни.
В некоторых случаях порок органов брюшной полости ставится ошибочно. Такое бывает, если брюшная полость малыша сдавливается стенками матки, патологиях миометрия или других факторах.
На экране монитора видна псевдоомфалоцеле — ошибочная визуализация выхода органов брюшной полости за пределы брюшной стенки. Иногда УЗИ «не видит» значительных пороков. Так, грыжа по форме и эхоструктуре напоминает петли кишечника, в этом плане большую помощь оказывает допплерометрия, позволяющая увидеть кровоток.
Наша клиника имеет прекрасный 4D аппарат, оснащённый всеми современными возможностями, исключающими ошибки диагностики.
Желудок
На 16-20 неделе визуализируется желудок плода как анэхогенное образование круглой или овальной формы в верхних отделах брюшной полости. Если желудок не наполнен амниотическими водами, то можно говорить об атрезии пищевода (полном отсутствии просвета).
При диафрагмальной грыже желудок смещён и также не может быть определён на УЗИ. Также амниотическая жидкость отсутствует при поражении ЦНС у плода.
Если плод заглатывает вместе с жидкостью кровь, в желудке визуализируются гиперэхогенные включения. Они также видны при опухолях желудка, но они обычно сопровождаются другими пороками развития. Размеры органа увеличиваются при кишечной непроходимости, многоводии, утолщении стенок, отсутствии малой кривизны.
Уменьшение размеров желудка типично для микрогастрии, которая возникает на фоне отсутствия мочевого пузыря или неправильного положения печени. В 52% случаев плод погибает до 24-й недели беременности, ребёнок рождается нежизнеспособным.
Щелевидный желудок характерен для недоразвитии на ранних стадиях беременности. Данная патология исправляется после рождения малыша: ребёнку конструируют желудок из части тонкого кишечника. Операция крайне сложная, но аномалия не является показанием для выполнения аборта.
Атрезия желудка характеризуется отсутствием эхотени и предполагает образование плёнки с отверстием или без него, расположенной поперёк стенок желудка. Если это изолированная патология, то в 90% случаев она устраняется хирургически. Но обычно атрезия желудка сочетается со сращиванием пищевода, асцитом (излишним скоплением жидкости), недоразвитостью лёгких.
Агенезия желудка предполагает полное отсутствие органа. Это типично для тяжёлых хромосомных аномалий, от которых плод погибает в пренатальный период. Большое значение в диагностике имеет УЗИ на 22 неделе. некоторые отклонения исчезают сами собой, а некоторые требуют немедленного вмешательства.
Читайте также:
- Правый желудочек при легочном сердце. Гипертрофия правого желудочка с блокадой ножки пучка Гиса
- Советы по рентгенографии у пациентов с ожирением (избыточным весом)
- Стригущий лишай волосистой части головы
- Семья больного шизофренией. Снижение стигматизации шизофрении
- Отклонение электрической оси вправо. Значение узловатости комплекса QRS.
