В чем отличие апоптоза от некроза? Причины апоптоза
Добавил пользователь Skiper Обновлено: 21.01.2026
Автор: Заболоцкая Валерия Михайловна
Должность: преподаватель
Учебное заведение: ГБПОУ ДЗМ
Населённый пункт: Москва
Наименование материала: статья
Тема: "Некоторые аспекты по теме "Некроз и апоптоз"
Раздел: среднее профессиональное
Некоторые аспекты по теме «Некроз и апоптоз»
Некроз - патологическая гибель клеток (смерть от «несчастного случая»).
- генетически запрограммированная физиологическая гибель
клетки. Например, гибель неоплодотворенной яйцеклетки, гибель эритроцита
через 120 дней жизни и т.д. Апоптоз - это сконструированный процесс под
строгим генетическим контролем, чтобы не навредить окружающим клеткам.
Для осуществления данного процесса требуется энергия.
Значение апоптоза: поддержание баланса между размножением и смертью
клеток, запрограммированное обновление тканей.
1. Гибель целой группы клеток в
одном участке органа
1. Гибель одиночных клеток,
расположенных «мозаично» в органе
2. Патологический процесс
2. Физиологический процесс
4. Возникает из-за действия внешних
4. Генетически запрограммированная
5. Активация собственных ферментов
5. Без активации гидролаз
6. Требует затрат энергии организма
рубцовая соединительная ткань
7. После апоптоза восстанавливаются
клетки аналогичные погибшим
8. Нет клинических проявлений
Механизм апоптоза:
Начинается с ядра клетки - запускают апоптоз ферменты, которые
присутствуют в ядре каждой клетки и до момента апоптоза находятся в
неактивном состоянии - ферменты разрезают молекулы ДНК на куски -
далее куски ДНК сворачиваются и уплотняются - ферменты повреждают
оболочку ядра - затем нарушают целостность клеточной мембраны -
повреждение мембраны является сигналом для макрофагов - макрофаги
фагоцитируют фрагменты клетки.
Механизм некроза:
В результате «несчастного случая» нарушается целостность мембраны
клетки и ее структур - из разрушенных лизосом выходят собственные
пищеварительные ферменты клетки (гидролазы) - гидролазы разрушают все
В зависимости от причин различают следующие виды некроза:
Травматический - возникает при действии физических факторов.
Токсический - возникает под действием токсинов, кислот, щелочей,
Трофоневротический - возникает при нарушении иннервации тканей, что
ведет к сосудистым нарушениям и необратимым изменениям в тканях.
Сосудистый - возникает при нарушении кровоснабжения органа вследствие
тромбоза (закупорка сосуда тромбом) или эмболии (закупорка сосуда
эмболом - кусочек жира при переломе или пузырек воздуха при инъекции).
Формы некроза: сухой некроз, влажный некроз, инфаркт и гангрена.
Сухой некроз протекает с преобладанием процессов уплотнения тканей. К
сухому некрозу относится творожистый (развивается при туберкулезе, когда
омертвевшая ткань белесоватая и крошится как творог) и фибриноидный
некроз (возникает при пропитывании соединительной ткани фибриногеном,
который превращается в фибрин, оседает на волокнах, уплотняет и
Влажный некроз протекает в тканях с большим количеством воды, когда
ткань расплавляется. Например, расплавление серого вещества головного
- некроз тканей, возникший при нарушении кровообращения
любого органа (тромбоз, эмболия, спазм артерии).
Некротизированные участки черного цвета, так как гемосидерин (пигмент
эритроцитов) окисляется с образованием сернистого железа.
Различают три вида гангрены:
Сухая гангрена - сопровождается мумификацией, частая локализация -
Влажная гангрена - сопровождается инфицированием некротизированной
Пролежень - развивается на участках тела, подвергающихся наибольшему и
24. Некроз и апоптоз. 1) Определение некроза и апоптоза, их отличия. 2) этапы развития некроза 3) макро- и микроскопические признаки некроза 4) классификация некроза 5) исходы и значение некроза.
1) Некроз - омертвение, гибель клеток и тканей в живом организме, полное прекращение их жизнедеятельности.
Апоптоз - генетически запрограммированная гибель клетки в живом организме, разделение клетки на части с образованием апоптозных тел и последующий фагоцитоз этих тел макрофагами.
Отличия апоптоза и некроза:
а) распространненность: некроз может захватывать территорию от части клетки до целого органа, апоптоз распространяется только на отдельные клетки или их группы.
б) апоптоз контролируется генетически (синтез антионкогена p53 приводит к активации апоптоза), некроз - нет
в) биохимически: при апоптозе разрушение ядра происходит с участием специальных эндонуклеаз, расщепляющих ДНК с образованием однотипных по размерам фрагментов, а в цитоплазме никогда не активируются гидролитические ферменты
г) морфологически: апоптоз - конденсация и маргинация хроматина, изрезанность контуров ядра, образование апоптозных телец, связанных цитоплазматическими отростками и их фагоцитоз; некроз - неупорядоченный распад хроматина, набухание органелл и фокусы разрушения мембран, аутолиз клетки под действием гидролитических ферментов
д) на апоптоз реакция воспаления отсутствует, на некроз - присутствует.
2) Этапы развития некроза:
1. паранекроз - подобные некротическим, но обратимые изменения
2. некробиоз - необратимые дистрофические изменения с преобладанием катаболизма над анаболизмом
3. смерть клетки
4. аутолиз - разложение мертвого субстрада под действием ферментов погибших клеток и макрофагов
3) Микроскопические признаки некроза:
а) в ядре: кариопикноз (сморщивание и конденсация хроматина), кариорексис (распад на глыбки), кариолизис (растворение)
б) в цитоплазме: денатурация и коагуляция белков (фокальная или полная) → плазморексис (распад цитоплазмы на глыбки) → плазмолиз ( гидратация и гидролитическое расплавление цитоплазмы)
в) межуточное вещество: деполимеризация гликозаминогликанов, пропитывание белками плазмы, набухание, расплавление
г) коллагеновые волокна набухают, пропитываются фибрином → плотные гомогенные массы → распад; эластические волокна: набухание, базофилия, распад, расплавление (эластолиз); фрагментация и глыбчатый распад ретикулярных и нервных волокон
д) при распаде клеток и межклеточного вещества образуется тканевой детрит, вокруг него - демаркационное воспаление.
Макроскопические признаки некроза:
а) некротизированная ткань плотная и сухая (мумификация) или дряблая, расплавленная (миомаляция, энцефаломаляция)
б) бледная, бело-желтая ткань (очаг некроза в почках, селезенке, миокарде); темно-красная, пропитана кровью (очаг циркуляторного некроза в легких); окрашена секретами (фокусы некроза кишечника и т.д.)
в) при гнилостном распаде: дурной запах.
4) Классификация некроза:
а) в зависимости от причины: 1. травматический (ожог, отморожение, электротравма) 2. токсический (отравления, инфекции) 3. трофоневротический (пролежни у больных с поражением ЦНС) 4. аллергический - обычно фибриноидный (феномен Артюса) 5. сосудистый (инфаркт)
б) по механизму развития: прямой - непосредственное воздействие повреждающего фактора (1+2) и непрямой - опосредованное действие повреждающего фактора через сосудистую и нервно-эндокринную систему (3+4+5)
1. коагуляционный (сухой) некроз - обезвоживание тканей и коагуляция белка в тканях с малым количеством жидкостей и больших количеством белка (восковидный некроз мышц живота при брюшном тифе)
2. колликвационный (влажный) некроз - расплавление мягкой ткани, образование кист в тканях с большим количеством жидкостей и малым белка (головной мозг)
3. гангрена - некроз тканей, соприкасающихся с внешней средой (конечностей, легких)
4. секвестр - участок мертвой ткани, который не рассасывается и свободно располагается среди живым тканей
Отличия апоптоза от некроза:
Апоптоз охватывает всегда только отдельные клетки или их группы.
В отличие от некроза разрушение клетки происходит не активированными гидролитическими ферментами, а с участием специальных калий-магнийзависимых эндонуклеаз, которые разрезают ядро на множество фрагментов.
Образующиеся фрагменты клеток - апоптозные тела фагоцитируются близлежащими клетками - паренхиматозными и стромальными.
Апоптоз не сопровождается развитием воспаления.
Очень многие патологические процессы заканчиваются запрограммированной смертью клетки - это так называемый апоптоз. Другими словами, у клетки есть программа гибели, но в нормальном состоянии она выключена. Гены, отвечающие за включение этой программы, образно называются суицидными. Они активируются и запускают весь механизм апоптоза, что и приводит к гибели клетки.
Явление апоптоза имеет большой смысл, особенно для развивающейся нервной ткани. Если клетка неправильно развивается, то для нервной системы она будет источником патологий. Апоптоз - это биологический ассенизатор. Он включает гибель каждой изношенной или неправильно развивающейся клетки. Тем самым апоптоз предохраняет от возможности возникновения патологий на взрослых этапах развития организмов и тканей.
Но если этот ассенизатор выходит из-под контроля, то эта гибель становится патологической. Усиленный, неконтролируемый апоптоз вызывает массированную гибель клеток. Пример патологического апоптоза - дегенеративные заболевания нервной системы: болезнь Альцгеймера, болезнь Паркинсона и т.д.
Этот фактор, по-видимому, и вызвал интерес Нобелевского комитета, и эти работы были отмечены Нобелевской премией.
Таблица 1. Основные характеристики апоптоза и некроза
Физиологический или патологический
Нерегулируемый или слабо регулируемый
Плазматическая мембрана интактна до поздней стадии
Плазматическая мембрана разрушается в начальной стадии
Инфильтрация полиморфноядерными лейкоцитами отсутствует или минимальна
Лейкоцитарная инфильтрация всегда присутствует
Кариопикноз, кариорексис, фрагментация ДНК
Набухание (онкоз) цитоплазмы и митохондрий
Образование апоптозных телец с последующим их фагоцитозом или вторичным некрозом
Разрушение и дезинтеграция клетки
Морфологические проявления апоптоза Апоптоз имеет свои отличительные морфологические признаки, как на светооптическом, так и на ультраструктурном уровне. При окраске гематоксилином и эозином апоптоз определяется в единичных клетках или небольших группах клеток. Апоптотические клетки выглядят как округлые или овальные скопления интенсивно эозинофильной цитоплазмы с плотными фрагментами ядерного хроматина. Поскольку сжатие клетки и формирование апоптотических телец происходит быстро и также быстро они фагоцитируются, распадаются или выбрасываются в просвет органа, то на гистологических препаратах он обнаруживается в случаях его значительной выраженности. К тому же апоптоз - в отличие от некроза - никогда не сопровождается воспалительной реакцией, что также затрудняет его гистологическое выявление.
Сравнительная характеристика некроза и апоптоза
Активируется физиологическими или патологическими стимулами
Различная в зависимости от повреждающего фактора
Группа клеток, ткань
Энергозависимая фрагментация ДНК эндогенными эндонуклеазами. Лизосомы интактные.
Нарушение или прекращение ионного обмена. Из лизосом высвобождаются ферменты.
Внутриядерная конденсация с расщеплением на фрагменты
Диффузная локализация в некротизированной клетке
Целостность клеточной мембраны
Сморщивание клеток и фрагментация с формированием апоптотических телец с уплотненным хроматином
8. Некроз и апоптоз клетки
Различают два вида клеточной гибели: насильственная смерть от повреждения - некроз и запрограммированная клеточная смерть - апоптоз.
Некроз - это посмертные изменения клетки необратимого характера, заключающиеся в постепенном ферментативном разрушении и денатурации ее белков. Он развивается при чрезмерной альтерации клетки, не требует затрат энергии и не зависит от управляющих сигналов местного и центрального происхождения («анархических путь гибели»). Вследствие синтеза поврежденной клеткой БАВ (простогландины) и нарушения целостности ее мембран (выход различных ферментов), некроз представляет определенную угрозу окружающим структурам - это часто способствует развитию воспалительного процесса.
Насильственная гибель клетки обусловлена:
лишением ее питания и кислорода;
необратимыми изменениями структуры и функции с угнетением важнейших метаболических процессов различными патогенными агентами.
Некрозу предшествует глубокая, частично необратимая стадия повреждения клетки - некробиоз (рис. 1). Несмотря на многообразие этиологических факторов, провоцирующих в конечном счете развитие некробиоза и некроза, молекулярно-клеточные изменения, выявляемые при гибели клетки в большинстве случаев одинаковы (Зайчик А.Ш., Чурилов Л.П., 1999). Согласно их мнению, важно различать гипоксический и свободно-радикальный некробиоз. Механизмы свободно-радикального повреждения клетки (см. выше) могут запускаться без первичной гипоксии, а иногда даже в условиях его избытка. Гипоксический некробиоз (см. раздел «Гипоксия») инициируется различными патогенными факторами, вызывающих продолжительную гипоксию. Оба вида некробиоза могут комбинироваться и взаимно дополнять друг друга. Исходом обоих видов некробиоза являются такие повреждения клетки, при которых она уже неспособна к самостоятельному энергообеспечению (т. необратимости, рис. 1) и подвергается некрозу.
Некоторые исследователи иногда рассматривают некробиоз, как процесс собственной гибели клетки. По Давыдовскому И.В., некробиоз - это процесс отмирания клеток. Некроз же, в большей степени характеристика морфологическая, наблюдающаяся после гибели клетки, а не механизм самой гибели.
Различают две основные разновидности некроза:
коагуляционный (сухой) некроз. При нем в клетке развивается значительный ацидоз, идет коагуляция белков и отмечается повышенное накопление кальция с агрегацией элементов цитоскелета. Очень часто наблюдается при тяжелой гипоксии, например, в кардиомиоцитах при инфаркте миокарда. Данный некроз преимущественно развивается в тканях богатых белком и кальцием и характеризуется ранними и глубокими поражениями митохондрий;
колликвационный некроз. Для него типично преобладание гидролитических процессов лизосомального аутолиза или гетеролизиса при участии фагоцитов. Очаг некроза размягчен, наблюдается накопление активных гидроксильных радикалов и эндогенное омыление клеток, что приводит к разрушению ее структур, например различных мембран.
Между коагуляционным и колликвационным некрозоми четких границ нет. Возможно, это объясняется тем, что механизмы их развития во многом общие. Ряд исследователей выделяют и так называемый казеозный (творожистый) некроз (при туберкулезе), пологая при этом, что он представляет собой комбинацию двух предыдущих типов.
Апоптоз - это программированная клеточная смерть (инициирующаяся под действием вне- или внутриклеточных факторов) в развитии которой активную роль принимают специальные и генетически запрограммированные внутриклеточные механизмы. Он, в отличие от некроза активный процесс, требующий определенных энергозатрат. Первоначально пытались разграничить понятия «программированная клеточная гибель» и «апоптоз»: к первому термину относили устранение клеток в эмбриогенезе, а ко второму - программированную смерть только зрелых дифференцированных клеток. В настоящее время выяснилось, что никакой целесообразности в этом нет (механизмы развития клеточной гибели одинаковы) и два понятия превратились в синонимы, хотя это объединение и не бесспорно.
Прежде чем приступить к изложению материала о роли апоптоза для жизнедеятельности клетки (и организма) в норме и патологии, мы рассмотрим механизм апоптоза. Их реализацию можно представить в виде поэтапного развития следующих стадий:
1 стадия - стадия инициации (индукции). В зависимости от происхождения сигнала, стимулирующего апоптоз, различают:
внутриклеточные стимулы апоптоза. Среди них к наиболее известным относят - разные виды облучения, избыток Н + , оксид азота, свободные радикалы кислорода и липидов, гипертермия и др. Все они могут вызывать различные повреждения хромосом (разрывы ДНК, нарушения ее конформации др.) и внутриклеточных мембран (особенно митохондрий). То есть в данном случае поводом для апоптоза служит «неудовлетворительное состояние самой клетки» (Мушкамбиров Н.П., Кузнецов С.Л., 2003). Причем, повреждение структур клеток должно быть достаточно сильным, но не разрушительным. У клетки должны сохраниться энергетические и материальные ресурсы для активации генов апоптоза и его эффекторных механизмов. Внутриклеточный путь стимуляции программированной смерти клетки можно обозначить как «апоптоз изнутри»;
трансмембранные стимулы апоптоза, т.е., в этом случае он активируется внешней «сигнализацией», которая передается через мембранные или (реже) внутриклеточные рецепторы. Клетка может быть вполне жизнеспособной, но, с позиции целостного организма или «ошибочной» стимуляции апоптоза, она должна погибнуть. Этот вариант апоптоза получил название «апоптоз по команде».
Трансмембранные стимулы подразделяются на:
«отрицательные» сигналы. Для нормальной жизнедеятельности клетки, регуляции ее деления и размножения необходимо воздействие на нее через рецепторы различных БАВ: факторов роста, цитокинов, гормонов. Среди прочих эффектов, они подавляют механизмы клеточной гибели. И естественно, дефицит или отсутствие данных БАВ активирует механизмы программированной смерти клетки;
«положительные» сигналы. Сигнальные молекулы, такие как ФНОα, глюкокортикоиды, некоторые антигены, адгезивные белки и др., после взаимодействия с клеточными рецепторами могут запускать программу апоптоза.
На клеточных мембранах находится группа рецепторов, в задачу которых передача сигнала к развитию апоптоза является основной, возможно даже единственной функцией. Это, например, белки группы DR (death receptos - «рецепторы смерти»): DR3, DR4, DR5. Наиболее хорошо изучен Fas-рецептор, появляющийся на поверхности клеток (гепатоцитах) спонтанно или под влиянием активации (зрелые лимфоциты). Fas-рецептор при взаимодействии с Fas-рецептором (лигандом) Т-киллера запускает программу смерти клетки мишени. Однако, взаимодействие Fas-рецептора с Fas-лигандом в областях, изолированных от иммунной системы, заканчивается гибелью самого Т-киллера (см. нижеигандом в областях, изолированных от иммунной системы, заканчивается гибелью самого Т-киллера ()ожно 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 ).
Следует помнить, что некоторые сигнальные молекулы апоптоза, в зависимости от ситуации могут наоборот, блокировать развитие программированной смерти клеток. Амбивалентность (двойственное проявление противоположных качеств) характерна для ФНО, ИЛ-2, интерферона γ и др.
На мембранах эритроцитов, тромбоцитов, лейкоцитов, а так же клеток легкого и кожи обнаружены особые антигены-маркеры. На них синтезируются физиологические аутоантитела, и они, выполняя роль опсонинов, способствуют фагоцитозу этих клеток, т.е. гибель клеток происходит путем аутофагоцитоза. Выяснилось, что антигены-маркеры появляются на поверхности «старых» (прошедших свой путь онтогенетического развития) и поврежденных клетках, молодые и неповрежденные клетки их не имеют. Данные антигены получили название «антигены-маркеры стареющих и поврежденных клеток» или «белок третьей полосы». Появление белка третьей полосы контролируется геномом клетки. Следовательно, аутофагоцитоз можно рассматривать, как вариант запрограммированной гибели клеток.
Смешанные сигналы. Это сочетанное воздействие сигналов первой и второй группы. Например, апоптоз происходит с лимфоцитами, активированных митогоном (положительный сигнал), но не вступивших в контакт с АГ (отрицательный сигнал).
2 стадия - стадия программирования (контроля и интеграции механизмов апоптоза).
Для этой стадии характерно два, диаметрально противоположных процесса, наблюдающихся после инициации. Происходит либо:
реализация пускового сигнала к апоптозу через активацию его программы (эффекторами являются каспазы и эндонуклеазы);
блокируется эффект пускового сигнала апоптоза.
Различают два основных, но не исключающих друг друга, варианта исполнения стадии программирования (рис. 14):
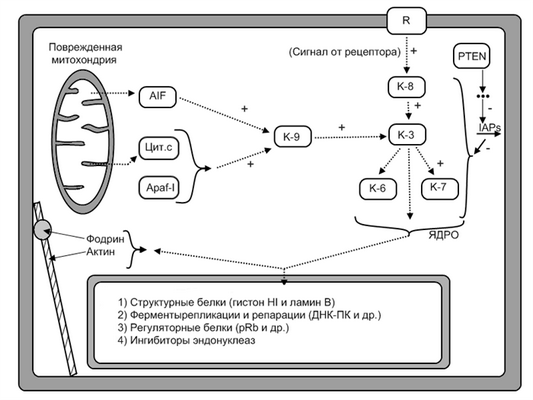
Рис. 14. Каспазный каскад и его мишени
R- мембранный рецептор; К - каспазы;AIF- митохондриальная протеаза; Цит. С - цитохром с;Apaf-1 - цитоплазматический белок;IAPs- ингибиторы каспаз
1. Прямая передача сигнала (прямой путь активации эффекторных механизмов апоптоза минуя геном клетки) реализуется через:
адапторные белки. Например, так осуществляется запуск апоптоза Т-киллером. Он активирует каспазу-8 (адапторный белок). Аналогично может действовать и ФНО;
цитохром С и протеазу ΑIF (митохондриальная протеаза). Они выходят из поврежденной митохондрии и активируют каспазу-9;
гранзимы. Т-киллеры синтезируют белок перфорин, который образует каналы в плазмолемме клетки-мишени. Через эти каналы в клетку проникают протеолитические ферменты гранзимы, выделяемые все тем же Т-киллером и они запускают каскад каспазной сети.
2. Опосредованная передача сигнала. Она реализуется с помощью генома клетки путем:
репрессии генов, контролирующих синтез белков-ингибиторов апоптоза (гены Bcl-2, Bcl-XL и др). Белки Bcl-2 в нормальных клетках входят в состав мембраны митохондрий и закрывают каналы по которым из этих органоидов выходят цитохром С и протеаза AIF;
экспрессии, активации генов, контролирующих синтез белков-активаторов апоптоза (гены Bax, Bad, Bak, Rb, P53 и др.). Они, в свою очередь активируют каспазы (к-8, к-9).
На рис. 14 представлена примерная схема каспазного принципа активации каспаз. Видно, что откуда бы не запускался каскад, его узловым моментом является каспаза 3. Она активируется и каспазой 8 и 9. Всего в семействе каспаз - более 10 ферментов. Локализуются в цитоплазме клетки в неактивном состоянии (прокаспазы). Положение всех каспаз в данном каскаде до конца не выяснено, поэтому на схеме ряд из них отсутствует. Как только активируются каспазы 3,7,6 (возможно и их другие типы) наступает 3 стадия апоптоза.
3 стадия - стадия реализация программы (исполнительная, эффекторная). Непосредственными исполнителями («палачами» клетки) являются выше указанные каспазы и эндонуклеазы. Местом приложения их действия (протеолиза) служат (рис. 14):
цитоплазматические белки - белки цитоскелета (фодрин и актин). Гидролизом фодрина объясняют изменение поверхности клетки - «гофрирование» плазмолеммы (появление на ней впячиваний и выступов);
белки некоторых цитоплазматических регуляторных ферментов: фосфолипазы А2, протеинкиназы С и др.;
ядерные белки. Протеолиз ядерных белков занимает основное место в развитии апоптоза. Разрушаются структурные белки, белки ферментов репликации и репарации (ДНК-протеинкиназы и др.), регуляторные белки (рRb и др.), белки-ингибиторов эндонуклеаз.
Иннактивация последней группы - белков ингибиторов эндонуклеаз приводит к активации эндонуклеаз, второму «орудию» апоптоза. В настоящее время эндонуклеазы и в частности, Са 2+ , Мg 2+ -зависимая эндонуклеаза, рассматривается как центральный фермент программируемой смерти клетки. Она расщепляет ДНК не в случайных местах, а только в линкерных участках (соединительные участки между нуклеосомами). Поэтому хроматин не лизируется, а только фрагментируется, что определяет отличительную, структурную черту апоптоза.
Вследствие разрушения белка и хроматина в клетке формируются и от нее отпочковываются различные фрагменты - апоптозные тельца. В них находятся остатки цитоплазмы, органелл, хроматина и др.
4 стадия - стадия удаления апоптозных телец (фрагментов клетки). На поверхности апоптозных телец экспрессируются лиганды, они распознаются рецепторами фагоцитов. Процесс обнаружения, поглощения и метаболизирования фрагментов погибшей клетки происходит сравнительно быстро. Это способствует избежать попадания содержания погибшей клетки в окружающую среду и тем самым, как отмечено выше, воспалительный процесс не развивается. Клетка уходит из жизни «спокойно», не беспокоя «соседей» («тихий суицид»).
Программированная клеточная гибель имеет важное значение для многих физиологических процессов. С апоптозом связаны:
поддержание нормальных процессов морфогенеза - запрограммированная смерть клеток в процессе эмбриогенеза (имплантации, органогенеза) и метаморфоза;
поддержание клеточного гомеостаза (в том числе ликвидация клеток с генетическими нарушениями и инфицированных вирусами). Апоптозом объясняется физиологическая инволюция и уравновешивание митозов в зрелых тканях и органах. Например, гибель клеток в активно пролиферирующих и самообновляющихся популяциях - эпителиоцитов кишечника, зрелых лейкоцитов, эритроцитов. Гормонально-зависимая инволюция - гибель эндометрия в конце менструального цикла;
селекция разновидностей клеток внутри популяции. Например, формирование антигенспецифической составляющей иммунной системы и управление реализацией ее эффекторных механизмов. С помощью апоптоза происходит выбраковка ненужных и опасных для организма клонов лимфоцитов (аутоагрессивных). Сравнительно недавно (Griffith T.S., 1997) показали значение программированной гибели клеток в защите «иммунологически привилегированных» зон (внутренние среды глаза и семенников). При прохождении гисто-гематических барьеров данных зон (что случается редко), эффекторные Т-лимфоциты гибнут (см. выше). Включение механизмов их смерти обеспечивается при взаимодействии Fas-лиганда барьерных клеток с Fas-рецепторами Т-лимфоцита, тем самым предотвращается развитие аутоагрессии.
Роль апоптоза в патологии и виды различных заболеваний связанных с нарушением апоптоза представлены в виде схемы (рис. 15) и таблицы 1.
Конечно, значение апоптоза в патологии меньше чем некроза (возможно, это связано с недостаточностью таких знаний). Однако, проблема его в патологии имеет и несколько иной характер: она оценивается по степени выраженности апоптоза - усиление или ослабление при тех или иных болезнях.
Лекция № 4. НЕКРОЗ, АПОПТОЗ, ОБЩАЯ СМЕРТЬ
Некроз: определение понятия и его виды. Причины развития некроза и его исходы. Апоптоз, сущность и биологическое значение. Общая смерть, ее стадии и морфологические признаки.
Некрозом называется гибель клеток в живом организме с полным прекращением их функции. Некроз может возникать при действии сверхсильного, чрезвычайного раздражителя (и тогда некроз развивается немедленно) или при действии относительного слабого раздражителя, но продолжительного по времени (обратимая дистрофия - необратимая дистрофия - некроз; необратимая атрофия - некроз). В большинстве случаев некроз развивается постепенно, в результате необратимых дистрофических или атрофических изменений. При этом выделяют следующие морфогенетические стадии процесса: паранекроз (еще обратимые изменения) - некробиоз (необратимые изменения, но еще жизнь) - некроз - аутолиз. Аутолиз - самопереваривание погибших клеток и тканей с помощью ферментов распадающихся лизосом. Является совершенно необходимым процессом, способствующим заживлению тканей в месте развития некроза.
Некроз имеет место не только в патологии, но и в норме (естественная гибель и отторжение эпителия кожи, эпителия кишечника, гибель стареющих эритроцитов).
Одним из вариантов некроза является АПОПТОЗ. Апоптоз - это вид некроза, причиной развития которого является активация в ядре клетки специальных генов апоптоза. То есть апоптоз - это своего рода запрограммированная смерть клетки, активный процесс самоубийства клетки. Включение апоптотических генов происходит при активации особого цитоплазматического белка р53, он же может активироваться разнообразными факторами внеклеточной среды: действие гормонов (напр., глюкокортикоиды вызывают апоптоз кортикальных лимфоцитов вилочковой железы, апоптоз лимфоцитов реактивных центров фолликулов лимфоузлов и селезенки), действие цитокинов (напр., фактор некроза опухоли), радиация, некоторые химиопрепараты (часть из них - производные ретиноловой кислоты). Важно отметить, что мощным стимулирующим апоптоз Т-хелперов действием обладают вирусы ВИЧ-инфекции. Активация апоптотических генов может происходить и спонтанно, в результате определенных мутационных перестроек генов.
Обычный некроз и апоптоз имеют ряд важных отличий: - при обычном некрозе повреждение клетки, как правило, начинается с цитоплазмы, поскольку повреждающий агент действует извне, повреждение и распад ядра происходит в последнюю очередь; - при апоптозе процесс гибели начинается сразу с ядра, при этом стимуляция апоптотических генов приводит к активации ядерных эндонуклеаз, которые и разрушают ДНК ядра. Гибель цитоплазмы происходит позднее, после фагоцитоза погибшей клетки макрофагами.
Некроз, особенно при патологических процессах, имеет вид крупноочагового процесса и поэтому в ответ на некроз обычно развивается воспалительная реакция с последующим склерозом и организацией. Апоптоз же представляет собой гибель клеток, рассеянных по органу или ткани, ввиду чего воспаление в ответ на апоптоз не развивается, а элиминация погибших клеток обеспечивается фагоцитозом макрофагами (гистиоцитами), расположенными поблизости. К тому же выделения цитоплазматических цитокинов из апоптотически погибающей клетки в окружающую среду не происходит, и поэтому нет стимула для развития воспалительной реакции.
Апоптоз имеет огромное значение в морфообразовательных процессах в эмбриогенезе (пятипалость руки, гибель провизорных органов - желточный мешок, первичная почка, очаги эмбрионального кроветворения в селезенке и в последующем в печени). Постепенно развивающаяся гибель эритроцитов с потерей ядра на уровне нормобластов - также пример апоптической гибели клетки.
Колоссальное значение имеет апоптоз в противоопухолевой резистентности организма. Установлено, что опухолевые клетки в невосприимчивом к ним организме погибают путем апоптоза, который активируется специальным цитокином - фактором некроза опухоли (ФНО). Отсюда происходят попытки терапии опухолей путем искусственной стимуляции в них апоптоза дозированным облучением или путем воздействия некоторыми химиопрепаратами. Напротив, развитие опухоли связывают с репрессией генов апоптоза.
Выделяют понятия прямого и непрямого некроза. ПРЯМОЙ НЕКРОЗ - гибель клеток происходит в месте непосредственного воздействия повреждающего агента (термическая или механическая травма, повреждающее действие высоких концентраций кислот и щелочей, действие лучевой энергии, действие бактерий или их токсинов, аллергический некроз; к прямому некрозу можно отнести также и апоптоз); НЕПРЯМОЙ НЕКРОЗ - гибель клеток и тканей происходит в отдалении от непосредственного действия повреждающего агента (сосудистый, трофоневротический некроз).
У детей преобладает прямой некроз: вызванный в первую очередь микробными факторами и повреждающими агентами аллергических реакций (иммунные комплексы, аутоантитела). Ввиду того, что болезни сосудов, такие как атеросклероз, у них не встречаются, непрямой некроз для детей не характерен.
Макроскопические признаки некроза : изменение цвета пораженного участка ткани (белый, желтоватый, темно-красный или красно-коричневый, зеленоватый, черный), изменение ее консистенции (уплотнение или, наоборот, размягчение), некротизированные ткани при длительном существовании в организме могут заселяться микробами, которые разлагают погибшую ткань с выделением дурно пахнущих газов.
Микроскопические признаки некроза : на уровне светового микроскопа - кариопикноз, кариорексис, кариолизис, затем плазмокоагуляция, плазморексис, плазмолиз. Однако наиболее ранние некротические изменения выявляются на уровне электронного микроскопа и состоят они в агрегации хроматина ядра, массовом разрушении внутренних мембран клетки с появлением в митохондриях электронноплотных депозитов (отложений) солей кальция, связанных с белками, разрушении митохондрий, рибосом и лизосом.
(Биохимические основы некроза хорошо описаны в лекциях по патологической анатомии В. В. Серова).
Клинико-морфологические формы некроза : инфаркт, сухая и влажная гангрена, пролежень, секвестр.
Инфаркт - сосудистый (ишемический) некроз. Различают красный (геморрагический) инфаркт (легкие, кишечник) и белый или белый с геморрагическим венчиком (ишемический) инфаркт. Белый инфаркт встречается в головном мозге, белый с геморрагическим венчиком - в почках, миокарде. Инфаркт миокарда обычно развивается в левом желудочке сердца.
Гангрена - некроз тканей, контактирующих с внешней средой. (Морфологические отличия сухой и влажной гангрены). Разновидностью гангрены является пролежень - некроз, развивающийся в месте длительного сдавления мягких тканей извне, Например, некроз кожи, подкожной клетчатки и поверхностных мышц в области крестца и копчика вследствие сдавления этих зон при дли тельном вынужденном лежании ослабленных больных на спине, или образование пролежня на слизистой трахеи при длительном нахождении в ней интубационной трубки при искусственной вентиляции легких, пролежень слизистой уретры или мочевого пузыря при длительном нахождении в них катетера.
Секвестр - участок сухого некроза, который подвергается лишь частичному краевому аутолизу и оказывается свободно лежащим в секвестрационной полости. В последующем секвестр может выходить наружу через свищевые (секвестрационные) ходы. Наиболее часто секвестры образуются в костях при остеомиелитах, изредка в поджелудочной железе при панкреонекрозах, в легких.
В зависимости от вторичных изменений некротизированной ткани выделяют сухой (или коагуляционный) некроз и влажный (или колликвационный) некроз. Сухой некроз наблюдается в тканях, богатых белком - кожа, мышцы, в том числе миокард, творожистый (казеозный) некроз при туберкулезе, сифилисе, лепре, фибриноидный некроз стенок сосудов и соединительной ткани. Влажный некроз развивается в тканях, бедных белком, но богатых водой: жировая клетчатка, вещество головного и спинного мозга, изредка колликвационный некроз развивается в миокарде (массивный трансмуральный инфаркт миокарда), при этом мышца сердца может разорваться.
1. Рассасывание некротизированной ткани с полной регенерацией (восстановлением) ткани. Примером могут являться бесследное заживление мелких повреждений на коже, полное заживление мелких участков некроза в печени, почках, кроветворных органах (лимфоузлы, селезенка).
2. Рассасывание с образованием рубца (напр., рубец в сердце после перенесенного инфаркта миокарда, рубцы на коже после термических или химических ожогов).
3. Рассасывание с образованием кисты (напр., образование кисты в головном мозге после перенесенного ишемического инсульта в форме инфаркта).
Рассасывание - это сложный процесс, протекающий с участием воспалительной реакции и сосудов микроциркуляторного русла. Иногда рассасывание может принять форму нагноения ткани. Это считается одним из неблагоприятных вариантов исхода некроза, так как это чревато различными осложнениями, вплоть до сепсиса.
4. Отторжение по типу слущивания и по типу мутиляции. Например, слущивание погибших эпидермальных клеток или погибшего эпителия кишечника в его просвет. Такой вариант исхода некроза является самым оптимальным, так как он не требует дополнительных затрат энергии на рассасывание.
Мутиляция (самоампутация) - отторжение некротизированных органов или частей органов. Примером мутиляции является отторжение некротизированных пальцев стоп при их сухой гангрене или лепре, отторжение некротизированного червеобразного отростка в полость брюшины при гангренозном аппендиците.
Одним из вариантов отторжения является секвестрирование - отторжение некротизированных фрагментом костной ткани через секвестрационные каналы.
5. Инкапсуляция некроза. Развивается при невозможности отторжения или рассасывания некротических масс. Примером является инкапсуляция очагов казеозного некроза при туберкулезе. Биологический смысл инкапсуляции состоит в изолировании участка некроза от окружающей здоровой ткани. Нередко в инкапсулированных очагах некроза развивается петрификация - дистрофическое обызвествление.
Для предотвращения различных осложнений и ускорения заживления тканей в хирургии широко используют иссечение некротизированных тканей. При этом сокращается время, необходимое для рассасывания некротических масс, возникающий рубец тонкий, нежный, т.е. косметический, частота гнойных осложнений резко снижается.
Общая смерть - процесс гибели всего организма. Выделяют 2 стадии этого процесса: клиническая и биологическая смерть. Клинической смерти обычно предшествуют разнообразные терминальные состояния: агония, шок, массивная кровопотеря с острой гиповолемией.
Клиническая смерть - процесс еще обратим (еще не труп), биологическая смерть - процесс необратим и умерший превращается в труп, в котором начинают происходить аутолитические изменения.
Отличия клинической и биологической смерти: остановка дыхания, сердечной деятельности и кровообращения, отсутствие зрачкового рефлекса, отсутствие ЭКГ- и ЭЭГ-импульсов. Факторы, влияющие на продолжительность клинической смерти (температура внешней среды, возраст, быстрота наступления смерти, наличие преморбида).
Патология реанимации: болезни оживленного организма, мозговая смерть (декортикация, децеребрация).
Умение максимально своевременно дифференцировать клиническую и биологическую смерть нужно для проведения эффективных реанимационных мероприятий, а также в трансплантологии для своевременного взятия органов для их пересадки реципиенту.
Морфологические признаки биологической смерти: ранние (появление ранних трупных пятен, охлаждение трупа, трупное окоченение (начинается через 2-5 часов, продолжается 2-3 суток); поздние - поздние трупные пятна, трупное высыхание слизистых оболочек (а также всего тела в виде мумификации), помутнение роговицы, трупное разложение (посмертный асептический аутолиз + гниение с участием гнилостных микробов).
Читайте также:
