Варианты сочетания лучевой и химиотерапии опухоли головы и шеи
Добавил пользователь Валентин П. Обновлено: 22.01.2026
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России, 125284 Москва, 2-й Боткинский пр-д, д. 3, Российская Федерация
ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, Томск
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
Особенности терапии сопровождения лучевого лечения больных с опухолями головы и шеи
В публикации освещены основные вопросы переносимости при проведении одновременно лучевой и таргетной терапии больных с опухолями головы и шеи. На примере клинического наблюдения показано течение побочных эффектов и затронуты ключевые вопросы подготовки к лечению и терапии сопровождения. Представлено состояние пациента в поздние сроки и обсуждена связь между адекватным лечением ранних реакций, отсроченным состоянием и качеством жизни больных.
В настоящее время перед онкологами стоят связанные между собой задачи излечения от онкологического процесса, реабилитации, социальной адаптации и сохранения высокого качества жизни больных. Применение методов противоопухолевого воздействия нередко ограничивает состояние пациентов, требующее адекватной поддерживающей терапии на всех этапах лечения и реабилитации. Результаты лучевого и химиолучевого лечения больных с опухолями головы и шеи неотъемлемо связаны с адекватной сопроводительной терапией, в том числе нутритивной поддержкой, ранозаживляющей терапией, своевременной профилактикой и лечением вторичной инфекции, постоянным контактом и психологической поддержкой пациентов, а также с адекватным обезболиванием. Особое значение вышесказанное приобретает в свете внедрения все более агрессивных методов терапии и хирургии с целью снижения смертности, превышающей в мире 270 тыс. человек в год [1].
Большинство пациентов обращаются в специализированные онкологические учреждения уже на поздних стадиях процесса и с признаками нутритивной недостаточности. Энергозатраты постепенно растут, что без соответствующего увеличения калорийности пищи может приводить к потере 1—2 кг мышечной массы в месяц [2—4]. Важно отметить, что потеря массы тела на фоне опухолевой прогрессии врачей нередко не беспокоит, в то время как сам пациент не может адекватно скорректировать свою диету. В ряде исследований показано, что более чем у 50% больных облучение начинают на фоне нутритивной недостаточности, а к моменту завершения лечения частота ее проявления превышает 80% [5—7]. Как сама опухоль, так и лучевые реакции в виде мукозита могут препятствовать нормальному пероральному питанию. С другой стороны, следствием выраженной нутритивной недостаточности является раннее проявление и более тяжелое течение лучевых реакций, что приводит к вынужденному перерыву в курсе облучения и потере его эффективности [8, 9].
Важнейшее условие успешной лучевой терапии — сохранение жизнеспособности нормальных тканей, находящихся в зоне облучения. Современные методы подведения доз ионизирующего излучения направлены на минимизацию лучевых реакций и повреждений. Между тем воздействие ионизирующего излучения на окружающие здоровые ткани исключить полностью не удается [10—13]. В результате лучевая терапия может приводить к местным побочным эффектам облучения, выраженность которых в первую очередь зависит от суммарной поглощенной дозы ионизирующего излучения. Немаловажными факторами являются объем облучаемых тканей и распределение доз в этом объеме, а также методика фракционирования и сроки проведения лучевого лечения.
Общей особенностью местных лучевых побочных эффектов является наличие скрытого периода между облучением и появлением первых клинических проявлений. Чем больше интенсивность подведенного ионизирующего излучения, тем короче этот период. Важной особенностью местных лучевых повреждений является прогрессирование морфологических изменений с ухудшением клинических проявлений, приобретающих хронический характер. Наиболее распространенным побочным эффектом, возникающим в ходе лучевой терапии у больных орофарингеальным раком, является лучевой мукозит (эпителиит), развивающийся более чем у 60% пациентов при проведении стандартного режима фракционирования и практически у 100% больных при нетрадиционных режимах или химиолучевой терапии [14, 15]. Ведущие радиотерапевты свидетельствуют, что более чем в 40% случаев при проведении облучения с лекарственной модификацией развиваются побочные эффекты тяжелой степени [16—19]. Мукозит играет ключевую роль при лучевой терапии рака головы и шеи, а также значительно влияет на качество жизни больных в процессе лечения и после его завершения. Необходимо отметить, что спектр ранних побочных явлений значительно шире и также включает дерматит, ксеростомию, накопление вязкого секрета, дисгевзию, дисфагию, одинофагию, алопецию в области облучения, осиплость, присоединение вторичной инфекции в области облучения или в результате аспирации. Кроме того, дефекты слизистой оболочки могут стать входными воротами для оппортунистических инфекций, например кандидоза. Побочные эффекты во многом взаимосвязаны патогенетически и провоцируют друг друга, причем неадекватное ведение пациента с ранними лучевыми реакциями может приводить к поздним лучевым повреждениям. Через 1,5—2 нед после окончания лучевой терапии проявления реакции слизистых обычно купируются. Вкусовые ощущения восстанавливаются через 1—2 мес, а слюноотделение — через 2—5 мес, иногда и в более поздние сроки.
Лучевой дерматит кожи головы и шеи также представляет собой часто возникающий побочный эффект при лучевой терапии опухолей головы и шеи. Его проявления во многом недооценены, однако на самом деле значительно влияют на переносимость лечения и качество жизни пациентов [20, 21]. Местные лучевые реакции кожи челюстно-лицевой области проявляются в основном в виде эритемы и сухого эпидермита, возникающих при дозе более 20 Гр. При их возникновении перерыв в лечении не требуется, поскольку купируются они самостоятельно либо при местной ранозаживляющей терапии. При облучении метастатических узлов на шее и подведении суммарной очаговой дозы (СОД) 50 Гр дерматит бывает более выраженный и достигает степени влажного эпидермита. С момента проявлений лучевого дерматита и до полного стихания реакций показано применение ранозаживляющих местных средств (гели, метилурациловая мазь, рибофлавин), а также солнцезащитных средств. Кожу необходимо оберегать от трения и раздражения. Для борьбы с ксерозом используют крем с мочевиной, масляный раствор витамина А. Характерная черта развития тяжелых лучевых дерматитов - длительное, прогрессирующее и нередко рецидивирующее течение нарушений микроциркуляции, трофических и обменных процессов в облученных тканях. Как выяснилось в последнее время, существует ряд патофизиологических и клинических особенностей развития лучевого дерматита на фоне таргетной терапии, которые позволяют говорить об отдельной форме — биолучевом дерматите [22]. Такой вариант дерматита характеризуется более выраженным ксерозом, интенсивным воспалительным ответом, выраженным истончением эпидермиса, некрозом эпидермиса и поверхностных слоев дермы, а также выраженной экссудацией. .Биолучевой дерматит имеет раннее начало (на 1—2-й неделе), более острый характер течения и ранние сроки репарации. Дефекты кожи могут стать входными воротами для оппортунистических инфекций, например Staphylococcus aureus. Поэтому очевидно, что ранозаживляющая терапия является ключевым компонентом терапии сопровождения в рамках борьбы с лучевым мукозитом и дерматитом.
Таким образом, лучевое лечение больных с опухолями головы и шеи требует соответствующей сопроводительной терапии, в том числе нутритивной поддержки, ранозаживляющей терапии, своевременной профилактики и лечения вторичной инфекции, постоянного контакта и психологической поддержки пациентов, а также адекватного обезболивания. При этом аналгезирующую терапию используют как при болевом синдроме, формирующемся в результате опухолевого поражения, так и при возникающих в процессе терапии лучевых реакциях. Любой компонент терапии сопровождения одинаково важен, поскольку его отсутствие или неадекватное применение может сказаться не только на качестве жизни больного, но и на результатах лечения основного заболевания.
В постлучевом периоде нормальные ткани, подвергшиеся облучению, очень ранимы, поэтому к ним нужно относиться бережно. В ранние сроки не рекомендуется выполнять инвазивные диагностические процедуры и биопсию без крайней необходимости. Показан подбор диеты при необходимости в сочетании с противорефлюксными препаратами. Травмы, алкоголь, курение, раздражающая пища легко вызывают изъязвление слизистой оболочки, что нередко сопровождается обнажением кости нижней челюсти с последующим развитием остеомиелита. Пациенту должно быть рекомендовано продолжить контроль за массой тела, а также проводить оценку нутритивного статуса и степени нутритивной недостаточности при каждом контрольном обследовании. На усмотрение курирующего специалиста можно в дальнейшем назначать нутритивную терапию, предпочтительно сипинг.
Таким образом, вопрос об адекватности поддерживающей терапии и последующей реабилитации пациентов, получающих лучевое и химиолучевое лечение по поводу опухолей головы и шеи, остается одной из актуальных проблем в современной онкологии, что демонстрирует приведенное ниже клиническое наблюдение.
Клиническое наблюдение
Пациент К., 52 года, считает себя больным с декабря 2012 г., когда впервые обратил внимание на появление боли в горле, дискомфорт при приеме пищи, постоянную субфебрильную температуру. Гнусавость отмечал ранее в течение года. Обратился к врачу по месту жительства. Проводимая антибактериальная терапия эффекта не дала. Обратился в районный онкологический диспансер Пензы, где был заподозрен и верифицирован рак глотки. Направлен в МНИОИ им. П.А. Герцена, куда обратился в феврале 2013 г.
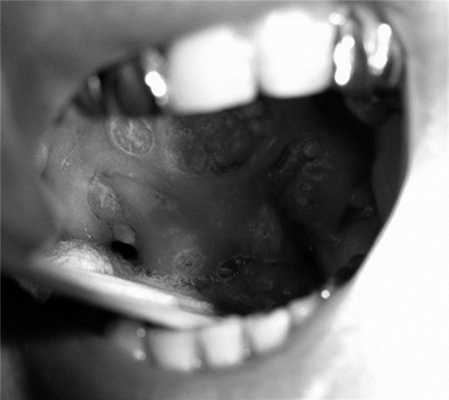
В беседе пациент предъявлял жалобы на чувство инородного тела в горле, гнусавость, выраженные боли в глотке, а также помеху при глотании пищи и жидкости. В анамнезе курение отрицал. При осмотре больного определялось опухолевое поражение ротоглотки, включая мягкое небо, с переходом за среднюю линию и на твердое небо, небную миндалину, дужки, стенку рото- и носоглотки. Просвет глотки был значительно сужен, а нижний полюс опухоли недостижим (рис. 1). Рис. 1. Картина распространения опухолевого процесса до начала лечения (описание в тексте). На шее с обеих сторон очаговой патологии не выявлено.
Данные МРТ: картина объемного образования носо-, рото- и гортаноглотки смешанного характера роста с выраженным экзофитным компонентом размером 51×38 мм, протяженностью не менее 66 мм. Верхний полюс опухоли ниже уровня левого слухового валика на 5—6 мм. С учетом ограничения интерпретации на фоне артефактов создавалось впечатление, что образование исходит из левой боковой стенки ротоглотки — зональность не прослеживается. Отмечалось пролабирование опухоли в клетчатку ретрофарингеального и сонного пространства с вовлечением нижнего отдела верхнего и среднего констрикторов глотки. На этом уровне задний контур образования плотно прилежал преимущественно к левой длинной мышце шеи с вовлечением ее фасции. Образование на визуализируемом уровне вовлекало левые отделы мягкого неба, дужки и миндаликовую нишу, несколько деформировало левые отделы корня. Латеральный контур на этом уровне вовлекал нижние отделы латеральной крылонебной мышцы. Нижний полюс опухоли располагался на уровне гортаноглотки по левой стенке в виде утолщения, в проекции плоскости, проведенной через апикальные отделы лепестка надгортанника. Визуализировались единичные лимфатические узлы левой подбородочной области (размер 12×9 мм), а также по ходу сосудов шеи в верхней трети с обеих сторон до 10 мм.
При гистологическом исследовании биопсийного материала опухоли правой небной миндалины выявлен инфильтративный рост плоскоклеточного рака с наклонностью к ороговению. Иммуногистохимическое исследование (АТ к белку р16) — положительная реакция в клетках опухоли.
На основании результатов проведенных исследований диагностирован рак ротоглотки IVA стадии, cT4N0M0. Тактика лечения обсуждена на междисциплинарном консилиуме с участием радиолога, хирурга и химиотерапевта, рекомендовано проведение одновременного химиолучевого лечения. Учитывая соматическое состояние пациента, сопутствующую патологию и показатели функции почек, в качестве лекарственного компонента лечения применялся цетуксимаб.
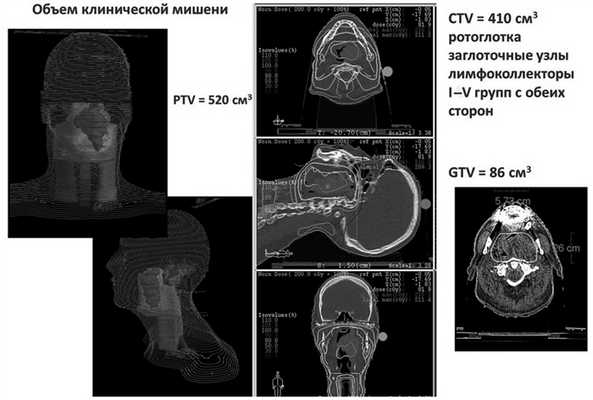
Риск нутритивной недостаточности по критериям MUST, опросникам NRS-2002 и ESMO был оценен как высокий. Учитывая соматическое состояние пациента, локализацию и объем опухолевого поражения, план биолучевого лечения по радикальной программе, в том числе объем облучения 520 см 3 , риск развития выраженных побочных эффектов лечения (мукозита, дерматита) также был оценен как высокий (рис. 2). Рис. 2. Дозное распределение при лучевом терапевтическом воздействии на локорегионарную область ротоглотки, включая заглоточные лимфатические узлы и лимфоколлекторы шеи Ib—IV групп с обеих сторон. PTV — планируемый объем облучения мишени; CTV — клинический объем мишени; GTV — макроскопический объем опухоли.
С 05.03.13 по 16.05.13 проведено одновременное химиолучевое лечение в разовой очаговой дозе (РОД) 2 Гр до СОД 70 Гр с цетуксимабом (стартовая доза 800 мг, далее 1 раз в неделю, поддерживающая доза 500 мг) (см. рис. 2). В процессе терапии имели место выраженные лучевые реакции в виде мукозита III степени RTOG, проявившиеся на ранних сроках (СОД 24 Гр), которые потребовали незапланированного перерыва в лечении в течение 14 календарных дней (СОД 40 Гр) (рис. 3). Рис. 3. Клиническая картина динамики мукозита в процессе лечения. Также отмечались характерные для таргетного препарата кожные реакции в виде папулезно-пустулезных высыпаний на коже лица, головы, груди, шеи, максимально выраженные до III степени через 2 дня после 4-го введения цетуксимаба, на фоне дерматита лица и шеи II степени в проекции полей облучения (рис. 4). Рис. 4. Клиническая картина динамики дерматита в процессе лечения. Пациенту проведены облучение в полном объеме, а также все запланированные введения цетуксимаба.
С 1-го дня лучевого лечения проведена профилактическая ранозаживляющая терапия гелем с деринатом с последующей интенсификацией обработок по мере проявления мукозита. Больному было рекомендовано ежедневно полоскать полость рта теплыми дезинфицирующими растворами, например отваром ромашки, шалфея и др. Назначена механически и химически щадящая богатая белком диета с исключением алкогольных напитков. Также пациенту на пике лучевых реакций потребовалась обезболивающая терапия, проведение которой позволило обеспечить удовлетворительное качество жизни и полноценное питание пациента per os на всем протяжении лечения и после его завершения. Нутритивную поддержку проводили, используя специализированное питание нейтрального вкуса, с расчетом объема по энергетическим затратам и потерям белка, а также подключением смесей с пищевыми волокнами при появлении запора. В рамках борьбы с дерматитом проводили увлажнение и обработку кожи кремом с витамином K, а также такие профилактические меры, как защита кожи от солнца и механических травм. Следует отметить, что пациент тщательно выполнял все назначения.
При осмотре через 1 нед после окончания химиолучевой терапии клинически экзофит опухоли не определялся. Отмечено стихание мукозита до I степени RTOG и дерматита до I степени RTOG (см. рис. 3, 4). Далее еще через 1 нед лучевые реакции стихли полностью. По данным контрольного обследования через 1,5 мес получены данные, подтверждающие полный эффект, признаков остаточной опухоли не выявлено. Пациент оставлен под наблюдением. В поздние сроки единственным негативным последствием являлась ксеростомия I степени RTOG, не мешающая пациенту жить и работать в привычном ему до болезни ритме. В настоящее время безрецидивный срок наблюдения пациента составляет 6 лет.
Таким образом, в рамках существующих подходов к лечению больных с опухолями головы и шеи требуются не только высокий уровень методик противоопухолевого воздействия, но и комплексная программа терапии сопровождения и реабилитации. При детальном рассмотрении переносимости биолучевой терапии обращает на себя внимание достаточно интенсивное течение лучевых реакций с ранним их развитием до III степени RTOG и быстрым стиханием по завершении лечения. Вынужденный 14-дневный перерыв в облучении не выходит за рекомендованные в мировой практике рамки сроков реализации радикального курса, позволяющие говорить о полноценной реализации противоопухолевого эффекта. Полученный результат лечения в полной мере подтверждает этот факт. Терапия сопровождения, если не обеспечивает отсутствие выраженных реакций в силу, видимо, их неизбежности на современном уровне развития лучевой и лекарственной терапии, все же позволяет оптимизировать сроки проведения специального лечения, максимально нивелировать проявления мукозита и дерматита как с точки зрения качества жизни пациентов, так и ускорения их реабилитации по завершении курса облучения. Это особенно важно в случае этапного комбинированного и комплексного лечения больных с опухолями головы и шеи. Таким образом, мультидисциплинарный подход к ведению этой сложной категории больных с применением адекватного сопроводительного лечения позволяет рассчитывать на достаточно хорошую переносимость агрессивных методик химиолучевого лечения даже при значительных объемах облучения и у соматически отягощенных больных. В последние годы это позволяет значительно чаще брать на лечение пациентов, которым ранее в нем было отказано либо план химиолучевой терапии которых не был бы реализован в полном объеме.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Материалы конгрессов и конференций
Злокачественные опухоли в области головы и шеи в общей структуре онкологической заболеваемости составляют около 15%, а основным морфологическим видом новообразований является плоскоклеточный рак (2). За последние 15 лет заболеваемость раком слизистой оболочки полости рта , глотки, гортани возросла на 15-17%. Около 90% больных - это люди работоспособного возраста (30-60 лет) и, несмотря на так называемую «визуальную» локализацию данных новообразований, 60-70% больных поступают на лечение с местно-распространенными опухолевыми процессами (III-IV стадии). Традиционными методами лечения опухолей головы и шеи являются лучевой, хирургический и комбинированный. Показатели выживаемости больных с местно-распространенными опухолями головы и шеи после радикальных оперативных вмешательств составляют 40-50%, и 20-30% после лучевой терапии в самостоятельном плане. В течение последних 10 лет подходы к лечению местно-распространенного рака головы и шеи существенно изменились благодаря появлению новых активных противоопухолевых препаратов, а также широкому применению оптимальных вариантов химиотерапии в сочетании с хирургическим или лучевым лечением.
Целью применения лекарственных препаратов является уменьшение частоты местных рецидивов и метастазов, снижение частоты отдаленного метастазирования и сохранение функции пораженного органа, а следовательно повышение качества жизни больных после проведенного лечения. Лекарственные препараты используют в качестве: а) неоадъювантной химиотерапии с последующим стандартным оперативным лечением или лучевой терапией; б) адъювантной химиотерапии после хирургического или лучевого лечения. В задачу неоадъювантной химиотерапии входит: 1) уменьшение массы опухоли, 2) уничтожение микрометастазов, 3) проведение операции в абластичных условиях. При достаточном уменьшении размеров опухоли на втором этапе производится операция или лучевая терапия. Целью адъювантной химиотерапии является подавление активности и разрушение микрометастазов после эффективного хирургического или лучевого лечения. Комбинация химиотерапии и лучевого лечения в одновременном или последовательном сочетании направлена на снижение частоты локальных рецидивов и метастазов.
Применение химиотерапии при плоскоклеточном раке головы и шеи начиналось 25 лет назад с монохимиотерапии метотрексатом. В последующем стали использовать цисплатин и блеомицин, что позволило повысить общую эффективность на 6-20%, а полный эффект отмечался у 2-5% больных, что, естественно, не отражалось на выживаемости больных. Комбинация цисплатина с 5-фторурацилом позволила получить у 50-60% больных объективный клинический эффект (6). Эти препараты и на сегодняшний день остаются главными лекарствами, применяемыми в клинических исследованиях при плоскоклеточном раке головы и шеи. Многочисленные исследования показали необходимость проведения не менее 2-х курсов химиотерапии для правильной оценки эффекта (6). У больных с гистологически доказанным полным эффектом после химиотерапии выживаемость была выше по сравнению с больными с частичным эффектом. После успешной химиотерапии можно проводить эффективную лучевую терапию или выполнять хирургическое вмешательство без серьезных осложнений. Снижается также частота отдаленного метастазирования.
С целью повышения эффективности полихимиотерапии 5-фторурацилом и цисплатином проводится фармакологическая модуляция 5-фторурацила с использованием лейковорина. Лейковорин подавляет синтез тимидина, подавляя одновременно цитотоксический эффект аллопуринола, который подавляет фосфолитическую активность трансферазы. Следовательно, дозы 5-фторурацила могут быть повышены. При индукционном режиме полихимиотерапии объективный клинический эффект достигнут у 80% больных (среди них полный клинический эффект у 29%) при использовании 2-х циклов химиотерапии. Однако, лейковорин позволяет не только повысить эффективность 5-фторурацила, но одновременно повышает степень поражения слизистой желудочно-кишечного тракта. В связи с этим отмечена тенденция к снижению дозы лейковорина до 20 мг/м 2 . Последние годы в качестве модулятора 5-фторурацила стал использоваться метотрексат в дозе 20 мг/м 2 , так как имеются данные о кумулятивном влиянии метотрексата на 5-фторурацил (4,7).
С целью повышения эффективности терапии изучаются также возможности длительной внутривенной инфузии 5-фторурацила в сочетании с платидиамом при раке головы и шеи. Вот одна из используемых схем: платидиам 100 мг/м 2 в 1-й день в течение 5-ти часов и 5-фторурацил по 750-1000 мг/м 2 в сутки 1-5 день в виде непрерывной 11-часовой инфузии. Эффективность этой схемы по данным различных авторов колеблется от 13 до 40% полной клинической регрессии и от 60 до 90% частичной. В клинике опухолей головы и шеи данное лечение было проведено 85 больным плоскоклеточным раком слизистой оболочки дна полости рта III-IV стадий. Интервал между курсами составил 2,5-3 недели. После химиотерапии полная регрессия опухоли отмечена у 11% больных, частичная - у 40%, а у 43% отмечена стабилизация процесса, и у 6% прогрессирование опухоли. На втором этапе было проведено лучевое лечение. Эффект от лучевой терапии был отмечен у тех больных, которые имели регрессию опухоли после лекарственной терапии. Уменьшение опухоли более чем на 50% после предшествующей комбинированной химиотерапии и одного курса лучевой терапии является показанием к продолжению консервативного лечения по радикальной программе (2).
Использование химиотерапии и лучевой терапии, применяемых одновременно или последовательно, может быть одним из перспективных направлений в улучшении эффективности лечения больных злокачественными новообразованиями головы и шеи. Механизмы, посредством которых химиотерапия потенцирует цитотоксический эффект радиотерапии, включают: 1) подавление репродукции сублетально поврежденных клеток; 2) сенсибилизацию гипоксических клеток, 3) синхронизацию клеточного деления.
Лекарства, оказывающие цитостатический эффект при опухолях головы и шеи (цисплатин и его различные аналоги, 5-фторурацил, блеомицин, метотрексат), клинически изучены как в режиме моно-, так и полихимиотерапии в сочетании с лучевой терапией. Имеются многочисленные исследования по использованию химиотерапии в сочетании с облучением. Однако, при клинических исследованиях не выявлено какой-либо одной наиболее эффективной схемы лечения. В то же время большинство авторов отдают предпочтение полихимиотерапии по сравнению с монохимиотерапией. В большинство этих схем включаются препараты цисплатин и 5-фторурацил. Нет также единого мнения об одновременном или последовательном применении химиотерапии и облучения.
Более 10 лет изучаются возможности использования химиотерапии в сочетании с облучением как органосохраняющего лечения рака гортани и гортаноглотки и как альтернатива хирургическому методу лечения, который пока еще остается стандартным подходом в лечении местно-распространенного рака этих локализаций. Отдаленные результаты полного удаления гортани при III-IV стадиях рака этого органа составляют 55-65%, но после ларингэктомии практически все пациенты становятся инвалидами и нуждаются в функциональной и психологической реабилитации. В ряде исследований была показана возможность использования химиолучевого лечения как альтернатива хирургическому у отдельно отобранных больных местно-распространенным раком гортани с хорошими результатами. 332 больных раком гортани III-IV стадии были рандомизированы на 2 группы. Первая группа получала 2-3 цикла химиотерапии с использованием цисплатина и 5-фторурацила с последующей лучевой терапией в радикальных дозах. Вторая группа больных была оперирована с последующим облучением. Анализ результатов показал, что никакой значительной разницы в результатах лечения между двумя группами больных не имеется. После двух курсов химиотерапии полный клинический эффект был достигнут у 31% больных, частичный - у 54%. После трех циклов химиотерапии полный клинический эффект был отмечен у 49% больных. Частота местных рецидивов была выше в группе больных, получавших химиотерапию (20% против 7% в группе оперированных больных). В то же время частота отдаленных метастазов после хирургического лечения была выше по сравнению с группой больных, получавших химиолучевое лечение - 17%, против 11%. Безрецидивное течение заболевания в обеих группах было одинаковым и составило 53,3% и 55,9% соответственно в сроки наблюдения за больными в среднем 33 месяца. Таким образом, у 53% больных была сохранена гортань после химиолучевой терапии (6).
В нашей клинике химиолучевое лечение рака гортани III стадии проведено 78 больным. Проводились 2 курса химиотерапии цисплатином, 5-фторурацилом и блеомицетином с лучевой терапией. Регионарные рецидивы и метастазы выявлены у 10%, отдаленные метастазы у 4%. Без рецидива и метастазов с сохраненной гортанью живы 83% больных. Пятилетняя выживаемость после дополнительного хирургического лечения локальных рецидивов и метастазов составила 88%. Таким образом, полученные данные показывают, что применение химиотерапии в комбинации с лучевой терапией является эффективной стратегией в отношении сохранения гортани, причем не снижая отдаленных результатов лечения и не повышая токсичности и нежелательных последствий для больного.
В последние годы активно изучаются возможности неоадъювантной химиотерапии в сочетании с операцией при раке головы и шеи. Проводится сравнение результатов лечения и осложнений при традиционном комбинированном лечении (лучевая терапия + операция) с различными схемами неоадъювантной химиотерапии цисплатином, 5-фторурацилом, метотрексатом и операцией на втором этапе. Неоадъювантная химиотерапия, проведенная с эффектом, вызывает большее угнетение пролиферативной активности опухоли по сравнению с лучевой терапией. Послеоперационные осложнения в группе предоперационной химиотерапии развиваются почти в два раза реже по сравнению с группой предоперационной лучевой терапии (2,8).
Химиотерапия, проведенная в предоперационном периоде, снижает частоту появления рецидивов и метастазов по сравнению с комбинированным лечением и увеличивает 5-летнюю выживаемость на 10%. Предоперационная химиотерапия позволяет выполнять функционально-щадящие операции у 80% больных (1).
В последние годы в клинике появился ряд новых противоопухолевых препаратов - паклитаксел, доцетаксел, относящихся к группе таксанов. Эффективность этих препаратов при опухолях головы и шеи только начинает изучаться. Отмечено, что одна треть больных реагирует на монохимиотерапию таксанами. Эффект резко повышается (до 70-75%) при комбинации с 5-фторурацилом и цисплатином. Имеются отдельные работы по комбинации паклитаксела с 5-фторурацилом и облучением. Эффективность достигает 80% (5,9). Однако, это лишь предварительные результаты клинических исследований данных препаратов при опухолях головы и шеи. Проблема требует дальнейшего тщательного изучения.
В заключении следует отметить, что использование противоопухолевых лекарственных препаратов в лечении злокачественных новообразований головы и шеи позволяет улучшить результаты лечения, снизить частоту отдаленного метастазирования, сохранить пораженный орган. Наша цель - шире использовать химиотерапию для разработки более рациональных подходов к лечению опухолей головы и шеи.
Список литературы.
1. Карасева В.В.. Комбинированная химиотерапия плоскоклеточного рака полости рта и ротоглотки. Автореферат дисс. док. мед. наук. Москва, 1998.
2. Пачес А.И.. Опухоли головы и шеи. Москва. 1997. 467 стр.
3. Уваров А.А.. Органосохраняющие методы лечения местнораспространенного рака орофарингеальной области. Диссертация док. мед. наук. Москва, 1997.
4. Brigham B.A. et al. Role of folinic acid in Methotrexate treatment of head and neck squamous cancers. Proc. ASCO 1998. Abstr. 1518.
5. Dang T.P. et al. Carboplatin and Taxol as induction therapy for locally advanced carcinoma of the Head and Neck. Proc. ASCO 1998. Abstr. 1516.
6. Dimery Y.W. W.K. Hong. Overview of Combined Modality Therapies for Head and Neck cancer. National Cancer Institute. Vol. 85, № 2, 1993. pp. 95-111.
7. Dreyfuss A.I. et al. Docetaxel: An Active Drug for squamous cell carcinoma of the Head and Neck. J. Clin. Oncol. Vol. 14, № 5, 1996. pp. 1672-1678
9. Vokes E.E. et al. Intensive concominant chemoradiotherapy (CT/XRT) for head and neck cancer (HNC): high locoregional control and organpreservation (OP) rates. Proc. ASCO 1998. Abstr. 1485.
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Опухоли головы и шеи
К опухолям головы и шеи относят онкологические заболевания носа, рта, гортани, глотки, слюнных желез, придаточных пазух. Опухоли эндокринной, лимфатической, центральной нервной системы и глаз в эту группу не входят.
Доля опухолевых образований области головы и шеи составляет около 20% онкологической заболеваемости. Часто эти опухоли оказываются очень агрессивны: они быстро растут, дают множественные метастазы и с трудом поддаются лечению. Для того, чтобы успешно справляться с опухолями головы и шеи, онкологи взаимодействуют с узкими специалистами, в частности, с отоларингологами, стоматологами и дерматологами.

По расположению различают опухоли губ, слизистой оболочки и полости рта, языка, слюнных желез, глотки, гортани, носа, околоносовых пазух.
Опухоли головы и шеи могут иметь соединительнотканное, эпителиальное, нейрогенное происхождение. По степени зрелости клеток среди них выделяют высокодифференцированные и незрелые, последние хуже поддаются лечению и ухудшают общий прогноз.
Спровоцировать развитие опухолей головы и шеи могут различные причины. Вот лишь некоторые из них:
- злоупотребление алкоголем;
- курение и нюхательно-жевательный табак;
- употребление спиртосодержащих жидкостей для ополаскивания полости рта;
- некоторые вирусы (вирус Эпштейна-Барр, вирус папилломы человека и др.);
- профессиональные вредности (контакт с древесной и текстильной пылью, сажей, краской, металлом и др.);
- радиоактивное излучение;
- регулярное употребление слишком горячей пищи.
Чаще всего новообразования головы и шеи возникают у пациентов в возрасте старше 50 лет. Клинические проявления опухолей данной группы в зависимости от расположения и стадии могут быть очень разнообразными.
Рак губы
До 95% случаев рака губы встречается у мужчин, типичным местом локализации опухоли является нижняя губа. С точки зрения гистологии, злокачественные опухоли губы обычно представляют собой плоскоклеточный рак. Ему чаще всего предшествуют предраковые состояния — хронические трещины, ограниченный гиперкератоз, бородавчатый предрак и др.
Для рака губы на разных стадиях развития характерны местные изменения в виде вдавления или болезненной эрозии, покрытой корочками. Со временем рак губы захватывает все большую площадь и может изъязвляться. Благодаря особенностям расположения рак губы легко распознается на ранних стадиях, поэтому хорошо поддается лечению.
Рак полости рта
До 50% злокачественных опухолей полости рта приходится на рак языка, еще 20% случаев составляет рак дна ротовой полости. Опухоль часто развивается на месте лейкоплакии (характерных роговых пластинок), гиперкератической красной волчанки или красного плоского лишая.

Внешне рак полости рта может иметь вид язвы или инфильтрата (уплотнения). В ряде случаев опухоль выступает над поверхностью слизистой. По строению ткани среди онкологических заболеваний полости рта преобладает плоскоклеточный рак, реже встречается аденокарцинома. Для рака полости рта характерно быстрое и незаметное прорастание в здоровые окружающие ткани и метастазирование в региональные лимфоузлы.
Уже на ранних стадиях рака ротовой полости пациентов беспокоят боль и неприятные ощущения, позднее присоединяются затруднения при глотании и разговоре, припухлость, язвочки, кровотечения из ротовой полости. По мере роста опухоли все симптомы усиливаются, что и становится поводом для обращения к врачу.
Рак слюнных желез
В структуре злокачественных опухолей головы и шеи рак слюнных желез составляет 3-5%. Преимущественно поражаются крупные околоушные железы, а опухоли малых слюнных желез в основном локализуются на нёбе. В слюнных железах можно обнаружить следующие формы:
- мукоэпидермоидный рак;
- ацинозно-клеточный рак;
- цилиндрома; .
Рак слюнных желез дает метастазы в близлежащие лимфатические узлы, иногда — в легкие и кости. Клинически он протекает безболезненно, при осмотре можно обнаружить лишь уплотнение. При прорастании в соседние ткани рак слюнных желез вызывает парез лицевого нерва.
Рак гортани и глотки
Рак гортани в структуре всех злокачественных опухолей составляет около 2%. Наиболее частые его морфологические варианты- плоскоклеточный рак и аденокарцинома. Опухоль может прорастать в стенки органа или имеет вид бугристых разрастаний на широком основании. Рак верхнего отдела гортани считается очень опасным, при поражении голосовых связок прогноз благоприятнее, так как опухоль в этом случае растет медленнее и редко дает метастазы.
Пациенты с раком гортани долгое время жалуются на першение в горле, ощущение инородного тела. При поражении надгортанника рано появляются боли при глотании, если опухоль возникла в области голосовых связок, у больного может наблюдаться охриплость голоса вплоть до полного его исчезновения.
На рак глотки приходится до 12% опухолей головы и шеи. Для него характерны ранние метастазы в лимфоузлы. Рак гортани развивается в труднодоступном для обозрения месте, часто без каких-либо симптомов, поэтому, как правило, обнаруживается на поздних стадиях, когда у пациента уже затрудняется носовое дыхание, ухудшается слух, появляется гнусавость голоса.
Диагностика и лечение
Многие опухоли головы и шеи можно обнаружить при простом осмотре. Если поражается носовая полость, пазухи, гортань или глотка, для осмотра используют специальные инструменты с зеркалами, а также эндоскопическое оборудование. При пальпации можно обнаружить увеличенные лимфатические узлы, а также саму опухоль в виде уплотнения, подвижного или спаянного с соседними тканями.
Новообразования мягких тканей, околоушных слюнных желез легко обнаружить при помощи ультразвукового исследования. Большую роль в детализации строения опухолей головы и шеи играют рентгенологические методы исследования — компьютерная и магнитно-резонансная томография. Окончательный диагноз позволяет установить биопсия ткани опухоли и ее гистологическое изучение.

Радикальный способ лечения опухолей головы и шеи — хирургическое удаление новообразования и региональных лимфатических узлов. Для опухолей первой стадии бывает достаточно только операции, на второй стадии хирургическое лечение комбинируют с радиологическим. Иногда курс лучевой терапии назначают перед оперативным вмешательством для уменьшения размеров опухоли и предупреждения появления метастазов. Облучению в обязательном порядке подвергаются также расположенные в непосредственной близости от опухоли лимфатические узлы.
При раннем обнаружении опухоли в носовой полости, синусах, глотке применяют эндоскопический доступ, если образование небольшое, ограничено капсулой и находится на поверхности слизистой, может быть использована крио- или лазерная деструкция,фотодинамическая терапия. Это наиболее щадящие способы лечения. После удаления опухоли из-за особенностей ее расположения и функционирования пациентам часто необходима пластика в области шеи и лица.
Комбинацию лучевой и химиотерапии применяют с паллиативной целью, когда опухоль невозможно удалить полностью.
Лучевая терапия
Лучевая терапия — это один из ведущих методов противоопухолевого лечения, основанный на использовании ионизирующего излучения. Может применяться как самостоятельный вид терапии, так и в рамках комбинированного/комплексного лечения (совместно с другими методами), в качестве радикальной, нео- и адъювантной, консолидирующей, профилактической и паллиативной терапии.
Эффективность данного метода основана на повреждении ДНК. Существуют различные механизмы, позволяющие более эффективно разрушать опухолевые клетки в сравнении с нормальными. Во-первых, опухолевые клетки более активно делятся, соответственно, их ДНК чаще находится в «рабочем» режиме, когда она менее устойчива к воздействию ионизирующего излучения. По той же причине большая часть острых лучевых реакций представлена мукозитами, то есть воспалением слизистых, которым также свойственно активное деление. Во-вторых, окружающие здоровые клетки способствуют восстановлению поврежденных, подвергшихся лучевому воздействию. Поэтому важно сделать так, чтобы в объём облучения попало как можно меньше здоровой ткани. В-третьих, современное оборудование для лучевой терапии, управляемое командой грамотных специалистов, позволяет подвести максимально высокие дозы прямо в мишень, существенно снижая дозу ионизирующего излучения, приходящуюся к окружающим здоровым органам и тканям.

Виды лучевой терапии
Уже несколько десятилетий человечество изучает воздействие ионизирующего излучение на организм человека. При этом акцентируется внимание как на положительном, так и отрицательном эффекте, возникающем при его применении. Разрабатываются новые методы, которые позволяют добиваться максимального лечебного эффекта при снижении отрицательного действия на организм. Улучшается оборудование для проведения лучевой терапии, появляются новые технологии облучения.
Сейчас классификация методов лучевой терапии довольно обширна. Мы остановимся только на самых распространенных методиках.
Контактная лучевая терапия
При контактной лучевой терапии источник излучения вводится непосредственно в опухоль или прилегает к ее поверхности. Это позволяет прицельно облучать новообразование с минимумом воздействия на окружающие его ткани.
К контактным видам лучевой терапии относятся:
- Аппликационная лучевая терапия. Применяется при лечении поверхностно расположенных опухолей, например, новообразований кожи, слизистых оболочек гениталий. В этом случае используются индивидуально изготовленные аппликаторы, которые накладываются непосредственно на поверхность новообразования.
- Внутриполостная лучевая терапия. Источник ионизирующего излучения вводится в просвет полого органа, например, в пищевод, мочевой пузырь, прямую кишку, полость матки или влагалища. Для облучения используются специальные аппликаторы (их называют эндостатами), которые заполняются радионуклидами.
- Внутритканевое облучение. Источник ионизирующего излучения вводится непосредственно в ткань опухоли. Для этого используются интростаты, которые могут иметь вид игл, шариков, трубочек, заполненных источником излучения.
Кроме того, существует такой вид лечения, как радионуклидная терапия. В этом случае используются открытые источники излучения в виде растворов радионуклидов (радиофармацевтический препарат — РФП), которые при попадании в организм прицельно накапливаются в опухолевых очагах и уничтожают их. Чаще всего РФП вводится внутривенно. Наибольшее распространение получили следующие виды радионуклидной терапии:
- Терапия радиоактивным йодом. Используется для лечения ряда видов рака щитовидной железы, поскольку йод избирательно накапливается в тиреоидной ткани.
- Применение остеотропных РФП используется для лечения метастазов в костях или костных опухолей.
- Радиоиммунотерапия — радионуклиды присоединяют на моноклональные антитела, чтобы добиться прицельного воздействия на опухолевую ткань.
Дистанционная лучевая терапия
При дистанционной лучевой терапии источник излучения находится на расстоянии от тела пациента, при этом на пути его прохождения могут лежать здоровые ткани, которые в процессе проведения терапии также подвергаются облучению, что приводит к развитию осложнений разной степени выраженности. Чтобы их минимизировать, разрабатываются различные технологии, позволяющие сконцентрировать максимальную дозу ионизирующего излучения непосредственно на в мишени (опухоли). С данной целью используются:
- Короткофокусная рентгенотерапия. При облучении используется рентгеновское излучение малой и средней мощности, которое способно проникать в ткани на глубину до 12 мм. Метод назван так из-за того, что источник располагается на коротком расстоянии от облучаемой поверхности. Таким способом лечат неглубокие опухоли кожи, вульвы, конъюнктивы и век, ротовой полости.
- Гамма-терапия. Этот вид излучения имеет большую проникающую способность, поэтому может использоваться для лечения более глубоко расположенных опухолей, нежели рентген-терапия. Однако сохраняющаяся большая нагрузка на окружающие органы и ткани приводят к ограничению возможности использования данного метода в современной онкологии.
- Фотонная терапия. Именно этим видом излучения проводится лучевое лечение большинства онкологических пациентов в современном мире. Достаточно высокая проникающая способность в сочетании с высокотехнологичными способами подведения дозы (IMRT и VMAT), достаточно совершенные системы планирования позволяют очень эффективно использовать этот вид излучения для лечения пациентов с приемлемыми показателями токсичности.
- Применение корпускулярного излучения (электроны, протоны, нейтроны). Эти элементарные ядерные частицы получают на циклотронах или линейных ускорителях. Электронное излучение используют для лечения неглубоких опухолей. Большие надежды возлагаются на протонную терапию, с помощью которой можно максимально прицельно подводить высокие дозы излучения к глубоко расположенным опухолям при минимальном повреждении здоровых тканей за счет выделения радиационной дозы на определённом отрезке пробега частиц, однако пока эти виды излучения играют сравнительно небольшую роль в лечении онкологических заболевания из-за своей высокой стоимости и ряда не до конца решённых технологических аспектов реализации метода.
Этапы лучевой терапии
Весь процесс проведения лучевой терапии делят на три этапа:
- Предлучевая подготовка (КТ-симуляция), этап выбора объёмов облучения и критических структур, этап дозиметрического планирования, верификации плана лучевой терапии.
- Этап облучения.
- Постлучевой этап.
Этап планирования
Как правило, этап планирования занимает несколько дней. В это время проводятся дополнительные исследования, которые призваны дать возможность врачу более точно оценить границы опухоли, а также состояние окружающих ее тканей. Это может повлиять на выбор вида лучевой терапии, режима фракционирования, разовой и суммарной очаговых доз. Основой же данного этапа является выполнение так называемой КТ-симуляции, то есть компьютерной томографии необходимого объёма с определёнными параметрами и в определённом положении тела пациента. Во время КТ-симуляции на кожу пациента и/или его индивидуальные фиксирующие устройства наносятся специальные метки, призванные помочь правильно укладывать пациента в дальнейшем, а также облегчить задачу навигации по время проведения сеансов облучения.
Затем врач-радиотерапевт рисует объёмы облучения и критических структур (тех, на которые будет предписано ограничение дозы) на полученных срезах КТ с учётом данных других диагностических модальностей (МРТ, ПЭТ). Далее формируется задача для медицинского физика, включающая определение доз, которые должны быть подведены к мишени, мишеням или отдельным её частям, а также тех, которые не должны быть превышены в объёмах здоровых органов и тканей. Медицинский физик разрабатывает дозиметрический план в соответствии с заданными параметрами, при соблюдении которых и успешной верификации данного плана на фантоме, можно считать пациента готовым к лучевой терапии.
На этапе подготовки к лучевой терапии пациенту рекомендуется придерживаться нескольких правил:
- Отказаться от средств, раздражающих кожу.
- Если на коже в месте воздействия имеются повреждения или элементы сыпи, следует проконсультироваться с врачом.
- Если предполагается лучевая терапия в челюстно-лицевой области, требуется санация полости рта.
- Воздержаться от загара.
- Главное правило на любом этапе: обсудить все нюансы предстоящих подготовки и лечения с лечащим врачом-радиотерапевтом и строго придерживаться полученных рекомендаций!
Этап облучения
Проведение этапа облучения будет зависеть от выбранного метода лучевой терапии.
Проведение дистанционной лучевой терапии
Продолжительность курса дистанционной лучевой терапии зависит от выбранного режима фракционирования, а также цели лечения. Паллиативные курсы, как правило, короче неоадъювантных и адъювантных, а те, в свою очередь, менее продолжительны, чем радикальные. Однако подведение радикальной дозы возможно и за один-несколько сеансов в зависимости от клинической ситуации. В таком случае курс дистанционной лучевой терапии называется стереотаксической радиотерапией или радиохирургией. Варьирует и кратность сеансов в день и в неделю: чаще всего используются схемы с пятью сеансами в неделю, однако могут быть предложены и 2-3 сеанса в день (гиперфракционирование) и схемы с 1-4 и 6 сеансами в неделю.
Во время облучения пациент в подавляющем большинстве случаев располагается лежа на столе специальной установки. Крайне необходимо соблюдать полную неподвижность во время сеанса облучения. Для достижения этого могут использоваться специальные фиксирующие устройства и системы иммобилизации.
Перед тем как включить установку, медперсонал покидает помещение, и дальнейшее наблюдение осуществляется через мониторы или окно. Общение с пациентом осуществляется по громкой связи. Во время выполнения сеанса, части аппарата и стол с пациентом совершают движения по заданной траектории. Это может создавать шум и беспокойство у больного. Однако бояться этого не стоит, поскольку вся процедура контролируется.
Сам сеанс лучевой терапии может длиться как 5-10, так и 60-120 минут, чаще — 15-30 минут. Само воздействие ионизирующего излучения не вызывает никаких физических ощущений. Однако в случае ухудшения самочувствия пациента во время сеанса (выраженной боли, судороги, приступа тошноты, паники), следует позвать медицинский персонал заранее оговоренным способом; установку сразу отключат и окажут необходимую помощь.
Контактная лучевая терапия (брахитерапия)
Брахитерапия проводится в несколько этапов:
- Введение в облучаемую зону неактивных проводников — устройств, в которые затем имплантируют источник ионизирующего излучения. При внутриполостной лучевой терапии используются приспособления, называемые эндостатами. Их устанавливают непосредственно в полость облучаемого органа и рядом с ним. При внутритканевой лучевой терапии используются интростаты, которые устанавливаются непосредственно в ткань опухоли по заранее просчитанной схеме. Для контроля их установки, как правило, используются рентгенологические снимки.
- Перемещение источника излучения из хранилища в интро- и эндостаты, которые будут облучать опухолевую ткань. Время облучения и особенности поведения пациента будут зависеть от вида брахитерапии и используемого оборудования. Например, при внутритканевой терапии, после установки источника ионизирующего излучения пациент может покинуть клинику и прийти на повторную процедуру через рекомендуемый промежуток времени. Весь этот период в его организме будет находиться интростат с радионуклидами, которые будут облучать опухоль.
Проведение внутриполостной брахитерапии будет зависеть от используемых установок, которые бывают двух типов:
- Установки низкой мощности дозы. В этом случае один сеанс облучения длится около 2-х суток. Под наркозом имплантируются эндостаты. После контроля правильности их установки и введения радионуклидов, пациент переводится в специальное помещение, где должен будет находиться все время, пока длится процедура, соблюдая строгий постельный режим. Разрешается только немного поворачиваться на бок. Вставать категорически запрещено.
- Установки высокой мощности дозы. Время облучения составляет несколько минут. Для установки эндостатов наркоза не требуется. Но во время процедуры все равно необходимо лежать абсолютно неподвижно. Внутриполостная лучевая терапия установкой высокой мощности проводится несколькими сеансами с интервалами от одного дня до одной недели.
Радионуклидная терапия
При радионуклидной терапии пациент принимает радиофармпрепараты внутрь в виде жидкого раствора, капсул или инъекций. После этого он помещается в специальную палату, имеющую изолированную канализацию и вентиляцию. По истечении определенного срока, когда мощность дозы снизится до приемлемого уровня, проводится радиологический контроль, пациент принимает душ и переодевается в чистую одежду. Для контроля результатов лечения проводится сцинтиграфия, после чего можно покинуть клинику.
Как вести себя во время лучевой терапии
Лучевая терапия является серьезным стрессом для организма. У многих пациентов в этот период ухудшается самочувствие. Чтобы его минимизировать рекомендуется придерживаться следующих правил:
- Больше отдыхать. Минимизируйте физическую и интеллектуальную нагрузку. Ложитесь спать, когда почувствуете в этом необходимость, даже если она возникла в течение дня.
- Постарайтесь сбалансировано и полноценно питаться.
- Откажитесь на время проведения терапии от вредных привычек.
- Избегайте плотной обтягивающей одежды, которая бы могла травмировать кожу.
- Следите за состоянием кожи в месте облучения. Не трите и не расчесывайте ее, используйте средства гигиены, которые вам порекомендует врач.
- Защищайте кожу от воздействия солнечных лучей — используйте одежду и головные уборы с широкими полями.

Побочные эффекты лучевой терапии
Лучевая терапия, как и другие методы противоопухолевого лечения, вызывает ряд осложнений. Они могут быть общими или местными, острыми или хроническими.
Острые (ранние) побочные эффекты развиваются во время проведения радиотерапии и в ближайшие недели после неё, а поздние (хронические) лучевые повреждения — через несколько месяцев и даже лет после ее окончания.
Общие реакции
Угнетенное эмоциональное состояние
Подавляющее большинство пациентов, проходящих лечение по поводу злокачественного новообразования, испытывают тревожность, страх, эмоциональное напряжение, тоску и даже депрессию. По мере улучшения общего состояния, эти симптомы стихают. Чтобы облегчить их, рекомендуется чаще общаться с близкими людьми, принимать участие в жизни окружающих. При необходимости рекомендуется обратиться к психологу.
Чувство усталости
Чувство усталости начинает нарастать через 2-3 недели от начала терапии. На это время рекомендуется оптимизировать свой режим дня, чтобы не подвергаться ненужным нагрузкам. В то же время нельзя полностью отстраняться от дел, чтобы не впасть в депрессию.
Изменение крови
При необходимости облучения больших зон, под воздействие радиации попадает костный мозг. Это в свою очередь приводит к снижению уровня форменных элементов крови и развитию анемии, повышению риска кровотечения и развития инфекций. Если изменения выражены сильно, может потребоваться перерыв в облучении. В ряде случаев могут назначать препараты, стимулирующие гемопоэз (кроветворение).
Снижение аппетита
Обычно лучевая терапия не приводит к развитию тошноты или рвоты, но снижение аппетита наблюдается довольно часто. Вместе с тем, для скорейшего выздоровления требуется полноценное высококалорийное питание с высоким содержанием белка.
Локальные осложнения
Побочные реакции со стороны кожи
Вероятность развития кожных реакций и их интенсивность зависят от индивидуальных особенностей пациента. В большинстве случаев через 2-3 недели в области воздействия возникает покраснение. После окончания лечения оно сменяется пигментированием, напоминающим загар. Чтобы предотвратить чрезмерные реакции, могут назначаться специальные кремы и мази, которые наносятся после окончания сеанса. Перед началом следующего их необходимо смыть теплой водой. Если реакция выражена сильно, делают перерыв в лечении.
Реакции со стороны полости рта и горла
Если облучают область головы и шеи, могут развиться лучевой стоматит, который сопровождается болью, сухостью во рту, воспалением слизистых, а также ксеростомия вследствие нарушения функции слюнных желез. В норме эти реакции проходят самостоятельно в течение месяца после окончания лучевой терапии. Ксеростомия может беспокоить пациента в течение года и более.
Осложнения со стороны молочной железы
При прохождении лучевой терапии по поводу рака молочной железы могут возникать следующие реакции и осложнения:
- Покраснение кожи груди.
- Отек груди.
- Боль.
- Изменение размера и формы железы из-за фиброза (в некоторых случаях эти изменения остаются на всю жизнь).
- Уменьшение объема движения в плечевом суставе.
- Отек руки на стороне поражения (лимфедема).
Побочное действие на органы грудной клетки
- Воспаление слизистой пищевода, которое приводит к нарушению глотания.
- Кашель.
- Образование мокроты.
- Одышка.
Последние симптомы могут свидетельствовать о развитии лучевого пневмонита, поэтому при их возникновении следует немедленно обратиться к вашему врачу.
Побочные реакции со стороны прямой кишки/петель кишечника
- Расстройство стула — диарея или наоборот, запоры.
- Боли.
- Кровянистые выделения из заднего прохода.
Побочные действия со стороны мочевого пузыря
- Учащенное болезненное мочеиспускание.
- Наличие примеси крови в моче иногда может быть настолько выраженным, что моча приобретает кроваво-красный цвет.
- Наличие патологических примесей в моче — кристаллы, хлопья, гнойное отделяемое, слизь.
- Уменьшение емкости мочевого пузыря.
- Недержание мочи.
- Развитие везиковагинальных или везикоректальных свищей.
Побочные эффекты при облучении опухолей забрюшинного пространства, печени, поджелудочной железы
- Тошнота и рвота.
- Ознобы после сеансов.
- Боли в эпигастрии.
Химиолучевая терапия
Лучевая терапия довольно редко проводится в качестве самостоятельного лечения. Чаще всего она сочетается с каким-либо другим видом лечения: хирургическим, а чаще всего — с лекарственным. Это может быть как вариант одновременной химиолучевой терапии, так и последовательной, а также варианты сочетания лучевой терапии с иммунотерапией, таргетной и гормональной терапии. Такие виды лечения могут иметь ощутимо более высокую противоопухолевую эффективность, однако необходимо тщательно оценить риски совместных побочных эффектов, поэтому принятие решения о любом объёме лечения с онкологической патологией должен принимать мультидисциплинарный онкологический консилиум.
Читайте также:
