Векторы для переноса генов. Ретровирусы и аденовирусы в качестве векторов
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Трансфекция клеток
Для начала стоит ввести определения некоторых терминов. Транспорт генов осуществляется благодаря вектору - это молекула ДНК, используемая как «транспортное средство» для искусственного переноса генетической информации в клетку. Выделяют множество разновидностей векторов: плазмидные, вирусные, а также космиды, фазмиды, искусственные хромосомы и т.д. Принципиально важно, что векторы (в частности, плазмидные) обладают характерными для них свойствами: 1. Точка начала репликации (ori) - последовательность нуклеотидов, с которой начинается удвоение ДНК. Если векторная ДНК не сможет удваиваться (реплицироваться), то необходимый лечебный эффект не будет достигнут, потому что она просто быстро расщепится внутриклеточными ферментами-нуклеазами, а из-за недостатка матриц будет в итоге образовано гораздо меньше молекул белка. Следует отметить, что эти точки специфичны для каждого биологического вида, то есть если векторную ДНК предполагается получать путём её размножения в культуре бактерий (а не просто химическим синтезом, что обычно гораздо дороже), то потребуются отдельно две точки начала репликации - для человека и для бактерий; 2. Сайты рестрикции - специфические короткие последовательности (чаще палиндромные), которые узнаются специальными ферментами (эндонуклеазы рестрикции) и разрезаются ими определённым образом - с образованием «липких концов». Эти сайты необходимы для того, чтобы сшить векторную ДНК (которая, по сути, является «болванкой») с нужными терапевтическими генами в единую молекулу. Такая сшитая из двух или нескольких частей молекула зовётся «рекомбинантной»; 3. Понятно, что нам желательно бы получить миллионы копий рекомбинантной молекулы ДНК. Опять-таки, если мы имеем дело с культурой клеток бактерий, то далее эту ДНК нужно выделить. Проблема заключается в том, что далеко не все бактерии проглотят нужную нам молекулу, некоторые не станут этого делать. Чтобы эти две группы всё-таки различить, в векторную ДНК вставляют селективные маркёры - участки устойчивости к определённым химическим веществам; теперь если в среду добавить эти самые вещества, то выживут только те, которые обладают устойчивостью к ним, а остальные погибнут. Все эти три составляющие можно наблюдать и в самой первой искусственно синтезированной плазмиде: Сам процесс внедрения плазмидного вектора в определённые клетки называется трансфекцией. Плазмида - это довольно короткая и обычно кольцевая молекула ДНК, которая находится в цитоплазме бактериальной клетки. Плазмиды не связаны с бактериальной хромосомой, они могут реплицироваться независимо от нее, могут выбрасываться бактерией в окружающую среду или, наоборот, поглощаться (процесс поглощения - трансформация). С помощью плазмид бактерии могут обмениваться генетической информацией, например, передавать устойчивость к определённым антибиотикам. Плазмиды существуют в бактериях в естественных условиях. Но никто не может помешать исследователю искусственно синтезировать плазмиду, которая будет обладать нужными для него свойствами, вшить в нее ген-вставку и внедрить в клетку. В одну и ту же плазмиду можно вшивать разные вставки .
Методы генной терапии
Существует два основных подхода, различающиеся природой клеток-мишеней: 1. Фетальная, при которой чужеродную ДНК вводят в зиготу (оплодотворённую яйцеклетку) или эмбрион на ранней стадии развития; при этом ожидается, что введённый материал попадёт во все клетки реципиента (и даже в половые клетки, обеспечив тем самым передачу следующему поколению). В нашей стране она фактически запрещена ; 2. Соматическая, при которой генетический материал вводят уже родившемуся в неполовые клетки и он не передаётся половым клеткам. Генная терапия in vivo основана на прямом введении клонированных (размноженных) и определенным образом упакованных последовательностей ДНК в определённые ткани больного. Особенно перспективным для лечения генных болезней in vivo представляется введение генов с помощью аэрозольных или инъецируемых вакцин. Аэрозольная генотерапия разрабатывается, как правило, для лечения лёгочных заболеваний (муковисцидоз, рак лёгких). Разработке программы генной терапии предшествует много этапов. Это и тщательный анализ тканеспецифической экспрессии соответствующего гена (т. е., синтеза на матрице гена какого-то белка в определённой ткани), и идентификация первичного биохимического дефекта, и исследование структуры, функции и внутриклеточного распределения его белкового продукта, а также биохимический анализ патологического процесса. Все эти данные учитываются при составлении соответствующего медицинского протокола.
Прямая доставка и клеточные носители терапевтических генов
Существует множество методов внедрения чужеродной ДНК в эукариотическую клетку: некоторые зависят от физической обработки (электропорация, магнетофекция и т.д.), другие - от применения химических материалов или биологических частиц (например, вирусов), которые используются как переносчики. Сразу стоит оговориться, что обычно комбинируются химические и физические методы (например, электропорация + окутывание ДНК липосомами). Прямые методы 1. Трансфекция на химической основе может быть классифицирована на несколько видов: с использованием вещества циклодекстрина, полимеров, липосом или наночастиц (с или без химической или вирусной функционализации, т.е. модификации поверхности): а) Один из самых дешевых методов - использование фосфата кальция. Он повышает эффективность включения ДНК в клетки в 10-100 раз. ДНК образует с кальцием прочный комплекс, что обеспечивает его эффективное поглощение. Недостаток - ядра достигает всего около 1 - 10% ДНК. Метод используется in vitro для переноса ДНК в клетки человека: б) Применение сильноразветвленных органических молекул - дендример, для связывания ДНК и переноса её в клетку: в) Очень эффективным методом для трансфекции ДНК является внедрение её через липосомы - малые, окруженные мембраной тельца, которые могут сливаться с клеточной цитоплазматической мембраной (ЦПМ), представляющая собой двойной слой из липидов. Для эукариотических клеток трансфекция производится эффективнее с применением катионных липосом, потому что клетки к ним более чувствительны. Процесс имеет своё название - липофекция. Этот метод сегодня считается одним из самых безопасных. Липосомы нетоксичны и неиммуногенны. Однако, эффективность переноса генов с помощью липосом ограничена, поскольку внесенная ими ДНК в клетках обычно сразу же захватывается лизосомами и разрушается. Введение ДНК в клетки человека с помощью липосом сегодня является главным при терапии in vivo: г) Еще один метод - использование катионных полимеров, таких как диэтиламиноэтил-декстран или полиэтиленимин. Отрицательно заряженные молекулы ДНК связываются с положительно заряженными поликатионами, и этот комплекс далее проникает в клетку путём эндоцитоза. ДЭАЭ-декстран изменяет физические свойства плазматической мембраны и стимулирует поглощение этого комплекса клеткой. Главный недостаток метода заключается в том, что ДЭАЭ-декстран в высоких концентрациях токсичен. Метод не получил распространения в генотерапии; д) С помощью гистонов и других ядерных белков . Эти белки, содержащие много положительно заряженных аминокислот (Lys, Arg), в естественных условиях помогают компактно уложить длинную цепь ДНК в сравнительно небольшое ядро клетки. 2. Физические методы: а) Электропорация - очень популярный метод; мгновенное повышение проницаемости мембраны достигается за счет того, что клетки подвергаются коротким воздействиям интенсивного электрического поля. Показано, что в оптимальных условиях количество трансформантов может достигать 80% выживших клеток. На человеке на сегодняшний день не используется. б) «Cell squeezing» - метод, изобретенный в 2013 г. Он позволяет доставить молекулы в клетки путём "мягкого сдавливания" клеточной мембраны. Метод исключает возможность токсичности или неправильного попадания по мишени, так как он не зависит от внешних материалов или электрических полей; в) Сонопорация - метод искусственного переноса чужеродных ДНК в клетки с помощью воздействия на них ультразвуком, вызывающим открывание пор в клеточной мембране; г) Оптическая трансфекция - метод, при котором производится крошечное отверстие в мембране (около 1 мкм в диаметре) при использовании сильносфокусированного лазера; д) Гидродинамическая трансфекция - метод доставки генетических конструкций, белков и т.д. путем контролируемого повышения давления в капиллярах и межклеточной жидкости, что вызывает кратковременное повышение проницаемости клеточных мембран и образование в них временных пор. Осуществляется быстрой инъекцией в ткань, доставка при этом является неспецифичной. Эффективность доставки для скелетной мышцы - от 22 до 60% ; е) Микроинъекция ДНК - введение в ядро клетки животных с помощью тонких стеклянных микротрубочек (d=0,1-0,5 мкм). Недостаток - сложность метода, высока вероятность разрушения ядра либо ДНК; можно трансформировать ограниченное число клеток. Не используется для человека. 3. Методы на основе частиц. а) Прямой подход к трансфекции - генная пушка, при этом ДНК сцепляют в наночастицу с инертными твердыми веществами (чаще золото, вольфрам), которая затем «выстреливает» направленно в ядра клеток-мишеней. Этот метод применяется in vitro и in vivo для введения генов, в частности, в клетки мышечных тканей, например при таком заболевании, как миодистрофия Дюшена. Размеры частиц золота - 1-3 мкм. б) Магнитофекция - метод, использующий силы магнетизма для доставки ДНК в клетки-мишени. Сначала нуклеиновые кислоты (НК) ассоциируются с магнитными наночастицами, а далее, под действием магнитного поля, частицы загоняются в клетку. Эффективность почти 100%-ная, отмечена явная нетоксичность. Уже через 10-15 мин частицы регистрируются в клетке - это гораздо быстрее других методик. в) Импалефекция (impalefection; "impalement", букв. "сажание на кол" + "infection") - метод доставки с применением наноматериалов, таких как углеродные нанотрубки и нановолокна. При этом клетки буквально протыкаются подстилкой из нанофибрилл . Приставка «нано» применяется для обозначения их очень маленьких размеров (в пределах миллиардных долей метра). Отдельно стоит выделить такой метод, как РНК-трансфекция: в клетку доставляется не ДНК, а молекулы РНК - их «преёмники» в цепи биосинтеза белка; при этом активизируются специальные белки, разрезающие РНК на короткие фрагменты -- т.н. малые интерферирующих РНК (миРНК). Эти фрагменты связываются с другими белками и, в конце концов, это приводит к угнетению экспрессии клеткой соответствующих генов. Таким образом можно заблокировать в клетке действие тех генов, которые потенциально на данный момент приносят больше вреда, чем пользы. Широкое применение РНК-трансфекция нашла, в частности, в онкологии. Основные принципы доставки генов с использованием плазмидных векторов рассмотрены. Теперь можно перейти к рассмотрению вирусных методов. Вирусы - это неклеточные формы жизни, чаще всего представляющие собой молекулу нуклеиновой кислоты (ДНК или РНК), обёрнутой в белковую оболочку. Если вырезать из генетического материала вируса все те последовательности, которые вызывают возникновение заболеваний, то весь вирус также можно успешно превратить в «транспортное средство» для нашего гена. Процесс внедрения ДНК в клетку, опосредованное вирусом, называется трансдукцией. На практике чаще всего используют ретровирусы, аденовирусы и аденоассоциированные вирусы (AAV). Для начала стоит разобраться, каким должен быть идеальный кандидат для трансдукции среди вирусов. Критерии таковы, что он должен быть: • стабилен; • ёмок, то есть вмещать достаточное количество ДНК; • инертным в отношении метаболических путей клетки; • точным - в идеале, должен встраивать свой геном в конкретный локус генома ядра хозяина и др. В реальной жизни очень сложно скомбинировать хотя бы несколько пунктов, так что обычно выбор происходит при рассмотрении каждого индивидуального случая в отдельности. Из всех трёх перечисленных наиболее используемых вирусов самыми безопасными и одновременно самыми точными являются AAV. Их почти что единственный недостаток - сравнительно малая ёмкость (ок. 4800 п.н.), которая, однако, оказывается достаточной для многих генов . Помимо перечисленных методов достаточно часто генная терапия применяется в комбинации с клеточной: при этом сначала в питательную среду высаживают культуру определённых клеток человека, после этого тем или иным способом внедряют в клетки нужные гены, некоторое время культивируют и снова пересаживают в организм хозяина. В результате клеткам можно вернуть их нормальные свойства. Так, к примеру, модифицировали белые клетки крови человека (лейкоциты) при лейкемии:
Судьба гена после его попадания в клетку
Так как с вирусными векторами всё более-менее ясно в силу их свойства более эффективно доставлять гены до конечной цели - ядра, то остановимся на судьбе плазмидного вектора. На данном этапе мы добились того, что ДНК прошла первый большой барьер - цитоплазматическую мембрану клетки. Далее, в комплексе с другими веществами, оболочкой или без, ей необходимо достигнуть клеточного ядра, чтобы специальный фермент - РНК-полимераза - синтезировала молекулу информационной РНК (иРНК) на матрице ДНК (этот процесс называется транскрипция). Только после этого иРНК выйдет в цитоплазму, образует комплекс с рибосомами и согласно генетическому коду синтезируется полипептид - например, фактор роста сосудов (VEGF), который начнёт выполнять определённую терапевтическую функцию (в данном случае - запустит процесс образования ветвлений сосудов в ткани, подверженной ишемии). Что касается экспрессии введенных генов в требуемом типе клеток, то эта задача решается с помощью регуляторных элементов транскрипции. Ткань, в которой происходит экспрессия, часто определяется комбинацией специфичного для этой ткани энхансера(«усиливающей» последовательности) с определенным промотором (последовательность нуклеотидов, с которой РНК-полимераза начинает синтез), который может быть индуцируемым . Известно, что активность генов можно модулировать in vivo внешними сигналами, а так как энхансеры могут работать с любым геном, то в вектора можно вводить еще инсуляторы, которые помогают энхансеру работать независимо от его положения и могут вести себя как функциональные барьеры между генами. Каждый энхансер содержит набор участков связывания активирующих или супрессирующих белковых факторов . С помощью промоторов можно также регулировать уровень экспрессии генов. Например, есть металлотионеиновые или температурочувствительные промоторы; промоторы, управляемые гормонами. Экспрессия гена зависит от его положения в геноме. В большинстве случаев существующие вирусные методы приводят лишь к случайному встраиванию гена в геном. Чтобы исключить такую зависимость, при конструировании векторов снабжают ген известными нуклеотидными последовательностями, которые позволяют гену экспрессироваться независимо от места его встраивания в геном. Наиболее простой путь регуляции экспрессии трансгена - это обеспечение его индикаторным промотором, который чувствителен к физиологическому сигналу, такому, как выделение глюкозы или гипоксия. Такие «эндогенные» контролирующие системы могут быть полезны в некоторых ситуациях, таких, как осуществление глюкозозависимого контроля продукции инсулина. Более надежны и универсальны «экзогенные» системы контроля, когда экспрессия гена контролируется фармакологически введением маленькой лекарственной молекулы. В настоящее время известны 4 основные системы контроля - регулируемые тетрациклином (Tet), стероидом насекомых, экдизоном или его аналогами, антипрогестиновым препаратом майфпристоном (RU486) и химическими димеризаторами, такими, как рапамицин и его аналоги. Все они включают лекарственно зависимое привлечение домена активации транскрипции к основному промотору, ведущему нужный ген, но отличаются по механизмам этого привлечения .
Заключение
Обзор данных позволяет прийти к заключению, что, несмотря на усилия многих лабораторий мира, все уже известные и испытанные in vivoи in vitro векторные системы далеки от совершенства . Если проблема доставки чужеродной ДНК in vitro практически решена, а ее доставка в клетки-мишени разных тканей in vivo успешно решается (главным образом путем создания конструкций, несущих рецепторные белки, в том числе и антигены, специфичные для тех или иных тканей), то другие характеристики существующих векторных систем - стабильность интеграции, регулируемая экспрессия, безопасность - все еще нуждаются в серьезных доработках. Прежде всего, это касается стабильности интеграции. До настоящего времени интеграция в геном достигалась только при использовании ретровирусных либо аденоассоциированных векторов. Повысить эффективность стабильной интеграции можно путем совершенствования генных конструкций типа рецептор-опосредованных систем либо путем создания достаточно стабильных эписомных векторов (то есть ДНК-структур, способных к длительному пребыванию внутри ядер). В последнее время особое внимание уделяется созданию векторов на базе искусственных хромосом млекопитающих. Благодаря наличию основных структурных элементов обычных хромосом такие мини-хромосомы длительно удерживаются в клетках и способны нести полноразмерные (геномные) гены и их естественные регуляторные элементы, которые необходимы для правильной работы гена, в нужной ткани и в должное время. Генная и клеточная терапия открывает блестящие перспективы для восстановления утраченных клеток и тканей и генно-инженерного конструирования органов, что, несомненно, существенно расширит арсенал методов для медико-биологических исследований и создаст новые возможности для сохранения и продления жизни человека .
Генотерапевтические векторные системы на основе вирусов

Основным объектом при проведении экспертизы на возможность медицинского применения генетических конструкций на основе вирусов, предназначенных для введения генов в геном человека, являются получаемые биотехнологическим путем структуры, имитирующие в организме человека поведение вирусной частицы, но не вызывающие инфекционный процесс. В их состав входят: белки вируса, формирующие оболочку частицы, способную к узнаванию клеток-мишеней и к интернализации в цитоплазму; и трансген-экспрессирующая кассета, осуществляющая после доставки в клетку длительную экспрессию одного или нескольких генов. Распространение в практике генной терапии наследственных и инфекционных болезней приобрели векторные системы на основе лентивирусов, аденовирусов, аденоассоциированных вирусов, ортопоксвирусов, герпесвирусов и отдельных РНК-вирусов, не относящихся к ретровирусам. Достигнутый уровень генной инженерии позволяет создавать векторные системы, нацеленные на разные типы клеток и участки генома человека (векторы на основе ВИЧ). Векторные системы, полученные на основе лентивирусов и аденоассоциированных вирусов, способны интегрировать трансген-экспрессирующую кассету с геномом клеток-мишеней. Псевдотипирование векторов с гликопротеинами оболочки вируса бешенства придает им способность ретроградно транспортировать трансгены по нейрональным аксонам в ЦНС. Для изменения тропизма векторных систем исследователями используются несколько приемов: физический таргетинг, заключающийся в покрытии вирусной частицы специальной оболочкой, изменяющей ее природный тропизм и делающей ее неузнаваемой для иммунной системы человека; и генетическая модификация вируса, предполагающая модификацию белков оболочки вектора. Повышение эффективности транскрипции трансгена в клетке-мишени достигается путем транскрипционального таргетинга, предполагающего введение в трансген-экспрессирующую кассету специфических для данных тканей промоторных последовательностей.
Библиографическое описание: Супотницкий М.В. Генотерапевтические векторные системы на основе вирусов // Биопрепараты. - 2011. - № 3. - С. 15-26.
The main objects of performing the expertise of the possibility of medical application of genetic constructions based on viruses, developed for inserting genes into human genome, are structures derived by biotechnologies, imitating virus particle behavior, but not causing infectious process. They content of viral proteins, forming the particle's coat, able to recognize target-cells and to internalize into cytoplasm; and transgene expression cassettes, performing longtime expression of one or more genes after being delivered to a cell. In gene therapy of hereditary and infectious diseases vector systems based on lentiviruses, adenoviruses, adeno-associated viruses, orthopoxvirus, herpesviruses and single RNA- viruses, which do not relate to retroviruses are widespread. The achieved level of gene engineering allows to create vector systems, aimed at different cell types and parts of human genome (vectors, based on HIV). Vector systems, derived based on lentiviruses and adeno-associated viruses are able to integrate transgene expression cassette into target cells genome. Pseudotyping of vectors with lyssavirus glycoproteins coat provides them with a capability to retrograde transportation of transgenes to CNS by neuronal axons. For the purpose of changing vector systems tropism the scientists use few methods: physical targeting, which means covering virus particle with a special coat, changing it's natural tropism and making it incognoscible for human immune system; and virus genetic modification, which means modifying proteins of vector cover. Increasing of transgene transcription efficacy in a target-cell is performed by transcriptional targeting, which means inserting specific for the given tisues promotor sequences into transgene expression cassette.
Bibliographical description: Supotnitskiy M.V. Genotherapeutic vector systems based on viruses // Biopreparats (Biopharmaceuticals). - 2011. - No. 3. - P. 15-26.
Генная терапия наследственных и инфекционных болезней предполагает доставку генов в клетки-мишени. Но ни ДНК, ни РНК не могут быть использованы в «голом виде» для достижения этой цели. Сахарофосфатный остов молекул нуклеиновых кислот располагается по их периферии полярными группами наружу, придавая им анионные свойства. При физиологических значениях рН нуклеиновая кислота несет отрицательный заряд, отталкивающий ее от отрицательно заряженной наружной поверхности клеточной мембраны. Еще одно ограничение при проникновении в клетку нуклеиновой кислоте создает ее гидро- фильность. Все ее гидрофобные основания «повернуты» вовнутрь молекулы, поэтому она не может проникнуть через гидрофобный барьер клетки-мишени. В сыворотке крови нуклеиновая кислота быстро деградирует под воздействием нуклеаз. Период полужизни немодифицированной интерферирующей РНК в сыворотке крови укладывается в 5 - 60 мин, для ДНК - он составляет не более 10 мин. Кроме того, нуклеиновые кислоты не способны специфически узнавать клетки-мишени [25]. Поэтому для доставки генов в эукариотические клетки, с начала 1980-х гг. разрабатываются векторные генетические конструкции. В настоящее время сформировалось два альтернативных направления их создания - на основе вирусов и на основе искусственных векторных систем. Цель работы - анализ подходов к конструированию генотерапевтических векторных систем на основе вирусов. Данная публикация представляет собой начало цикла статей, посвященных способам и средствам, используемым при доставке генов в геном человека в рамках технологий генной терапии наследственных и инфекционных болезней.
Ретровирусные векторные системы. Ретровирусы относятся к группе вирусов, РНК-геном которых в инфицированных клетках конвертируется в ДНК. Геном ретровирусов включает три структурных гена, обозначенные как gag, pol и env, фланки- рованых элементами, названными длинными терминальными повторами (LTR, viral long terminal repeat). В LTR содержатся регуляторные элементы, выполняющие важные функции в жизненном цикле ретровируса. Эти повторы необходимы для интеграции ДНК копии генома вируса с геномом хозяина. Они определяют, где начало и где конец вирусного генома. LTR также служат энхансер-промоторными последовательностями, т.е. они контролируют экспрессию генов вируса. Большой геном ретровирусов облегчает генетические манипуляции.
После инфицирования клетки-мишени копия ретровирусной ДНК интегрируется с ее геномом строго определенным образом. Практически все инфицированные клетки способны экс- прессировать гены, привнесенные вирусом. Мощные транскрипционные энхансеры существенно повышают уровень экспрессии генов, клонированных в клетках различных типов. С их помощью можно переместить до 8 т.п.о., что в большинстве случаев более чем достаточно для синтеза крупномолекулярных белков. Весьма удобным для исследователя является то обстоятельство, что ретровирусные векторы можно размножать, достигая их высокой концентрации в небольшом объёме - более 10 9 вирусных частиц/см 3 . В опытах по инфицированию ретровирусами мозга, печени, мышц, глаз или клеток панкреатических островков грызунов показана устойчивая экспрессия трансгенов в течение более 6 мес. [9]. Ранние этапы жизненного цикла ретровирусов и векторов на их основе показаны на рис. 1.
Рис. 1. Ранние этапы жизненного цикла ретровирусов и векторов на их основе. Проникновение ретровируса в клетку сопровождается освобождением капсида от его оболочки и началом синтеза двуцепочечного ДНК-генома (провируса) на матрице вирусной РНК с помощью РНК-зависимой ДНК-полимеразы (обратной транскриптазы), входящей в состав вирусного нуклеокапсида. Затравкой (праймером) этой многоступенчатой реакции служит клеточная тРНК (для большинства MuLV - пролиновая тРНК), комплементарная PBS- участку, расположенному в 5'-концевой части вирусной РНК. Конечным продуктом полимеразной реакции является двуцепочечный ДНК-провирус, содержащий все вирусные гены и фланкированный 3'- и 5'-LTR. Вирусная ДНК, интеграза (IN) и отдельные вирусные и клеточные белки образуют вирусный преинтеграционный комплекс, который импортируется во внутрь ядра. IN катализирует интеграцию вирусной ДНК с ДНК генома клетки. По [18].
Векторы на основе ретровирусов с самого начала их разработки предназначались для введения через неповрежденные клетки за счет механизмов слияния, обеспечиваемых поверхностными белками оболочки вируса. Чувствительность дыхательного эпителия к ретровирусным инфекциям подразумевает возможность ингаляционного пути введения в организм человека векторных конструкций на основе ретровирусов. Сравнение свойств наиболее распространенных генотерапев- тических векторных систем приведено в табл. 1.
Таблица 1. Сравнение свойств наиболее распространенных генотерапевтических векторных систем
Векторы для переноса генов. Ретровирусы и аденовирусы в качестве векторов
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
Важной задачей генной и генно-клеточной терапии является поиск оптимального вектора - переносчика генетической информации. Вирусы представляют собой естественную биологическую систему переноса генов в эукариотические клетки. Одними из наиболее эффективных и доступных векторов для доставки рекомбинантных нуклеиновых кислот в клетки являются адено- и лентивирусы. В настоящем исследовании с помощью системы Gatewayклонирования нами были сконструированы аденовирусные и лентивирусные векторы, кодирующие ангиогенные и нейропротекторные факторы: изоформы сосудистого эндотелиального фактора роста vegf121, vegf165, vegf189; основной фактор роста фибробластов fgf2; глиальный нейротрофический фактор gdnf. Эффективность трансдукции клеток линии НЕК293А полученными генетическими конструкциями и экспрессия рекомбинантных белков подтверждены методом иммунофлуоресцентного анализа.
Большинство нейропротекторных стратегий, направленных на предотвращение гибели нейронов при нейродегенеративных заболеваниях, после нейротравм и ишемических инсультов недостаточно эффективны и не приводят к полному функциональному восстановлению больного. При этом ситуация осложняется недоступностью нейропротекторных лекарственных веществ в клинике [1] .
К природным нейропротекторным агентам относят нейротрофические факторы (NGF, BDNF, CNTF, GDNF, NT-3/4), эффективно поддерживающие выживание нейронов в патологических условиях и стимулирующие нейрорегенерацию [2] . Особого внимания заслуживают и другие ростовые факторы. В многочисленных исследованиях установлено выраженное нейропротекторное действие IGF, FGF и VEGF при нейродегенеративных заболеваниях, травме спинного мозга, ишемии головного мозга 5 . Повышенный интерес к VEGF обусловлен как его ангиогенным, так и нейропротекторным действием 8 .
Одной из ключевых задач разработки «инструментов» для генной терапии является создание экспрессионных генетических конструкций, обеспечивающих перенос рекомбинантных генов в целевые клетки in vitro и in vivo. Идеальная векторная система в генной терапии не требует инвазивных методов доставки, ограничена действием только на клетки-мишени, обеспечивает экспрессию известного количества трансгенных продуктов в течение определенного периода времени. Аденовирусы являются одними из наиболее часто применяемых векторов в генной терапии, уступая только ретровирусам [10] . Перспективными в разработке методов генной терапии также считаются векторы на основе лентивирусов. Лентивирусы, как и аденовирусы, способны инфицировать различные клетки. В то же время, за счет интеграции в геном клетки-хозяина они обеспечивают долговременную экспрессию и передачу трансгена дочерним клеткам при делении.
Недавно группой американских ученых на основе технологии Gateway-клонирования (Invitrogen, США) была создана коллекция клонов (hORFeome V8.1), кодирующих более 16 100 открытых рамок считывания генов человека [11] . Применение технологии Gateway-клонирования позволяет быстро и эффективно проводить субклонирование с сохранением ориентации открытой рамки считывания в различные экспрессионные векторы для дальнейших исследований по функциональному анализу экспрессии генов и белков. Cистема Gateway-клонирования основана на сайт-специфической рекомбинации бактериофага лямбда, которая происходит между специфическими последовательностями ДНК в пределах очень коротких участков гомологии, обычно 15-30 п.н. В связи с отсутствием этапа ПЦР амплификации, использование системы Gateway-клонирования сводит к минимуму риск возникновения мутаций во время генно-инженерных манипуляций, а применение сайтспецифической рекомбинации позволяет избежать применения многочисленных ферментативных реакций и стадий очистки промежуточных продуктов гидролиза ДНК, характерных для систем рестрикциилигации.
Целью нашего исследования стали разработка и создание рекомбинантных аденовирусов и лентивирусов, кодирующих гены ангиогенных и нейропротекторных факторов (vegf121, vegf165, vegf189, fgf2, gdnf) по технологии Gateway-клонирования (Invitrogen, США).
Материал и методы
Клонирование кДНК генов vegf121, vegf165, vegf189 и gdnf в плазмидный вектор pENTR-D/TOPO. Амплификация фрагментов кДНК генов vegf и gdnf проводилась на термоциклере С1000 Thermo Cycler (BioRad) с помощью высокоточной полимеразы Phusion High fidelity DNA Polymerase (FINNZYMES). Праймеры синтезированы компанией «Синтол» (Россия), нуклеотидные последовательности приведены в табл. 1. Очищенные продукты ПЦР-амплификации клонировали (с применением топо-изомеразы) в плазмидный вектор pENTR-D/TOPO (Invitrogen) с последующей трансформацией в компетентные клетки E. coli Top 10. ПЦР-скрининг колоний проводили с использованием вектор-специфичных праймеров (табл. 1). Получение целевых рекомбинантных плазмид подтверждали данными секвенирования и рестрикционного анализа.

Клонирование кДНК гена fgf2 в плазмидный вектор pDONR221 с помощью технологии Gatewayклонирования (Invitrogen, США). ПЦР-амплификацию фрагмента гена основного фактора роста фибробластов проводили в два этапа: первый этап служит для присоединения attB - сайтов с использованием геноспецифичных праймеров hFGF2 - attB1 и hFGF2 - attB2, нуклеотидные последовательности которых представлены в табл. 1. Второй этап ПЦРамплификации проводили с использованием адаптерных праймеров GW-attB1 и GW-attB2 (Литех, Россия), предназначенных для увеличения длины нуклеотидной последовательности att-сайтов. BP - рекомбинацию проводили по стандартному протоколу, предложенному компанией Invitrogen, с последующей трансформацией в компетентные клетки E. coli Top 10. ПЦР-скрининг колоний и подтверждение получения целевых рекомбинантных плазмид проводили, как описано выше.
Создание экспрессионных конструкций на основе аденовирусов и лентивирусов при помощи технологии Gateway-клонирования (Invitrogen, США). Для создания экспрессионных конструкций на основе аденовирусов и лентивирусов проводили LR-рекомбинацию кДНК генов из плазмид-доноров pENTR-VEGF121, pENTR- VEGF165, pENTR- VEGF189, pENTR-Gdnf и pDONR-FGF2 в плазмидные векторы pAd/CMV/V5Dest (Invitrogen) (для создания аденовирусных конструкций) или pLX303 (AddGene № 25897) (для создания лентивирусных конструкций). Трансформация компетентных клеток E. coli, ПЦР-скрининг колоний и подтверждение получения целевых рекомбинантных плазмид проводили, как описано выше.
Генетическая модификация (трансфекция) клеток HEK293A рекомбинантными плазмидами. Клетки линии НЕК293А (Invitrogen, США) культивировали при 37°С во влажной атмосфере, содержащей 5% CO2, в среде Игла, модифицированной Дульбекко (DMEM), содержащей 10% сыворотку крови плодов коровы (FBS), 1% смеси антибиотиков пенициллина и стрептомицина и 2 мМ L-глутамина. Трансфекцию клеток линии НЕК293А с помощью полученных генетических конструкций (pAd-FGF2, pAd-GDNF, pAd-VEGF121, pAd-VEGF165, pAd-VEGF189; pLX-FGF2, pLX-VEGF121, pLX-VEGF121, pLX-VEGF165, pLX-VEGF189) проводили с помощью трансфекционного реагента TurboFect (Fermentas, Канада) согласно методике, рекомендованной производителем. Анализ экспрессии белков проводили через 48 ч после трансфекции с помощью иммунофлуоресцентного анализа.
Иммунофлуоресцентный анализ экспрессии рекомбинантных белков. Для фиксации трансфицированных клеток НЕК293А в лунки культурального планшета после удаления питательной среды добавляли охлажденный метанол, затем планшет инкубировали при -20°С в течение 10 мин. После инкубации клетки промывали трис-буферным раствором TBS (50 мM Трис, 150 мM NaCl, pH 7,6). Проницаемость клеточных мембран увеличивали с помощью 0,1% раствора тритона Х-100 (Helicon, Россия). Инкубацию с первичными антителами (табл. 2) проводили в TBS в течение 1 ч. Затем клетки промывали TBS и далее инкубировали со вторичными антителами (табл. 2) в течение 1 ч. Ядра клеток окрашивали флуоресцентным красителем DAPI (4’,6-diamidino-2-phenylindole; Invitrogen, США). Результаты анализировали с помощью флуоресцентного микроскопа AxyoObserver Z1 (Carl Zeiss, Германия).

Получение рекомбинантных аденовирусов. Для получения рекомбинантных аденовирусов Ad5-GDNF, Ad5-FGF2, а также Ad5-VEGF (изоформы 121, 165, 189) аденовирусный плазмидный вектор перевели из кольцевой в линейную форму с помощью рестрикции ферментом PacI. Полученными очищенными линейными плазмидами трансфицировали клетки линии HEK293A с помощью трансфекционного реагента TurboFect. После трансфекции каждые 2-3 сут. меняли среду на свежую пока не стали заметны области цитопатического эффекта. На 10 сут. после трансфекции суспензию клеток из лунки собирали в стерильную 2 мл пробирку. После сбора клеточной суспензии проводили несколько циклов замораживания/оттаивания с последующим центрифугированием для подготовки неочищенного вирусного лизата. Вирусный сток хранили при -80°С.
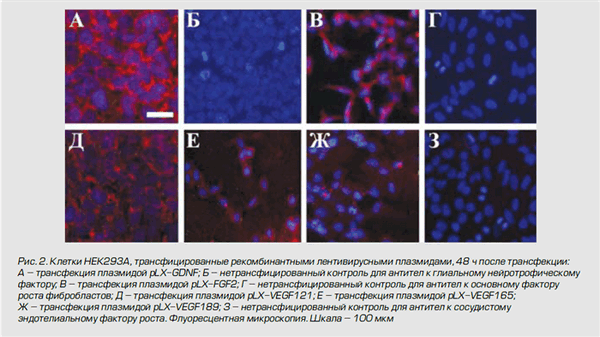
Получение рекомбинантных лентивирусов, экспрессирующих ангиогенные и нейропротекторные факторы. Для получения рекомбинантных лентивирусов проводили трансфекцию клеток HEK293T (АТСС, CRL-11268) при плотности монослоя в 70-80% кальциево-фосфатного методом по стандартному протоколу рекомбинантными плазмидами pLX303, psPAX2 (Addgene, США) и pCMV-VSV-G (Addgene, США). Эффективность трансфекции оценивали по количеству GFP-позитивных клеток методом флуоресцентной микроскопии. Клеточный лизат собирали через 2 сут. после трансфекции с последующим центрифугированием и фильтрацией супернатанта. Вирусный сток хранили при -80°С.
Результаты и обсуждение
Первоначально в результате ПЦР-амплификации и на последующих этапах клонирования с помощью технологии BP-рекомбинации и ТОРО-клонирования были получены векторы-доноры: pDONR-FGF2, а также pENTR-GDNF, pENTR-VEGF121, pENTR-VEGF165, pENTR-VEGF189. Экспрессионные аденовирусные плазмиды pAd-FGF2, pAd-GDNF, pAd-VEGF121, pAdVEGF165, pAd-VEGF189, а также лентивирусные плазмиды pLX303-FGF2, pLX303-GFNF, pLX303-VEGF121, pLX303-VEGF165, pLX303-VEGF189 были получены с использованием LR-рекомбинации (Invitrogen). Наличие целевых фрагментов подтверждено данными рестрикционного анализа и автоматического секвенирования.
Генетическую модификацию клеток HEK293A рекомбинантными плазмидами проводили с помощью трансфекционного реагента Turbofect. Эффективность экспрессии генов подтверждена иммунофлуоресцентным анализом. Показано, что клетки НЕК293А, модифицированные рекомбинантными плазмидами со вставками генов ангиогенных и нейропротекторных факторов, специфично реагируют с первичными антителами к основному фактору роста фибробластов, глиальному нейротрофическому фактору и сосудистому эндотелиальному фактору роста (рис. 1-2).
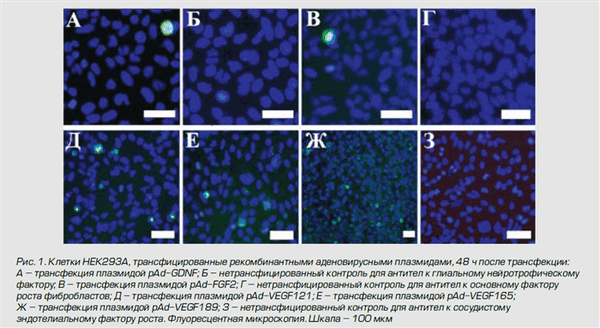
На первом этапе получения рекомбинантных аденовирусов кольцевую плазмиду pAd со вставкой интересующего гена перевели в линейную форму с помощью рестрикционного расщепления эндонуклеазой PacI. Расщепление вектора способствует взаимодействию левого и правого инвертированных повторов и удалению бактериальных последовательностей (участка начала репликации pUC и гена резистентности к ампициллину). Упаковка и репликация рекомбинантного аденовируса происходит в клетках линии HEK293A, содержащих Е1-участок, удаленный в рекомбинантных аденовирусных векторах. Таким образом, делеция Е1-области обеспечивает место для трансгенной вставки и блокирует репликацию вируса. На раннем этапе репликации вируса экспрессируются четыре несмежных области генома (с E1 по Е4) .Они служат, отчасти, в качестве ведущих регуляторов транскрипции, начиная с процесса экспрессии вирусного гена и заканчивая репликацией генома. После начала репликации ДНК, поздний промотор ведет большую часть вирусной транскрипции.
Через 72 ч после трансфекции очищенными рекомбинантными плазмидами были зафиксированы первые признаки цитопатического эффекта, характеризующегося характерными изменением морфологии клеток, принимающих округлую форму. Через 10 сут. после трансфекции суспензию клеток собирали и подвергали нескольким циклам замораживанияоттаивания. Полученные рекомбинантные аденовирусы хранили при -80°С для дальнейших исследований в экспериментах in vivo.
Для эффективной продукции лентивирусов в клетках HEK293T была проведена трансфекция кальциево-фосфатным методом рекомбинантными плазмидами pLX303 со вставками генов ангиогенных и нейропротекторных факторов, а также упаковочными плазмидами psPAX2 и pCMV-VSV-G. Введенная в пакующие клетки в составе плазмиды pCMV-VSV-G (packaging vector plasmid) пакующая кассета под контролем промотора цитомегаловируса экспрессирует гены, необходимые для формирования инфицирующей вирусной частицы. Но из кассеты исключен ген env, кодирующий белки-предшественники оболочки, определяющие его способность выходить за пределы клетки. Современная генерация пакующих систем включает обычно две плазмиды: одна кодирует Gagи Gag-pol-белки (Gag формируют сердцевину вируса, Pol - его ферментную систему соответственно); вторая - Rev-белок (избирательно активирует синтез структурных белков вируса и обеспечивает экспорт из ядра длинных молекул вирусной РНК). Векторная плазмида (transfer vector plasmids) содержит кассету, экспрессирующую мРНК, включающую все cisактивирующиеся элементы и последовательности, кодирующие пакующий сигнал. Такие плазмиды содержат трансген-экспрессирующую кассету с геном, предназначенным для экспрессии в новом хозяине и находящимся под контролем внутреннего промотора, обычно позиционированного между 3'-Tat/Rev SA-сайтом и 3'-LTR. Для формирования оболочки векторной вирусной частицы в систему включен оболочечный вектор psPAX2 (envelope vector). Он содержит кассету, определяющую синтез гликопротеинов оболочки вируса. Однако, так как вектор не содержит структурных вирусных генов gag, pol и env, образования полноценных вирусных частиц не происходит.
В качестве положительного контроля была также проведена трасфекция плазмидой pWPT-GFP (Addgene) в комплексе с упаковочными плазмидами. Эффективность экспрессии зеленого флуоресцентного белка подтверждена с помощью флуоресцентной микроскопии через 24 ч. после трансфекции.
Таким образом, с использованием системы клонирования Gateway были получены рекомбинантные аденовирусы и лентивирусы, экспрессирующие разные изоформы сосудистого эндотелиального фактора роста (vegf121, vegf165, vegf189), основной фактор роста фибробластов fgf2 и глиальный нейротрофический фактор gdnf. Подтверждённая эффективность трансдукции клеток адено- и лентивирусными векторами и экспрессия терапевтических генов позволяют начать доклинические испытания полученных генетических конструкций в генной и генноклеточной терапии нейродегенеративных и ишемических заболеваний человека.
Векторы генной инженерии растений
Манипуляции с клетками млекопитающих можно разделить на 2 большие группы: эксперименты с соматическим клетками и эксперименты по трансформации половых клеток. В последнем случае конечный результат - получение трансгенных организмов.
Характеристика векторов для переноса генов в животные клетки
Одними из лучших носителей для введения чужеродной информации в животную клетку являются вектора на основе ретровирусов, например, на основе вируса лейкоза мышей. Они обеспечивают высокоэффективный перенос генов и их стабильное встраивание в хромосому клеток-мишеней. В основном трансформации животных клеток осуществляют либо с помощью ретровирусов (около 40% от всех трансформаций), либо путем упаковки ДНК в липосомы (25%), реже используют аденовирусы, так как они могут вызывать сильный иммунный ответ, кроме того, невозможно их повторное введение.
Если проблема доставки чужеродной ДНК in vitro практически решена, а ее доставка в клетки-мишени разных тканей in vivo успешно решается (главным образом путем создания конструкций, несущих рецепторные белки, в том числе и антигены, специфичные для тех или иных тканей), то другие характеристики существующих векторных систем - стабильность интеграции, регулируемая экспрессия, безопасность — все еще нуждаются в серьезных доработках. Прежде всего это касается стабильности интеграции. До настоящего времени интеграция в геном достигалась только при использовании ретровирусных либо аденоассоциированных векторов. Повысить эффективность стабильной интеграции можно путем совершенствования генных конструкций типа рецептор-опосредованных систем, либо путем создания достаточно стабильных эписомных векторов (то есть ДНК-структур, способных к длительной персистенции внутри ядер).
В последнее время особое внимание уделяется созданию векторов на базе искусственных хромосом млекопитающих (MAC - mammalian artificial chromosomes). Благодаря наличию основных структурных элементов обычных хромосом такие мини-хромосомы длительно удерживаются в клетках и способны нести полноразмерные (геномные) гены и их естественные регуляторные элементы, которые необходимы для правильной работы гена, в нужной ткани и в должное время. Такие искусственные хромосомы уже созданы для дрожжей (YAK), так как геном дрожжей полностью картирован.
Для идентификации модифицированных клеток, необходимы маркеры. Если трансформируют соматические клетки, то применяют обычно селективные маркеры. Аксель с коллегами из колледжа терапии и хирургии Колумбийского университета исправили таким образом генетический дефект клеток мыши. Они взяли фрагмент ДНК, содержащий ген тимидинкиназы (ТК), который получен из вируса герпеса, смешали эту ДНК с несколькими миллиграммами ДНК-носителя из спермы лосося и осадили ДНК на культуру L-клеток мыши, в которых ген ТК отсутствовал (ТК-). С частотой 1 на 100000 клетки приобретали ген ТК, поэтому на селективной среде, которая не позволяла расти ТК- клеткам, росли и нормально размножались ТК+ - клетки.
Другой селективный маркер - ген, кодирующий дигидрофолатредуктазу (ДГФР), можно использовать при трансформации немутантных линий клетки. Благодаря экспрессии многих копий этого гена животная клетка вместе с плазмидой приобретает устойчивость к высоким концентрациям ингибитора фермента, и таким образом трансформантов можно отбирать при высоких концентрациях ингибитора.
Разработано еще два универсальных вектора, содержащих генные маркеры, работающие в нормальных клетках. Они построены по одному и тому же принципу: прокариотические гены, определяющие фенотип трансгенных клеток, соединены с эукариотическими регуляторными сигналами.
Один из векторов состоит из прокариотического гена устойчивости к антибиотику неомицину, встроенного в раннюю область генома SV-40. Эукариотические клетки чувствительны к аналогу неомицина G 418, который инактивируется продуктом гена. Таким образом клетки, прошедшие трасфекцию приобретают способность расти на среде, содержащей G 418.
Векторы генной инженерии растений
Потенциальные векторы могут быть классифицированы на три категории.
1. Векторы, полученные на основе растительных патогенов (вирусов, вироидов), которые характеризуются естественной способностью к введению в клетку чужеродной ДНК.
2. Векторы, полученные на основе мобильных генетических элементов. Их еще называют подвижные элементы, транспозируемые элементы, транспозоны. Транспозоны способны менять свою локализацию в геномах.
1. Векторы, полученные на основе природных растительных векторов. Представители Тi- или Ri-плазмида.
Вироиды. Около 40 лет назад считалось, что все инфекционные болезни растений и животных вызваны или микроорганизмами (бактерии, грибы) или вирусами. Было известно, что самые мелкие вирусы, способные к независимой репликации, имеют геномы с молекулярной массой 1 млрд. Поэтому резонно было предположить, что этот размер представляет собой минимальное количество информации, необходимой для кодирования вирусом своих продуктов и подавления метаболизма клетки-хозяина. Действительно, хотя и известны меньшие вирусы, они для репликации нуждаются в вирусах-помощниках, находящихся в той же клетке. Но в 1971 году было показано, что болезнь «веретенообразность клубней» картофеля вызвана небольшими неинкапсулированными молекулами автономно реплицирующейся РНК - вироидами. Оказалось, что вироиды вводят в хозяйскую клетку еще меньшую информацию.
Вироиды реплицируются за счет фермента хозяина механизмом типа катящихся колец с кольцевым вироидом в качестве матрицы.
Благодаря ряду особенностей вироиды рассматриваются в качестве потенциальных векторов:
1) вызывают инфекцию всего растения и могут сами мигрировать по растению;
2) переносятся через клеточный сок;
3) некоторые вироиды передаются через семена (значит, они интегрируются с геномом хозяина);
4) инфицируют широкий ряд растений.
Транспозоны. Одним из перспективных векторов для переноса генетической информации в растение является вектор, сконструированный на основе мобильных генетических элементов.
В 70-е годы прошедшего столетия в молекулярной генетике появилось новое понятие - нестабильность генома. Этому важнейшему феномену посвящена монография Р. Б. Хенсина «Непостоянство генома». Оказалось, что в геноме, считавшимся многие годы незыблемым, определенные сегменты ДНК могут менять свою локализацию, то есть мигрировать или, как еще принято говорить у генетиков, транспозировать. Однако это понятие ни в коей мере не отменяет основного постулата классической генетики о постоянстве генома.
Первая группа транспозирующихся элементов (ТЭ) получила название инсерционных последовательностей - это простые транспозоны, обозначаются IS с номерами.
Каждый IS обладает короткими инвертированными концевыми повторами, 15-25 пар нуклеотидов. Эти повторы представляют собой два участка одной и той же двунитевой ДНК, имеющие одинаковые нуклеотидные последовательности, но расположены в противоположной (обратной) ориентации. ДНК IS фланкирована очень короткими прямыми повторами. Мишень содержит до внедрения только один такой повтор (5 или 9 пар нуклеотидов). Наличие прямых и обратных повторов указывает на присутствие транспозона. Рамка считывания несет информацию о белках.
Сложные транспозоны обозначаются Tn c номерами. Один класс представлен сложными элементами, состоящими из центральной части, несущей маркер, например лекарственной устойчивости, фланкированной с каждой стороны родственными последовательностями - плечами - длинными концевыми повторами. Плечи могут иметь либо одинаково ориентированную, либо инвертированную последовательность. Иногда плечи состоят из IS элементов. В случае Tn9 на каждом плече по IS1. В других случаях плечи напоминают IS элементы.Все модули имеют концевые инвертированные повторы, поэтому сложный транспозон также заканчивается короткими инвертированными повторами. Если же плечи имеют инвертированную ориентацию друг относительно друга, короткие повторы на концах Tn идентичны.
Природа транспозиционного события состоит в разрезании сайта мишени рестриктазой, куда внедряется транспозон. Рестриктазы (рестрикционные эндонуклеазы) ферменты, разрезающие ДНК по определенным нуклеотидным последовательностям, которые они «узнают». Эти последовательности называются сайтами рестрикции. Образование и достройка ступенчатых концов делают понятными наличие прямых повторов ДНК мишени в сайте внедрения.
Рекомбинация между любой парой прямых повторов будет приводить к делеции, т.е. утрате ДНК между ними (Рис. 4). Промежуточная область вырезается в виде кольцевой ДНК. Хромосома сохраняет одну копиюпрямого повтора. В случае Т9 (который заключен между двумя IS1) рекомбинация приведет к замене Т9 на IS1.
В чем же заключается смысл предусмотренного природой процесса перемещения отдельных сегментов ДНК. В результате внедрения,
транспозоны прерывают соответствующий ген и он перестает функционировать. Таким образом, транспозоны играют значительную роль в эволюции. Кроме того, транспозоны несут в себе сигналы для начала считывания информации. Внедряясь в новые области ДНК, они изменяют процесс считывания информации. У бактерий ряд транспозонов несет гены устойчивости к антибиотикам. Они могут передаваться из одной клетки к другой. В результате, у данного вида возрастает число бактерий выживающих при высоких концентрациях антибиотика. В индивидуальном развитии высших организмов на определенных этапах происходит включение или выключение определенных программ. В этом ключевую роль также играют транспозоны. Можно считать экспериментально доказанным участие мигрирующих элементов в образовании опухолей.
Наибольшее применение в качестве векторов в настоящее время нашли плазмиды - внехромосомные, автономно реплицирующиеся, кольцевые молекулы ДНК бактерий. Почвенные бактерии или агробактерии содержат плазмидную ДНК, способную генетически трансформировать растительную клетку.
Агробактерии. Agrobacterium tumefaciens и Agrobacterium rhizogenes представляют собой почвенные бактерии, которые в участках повреждения двудольных растений вызывают заболевания, называемые соответственно «корончатым галлом» и «косматым корнем». Среди однодольных растений только некоторые представители семейств Liliaceae и Amaryllidaceae оказались в слабой степени восприимчивы к заболеванию корончатых галлов. Причины подобного ограничения круга хозяев в настоящее время не раскрыты. Однажды начавшись, опухолевый рост может продолжаться и в отсутствие бактерий, а опухолевая ткань способна расти в асептичных условиях в культуре на питательной среде, не содержащей экзогенных ауксинов и цитокининов, которые в норме необходимы для стимляции роста растительных тканей in vitro.
Опухолевые ткани синтезируют новые производные аминокислот и сахаров, известные как опины. Тип опина, синтезируемого в опухоли (например нопалин, октопин, агроцинопин, маннопин и агропин), зависит от штамма агробактерий, вызвавшего ее образование. Октопин и нопалин - опины - образуются из аргинина; их легче всего обнаружить в ткани корончатых галлов. В соответствии с этим многие широко распространенные штаммы Agrobacterium tumefaciens классифицируют как штаммы октопинового или нопалинового типа. В опухолях косматого корня, вызываемых A. rhizogenes,как правило, обнаруживается агропин. Штаммы агробактерий, вызывающие образование опухолей, способны к избирательному катаболизму опинов того типа, синтез которых индуцируют, используя последние в качестве источников углерода и азота.
Как индукция опухолей, так и синтез опинов обусловлены бактериальными плазмидами.
Ti-плазмиды. Ti-плазмиды (от англ. Tumour inducing - образующие опухоль), обнаруженные (рис. 5. А) во всех вируленных штаммах A. tumefaclvns, имеют размеры около 200—250 тыс. пар нуклеотидов (т. п. н.) и стабильно сохраняются в агробактериях при температуре ниже 30°С. Согласно данным ДНК-ДНК-гибридизации в Ti-плазмидах различных штаммов агробактерий имеются четыре области гомологии. Генетический анализ показал, что две области, Т-ДНК (от англ. Transferred) и vir-область (от англ. virulence), связаны с опухолеобразованием, тогда как две другие вовлечены в конъюгационный перенос и репликацию плазмид в клетках агробактерий.
В процессе опухолеобразования определенная последовательность Ti-плазмиды, Т-ДНК, переносится в клетки растения и встраивается в их ядерный геном без заметных перестроек. Т-ДНК стабильна в растительном геноме. В растительную ДНК может включаться одна или более копий Т-ДНК, и хотя множественные копии Т-ДНК могут образовывать тандемные повторы, они могут быть разбросаны по геному - сцеплены с различными районами растительной ДНК. Место встраивания Т-ДНК в растительную ДНК, по-видимому, случайно. В различных Ti-плазмидах найдены области, гомологичные Т-ДНК. В обычно используемых напалиновых штаммах A. tumefaciens размер области Т-ДНК составляет около 24 т. п. н. В некоторых корончатых галлах октопинового типа выявлены два несмежных сегмента TL (Т-левая Т-ДНК) и ТR (Т-правая). Последовательность ТL (14 т.п.н.) обнаружена во всех линиях трансформированных клеток. TR (7 т. п. н.), которая происходит из района Ti-плазмиды, локализующегося правее Tl-ДНК, обнаружена в некоторых опухолевых линиях, причем число ее копий может отличаться от такового для ТL . Последнее обстоятельство указывает на независимость процессов переноса TL и TR.
В опухолевых клетках Т-ДНК транскрибируется с образованием различных полиаденилированных мРНК. количество накапливающихся в клетках транскриптов Т-ДНК относительно невелико по сравнению с другими растительными мРНК, а относительное их содержание может быть различным. Определение нуклеотидной последовательности Т-ДНК нопалинового типа позволило идентифицировать 13 протяженных открытых рамок считывания, тогда как в октопиновых TL- и TR-ДНК обнаружено соответственно 8 и 6 протяженных открытых рамок. Транскрипты правой части нопалиновой т-днк функционально эквивалентны транскриптам tl-днк.общая организация генов Т-ДНК и их фланкирующих областей (последовательностей ДНК расположенных с обеих сторон генов) сходна с таковой эукариотических генов, хотя они не содержат интронов. один из генов октопиновой TL- области (транскрипт 3) кодирует октопинсинтазу (ocs). В нопалиновых плазмидах гены опинсинтаз включают и гены нопалинсинтазы и агроцинопинсинтазы (acs). В октопиновых Тi-плазмидах TR-ДНК o6ласть кодирует два белка, ответственных за синтез маннопина, и один — за превращение маннопина в агропин. Локус tmr (транскрипт 4) кодирует фермент, участвующий в синтезе цитокинина; мутации в этом локусе приводят у некоторых растений к пролиферации корней из ткани корончатых галлов («rooty» или «корневые» мутанты). Локус tms1 и tms2 (транскрипты 1 и 2) определяют нерегулируемый синтез ауксинов, и мутации в любом из них у многих типов растений обусловливают появление побегов из ткани корончатых галлов («snooty» или «побеговые» мутанты). Таким образом, Т-ДНК содержит гены (tms 1, tms2 и tmr), продукты которых препятствуют нормальной регуляции метаболических процессов, вовлеченных в синтез фитогормонов, что и приводит к онкогенному фенотипу. Следовательно, эти гены (tms 1, tms2 и tmr) можно отнести к так называемым онкогенам, т.е генам, индуцирующим образование опухоли. однако следует отметить, что входящие в состав Т-ДНК гены не участвуют в переносе Т-ДНК в растительные клетки и не влияют на её стабильность в геноме растения.
Ri-плазмиды. Индукция заболевания косматого корня бактериями A. rhizogenes аналогична трансформирующему действию A. tumefaciens. Под контролем vir-области две отдельные области Т-ДНК плазмиды переносятся в растительный геном TL- и TR.. TR-ДНК содержит гены, кодирующие опины (маннопин или агропин), и, соответственно этому, штаммы характеризуют по их специфическим опиновым генам. TR-ДНК, кроме того, содержит два гена, кодирующие ауксин. Эти гены в значительной степени гомологичны ауксиновым генам A. Tumefaciens. TL Т-ДНК A. rhizogenes полностью секвенирована; она содержит по крайней мере 11 открытых рамок считывания, сходных с эукариотическими, которые снабжены необходимыми элементами промоторов и сигналами полиаденилирования (последние должны функционировать после переноса в растительный геном).Для поддержания фенотипа косматого корня нет абсолютной необходимости в TL, однако штаммы Agrobacterium, несущие как TL, так и ТR, более вирулентны и заражают большее число видов растении, чем штаммы, несущие только одну Т-ДНК.
Читайте также:
