Влияние инсулина на рост. Механизм секреции инсулина
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Основным источником энергии для клеток организма является глюкоза. Глюкоза образуется при всасывании углеводов, которые человек получает с пищей.
Когда человек не ест, нормальный уровень глюкозы крови поддерживается за счет использования запасов углеводов, которые есть в организме (гликоген печени) и синтеза глюкозы из белков. Часто спрашивают, если человек не ест, почему у него повышается глюкоза крови, откуда она берется. Ответ: из гликогена печени и распада белков. Однако запасов гликогена мало (примерно 90 грамм), а синтезировать глюкозу из белка организму крайне невыгодно, поэтому при голодании организм начинает «экономить» глюкозу и отключает ее поступление в часть органов. Т.е. при голодании глюкоза поступает только в критически важные органы (мозг, сосуды, почки, нервы).
Не пропускает глюкозу в ткани при голодании инсулин. Образно говоря, на клетках некоторых органов «висит замок», который открывается инсулином. Когда инсулин открывает замок, глюкоза поступает в клетку. Эти ткани являются инсулинозависимыми, глюкоза может попасть в них только тогда, когда инсулин «даст разрешение». Инсулинозависимыми тканями являются мышцы, жировая ткань.
Но в некоторые органы глюкоза попадает без инсулина, там нет замков, дверь для глюкозы всегда открыта. Эти органы называются инсулинНЕзависимыми. Смысл действия инсулина: есть еда, можем прокормить всех, инсулин открывает двери в клетки для глюкозы. Нет еды, значит, будем кормить только самые важные органы, инсулин закрывает двери для глюкозы в менее важных органах (можно оставить «голодными» мышцы и жир, но мозг нельзя).
Но что происходит, когда нет инсулина или он дефектный? Тогда глюкоза из углеводов пищи попадает в кровь, но не может поступить в ткани. Даже если уровень глюкозы в крови высокий, инсулинозависимые ткани голодают, дверь для глюкозы в клетке закрыта на замок, ключа нет или он сломан («голод среди изобилия»).
И в то же время в инсулинНЕзависимые ткани глюкоза поступает в излишних количествах. А что излишне, то нездорово. Глюкоза начинает связываться с белками этих тканей и повреждать их. Именно из-за этого при диабете и происходит повреждение органов-мишеней (нервов, сосудов, почек и др.).
Как происходит секреция инсулина в норме?
Минимальное количество инсулина в организме вырабатывается всегда (это называется базальная секреция инсулина). Когда человек поел, всасываются углеводы, в кровь поступает глюкоза, происходит выброс инсулина (это называется пищевой или прандиальный пик), двери открываются, глюкоза идет в клетку.
В норме секреция инсулина в ответ на прием пищи происходит в 2 фазы: первую быструю фазу (1-3 минуты) и вторую медленную (до 25-30 минут).
Поговорим про инсулин
Инсулин — это гормон поджелудочной железы, который главным образом воздействует на обмен веществ, причем в основном — на концентрацию глюкозы в крови. В своих тканях-мишенях он влияет как на мембранные, так и на внутриклеточные процессы. Некоторые из его эффектов перечислены в ниже.
Эффекты инсулина

Мембранные эффекты
- Стимуляция транспорта глюкозы (и некоторых других моносахаридов)
- Стимуляция транспорта аминокислот (особенно аргинина)
- Стимуляция транспорта жирных кислот
- Стимуляция поглощения клеткой К+ и Mg2+
Внутриклеточные эффекты
- Стимуляции синтеза РНК и ДНК
- Стимуляция синтеза белка
- Усиленная стимуляция гликогенсинтазы (гликогенез)
- Стимуляция глюкокиназы
- Ингибирование глюкозо-6-фосфатазы
- Стимуляция липогенеза
- Ингибирование липолиза (ингибирование синтеза цАМФ)
- Стимуляция синтеза жирных кислот
- Активация Mg2+-стимулируемой Na+/K+-АТФазы
Механизм действия инсулина и влияние его на обмен
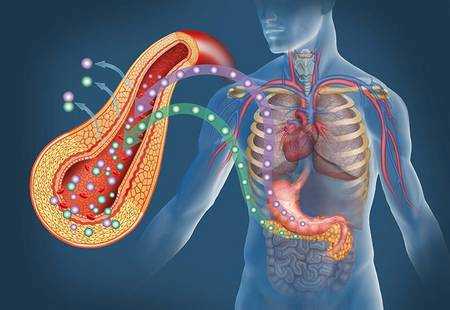
Инсулин и глюкоза
Попав в клетку, глюкоза быстро превращается в глюкозо-6-фосфат, поэтому ее внутриклеточная концентрация остается крайне низкой. Уровень глюкозы в артериальной крови в норме поддерживается в пределах 4-8 ммоль/л (72-144 мг/100 мл), так что по обе стороны клеточной мембраны всегда существует градиент ее концентраций. Несмотря на это, однако, простая диффузия обеспечивает поступление в большинство клеток лишь небольшого количества глюкозы, которого явно недостаточно для удовлетворения их метаболических потребностей (даже при возрастании концентрационного градиента, как это имеет место при высокой гипергликемии). В присутствии же инсулина проникновение декстрозы в клетки резко усиливается. Это действие инсулина проявляется лишь при наличии концентрационного градиента глюкозы, конкурентно ингибируется другими моносахаридами (например, галактозой) и следует кинетике насыщаемого процесса. Таким образом, гормон стимулирует процесс облегченной диффузии декстрозы, который осуществляется при участии чувствительных к гормону белковых транспортеров глюкозы (GLUT), расположенных на клеточной мембране. Эти транспортеры способны переносить глюкозу через клеточную мембрану в обоих направлениях, но ее поток зависит от концентрационного градиента, который направлен из внеклеточного пространства во внутриклеточное. В разных клетках найдены многочисленные GLUT, но инсулинозависимым является только один из этих белков — GLUT4, и именно он присутствует в мембранах клеток скелетных и сердечных мышц, а также жировой ткани.
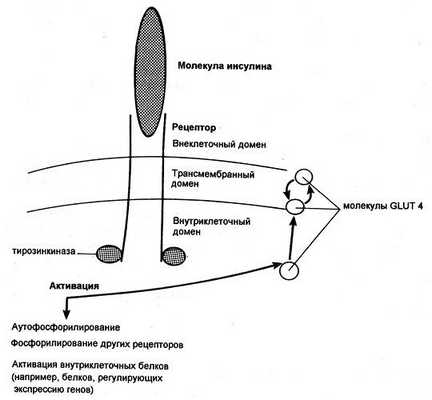
Димерный рецептор инсулина и последствия инсулиновой активации тирозинкиназы (GLUT — транспортер глюкозы)
Некоторые ткани полностью удовлетворяют свои потребности в глюкозе за счет инсулиннезависимых механизмов. Например, в клетки печени и центральной нервной системы декстроза попадает с помощью инсулиннезависимых GLUT, и поглощение этими тканями зависит только от ее уровня в крови. Кроме того, мембрану эритроцитов, клеток почек и кишечника глюкоза пересекает вместе с ионами натрия, которые поступают в клетки путем пассивной диффузии по градиенту концентрации.
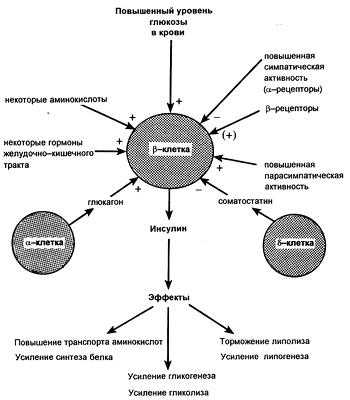
Регуляция продукции инсулина
Инсулин влияет и на внутриклеточные процессы обмена веществ. В печеночных и других клетках он стимулирует синтез гликогена, повышая активность гликогенсинтазы, что ускоряет включение гликозильных остатков в гликоген. Гормон поджелудочной железы повышает также активность печеночной глюкокиназы; этот фермент катализирует фосфорилирование глюкозы (с образованием глюкозо-6-фосфата). Одновременно гормон ингибирует печеночную фосфатазу, которая дефосфорилирует глюкозо-6-фосфат, с образованием свободной глюкозы. Такие изменения активности печеночных ферментов обусловливают снижение продукции декстрозы и наряду со стимуляцией поглощения ее периферическими клетками определяют гипогликемию, возникающее под влиянием инсулина. Возрастающая под действием последнего утилизация глюкозы в тканях обеспечивает сохранение запасов других внутриклеточных энергетических субстратов, таких как жиры и белки.
Белки и инсулин
Инсулин стимулирует не только активный транспорт аминокислот в периферические клетки, но и непосредственно синтез белка. Поскольку эти два эффекта могут не зависеть друг от друга, гормон влияет, очевидно, не только на клеточную мембрану, но и на внутриклеточные процессы. Стимуляции синтеза белка предшествует возрастание активности мРНК. Поскольку гормон с трудом проходит сквозь мембраны клеток, в механизме его ядерного эффекта должен принимать участие второй посредник. Синтез белка под действием инсулина усиливается и вследствие возрастания количества поступающих в клетку аминокислот. С другой стороны, возрастание утилизации глюкозы замедляет распад белка. Ускорение синтеза и замедление распада белка под влиянием гормона приводят к увеличению белковых запасов в интрацеллюлярном секторе.
Все эти эффекты определяют важнейшую роль инсулина в регуляции процессов роста и развития.
Инсулин и жир
Инсулин стимулирует поглощение и окисление глюкозы клетками жировой ткани. Он также стимулирует синтез липопротеиновой липазы в эндотелиальных клетках. Этот фермент катализирует гидролиз триглицеридов, связанных с липопротеинами крови, и способствует поступлению жирных кислот в адипоциты. Наряду с прямой стимуляцией липогенеза в печени и жировой ткани это приводит к увеличению запасов жира. Кроме того, инсулин ингибирует опосредуемый цАМФ липолиз, тормозя гормончувствительную внутриклеточную липопротеиновую липазу.
Инсулин и калий
Присутствие инсулина необходимо для поддержания внутриклеточной концентрации ионов калия; этот эффект, по всей вероятности, является следствием прямого влияния гормона на клеточную мембрану.
Влияние инсулина на рост. Механизм секреции инсулина
Для цитирования: Регуляция секреции инсулина в норме и при сахарном диабете 2 типа: роль инкретинов. РМЖ. 2006;26:1867.
Сахарный диабет 2 типа является гетерогенным заболеванием, развивающимся в результате комбинации врожденных и приобретенных факторов. Согласно мнению профессора Ральфа Де Фронзо, патофизиология сахарного диабета 2 типа представляет собой кульминацию двух одновременно протекающих процессов: с одной стороны - инсулинорезистентность, с другой - недостаточность функции b-клеток для того, чтобы преодолеть инсулинорезистентность путем повышения уровня инсулина. В этой связи изучение функции b-клеток в норме и при патологии находятся под пристальным вниманием исследователей.
В норме b-клетки быстро адаптируются к снижению чувствительности к инсулину на уровне печени или периферических тканей, повышая секрецию инсулина и предотвращая развитие гипергликемии натощак. При сахарном диабете 2 типа гипергликемия натощак развивается в случаях недостаточной функции b-клеток в плане производства и секреции инсулина, необходимого для преодоления инсулинорезистентности. Вне всякого сомнения, эти факторы тесно связаны друг с другом, хотя кажется абсолютно ясным, что без нарушенной секреции инсулина не может развиваться гипергликемия и таким образом именно b-клетки и их функция являются «сердцем» данной проблемы.
Более 25 лет тому назад было убедительно показано, что у пациентов с нарушенной толерантностью к глюкозе или с сахарным диабетом 2 типа имеют место нарушения кинетики выделения инсулина и снижение инсулинового ответа на пищевую нагрузку.
Рассматривая вопросы секреции инсулина в норме и при сахарном диабете 2 типа, необходимо отметить, что у здоровых лиц существует постоянная базальная секреция инсулина, которая имеет место даже тогда, когда отсутствуют любые экзогенные стимулы для выделения инсулина. И даже в тех случаях, когда уровень глюкозы плазмы после ночного голодания низкий (4,4-5,5 ммоль/л), все равно в организме человека поддерживается постоянная базальная секреция инсулина.
Известно, что в постпрандиальном периоде глюкоза попадает в циркуляцию крови непосредственно из абсорбированных с пищей углеводов, а затем распределяется - в основном в скелетные мышцы через многократное увеличение инсулинопосредованного захвата глюкозы (ИОЗГ). А в связи с тем, что пациенты с сахарным диабетом 2 типа имеют ограниченные возможности к быстрому увеличению ИОЗГ, постпрандиальная гликемия у них будет значительно повышенной.
Необходимо особо подчеркнуть, что постпрандиальная гипергликемия может развиваться и существовать в течение нескольких лет до развития и появления гипергликемии натощак и до клинической манифестации сахарного диабета.
Организация запасов глюкозы в первую очередь именно мышечной тканью частично объясняется тем, что эта ткань способна абсорбировать глюкозу достаточно быстро и в больших количествах, препятствуя развитию постпрандиальной гипергликемии в физиологических условиях. Причем колебания постпрандиального уровня глюкозы являются важной составляющей общей суточной гипергликемии.
В настоящее время убедительно показано, что b-клетки несут серьезную ответственность за поддержание в организме человека уровней глюкозы в достаточно узком диапазоне. По мнению P.D. Home (2000), уровень глюкозы в норме у лиц молодого и среднего возраста абсолютно стабилен в течение ночи и составляет непосредственно перед завтраком 4,3 ммоль/л. После завтрака концентрация глюкозы повышается, достигая 7,0 ммоль/л в течение 30 минут, затем снижается, достигая показателя 5,5 ммоль/л в течение почти такого же времени.
Необходимо отметить, что у больных сахарным диабетом 2 типа повышение секреции инсулина в ответ на прием пищи замедлено и ослаблено. У некоторых пациентов инсулиновый ответ на прием пищи вообще отсутствует.
Особое место в исследованиях занимает информация, касающаяся двухфазности секреции инсулина в норме и патологии.
В настоящее время известно, что выделение инсулина происходит двухфазным образом, характеризующимся наличием острых пиков, продолжающихся в среднем в течение 10 минут (первая фаза), с последующим постепенным повышением выделения инсулина (вторая фаза).
Существует точка зрения, что эти две фазы фактически представляют два различных внутриостровковых пула инсулина. Первый пул, или пул немедленного реагирования, представляет собой в количественном отношении около 5-10% внутриостровкового содержания инсулина. Речь идет о гранулах инсулина, находящихся максимально близко к мембране b-клетки, и считается, что именно этот быстровыделяемый пул обеспечивает первую, раннюю фазу в секреции инсулина.
Второй пул, или готовый к использованию пул инсулина, или резервный пул, для выделения которого необходима аденозинтрифосфат-зависимая мобилизация инсулинсодержащих гранул, перемещающихся постепенно в первый пул, с последующим экзоцитозом, фактически представляет 90-95% запасов инсулина, содержащихся в b-клетках в данную единицу времени.
Несомненно, что обе фазы в секреции инсулина являются важными в поддержании нормального гомеостаза глюкозы. Однако в настоящее время значительно большее внимание уделяется именно первой фазе инсулиновой секреции. Предполагается, что это и есть главная детерминанта в «раннем» выделении инсулина в течение первых 30 минут после приема пищи или глюкозы.
Интересно отметить, что инсулиновый секреторный ответ панкреатических b-клеток на стимуляцию глюкозой заключается в развитии первой фазы, которая появляется сразу же после внутривенного введения глюкозы. Далее следует снижение секреции инсулина до самых низких значений и затем развитие пролонгированной второй фазы ответа. Первая фаза секреции инсулина развивается за счет активации КАТФ-зависимых (триггерных) каналов, которые повышают концентрацию кальция и, как предполагается, высвобождают гранулы из «готового к высвобождению» пула. Из этого следует, что вторая фаза влечет за собой приготовление гранул для опорожнения, возможно, включающее транслокацию и способность к наполнению перед экзоцитозом. Механизмы, ответственные за развитие второй фазы инсулиновой секреции, включают путь КАТФ-зависимых каналов по причине необходимости увеличения концентрации кальция и дополнительные сигналы независимо от КАТФ-зависимых каналов. Механизмы, лежащие в основе таких дополнительных сигналов, пока остаются неизвестными. Современные гипотезы предполагают повышение цитозольного длинноцепочечного ацетил-КоА, малат-пируватный цикл, «экспорт» глутамата из митохондрий, а также увеличение соотношения АТФ/АДФ.
У человека каждая b-клетка содержит около 10000 гранул инсулина, из которых только 100 представляют собой «готовый к высвобождению» пул.
Очевидно, что стимуляция высвобождения при помощи даже одного стимулятора секреции, такого как глюкоза, происходит согласно строго координированному взаимодействию многих факторов по отношению к передвижению гранул: прикрепление к плазматической мембране, приготовление к высвобождению (наполнение) и экзоцитоз. Общее количество инсулинсодержащих гранул в b-клетках значительно превышает количество, требуемое для контроля гликемии, связанной с однократным приемом пищи. Характерно, что лишь очень малый процент гранул и, соответственно, общего содержания инсулина в гранулах, секретируется в ответ на стимуляцию глюкозой [Proks P. еt al., 1996].
Хорошо известно, что существуют и неглюкозные стимулы секреции инсулина, такие как аминокислоты, свободные жирные кислоты и гормоны. Важную роль в стимуляции секреции инсулина играет и невральная регуляция.
Следует отметить также, что многие гормоны влияют на b-клетки, либо стимулируя, либо подавляя, либо модулируя инсулиновый ответ на глюкозу.
В последние годы большой научно-практический интерес вызывает изучение роли гормонов желудочно-кишечного тракта в регуляции секреции инсулина, а следовательно, и в регуляции гомеостаза глюкозы в организме человека.
В этой связи следует подчеркнуть, что в литературе имеются данные, свидетельствующие о важной роли таких гормонов желудочно-кишечного тракта, как глюкагоноподобный пептид 1 (ГПП-1) и глюкозо-зависимый-инсулинотропный полипептид или желудочный ингибирующий пептид (ГИП). Эти гормоны получили название инкретины, а их действие, приводящее к усилению глюкозозависимой секреции инсулина b-клетками поджелудочной железы, было названо «инкретиновый эффект». Кстати, «инкретиновый эффект» был впервые описан в 1960 году, и приписывается пептидным гормонам, которые секретируются К- и L-клетками кишечника в ответ на прием пищи.
Наиболее популярным и наиболее изученным в настоящее время является ГПП-1.
ГПП-1 является посттрансляционным продуктом гена проглюкагона, членом суперсемейства глюкагона, в которое входят такие пептидные гормоны, как глюкагон, глюкагоноподобный пептид 1, глюкагоноподобный пептид 2, желудочный ингибирующий пептид и экзендин-4. В нашей статье основное внимание будет уделено именно ГПП-1.
ГПП-1 продуцируется энтеро-эндокринными L-клетками тонкого кишечника, и регуляция его секреции из эндокринных клеток ЖКТ осуществляется с помощью нескольких внутриклеточных сигналов, включая протеин киназу А, протеин киназу С и кальций. Многочисленные экспериментальные работы продемонстрировали, что секреция ГПП-1 контролируется нутриентами, а также невральными и эндокринными факторами. Следует отметить, что плазменные базальные уровни ГПП-1 у человека находятся в пределах от 5 до 10 пМ, и повышаются после приема пищи до 50 пМоль.
В исследованиях Kieffer T.Y. (1999), Drucker D.J. (1998), Massimo S.P. (1998) было показано, что ГПП-1 секретируется в ответ на прием смешанной пищи и таких отдельных нутриентов, как глюкоза, жирные кислоты и пищевые волокна. Так, пероральный прием глюкозы у человека приводил к двухфазному увеличению ГПП-1 в плазме, тогда как внутривенные инфузии глюкозы имели минимальный эффект [Hermann C., 1995]. В связи с тем, что большинство L-клеток, продуцирующих ГПП-1, расположены в дистальных отделах тонкого кишечника, быстрое повышение уровня ГПП-1 в плазме, наблюдаемое после приема пищи, может быть обусловлено непрямыми стимулирующими эффектами. В связи с чем Roberge J.N. (1993) было сделано предположение о наличии проксимально-дистальной петли, которая передает нутриент-стимулирующие сигналы из проксимальных отделов кишечника через невральные и эндокринные эффекты к дистальным L-клеткам.
При анализе экспериментальных работ было высказано предположение, что кандидатом на роль такого трансмиттера могут претендовать ГИП и ацетилхолин. Однако у человека ГИП не стимулирует секрецию ГПП-1, что было убедительного показано в исследованиях Nauck M.A. (1993). В литературе также обсуждается роль гастрин-продуцирующего пептида [Hermann-Rinke C., 2000] и n. vagus, который играет важную роль, обеспечивая быстрое высвобождение ГПП-1 из дистальных L-клеток в ответ на прием нутриентов [Rocca A.S., 1999].
Таким образом, двухфазная секреция ГПП-1, может происходить за счет интеграции гормональных и невральных факторов, которые стимулируют раннее выделение ГПП-1 (10-15 минут), а прямой нутриентный контакт с L-клетками стимулирует вторую фазу (30-60 минут) секреции ГПП-1 [Kieffer T.Y., 1999].
Хотя этот вопрос и менее изучен, необходимо также отметить, что подавляют секрецию ГПП-1 инсулин и соматостатин-28 [Hansen L., 2000], а также нейропептид галанин [Hermann-Rinke C., 2000].
Период полужизни циркулирующего, биологически активного ГПП-1 меньше, чем 2 минуты. Такой короткий период полужизни ГПП-1 в плазме обусловлен протеазной активностью фермента дипептидил пептидаза IV (ДПП-IV). ДПП-IV широко экспрессируется во многих тканях и органах, включая поджелудочную железу, ЦНС, сосудистую сеть эндотелия тонкого кишечника, находящегося в непосредственной близости к месту секреции ГПП-1.
Необходимо отметить, что первичный путь клиренса ГПП-1 осуществляется через почки с помощью механизмов, включающих гломерулярную фильтрацию и канальциевый метаболизм [Dearcor C.F., 1996]. В этой связи интерес представляют данные, что у пациентов после двусторонней нефрэктомии или у пациентов с уремией уровень иммунореактивного ГПП-1 в плазме был повышенным.
Множественные биологические эффекты ГПП-1 проявляются на самых различных уровнях (табл. 1).
Было установлено, что действие ГПП-1 не ограничивается только усилением экзоцитоза секреторных гранул, содержащих инсулин из b-клеток, а как следует из данных, представленных в таблице 1, ГПП-1 влияет также и на a-клетки поджелудочной железы, подавляя секрецию глюкагона, что, в свою очередь, ограничивает постпрандиальное повышение глюкозы.
ГПП-1 усиливает регенерацию островковых клеток путем воздействия на факторы транскрипции, такие как PDX-1. Этот ростовый эффект ГПП-1 может играть роль в адаптации островков к возрастающим требованиям к b-клеткам, например, в условиях инсулинорезистентности, на фоне ожирения. ГПП-1 имеет внепанкреатический эффект, включая инсулиннезависимое распределение глюкозы и улучшение чувствительности к инсулину [M.A. Nauck et al., 1997].
Определенный интерес представляют данные о том, что эффект действия ГПП-1 проявляется путем мощного усиления, подобно взрыву (вспышке) секреции инсулина. Однако введение ГПП-1 не влияет на частоту и амплитуду пульсовой секреции инсулина [Porksen W., 1998].
Кроме того, имеются доказательства того, что ГПП-1 действует как вещество, повышающее чувствительность b-клеток к глюкозе. Так, ГПП-1 может способствовать образованию АТФ в митохондриях. Во всяком случае, важное клиническое значение имеет тот факт, что препараты сульфонилмочевины, которые связываются с АТФ-чувствительными калиевыми каналами и закрывают их, вызывая тем самым деполяризацию мембраны и поступление ионов кальция внутрь клетки, могут выключать зависимость ГПП-1 от глюкозы. Так, введение ГПП-1 в изолированную поджелудочную железу крыс, находящуюся в перфузионном растворе с низкой концентрацией глюкозы, которая обычно не влияет на секрецию инсулина, приводило к значительной стимуляции секреции инсулина в случаях, когда в железу предварительно вводились препараты сульфонилмочевины. Показано, что цАМФ, образующийся в результате активации рецепторов ГПП-1, также может непосредственно влиять на процесс экзоцитоза, и, по оценкам исследователей, этот процесс составляет до 70% от всего секреторного инсулинового ответа. Клинически важным следствием зависимости эффектов ГПП-1 от концентрации глюкозы в крови, соответствующие нормальной или выше нормы гликемии натощак, конечно, является то, что ГПП-1 не может вызвать развитие выраженной гипогликемии (кроме, возможно, случаев одновременного применения с препаратами сульфонилмочевины).
Недавно было показано, что ГПП-1 способен ингибировать апоптоз b-клеток. В связи с тем, что нормальное количество b-клеток поддерживается равновесием процессов апоптоза и пролиферации, эти данные представляют огромный интерес и открывают возможность того, что ГПП-1 может оказаться эффективным при патологических состояниях, связанных с усиленным апоптозом b-клеток. Все это позволяет предположить, что ГПП-1 может быть способным стимулировать образование новых b-клеток (неогенез) у пациентов с сахарным диабетом 2 типа и недостаточным количеством функционирующих клеток (хотя еще не выяснено, насколько этот процесс выражен у человека).
Особый интерес представляют данные, касающиеся изучения секреции ГИП и ГПП-1 при сахарном диабете 2 типа.
Так, в исследовании Toft-Nielsen обнаружили, что уровни ГИП натощак у больных сахарным диабетом 2 типа близки к нормальным значениям. В то же время эти авторы, изучая секрецию ГПП-1 у больных сахарным диабетом 2 типа, выявили существенные нарушения этого этерогормона при данном заболевании.
При сравнении секреции инсулина в ответ на оральную и внутривенную нагрузку глюкозой при условии одинаковой концентрации глюкозы оказалось, что превышение секреции инсулина на пероральное введение у здоровых лиц достоверно выше, чем при сахарном диабете 2 типа [Nauck, 1986].
Говоря о нарушении инкретинового эффекта при сахарном диабете 2 типа, важно подчеркнуть, что при этом заболевании секреция ГПП-1 снижена на 20-30% при сохранении в целом его инсулиностимулирующего действия. В то же время следует подчеркнуть, что секреция ГИП при сахарном диабете не меняется, однако установлено снижение его стимулирующего влияния на b-клетки поджелудочной железы.
Причины этих нарушений окончательно не установлены, хотя большинство исследователей приходят к заключению, что нарушение секреции ГПП-1, очевидно, является следствием сахарного диабета 2 типа.
В заключение следует сказать, что в последнее десятилетие благодаря фундаментальным и клиническим исследованиям развилось новое и перспективное направление в лечении сахарного диабета 2 типа, основанное на использовании инкретинового эффекта. Так, изучены свойства и лечебный потенциал ГПП-1, и сегодня нет сомнений в его терапевтической эффективности. Принципиально важным моментом в этом плане являются глюкозозависимая стимуляция секреции инсулина и ингибирование секреции глюкагона. В то же время возможное торможение апоптоза b-клеток поджелудочной железы и усиление их регенерации дают определенную надежду на то, что при сахарном диабете 2 типа удастся остановить прогрессирующее снижение массы функционирующих b-клеток при развитии дефицита секреции инсулина.
Результатом многолетних клинических исследований, проводимых совместно компаниями «Эли Лилли» и «Амилин Фармасьютикалс», явилась разработка препарата Эксенатид, являющегося экзогенным функциональным аналогом ГПП-1 и первым представителем лекарственного класса инкретиновых миметиков. Эксенатид показан при сахарном диабете типа 2 в качестве дополнительной терапии к метформину, производным сульфонилмочевины или комбинации метформина и производных сульфонилмочевины для улучшения гликемического контроля. Неоспоримым преимуществом Эксенатида, делающим возможным его клиническое применение (в отличие от ГПП-1), явился длительный период полувыведения, составляющий 2,4 часа (1-2 минуты для ГПП-1). Аминокислотная последовательность Эксенатида частично соответствует последовательности человеческого ГПП-1, в результате чего он связывается и активирует рецепторы ГПП-1 у человека, приводя к усилению глюкозозависимого синтеза и секреции инсулина из b-клеток поджелудочной железы с участием циклического АМФ и/или других внутриклеточных сигнальных путей. При этом Эксенатид стимулирует высвобождение инсулина из b-клеток в присутствии повышенных концентраций глюкозы, минимально влияя на выброс инсулина при нормогликемии, что ведет к низкому риску гипогликемий. Нормализация углеводного обмена при назначении экзенатида достигается не только за счет глюкозозависимой стимуляции синтеза инсулина, но и за счет реализации таких важных эффектов, как подавление неадекватно повышенного уровня глюкагона, снижение аппетита, торможение эвакуации желудочного содержимого и увеличение массы b-клеток, обусловленное стимуляцией пролиферации и неогенеза, с одной стороны, и торможением апоптоза - с другой. Все вышеперечисленное вселяет уверенность, что инкретин миметики найдут свое достойное место в ряду препаратов, применяемых для лечения сахарного диабета.
Роль гормона роста в регуляции жирового и углеводного обмена
Исследования, проводимые в последнее время и посвященные изучению различных факторов, участвующих в развитии ожирения, наглядно демонстрируют: гормон роста (ГР) играет активную роль в регуляции основного обмена.
Исследования, проводимые в последнее время и посвященные изучению различных факторов, участвующих в развитии ожирения, наглядно демонстрируют: гормон роста (ГР) играет активную роль в регуляции основного обмена. До сих пор не совсем понятно, почему при двух противоположных состояниях (акромегалии — состоянии, сопровождающемся повышенной секрецией ГР, и соматотропной недостаточности) имеют место схожие нарушения обмена: развитие ожирения, сахарный диабет, гиперлипидемии и дислипопротеидемии.
Говоря о метаболических эффектах гормона роста, необходимо помнить о том, что ГР не только является анаболическим гормоном, но также обладает антинатрийуретической и липолитической активностью. Ростовые факторы (ИФР-1, ИФР-2), помимо того что через них действует ГР, оказывают и собственное воздействие на органы и ткани организма. Большая часть циркулирующего в крови ИФР-1 продуцируется печенью, последний может синтезироваться в ряде органов и тканей, где действует как ауто- и/или паракринный ростовой фактор.
Об участии ГР в развитии и функционировании иммунной и кроветворной систем известно достаточно давно. Практически все клетки, относящиеся к системе лимфогемопоэза, не только имеют функционально активные рецепторы к ГР и ИФР-1 (Tapson et al., 1988; Johnson et al., 1992), но и синтезируют указанные соединения. Примером воздействия соматотропина на иммунокомпетентные клетки можно считать тот факт, что введение ГР гипофизэктомированным крысам восстанавливало клеточный и гуморальный иммунитет и повышало выживаемость гипофизэктомированных крыс, инфицированных Salmonella tiphy, в той же степени, что и тетрациклин (Еdvards et al., 1991).
ГР стимулирует синтез и секрецию ИФР-1 в печени, ИФР-1, в свою очередь, по механизму отрицательной обратной связи регулирует секрецию ГР. Большая часть ростовых факторов, синтезируемых в печени, находится под контролем не только ГР, но и инсулина. Так, снижение уровня инсулина, наблюдаемое у пациентов с сахарным диабетом первого типа, сочетается с уменьшением в крови уровня циркулирующего ИФР-1 и увеличением концентрации ГР.
Среди многочисленных факторов, влияющих на энергетический обмен, наиболее пристальное внимание клиницистов и исследователей в последнее время привлекает лептин, вырабатывающийся адипоцитами белой жировой ткани. Он выступает как антагонист нейропептида Y, синтезируемого аркуатным ядром гипоталамуса, в результате формируется ось, направленная на стимуляцию и торможение чувства насыщения: лептин усиливает чувство насыщения, нейропептид Y стимулирует чувство голода. Установлена прямая зависимость между концентрацией лептина и ИМТ, а также процентом жировой массы.
Достаточно интересен механизм взаимодействия между лептином и основными соединениями, принимающими активное участие в энергетическом обмене. Концентрация лептина у женщин в несколько раз превосходит таковую у мужчин, что может быть связано с преобладанием подкожно-жировой клетчатки над висцеральной у женщин, а также с положительным влиянием, оказываемым эстрогенами на концентрацию лептина. Предполагается, что именно лептин служит у женщин маркером достижения критической жировой массы, необходимой для наступления менархе и запуска репродуктивной функции.
Достаточно интересен механизм взаимодействия лептина и инсулина: в ответ на повышение инсулинемии адипоциты активизируются, что ведет к повышению концентрации лептина. В свою очередь, лептин, воздействуя на собственные рецепторы, локализованные на поверхности β-клеток, тормозит выброс инсулина. Однако данные, полученные Dagogo- Gack S., опровергают наличие корреляции между гиперлептинемией и гиперинсулинемией, в связи с чем принципы взаимодействия между лептином и инсулином требуют дальнейшего уточнения и изучения.
Хорошо известно, что гиперсекреция ГР вызывает многочисленные нарушения в функционировании органов и систем организма. Стимулируя рост мягких тканей, ГР способствует значительному увеличению размеров сердца. При этом диаметр клапанного аппарата остается прежним. В результате формируется недостаточность кровообращения. Обладая диабетогенными свойствами, ГР в высоких концентрациях приводит к стимуляции гликогенолиза, торможению утилизации глюкозы мышцами, повышает активность инсулиназы печени. Повышенная концентрация свободных жирных кислот вследствие активации липолиза угнетает активность гликолитических ферментов в периферических тканях и затрудняет утилизацию глюкозы периферическими тканями. Эти нарушения способствуют формированию инсулинорезистентности в 50-60% случаев и, вероятно, могут приводить к развитию сахарного диабета второго типа — в 20% случаев. Развитие апноэ во сне в связи с гипертрофией мягких тканей гортани и сужением верхних дыхательных путей повышает риск внезапной смерти у пациентов с акромегалией в три раза (в сравнении с контрольной группой). Не менее серьезным осложнением акромегалии являются разнообразные нарушения деятельности сердечно-сосудистой системы, включающие артериальную гипертензию, увеличение размеров сердца, развитие акромегалической кардиомиопатии и сердечной недостаточности.
Дефицит гормона роста (ДГР) — заболевание, развивающееся в результате тех или иных оперативных, лучевых, механических или иных воздействий на область гипофиза у взрослых и характеризующееся развитием стертой симптоматики. Наиболее характерными признаками ДГР являются снижение качества жизни пациентов, повышение удельного веса жировой с одновременным снижением процента мышечной массы, снижение плотности костной ткани, повышение атерогенности плазмы крови, развитие сердечно-сосудистых осложнений.
ДГР приводит к развитию гиперинсулинемии. Iranmanesh A. с соавторами доказали существование отрицательной связи между ИМТ и периодом полужизни ГР, ИМТ и амплитудой пиков секреции ГР, из чего можно сделать вывод, что, чем ниже концентрация ГР, тем выше показатель ИМТ.
Veldhuis J. D. в 1995 году выявил, что суточная концентрация ГР отрицательно коррелирует с содержанием жировой ткани. Хорошо известно, что развитие алиментарного ожирения сопровождается повышением содержания лептина в сыворотке крови. В условиях развития соматотропной недостаточности лептинемия повышается, что связано с прекращением отрицательного влияния ГР на секрецию лептина адипоцитами. Факт непосредственного воздействия инсулина на гипофиз остается спорным, но, несмотря на малое количество рецепторов к инсулину на поверхности питуитоцитов, торможение секреции и выброса ГР, сопровождающееся снижением концентрации м-РНК и ГР в соматотрофах, было выявлено в экспериментах in vitro.
Декомпенсированная соматотропная недостаточность способствует повышению концентрации ТГ, снижению содержания ЛПВП, повышению уровня фибриногена, активизации ингибитора-1 плазминогенного активатора фибриногена, снижению массы левого желудочка и уменьшению в связи с этим систолического выброса. Все перечисленные факторы способствуют повышению атерогенности плазмы крови, развитию сердечно-сосудистых осложнений у пациентов с дефицитом гормона роста.
Два независимых исследования, проведенные в Швеции и Великобритании, были посвящены ретроспективному анализу продолжительности жизни и причинам смерти у пациентов с ДГР. Ретроспективное исследование продолжительности жизни пациентов с подтвержденным диагнозом ДГР позволило выявить более высокий уровень смертности в описываемой группе в сравнении с данными в популяции. Анализ причин смертности позволил достоверно утверждать, что первое место среди них занимают сосудистые заболевания. Два независимых эхокардиографических исследования подтвердили факт достоверного уменьшения массы левого желудочка и снижения систолического выброса у пациентов с ДГР в сравнении с контрольной группой (Rasat R. et al.,1996).
По сравнительным данным, полученным в результате многочисленных исследований, отмечались уменьшение толщины стенки левого желудочка, снижение фракции выброса у пациентов с более чем 20-летним анамнезом дефицита гормона роста (Frustraci A. et al., 1992). Острый инфаркт миокарда, ишемическая болезнь сердца в сочетании с сердечной недостаточностью и цереброваскулярными расстройствами являлись наиболее частыми причинами «сосудистой смерти» у пациентов с ДГР. Заместительная терапия ГР способствовала увеличению толщины стенки левого желудочка, повышению фракции выброса, увеличению массы левого желудочка, повышению ударного объема (Cuneo R. C. et al., 1989).
На принятом в Порт Стефенс консенсусе, посвященном диагностике и лечению ДГР, рекомендовано начинать терапию с низких доз препарата: 0,15-0,30 мг/день или 0,45-0,90 МЕ/день. Для контроля компенсации ДГР используется определение концентрации ИФР-1, именно этот показатель отражает функциональную активность системы гипоталамус-гипофиз-ростовые факторы.
Wiren L. et al. (1998) предлагают следующий расчет дозы препарата: 6 mg /кг/сутки или 0,018 МЕ/кг/сутки, максимальная доза в этом случае не будет превышать 12 mg /кг/сутки или 0,036 МЕ/кг/сутки. В ходе другого исследования нормализация концентрации ИФР-1 наступила при введении средних доз препарата, составляющих 0,6-1,2 МЕ/сутки (Janssen Y. J. H. et al., 1998).
В целях изучения влияния генотропина на показатели липидного обмена и антропометрических показателей у взрослых с ДГР в клинике эндокринологии ММА им. И. М. Сеченова было обследовано 18 пациентов (15 женщин и 3 мужчин) в возрасте 33,5±7 лет с подтвержденным диагнозом ДГР, семь из которых получали генотропин в дозе 1,0±0,2 МЕ/сутки в течение 6 месяцев. Исследовались показатели ИМТ, ОТ/ОБ, ХС, ТГ, ЛПНП, ЛПВП и индекс атерогенности (ИА) до лечения и через 6 месяцев терапии. Все полученные данные сравнивались с аналогичными показателями в группе, не получавшей генотропин. За время лечения в группе, получавшей генотропин, зафиксировано достоверное снижение показателей ОТ (р = 0,02) и ОТ/ОБ (р = 0,04), в отличие от группы сравнения, где рассматриваемые параметры остались прежними — р = 0,9 и р = 0,3 соответственно. В показателях липидного спектра на фоне приема генотропина произошло статистически значимое снижение ХС (р = 0,007), ЛПНП (р = 0,003), ИА (р = 0,003), содержание ТГ не изменилось (р = 0,4), а ЛПВП повысилось (р = 0,002). Среди пациентов, не получавших генотропин, не было отмечено сколь-нибудь значимых изменений в показателях жирового обмена: ХС (р = 0,4), ТГ (р = 0,6), ЛПНП (р = 0,4), ЛПВП (р = 0,3), ИА (р = 0,5). Таким образом, препараты гормона роста эффективно снижают концентрацию ХС, ЛПНП с одновременным повышением содержания ЛПВП, способствуют снижению ОТ и отношения ОТ/ОБ, что уменьшает риск развития висцерального ожирения и сердечно-сосудистых заболеваний у пациентов с ДГР.
Что такое инсулин?

Выпускник медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 19.09.2020
- Reading time: 3 минут чтения
Инсулин - это гормон, вырабатываемый поджелудочной железой, который необходим для метаболизма углеводов и, в меньшей степени, жиров. Благодаря инсулину энергия (глюкоза) из пищи переносится из крови в клетки. Таким образом снижается уровень сахара в крови и обеспечивается питание клеток.
Когда уровень инсулина в норме, уровень сахара в крови в норме. Когда инсулин слишком низкий (или не работает должным образом), диагностируется диабет. Когда уровень инсулина высокий, а уровень сахара в норме, мы говорим об инсулинорезистентности.
Диабет 1 типа, диабет 2 типа и инсулинорезистентность - это проблемы со здоровьем, которые связаны с инсулином - гормоном, необходимым для жизни. Он нужен организму в строго определенном количестве. Опасны как дефицит инсулина, так и его чрезмерный избыток.
Какую роль инсулин играет в организме? Когда следует проверять его уровень? Что происходит, когда инсулина слишком мало или слишком много?
Как действует инсулин
Инсулин - это гормон, понижающий уровень сахара в крови. Его образно называют ключом, открывающим клетки энергии из пищи. Источником энергии для организма являются углеводы. Энергия из простых углеводов проникает в кровь практически сразу после еды, сложные углеводы сначала нужно расщепить на простые сахара - глюкозу в процессе пищеварения. Она циркулирует в крови и попадает в клетки только в присутствии инсулина. Без инсулина клетки не могут получать энергию из пищи, даже если в крови много глюкозы.
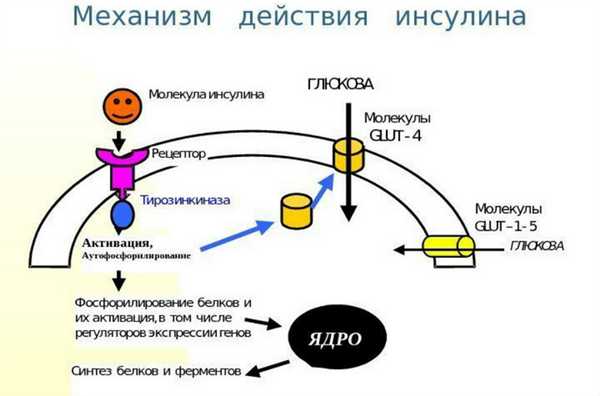
Механизм действия инсулина
Отсюда взаимосвязь между уровнем сахара и инсулином. Когда этот гормон отсутствует, глюкоза не попадает в клетки, она остается в крови, что приводит к гипергликемии. Состояние диагностируют в лабораторных исследованиях или с помощью глюкометра.
Важно отметить, что инсулин не снижает уровень сахара в крови до нуля, то есть не вся энергия из пищи поступает в клетки. Строго определенное количество сахара остается в крови и является топливом, необходимым для работы мозга. Мозгу постоянно нужна глюкоза, это орган, не зависящий от действия инсулина, он забирает сахар из крови без этого гормона.
Вот почему в крови здорового человека содержится определенное количество сахара, которое в лабораторных условиях дает результат в диапазоне 70-99 мг/дл глюкозы натощак.
Инсулин - это белок. Поэтому его следует принимать в виде подкожной инъекции . Таблеток инсулина не существует, потому что они перевариваются в пищеварительном тракте.
Подкожная инъекция инсулина
Инсулин и глюкагон
Инсулин вырабатывается в ответ на повышение уровня глюкозы в крови. После обильной еды с большим количеством углеводов уровень этого гормона в кровотоке значительно увеличивается. Между приемами пищи и ночью уровень инсулина ниже.
Гормон, противоположный инсулину, - это глюкагон, повышающий уровень сахара в крови. В здоровом организме эти два гормона остаются в равновесии. Глюкагон высвобождается, когда сахар в крови начинает слишком низко падать (например, ночью), а инсулин - когда сахар в крови начинает слишком сильно повышаться.
Благодаря сбалансированной секреции этих двух гормонов, у здорового человека уровень сахара остается нормальным как после обильной еды, так и в результате многочасового голодания.
Инсулин - анаболический или строительный гормон, благодаря которому можно выращивать клетки (неиспользованная глюкоза превращается в жир). Высокий уровень инсулина в организме, типичный для инсулинорезистентности, способствует увеличению избыточного веса.
Когда не хватает инсулина
Отсутствие или тяжелая недостаточность инсулина означает диабет типа 1. Это заболевание диагностируется по заметно повышенному уровню сахара в крови (гипергликемия). Его лечение заключается в восполнении дефицита инсулина. Причина нехватки инсулина у пациентов с диабетом 1 типа - это разрушение иммунной системой бета-клеток поджелудочной железы (аутоиммунное заболевание).
Сегодня на рынке представлено множество препаратов инсулина. Инсулин животного происхождения ушел в прошлое, сегодня применяются так называемый человеческий инсулин и аналог инсулина.
Симптомы нехватки инсулина:
- Очень сильная жажда;
- Отхождение большого количества мочи; - клетки голодают, не могут получать энергию из крови, организм начинает сжигать жир, что приводит к потере веса.


До того как был «изобретен» инсулин, диабет 1 типа считался смертельным заболеванием. Пострадавшие пациенты гибли от крайнего недоедания. Поскольку теперь инсулин производят в лабораториях, и он доступен всем, диабет 1 типа перешел в разряд хронических заболеваний.
Когда слишком много инсулина
Избыток инсулина тоже вреден для организма. Мы имеем дело с высоким уровнем инсулина в крови при:
Инсулинорезистентность - это нарушение обмена веществ, диабет 2 типа - это заболевание, которое возникает в результате инсулинорезистентности, поэтому эти проблемы можно обсуждать вместе. Они отличаются тем, что гликемия нормальна при инсулинорезистентности и повышена при диабете 2 типа.
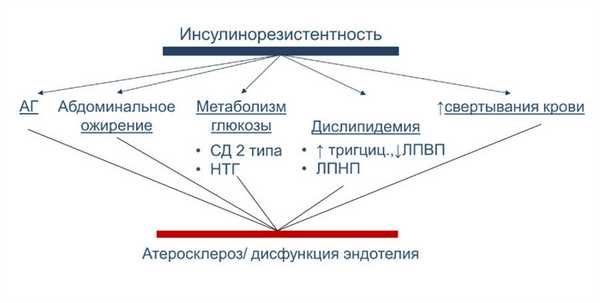
Инсулинорезистентность
Высокая концентрация инсулина возникает, когда поджелудочная железа вынуждена производить избыточный инсулин. Когда это происходит? Когда клетки организма нечувствительны к инсулину (другими словами - устойчивы к нему). Чтобы преодолеть это сопротивление, поджелудочная железа вырабатывает повышенное количество гормона, что дает побочные эффекты:
- Инсулин стимулирует аппетит;
- Как анаболический гормон, он способствует увеличению веса.
Выработка большого количества инсулина ложится нагрузкой на поджелудочную железу, она перестает быть эффективной в этом процессе. Поэтому на основе инсулинорезистентности развивается диабет 2 типа.
Читайте также:
- Весенний авитаминоз. Определяем нехватку витаминов в организме
- Синдром Хольтермюллера-Видеманна (Holtermuller-Wiedemann)
- Приступы гнева
- Синдром Педжета-Шреттера (Paget-Schroetter)
- Клинические проявления поражений палочки инфлюэнзы. Микробиологическая диагностика палочки инфлюэнзы. Лечение поражений палочки инфлюэнзы. Профилактика заражения палочкой инфлюэнзы.
