Влияние погибающих (апоптических) клеток на иммунитет
Добавил пользователь Владимир З. Обновлено: 08.01.2026
Живая клетка рождается в результате деления материнской клетки, проходит жизненные циклы и в конце концов умирает. Клетки погибают «от старости» или каких-либо повреждений. Но вот оказалось, что они могут умирать и без видимых причин, самопроизвольно. И такая гибель — важный защитный механизм организма животных и человека.
Середина XIX века — время зарождения цитологии, науки о клетке. Именно тогда открыли, что живой организм состоит из отдельных клеток, которые постоянно размножаются — без этого не было бы ни роста, ни развития. И стало ясно, что такой процесс не может продолжаться бесконечно. В противном случае старики достигали бы размеров слона. Естественно, что для сохранения постоянства массы, формы да и функции тела какая-то часть клеток должна непрерывно отмирать. До недавнего времени считалось, что процесс отмирания — исключительно дегенеративный: клетка стареет, в ней накапливаются повреждения, замирает обмен веществ, она работает все хуже, чахнет и, наконец, погибает. Его, по существу, не отличали от того варианта гибели клеток, который происходит при травме, воздействии ядов, прекращении кровоснабжения и т. п., — некроза. То есть процесс отмирания рассматривали как катастрофу, а не как физиологически естественное явление.
Однако спустя столетие ученые поняли, что все происходит совсем иначе — клетки отмирают без видимой причины, и такая самопроизвольная гибель отличается от некроза. Жила, жила клетка и вдруг по непонятным причинам «умерла», причем без признаков воспаления и рубцевания.
Механизм программируемой гибели клеток теперь выяснен достаточно полно. Причиной гибели клетки может быть ее растворение, или, говоря научным языком, лизис. В 50-х годах XX века установили, что внутри клеток имеются макроскопические пузырьки—лизосомы. В них содержатся переваривающие ферменты, вроде тех, которые выделяются в желудке и кишечнике. Если целостность этих пузырьков по тем или иным причинам нарушается, то ферменты изливаются в протоплазму клетки и начинают «переваривать» ее содержимое. Это приводит к постепенному растворению, распаду клетки на части, и в итоге — к ее гибели.
Высказывалось также предположение, что программируемая смерть клетки может происходить и из-за избытка супероксид-радикалов. Суть механизма в следующем. Жизнедеятельность клетки требует кислорода, который обеспечивает ее энергией. Молекула кислорода, как известно, состоит из двух атомов и обозначается знаком О2. Если написать ее структурную формулу, то получается 0=0. В таком виде кислород не слишком реакционно способен. Да простят меня химики, но для упрощения скажем, что под действием ферментов в живых тканях из молекул 0=0 постоянно образуются молекулы типа -0-0-, атомарный кислород -0-, гидроксильные радикалы Н-0- или озон -0-0-0-, очень сильные окислители. У них, выражаясь образно, атомы кислорода не держатся друг за друга, а имеют одну или две свободные руки (валентности), готовые «схватить за руку» любой другой атом.
В физиологических условиях из поступившего в организм кислорода воздуха примерно 5—6% его молекул образует такие супероксидные формы, которые в небольшом количестве опасности не представляют. Но при воздействии радиации, некоторых ядов, четыреххло-ристого углерода, печально известных диоксинов, при вирусных заболеваниях и некоторых нарушениях обмена веществ и т. п. супероксидные радикалы образуются в избытке. В этом случае они начинают окислять совсем не то, что требуется, в частности внешние и внутренние оболочки клеток. Как полагают многие исследователи, окислительные процессы провоцируют возникновение таких заболеваний, как склероз, гипертония, снижение иммунитета, рак, слабоумие. Окисление мембраны клеток дезорганизует работу ферментов, затрудняя проникновение в клетку ионов и питательных веществ, что ведет к невероятной путанице в согласованности работы клеточных механизмов и в конечном итоге заканчивается гибелью клетки.
Существует еще один вариант программируемой клеточной гибели, так называемая «кальциевая смерть». Она имеет много причин, но суть ее сводится к тому, что избыток ионов кальция, находящийся в межклеточной жидкости, по тем или иным причинам поступает в протоплазму клетки, активирует там ряд ферментов, что ведет сначала к нарушению обмена веществ, а затем и распаду клетки.
Термин «апоптоз» был предложен в 1972 году американским исследователем Дж. Керром для описания программируемой гибели клетки. Слово это происходит от греческих слов «апо» — завершенность и «птоз» — падение и может быть переведено как «опадание листьев». Суть термина подчеркивает его естественность, фи-зиологичность в отличие от некроза — смерти от повреждения. Проходит жизненный цикл, и падают плоды, опадают листья.
Апоптоз — принципиально новое фундаментальное понятие в клеточной биологии. Керр и его сотрудники сформулировали основные признаки апоптоза. Во-первых, при апоптозе распад клетки начинается с ядра — оно сморщивается и распадается на отдельные фрагменты. Во-вторых, апоптирующая клетка уменьшается в объеме и как бы отделяется от соседей. В-третьих, меняются свойства ее мембраны, в результате чего она легко распознается макрофагами (пожирателями клеток). В-четвертых, сохраненные мембраны образуют на месте погибшей клетки живые капельки с функционирующими органеллами, которые поглощаются клетками-соседями или макрофагами. На месте погибшей клетки ничего не остается.
Апоптоз запрограммирован генетически. Пока гены, инициирующие самоубийство, неизвестны. Скорее всего, гены-«убийцы» спят, но под влиянием каких-либо сигналов «просыпаются», подготавливая клетку к самопроизвольной гибели. Факторов, которые могут подстегнуть клетку к самоубийству, очень много. И механизмы апоптоза применительно к каждому случаю тоже различны.
В наглядной форме апоптоз наблюдается в какой-либо ткани, отслужившей свой срок. Так отмирает хвост у головастиков, изменяется форма и размеры эмбриона. Уменьшение объема грудной железы после окончания лактации происходит без всякого некроза, атрофия предстательной железы после кастрации тоже. Отмирает и то, что отслужило свой срок. Во взрослом организме апоптоз происходит постоянно. Он наиболее распространен у корот-коживущих клеток, например выстилающих кишечник, клеток кожи, клеток крови.
Апоптоз является защитным механизмом организма. При инфаркте в результате тромбоза отмирает участок сердечной мышцы. Под микроскопом видно, что в погибшей мышечной ткани некротические клетки чередуются с апоптозными. Разница между ними существенная, поскольку на месте некроза возникает воспаление и рубец, а на месте апоптоза — соседние клетки замещают погибшие.
Самоуничтожение клеток, пораженных вирусом, уменьшает число больных клеток, при этом распадаются и вирусные ДНК.
Другой вид апоптоза — самоуничтожение мутировавших клеток. Клетка-мутант, не только раковая, хотя она и наиболее опасна, но и любая другая, распознается как чужеродная, и организм «дает команду» на ее самоуничтожение.
Ну и наконец: ударился человек обо что-то. Но не сильно. Так, ушиб. Но клетки-то повреждены, следовательно неполноценны. А вдруг в них попадут микробы? Поэтому поврежденным дефектным клеткам тоже приходится апоптировать, чтобы не подвергать опасности весь организм.
Важным различием между некрозом и апоптозом является следующее: если некроз — это катастрофическая и необратимая смерть, то апоптоз — это лишь подсказанная разнообразными факторами идея о целесообразности самоубийства. Значит, в развитие апоптоза можно вмешаться: если надо — ускорить, если надо — замедлить. Например, замедлить атрофию нейронов и ускорить гибель раковых клеток.
Апоптоз, как уже говорилось, генетически запрограммирован, поэтому он развивается поэтапно, а не разворачивается подобно пружине. Каждой его стадией можно управлять при помощи лекарственных препаратов. В 1998 году японскими исследователями было установлено, что дробление ДНК при апоптозе начинается с ее ферментативного расщепления на крупные фрагменты. Добавив активатор или блокатор фермента, можно регулировать апоптоз на самой начальной стадии — фрагментации ДНК, что позволит направлять клеточное самоубийство в нужном направлении: например, активировать при злокачественных опухолях или подавлять при инфаркте миокарда.
В настоящее время выявлены физиологические блокаторы апоптоза, в частности фактор роста, нейтральные аминокислоты, цинк, противовоспалительные вещества, гормоны: эстрогены, андрогены, блокаторы ферментов (цистеиновых протеаз) и фенобарбитал (люминал).
Теперь третье, самое реальное. Если смерть клетки от апоптоза обратима, то с ней мы вполне можем побороться для того, чтобы предохранить хотя бы часть органа или ткани от гибели при патологических процессах. Сделать это можно, например, сохраняя целостность клеточных мембран. Она обеспечивается входящими в их состав липидами (особый вид животных жиров), особенно одной из разновидностей липидов— фосфолипидами. В терапии уже давно и с успехом используется целый набор препаратов, содержащих фосфолипиды.
Особенно популярен комплексный липидный препарат эссенциале. Аминокислоты также защищают мембраны от разрушения. Среди них — метионин, гистидин, цистеин, для защиты нервных клеток мозга применяют аминокислотный препаратцеребролизин.
Защита мембран и прочих компонентов клеток от переокисления у здорового человека обеспечивается естественными антиоксидан-тами, но при болезнях, протекающих с явлениями клеточного апоптоза, например при инфаркте миокарда, гепатите, снижении иммунитета, некоторых болезнях надпочечников, анти-оксидантов не хватает и тогда эффективными оказываются витамины-антиокислители, к которым относятся (по мере убывания активности) витамины Е, С, А и К. В последние годы создано много эффективных синтетических антиоксидантов, в том числе мексидол, эмоксипин, ионол и другие.
Весьма полезны для предотвращения апоптоза средства, снижающие уровень кальция внутри клетки. Обычно их используют для лечения стенокардии. При стенокардии снижается приток крови к сердечной мышце, что создает все условия для апоптоза ее клеток. Даже в том случае, если инфаркт предупредить не удается, то при регулярном употреблении средств, снижающих уровень кальция, он ограничивается лишь зоной неизбежного некроза, а клетки, уже приготовившиеся для самоубийства ради спасения себе подобных, остаются живы. Таким образом, иногда удается спасти от гибели хотя бы часть сердечной мышцы.
Механизм апоптоза только начинает изучаться, а фармакологи уже могут предложить свои эффективные лекарственные препараты, способные управлять этим процессом, что не может не радовать.
Читайте в любое время
Два возможных пути гибели живой клетки. 1-й путь — апоптоз (генетически запрограммированное самоубийство клеток): последовательная фрагментация ядра, разделение клетки на фрагменты без распада мембран и клеточных структур; 2-й путь — некроз (катастрофическая необратимая смерть клеток): разрыв внутриклеточных структур, разрушение мембран, переваривание клеточных белков.
Влияние погибающих (апоптических) клеток на иммунитет
Физиология:
Популярные разделы сайта:
Значение апоптоза. Участие апоптоза в иммунном ответе
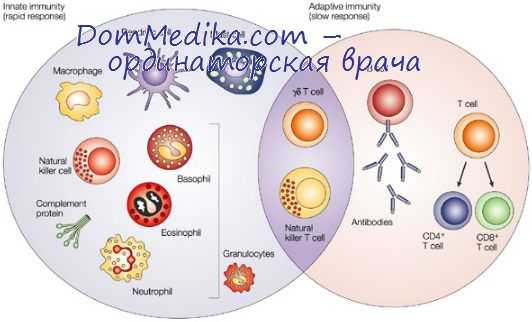
Апоптоз — крайне важный механизм иммунной регуляции. Развитие клеток иммунной системы происходит при постоянном участии апоптоза. Подробно изучена роль апоптоза в различных стадиях дифференцировки лимфоцитов. В стадии про-Т- и про-В-лимфоцитов при отсутствии ИЛ-7 происходит избыточная гибель клеток. Апоптоз служит основным механизмом выбраковки клеток с дефектами перестройки генов антигенраспознающих рецепторов (TCR, BCR).
Свыше 97% лимфоцитов погибает при апоптозе в тимусе в результате селекции: при положительной селекции погибают лимфоциты, не распознающие аутологичных молекул HLA со средней степенью аффинности; при отрицательной селекции с помощью апоптоза происходит выбраковка аутоагрессивных клонов. При дифференцировке субпопуляций Т-хелперов и ЦТЛ апоптозу подвергаются клетки в случае несоответствия их костимулирующих молекул (CD4 и CD8).
Клетки, выполнившие свою функцию в иммунном ответе, подвергаются апоптозу. Большинство активированных клеток погибает при апоптозе в результате элиминации антигена. При отсутствии антигена клетки не получают сигналов, необходимых для их выживания. В этом случае митохондрии клетки высвобождают цитохром с, который в комплексе с APAF-1 (Apoptosis Protein Activating Factor — активирующий апоптоз фактор 1) вызывает активацию каспаз. При длительной антигенной стимуляции клетки подвергаются апоптозу по механизму индуцированной активацией клеточной гибели.
Этот механизм обусловлен тем, что в нем участвует семейство рецепторов фактора некроза опухоли. Наиболее важный из них — рецептор Fas, при связывании со своим лигандом FasL вызывает активацию каскада каспаз и в итоге — гибель клетки. FasL может экспрессироваться на поверхности различных клеток, однако существуют данные, что Т-лимфоциты могут сами секретировать растворимый FasL и тем самым запускать собственную гибель при длительной стимуляции.
Нарушения регуляции гибели клетки — важный компонент многих заболеваний: опухолевых, лимфопролиферативного синдрома, СПИДа, ишемии и нейродегенеративных заболеваний (болезнь Паркинсона, Альцгеймера, Хантингтона). При одних заболеваниях функция апоптоза снижена, при других, наоборот, выражена чрезмерная гибель клеток путем апоптоза. Подавление апоптоза играет центральную роль в развитии и прогрессировании раковых образований. Существует множество молекулярных механизмов, с помощью которых в опухолевых клетках происходит подавление апоптоза.
Клетки могут приобрести устойчивость к апоптозу путем усиленной экспрессии антиапоптотических факторов или в результате мутаций в генах проапоптотических молекул. Так, в опухолевых клетках снижена экспрессия рецептора Fas либо изменена его конформация, что делает невозможным взаимодействие с лигандом. Важную роль в канцерогенезе играет и белок р53 — фактор транскрипции. Он регулирует клеточный цикл и активирует белки, участвующие в репарации ДНК. Однако, если повреждения ДНК восстановить невозможно, белок р53 запускает процесс апоптоза.
Мутации гена р53 резко ослабляют процесс элиминирования опухолевых клеток. В процессе канцерогенеза могут участвовать и другие механизмы подавления апоптоза. Еще одно заболевание, при котором резко снижен уровень апоптоза, — аутоиммунный лимфопролиферативный синдром. При этом заболевании не происходит апоптоза аутоагрессивных Т-клеток, что приводит к развитию разнообразных аутоиммунных процессов, таких, как тромбоцитопения, гемолитическая анемия и аутоиммунная нейтропения.
Гибель клеток при метаморфозе, эндокринозависимой атрофии тканей и в процессе удаления стареющих, избыточных или аномальных клеток называется апоптозом. Это запрограммированная клеточная гибель - естественный процесс, который находится под контролем генетической регуляции. Одним из внеклеточных факторов, запускающих в клетке апоптоз, является Fas-лиганд (FasL). Белок Fas/АРО-1, также называемый CD95, относится к семейству рецепторов фактора некроза опухоли (TNF). Степень активации рецептора Fas различными лигандами зависит от микроокружения клеток. Активация каспаз - необходимый этап Fas-опосредованного апоптоза. В дендритных клетках активация рецепторов Fas вызывает их фенотипическое и функциональное созревание. Fas-опосредованная дифференцировка клеток иммунной системы (ИС) сопровождается секрецией провоспалительных цитокинов TNF, ИЛ-1b, ИФg, что указывает на участие Fas-системы в реализации иммунного ответа (ИО) организма при воспалении. Рецептор Fas выявлен в клетках многих типов тканей. FasL экспрессирован преимущественно в активированных Т-лимфоцитах и ЕК-клетках. Большинство незрелых Т-клеток неспособны осуществлять свои функции из-за дефекта Т-рецепторов или аутоагрессивны для организма, и потому уничтожаются в тимусе или на периферии (клональная селекция). Fas участвует в самоликвидации активированных Т-клеток и, следовательно, в подавлении избыточного ИО. Факты предполагают участие Fas-системы в удалении активированных или аутоагрессивных В-клеток.
Установлено, что функционально активными цитотоксическими Т-лимфоцитами (ЦТЛ) являются CD8+ Т-клетки, но CD4+ Т-клетки Th-1-типа также проявляют цитотоксичность, распознают и уничтожают опухолевые клетки, а также инфицированные вирусами или бактериями. ИО клеток и воспалительные реакции могут вызвать неспецифическое повреждение близлежащих тканей.
Показано, что нормальное функционирование Fas-системы поддерживает клеточный гомеостаз в организме. Потеря функциональной активности Fas-системы вызывает гиперплазию лимфоидных органов и развитие лимфопролиферативных процессов. Отклонение от нормы и выживание лимфоцитов позволяет клеткам накапливать мутации, приводящие к злокачественным новообразованиям.
Обнаружены: повышенный уровень рецептора Fas у больных системной красной волчанкой и другими аутоиммунными заболеваниями, а также нарушения элиминации активированных лимфоцитов, что обусловлено ингибированием Fas-зависимого апоптоза. То же выявлено в сыворотке крови больных с опухолевыми новообразованиями. Характерно повышение концентрации рецептора Fas при метастазировании и его снижение после оперативного удаления опухолей. FasL, локализованный на поверхности опухолевых клеток, взаимодействует с Fas-положительными ЦТЛ и ЕК-клетками, индуцируя апоптоз последних. Этот механизм является одной из причин подавления противоопухолевого иммунитета. Вероятно, ЦТЛ активируются при распознавании вирусных антигенов на поверхности инфицированных клеток печени, и их элиминация осуществляется с помощью Fas/FasL взаимодействия.
Перспективы клинического использования знаний о Fas-системе заключаются в возможности блокирования индуцированной FasL элиминации здоровых клеток. Нейтрализующие моноклональные антитела против Fas (или FasL) и другие ингибиторы Fas-опосредуемого апоптоза могут найти терапевтическое применение при гепатитах, СПИДе и других заболеваниях, связанных с ЦТЛ-индуцированным повреждением тканей. Однако необходимо балансировать между двумя крайностями - деструкцией тканей, вызываемой mFasL, и воспалительными реакциями, причиной которых является повышенная концентрация рецептора sFasL. При трансплантации можно использовать FasL в качестве иммуносупрессивного агента. Перспективным направлением является противоопухолевая терапия. Повышенная продукция некоторыми типами опухолевых клеток sFas лежит в основе их резистентности к ЦТЛ- и ЕК-индуцированной Fas-зависимой элиминации. Выявление факторов, влияющих на механизмы альтернативного сплайсинга мРНК рецептора Fas, может обеспечить выбор препаратов, ингибирующих sFas и повышающих чувствительность опухолевых клеток к Fas-опосредуемому апоптозу.
Таким образом, Fas-система играет важную роль в регуляции гомеостаза и функционировании клеток ИС, и углублённое изучение апоптоза важно для познания патогенеза многих заболеваний. Физиологическое значение лигандов рецептора Fas проявляется не только в индукции апоптоза, но и в инициации регуляторных сигналов, активирующих пролиферацию и дифференцировку иммунокомпетентных клеток. Нарушения клеточного гомеостаза в ИС приводят к развитию различных патологических состояний. Новые подходы к управлению иммунопатологическими процессами путём влияния на Fas-систему могут способствовать созданию иммуномодулирующих препаратов, способных регулировать атипичный или восстанавливать дефектный физиологический апоптоз. Поэтому факторы, регулирующие активность Fas-системы, могут найти широкое клиническое применение, с учётом их ростостимулирующего и цитодифференцирующего потенциала.
X Международная студенческая научная конференция Студенческий научный форум - 2018

РОЛЬ АПОПТОЗА В СОЗРЕВАНИИ И ФУНКЦИОНИРОВАНИИ ИММУННОЙ СИСТЕМЫ
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Гибель клеток при метаморфозе, эндокринозависимой атрофии тканей и в процессе удаления стареющих, избыточных или аномальных клеток называется апоптозом. Это запрограммированная клеточная гибель - естественный процесс, который находится под контролем генетической регуляции. Одним из внеклеточных факторов, запускающих в клетке апоптоз, является Fas-лиганд (FasL). Белок Fas/АРО-1, также называемый CD95, относится к семейству рецепторов фактора некроза опухоли (TNF). Степень активации рецептора Fas различными лигандами зависит от микроокружения клеток. Активация каспаз - необходимый этап Fas-опосредованного апоптоза. В дендритных клетках активация рецепторов Fas вызывает их фенотипическое и функциональное созревание.
Основная часть
В функционировании иммунной системы апоптоз выполняет ряд характерных функций. Во-первых, вследствие апоптоза уничтожаются аутореактивные лимфоциты во время отрицательного отбора в первичных лимфоидных органах. Апоптозом гибнут также клетки, которые оказались не способными корректно перестроить гены рецепторов и пройти положительную селекцию. С помощью апоптоза контролируется пролиферация клеток в различных ветвях гематопоезу. Апоптоз предотвращает также неправильной активации наивных лимфоцитов. Такая гибель клеток наступает вследствие недостаточного поступления костимуляторних сигналов. Кроме того, апоптоз важный для элиминации активированных эффекторных клеток, уже выполнили свою функцию, т.е. апоптоз контролирует прекращения иммунных реакций. Система белков Fas и FasL играет важную роль крайней мере в трех видах физиологической гибели клеток, связанной с функционированием иммунной системы. Во-первых, это участие в подавлении активированных Т-клеток периферической крови в конце иммунного ответа, а также элиминация периферических аутореактивных В-клеток. С помощью Fas - FasL-системы происходит положительная селекция Т-лимфоцитов в тимусе в эмбриогенезе. Во-вторых, при участии системы белков Fas и FasL происходит уничтожение клеток, инфицированных вирусом, или опухолевых клеток цитотоксическими Т-лимфоцитами и натуральными киллерами. Клетки, погибших путем апоптоза, не вызывают воспаления и мгновенно фагоцитируются тканевыми макрофагами и другими фагоцитами. В-третьих, Fas - FasL-система обеспечивает защиту имунопривилейованих сайтов организма (глаза, нервной системы) от вредного эффекта воспалительных иммунных процессов. Известно, что клетки, которые экспрессируют FasL в глазу, нервной системе, плаценте, способны индуцировать апоптоз в иммунных клеток-эффекторов, предотвращая развитие нежелательных в этих органах и системах воспалительного процесса, который может привести к слепоте, нарушение функции нервной системы или отторжения плода. Показано, что клетки некоторых типов опухолей - меланомы, рака легких, астроцитомы, карциномы желудка и толстой кишки - также экспрессируют FasL. Очевидно, это позволяет опухолевым клеткам избегать иммунного контроля путем индуцирования апотозу в цитотоксических клеток-эффекторов, экспрессирующих Fas-рецептор. Апоптозом погибают также нейтрофилы в очаге воспаления. После этого остатки нейтрофилов фагоцитируются макрофагами. Известно еще по меньшей мере два аспекта функционирования лимфоцитов, непосредственно связанных с проявлениями апоптоза. Один из этих аспектов — реализация цитотоксической активности лимфоцитов. Клетки-мишени естественных киллеров и цитотоксических Т-лимфоцитов гибнут при морфологических и биохимических проявлениях апоптоза, хотя при этом примешиваются некоторые черты некротической гибели клеток. Эта двойственная природа гибели с преобладанием апоптоза может быть проанализирована на примере наиболее универсального механизма действия киллеров. Этот механизм состоит из формирования в мембране клетки-мишени пор (вследствие полимеризации перфорина) и поступления через эти поры сери-новых протеаз — гранзимов (главным образом гранзима В), которые включают механизм апоптоза. Среди других механизмов цитотоксического действия Т-лимфоцитов (но не естественных киллеров) могут быть названы Fas-опосредованный апоптоз (в клетках-мишенях увеличивается присутствие Fas-рецепторов, а цитотоксические Т-лимфоциты «нарабатывают» Fas-лиганд) и апоптоз, индуцируемый фактором некроза опухоли или лимфо-токсином через рецептор 1-го типа (TCRF1). Другая область функционирования иммунной системы, для которой оказалась важной реализация апоптоза, — защита «иммунологически привилегированных» зон в организме от эффекторных клеток иммунной системы. Недавно выяснилось, что по крайней мере две такие зоны — внутренние среды глаза и семенники — выстланы клетками, синтезирующими Fas-лиганд. В глазу это клетки эпителия, эндотелия, радужки, сетчатки, ресничных телец, в семенниках — эпителиальные, эндотелиальные и клетки Сертоли (сустентоциты). В результате эффекторные Т-лимфоциты, продуцирующие Fas-рецептор, неизбежно гибнут в процессе миграции через этот «барьер» вследствие взаимодействия указанного рецептора с Fas-лиган-дом барьерных клеток, приводящего к апоптозу этих агрессивных Т-лимфоцитов [Griffith T.S., 1997].
Таким образом, апоптоз является одним из ключевых процессов, определяющих формирование антигенспецифичес-кой составляющей иммунной системы и в значительной степени — реализацию ее эффекторных функций. Особенно важной оказывается роль апоптоза в обеспечении «неотвечаемости» лимфоцитов, т.е. отсутствия воздействия лимфоцитов на собственные компоненты организма, что достигается, с одной стороны, формированием аутотолерантности вследствие апоптоза аутореактивных клонов лимфоцитов, а с другой стороны — исключением некоторых областей организма из-под контроля иммунной системы с помощью «барьера», преодолевая который, активированные клетки подвергаются апоптозу.
Заключение
Апоптоз- программированная клеточная смерть-играет огромную роль в гомеостатическом контроле динамичного баланса между пролиферацией клеток и их элиминацией.Апоптоз индуцируется различными стимулами,включая сигналы с «рецепторов смерти» и нерецепторные сигналы. Апоптоз играет ключевую роль в развитии и дифференцировке клеток иммунной системы и в иммуннорегуляции
Как умирающие клетки успокаивают иммунитет
Наши клетки умирают постоянно, и это вполне естественно: они стареют, они изнашиваются, в конце концов, они часто становятся просто ненужными: например, во время эмбрионального развития множество клеток, выполнив свою работу, должны уступить место другим. При этом клетки умирают не вдруг, а по определённой программе, которая называется апоптоз и которую они сами в себе включают.
При апоптозе прекращается синтез почтит всех белков, кроме особой группы ферментов, называемых каспазами. Они расщепляют клеточные белки, одновременно в клетке расползаются на части органеллы, в том числе и ядро с фрагментированной ДНК, и всё заканчивается тем, что клетка распадается на небольшие кусочки, окружённые мембранами. Эти кусочки поглощают и переваривают иммунные клетки-макрофаги.
Особенность такого клеточного самоубийства в том, что умирающая клетка не раздражает иммунитет. Если бы всё произошло иначе, и клетка просто разорвалась бы, например, от механического напряжения, то иммунитет запустил бы сильное воспаление. При незапланированной смерти из клетки выходит множество молекул, которые в норме должны быть только у неё внутри и нигде больше - например, та же ДНК. Если иммунитет чувствует клеточную ДНК и ряд клеточных молекул вне клетки, он понимает, что что-то очень сильно не в порядке. (Впрочем, стоит уточнить, что и среди программ клеточного суицида есть одна под названием некроптоз, которая так разрушает клетку, чтобы простимулировать иммунную систему.)
При апоптозе же всё совсем не так - умирающие клетки подавляют воспаление и стимулируют ранозаживляющие процессы. Очевидно, апоптотические клетки как-то сигналят поедающим их макрофагам, что всё нормально и звать дополнительные иммунные вооружённые силы не нужно. Именно эти противовоспалительные сигналы от умирающих клеток попытались расшифровать исследователи из Виргинского университета. В статье в Nature они пишут, что клетки в апоптозе действительно выделяют определённые вещества, причём вещества эти оказываются одни и те же вне зависимости от типа умирающей клетки.
Молекулярные сигналы от апоптотических клеток влияют на активность генов в макрофагах. Авторы работы пишут о шести сигнальных молекулах, которые, чтобы нужным образом подействовать на иммунные клетки, должны действовать все вместе, то есть сразу все шесть. И если взять, к примеру, три молекулы-сигнала, то активность генов у макрофагов изменится, но не очень сильно.
Исследователи в своей статье подробно говорят только о трёх сигнальных молекулах - спермидине, гуанозинмонофосфате (ГМФ) и инозинмонофосфате (ИМФ). Спермидин относится к классу полиаминов и образуется в биохимических реакциях, связанных с превращениями аминокислот. Клетки, умирающие апоптозом, усиливают в себе синтез спермидина, который выходит наружу через специальный канал в мембране, образованный белком паннексином 1. Канал открывается ферментами каспазами - теми самыми, которые организуют в клетке апоптоз. То есть умирающая клетка одновременно синтезирует нужный сигнал и создаёт для него канал наружу. (Паннексин 1 выводит из клетки не только спермидин, но и другие апоптотические сигнальные молекулы.) При этом клетки не выпускают из себя мочевину, которая образуется в тех же реакциях, что и спермидин - мочевина как раз стимулирует воспаление, поэтому при апоптозе она никак не должна оказаться снаружи.
Спермидин, ГМФ и ИМФ связаны с множеством молекулярных процессов. ГМФ и ИМФ действуют на рецепторы, которые посылают сигналы целому ряду генов, в том числе и тех, которые связаны с иммунитетом. Известно также, что инозин, который можно получить из ИМФ, очень эффективно подавляет воспаление. Вводя спермидин, ГМФ и ИМФ мышам с артритом, исследователям удавалось ослабить симптомы болезни, которые опять же возникают из-за сильного воспаления; и точно так же с помощью тех же трёх молекул удавалось ослабить иммунное отторжение у мышей с пересаженным лёгким.
Как всё это работает у человека, ещё предстоит выяснить; всё-таки человеческие рецепторы отчасти отличаются от мышиных, и, например, на инозин реагируют во много раз слабее. Но, возможно, тот способ, с помощью которого умирающие клетки успокаивают иммунитет, можно будет в перспективе использовать в повседневной медицине - в тех случаях, когда нужно предотвратить слишком сильную иммунную реакцию.
Читайте также:
- Инфекционный мононуклеоз
- Пример раннего детского аутизма и слабоумия
- Особенности роста и гипертрофии миокарда новорожденных.
- Профилактические визиты к врачу для подростков
- Тест на нитратредуктазную активность бактерий. Хроматография при идентификации бактерий. Индикаторные бумажки для идентификации бактерий.
