Внутриутробное хирургическое лечение плода. Хирургическое устранение пороков развития
Добавил пользователь Cypher Обновлено: 22.01.2026
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, Республика Башкортостан, Уфа, Россия
ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, Уфа, Россия
Малоинвазивная хирургия плода: новые аспекты
Журнал: Проблемы репродукции. 2019;25(4): 21‑26
Концепция хирургии плода — выполнение инвазивной хирургической операции у плода в утробе матери возникла в результате быстрого прогресса в пренатальной диагностике в 60-х годах прошлого века. Искушение начинать лечение плода до появления необратимых изменений или даже его гибели привело к исследованиям на животных и прикладным исследованиям внутриутробного вмешательства. На раннем этапе основные правила, в том числе регистрации оперативных вмешательств у плода, устанавливались и осуществлялись Международным обществом терапии и хирургии плода [1]. Оперативное вмешательство у плода считалось приемлемым при следующих условиях: 1) аномалия плода установлена; 2) ее можно отличить от других состояний, не требующих вмешательства; 3) естественная история аномалии достаточно хорошо понятна, и ее течение без вмешательства у конкретного пациента является прогнозируемым; 4) аномалия, если ее не лечить, является смертельной.
Кроме того, любому вмешательству должны предшествовать подробные обсуждения с междисциплинарной группой, а тщательно продуманный механизм информированного согласия должен включать этические аспекты, касающиеся матери и плода. При всех этих ограничениях может быть оправдано лишь несколько показаний к операции, в том числе: двусторонняя непроходимость нижних мочевых путей, врожденная диафрагмальная грыжа и несколько редких заболеваний, таких как большие кистозные образования в легких и крестцово-копчиковая тератома. Несмотря на то что исследования на животных продемонстрировали возможность открытой операции на плоде, способствующей устранению или коррекции заболевания, клиническое применение оказалось более сложным. Осложнения открытой операции (прямой доступ к плоду с помощью лапаротомии и гистеротомии) связаны с риском нарушения здоровья матери и плода, повышением перинатальной смертности. Кроме того, необходимо учитывать сложности отбора пациентов [2].
Малоинвазивная хирургия плода
Появление лапароскопии и других малоинвазивных хирургических методов в начале 90-х годов прошлого века возродило идею вмешательства у плода. Фетоскопия появилась на несколько десятилетий ранее, но вытеснена гораздо менее инвазивной и более точной ультразвуковой техникой. С ростом рынка лапароскопии стали доступны лучшие, меньшие размерами эндоскопы и разработана техника эндоскопической хирургии плода [3—7]. Малоинвазивная хирургия плода «обещала» снижение травмы плода и, что важно, матери. Безусловно, оставление плода на месте снижает риск обезвоживания и гипотермии, связанных с открытой операцией на плоде. Прямая травма плода, однако, зависит от патологии и самой процедуры. Эндоскопическая хирургия плода оказалась менее травматичной для беременной матки и позволила избежать обширной хирургической травмы матери. Обязательное кесарево сечение после открытой операции на плоде было заменено реальной возможностью вагинального родоразрешения (более 50% при первых родах [2, 8] и 78% при последующих [8]). Другие потенциальные преимущества эндоскопической хирургии плода не всегда реализуются. Согласно информации Центра лечения плода при Калифорнийском университете в Сан-Франциско (США), недоношенность все еще усложняет эндоскопическую хирургию плода [2]. В этом исследовании показано, что средняя длительность послеоперационного пребывания в стационаре после эндоскопического хирургического лечения плода составила 7,9 дня, частота отслойки плаценты — 5,9%, риск отека легких — 25% (при открытой операции 11,9 дня, 8,9 и 27,8% соответственно).
Что нового в хирургии плода?
За последние два десятилетия появилось много разработок в хирургии плода — не все из них улучшения. Некоторые усовершенствования связаны с модернизацией малоинвазивной техники, технологий и методов, другие отложены из-за прогресса в постнатальной терапии. Тем не менее на основе нового понимании физиологии плода разработаны более совершенные виды внутриутробных вмешательств. Сегодня определено множество показаний к операциям у плода. 1-я группа состояний, поддающихся антенатальному вмешательству, может быть квалифицирована как собственно «хирургическая операция на плодах». Это крайне редкие состояния, которые вызывают интересные анонсы при успешном лечении, но являются скорее отражением междисциплинарного творчества, чем основой программы лечения плода. Примеры включают резекцию матки при гигантской крестцово-копчиковой тератоме внутриутробно, внутриутробные вмешательства при атрезии трахеи и синдроме околоплодных вод. Все эти состояния встречаются редко и еще реже поддаются вмешательству.
Врожденные пороки развития легочных дыхательных путей, ранее известные как врожденные кистозные аденоматозные поражения, когда-то были нередкими показаниями к открытой операции. Следует отметить, что подавляющее большинство этих состояний регрессирует в течение III триместра беременности, и это серьезно ограничивает действительное число поражений при резекции матки [9]. Синдром обратной артериальной перфузии (синдром акардии), ассоциированный с близнецами, был первым показанием к лечению современными методами эндоскопической хирургии. С тех пор двухпортовое перевязывание пуповины близнеца заменено радиочастотной абляцией или биполярной коагуляцией с гораздо лучшими общими результатами (85% выживаемости близнеца). В большинстве центров терапии плода наблюдали только несколько таких состояний, но в недавнем совместном отчете из 15 североамериканских центров терапии плода содержится информация примерно о 80 таких случаях [10].
Синдром фето-фетальной трансфузии (СФФТ)
СФФТ является тяжелым осложнением монохориальной беременности, которое возникает из-за дисбаланса кровотока через межпозвоночные плацентарные анастомозы сосудов. Клинические эффекты, обычно не наблюдаемые до II триместра беременности, связаны с несоответствием внутрисосудистого объема. У близнеца-донора развивается гиповолемия, приводящая к олигурии и олигогидрамниону из-за снижения почечной перфузии, а у близнеца-реципиента — последствия гиперволемии, в том числе полиурия и полигидрамнион [11]. Оба близнеца подвержены риску развития заболеваний: донор — от гипоксически-ишемических травм и ограничения роста, а реципиент — от сердечной декомпенсации и отечности. Кроме того, эти дети часто страдают от долговременных осложнений — дефектов развития нервной системы [12].
Степень тяжести заболевания СФФТ определяется с помощью клинических и ультразвуковых критериев, разработанных R. Quintero и соавт. [13]. Если не лечить, СФФТ тяжелой степени является смертельным, перинатальная смертность составляет от 80 до 90% [11, 14, 15]. Первоначальные вмешательства для коррекции СФФТ сосредоточены на удалении избытка амниотической жидкости, окружающей близнеца-реципиента, с целью предотвращения преждевременных родов, вторичных к полигидрамниону, и улучшения кровообращения плода путем снижения давления на хорионическую пластинку [15, 16]. В 1990 г. предложена альтернативная процедура: использовали фетоскопический лазер для коагуляции поверхностных кровеносных сосудов, которые пересекают разделяющую мембрану плаценты, отделяя два кровообращения плода и разрушая сосуды, вызывающие дискордантную трансфузию между близнецами [17]. В настоящее время плацентарная лазерная абляция является предпочтительным лечением СФФТ между 16-й и 26-й неделями беременности. Процедура выполняется через единственный участок доступа к матке с использованием фетоскопа и тонкого лазерного волокна. Превосходство лазерной абляции по сравнению с амниоредукцией впервые продемонстрировано в 2004 г., когда консорциум «Eurofoetus» провел многоцентровое рандомизированное контролируемое исследование. Сравнивали результаты селективной лазерной абляции и серийной амниоредукции при СФФТ тяжелой степени между 16-й и 26-й неделями беременности [14]. После лазерной абляции отмечена значительно более высокая выживаемость младенцев по сравнению с амниоредукцией, по крайней мере, от 1 до 6 мес (76% по сравнению с 51%). Более того, у близнецов после лазерной абляции с меньшей вероятностью появлялись неврологические осложнения в возрасте 6 мес (31% по сравнению с 52%). Эти данные объединены в обзоре 2014 г. с описанием многоцентрового рандомизированного контролируемого исследования, проведенного в США в 2007 г. при поддержке Национального института здоровья детей и развития человека [18]. В этом обзоре не выявлено различий в общей смертности между группами лазерной абляции и амниоредукции (относительный риск 0,87), но в нем сообщалось о более высокой доле младенцев, живущих в возрасте 6 лет без неврологических отклонений после лазерной абляции (относительный риск 1,57). Авторы обзора пришли к выводу, что эндоскопическая лазерная коагуляция сосудов анастомоза должна и впредь учитываться при лечении всех стадий СФФТ для улучшения результатов развития нервной системы. Хотя и продолжаются некоторые споры о пользе вмешательства на I стадии СФФТ, недавний многоцентровой ретроспективный анализ продемонстрировал улучшение результатов при дородовом вмешательстве (амниоредукция или лазер) по сравнению с наблюдением [19].
Опухоли у плода
К счастью, опухоли у плода встречаются редко — 4—8 случаев на 100 000 рождений [20]. Хотя широкое использование антенатальной ультрасонографии привело к повышению выявления опухолей у плода, большинство из них лучше всего лечить после родов. Однако некоторые опухоли могут нарушать развитие плода или, вызывая развитие отечности, приводить к его гибели. Наиболее распространенной опухолью в этой категории является ККТ, частота которой составляет 1 случай на 35 000—40 000 родов [21]. ККТ образуются из аномального роста плюрипотентных клеток в узле Хенсена и поэтому содержат ткани эндодермального, мезодермального и эктодермального происхождения с твердым и кистозным компонентами. Они обычно проявляются в виде массы смешанной эхогенности, простирающейся от крестца или растущей из крестца в таз. Поскольку ККТ часто бывают сосудистыми, содержат артериовенозные шунты и склонны к быстрому росту, они могут привести к компрометации плода путем сосудистой «кражи» и к развитию сердечной недостаточности. Опухолевая ткань также может быть хрупкой, с самопроизвольным кровотечением, возникающим, когда увеличивающаяся опухоль сжимается у стенки матки во время родов. Плоды с ККТ могут иметь дополнительные аномалии, чаще всего возникающие вследствие деформации ККТ, которая может повлиять на прогноз для здоровья и жизни плода. Они включают ректальный стеноз или атрезию, гидрокаликоз, обструкцию мочевых путей и связанные с этим почечные аномалии, легочную гипоплазию, вызванную олигогидрамнионом, и вывих бедра или косолапость [22]. В нескольких исследованиях предпринята попытка описать течение нелеченых ККТ и выявить факторы, указывающие на плохой прогноз. Ранние описания случаев ККТ, вероятно, отрицательно искажены тем фактом, что многие пренатальные случаи были обнаружены во время обследования на наличие гидрамниона или других осложнений беременности. Более поздние описания, включающие случаи, выявленные в ходе рутинного целевого ультразвукового исследования, позволяют предположить, что большинство плодов со случайно выявленными ККТ доживают до родов без вмешательства и подвергаются хирургическому лечению в неонатальном периоде [23]. Высокососудистые опухоли повышают риск пренатальной смерти в результате сердечной недостаточности или кровотечения, что делает гидропс самым сильным предиктором неблагоприятного исхода [24]. Описаны и другие предикторы неблагоприятного исхода, а именно: отношение объема опухоли к массе плода 0,12 или более; преобладание твердых элементов опухоли над кистозными; быстрый рост опухоли; нарушение сердечной функции плода или кардиомегалия; развитие осложнений, таких как гидрамнион или зеркальный синдром (признаки преэклампсии у матери, которые являются «зеркальным» отображением гидропических изменений плода) [23, 25, 26].
Данные литературы по легочным эмбриопатиям, таким как врожденный кистозно-аденоматозный порок развития или легочная секвестрация, указывают на их сходство с ККТ. Большинство из легочных эмбриопатий хорошо переносится плодом и успешно лечится после рождения, тогда как другие могут привести к антенатальной сердечной декомпенсации и отекам. Как и в случае с ККТ, прогноз для плодов с гидропсом в этой ситуации неблагоприятный. Грядущая декомпенсация сердца в раннем гестационном периоде является показанием для фетальной хирургии, обычно в виде открытого доступа с целью резекции патологически измененных тканей или установки торако-амниотического шунта. Обзор результатов лечения плодов с врожденной кистозно-аденоматозной мальформацией или секвестрацией легкого из одного из крупнейших в мире центров лечения плода подтверждает, что для плодов без гидропса выживаемость без антенатального хирургического вмешательства является превосходной (98% выживаемости для 125 случаев врожденных кистозных аденоматозных мальформаций; 100% выживаемости для 23 случаев легочной секвестрации) [27].
Шунтирование
Чрескожное размещение катетеров в дренажных полостях тела под ультразвуковым контролем можно охарактеризовать как хирургические операции на плодах, даже если этот подход ближе к другим методам чрескожного введения, таким как кордоцентез и отбор проб ворсин хориона. Наиболее распространенными являются везикоамниотические и плевроамниотические шунты. Двусторонняя или нижняя непроходимость мочевых путей (ННМП) приводит к развитию синдрома Поттера — ангидрамниону, контрактурам конечностей и тяжелой легочной гипоплазии. Данное состояние несовместимо с жизнью. Наиболее распространенной причиной ННМП у плодов мужского пола являются задние уретральные клапаны. Экспериментальные исследования показали, что везикоамниотическое шунтирование может восстановить объем амниотической жидкости и предотвратить легочную гипоплазию [28]. Везикостомия с помощью открытой хирургии плода отменена, поскольку она была чрезмерно инвазивной, и с тех пор описаны различные формы чрескожных методов шунтирования мочевого пузыря [29]. Устанавливаемый шунт представляет собой катетер с двойным пигтейлом, позволяющим фиксировать его между мочевым пузырем и брюшной стенкой.
Технические аспекты везикоамниотического шунтирования предполагают долгосрочную эффективность самого устройства, исключающую его окклюзию и миграцию. Наиболее сложной проблемой при лечении ННМП у плода является определение показаний к вмешательству и правильный отбор пациентов: шунтирование бесполезно без адекватной экскреции почек, а почечную функцию плода трудно точно оценить [30]. Кроме того, результаты бывают неоднозначными, даже когда учтены все критерии вмешательства. Хотя у этих пациентов можно предотвратить легочную гипоплазию и неонатальную смерть, долговременный прогноз функционирования почек и мочевого пузыря часто бывает плохим [31]. Возможная польза от везикоамниотического шунтирования у отдельных пациентов в настоящее время исследуется с помощью испытания чрескожной обструкции нижних мочевых путей [29].
Выводы
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Хирургия плода
Научно-практический подход «плод как пациент» имеет бесспорный приоритет в мировой и отечественной медицине. Развитие ультразвуковой и инвазивной пренатальной диагностики, а также эндоскопической техники обеспечило возможности для развития нового направления в перинатологии — фетальной хирургии, или хирургии плода.
Существует большая группа аномалий развития плода, плаценты и пуповины, вызывающих значительные или необратимые нарушения, которые затрудняют хирургическую коррекцию после рождения ребенка. В таких случаях оптимальным становится внутриутробное вмешательство.
Трепетные истории
Родоначальником современной фетальной хирургии принято считать американца Альберта Лилея. Именно он в 1963 году впервые, под контролем рентгеновского исследования, успешно осуществил внутриутробное переливание донорской крови плоду, страдающему анемией. Но как отдельное направление медицины хирургия плода была признана мировым научным сообществом лишь после сенсационной операции, проведенной профессором Калифорнийского университета в Сан-Франциско Майклом Харрисоном. 26 апреля 1981 года возглавляемая им бригада хирургов, урологов и гинекологов внутриутробно открытым доступом восстановила проходимость мочеиспускательного канала плоду на 36 неделе беременности. Плод выжил, ребенок родился без почечной недостаточности неоперабельной в постнатальном периоде.
Но, пожалуй, самая резонансная в мировых СМИ фетальная операция на открытой матке случилась в 1999 году. У еще нерожденного 21‑недельного Самуэля, как потом назвали ныне здорового 15‑летнего подростка, была диагностирована spina bifida — редкий дефект позвоночных дужек, приводящий к развитию спинномозговых грыж. Без устранения дефекта плод был обречен на паралич нижних конечностей. Американский хирург Джозеф Брюнер успешно провел внутриутробную операцию по выделению корешков спинного мозга из грыжевого мешка, погружению их в спинномозговой канал и вентрикуло-перитонеальному шунтированию. 2 декабря 1999 года Самуэль родился доношенным и здоровым, а сделанный в операционной снимок, на котором палец хирурга хватают высунувшиеся из раны крохотные пальчики плода, разошелся по всему миру.На данный момент в мире проведено более пяти тысяч подобных операций.
Критерии и показания
Международный союз фетальной медицины и хирургии, к которому в 1993 году присоединилась Российская Федерация, разработал критерии для внутриутробных операций:
- подтвержденный диагноз и однозначно негативный прогноз для плода;
- отсутствие эффективных методов лечения данного заболевания после рождения;
- наличие экспериментальных данных об эффективности и безопасности планируемого фетального оперативного вмешательства как для матери, так и для ребенка, как во время внутриутробного периода, так и после родоразрешения.
Оптимальный срок для проведения фетальных операций — 18-30 недель гестации.
В фетальной хирургии используются три основные технологии: кордоцентез, фетоскопия и операции на открытой матке.Кордоцентез — методика, ранее использовавшаяся лишь для исследования пуповинной крови, сейчас применяется и для введения с помощью сверхтонкой иглы лекарственных и гормональных веществ непосредственно в пуповину плода.
Фетоскопия
При фетоскопии через 1,5-2‑сантиметровые разрезы в брюшную полость и матку беременной женщины вводят эндоскоп и с его помощью осуществляют манипуляции: гемотрансфузию, введение баллонов, расширяющих артериальный или пищеводный просвет у плода, хирургическое обеспечение бронхолегочной проходимости у плода, коагуляцию сосудов и т. д. Диаметр фетоскопа составляет 1,2-2 мм. Место введения троакаров определяют под контролем эхографии. Каждый инструмент имеет размер 3-5 мм. Число вводимых троакаров может достигать 5-6 штук. Для фетоскопических лазерных процедур используют фетоскоп с лазерным проводником. Манипуляции проводят под местной или местно-регионарной анестезией. Процедуру завершают амниодренированием до достижения нормального количества околоплодных вод.
Обычно пациентки выписываются из стационара в течение 1-2 дней после операции, но продолжают находиться под наблюдением с целью своевременного выявления осложнений. Наиболее частое осложнение (6-9 %) в течение месяца после вмешательства — это разрыв плодных оболочек.
Эндоскопическое антенатальное вмешательство менее инвазивное, чем открытое, что позволяет уменьшить частоту преждевременных родов, предотвратить охлаждение и дегидратацию плода. Кроме общехирургических осложнений, таких как интраоперационное инфицирование, возрастание угрозы выкидыша — при фетоскопических операциях возможны и специфические осложнения. Описаны случаи фетоскопического рассечения амниотических перетяжек, которые могут приводить к прогрессирующей ампутации частей конечностей плода. Но данные случаи единичны и зависят от исправностиаппаратуры и профессионализма хирурга.
Открытый доступ
Операции на открытой матке — по сути, аналогичны кесареву сечению, но кожный и маточный разрезы имеют, как правило, в два раза меньшие размеры. Так, разрез на матке составляет обычно 5-7 см, а разрез передней брюшной стенки — 10-12 см. Через разрез, не пересекая пуповины, извлекают в рану плод, придерживаясь правила «как можно больше внутри матки, как можно меньше снаружи», и проводят необходимое вмешательство. Операция осуществляется под общим обезболиванием или под эпидуральной анестезией. Плоду дополнительно могут вводить микродозы анальгетиков и анестетиков. На края раны на матке накладывают клеммы для предупреждения кровотечения. Во время операции проводится всесторонний мониторинг состояния не только матери, но и плода. После вмешательства осуществляется массивный токолиз — торможение сократительной активности матки с помощью введения токолитиков. При отсутствии осложнений пациентки выписываются из стационара через 5-7 суток. Вследствие возрастающей вероятности маточных разрывов, перенесшим подобную операцию женщинам родоразрешение рекомендовано проводить путем кесарева сечения. Нередко открытый доступ позволяет осуществить ряд манипуляций, невозможных при эндоскопическом доступе: удалить разросшуюся опухоль у плода, ушить объемное грыжевое выпячивание, прооперировать угрожающий жизни ребенка порок сердца.
На потоке
Наиболее частое показание к открытым хирургическим вмешательствам — это миеломенингоцеле — спинномозговая грыжа, содержащая в грыжевом мешке, наряду с цереброспинальной жидкостью, участок спинного мозга вместе с нервными корешками.За прошедшие два десятилетия риски гибели плода при фетальных хирургических вмешательствах значительно снизились. Так, если еще в середине 90‑х годов до 50 % новорожденных не выживало, то сейчас частота гибели плода не превышает 25 %.Столь высокий процент смертности объясняется частично тем, что в ряде случаев, при операциях по поводу фето-фетального трансфузионного синдрома, врачам приходится, по согласованию с матерью, принимать решение о «редукции» — умерщвлении нежизнеспособного плода, для того чтобы сохранить жизнь перспективному близнецу. На данный шаг приходится идти, когда изоляция сросшихся плацентами плодов методом лазерной коагуляции и формирование у них автономных кровеносных систем, с целью предоставления им возможности самостоятельного развития в утробе матери — технически неосуществимы.
Одной из самых разработанных и успешных в фетальной хирургии является методика коррекции spina bifida (рис. 2). Наилучшие результаты достигаются при операции на сроках 17-27 недель беременности. Полностью выздоравливают 36 % подвергшихся хирургическому вмешательству пациентов. Еще 42 % детей могут самостоятельно передвигаться без помощи костылей. Для сравнения: доля способных к самостоятельному передвижению детей, у которых коррекция осуществлялась после рождения, — составляет лишь 21 %.
Широко используется фетальная хирургия при диафрагмальных грыжах плода. Весь цикл оперативного лечения включает три этапа: на сроке от 17 до 30 недель отверстие в диафрагме плода закрывают специальным баллоном, который удаляется в первые дни после рождения ребенка, а в возрасте от 1 до 3 месяцев диафрагмальный дефект младенцу ушивают открытым
доступом. Именно первый — фетальный — операционный этап позволил повысить эффективность лечения до 85 %.
Точки роста
В последние годы значительных успехов достигла фетальная онкологическая хирургия. Риск развития злокачественного новообразования у плода в утробе матери составляет 1:10 000, но данные случаи практически всегда имеют для ребенка летальный прогноз. Ряд опухолей, например пояснично-крестцовые тератомы, сегодня успешно удаляются в утробе матери. Стал широко известен случай успешного удаления онкохирургами клиники Джексона во Флориде оральной тератомы у четырехмесячного плода. А специалисты больницы Королевского Колледжа в Лондоне полностью удалили опухоль легкого у плода на сроке 20 недель.
Одной из проблемных патологий остается гидроцефалия плода. Послеоперационная смертность здесь составляет 18 %. Остаточные нарушения психофизического развития отмечаются у 66 % фетально прооперированных детей. Но учитывая, что без операции летальность при данной патологии составляет 100 % — прогресс очевиден.
Сегодня открытая фетальная хирургия относительно редко применяется в Европе, за исключением операций на плаценте. Крупнейшие европейские центры расположены в Каталонии, Лондоне, Париже. И наоборот, американские центры относительно редко применяют фетоскопию, отдавая предпочтение минимальным по объему лапаротомиям.
Одной из главных проблем при проведении эндоскопических операций является плохая видимость вследствие недостаточной прозрачности околоплодных вод. В начале 2000‑х годов немецкие врачи из Медицинского университета Бонна нашли частичное решение данной проблемы: они закачивают в околоплодную жидкость углекислый газ, безвредный для плода. Таким образом, отпадает необходимость в сложной процедуре замены околоплодных вод. На сегодняшний день ряд клиник по всему миру используют данную методику.
Фетальная хирургия в России
В СССР первую внутриутробную операцию провели в 1989 году в НИИ акушерства и гинекологии им. Д. О. Отта Санкт-Петербурга. Это была коррекция обструктивной уропатии наложением пиелоамнионального шунта. И по сей день в данном медучреждении подобные фетоскопические операции проводятся для лечения обструкции нижних отделов мочевыводящих путей. Также при кистозных поражениях легких плода, гидротораксе применяют внутриматочную эвакуацию жидкости и методику плевроамнионального шунтирования.
Сегодня фетоскопические операции проводятся в ряде клиник Российской Федерации.К сожалению, несмотря на прогресс последних лет, российские успехи в фетальной хирургии на фоне развитых европейских стран и США пока выглядят скромно. Давно назрела необходимость в координации действий всех подразделений здравоохранения, которые занимаются исследованиями плода.
Из-за отсутствия единых методических подходов к диагностике врожденных и наследственных заболеваний во многих регионах страны регистрация пороков развития ведется неадекватно, что в свою очередь приводит к путанице в показателях. Поэтому для развития фетальной хирургии в РФ ряд организационных проблем должен быть решен на самом высоком уровне системы государственного здравоохранения.
IX Международная студенческая научная конференция Студенческий научный форум - 2017

Атрезия пищевода — тяжёлый порок развития, при котором верхний отрезок пищевода заканчивается слепо. Нижний отрезок органа чаще всего сообщается с трахеей. Популярная частота — 0,3:1000. Сочетание мужского и женского пола — 1:1. В 5 % случаев атрезия пищевода встречается при хромосомных болезнях (трисомию хромосомы 21, 18, 13-15).
Развитие порока связано с нарушениями в ранних стадиях эмбриогенеза. Известно, что трахея и пищевод возникают из одного зачатка — головного конца передней кишки. На самых ранних стадиях трахея широко сообщается с пищеводом. Их разделение происходит на 4-5 неделе эмбриогенеза.
Обнаруживается при первом же кормлении ребенка или питье жидкости. Пища или жидкость сразу выделяется обратно при полной атрезии, а при трахеопищеводном свище, попадая вдыхательные пути, вызывает поперхивание и тяжелый приступ кашля с нарушением дыхания и появлением цианоза. Используют зондирование (катетеризацию) пищевода резиновым катетером, который вводится через нос. При атрезии катетер не удается провести глубже 10-12 см от края десен, так как он упирается в слепой отрезок атрезированного пищевода. При наличии пищеводно-трахеального свища катетер не удается провести в желудок. Производят контрастное исследование пищевода обязательно в вертикальном положении исследуемого с целью предупреждения аспирации контрастного вещества.
Атрезия пищевода очень опасна для жизни новорождённого, так как её наличие провоцирует развитие аспирационной пневмонии (инфекционно-токсическое повреждение органов дыхания), возникающей из-за попадания слюны, слизи, пищи в дыхательные пути. Также дети резко теряют вес, поскольку не могут питаться.
Атрезия пищевода проявляется буквально с первых часов жизни новорождённого малыша. На её наличие указывают: обильные пенистые выделения изо рта; выделение слюны из носа; приступообразный кашель; отчётливо слышные хрипы в лёгких; одышка; посинение кожи при каждом кормлении, то есть так называемый синдром Мендельсона, возникающий вследствие попадания слизи в дыхательные пути; срыгивание молока в неизменном виде; метеоризм.
Врожденный гипертрофический пилоростеноз-аномалия развития пилорического (выходного) отдела желудка, приводящая к нарушению его проходимости и затруднению эвакуации пищи. Врожденный пилоростеноз встречается с популяционной частотой 1 случай на 300 новорожденных; в 4 раза чаще с данным пороком рождаются мальчики.
В настоящее время врожденный пилоростеноз рассматривается как многофакторная патология, в происхождении которой могут участвовать семейно-наследственные факторы и неблагоприятные воздействия на развивающийся плод. При изучении генетического аспекта врожденного пилоростеноза были описаны случаи рецессивного, сцепленного с полом и аутосомно-доминантного наследования. Промоторами развития врожденного пилоростеноза могут выступать неблагоприятные экзогенные факторы: внутриутробные инфекции (краснуха, цитомегалия, герпес).
Симптомы: В первые дни жизни ребенка отмечаются срыгивания и нечастая рвота. Отчетливая клиника врожденного пилоростеноза проявляется к концу второй-началу третьей недели жизни ребенка. Типичным признаком стеноза привратникового отдела желудка служит рвота «фонтаном» практически после каждого кормления. При этом объем рвотных масс значительно превышает количество высосанного за последнее кормление молока. Характер рвотных масс - застойный, в виде створоженного молока с кислым запахом. Важным дифференциально-диагностическим признаком врожденного пилоростеноза служит отсутствие в рвотных массах примеси желчи. На фоне постоянной рвоты у ребенка с врожденным пилоростенозом быстро прогрессирует обезвоживание, урежается частота мочеиспусканий, появляются запоры. Стул ребенка имеет темно-зеленый цвет из-за преобладания желчи; моча становится концентрированной, оставляет на пеленках окрашенные разводы. Вследствие нарушений водно-солевого баланса развиваются тяжелые метаболические и электролитные нарушения (гиповолемия, алкалоз), дефицитная анемия, сгущение крови. Осложнением врожденного пилоростеноза может служить язвенное поражение привратника с перфорацией язвы и желудочно-кишечным кровотечением. Синдром рвоты может приводить к асфиксии, евстахеиту, отиту, аспирационной пневмонии.
Диагностика: Диагноз подтверждается с помощью ультразвукового, эндоскопического, рентгенологического обследования желудка. При осмотре ребенка с врожденным пилоростенозом определяется вздутие в эпигастральной области, видимая перистальтика желудка (симптом «песочных часов»). В большинстве случаев удается пальпировать гипертрофированный привратник, имеющий плотную консистенцию и сливообразную форму. При проведении рентгенографии желудка с бариевой взвесью обращает на себя внимание сегментирующая перистальтика, задержка контраста в желудке и отсутствие его эвакуации в 12-перстную кишку, в боковой проекции - симптом антропилорического «клюва» (сужение пилорического канала).
Наличие у ребенка врожденного пилоростеноза требует активной хирургической тактики. Проведение бужирования привратникового канала приводит к его кратковременному раскрытию и повторному стенозированию.
Большой опыт оперативного лечения врожденного пилоростеноза позволяет добиваться хороших отдаленных результатов и полного выздоровления детей. Без своевременного оперативного лечения ребенок с врожденным пилоростенозом может погибнуть от метаболических нарушений, дистрофии, присоединения гнойно-септических осложнений (пневмонии, сепсиса).
Атрезия заднего прохода и прямой кишки - аномалия развития нижних отделов кишечника, характеризующаяся недоразвитием прямой кишки и отсутствием анального отверстия. Частота рождения детей с атрезией прямой кишки составляет 1:5000; при этом мальчики страдают данным пороком в 2 раза чаще.
Формирование атрезии прямой кишки связано с нарушением эмбрионального развития, а именно - с неразделением клоаки на урогенитальный синус и прямую кишку на 7-й неделе эмбриогенеза.
Атрезии полные (без свища, около 10% случаев) и атрезии со свищами (около 90% случаев).
Варианты полной атрезии представлены:
атрезией заднего прохода и прямой кишки
атрезией прямой кишки
атрезией заднего прохода
прикрытым заднепроходным отверстием
Свищевые формы атрезии прямой кишки могут включать следующие виды:
со свищами, открывающимися в мочевыводящие органы (уретру, мочевой пузырь)
со свищами, открывающимися в половые органы (преддверие влагалища, влагалище, матку)
со свищами, открывающимися на промежность
Симптомы: неотхождение мекония и газов, вздутие живота, рвота сначала желудочным содержимым, затем - желчью и каловыми массами, выраженный токсикоз и эксикоз. Иногда анальное отверстие затянуто тонкой перепонкой кожи. При атрезии прямой кишки со свищами в мочевую систему также развивается кишечная непроходимость, поскольку отверстия свищей обычно узкие и плохо проходимые для каловых масс. Свищи в мочевую систему обычно встречаются у мальчиков. При ректовезикальных и ректоуретральных свищах моча имеет примесь мекония, а из уретры при натуживании выделяются пузырьки газа. Попадание кишечного содержимого в мочевые пути нередко приводит к осложнениям - циститу, пиелонефриту и уросепсису, вызывающему гибель ребенка. Клиническими признаками атрезии прямой кишки со свищом во влагалище служит выделение мекония (кала) и газов через половую щель. Острая кишечная непроходимость нехарактерна, однако постоянное выделение кишечного содержимого через влагалище создает условия для развития инфекции мочевыводящих путей, вульвита у девочек.
В большинстве случаев атрезия заднепроходного отверстия и прямой кишки обнаруживается во время первого осмотра новорожденного неонатологом. Реже (при сформированном анальном отверстие, но атрезированной прямой кишке) порок распознается в первые сутки жизни новорожденного по отсутствию отхождения мекония и развитию клиники острой кишечной непроходимости.
Обследование ребенка с подозрением на атрезию прямой кишки должно быть проведено в кратчайшие сроки, поскольку без оперативного вмешательства больные погибают на 4-6 сутки после рождения. В ряду самых первых исследований с целью определяя уровня атрезии ребенку должны быть выполнены инвертография по Вангенстину, УЗИ промежности, тонкоигольная пункция промежности. При нормально сформированном заднепроходном отверстии диагноз атрезии прямой кишки подтверждается с помощью зондирования прямой кишки, пальцевого исследования, ректоскопии, проктографии.
Все формы атрезии прямой кишки подлежат хирургической коррекции. В отдаленном периоде у 30-40% пациентов отмечаются хорошие функциональные результаты, у остальных могут отмечаться недержание кала, стенозы анального отверстия и прямой кишки.
Омфалоцеле- вид врождённого дефекта передней брюшной стенки, при котором петли кишечника, печень и, иногда, другие органы выходят за пределы брюшной полости в грыжевом мешке. Частота порока омфалоцеле составляет 1-2 на 10 000 живых новорождённых, особых различий по полу нет.
Омфалоцеле плода возникает в результате нарушения процесса возвращения кишечника в брюшную полость после того, как между 6-й и 10-й неделями гестации происходит его миграция в пупочный канатик. При омфалоцеле плода имеется центральный дефект брюшной стенки в области пупочного кольца, через который эвентрированы органы брюшной полости, покрытые мембраной, состоящей из висцеральной брюшины, вартонова студня и амниона. Пупочный канатик также входит в состав стенки грыжевого мешка. Содержимым грыжевого мешка обычно являются петли тонкой и толстой кишки, желудок и, приблизительно в 50% случаев, печень. Мышцы брюшной стенки нормально развиты. В 10—18% случаев отмечается разрыв грыжевого мешка, который может произойти внутриутробно, во время родов или после рождения.В некоторых случаях, предположительно, омфалоцеле может являться следствием генетического расстройства (синдром Эдвардса, синдром Патау).
Пренатальный диагноз ставится на основании УЗИ. При значительных размерах омфалоцеле плода рекомендуют плановое кесарево сечение во избежание повреждения печени и разрыва мешка, которые могут произойти при самостоятельных родах.
Консервативное лечение : Подобную тактику можно использовать при огромных грыжах пупочного канатика или их сочетании с множественными тяжёлыми пороками развития. Наиболее часто для этих целей применяют такие дубящие растворы, как повидон-йод, мербромин, 5% раствор калия перманганата. Грыжевой мешок за пуповинный остаток фиксируют над больным в вертикальном положении, оболочки грыжи несколько раз в сутки обрабатывают одним из перечисленных растворов, добиваясь образования плотной корки, под которой постепенно формируется рубец, образуя большую вентральную грыжу. Однако этот метод имеет множество серьёзных недостатков (инфицирование оболочек, их разрыв, длительный период заживления, выраженный спаечный процесс и др.), поэтому его следует использовать лишь в экстраординарных случаях.
Хирургическое лечение: Хирургическое лечение может быть радикальным (послойное ушивание всех слоев брюшной стенки после погружения органов в брюшную полость) или этапным. Второй вариант предусматривает постепенное формирование передней брюшной стенки с использованием на промежуточных этапах ауто- или аллопластических материалов.
Радикальное вмешательство - операция выбора, выполняемая в тех случаях, когда висцеро-абдоминальная диспропорция (соотношение между объёмом грыжевого образования и ёмкостью брюшной полости) выражена умеренно, и послойное ушивание передней брюшной стенки не вызывает значительного повышения внутрибрюшного давления. Соответственно радикальную операцию обычно выполняют при омфалоцеле малых и средних размеров, реже - при больших омфалоцеле.
Наибольшие трудности возникают при лечении омфалоцеле больших размеров со значительной степенью висцеро-абдомннальной диспропорции, когда радикальная операция невозможна из-за резкого повышения внутрибрюшного давления. В таких случаях приходится применять различные виды этапного хирургического лечения. Все пациенты с омфалоцеле, не имеющие летальных пороков развития других органов и систем, выживают.
Желудочно-кишечные пороки - это структурные отклонения, которые могут произойти в любом месте вдоль желудочно-кишечного тракта, который состоит из пищевода, желудка, тонкого и толстого кишечника, прямой кишки и ануса. Неполное или ненормальное развитие любого из этих органов может вызвать непроходимость. Частота этих нарушений варьируются в диапазоне от 1 на 32000 родившихся до 1 на 10000 новорожденных. Генетика играет определенную роль во всех этих пороках, но степень ее влияния не известна. Раннее выявление и лечение этих пороков имеет большое значение, так как при отсутствии лечения они могут привести к серьезным проблемам со здоровьем и даже к смерти. Как правило, для устранения этих пороков применяется хирургический метод.
Операция у еще не родившегося ребенка: это возможно?

В связи с широким развитием методов пренатальной диагностики и выявлением многих заболеваний и пороков развития плода перед учеными и врачами появились новые вопросы и задачи: можно ли вылечить ребёнка еще до его рождения и каким образом это сделать? Так стала развиваться новая дисциплина, которая называется фетальная хирургия (от слова «fetus» — плод). Пациентом при этом является ребёнок, еще не родившийся на свет. В этой статье мы рассмотрим некоторые вопросы, касающиеся фетальной хирургии и расскажем вам много интересного.
В каком случае оправдано внутриутробное хирургическое вмешательство?
Даже операции у новорожденных или грудных детей очень сложны и несут под собой определенные риски. Это риск большой кровопотери, осложнений анестезии, анатомические трудности. Что уж говорить об операциях, проводимых у малыша, который находится в утробе матери! Неужели нельзя подождать, пока он появится на свет и прооперировать его в привычных условиях?
В ряде случаев нельзя. Более того, выжидательная тактика чревата развитием осложнений и необратимых патологических процессов, которые будут угрожать жизни ребёнка. Цель внутриутробно проводимой операции: убрать дефект, который мешает нормальному анатомическому развития органа, и обеспечить правильное становление его функций.
Немного из истории: чудеса спасения детей

Как давно стала развиваться фетальная хирургия? Считается, что первым врачом, прооперировавшим малыша в утробе матери, был Альберт Лилей. Это произошло в 1963 году. Он перелил донорскую кровь плоду, страдающему анемией. Но лишь спустя 18 лет фетальная хирургия была признана отдельной дисциплиной после проведения уникальной операции Майклом Харрисоном в Калифорнии. Он вместе с бригадой специалистов провел сложную операцию плоду 36 недель по восстановлению проходимости мочеиспускательного канала. Это спасло жизнь малышу, который родился без почечной недостаточности.
В 1999 году была проведена операция крохотному американцу Самуэлю, которому шла все лишь 22 неделя внутриутробного развития. У него был дефект дужек позвонков, который привел бы к развитию спинномозговой грыжи и параличу нижних конечностей. Хирург Дзозеф Брюнер спас мальчика, проведя ему внутриутробною коррекцию порока. Во время операции крохотная ручка Самуэля высунулась из раны и ухватила своего спасителя за палец. Уникальная фотография этого трогательного момента облетела весь мир. Самуэль родился абсолютно здоровым. С тех пор проведены тысячи внутриутробных операций, а их методика все совершенствуется.
При каких пороках развития и болезнях оперируют внутриутробно?
На настоящий момент разработаны внутриутробные вмешательства при следующих болезнях:
- Некоторые пороки развития легких (например, врожденная кистозная аденоматозная мальформация);
- Тератома крестцово-копчиковой области и другие онкологические новообразования;
- Обструктивные пороки мочевого пузыря и мочеиспускательного канала, которые препятствуют оттоку мочи у плода;
- Пороки развития нервной трубки (например, спинномозговая грыжа);
- Некоторые врожденные пороки сердца: тяжелый стеноз аорты, синдром гипоплазии (недоразвития) левых отделов сердца с нормальной или недоразвитой перегородкой между предсердиями, атрезия (полное заращение) легочной артерии, тяжелый стеноз клапанов легочной артерии и другие пороки.
- Врожденная диафрагмальная грыжа;
- Фето-фетальная трансфузия и другие патологические состояния.
Кто принимает решение о необходимом внутриутробном хирургическом вмешательстве?
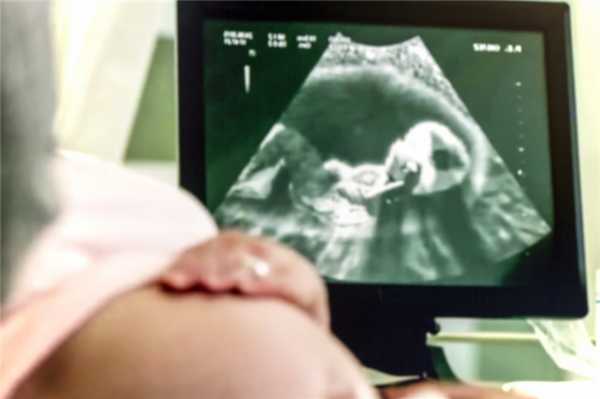
Выявление порока развития у еще не родившегося ребёнка безусловно вызывает стресс у его родителей. Появляется масса вопросов относительно его жизни и здоровья, методов его лечения и возможных исходов. Собирается перинатальный консилиум, на котором будут обсуждаться эти и другие важные вопросы.
При выявлении пороков, несовместимых с жизнью, женщину информируют о возможности прерывания беременности. Если же хирургическая коррекция порока возможна, то обсуждаются все нюансы оперативного вмешательства. Во многих случаях порок развития можно скорректировать после рождения ребёнка. Однако при ряде патологий рекомендуется это делать гораздо раньше того момента, как малыш появится на свет.
В пользу внутриутробного вмешательства склоняются при соблюдении всех нижеперечисленных условий:
- Реальная возможность устранить дефект внутриутробно;
- Наличие преимуществ именно столь раннего вмешательства;
- Угроза гибели малыша в случае отказа от внутриутробной операции;
- Отсутствие большой опасности внутриутробного вмешательства для матери;
- Доказанная эффективность и относительная безопасность планируемого метода лечения.
Для внутриутробной коррекции порока женщину направляют в специализированный центр, который проводит подобные операции. Конечно, никто не может заранее дать гарантию благоприятного исхода. Все-таки внутриутробное вмешательство может приводить к развитию преждевременной родовой деятельности, отслойке плаценты и другим осложнениям. Хоть это случается и не часто, риск возникновения данных осложнений все равно есть.
Какие хирургические доступы используются при операциях у плода?

Выбор хирургического доступа зависит от вида порока или иной проблемы у плода и от цели, которую преследуют врачи на операции. На настоящий момент проводятся внутриутробные вмешательства тремя разными способами:
- Путем кордоцентеза: введение непосредственно в пуповину плода необходимых лекарств, гормонов, компонентов крови.
- Путем фетоскопии: операция эндоскопическими инструментами через небольшие разрезы брюшной полости и матки.
- Открытым доступом: через разрез на матке к ране подводится плод и проводится необходимое вмешательство.
Чаще всего операции у плодов проводятся в сроке от 18 до 30 недель.
Что такое лечение EXIT?
В данном случае EXIT расшифровывается так: ex utero intrapartum treatment. Так называется лечение плода вне матки в процессе родов, а именно в процессе операции кесарева сечения.
Как проводится операция? Сначала через разрез на матке плод извлекается частично. Это нужно для того, чтобы сохранить кровоснабжение малыша через пуповину. Таким образом открывается возможность для оперативного вмешательства в области шеи при «выключенном» дыхании. После удаления врожденного образования, препятствующего дыханию, и освобождения дыхательных путей плод извлекается из матки полностью, и операция кесарева сечения заканчивается обычным путем.
Развитие фетальной хирургии в нашей стране
Первая операция у плода в Советском Союзе была проведена в 1989 году в Санкт-Петербурге в НИИ акушерства и гинекологии им. Д. О. Отта. Это была операция по поводу нарушения оттока мочи из-за порока развития мочевыводящей системы. Плоду был наложен шунт, который выводил мочу из почечной лоханки в амниотический пузырь (пиелоамниональный шунт). Подобные операции здесь проводятся до сих пор и стали более совершенны.
Несмотря на то что российские успехи в области фетальной хирургии на данный момент отстают от успехов США и ряда европейских стран, эта область медицины у нас все равно развивается. Внутриутробная коррекция пороков и некоторых патологических состояний проводится в Санкт-Петербурге, Москве, Томске, Екатеринбурге, Челябинске, Новосибирске, Иркутске. Столь малое количество специализированных центров объясняется сложностью операций, высокой стоимостью специализированного оборудования, необходимостью обучения большого числа квалифицированных кадров. Однако фетальная хирургия является прогрессивным направлением в современной медицине в борьбе за жизнь каждого крохотного человека.

Данный тест рассчитан ТОЛЬКО ДЛЯ ЖЕНЩИН. Как вы чувствуете себя физически? Давайте проверим это тестом, предложенным португальскими специалистами. Он поможет Вам определить уровень Вашего самочувствия.
Что такое пороки развития плода и почему они возникают?

Врожденный порок развития у ребёнка - это последствия осложнений вынашивания, которые занимают значительное место в причинах инвалидности и даже смертности детей. По данным исследований, каждый год в период младенчества врожденные пороки становятся причиной летального исхода у более чем 300 тысяч малышей. Это большое горе для всей семьи, и в первую очередь - для мамы. MedAboutMe рассказывает о причинах врожденных пороков развития, их ранней диагностике и профилактике.
Почему возникают пороки развития плода во время беременности?

Выделяют эндогенные и экзогенные факторы возникновения пороков.
К эндогенным, или внутренним относят возникновение спонтанных, случайных мутаций или их наследование, заболевания эндокринной системы. Увеличивает риск появления таких изменений в генах и хромосомах близкородственный брак, возраст матери или отца (возраст отца влияет, по данным ученых, серьезнее).
Экзогенные, или внешние факторы - все, что влияет на мать и ребёнка извне. К ним относят:
- Физическое воздействие: травмы живота во время беременности, радиационное излучение;
- Химическое: влияние алкоголя, наркотических средств (по последним данным, даже незначительное употребление смесей для курения с «легким» наркотическим эффектом на сверхранних сроках изменяет геном эмбриона), некоторых лекарственных препаратов, частый или продолжительный контакт с пестицидами, соединениями свинца и т. д., неблагоприятная экологическая обстановка - близость больших производств, мусорного полигона и т. д.;
- Биологическое воздействие - это инфекции и болезни, аутоиммунные патологии в организме матери. Особенно опасна краснуха у матери, поэтому вакцинация от нее это часть профилактики.
- Также может влиять социально-экономические состояние матери с дефицитным рационом питания или нехваткой витаминов, минералов в организме, тяжелыми условиями жизни, труда, пренебрежение или недоступность врачебной помощи.
Такие факторы способны влиять на процессы экспрессии генов, размножение, миграцию и рост клеточных структур, их своевременное обновление и гибель. Как результат, развиваются болезни и пороки развития. Так, при замедленном делении клеток формируется недоразвитие ткани или органа вплоть до полного его отсутствия, при несвоевременной миграции - атипичное, неправильное расположение органов, даже частей тела.
Важно помнить, что во многих случаях причину развития порока плода определить не удается, и винить мать или отца в этом нецелесообразно и бессмысленно. Далеко не все возможно предотвратить и предсказать. То, что повлияло в одной ситуации, не оставило следа в другой - и все, что можно сделать, это заниматься доступной профилактикой и вовремя посещать врача.
Какие бывают пороки развития?
Среди аномалий и пороков развития выделяют разные характеры нарушений:
- При отсутствии органа говорят об аплазии;
- При его недоразвитии - о гипоплазии;
- При увеличенном размере или массе органа - гиперплазии;
- При тканях в нетипичном для них месте - о гетеротопии;
- При расположении целого органа в нетипичном месте - об эктопии;
- Если нарушена дифференциация клеток, то это гетероплазия;
- Увеличенную длину тела называют макростомией;
- Кроме этого может быть удвоение части органа (например, двойная матка), его стеноз, несформированность естественного канала (отсутствие мочеиспускательного например), неразделение органов и тканей, незаращение эмбриональных щелей - например, жаберных, которые есть у всех эмбрионов млекопитающих, а затем они зарастают.
Порок развития может возникать в любом органе и системе:
- В нервной - самые серьезные - это аплазия головного мозга, спина бифида, микроцефалия;
- Сердечно-сосудистая: различные врожденные пороки сердца, дефекты перегородок, отсутствие желудочка, тетрада Фалло (сочетанная аномалия);
- Костей, мышц, связок, конечностей - недоразвитие руки, ноги, части тела;
- Дыхательных органов;
- Пищеварительной, мочевыводящей, репродуктивной системы;
- Пороки лица - недоразвитие или отсутствие ушных раковин и внутренней структуры уха, глаза, расщепление неба и т. д.
Что можно определить еще до рождения?
Часть пороков можно выявить еще до рождения: при помощи ультразвукового исследования специалист видит пороки сердца, нарушения формирования лицевых и черепных структур, конечностей, части внутренних органов. Однако патологии функций органов по УЗИ не определить - нельзя выявить незрячесть, ограничения слуха и т. д.
Анализы крови во время скринингов позволяют определить вероятность хромосомных нарушений, для которых характерны определенные аномалии развития, например, при синдроме Дауна часты врожденные пороки сердца.
Кто в группе риска?

Основной и легко предупреждаемый фактор риска пороков развития плода - нехватка витамина В9 (фолиевая кислота). Она крайне необходима для деления клеток, правильного формирования тканей и структур. Самый важный период - ранний срок беременности, этап формирования нервной трубки зародыша и всей нервной системы, включая головной и спинной мозг. Фолиевая кислота нужна не только для развития плода: она - часть профилактики недоношенности и разрыва плодного пузыря.

В сутки необходимо принимать 400-600 мкг фолиевой кислоты, с учетом суточной потребности в 800 мкг. К счастью, часть этого витамина мы получаем с пищей - в основном им богаты листовые салаты, орехи. А вот печенью, в которой его тоже много, увлекаться не следует - избыток витамина А может навредить эмбриону.
Однако необходимо начать прием еще на этапе планирования беременности. По данным исследования французских ученых, препараты нужны еще за 6 месяцев до зачатия, причем не только будущей матери, но и отцу.
Кроме дефицита фолиевой кислоты выделяют и другие факторы риска:
- Возраст женщины более 35 лет, мужчины - от 40.
- Наличие в анамнезе выкидышей, замерших, внематочных беременностей.
- Наличие детей или близких родственников с наследственными хромосомными патологиями, врожденными пороками;
- Вегетарианская диета женщины;
- Радиационное облучение одного или обоих будущих родителей;
- Прием тератогенных препаратов.
При выявлении у пары подобных факторов риска показана медико-генетическая консультация с генетической диагностикой для снижения риска возникновения пороков у ребёнка.
Как и когда проводят диагностику пороков плода?
Первый этап определения и профилактики возможных рисков проводят еще на стадии подготовки к зачатию с изучением семейной истории, наличия вредных факторов, подготовки рекомендаций.
Второй этап - скрининговые исследования с УЗИ и анализами крови. Исследования могут проводиться при помощи обычного двухмерного УЗ-изображения, 3D, 4D (в движении), с допплерометрией. По итогам скринингов определяется наличие грубых пороков, видимых на УЗИ, а также рассчитывается риск хромосомных аномалий по результатам двойного теста в первом триместре (анализа крови на b-ХГЧ и плазменного протеина А). При необходимости во втором триместре добавляют тройной и четверной тест.
Если по итогам скрининга риск высок, показана биопсия ворсин хориона, плацентоцентез, кордоцентез, амниоцентез - процедуры инвазивной диагностики количества и качества хромосом плода. В последнее время разработан также неинвазивный метод определения по выделению клеток ребёнка, циркулирующих в крови матери, однако он пока недостаточно широко доступен.
Результаты скрининговых тестов интерпретирует только специалист - не надо пугаться цифр. Комплексная оценка требует полной расшифровки с учетом анамнеза и иных факторов риска.
Следующий этап диагностики проводится уже после рождения ребёнка с обследованием органов слуха, зрения функций сердца, нервной и иных систем.
Как лечат пороки развития?
При установлении диагноза созывается перинатальный консилиум с участием акушера-гинеколога, специалиста УЗИ-диагностики, генетика, неонатолога, психолога и врача, специализирующегося на данном пороке - например, кардиохирурга, ортопеда и т. д с целью определения прогноза, возможной коррекции патологии.
Решение о продолжении беременности остается за самими родителями, врачи оказывают информационную поддержку и помощь.
Стоит знать, что сегодня многие пороки, которые ранее считались несовместимыми с жизнью ребёнка, успешно исправляются. Так, например, проводятся операции на сердце, позвоночнике ребёнка еще до рождения. Консилиум также разрабатывает план наблюдения, ведения родов, а после появления малыша на свет он наблюдается у врачей, проходит реабилитационную и лечебную программу. О том, как проходит терапия детей с врожденными пороками сердца, мы рассказываем в отдельной статье.
Читайте также:
- Туберкулез легких
- Примеры экзофитного роста ретинобластомы
- Эпидемиология дизентерии. Распрастраненность дизентерии. Эпидемиология шигелл. Механизмы и пути передачи дизентерии.
- Наружные кишечные свищи. Причины, диагностика
- Уход после артроскопической операции по поводу кальцифицирующего тендинита плечевого сустава
