Воротный механизм калиевых каналов - гейтинг
Добавил пользователь Alex Обновлено: 28.01.2026
Важнейшую роль в процессах реполяризации сердца играют калиевые каналы, генерирующие различные токи. Замедление реполяризации посредством блокирования калиевых каналов приводит к увеличению продолжительности рефрактерных периодов возбудимых тканей сердца и является основным механизмом действия антиаритмических препаратов III класса. При этом излишнее неравномерное замедление реполяризации может способствовать электрической неоднородности тканей и развитию опасных для жизни аритмий (полиморфной желудочковой тахикардии типа torsade de pointes). В обзоре представлены сведения о структуре, функции и свойствах калиевых каналов клеток проводящей системы сердца и сократительного миокарда. Освещены их физиологическая роль и участие в патологических процессах, в том числе при врожденных синдромах, связанных с возникновением опасных для жизни аритмий. Представлены дальнейшие перспективы развития данного направления.
Ритмичную работу сердца обеспечивает взаимосвязь последовательных процессов сокращения и расслабления, которые напрямую сопряжены с генерацией и распространением возбуждения и последующей рефрактерностью возбудимых тканей. Распространение потенциала действия (ПД) по проводящей системе и сократительному миокарду вызывает последовательное сокращение всех отделов сердца [1].
ПД имеет фазы — деполяризации и реполяризации. В фазу деполяризации мембранный потенциал достигает максимального значения, а во время фаз реполяризации происходит его постепенный возврат к уровню потенциала покоя. Именно в это время реализуется электромеханическое сопряжение, необходимое для сокращения миокарда, вот почему совокупная длительность фаз реполяризации должна быть достаточно продолжительной.
Важнейшую роль в процессах реполяризации и поддержании потенциала покоя на постоянном уровне играют токи ионов калия. Удлинение реполяризации увеличивает рефрактерность возбудимой ткани. На этом основано антиаритмическое действие препаратов III класса (блокаторов калиевых каналов). В то же время неравномерное замедление реполяризации может способствовать электрической неоднородности тканей и развитию опасных для жизни аритмий (полиморфной желудочковой тахикардии типа torsade de pointes — TdP) [2, 3].
В зависимости от способа активации и количества трансмембранных доменов, калиевые каналы подразделяют следующим образом:
- потенциалзависимые калиевые каналы (voltage gated — Kv);
- калиевые каналы аномального входящего выпрямления (inward rectifier Kir);
- механочувствительные двупоровые калиевые каналы (2 pore domain — K2P);
- активируемые кальцием калиевые каналы (calcium-activated — KCa; в данном обзоре не рассмотрены, поскольку функционально-активные KCa не представлены на поверхности кардиомиоцитов человека и не участвуют в процессах деполяризации и реполяризации) [4].
Потенциалзависимые калиевые каналы (Kv)
Kv — самое многочисленное семейство калиевых каналов. Все Kv состоят из четырех α-субъединиц. Тетрамеры могут быть образованы четырьмя одинаковыми α-субъединицами (гомотетрамеры) или состоять из четырех разных α-субъединиц (гетеротетрамеры). На работу тетрамеров α-субъединиц существенное влияние могут оказывать вспомогательные β-, γи D-субъединицы, расположенные в цитоплазме клеток и изменяющие кинетику канала. Некоторые белки способны повышать экспрессию калиевых каналов на мембранах и изменять функции их α-субъединиц. Точное определение канала, обеспечивающего тот или иной ионный ток в кардиомиоцитах, всегда крайне затруднено [5].
В зависимости от своих временны'х параметров и вольтажных характеристик Kv могут быть разделены на 2 большие группы.
- Каналы, генерирующие кратковременный выходящий ток (transient outward — Ito), регистрируемый в самом начале реполяризации.
- Каналы, генерирующие токи замедленного выпрямления (IK).
В зависимости от времени нарастания и продолжительности выделяют очень быстрые (ultra rapid — IKur), быстрые (rapid — IKr) и медленные (slow — IKs) токи замедленного выпрямления. Калиевые токи замедленного выпрямления присутствуют в течение всех фаз реполяризации, наибольший их вклад приходится на более поздние ее этапы [6].
Калиевые каналы, генерирующие кратковременный выходящий ток (Ito). Ito регистрируется в самом начале реполяризации (фаза 1 ПД) в течение непродолжительного времени. Он оказывает существенное влияние на ток ионов кальция (ICa,L) и, соответственно, на электромеханическое сопряжение и сократимость миокарда, а также на калиевые токи замедленного выпрямления. В результате сложных взаимодействий между ионными токами изменения Ito могут непредсказуемо влиять на продолжительность ПД и определять предрасположенность к возникновению аритмий [7].
При детальном исследовании биофизических характеристик тока Ito было отмечено, что он состоит из двух компонентов, различающихся по скорости восстановления соответствующих им ионных каналов, — быстрого (fast — Ito,f) и медленного (slow — Ito,s). Эти токи тканеспецифичны. Ito,f в миокарде желудочков обнаруживают преимущественно в субэпикардиальных отделах, он соответствует фазе начальной быстрой реполяризации и определяет характерную форму кривой ПД (спайк и плато — spike and dome). В правом желудочке ток Ito,f выражен сильнее, чем в левом [8].
Каналы, генерирующие ток Ito, являются гомотетрамерами. В сердце человека в образовании каналов Ito,s участвуют α-субъединицы Kv1.4, а каналы Ito,f формируют α-субъединицы Kv4.2 и Kv4.3 [9].
Экспрессию каналов Ito и их активность регулируют добавочные субъединицы, к которым относят β-субъединицы, KChIP (Kv channel interacting proteins — белок, взаимодействующий с потенциалзависимыми калиевыми каналами), фриквенин (frequenin), KChAP (Kv channel associated protein — белок, связанный с потенциалзависимыми калиевыми каналами), а также вспомогательные субъединицы MinK (Minimum K+) и MiRP (MinK related peptides — пептиды, подобные MinK) [10].
Калиевый канал, активируемый кальцием - Calcium-activated potassium channel
Калиевые каналы, активируемые кальцием калиевые каналы, управляемые кальцием, [1] или которые структурно или филогенетически связаны с каналами, управляемыми кальцием. Впервые они были обнаружены в 1958 году Гардосом, который увидел, что уровни кальция внутри клетки могут влиять на проницаемость калия через клеточную мембрану. Затем в 1970 году Мич был первым, кто заметил, что внутриклеточный кальций может запускать калиевые токи. У человека они делятся на три подтипа: каналы с большой проводимостью или BK, которые имеют очень высокую проводимость от 100 до 300 пСм, промежуточную проводимость или IK-каналы с промежуточной проводимостью от 25 до 100 пСм и малую проводимость или SK-каналы с небольшой проводимостью от 2 до 25 пс. [2]
Это семейство ионных каналов, по большей части, активируется внутриклеточным Ca 2+ и содержит 8 членов в геноме человека. Однако некоторые из этих каналов (KCa4 и КCa5 каналов) вместо этого реагируют на другие внутриклеточные лиганды, такие как Na + , Cl − , и pH. Кроме того, несколько членов семейства являются как лигандами, так и Напряжение активирован, что еще больше усложняет описание этого семейства. KCa субъединицы канала α имеют шесть или семь трансмембранный сегменты, похожие на KV каналы но иногда с дополнительной N-концевой трансмембранной спиралью. Субъединицы α образуют гомо- и гетеротетрамерные комплексы. Кальций-связывающий домен может содержаться в последовательности субъединицы α, как в KCa1, или может происходить через дополнительный связывающий кальций белок, такой как кальмодулин.
Содержание
Структура
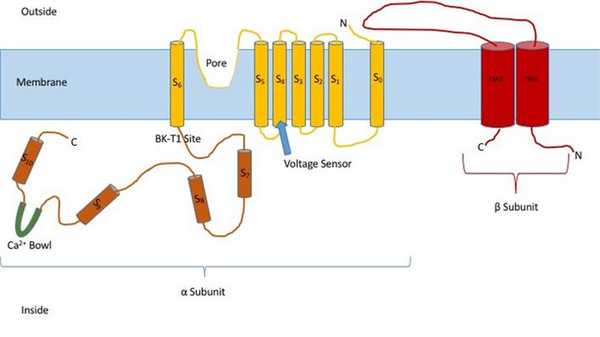
Знание структуры этих каналов может дать представление об их функции и механизме стробирования. Они состоят из двух разных субъединиц: альфа и бета. Альфа-субъединица представляет собой тетрамер, который образует поры, датчик напряжения и область, чувствительную к кальцию. Эта субъединица канала состоит из семи трансмембранных единиц и большой внутриклеточной области. Датчик напряжения выполнен трансмембранной областью S4, имеющей несколько Аргинин остатки, которые действуют так, чтобы «ощущать» изменения заряда и перемещаться таким же образом, как и другие калиевые каналы, управляемые напряжением. Когда они двигаются в ответ на изменения напряжения, они открывают и закрывают ворота. Линкер между областями S5 и S6 служит для образования пор канала. Внутри клетки стоит обратить внимание на чашу из кальция. Считается, что эта чаша является местом связывания кальция. [3]
Считается, что бета-субъединица канала является регуляторной субъединицей канала. Существует четыре различных типа бета-субъединицы: 1, 2, 3 и 4. Бета 2 и 3 являются ингибирующими, а бета 1 и 4 - возбуждающими или заставляют канал быть более открытым, чем закрытым. Возбуждающие бета-субъединицы влияют на альфа-субъединицы таким образом, что канал редко инактивируется. [4]
Классификация и описание гомологий
Человек KCa каналы
Ниже приведен список из 8 известных кальций-активируемых калиевых каналов человека, сгруппированных в соответствии с гомологией последовательностей трансмембранных гидрофобных ядер: [5]
Канал ВК
Хотя это не подразумевается в названии, но подразумевается структурой, эти каналы также могут быть активированы напряжением. Считается, что различные способы активации в этих каналах независимы друг от друга. Эта особенность канала позволяет им участвовать во многих различных физиологических функциях. Физиологические эффекты BK-каналов широко изучались с использованием нокаут-мышей. При этом наблюдались изменения в кровеносных сосудах мышей. У животных без ВК-каналов наблюдалось повышение среднего артериального давления и тонуса сосудов. Эти данные показывают, что каналы BK участвуют в расслаблении гладкомышечных клеток. В любой мышечной клетке повышенный уровень внутриклеточного кальция вызывает сокращение. В гладкомышечных клетках повышенный уровень внутриклеточного кальция вызывает открытие каналов ВК, которые, в свою очередь, позволяют ионам калия выходить из клетки. Это вызывает дальнейшую гиперполяризацию и закрытие потенциалозависимых кальциевых каналов, после чего может произойти релаксация. Мыши с нокаутом также испытали интенционный тремор, меньшую длину шага и меньшую скорость плавания. Все это симптомы атаксия, указывая на то, что каналы BK очень важны в мозжечке. [6]
Подтипы BK каналов
ИК канал
Каналы промежуточной проводимости кажутся наименее изученными из всех каналов. Считается, что структурно они очень похожи на каналы BK с основными различиями в проводимости и методах модуляции. Известно, что каналы IK модулируются кальмодулином, тогда как каналы BK - нет.
Каналы ИК показали сильную связь с кальцификацией в сосудистой сети, поскольку ингибирование канала вызывает уменьшение кальцификации сосудов. Чрезмерная экспрессия этих каналов совершенно по-разному влияет на организм. Исследования показали, что это лечение вызывает разрастание гладкомышечных клеток сосудов. Это открытие вызвало дальнейшие исследования этих каналов, и исследователи обнаружили, что каналы IK регулируют клеточный цикл в раковых клетках, В- и Т-лимфоцитах, а также стволовых клетках. Эти открытия обещают будущие методы лечения IK-каналов.
SK канал
Кальций с небольшой проводимостью активирует калиевые каналы, которые сильно отличаются от своих родственников с большей проводимостью. Основное и самое интересное отличие каналов SK в том, что они нечувствительны к напряжению. Эти каналы могут быть открыты только при повышенном уровне внутриклеточного кальция. Эта особенность каналов SK предполагает, что они имеют немного другую структуру, чем каналы BK и IK.
Как и другие калиевые каналы, они участвуют в гиперполяризации клеток после потенциала действия. Способность этих каналов активировать кальций позволяет им участвовать в вазорегуляции, слуховой настройке волосковых клеток, а также в циркадном ритме. Исследователи пытались выяснить, какие каналы ответственны за реполяризацию и постгиперполяризацию потенциалов действия. Они сделали это путем фиксации напряжения на ячейках, обработки их различными блокаторами каналов BK и SK, а затем стимулирования ячейки для создания тока. Исследователи обнаружили, что переполяризация клеток происходит из-за каналов BK и что часть постгиперполяризации происходит из-за тока через каналы SK. Они также обнаружили, что при блокировании каналов SK ток во время постгиперполяризации все еще имеет место. Был сделан вывод, что существует другой неизвестный тип калиевого канала, допускающий эти токи. [7]
Понятно, что в МАИ задействованы каналы СК. Непонятно, как именно это происходит. Есть три разных идеи, как это сделать. 1) Простая диффузия кальция объясняет медленную кинетику этих токов, 2) Медленная кинетика возникает из-за других каналов с медленной активацией, или 3) Кальций просто активирует систему вторичных мессенджеров для активации каналов SK. Было показано, что простая диффузия является маловероятным механизмом, поскольку ток чувствителен к температуре, а диффузионный механизм не будет чувствительным к температуре. Это также маловероятно, потому что с концентрацией кальция изменяется только амплитуда тока, а не кинетика активации канала.
Подтипы SK каналов
Другие подсемейства
- (Slack, Slo2.2, KCNT1 ) (Slick, Slo2.1, KCNT2 ) (Slo3, KCNU1 )
Прокариотический КCa каналы
Номер прокариотический KCa каналы описаны как структурно, так и функционально. Все они управляются кальцием или другими лигандами и являются гомолог к человеку KCa каналы, в частности KCa1.1 стробирования кольцо. Эти структуры служили шаблонами для лигандного стробирования.
Калиевый канал in silico

Новость
изображение одного из бактериальных K+-каналов: Tim Nugent
Автор
Редакторы
Несмотря на то, что за несколько десятилетий существования метода моделирования молекулярной динамики (МД) сущность подхода практически не поменялась, совершенствование алгоритмов и взрывное развитие компьютерных мощностей позволяет достигать все новых рубежей. Американские исследователи провели моделирование МД потенциал-чувствительного калиевого канала, в результате чего удалось в деталях проследить процесс активации / инактивации этого белка, «рассмотрев» подробности, ранее известные лишь гипотетически.
В основе работы возбудимых тканей — а это не только нервы, но и мышцы, и железы, — лежат ионные каналы, встроенные в плазматическую мембрану клетки и способные в ответ на определенные воздействия открываться и, наоборот, закрываться, пропуская определенные ионы или блокируя их проход. Живые клетки всегда имеют трансмембранный (ТМ) электростатический потенциал [1], лежащий в основе массы жизненно-важных процессов — от синтеза АТФ и рецепции до проведения нервного импульса. «За открытия, касающиеся ионных механизмов, участвующих в возбуждении и торможении <. >нервной клетки», британские физиологи Алан Ходжкин и Андре Хаксли получили в 1963 году Нобелевскую премию по физиологии и медицине. Однако молекулярные механизмы открытой ими потенциал-зависимой регуляции проницаемости мембраны для ионов оставались покрытыми мраком до 1980-х, когда появились современные подходы к изучению мембранных белков, а именно — ионных каналов.
Потенциал действия в возбудимой клетке начинается с открывания Na + -каналов, реагирующих на деполяризацию — уменьшение ТМ-потенциала, равного в покоящейся клетке примерно −70 мВ (цитоплазматическая сторона мембраны заряжена отрицательно по отношению к внеклеточной). Возникающий в связи с входящим в клетку «натриевым током» скачок потенциала открывает K + -каналы, и ионы калия устремляются изнутри клетки наружу. Позже нарушенный баланс K + и Na + будет восстановлен за счет действия Na + /K + -насоса, но главное уже произошло — потенциал действия «побежал» по мембране возбудимой клетки.
И Na + -, и K + -каналы здесь — потенциал-чувствительные, то есть они открываются и закрываются, реагируя на электрическое поле, причем в покое (когда потенциал ≈−70 мВ) они закрыты, а открываются они при деполяризации, когда ТМ-напряжение исчезает. Удивительная способность чувствовать такую «не биологическую» характеристику, как разность потенциалов, у всех потенциал-чувствительных каналов (и натриевых, и калиевых, и кальциевых) определяется наличием потенциал-чувствительного домена (ПЧД), четвертый ТМ-сегмент (S4) которого несет большой положительный заряд, а значит, может служить сенсором потенциала. Такие ионные каналы образуются из четырех субъединиц, в каждой из которой есть поровый домен (ПД) и ПЧД, «закрученные» вокруг общей оси, подобно лепесткам диафрагмы .
Подробнее строение потенциал-чувствительного канала мы уже разбирали в статье «О чем не знал Гальвани: пространственная структура натриевого канала» [2]
Структурная биология уже более 15 лет назад расшифровала строение K + -канала: сначала «обычного», потом и потенциал-чувствительного. (На самом деле, у человека более 40 типов разных K + -каналов, так что разнообразие не ограничивается двумя названными типами ;-) Однако особенность приготовления образцов для рентгеноструктурного анализа или спектроскопии ядерного магнитного резонанса (основных методов определения строения биомолекул) такова, что в эксперименте невозможно сохранить ТМ-потенциал, и все структуры каналов из-за этого получаются «открытыми» (то есть, активированными). До сих пор неизвестно строение неактивного (закрытого) канала, а значит и подробности цикла активации / инактивации неизвестны тоже.
Выход из сложившегося положения предлагает группа американских биофизиков во главе с Дэвидом Шоу (David Shaw), заслужившим себе репутацию на мировом финансовом рынке, а потом неожиданно «переквалифицировавшимся» в компьютерную молекулярную биологию и уже потрясшим мир преодолением «миллисекундного барьера» [3] в моделировании молекулярной динамики биомолекул [4].
На этот раз ученые не ставили задачи смоделировать процесс сворачивания белка (фолдинг); вместо этого они решили исследовать работу потенциал-чувствительного K + -канала в ответ на приложение внешней разности потенциалов: как он открывается, закрывается и проводит ионы [5]. Фактически, исследователи используют созданный ими специализированный суперкомпьютер для МД «Anton» в качестве микроскопа: без особенных хитростей запустив МД, наблюдают за тем, что произойдет. Подобную работу ни за что бы не опубликовали в одном из самых известных журналов — Science, — если бы не то обстоятельство, что длительность рассчитанных траекторий (сотни микросекунд) на порядки превосходит то, что можно посчитать на «обычных» суперкомпьютерах для довольно сложной системы, содержащей тетрамерный ионный канал, мембрану, воду и ионы. (Обычно для таких систем больше 1-10 мкс посчитать не удается.) Ну и конечно, рецензентов работы не мог не подкупить тот факт, что полученная в результате моделирования картина в целом согласуется с уже известным механизмом активации / инактивации канала, но показывает его в невиданных ранее подробностях.
В работе было проведено более двух десятков расчетов МД структуры K + -канала («химера Kv2,1/Kv1,2»), помещенной в липидный бислой в ячейке с водой с растворенным в ней KCl (0,5 М). Часть траекторий была получена в «деполяризованном» (V > 0 мВ), а часть — в «гиперполяризованном» (V < 0 мВ) состоянии. В условиях гиперполяризации мембраны канал из первоначально «открытого» состояния переходил в «закрытую» форму, не способную пропускать ионы K + и воду (рис. 1а). Наиболее сильные изменения в структуре канала происходили, как и ожидалось, в области потенциал-чувствительного домена: вольт-сенсорная α-спираль S4, в открытом состоянии «выдвинутая» наружу (во внеклеточную область), при появлении напряжения «ввинчивалась» в ПЧД, что сопровождается переносом заряженных групп (остатков аргинина и лизина) «вниз», с образованием временных солевых мостиков с противоположно заряженными группировками сегментов S1 и S2 ПЧД (рис. 1б). Такой механизм активации / инактивации предполагали и ранее, на основании многочисленных биохимических и биофизических экспериментов. Однако в таких подробностях ранее проследить за процессом не было никакой возможности (видео 1).
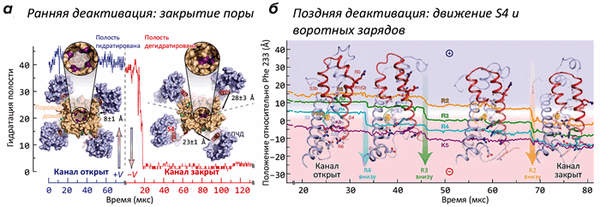
Рисунок 1. Движения потенциал-чувствительного домена (ПЧД) при активации K + -канала. а — Вид модели канала с внутриклеточной стороны в активированном (+V) и покоящемся (−V) состояниях. Канал представляет собой тетрамер: находящийся в центре поровый домен окружен четырьмя ПЧД. Геометрическое закрывание поры (показано на увеличенных врезках) подтверждается кривой гидратации, показывающей количество молекул воды, находящихся в «вестибюле» канала. При «включении» потенциала (через ≈20 мкс) растворитель и ионы K + покидают канал, и пора «захлопывается» под действием гидрофобного коллапса. Интересно, что в открытом канале ПЧД «прижаты» к поре, в то время как в закрытом — расположены более свободно. б — Постепенное «вдвигание» вольт-сенсора S4 и находящихся в нем «воротных зарядов» в ПЧД при «включении» потенциала (т.е., в процессе закрывания канала). В частности, в процессе инактивации заряд R2 переносится на 15 Å «вниз», что в общих чертах описывает основную структурную перестройку, сопровождающую инактивацию канала. Попутно с «нырянием» в ПЧД, сегмент S4 совершает поворот на ≈120°.
Видео 1. Визуализация инактивации K + -канала при реполяризации мембраны. Канал показан «сбоку», мембрана и две субъединицы из четырех для ясности скрыты. В начале траектории можно видеть проникающие через пору ионы K + и показанную синей поверхностью гидратированную полость канала; при закрывании канала эти события пропадают.
В моделировании был показан гипотетический до того переход из состояния канала, когда все вольт-сенсоры S4 уже выдвинуты деполяризацией (снятием напряжения) «вверх», но сама пора пока еще остается закрытой, в «полностью открытое» состояние. Показана и роль «линкера», соединяющего конец S4 с двумя ТМ-спиралями S5 и S6, образующими пору: этот линкер передает механическое движение переноса S4 вверх / вниз, что приводит к открыванию и закрыванию поры. На основе проделанного моделирования исследователи предложили схему функционирования потенциал-чувствительного K + -канала (рис. 2).
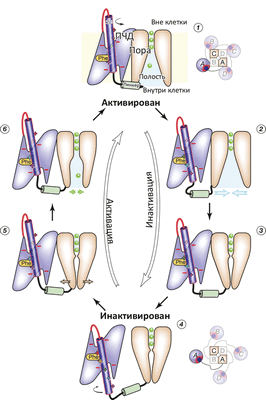
Рисунок 2. Схема работы потенциал-чувствительного K + -канала. (1) Реполяризация (восстановление ТМ-потенциала покоя −70 мВ) приводит к «вдвиганию» вольт-сенсора S4 в ПЧД, что приводит к (2) дегидратации полости канала и «гидрофобному коллапсу» (закрытию поры) (3). При окончании «вдвигания» S4 (4) линкер S4—S5 становится максимально длинным, что позволяет ПЧД «отсоединиться» от поры. При деполяризации (5) (например, при входящем Na + -токе) α-спираль S4 опять выдвигается, ПЧД плотно присоединяется к поре, которая вследствие этого открывается (6). Цикл замкнулся.
Отдельный акцент сделан на практическом применении таких «тяжелых» расчетов: кроме использования компьютера в качестве микроскопа, можно исследовать механизм возникновения так называемых каналопатий — таких заболеваний как аритмия, мигрени, параличи, болевые синдромы, которые связаны с нарушением работы ионных каналов. В частности, мутации в ПЧД (тех самых положительно заряженных остатков аргинина / лизина в S4) приводят к тому, что ПЧД начинает «подтекать» и пропускать через себя так называемые Ω-токи. В ряде дополнительных расчетов исследователи обнаружили и этот феномен, продемонстрировав механизм «протечки».
С одной стороны, Шоу и коллеги не открыли ничего особо нового — схема работы канала, предложенная на рис. 2, в общих чертах была известна и ранее. Однако, пожалуй, самое важное, что следует из их работы, — это то, что увеличение длительности расчетов МД позволяет узнать о биологических системах что-то новое, что само по себе отнюдь не очевидно (такие сложные конформационные явления могли и не произойти вовсе, несмотря на «игру» с потенциалом). Так что истинная причина, по которой чисто «расчетную» работу опубликовали в Science, заключается в том, что возможности методов молекулярного моделирования, часто подвергающиеся (вполне справедливой) критике, все же больше, чем полагали скептики.
О чем не знал Гальвани: пространственная структура натриевого канала
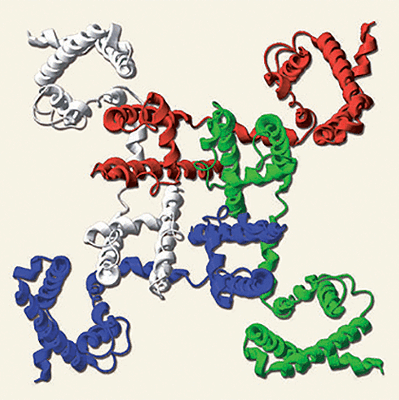
«Общий план» организации Na + -канала бактерии Arcobacter butzleri (NavAb): каждый из четырех мономеров, образующих пору (отверстие в центре), показан своим цветом. «Периферические» участки каждого мономера — потенциал-чувствительные домены, соединенные с доменом, образующим пору, гибким «шарниром». Каждый мономер состоит из шести трансмембранных α-спиралей, обозначаемых S1-S6.
В основе «животного электричества» и вообще всех электробиохимических потенциалов, столь важных для существования любой формы жизни, лежат ионные каналы, способные управлять прохождением тех или иных заряженных частиц через биологическую мембрану. Каналы, селективно пропускающие ионы натрия, отвечают за начальную фазу электрического возбуждения многих клеток, на котором держится передача нервных импульсов, сокращение мышц, секреция гормонов и многое другое. После многих лет исследований ученым удалось получить пространственную структуру потенциал-чувствительного натриевого канала, — правда, пока это канал бактерий, устроенный более просто, чем канал животных. Трехмерная организация проводящей поры и домена, «чувствующего» электрический потенциал, поможет лучше понять тонкости электрической активности возбудимых тканей и даст исследователям новое оружие против невралгических болей, эпилепсии и аритмии.
В 1786 году Луиджи Гальвани с помощниками наблюдали знаменитое подергивание лапок препарированной лягушки в ответ на прикосновение скальпеля к обнаженным бедренным нервам животного (рис. 1), что положило начало идее животного электричества, или гальванизма. Однако чего они в то время не осознали, это что любой (а не только посмертный!) прыжок лягушки начинается со своего рода «искры», запускающей биоэлектрический процесс возбуждения в нервах и мышцах. В наше время хорошо известно, что этот процесс носит название потенциала действия, и начинается он с лавинообразного входа внутрь возбудимой клетки (такой как нейрон или клетка мышц) положительно заряженных ионов натрия (Na + ), которых вне клетки в десять раз больше, чем внутри нее. Почти сразу после этого события входящий натриевый ток сменяется выходящим током ионов калия (K + , которых внутри клетки, напротив, в двадцать раз больше), что восстанавливает исходный электрический потенциал на мембране. Равновесная концентрация самих ионов после этого нормализуется при помощи Na + /K + -насоса.

Рисунок 1. Описание Гальвани своего опыта: «Я разрезал и препарировал лягушку. и, имея в виду совершенно другое, поместил ее на стол, на котором находилась электрическая машина. при полном разобщении от кондуктора последней и на довольно большом расстоянии от него. Когда один из моих помощников острием скальпеля случайно очень легко коснулся внутренних бедренных нервов этой лягушки, то немедленно все мышцы конечностей начали так сокращаться, что казались впавшими в сильнейшие тонические судороги. Другой же из них, который помогал нам в опытах по электричеству, заметил, как ему казалось, что это удается тогда, когда из кондуктора машины извлекается искра. Удивленный новым явлением, он тотчас же обратил на него мое внимание, хотя я замышлял совсем другое и был поглощен своими мыслями. Тогда я зажегся невероятным усердием и страстным желанием исследовать это явление и вынести на свет то, что было в нем скрытого».
«Шлюзом», в состоянии покоя не пускающим ионы натрия из межклеточной среды внутрь, являются потенциал-чувствительные натриевые каналы (ПЧНК), которые открываются при деполяризации — изменении электрического потенциала на мембране в сторону нуля (в покое, когда все ионные каналы закрыты, этот потенциал равен примерно −70 мВ). Пространственное строение натриевых каналов, несмотря на пятидесятилетнюю историю изучения, до недавнего времени оставалось неизвестным, — в отличие от K + -каналов, для нескольких типов которых в последнее десятилетие были получены пространственные структуры высокого разрешения. И вот ученые из Университета Сиэттла (штат Вашингтон, США) расшифровали пространственное строение ПЧНК бактерии Arcobacter butzleri (этот канал называется NavAb) [1], что должно позволить лучше понять, как работают натриевые каналы животных. Работа выполнена в лаборатории Уильяма Каттеролла, более 30 лет посвятившего изучению натриевых каналов.
«Электрические сигналы от потенциал-чувствительных натриевых каналов кодируют информацию в мозгу и передают ее в нервной системе, заставляют мышцы сокращаться, а также стимулируют выработку инсулина в поджелудочной железе», — поясняет Каттеролл важность выбранного им для изучения объекта. — «Если вам выполнили спинальную блокаду или дантист сделал вам инъекцию лидокаина, — натриевые каналы в зоне укола временно перестают работать и не сообщают мозгу о том, что происходит что-то не то» [2].
Натриевые каналы входят в большую группу потенциал-чувствительных ионных каналов, куда также относятся калиевые и кальциевые каналы. Однако функция ПЧНК уникальна тем, что именно с них начинается потенциал действия, когда в ответ на деполяризацию эти каналы временно (очень быстро, но очень ненадолго!) открываются, впуская Na + внутрь клетки. Считается, что активация и инактивация Na + -каналов происходит в разных участках этих белков [3], [4]. Как и другие потенциал-чувствительные каналы, ПЧНК могут полностью активироваться в ответ на всего лишь 10-мВ деполяризацию [5], вызывая каскадное открывание все новых каналов, что обусловливает крайне высокую чувствительность возбудимых тканей. В результате волна возбуждения (нервный импульс) будет бежать по нервному волокну до тех пор, пока не вызовет в нервном окончании секрецию молекул нейромедиатора, «передавая эстафету» другому нейрону или мышечной клетке.
Потенциал-чувствительные каналы либо состоят из четырех идентичных субъединиц, образующих в центре общую пору (так устроены калиевые каналы и «новоисследованные» Na + -каналы бактерий NavAb, см. заглавный рисунок), либо образованы одной длинной полипептидной цепью, образующей четыре гомологичных (но не идентичных) домена, каждый строением напоминающий мономер K + -канала или NavAb. Эти четыре домена образуют пору аналогичным образом, «сворачиваясь» вокруг общего центра. Четырехдоменное строение характерно для кальциевых и натриевых каналов животных, — что и отличает, главным образом, полученную структуру NavAb от натриевых каналов, находящихся в мембранах наших нейронов и мышечных клеток.
Пóра, образованная четырьмя поровыми доменами каждого из мономеров NavAb (или каждым из четырех доменов натриевых каналов животных), «настроена» на селективное пропускание ионов Na + через мембрану, когда канал открыт; при этом энергетический барьер прохода на другую сторону мембраны снижается настолько, что натрий проходит через канал практически со скоростью свободной диффузии. Открытие поры (образована трансмембранными сегментами S5 и S6) регулируется потенциал-чувствительными доменами (ПЧД, сегменты S1-S4), образующими «лепестки» канала (см. заглавный рисунок). Трансмембранный сегмент S4 этого домена несет большой положительный заряд: каждый третий аминокислотный остаток здесь — аргинин или лизин, выстроенные точно в линию по одной из сторон α- (точнее, 310) спирали S4. Вообще-то, наличие заряженных остатков весьма нетипично для гидрофобной среды мембраны, однако именно такое устройство позволяет ПЧД крайне чувствительно реагировать на изменение потенциала и, «выезжая» из мембраны под действием меняющегося электрического поля, заодно открывать и пору, раздвигая образующие ее α-спирали.
В уже известных пространственных структурах K + -каналов [6], [7] пóра находится в открытом состоянии, что вполне согласуется с тем фактом, что при деполяризации канал открывается. Однако в структуре канала NavAb, полученной Каттероллом и его коллегами, пóра закрыта, несмотря на состояние ПЧД, характерное для активированного (открытого) канала. Согласно предположению ученых, им удалось «поймать» канал либо в «пред-открытом», либо в инактивированном состоянии (последнее — это когда канал закрыт и в течение какого-то времени не может быть активирован).
Дело в том, что в настоящее время сымитировать электрический потенциал на мембране в процессе определения пространственной структуры белка нет никакой возможности, потому что мембраноподобное окружение создается в этом случае за счет мицелл или других детергентных сред, где просто нет непрерывной границы, которая могла бы разделять области с разным потенциалом.
Структура канала NavAb объясняет, как устроен потенциал-чувствительный домен с его «обоймой» положительно заряженных аминокислотных остатков, пронизывающих всю мембрану и способных под влиянием электрического поля двигаться «вверх-вниз», подобно поршню. Интересно также строение селективного фильтра, избирательно пропускающего ионы натрия, но непроницаемого для калия, — хотя он и существенно, судя по всему, отличается от селективного механизма ПЧНК животных. Однако самым интересным, по-видимому, стали «бреши» в стенках поры, открывающие доступ в ее внутренний резервуар прямо из толщи мембраны (рис. 2). По-видимому, именно эти «бреши», отсутствующие в K + -канале, являются причиной чрезвычайно высокой чувствительности ПЧНК к местным анестетикам, селективно блокирующим пору канала, — возможно, проникая внутрь нее именно из среды липидов мембраны (многие из этих анестетиков достаточно для этого гидрофобны) [8].
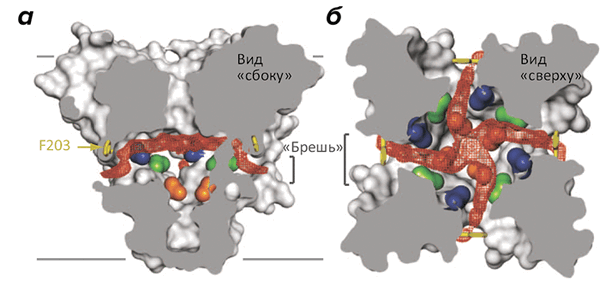
Рисунок 2. «Бреши» в боковых поверхностях натриевого канала NavAb. Бактериальный натриевый канал образован четырьмя идентичными мономерами, «сплетенными» между собой наподобие лепестков диафрагмы (поровый домен одного мономера тесно взаимодействует с потенциал-чувствительным доменом соседнего мономера). а — Боковое сечение канала, на котором видны «бреши», открывающие доступ из гидрофобной среды мембраны во внутренний резервуар поры (пустое пространство показано красным контуром). Границы мембраны показаны серыми линиями. б — Сечение в виде «сверху» показывает размер внутреннего резервуара поры NavAb в закрытом состоянии.
«Учитывая такое интересное строение натриевых каналов, открывается широкий простор для дизайна новых лекарственных веществ, действующих на эти каналы, — подытоживает Каттеролл. — Ученые надеются разработать новые лекарства, действующие на натриевые каналы „изнутри“. В частности, очень хотелось бы увидеть новые анестетики без побочных эффектов, а также лекарства, которые помогли бы против эпилепсии и расстройства сердечного ритма, приводящего иногда к внезапной сердечной смерти» [2]. Но это, конечно, не у бактерий — а значит, еще предстоит большая работа по выяснению того, как устроены натриевые каналы у животных и в особенности — у млекопитающих.
Калиевый канал - Potassium channel

Калиевый канал Kv1.2, структура в мембраноподобной среде. Расчетные углеводородные границы липидный бислой обозначаются красными и синими линиями.
Калиевые каналы являются наиболее распространенным типом ионный канал и встречаются практически во всех живых организмах. [1] Они образуют калий -селективный поры этот промежуток клеточные мембраны. Калиевые каналы находятся в большинстве ячейка типы и контролируют широкий спектр функций клеток. [2] [3]
Функция
Калиевые каналы функционируют, чтобы проводить ионы калия по их электрохимический градиент, делая это быстро (до скорость диффузии из K + ионов в объемной воде) и выборочно (исключая, в первую очередь, натрий несмотря на суб-ангстрем разница в ионном радиусе). [4] Биологически эти каналы действуют, чтобы установить или сбросить потенциал покоя во многих камерах. В возбудимых клетках, например нейроны, запаздывающий противоток ионов калия формирует потенциал действия.
Способствуя регулированию потенциал действия продолжительность в сердечная мышца, нарушение работы калиевых каналов может вызвать опасные для жизни аритмии. Калиевые каналы также могут участвовать в поддержании тонуса сосудов.
Они также регулируют клеточные процессы, такие как секреция гормоны (например, инсулин освободить от бета-клетки в поджелудочная железа ), поэтому их неисправность может привести к заболеваниям (например, сахарный диабет ).
В одном исследовании, проведенном Ремом и Лаздунски, было показано, что калиевые каналы влияют на токсины, в частности, на дендротоксин. Дендротоксин - это нейротоксин, выделенный из яда Dendroaspis. змеи. Предыдущие исследования показали, что блокирование К + канала влияет на действие токсинов, поэтому исследователи Рем и Лаздунски провели исследование, чтобы показать, связан ли К + канал с сайтом связывания дендротоксина I. Они пришли к выводу, что Чувствительный к дендротоксину K + канал, взятый из головного мозга крысы, представляет собой мультимерный белок, состоящий из полипептидных цепей Mr 76 000-80 000 и 38 000.
Существует четыре основных класса калиевых каналов:
- - открываются в ответ на наличие кальций ионы или другие сигнальные молекулы. - легче пропускает ток (положительный заряд) во внутреннем направлении (в ячейку). - конститутивно открыты или обладают высокой базальной активацией, такой как «каналы покоя» или «каналы утечки», которые устанавливают отрицательный мембранный потенциал нейронов. - находятся потенциалзависимые ионные каналы которые открываются или закрываются в ответ на изменения в трансмембранныйНапряжение.
В следующей таблице содержится сравнение основных классов калиевых каналов с репрезентативными примерами (полный список каналов в каждом классе см. На страницах соответствующих классов).
Дополнительные примеры фармакологических модуляторов калиевых каналов см. блокатор калиевых каналов и открыватель калиевых каналов.

Вид сверху на калиевый канал с ионами калия (фиолетовый), движущимися через пору (в центре). ( PDB: 1BL8 )
Калиевые каналы имеют тетрамерный структура, в которой четыре одинаковых белковые субъединицы объединить, чтобы сформировать четырехкратный симметричный (C4 ) комплекс, расположенный вокруг центральной ионопроводящей поры (т.е. гомотетрамера). Альтернативно, четыре родственных, но не идентичных белковых субъединицы могут связываться с образованием гетеротетрамерных комплексов с псевдо-C4 симметрия. Все субъединицы калиевых каналов имеют характерную структуру петли поры, которая выстилает верхнюю часть поры и отвечает за селективную проницаемость для калия.
Есть более 80 млекопитающее гены которые кодируют калиевый канал подразделения. Однако калиевые каналы, обнаруженные в бактерии являются одними из наиболее изученных ионных каналов с точки зрения их молекулярной структуры. С помощью Рентгеновская кристаллография, [49] [50] Было получено глубокое понимание того, как ионы калия проходят через эти каналы и почему (меньше) натрий ионы нет. [51] 2003 год Нобелевская премия по химии был присужден Род Маккиннон за его новаторскую работу в этой области. [52]
Фильтр селективности

Кристаллографическая структура бактериального Калиевый канал KcsA ( PDB: 1K4C ). [53] На этом рисунке для ясности показаны только две из четырех субъединиц тетрамера. Белок отображается в виде зеленой мультяшной диаграммы. Кроме того, отображаются карбонильные группы основной цепи и атомы белка боковой цепи треонина (кислород = красный, углерод = зеленый). Наконец, ионы калия (занимающие позиции S2 и S4) и атомы кислорода молекул воды (S1 и S3) изображены как пурпурные и красные сферы соответственно.
Каналы для ионов калия удаляют гидратную оболочку иона, когда он попадает в фильтр селективности. Фильтр избирательности образован последовательностью из пяти остатков, TVGYG, называемой последовательностью сигнатуры, в каждой из четырех субъединиц. Эта сигнатурная последовательность находится внутри петли между спиралью поры и TM2 / 6, исторически называемой P-петлей. Эта сигнатурная последовательность является высококонсервативной, за исключением того, что остаток валина в прокариотических калиевых каналах часто заменяется остатком изолейцина в эукариотических каналах. Эта последовательность принимает уникальную структуру основной цепи, структурно аналогичную структуре структурный мотив белка гнезда. Четыре набора электроотрицательный карбонильные атомы кислорода выровнены к центру поры фильтра и образуют квадратную антипризму, подобную водосольватирующей оболочке, вокруг каждого сайта связывания калия. Расстояние между карбонильными атомами кислорода и ионами калия в местах связывания фильтра селективности такое же, как между атомами кислорода воды в первой гидратной оболочке и ионом калия в водном растворе, обеспечивая энергетически выгодный путь для удалениясольватация ионов. Однако ионы натрия слишком малы, чтобы заполнить пространство между карбонильными атомами кислорода. Таким образом, для ионов натрия энергетически выгодно оставаться связанными с молекулами воды во внеклеточном пространстве, а не проходить через поры для селективных ионов калия. [54] Эта ширина, по-видимому, поддерживается водородная связь и силы Ван дер Ваальса внутри листа остатков ароматических аминокислот, окружающего фильтр селективности. [49] [55] Фильтр селективности открывается по направлению к внеклеточному раствору, открывая четыре карбонильных атома кислорода в остатке глицина (Gly79 в KcsA ). Следующим остатком на внеклеточной стороне белка является отрицательно заряженный Asp80 (KcsA). Этот остаток вместе с пятью остатками фильтра формирует пору, которая соединяет заполненную водой полость в центре белка с внеклеточным раствором. [56]
Механизм избирательности
Механизм селективности калиевых каналов продолжает оставаться предметом дискуссий. Карбонильные атомы кислорода сильно отрицательны и привлекательны для катионов. Фильтр может вмещать ионы калия в 4 местах, обычно помеченных от S1 до S4, начиная с внеклеточной стороны. Кроме того, один ион может связываться в полости на участке, называемом SC, или один или несколько ионов на внеклеточной стороне в более или менее четко определенных участках, называемых S0 или Sext. Возможны несколько различных вариантов использования этих участков. Поскольку рентгеновские структуры являются средними по многим молекулам, однако невозможно вывести фактическую заселенность непосредственно из такой структуры. В общем, наличие двух соседних позиций, занятых ионами, связано с электростатическим отталкиванием. Предложения по механизму селективности были сделаны на основе молекулярная динамика симуляции, [57] игрушечные модели ионного связывания, [58] термодинамические расчеты, [59] топологические соображения, [60] [61] и структурные различия [62] между избирательными и неизбирательными каналами.
Механизм ионной транслокации в KcsA широко изучен теоретическими расчетами и моделированием. [56] [63] Предсказание механизма ионной проводимости, в котором два дважды занятых состояния (S1, S3) и (S2, S4) играют существенную роль, было подтверждено обоими методами. Молекулярная динамика (MD) моделирование предполагает два внеклеточных состояния, Sдоб и S0, отражающие ионы, входящие и выходящие из фильтра, также являются важными участниками ионной проводимости.
Гидрофобная область
Эта область используется для нейтрализации окружающей среды вокруг иона калия, чтобы он не притягивался никакими зарядами. В свою очередь, это ускоряет реакцию.
Центральная полость
Центральная пора шириной 10 Å расположена недалеко от центра трансмембранного канала, где энергетический барьер является самым высоким для проникающего иона из-за гидрофобности стенки канала. Заполненная водой полость и полярный С-конец спиралей пор ослабляют энергетический барьер для иона. Считается, что отталкивание предшествующих нескольких ионов калия способствует прохождению ионов. Наличие полости можно интуитивно понять как один из механизмов канала для преодоления диэлектрического барьера или отталкивания со стороны мембраны с низкой диэлектрической проницаемостью за счет сохранения K + ион в водянистой среде с высокой диэлектрической проницаемостью.
Регулирование
Графическое изображение открытых и закрытых калиевых каналов ( PDB: 1lnq И PDB: 1k4c ). Показаны два простых бактериальных канала для сравнения «открытой» структуры канала справа с «закрытой» структурой слева. Вверху находится фильтр (отбирает ионы калия), а внизу - область стробирования (контролирует открытие и закрытие канала).
Поток ионов через поры калиевого канала регулируется двумя взаимосвязанными процессами, называемыми ворота и инактивация. Стробирование - это открытие или закрытие канала в ответ на раздражители, в то время как инактивация - это быстрое прекращение тока из открытого калиевого канала и подавление способности канала возобновлять проводимость. Хотя оба процесса служат для регулирования проводимости канала, каждый процесс может быть опосредован рядом механизмов.
Обычно считается, что стробирование опосредуется дополнительными структурными доменами, которые воспринимают стимулы и, в свою очередь, открывают поры канала. Эти домены включают домены RCK каналов BK, [64] [65] [66] и области датчика напряжения стробированного напряжения K + каналы. Считается, что эти домены отвечают на стимулы, физически открывая внутриклеточные ворота порового домена, тем самым позволяя ионам калия проходить через мембрану. Некоторые каналы имеют несколько регуляторных доменов или дополнительных белков, которые могут модулировать ответ на стимул. Хотя механизмы продолжают обсуждаться, известны структуры ряда этих регуляторных доменов, включая домены RCK прокариотических [67] [68] [69] и эукариотические [64] [65] [66] каналы, pH-диапазон KcsA, [70] циклические нуклеотидные домены гейтирования, [71] и калиевые каналы, управляемые напряжением. [72] [73]
Инактивация N-типа обычно является более быстрым механизмом инактивации и называется модель "мяч и цепь". [74] Инактивация N-типа включает взаимодействие N-конца канала или связанного с ним белка, который взаимодействует с поровым доменом и блокирует путь ионной проводимости, как «шар». В качестве альтернативы считается, что деактивация C-типа происходит внутри самого фильтра селективности, где структурные изменения внутри фильтра делают его непроводящим. Существует ряд структурных моделей инактивированного K + фильтры каналов, [75] [76] [77] хотя точный механизм остается неясным.
Фармакология
Блокираторы
Блокаторы калиевых каналов подавляют поток ионов калия через канал. Они либо конкурируют со связыванием калия внутри селективного фильтра, либо связываются за пределами фильтра, блокируя ионную проводимость. Примером одного из этих конкурентов являются ионы четвертичного аммония, которые связываются на внеклеточной поверхности. [78] [79] или центральная полость канала. [80] Для блокирования из центральной полости ионы четвертичного аммония также известны как блокаторы открытых каналов, поскольку связывание обычно требует предварительного открытия цитоплазматических ворот. [81]
Барий ионы также могут блокировать токи калиевых каналов, [82] [83] путем связывания с высоким сродством в фильтре селективности. [84] [85] [86] [87] Считается, что эта жесткая привязка лежит в основе токсичность бария подавляя активность калиевых каналов в возбудимых клетках.
С медицинской точки зрения блокаторы калиевых каналов, такие как 4-аминопиридин и 3,4-диаминопиридин, были исследованы для лечения таких состояний, как рассеянный склероз. [88] Мимо эффекты лекарств могут привести к Синдром удлиненного интервала QT, потенциально опасное для жизни состояние. Чаще всего это связано с действием на hERG калиевый канал в сердце. Соответственно, все новые препараты проходят доклинические испытания на сердечную безопасность.
Читайте также:
