Воспаление. Характеристики этапов воспаления
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
Главная / Издательство / Особенности развития воспалительной реакции в зависимости от локализации воспаления, реактивности организма, характера этиологического фактора. Роль возраста в развитии воспаления
2.1.2. Особенности развития воспалительной реакции в зависимости от локализации воспаления, реактивности организма, характера этиологического фактора. Роль возраста в развитии воспаления
Независимо от локализации воспалительного процесса и происхождения этиологического фактора в зоне острого воспаления всегда возникает стан-дартный комплекс сосудистых и тканевых изменений. Реакция со стороны тканей на действие повреждающего фактора носит фазный характер и прояв-ляется альтерацией, экссудацией и пролиферацией. Одновременно с ткане-выми расстройствами возникает комплекс сосудистых изменений в виде кратковременного спазма, артериальной, венозной гиперемии и стаза.
Интенсивность развития тех или иных фаз сосудистых и тканевых изменений в определенной мере зависит от реактивности организма и локализа-ции воспалительного процесса.
В случае нормальной реактивности организма возникает норм-ергическая воспалительная реакция, характеризующаяся адекватностью интенсивности развития воспаления силе воздействующего альтерирующего фактора.
В случае пониженной реактивности (дети первых лет жизни, пожилые люди, лица, ослабленные предшествующими заболеваниями) имеет место гипоергическая воспалительная реакция, когда на фоне интенсивного альте-рирующего воздействия возникает незначительное воспаление.
У лиц с повышенной или качественно измененной иммунологической реактивностью возможно развитие бурных гиперергических воспалительных реакций в ответ на действие слабого альтерирующего фактора.
Касаясь особенностей развития воспалительного процесса в зависимости от его локализации в различных тканях, необходимо отметить, что альтера-тивное воспаление характеризуется преобладанием дистрофических и некро-тических сдвигов и чаще всего наблюдается в паренхиматозных органах (миокард, печень, почки, скелетная мускулатура). Экссудативное воспаление характеризуется преобладанием реакции системы микроциркуляции, глав-ным образом ее венулярного отдела, над процессами альтерации и пролифе-рации. При этом на первый план выступают интенсивная экссудация плазмы, ее растворимых низкомолекулярных компонентов, а также эмиграция лейко-цитов; экссудативное воспаление чаще развивается в серозных полостях в случаях возникновения плеврита, перикардита, артрита и других, реже - в паренхиматозных органах.
Пролиферативное, или продуктивное, воспаление характеризуется преоб-ладанием размножения клеточных элементов пораженной ткани, а также ин-тенсивной микро- или макрофагальной, лимфоцитарной инфильтрацией ор-гана или ткани. Продуктивное воспаление протекает, как правило, длительно и носит хронический характер. Однако в ряде случаев оно может быть ост-рым, например гранулематозное воспаление при брюшном и сыпном тифе, васкулитах различной этиологии.
Продуктивное воспаление может иметь «специфическую» и «неспецифическую» природу. При так называемом специфическом продуктивном воспа-лении клеточный состав экссудата, цикл и длительность процесса определя-ются особенностями биологических свойств возбудителя. Специфическое воспаление большей частью имеет характер так называемых инфекционных гранулем-узелков, состоящих из элементов грануляционной ткани.
Воспаление как стандартный неспецифический комплекс сосудистых и тканевых изменений начинает постепенно формироваться в эмбриональном периоде, причем на ранних этапах эмбриогенеза воспаление как типовой па-тологический процесс еще не развивается. В период формирования бластулы, эмбрио- и трофобласта действие экзогенных раздражителей инфекционной природы приводит или к гибели зародыша, или частичному повреждению указанных структур, причем, в случае продолжения развития зародыша мо-гут возникать множественные врожденные пороки развития как самого заро-дыша, так и его провизорных органов (Серов В.В.,Пауков В.С., 1995). В 1951 г. был описан синдром Грега, обусловленный развитием коревой краснухи у беременных женщин, особенно в первом триместре беременности. При этом возникают множественные врожденные пороки развития органов эктодер-мального гистогенеза (зачатков глаз, органов слуха, головного мозга) и мезо-дермального происхождения (сердца, почек и других органов).
Продуктивный компонент воспалительной реакции, особенно со стороны мезенхимальных элементов кроветворного и стромального ряда, начинает формироваться в конце эмбриогенеза и в раннем периоде фетогенеза, когда происходит дальнейшая дифференциация тканей органов. Воздействие ин-фекционных патогенных факторов на материнский организм и плод приво-дит в этом периоде к формированию так называемых мезенхиматозов в виде пролиферации миелоидной ткани, диффузного фиброза селезенки и печени при врожденном сифилисе, фиброэластоза миокарда, фиброза стромы под-желудочной железы в сочетании с разрастанием жировой ткани.
В позднем фетальном периоде, соответствующем 28 неделям беременности, когда завершается формирование большинства органов плода, воспале-ние характеризуется не только альтеративно-пролиферативным характером, но и присоединением реакции микроциркуляторного русла.
Характерной особенностью воспалительного процесса в фетальном периоде является отсутствие эффективных местных механизмов защиты, обес-печивающих формирование барьеров, в связи с чем возникают быстрая гене-рализация инфекции и ареактивные некрозы в различных органах и на слизи-стых оболочках с развитием множественных эрозий слизистых. Образование обширных некрозов с последующим возникновением диффузного глиоза в головном мозге отмечается при инфицировании плода вирусом герпеса 2-го типа, а при возникновении токсоплазмоза в мозге формируются многочис-ленные кисты, содержащие зернистые шары и псевдоцисты. В то же время при названных инфекциях обнаруживаются признаки генерализации процес-сса в виде очагов некроза в паренхиматозных органах.
Инфицирование плода нередко характеризуется и формированием грану-лем, не имеющих, как правило, «специфического» характера (Серов В.В., Пауков В.С., 1995). При врожденном туберкулезе гранулемы не содержат ти-пичных клеток Лангханса и эпителиоидных клеток, характеризуются интен-сивным казеозным распадом, по периферии гранулем формируются миело-цитарный и моноцитарный барьеры. При врожденном сифилисе развитие ме-зенхиматоза сочетается с образованием милиарных гранулем, лишенных ги-гантских и плазматических клеток.
Таким образом, воспалительная реакция начинает формироваться в раннем фетальном периоде в виде так называемых «пролиферативных» мезен-химатозов в сочетании с врожденными пороками развития.
В позднем фетальном периоде преобладают альтеративно-проли-феративные сдвиги в зоне воспаления, возникают очаги некроза, формиру-ются гранулемы, содержащие значительные количества возбудителей. В этот период развития плода еще не сформированы в достаточной мере специфи-ческие иммунологические механизмы защиты, местные механизмы рези-стентности. Фагоцитоз носит незавершенный характер, в связи с чем зона воспаления не выполняет барьерной функции, не обеспечивает элиминации возбудителя, что приводит к быстрой генерализации инфекции, развитию множественных очагов некроза в различных органах и тканях (Гуревич П.С., Барсуков В.С.,1982).
Касаясь особенностей развития воспаления у новорожденных, следует отметить уникальную нозологическую форму патологии, так называемую флегмону новорожденных. Заболевание индуцируется стрептококковой и стафилококковой микрофлорой, болеют дети первого месяца жизни. Процесс локализуется в поясничной, крестцовой областях, на груди, спине, в подмы-шечной и затылочной областях. Воспаление начинается в глубине дермы, во-круг потовых желез, затем переходит на окружающие ткани. На коже возни-кает быстро распространяющийся участок гиперемии, приобретающий вско-ре синюшный оттенок, эпидермис на значительном протяжении отслаивается и подвергается некрозу. Воспалительная реакция носит некротический ха-рактер, некрозы распространяются на мышечную ткань, а затем на надкост-ницу и костную ткань. Отмечается незначительная лейкоцитарная инфильт-рация тканей, гнойный экссудат отсутствует.
У детей первых 2-3 месяцев жизни отмечается недостаточность фагоцитоза в связи с незрелостью рецепторного аппарата мембран фагоцитов, отсут-ствием достаточного количества опсонинов и хемоаттрактантов, в роли кото-рых выступают, в частности, комплемент и иммуноглобулины (Стефани Д.В., Вельтищев Ю.Е., 1996). В связи с этим не формируются нейтрофиль-ный и моноцитарный барьеры, обеспечивающие элиминацию инфекционных возбудителей за счет процессов киллинга и переваривания в фаголизосомах, в отличие от таковых барьеров у взрослого человека.
У детей первых месяцев жизни недостаточен синтез в печени плазменных факторов свертывания крови, преобладают антикоагулянтные механизмы, поэтому отсутствуют явления тромбоза в кровеносных сосудах и, соответст-венно, фиксация патогенного агента в зоне его инокуляции.
Таким образом, особенностями воспалительного процесса у детей первых месяцев жизни, преимущественно у недоношенных, являются склонность к генерализации процесса в связи с недостаточностью местных механизмов защиты, преобладание альтеративного и продуктивного компонентов воспа-ления, недостаточность процессов экссудации и связанных с ней механизмов защиты.
Недостаточность формирования местных механизмов защиты, склонность к генерализации инфекции, развитию септического состояния при развитии воспаления могут сохраняться в течение первых лет жизни.
В отроческом периоде, характеризующемся сменой молочных зубов на постоянные, происходят определенные сдвиги иммунного и гормонального статуса ребенка, что и приводит к развитию гиперергических воспалитель-ных реакций типа крапивницы, отека Квинке, бронхиальной астмы и других.
В пубертатном периоде перестройки нервной, эндокринной, иммунной систем организма нередко зона воспаления также в достаточной мере не вы-полняет своей барьерной функции, что приводит к учащению развития забо-леваний инфекционно-аллергической или аутоиммунной природы.
В пожилом и старческом возрасте постепенно подавляются все сферы деятельности человека, преобладают атрофические, дистрофические и скле-ротические процессы во внутренних органах, снижаются иммунологические механизмы защиты и неспецифическая резистентность. Так, у людей пожи-лого и старческого возраста возникает недостаточность опсонизирующих факторов, подавляются миграционная способность нейтрофилов, их бактери-цидная активность в связи с возрастной недостаточностью ферментативных систем. Снижение фагоцитарной активности по тем же причинам свойствен-но и мононуклеарной фагоцитирующей системе. Недостаточность фагоцито-за становится причиной длительной персистенции в организме вирусных и бактериальных антигенов, иммунных комплексов, что обусловливает дли-тельное течение воспалительного процесса, приобретающего нередко имму-нокомплексную природу.
С увеличением возраста отмечается снижение уровня Т-лимфоцитов в крови, уменьшается способность Т-лимфоцитов к последующей дифферен-цировке в иммунные регуляторные и киллерные клетки на фоне антигенной стимуляции, нарушается рецепция интерлейкинов, обеспечивающих реакции межклеточного взаимодействия, снижается продукция интерлейкина-2, то есть возникают характерные особенности развития иммунодефицитных со-стояний и обусловленная этим фактором недостаточность механизмов защи-ты в зоне воспалительного процесса инфекционной природы.
Воспаление. Характеристики этапов воспаления
1 ГБОУ ВПО «Саратовский Государственный медицинский университет им. В.И. Разумовского Минздрава России»
1. Зайчик А.Ш. Патологическая физиология. Том 2. Патохимия [Текст]: учеб. / А.Ш. Зайчик, Л.П. Чурилов. - 3-е изд. - СПб.:ЭЛБИ-СПб, 2007. - 688 с.
2. Инфекционный процесс / Под ред. Н.П. Чесноковой, А.В. Михайлова. - М.: «Академия естествознания», 2006. - 434 с.
3. Лекция 4. Особенности структуры, функции и метаболизма В- и Т- систем лимфоцитов / Н.П. Чеснокова, Е.В. Понукалина, Т.Н. Жевак [и др.] // Международный журнал фундаментальных и прикладных исследований. 2015. № 4. - С. 293 -297.
4. Патологическая физиология [Текст]: учеб. / под общ. ред. В.В.Моррисона, Н.П. Чесноковой. - 4-е изд. - Саратов: Изд-во Сарат. гос. мед. ун-та, 2009. - 679 с.
5. Патофизиология в 3-х томах [Текст]: учеб. / под общ. ред. А.И. Воложина, Г.В. Порядина - Москва: Издательский центр «Академия», 2007.
6. Типовые патологические процессы как основа патогенеза болезней различной этиологии [Текст]: монография / под общ. ред. В.М. Попкова, Н.П. Чесноковой. - Саратов: Изд-во Сарат. гос. мед. ун-та, 2017. - 536 с.
7. Типовые реакции иммунной системы на действие антигенов-аллергенов [Текст]: учеб. пособие / под ред. Н.П. Чесноковой. - Саратов: Изд-во Сарат. гос. мед. ун-та, 20014. - 156 с.
8. Цитокины: биологическая роль в развитии реакций адаптации и повреждения в условиях нормы и патологии различного генеза [Текст]: монография / под общ. ред. В.М. Попкова, Н.П. Чесноковой. - Саратов: Изд-во Сарат. гос. мед. ун-та, 2016. - 448 с.
Воспаление - типовой патологический процесс, составляющий основу патогенеза болезней с разнообразной локализацией патологии и симптоматикой. Воспаление может развиваться остро или хронически. При остром развитии воспалительного процесса возникает стереотипный комплекс сосудистых изменений в виде спазма сосудов, артериальной и венозной гиперемии.
Несколько опережая во времени развитие сосудистых реакций, а затем и параллельно с сосудистыми изменениями формируются тканевые расстройства в виде альтерации, экссудации, пролиферации. Указанные сосудистые и тканевые изменения имеют место при различных заболеваниях воспалительной природы - стоматитах, гингивитах, глосситах, паро- и перидонтитах, эзофагитах, энтеритах, миокардитах и так далее, то есть развиваются не зависимо от локализации воспаления [1, 4, 5, 6, 8].
Касаясь характеристики фазы альтерации, следует отметить морфологические и биохимические аспекты ее развития.
Альтерация - обобщающий термин, означающий повреждение. С точки зрения морфологии, это зона некроза, дистрофии, апоптоза, отека тканей и других деструктивных процессов. С метаболической, патохимической, функциональной сторон, это стадия освобождения медиаторов альтерации и проявления их биологических эффектов. По времени развития различают первичную и вторичную альтерацию.
Первичная альтерация формируется в момент воздействия патогенного фактора на организм, ее границы соответствуют зоне первичного действия патогенов.
Вторичная альтерация отсрочена во времени, связана с диффузией из зоны первичной альтерации в окружающую ткань токсических и ферментных факторов патогенности возбудителей бактериальной, вирусной, паразитарной природы, а также медиаторов альтерации гуморального и клеточного происхождения, предсуществующих или вновь синтезируемых.
К основным источникам предсуществующих медиаторов альтерации относятся тучные клетки, а также базофилы, в процессе дегрануляции которых освобождается гистамин, гепарин, серотонин, факторы активации тромбоцитов, хемотаксиса эозинофилов, нейтрофилов, а затем, в процессе антигенной стимуляции, продуцируются интерлейкины и другие биологически активные вещества.
В момент действия альтерирующих факторов терминалями нервных волокон освобождаются нейропептиды, такие, как субстанция P, пептид гена родственного кальцитонину, формирующие чувство боли.
В процессе дегрануляции тромбоцитов, высвобождаются катехоламины, серотонин, лизосомальные гидролазы, факторы гемостаза и фибринолиза.
К числу предсуществующих медиаторов альтерации клеточного происхождения относятся лизосомальная гидролаза, а также лизоцим, катионные белки, лактоферрин. Основными источниками которых являются клетки моноцитарно-макрофагальной системы и гранулоциты.
Типовой реакцией на повреждение в зоне воспаления, в том числе в тканях пародонта, является повышение проницаемости биологических мембран, в частности цитоплазматических, митохондриальных, лизосомальных и др.
Альтерирующие факторы различной биологической, а также, физической и химической природы инициируют активацию таких ферментов в зоне повреждения, как липоксигеназа и циклооксигеназа, обеспечивающих развитие каскада реакций образования, соответственно, лейкотриенов и простогландинов. Последние обладают мощным вазоактивным действием, регулирует тонус и проницаемость сосудистой стенки, гемостатические реакции, вызывая развитие экссудации и эмиграции лейкоцитов на стадии венозной гиперемии.
Важная роль в развитии воспаления принадлежит вновь синтезируемым медиаторам таким как лимфокины и монокины, вызывающим развитие синдрома системного воспалительного ответа, направленного в значительной мере на зобилизацию защитно-приспособительных реакций за счет вовлечения иммунной системы, гормонального баланса, метаболических изменений [1, 4, 5, 6, 7].
В настоящее время известно более 100 биологически активных веществ, секретируемых моноцитами/макрофагами, классификация которых приведена ниже:
1) протеазы: активатор плазминогена, коллагеназа, эластаза, ангиотензин-конвертаза;
2) медиаторы воспаления и иммуномодуляции:ФНО, ИЛ-1, ИЛ-3, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-15, ИФН, лизоцим, фактор активации нейтрофилов, компоненты комплемента;
3) факторы роста: КСФ-ГМ, КСФ-Г, КСФ-М, фактор роста фибробластов, трансформирующий фактор роста;
4) факторы свертывающей системы и ингибиторы фибринолиза: V,VII, IX, X, ингибиторы плазминогена, ингибиторы плазмина;
5) адгезивные вещества: фибронектин, тромбоспондин, протеогликаны.
Лимфокины - это биологически активные вещества, которые продуцируются сенсибилизированными лимфоцитами при специфической антигенной стимуляции [2, 3, 7, 8].
Следует отметить, что часть цитокинов (ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-8, ИЛ-10 и др.) могут продуцироваться лимфоцитами, а также клетками моноцитарномакрофагальной системы. В связи с этим они могут быть отнесены как к группе лимфокинов, так и к группе монокинов.
Лимфокины проявляют многообразную биологическую активность, обеспечивая бластогеный и митогенный эффекты на лимфоидную и моноцитарно-макрофагальную систему, развитие хемотаксиса нейтрофилов, макрофагов, лимфоцитов, вызывая антивирусные и антимикробные эффекты.
К числу вновь синтезируемых медиаторов в зоне воспаления клеточного происхождения относят свободные радикалы, такие как супероксид-анион-радикал, гидроксильный радикал, перекись водорода, оксид азота, имеющие как внутриклеточное, так и внеклеточное происхождение в условиях формирования гипоксии, ишемии, тромбоза, эмболии в зоне воспаления, а также при различных стрессорных ситуациях.
Свободные радикалы взаимодействуют со структурными белками клеток, с липидными компонентами биологических мембран с образованием эндоперекисей с последующей дестабилизацией биосистемы.
Особую роль вразвитии воспаления отводят оксиду азота, который является мощным вазодилятатором, ингибитором агрегации тромбоцитов, нейротрансмиттером неадренергически-нехолинергических нейронов, вызывающих релаксацию гладкой мускулатуры ряда органов и тканей, в частности половых органов.
При остром воспалении свободные радикалы вызывают разрушение межклеточного матрикса, оказывают повреждающее действие на фибробласты, в то же время они могут оказывать стимулирующее влияние на процессы пролиферации [1, 4, 5, 6, 7].
К числу факторов антиоксидантной защиты тканей относятся ферменты: каталаза, супероксиддисмутаза, глутатионпероксидаза, а также витамин К, α-токоферол, метионин и др.
Помимо клеточных медиаторов воспаления большую роль в развитии вторичной альтерации играют плазменные медиаторы: кинины, компоненты системы комплемента, факторы обертывания крови.
Относительно механизмов активации медиаторов альтерации гуморального происхождения следует отметить, что деструкция эндотелия сосудов в зоне альтерации приводит к обнажению субэндотелиальной выстилки с выраженными прокоагулянтными свойствами за счет наличия коллагена, эндотелина, простагландинов F2α, тромбоксанов, фибронектина и других компонентов. При этом возникает инициация внешнего и внутреннего механизмов активации протромбиназы и соответственно систем гемостаза, фибринолиза, комплемента, калликреин-кининовой системы, тромбоцитарного звена гемостаза.
Одновременно с тканевыми изменениями в зоне воспаления в тканях пародонта развивается комплекс сосудистых реакций. При кратковременном действии достаточно сильного повреждающего фактора первоначально возникает спазм сосудов вследствие раздражения вазоконстрикторных нервных окончаний и гладкомышечных элементов сосудистых стенок. Спазм сосудов очень быстро сменяется артериальной гиперемией - увеличением кровенаполнения воспалительного очага за счет усиления притока крови в условиях накопления умеренного количества биологически активных веществ - медиаторов воспаления, активации аксон-рефлекса и повреждения вазоконстрикторных нервных окончаний. Артериальная гиперемия характеризуется умеренным расширением артериол, капилляров и венул, увеличением скорости кровотока, феноменом новообразования капилляров, активацией обменных процессов в тканях [1, 4, 5].
В последующем артериальная гиперемия сменяется венозной вследствие нарушения оттока крови из очага воспаления. Этому способствует уменьшение просвета сосудов за счет набухания эндотелия, краевого стояния лейкоцитов, сгущения крови, агрегации тромбоцитов, а также сдавление венул и лимфатических сосудов экссудатом. Для венозной гиперемии характерно значительной расширение сосудов микроциркуляторного русла, замедление скорости кровотока, снижение оксигенации тканей очага воспаления. На стадии венозной гиперемии создаются условия для развития последующих тканевых изменений: экссудации и эмиграции.
Экссудация (от лат. ex-sudare - потеть) - выпотевание белоксодержащей жидкой части крови через сосудистую стенку в воспаленную ткань.
В основе развития экссудации при воспалении лежат следующие механизмы:
1) повышение проницаемости сосудов в результате воздействия медиаторов воспаления, ионов водорода, лизосомальных ферментов;
2) возрастание гидродинамического давления в сосудах очага воспаления вследствие увеличенного кровенаполнения;
3) возрастание осмотического и онкотического давления в воспаленной ткани в результате альтерации;
4) снижение онкотического давления крови из-за потери белков в условиях повышенной проницаемости сосудистых;
5) диффузия жидкой части крови через микропоры в эндотелиальных клетках (трансцеллюлярные каналы), а также активный перенос микровезикул при цитопемсисе.
Ведущим фактором экссудации является повышение проницаемости сосудов. К медиаторам воспаления, влияющим на проницаемость сосудистой стенки, относятся гистамин, серотонин, брадикинин, С5а и С3а, лейкотриены С4 и Д4, которые влияют непосредственно на эндотелиальные клетки, вызывая их контракцию, а также С5а de Arg, лейкотриен В4, интерлейкин-1, фактор активирующий тромбоциты [4, 5, 6, 7, 8].
Повышение проницаемости сосудов при воспалении является двухфазным. Первая фаза, или немедленная, возникает вслед за действием альтерирующего агента, достигает максимума на протяжении нескольких минут и продолжается в течение 5-30 минут. Вторая фаза, замедленная, развивается постепенно, достигает максимума через 4-6 часов и длится иногда до 10 часов в зависимости от вида и интенсивности воспаления.
Степень повышения проницаемости сосудов при воспалении определяет не только интенсивность экссудации, но и качественный состав экссудата, содержащего большее, чем в транссудате, количество белка, биологически активных веществ. В зависимости от качественного состава выделяют следующие виды экссудатов:
Эмиграция - выход форменных элементов белой крови за пределы сосудистого русла в очаг воспаления. Последовательность выхода лейкоцитов в зону воспаления получила название закона И. И. Мечникова, согласно которому через 1,5-2 часа с момента действия альтерирующего агента интенсивно эмигрируют нейтрофильные лейкоциты, которые выходят через поры между эндотелиальными клетками. Через 18-20 часов в зоне воспаления появляются моноциты, а затем лимфоциты, которые эмигрируют путем цигопемсиса и частично через поры между эндотелиальными клетками. При поражении тканей пародонта значительно усиливается эмиграция гранулоцитов и мононуклеаров не только в очаг воспаления, но и в ротовую полость. Выход форменных элементов в полость рта осуществляется через зубодесневой желобок из посткапиллярных венул маргинальной части десен и межзубных сосочков, расположенных непосредственно под эпителием [4, 5, 6, 7, 8].
Эмиграция лейкоцитов обусловлена, во-первых, действием хемоаттрактантов, обусловливающих развитие положительного хемотаксиса. В роли хемоаттрактантов могут выступать продукты специфических реакций в организме: компоненты комплемента (С3а, С5а, С567), лимфокины, цитофильные антитела, иммунные комплексы. В другую группу входят неспецифические эндогенные цитотаксины, выделяемые из поврежденных, инфицированных или активированных клеток, - калликреин, фибринопептид В, коллаген, лейкоэгрезин, цАМФ и др. Третью группу составляют экзогенные хемоаттрактанты, выделяющиеся в процессе жизнедеятельности различными микроорганизмами.
Миграции из кровотока и положительному хемотаксису лейкоцитов в полость рта способствует наличие мощных хемотаксических агентов бактериальных зубных бляшек.
Формирование в очаге воспаления положительного потенциала альтерации способствует эмиграции лейкоцитов под действием электрокинетических сил.
Выходу лейкоцитов способствует высокая проницаемость сосудов и процесс экссудации.
Эмигрировавшие элементы белой крови в зоне воспаления выполняют ряд функций. Нейтрофильные лейкоциты и моноциты обеспечивают фагоцитоз, являющийся одним из важнейших механизмов неспецифической резистентности организма. В то же время лейкоциты в зоне воспаления являются источником целого ряда бактерицидных факторов и биологически активных веществ - миелопероксидазы, лизоцима, лактоферрина, катионных белков, кининов, простагландинов, лизосомальных ферментов, хемотаксических факторов. Активные гранулоциты и моноциты продуцируют эндогенные пирогенные факторы, вызывающие развитие лихорадки, обеспечивающей реализацию комплекса защитно-приспособительных реакций в организме. Моноциты, относящиеся к категории макрофагов, принимают участие в инициировании иммунного ответа при воспалении, обеспечивая подготовку антигенов переработку их в иммуногенную форму. Таким образом, эмигрировавшие в зону воспаления моноциты принимают участие в специфических механизмах реагирования на действие патогенного фактора. Лимфоциты являются источником лимфокинов и принимают непосредственное участие в иммунологических механизмах защиты [2, 7, 8].
Исходом венозном гиперемии является развитие престаза и стаза - полной остановки кровотока в микроциркуляторном русле.
Пролиферация является завершающей фазой развития воспаления, обеспечивающей репаративную регенерацию тканей на месте очага альтерации. Процессу пролиферации предшествует формирование нейтрофильного и моноцитарного барьеров, фагоцитоз инфекционных возбудителей воспаления клеточного детрита. По периферии очага воспаления формируется фибробластический барьер, за счет которого зона воспаления инкапсулируется и возникает постоянная миграция клеточных и неклеточных элементов соединительной ткани и формирование соединительнотканного остова на месте первичной и вторичной альтерации. Одновременно в ряде тканей происходит размножение и органоспецифических элементов с последующим полным или частичным восстановлением структуры и функции поврежденной ткани [4, 5, 6, 7, 8].
Локальные расстройства кровоснабжения и обменных процессов в зоне воспаления, как правило, сочетаются с комплексом метаболических и функциональных расстройств на уровне целостного организма.
Синдром системного воспалительного ответа
Синдром системного воспалительного ответа - это комплекс цитокин-опосредованных системных морфологических, функциональных и биохимических изменений в организме, возникающих на фоне развития воспалительно-деструктивных процессов инфекционной, аллергической, онкологической, травматической природы, . стрессорного воздействия.
Основными признаками ССВО, помимо гормонального дисбаланса, являются: увеличение содержания в крови белков острой фазы, развитие лейкоцитоза более 12000 мкл, в тяжелых случаях возможна лейкопения - менее 4000 мкл.
Одновременно развивается температурная реакция выше 38 °С под влиянием провоспалительных цитокинов - вторичных эндопирогенов (ИЛ1, ИЛ6, ИЛ8, ФНОα, КСФ). Активация симпатоадреналовой системы приводит к развитию тахикардии, параллельно возникает тахипноэ.
Наиболее достоверным и хорошо изученным признаком острой фазы ответа является изменение белкового состава крови.
Белки острой фазы синтезируются главным образом в печени и делятся на две группы:
1. Позитивные маркеры (α1-антихемотрипсин, С-реактивный белок, фракция С3 комплемента, церулоплазмин, фибриноген, гаптоглобин, орозомукоид, плазминоген, антитромбин III), уровень которых возрастает.
2. Негативные маркеры (альбумин, трансферин), уровень которых снижается.
Уровень позитивных маркеров острой фазы нарастает в течение 24-48 часов после воздействия чрезвычайного альтерирующего фактора, причем в случае травматического повреждения степень увеличения позитивных маркеров в крови коррелирует с тяжестью повреждающего воздействия. При неосложненном течении патологии уровень позитивных маркеров острой фазы нормализуется в течение 72-96 часов. Однако в случае развития септических заболеваний, хронических воспалительных процессов, у больных с осложненным послеоперационным периодом уровень позитивных маркеров острой фазы длительное время может оставаться повышенным. В этих случаях большую прогностическую ценность представляет мониторинг позитивных маркеров острой фазы.
Наиболее чувствительным критерием системного действия на организм острой воспалительной реакции является возрастание концентрации в крови С-реактивного белка, в связи с чем наиболее распространен в клинической практике мониторинг С-реактивного белка. Последний является полипептидом с ММ 120 кД, обладает способностью связываться с полисахаридом С на поверхности одной из разновидностей стрептококка. Увеличение продукции С-реактивного белка печенью сочетается с последующим развитием комплекса системных реакций, в частности, индуцируемой этим белком активацией комплемента, подавлением функции тромбоцитов и лимфоцитов, торможением ретракции сгустка, стимуляцией фагоцитарной активности нейтрофилов.
Лекция №5. «Воспаление»
Воспаление - защитно-приспособительная реакция организма на действие патогенного раздражителя, проявляется на месте поврежденной ткани изменением кровообращения и повышением сосудистой проницаемости. Это типовой патологический процесс, направленный на устранение патологического раздражителя и восстановление поврежденной ткани. Мечников: воспаление - несовершенная защитная реакция организма, т. к. составляет основу большинства болезней, приводящих к смерти (воспаление печени - гепатит, почек - нефрит, легких - пневмония, ногтевого ложа - панариций, зева - ангина; старые названия).
Причины воспаления:
Возникновение, течение и исход воспаления зависят от реактивности организма, которая определяется возрастом, полом, состоянием физиологических систем, наличием сопутствующих заболеваний. Важное значение в возникновении, развитии и исходе воспаления имеет его локализация (крайне опасен для жизни абсцесс мозга или воспаление гортани при дифтерии).
· Нормергическое: ответная реакция организма на раздражение соответствует силе и характеру раздражителя.
· Гиперергическое: ответная реакция организма на раздражение интенсивнее действия раздражителя
· Гипергическое: воспалительные изменения выражены слабо или отсутствуют.
Стадии развития воспаления:
1. Альтерация клеток
2. Экссудация клеток
3. Пролиферация клеток
Все эти стадии присутствуют в зоне любого воспаления.
Альтерация - повреждение ткани - пусковой механизм развития воспалительного процесса. Она приводит к высвобождению биологически активных веществ - медиаторы воспаления. Все изменения, возникающие в очаге воспаления под влиянием этих веществ, направлены на развитие второй стадии воспаления. Медиаторы воспаления изменяют метаболизм, свойства и функции ткани. К ним относятся гистамин, серотонин, кинины (полипептиды плазмы крови). Они вызывают боль, расширение микрососудов, увеличение их проницаемости, активизируют фагоцитоз. Перестройка обмена веществ в зоне альтерации приводит к изменению физико - химических свойств ткани, и развитию в них ацидоза, что увеличивает проницаемость сосудов, распад белков, онкотическое и осмотическое давление. Это увеличивает выход воды из сосудов, обуславливая развитие экссудации и воспалительного отека.
Экссудация - выход из сосудов в ткань жидкой части крови, а также клеток крови. В результате альтерации развивается спазм артериол, и уменьшается приток артериальной крови (ишемия ткани в зоне воспаления). Это приводит к нарушению обмена веществ в ткани и к ацидозу. Спазм артериол сменяется их расширением, увеличивается скорость кровотока и объем притекающей крови. В очаге воспаления усиливается обмен веществ, увеличивается приток к нему лейкоцитов и антител. Увеличивается температура, и возникает покраснение участка воспаления (артериальная гиперемия). По мере развития воспаления она сменяется на венозную гиперемию. Объем крови в венулах и каппилярах увеличивается, скорость кровотока уменьшается, объем крови уменьшается, венулы становятся извитыми, в них появляются толчкообразные движения крови. Теряется тонус стенок венул, они тромбируются, сдавливаются отечной жидкостью. Уменьшение скорости кровотока способствует движению лейкоцитов из центра кровотока к его периферии. Они прилипают к стенкам сосудов - краевое стояние лейкоцитов. Оно предшествует их выходу из сосудов в ткань. Венозная гиперемия завершается остановкой крови. Лимфатические сосуды переполняются лимфой, лимфоток замедляется. Очаг воспаления изолируется от неповрежденной ткани. При этом кровь к нему поступает, а отток её замедляется, что препятствует распространению токсинов по организму. Венозная гиперемия является высшей точкой стадии экссудации. Ведущее значение в этой стадии имеет увеличение проницаемости микрососудов, развитие ацидоза и гипоксии. Накапливающаяся в очаге воспаления жидкость - экссудат. В нем содержится белок, глобулины и фибриноген, а также всегда содержатся форменные элементы крови, которые образуют воспалительный инфильтрат. Экссудация - ток жидкости из сосудов в ткань по направлению к центру очага воспаления, предупреждающая распространение патогенного раздражителя, способствующая поступлению в очаг воспаления лейкоцитов, антител и БАВ. В экссудате содержатся активные ферменты, действие которых направлено на уничтожение микробов, расплавление погибших клеток и тканей. Но вместе с тем экссудат может сдавливать нервные стволы и вызывать боль, нарушать функцию органов и тканей. Экссудация сопровождается иммиграцией лейкоцитов из сосудистого русла в ткань. Она включает период краевого стояния лейкоцитов у стенки сосуда, прохождение через стенку и период движения в ткани.
Механизм прохождения лейкоцитов: эндотелиоциты сосуда сокращаются, и в образовавшуюся щель лейкоцит выбрасывает часть цитоплазмы - псевдоподию, в результате лейкоцит оказывается под эндотелиоцитом. Преодолев базальную мембрану, он выходит за пределы сосуда и направляется к центру очага воспаления. Движению лейкоцитов способствует их отрицательный заряд, в то время, как в воспаленной ткани заряд всегда положительный.
И.И.Мечников разработал представление о хемотаксисе лейкоцитов, т.е. лейкоцит реагирует на химическое раздражение, исходящее из очага воспаления.
В 1882 году в России вышла работа Мечникова «О целебных силах организма», в которой было обосновано представление о фагоцитозе - процесс активного захватывания, поглощения и внутриклеточного переваривания живых и неживых частиц специальными клетками (фагоциты):
· Макрофаги (подвижные - клетки крови - моноциты; фиксированные - звездчатые эндотелиоциты в печени)
Макрофаги уничтожают возбудителей хронических инфекций, одноклеточные существа, животных - паразитов, измененные и погибшие клетки организма.
Стадии фагоцитоза:
1. приближение к объекту
2. прилипание объекта к оболочке фагоцита
3. погружение объекта в фагоцит
4. внутриклеточное переваривание объекта
В цитоплазме фагоцита вокруг объекта фагоцитоза образуется вакуоль - фагосома. К ней подходят лизосомы, и начинается процесс переваривания.
Виды фагоцитоза:
· завершенный (объект полностью уничтожается)
· незавершенный (объект не уничтожается, а быстро размножается в фагоците, который при этом погибает, а микроорганизмы разносятся кровью и лимфой). Это недостаточность фагоцита:
- наследственная (нарушение созревания фагоцитов).
- приобретенная (результат лучевой болезни, белкового голодания; в старческом возрасте).
3. Пролиферация - процесс размножения клеток, завершающая стадия воспаления. Размножаются клетки мезенхимы, сосудов, крови. В результате на месте очага воспаления восстанавливается ткань либо идентичная разрушенной, либо рубец, который может нарушать функцию органа (в пилорическом отделе желудка на месте язвы иногда образуется келоид, который препятствует эвакуации пищи в12 - перстную кишку).
Проявление воспалений:
· Местные
5. нарушение функций
Покраснение связано с развитием артериальной гиперемии (приток артериальной крови, содержащей оксигемоглобин ярко - красного цвета). Она же формирует и жар (местное повышение температуры). Припухлость возникает вследствие скопления экссудата, он давит на нервные стволы, вызывая боль. Она является результатом работы медиаторов воспаления. Нарушение функции воспаленного органа - это результат нарушения в нем метаболизма, кровообращения и нервной регуляции.
· Общие
Носят защитно - приспособительный характер: увеличивается число лейкоцитов, и изменяется лейкоцитарная формула. Часто возникает лихорадка, развивающаяся под влиянием пирогенов (выделяются нейтрофилами). Изменяется белковый состав крови (увеличивается количество a и b - глобулинов - острое воспаление; y - глобулинов - хроническое воспаление). Лейкоциты фагоцитируют и уничтожают микроорганизмы, повышенная температура тела активизирует лейкоциты и выработку антител. Увеличивается СОЕ (РОЕ), т.к. уменьшается заряд эритроцитов, их количество, но увеличивается количество альбуминов и глобулинов.
Воспаление - причины развития воспалительных реакций

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 19.07.2020
- Reading time: 2 минут чтения
Воспаление (лат. inflammatio) - это сложный процесс реакции организма на внешний или внутренний повреждающий (болезненный) фактор. Воспаление направлено на устранение этого фактора, восстановление поврежденных тканей и защиту от развития заболеваний.
Таким образом, воспаление выполняет защитную функцию в организме, но только тогда, когда оно острое. Хроническое воспаление перестает быть физиологическим фактором и становится патогеном, ведущим к аутоиммунным заболеваниям и раку.
Воспаление - это естественный процесс, который происходит на определенных этапах. Без воспалительной реакции, которая активирует иммунную систему для борьбы с патогеном, например, вирусом, бактериями, травмированными участками, мы не смогли бы пережить даже самую маленькую инфекцию.
Сложность воспалительного процесса отражается в часто используемых терминах - состояние, процесс или воспалительная реакция.
Симптомы воспаления
Симптомы острого воспаления были впервые описаны римским ученым и энциклопедистом Аврелием Цельсом (25 г. до н.э. - 50 г. н.э.). в единственной работе «Медицина», которая сохранилась до наших дней, он описал четыре основных симптома острого воспаления, которые иногда называют тетрадой Цельса:
- боль (лат. dolor);
- повышенная температура (лат. calor);
- покраснение (лат. rubor);
- отек (лат. tumor).
Пятый признак воспаления - потеря функции и повреждение органов (лат. Functiolaesa) был добавлен немного позже, возможно, греческим врачом и философом Галеном (129-200 н.э).
Покраснение кожи является результатом увеличения кровотока в области, пораженной патогенными микроорганизмами, отек - это результат проникновения белка и клеток из сосудов в ткани - все это вызывает боль. Температура также является следствием увеличения кровотока. В свою очередь, «потеря функции» означает, что орган не функционирует должным образом.
В развитии воспалительной реакции участвуют многие физиологические механизмы, связанные как с клетками - гранулоцитами, моноцитами, тромбоцитами, лимфоцитами Т и В, тучными клетками, эндотелиальными клетками кровеносных сосудов, макрофагами, фибробластами, так и с веществами, выделяемыми ими - медиаторами воспаления. Со временем могут быть поражены целые органы и могут возникнуть системные симптомы - повышение температуры тела, потеря веса, мышечная атрофия, чувство общей слабости.
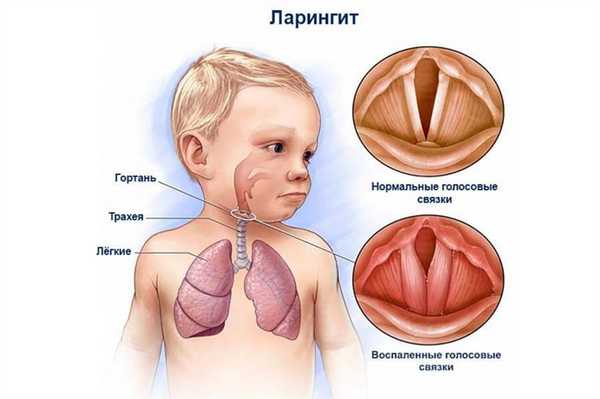
Воспаление при ларингите
Как возникает воспаление?
Чаще всего повреждающий фактор, который инициирует воспалительный процесс, приходит извне. Это может быть:
- физическое повреждение - химическое, тепло или холод, механическая травма;
- биологический агент - бактерии, вирус, чужеродный белок.
Также бывает, что причиной воспаления является процесс, происходящий внутри организма - эмболия артерии, сердечный приступ или развитие рака.
Изменения в кровеносных сосудах всегда являются корнем воспалительной реакции. Сосуды расширяются, и их проницаемость увеличивается. Это приводит к проникновению медиаторов и воспалительных клеток в окружающие ткани.

Составляющие воспаления
Острое воспаление выполняет важную защитную функцию - оно удаляет возбудителя и восстанавливает нормальную функцию органа. Переход острой фазы в хроническую фазу часто связан с потерей контроля организма над воспалительными механизмами и, следовательно, с функциональными нарушениями и даже повреждением пораженной ткани. Этот процесс можно сравнить с превращением острой боли (защитной функции) в хроническую боль, которая становится самой болезнью.
Патогенез воспалительного процесса
Воспалительная реакция неразрывно связана с иммунным ответом. Начинается с контакта патогена со специализированными клетками иммунной системы, так называемыми антигенпрезентирующие клетки. Когда клетки стимулируются, они продуцируют и высвобождают медиаторы воспаления, которые имеют решающее значение для инициации и поддержания воспалительного процесса.
Медиаторы оказывают про-и противовоспалительное действие на клетки-мишени, модулируя течение воспаления. Со временем адаптивная иммунная система (специфическая реакция) также участвует в борьбе с повреждающим фактором. Работа этой системы чрезвычайно точна - взаимодействие лимфоцитов Т и В приводит к выработке специфических антител, которые селективно нейтрализуют возбудителя.
Правильно функционирующая иммунная система эффективно распознает патогены и эффективно уничтожает их, не повреждая свои собственные клетки и ткани. Однако в определенных ситуациях иммунорегуляторные механизмы могут работать с дефектом - возникает воспалительная реакция на аутоантигены.
Это состояние встречается при многих аутоиммунных заболеваниях (диабет 1 типа, ревматоидный артрит, красная волчанка, целиакия, болезнь Хашимото).
Воспаление. Фагоцитоз. Асептическое и острое воспаление. Часть 7
Выпускник медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 25.11.2020
- Reading time: 4 минут чтения
Фагоцитоз - это способность определенных клеток (фагоцитов) удерживать и переваривать плотные частицы. Это явление было открыто И. Мечниковым.
Фагоцитоз осуществляется микрофагами (нейтрофилами) и системой мононуклеарных макрофагов.
Мононуклеарные макрофаги
Система (MMS) включает следующие элементы:
- промоноциты (костный мозг);
- моноциты (кровь);
- тканевые макрофаги;
- гистиоциты соединительной ткани;
- печеночные клетки Куппера;
- легочные альвеолярные макрофаги;
- свободные и фиксированные макрофаги лимфатической ткани;
- плевру и перитонеальные макрофаги.
Клетки мононуклеарной системы объединяет общее происхождение гемопоэтических клеток и саморегуляция.
Моноцитопоэз
Моноцитопоэз - это стимулирующий фактор колонии фибробластов и фактор роста макрофагов, но он же подавляет (отрицательная саморегуляция) интерферон фибробластов и лейкоцитов и т. д.
Процесс фагоцитоза делится на четыре стадии:
- Приближение.
- Адгезия.
- Оседание;
- Стадия пищеварения.
Фаза приближения
Фагоцит приближается к объекту - бактериям, мервому клеточному элементу, инородному объекту. При движении под действием хемотаксиса цитоплазма фагоцита образует удлинения (псевдоподии).
Адгезия
Способствует образованию аминополисахаридов на поверхности фагоцитов и перекрытию фагоцитарного объекта белками сыворотки, особенно иммуноглобулинами. Последний механизм по сути является опсонизацией - бактерии и поврежденные клетки перекрываются с IgM, IgG и компонентами комплемента (C3, C5 и др.), что облегчает адгезию к фагоциту.
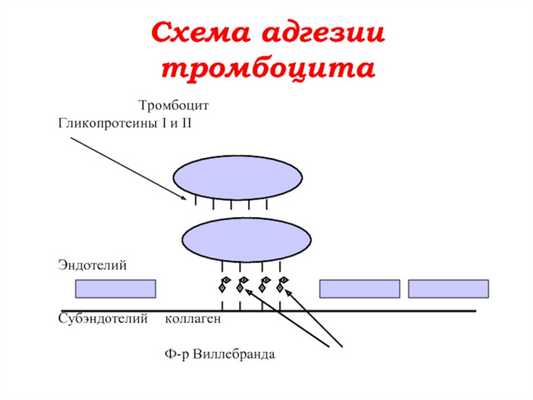
Адгезия
Поверхность фагоцита заряжена отрицательно, поэтому адгезия лучше, если объект, подлежащий фагоцитозу, заряжен положительно. Менее фагоцитарны отрицательно заряженные объекты, такие как опухолевые клетки.
Оседание
Этап фагоцитации объекта - путь инвагинации. Сначала фагоцит образует углубление, а затем фагосому - вакуоль, содержащую объект, подлежащий фагоцитозу. НАДН-зависимая оксидаза в мембране фагоцитов активируется до образования фагосом; в результате O2 превращается в O 2 ~ (супероксид-анион) и образуется H 2 O 2.
Эти продукты обладают бактерицидным действием, а также вызывают образование свободных радикалов. Под действием пероксидаз и каталаз H 2 O 2 расщепляется и высвобождается молекулярный O 2. Свободные радикалы и активный молекулярный O 2 действуют на мембрану фагоцита и объект, подлежащий фагоцитозу, активируя перекисное окисление липидов.
Липопероксиды и свободные радикалы неустойчивы к лизосомным мембранам и способствуют высвобождению лизосомальных ферментов.
Стадия пищеварения
Лизосомы присоединяются к фагосоме, содержащей фагоцитарный объект. Эти органеллы содержат все ферменты, необходимые для расщепления углеводов, белков, жиров и нуклеиновых кислот. В еще неактивной форме они попадают в вакуоль фагоцитов.
Пищеварительная вакуоль образуется при pH около 5,0, близком к оптимальному для лизосомальных ферментов. Активируются лизосомальные ферменты, и фагоцитарный объект постепенно переваривается. Во время стадии пищеварения проницаемость мембраны фагосомы увеличивается, содержимое фагосомы ускользает в цитоплазму, и микрофаг умирает (этому процессу способствует ацидоз). В этом случае фагоцитарный микроорганизм также может сохранять жизнеспособность.
Роль макрофагов в воспалительном процессе
Макрофаги начинают участвовать в фагоцитозе позже микрофагов. Макрофаги также более устойчивы к гипоксии и ацидозу, например, моноциты жизнеспособны даже при pH 5,5.
В очаге воспаления макрофаги выполняют несколько функций:
- Фагоцитируют бактериальные остатки, оставшиеся после эвакуации гноя и продуктов распада тканей - очищающая функция;
- Высвобождают лизосомальные ферменты - гиалуронидазу, аминопептидазу и др;
- Синтезируют компоненты системы комплемента и простагландины.
В то же время воспаленная тканевая среда также стимулирует образование фибробластов и фиброцитов. Постепенно появляется новая, богатая сосудами грануляционная ткань.
Фагоцитоз стимулируется продуктами повреждения тканей - внутриклеточные белки, ферменты, полипептиды, аминокислоты, электролиты и т. д., биологически активными веществами, половыми гормонами, тироксином, адреналином, лихорадкой. Но подавляется недостатком стимулирующих факторов, глюкокортикоидов, гликолортикоидов, ацетилхолина, ацетилхолина.
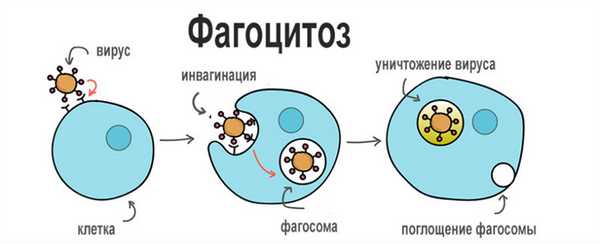
Фагоцитоз
Считается, что клетки плаценты и злокачественные опухоли способны секретировать вещество, которое подавляет функцию макрофагов, иммунологические реакции лимфоцитов и эмиграцию лейкоцитов, что приводит к значительному ослаблению или даже прекращению воспаления.
Объекты, которые фагоциты не могут переваривать, остаются в этих клетках в течение длительного времени и покрываются тонкой пленкой аминополисахаридов. После гибели фагоцитов они повторно фагоцитируются или выводятся из организма. Процесс, при котором фагоцит после переваривания высвобождает часть продуктов своего фагоцитоза в окружающую среду, называется экструзией.
Фагоцитоз - не единственный в организме механизм борьбы с воспалением. Большинство микроорганизмов погибают в условиях ацидоза, а также от ферментов, высвобождаемых во время гибели клеток и функционирования иммунокомпетентной системы.
Нейтрофилы во внеклеточном пространстве секретируют катионные белки, которые могут убивать ферменты без ферментов и фагоцитоза. Таким образом, воспалительные очаги постепенно избавляются от микроорганизмов и мертвых клеток.
Асептическое и острое воспаление
Дальнейшее течение воспаления зависит от того, является ли воспаление асептическим или бактериальным.
В асептических воспалительных условиях, например, вокруг хирургического шва, инородного тела, стенка микрофагов (нейтрофилов) начинает формироваться в течение нескольких часов, достигая максимума в течение дня.
Позже появляется следующий вал макрофагов, который достигает максимума через 2-3 раза. в день. Эмигрировавшие лейкоциты постепенно становятся неподвижными, больше не могут делиться и погибают в течение 3-5 дней. 2-3. на 5 сутки начинает формироваться стенка фибробластов, а на 5 сутки - соединительнотканная капсула.
Таким образом, в случае острого воспаления патогенный агент в организме преобразует белки, которые участвуют в реакции антиген-антитело, медиаторы и модуляторы воспаления, систему фагоцитов и миграцию клеток. В результате заканчивается острое воспаление. Однако, если инфекционные агенты попадают в участок асептического воспаления, например, в результате травмы, это воспаление становится септическим (бактериальным) воспалением.
Бактериальные воспалительные состояния бактерий и токсинов, не вызывающие гиперемии, экссудации и эмиграции лейкоцитов. Между клетками воспаленных тканей и особенно вокруг кровеносных сосудов накапливается все больше и больше микрофагов. Лизосомы микрофагов содержат множество активных ферментов, и эти клетки также начинают процесс фагоцитоза. При пальпации воспаленная ткань в это время кажется плотной, поэтому это называется стадией воспалительной инфильтрации.
По мере прогрессирования воспаления лейкоциты и те тканевые клетки, которые претерпели необратимые изменения во время воспаления, погибают. В этих клетках высвобождаются лизосомальные ферменты, которые расщепляют тканевые белки, белковые и липидные комплексы и другие структуры. Это стадия гнойного размягчения воспаления.
Эти стадии наблюдаются, например, у пациентов с гнойным воспалением перикарда (фурункул), гнойным воспалением апокринных потовых желез (гидраденит) и гнойным воспалением соединительной ткани (флегмона). При вдыхании воспаленная ткань выглядит мягкой, с характерным раскачиванием - флюктуацией. Образуется замкнутое скопление гноя - абсцесс.
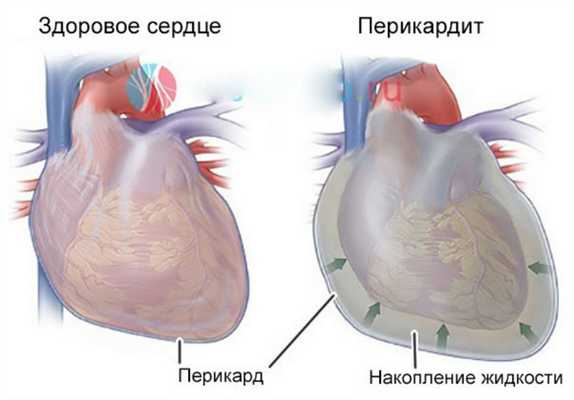
Гнойное воспаление перикарда
Гной разрывается в направлении наименьшего сопротивления (либо наружу, либо внутри тела). Если гной попадает в кровоток (пемия), в организме может развиться множество очагов гноя, но под действием микроорганизмов и токсических веществ - угрожающее общее заболевание (сепсис, септикопиемия). Поэтому важно диагностировать накопление гноя и обеспечить хирургический дренаж гноя наружу.
Читайте также:
