Защитная функция слизистой носа - иммунитет
Добавил пользователь Morpheus Обновлено: 22.01.2026
Пожалуй, не будет преувеличением сказать, что в 2021 году тема ОРВИ остается одной из самых обсуждаемых как среди специалистов, так и среди населения, а аптека - самым посещаемым учреждением. Респираторные заболевания сопровождаются воспалением верхних дыхательных путей, жаром, насморком, кашлем, чиханием, болью в горле, общим ухудшением самочувствия. Неосложненная инфекция при крепком иммунитете у взрослых как правило проходит за довольно короткий срок, однако у групп риска, в которые входят дети, пожилые, а также беременные женщины и лица с иммунодефицитом и хроническими заболеваниями, болезнь может осложняться и приводить к крайне нежелательным последствиям. Именно поэтому сегодня как никогда остро встает вопрос профилактики. В данной статье мы расскажем о местных иммуномодуляторах - средствах, поддерживающих иммунитет, разрешенных как детям, так и взрослым.
Как вирус попадает в организм
Выбор препаратов при ОРВИ
В современных методах лечения неосложненного ОРВИ и гриппа стараются избегать необоснованного использования антибиотиков, даже если заболевание в первую неделю- две сопровождается риносинуситом, конъюнктивитом, ларингитом, крупом, бронхитом.
Современные иммуномодуляторы
Выпуск различных форм фармакологических препаратов и их доступность подталкивает родителей к бесконтрольному применению таблеток и бальзамов для профилактики простудных заболеваний у детей. Пик активности обычно приходится на предэпидемический период и весь последующий эпидемический сезон. С целью повышения устойчивости организма к респираторным вирусам во время максимальной вероятности заразиться некоторые обращаются к сильнодействующим растительным препаратам иммуностимуляторам, таким как настойка эхинацеи, экстракт родиолы розовой. Их особенностью является неспецифическое действие, то есть, направленное на все без исключения звенья иммунитета. Грубо говоря, иммуностимуляторы «подстегивают» иммунитет, ускоряют процессы синтеза клеток и различных протективных молекул. В случае здорового организма у взрослого человека такая стимуляция, действительно, может помочь предотвратить развитие болезни. Иначе дела обстоят с группами риска, к которым относятся и дети. При выборе иммуномодулятора для ребенка следует учитывать существенные различия функционирования иммунной системы. Дело в том, что у детей по сравнению со взрослыми в несколько раз снижено производство интерферонов. Период до семи лет характеризуется «физиологической» иммунной недостаточностью, слабой активностью натуральных киллеров и фагоцитов. Организм ребенка неоднократно перестраивается, только до 7 лет - 4 раза. Также у малыша могут присутствовать скрытые хронические инфекции, дополнительно подрывающие защитные силы. До назначения каких-либо лекарств будет правильным установить уровень иммуноглобулинов, провести необходимые аллерготесты, получить консультацию специалистов: педиатра, иммунолога-аллерголога, отоларинголога. Однако иммуномодуляторы на основе интерферона способны точечно действовать на избранные звенья иммунитета, не вызывая привыкания и не стимулируя бесконтрольно иммунитет в целом. К хорошо известным препаратам на основе интерферона относятся препараты ВИФЕРОН, которые используются в клинической практике уже более 25 лет.
Иммуномодуляторы для носа
Понимание того, как «работает» мукозальный иммунитет легло в основу разработки новейших иммуномодуляторов, применяемых непосредственно в воротах инфекции - в носу, именно здесь зачастую происходит первая «встреча» клеток эпителия с вирусом. В рамках данной статьи стоит сказать о тех, действие которых неоднократно анализировалось в ходе испытаний среди различных групп людей. Так для сезонной профилактики ОРВИ по назначению врача взрослым и детям может быть рекомендован интерферон (с антиоксидантами) в виде геля [1]. Интерфероны являются важными факторами неспецифической резистентности организма человека к различным вирусам. К противовирусным препаратам с иммуномодулирующими свойствами относится, как уже говорилось выше, комплексный противовирусный препарат ВИФЕРОН Гель широкого спектра действия для детей и взрослых. Он обладает универсальным действием в отношении широкого спектра вирусов и других возбудителей заболеваний. Для профилактики Гель наносят в виде полоски длиной не более 0,5 см на предварительно подсушенную поверхность слизистой оболочки носа и/или на поверхность небных миндалин 2 раза в день 2 - 4 недели.

Местные иммуномодуляторы: мазь и гель
К местным иммуномодуляторам относятся две формы препарата ВИФЕРОН: Мазь и Гель. Мазь. Может применяться в составе интраназальной терапии различных заболеваний носоглотки. Так в статье «Клинико-иммунологическая эффективность местной интерферонотерапии при ОРВИ у детей» [2] описаны положительные эффекты от применения у детей от года до 14 лет, получавших ВИФЕРОН Мазь, в группе испытуемых по сравнению с плацебо бактериальные осложнения регистрировались в 2 раза реже. Группа ученых [3] отмечает положительные изменения показателей местного иммунитета у детей, снижение уровня провоспалительных цитокинов. Противовирусный эффект ВИФЕРОН Мазь у детей раннего возраста с ОРИ выражается как в элиминации вирусов из носоглотки, так и в снижении количества случаев присоединения «новых» вирусов. Отмечалось и положительное влияние на течение заболевания: уменьшение продолжительности катаральных симптомов, сухого кашля, ускорение его трансформации во влажный, сокращение сроков болезни. В количественных показателях эффект терапии можно описать следующим образом: «Сокращение продолжительности симптомов ОРВИ, в частности сухого кашля в 1,6 раз; трансформации сухого кашля во влажный в 1,4 раза, осиплости голоса в 1,3 раза.» [4]
Гель. Формула также содержит основное действующее вещество - интерферон альфа. Препарат применяется для лечения и профилактики гриппа и других острых респираторных заболеваний у детей и взрослых. Применение препарата ВИФЕРОН Гель с профилактической целью позволяет снизить заболеваемость ОРИ в 2,8 раза [5]. Особенностью гелевой структуры является то, что препарат в такой форме может оказывать пролонгированный эффект, не требуя частого обновления. Также у детей с ОРВИ при приеме ВИФЕРОН Геля сокращался период интоксикации в 1,3 раза, катаральных явлений в 1,4 раза, бронхообструктивносго синдрома в 2,2 раза. Внутрибольничное инфицирование у лиц, применявших ВИФЕРОН Гель, развивается в 2 раза реже [6].
Иммуномодуляторы для горла
В настоящее время растет доля микст-вирусных заболеваний, ассоциаций респираторных вирусов с герпесвирусами. Зачастую параллельно скрыто протекают такие инфекции как вирус Эпштейна-Бара, хламидийная инфекция, микоплазмы и проч. В таких случаях препарат выбора должен обладать неспецифическим (универсальным) противовирусным действием. Препараты широкого спектра действия как ВИФЕРОН Гель или Мазь могут применяться, не затягивая начало лечения, даже если нет возможности быстро провести верификацию возбудителя. Родители малышей часто сталкиваются с воспалением миндалин у детей. Видов ангины множество, как и способов лечения. Однако есть средство, которое может оказывать местный противовирусный эффект в независимости от возбудителя. ВИФЕРОН Гель можно наносить и на миндалины. Есть данные, по профилактике ОРВИ у детсадовских детей, получавших ВИФЕРОН Гель: число дней, пропущенных по болезни, оказалась в 1,5 раза меньше, а число эпизодов ОРВИ, перенесенных одним ребенком, почти в 2 раза ниже. При этом все перенесенные ОРВИ протекали в легкой форме [7].
Рекомендации Министерства Здравоохранения РФ
Министерство здравоохранения Российской Федерации за последние годы выпустило приказы, касающиеся стандартов лечения респираторных заболеваний у детей и взрослых. Так по рекомендациям официальной медицины в лечении гриппа средней тяжести при идентифицированном и неидентифицированном вирусе вне зависимости от осложнений; острых респираторных заболеваниях средней степени тяжести [8,9] в любом возрасте может применяться интерферон α2b в различных лекарственных формах, в том числе, в форме мази, суппозиториев и геля. Детям с легкой и средней степенью тяжести гриппа в амбулаторных условиях: Мазь и Гель в среднесуточной (ССД) дозе: 8 000МЕ (3-5 раз в день), на курс (СКД) 40 000МЕ (5 дней); Суппозитории ССД 300 000 (150 000 МЕ 2 раза в день); СКД: 1 500 000МЕ (5 дней) ii .
Нормализация слизистой оболочки полости носа как медико-социальная проблема
Наш организм может полноценно жить и развиваться лишь в том случае, если между ним и средой обитания постоянно происходит обмен веществ. Одной из важнейших форм связи организма с окружающей средой, не прерывающейся в течение всей жизни человека, является связь через дыхательную систему. Нос, являющийся начальным отделом дыхательного тракта, представляет собой мощный защитный барьер, информирующий центры о контакте с различными агентами внешней среды, осуществляющий кондиционирование вдыхаемого воздуха, задерживающий и обезвреживающий вещества, которые могут поступить в организм с воздухом [7].
Ведущая роль в защитной функции носа принадлежит слизистой оболочке, которая покрыта псевдомногослойным эпителием, состоящим из мерцательных, бокаловидных, а также коротких и длинных вставочных эпителиоцитов. Мерцательная клетка на своем свободном конце имеет многочисленные реснички.
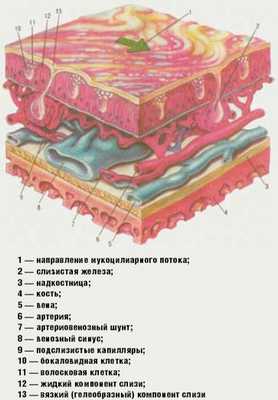 |
| Рис. Строение слизистой оболочки полости носа |
Реснитчатые клетки имеют по 250-300 ресничек длиной 7 и высотой 0,3 микрона. Каждая ресничка состоит из 9 пар микротрубочек, расположенных в виде кольца и окружающих две непарные центральные микротрубочки. Движение ресничек мерцательного эпителия слизистой оболочки носа осуществляется посредством скольжения микротрубочек. Движение ресничек строго направлено — от преддверия полости носа в сторону носоглотки. Мукоцилиарный клиренс обеспечивается назальным секретом. Источник секрета, покрывающего эпителий полости носа, — слизистые железы слизистой оболочки носа, бокаловидные клетки, транссудация из субэпителиальных капилляров, слезных желез, секрет специализированных Боумановых желез из ольфакторной зоны носа [7] (рис.).
Объем назальной секреции за 24 ч составляет от 100 мл до 1-2 л. Слизистая оболочка задних двух третей полости носа обновляется каждые 10-15 мин. Функция ресничек оптимальна при температуре 28-33 °C, достаточном количестве секрета с рН 5,5-6,5. Потеря влаги, понижение температуры до 7-10 °C, увеличение рН секрета более 6,5 вызывает прекращение колебания ресничек [8, 11].
Слизистая оболочка полости носа является первым барьером защиты дыхательных путей, поэтому на слизистой оболочке полости носа ежесекундно осаждаются тысячи микроорганизмов. Большинство из них являются представителями сапрофитной микрофлоры и не причиняют человеку никакого вреда, тогда как другие способны спровоцировать развитие инфекционного заболевания. При инфекционном рините размножение микробов на слизистой носа приводит к ее повреждению и отслаиванию верхней части эпителия. Этот процесс и объясняет все проявления насморка: чувство жжения в носу, истечение слизи (экссудата), заложенность носа, изменения голоса (гнусавость) и др. [9].
Ринит редко бывает самостоятельным заболеванием. Чаще всего насморк является симптомом какой-либо другой нозологической формы. Насморк наблюдается при различных ОРВИ или ОРЗ (грипп, парагрипп, аденовирусная инфекция, корь и др.). Острые респираторные заболевания являются наиболее распространенными в структуре инфекционных заболеваний. В России ежегодно регистрируется около 50 млн случаев инфекционных заболеваний, из них до 90% случаев приходится на острые респираторные вирусные инфекции. При патологии ЛОР-органов в первую очередь страдает слизистая оболочка с ее железистыми клетками.
Помимо инфекционных заболеваний, в индустриально развитых странах в настоящее время от 10% до 20% населения страдают острыми аллергическими заболеваниями. Кроме того, в патогенезе воспалительных заболеваний верхних дыхательных путей наряду с местным и общим воздействием возбудителя играют роль сенсибилизация организма и иммунологические сдвиги непосредственно в слизистой оболочке носа и околоносовых пазух [4].
Слизистая носа является той зоной, которая подвергается воздействию самых разнообразных инородных частиц. Молекулы аллергенов чрезвычайно быстро вызывают аллергическую реакцию, вследствие чего уже через минуту после проникновения аллергенов возникают чиханье, зуд в полости носа, ринорея [5, 6].
В качестве других этиологических факторов поражения слизистой оболочки могут быть неблагоприятная экология, профессиональные вредности, вредные привычки (табакокурение, наркомания). В городе, непосредственно у поверхности земли, обнаруживается наибольшая концентрация всех видов ксенобиотиков — свободно-радикальные соединения, канцерогены, соли тяжелых металлов, все виды аллергенов, ну и, конечно, патогенные микроорганизмы. Слизистая оболочка носа, полости рта и глотки находится в постоянном контакте с вдыхаемым воздухом и, таким образом, подвергается воздействию вредных факторов внешней среды, что приводит к ее отеку. В любом случае возникают условия, при которых слизистая носа легко инфицируется, реагируя появлением значительного отека [3].
Принимаемые при различных заболеваниях лекарственные препараты в качестве побочного действия часто дают субатрофию слизистой оболочки полости носа за счет системного действия, что особенно важно у представителей голосоречевых профессий в связи с наступающими изменениями в резонаторном тракте [1, 10].
При некоторых заболеваниях, например, при сахарном диабете, за счет нарушений в микроциркуляторном русле часто развиваются атрофические и субатрофические риниты. С учетом распространенности данного заболевания, в частности, в связи со снижением возраста впервые заболевших (трудоспособное население) проблемы увлажнения слизистой оболочки полости носа носят социальный характер.
Как показывают исследования, население планеты стареет, увеличивается средняя продолжительность жизни и соответственно возрастают требования к качеству жизни в данной группе населения. Известно, что со снижением уровня половых гормонов, обусловленных менопаузой у женщин и снижением функции половых желез у мужчин, вероятность развития субатрофических и атрофических процессов на коже и слизистых резко возрастает.
Таким образом, в нормализации функции слизистой оболочки полости носа ведущими направлениями терапии являются:
1) стимуляция кровообращения местного и общего, т. е. усиленное снабжение слизистой оболочки питательными веществами;
2) увлажнение слизистой оболочки носа и препятствование образованию корок;
3) борьба с местной патологической микрофлорой.
Таким принципам отвечают препараты топического действия, содержащие важнейшие микроэлементы, регулирующие реологические свойства слизи. Считается, что содержащиеся в изотоническом растворе микроэлементы, такие как Са, Fе, К, Мg, Сu, способствуют повышению двигательной активности ресничек, активизации репаративных процессов в клетках слизистой оболочки носа и нормализации функции ее желез [7]. Перечисленные микроэлементы содержатся в препаратах, которые готовят из морской воды, стерилизуя ее и доводя содержание солей до изотонической концентрации, и из воды минеральных источников, обладающей лечебными свойствами.
Известно, что морская вода очень полезна для человеческого организма, так как содержит много ценных микро- и макроэлементов. Морская вода активизирует все жизненные процессы организма, повышает его сопротивляемость к различным заболеваниям, она обладает местным антисептическим действием.
Целебные свойства морской воды:
- Промывание полости носа морской воды оказывает антибактериальное действие, смывая пыль, вирусы и бактерии.
- Полоскание горла теплой морской водой лечит заболевания горла и восстанавливает голосовые связки.
- Морские ванны и воздух стимулируют эндокриную систему.
- Морская вода ускоряет заживление ссадин и порезов благодаря содержанию большого количества солей и микроэлементов.
- Полоскание рта теплой морской водой укрепляет зубы и десны.
Одним из новых препаратов этой группы является Отривин Море [2], представляющий собой очищенный, деконтаминированный изотонический раствор океанической воды из Бретани, добываемой в экологически чистом районе Атлантического океана, богатой натуральными микроэлементами. Он содержит 18 минералов и микроэлементов.
Благодаря такому составу препарат Отривин Море идеально подходит для защиты слизистой оболочки носа от неблагоприятных условий города, а также для облегчения носового дыхания во время болезни. Отривин Море обеспечивает быструю элиминацию возбудителей и аллергенов, то есть многократно снижает их концентрацию и способствует механическому очищению поверхности слизистой оболочки носа. Помимо этого, Отривин Море стимулирует клетки мерцательного эпителия, способствует нормализации выработки слизи и ее разжижению, а также повышает местный иммунитет. Важным преимуществом препарата является отсутствие какого-либо системного действия на организм пациента, что крайне важно для людей, страдающих различными соматическими заболеваниями и опасающихся приема традиционных топических вазоконстрикторов из-за риска развития побочных эффектов. Кроме того, у пациента появляется возможность снизить дозировку других лекарственных средств, применяемых для комплексного лечения, и ускорить выздоровление.
Отривин Море можно использовать как в профилактических и лечебных целях, так и для ежедневной гигиены полости носа. Новинка не содержит консервантов и дополнительных химических ингредиентов. Основными показаниями для назначения препарата являются острый ринит (включая аллергический) и заложенность носа. При насморке и аллергии Отривин Море облегчает дыхание, деликатно очищая носовые ходы, а также оказывает антисептическое действие. Кроме того, средство можно использовать для гигиены полости носа перед применением других лекарственных препаратов. В целях профилактики возможно использование препарата Отривин Море в период эпидемий различных вирусных заболеваний, что препятствует развитию различных форм инфекционного процесса на слизистой носа. Препарат также может применяться с целью гигиены полости носа, эффективно очищая слизистую носа и бережно увлажняя ее. Натуральный состав Отривин Море не только обеспечит высокую безопасность проводимого лечения, но и позволяет применять препарат для промывания носа при аллергии.
Многие назальные спреи вызывают дискомфортные ощущения при их приеме, что связано с раздражением слизистой оболочки полости носа. Отривин Море в форме назального душа лишен данного побочного эффекта. Бережно промывая полость носа, препарат удаляет пыль, бактерии и секрет и предотвращает ее пересыхание, тем самым оберегая от раздражающего воздействия внешних факторов, что особенно важно людям, работающим в помещениях с чрезмерно сухим воздухом (например, там, где установлены кондиционеры или возле нагревательных приборов).
Большое значение имеет форма выпуска препарата. При использовании носовых капель большая часть введенного раствора стекает по дну полости носа в глотку. В этом случае не достигается необходимый лечебный эффект. В этом плане намного более выгодным выглядит назначение дозированных аэрозолей, так, особенностью препарата Отривин Море является выпуск в форме назального спрея.
Также Отривин Море можно использовать и для ежедневной гигиены полости носа. Эта процедура известна уже с древности и важна для нашего здоровья не менее, чем чистка зубов. В современном мире, в тесных и пыльных мегаполисах, ежедневное профилактическое промывание носа морской водой приобрело особую актуальность.
Для удобства пациентов Отривин Море выпускается во флакончиках оптимального объема — 50 и 100 мл, которые будут уместны и в домашней, и в дорожной аптечках. Кроме того, флакон Отривин Море снабжен универсальной насадкой, подходящей для всей семьи и может быть рекомендован детям с трехмесячного возраста. При этом распыляющий наконечник обеспечит аккуратное и равномерное увлажнение полости носа, а специальный клапан, защищающий лекарство от попадания в него микроорганизмов, гарантирует длительный срок использования после первого применения.
Таким образом, препарат Отривин Море является надежным средством, очищающим слизистую оболочку носа у взрослых и детей, восстанавливая ее физиологическую функцию, не вызывая при этом ее сухости и обладая стойким длительным эффектом, предотвращая тем самым развитие грозных осложнений и одновременно бережно воздействуя на ее структурные компоненты. Отривин Море может применяться как для лечения, так и для профилактики насморка, а также для защиты слизистой носа от раздражающего воздействия окружающей среды.
Литература
- Волошина И. А., Туровский А. Б. Ирригационная терапия атрофического ринита. С. 1906.
- Государственный реестр лекарственных средств. М.: МЗ РФ, 2008.
- Гуров А. А. Отек слизистой оболочки верхних дыхательных путей. Как с ним бороться? 1254 с.
- Карпова Е. П., Усеня Л. И. Топические деконгестанты для терапии воспалительных заболеваний полости носа и околоносовых пазух у детей. С. 18.
- Марков Г. И. Транспортная функция мерцательного эпителия слизистой оболочки полости носа при воспалительных заболеваниях // Вестник оториноларингологии. 1985. № 4. С. 36-37.
- Пальчун В. Т., Магомедов М. М., Лучихин Л. А. Оториноларингология. М.: Медицина. 2002. 576 с.
- Пискунов Г. З., Пискунов С. З. Клиническая ринология. М., 2002. 390 с.
- Плужников М. С., Шантуров А. Г., Лавренова Г. В., Носуля Е. В. Слизистая оболочка носа. Механизмы гомеостаза и гомокинеза. СПб. 1995. С. 5-18.
- Рязанцев С. В. Современные деконгестанты в комплексной терапии острых и хронических заболеваний ЛОР-органов // Российская оториноларингология. 2008, № 6 (19).
- Deitmer T., Scheffler R. The effect of different preparations of nasal decongestans in ciliary beat frequency in vitro // Rhinology. 1993; 31-151-3 (14).
- Satir P. How cillia move // Scientific American. 1974. Vol. 231. P. 45-46.
Н. Э. Бойкова, кандидат медицинских наук
Научно-клинический центр оториноларингологии Федерального медико-биологического агентства, Москва
Защитная функция слизистой носа - иммунитет
ГОУ ВПО "Башкирский государственный медицинский университет" Минздрава России
Иммунологические аспекты воспаления верхних дыхательных путей
Журнал: Вестник оториноларингологии. 2012;77(6): 23‑26
Азнабаева Л.Ф. Иммунологические аспекты воспаления верхних дыхательных путей. Вестник оториноларингологии. 2012;77(6):23‑26.
Aznabaeva LF. Immunological aspects of inflammation of the upper respiratory tract. Vestnik Oto-Rino-Laringologii. 2012;77(6):23‑26. (In Russ.).
Цель - исследование иммунологических аспектов воспаления слизистой оболочки верхних дыхательных путей. Установлены особенности адаптационных механизмов местного иммунитета слизистой оболочки верхних дыхательных путей в зависимости от локализации и остроты воспалительного процесса, что является основой для выбора направленной иммунокорригирующей терапии при хроническом воспалении и повышения корректности ее применения в отношении острого процесса.
Воспалительная патология верхних дыхательных путей в структуре заболеваемости занимает лидирующее положение. Так, острый ринит как проявление острых респираторных заболеваний отмечается у каждого третьего жителя Земли [1]. Болезни органов дыхания занимают первое место в общей структуре заболеваемости детей и взрослых и составляют 68—72%. За последние 20 лет, и особенно за последнее десятилетие, заболеваемость верхних дыхательных путей значительно возросла [2]. В настоящее время увеличение воспалительной патологии верхних дыхательных путей чаще всего связывают с нарушениями иммунной системы, в частности иммунной реактивности слизистой оболочки.
Слизистая оболочка верхних дыхательных путей является физиологическим барьером для различных патогенных агентов. Агрессивные свойства возбудителя могут реализоваться лишь при условии нарушения этих барьеров.
Барьерная функция слизистой оболочки дыхательных путей (в первую очередь носа, околоносовых пазух и глотки) определяется рядом иммунологических механизмов. Выделяют два барьера, которые тесно взаимосвязаны между собой: врожденный (неспецифический) — эпителиальные клетки, секрет, и адаптивный (иммунный) — макрофаги, фагоциты, лимфоциты, антитела и т.д.
На местном уровне защитные функции слизистой оболочки заключаются в предупреждении присоединения микроорганизмов к эпителиальному слою, выведении чужеродного материала из организма, разрушении патогена с последующей его элиминацией. В надэпителиальном слое защита представлена совокупностью мукоцилиарного клиренса, антител (секреторные иммуноглобулины класса А), фагоцитов (нейтрофилы) и различных ферментов. Проникновение патогена в подэпителиальный слой включает механизмы, направленные на отграничение участка с чужеродным материалом с последующим разрушением и выведением патогена из слизистой оболочки носа. Совокупность этих функций составляет понятие «местный иммунитет». Местный иммунитет представлен комплексом естественных защитных приспособлений, которые настолько совершенны, что вероятность заболевания при их нормальной работе минимальна [3].
В случаях недостаточного присутствия и активности факторов защиты на слизистой оболочке создаются условия для возникновения воспаления с сопутствующей ему индукцией воспалительных реакций иммунной защиты преимущественно на местном уровне, при необходимости — на системном. Поэтому болезнь и ее рецидивы служат индикатором различных иммунопатологических состояний.
Воспаление верхних дыхательных путей (ринит, синусит, тонзиллит, фарингит, ларингит) могут вызывать различные патогены: вирусы, микробы, грибы и их ассоциации. К условно-патогенным относятся грамположительные (стафилококки, стрептококки, пневмококки, энтерококки, коринебактерии, листерии и др.) и грамотрицательные бактерии (Haemophilus influenzae, Moraxella catarrhalis, Neisserie meningitiolis и др.). Эти микроорганизмы являются частью нормальной назофарингеальной флоры и у 5—70% людей их носительство не сопровождается какими-либо симптомами. Особую группу составляют внутриклеточные патогены. К ним относятся вирусы, хламидии, микоплазмы и др.[2].
Патогенные свойства микроорганизмы могут проявлять только при определенных условиях. Заболевание или его осложнение возникают тогда, когда нарушены локальные или системные механизмы защиты и возбудитель проникает в места, где в обычных условиях отсутствует (околоносовые пазухи, гортань, паратонзиллярная клетчатка).
Состояние иммунной системы играет важную роль в патогенезе острого воспаления, его рецидивов и хронизации. Инвазия патогена в эпителиальные клетки, репродукция вируса, размножение бактерий, инициация активности грибов возможны только в условиях снижения функциональной потенции периферических адаптивных систем. Тогда в иммунную защиту включаются факторы адаптивного иммунитета на системном уровне: происходит активация либо клеточного звена с образованием клона цитотоксических клеток против конкретного возбудителя (Th1-путь), либо гуморального с продукцией специфичных антител, в том числе и секреторных форм IgA (Th2-путь) [4].
Имеется неразрывная связь между факторами врожденного и адаптивного иммунитета. Для активации адаптивного иммунитета необходимы провоспалительные цитокины, которые синтезируются на раннем этапе иммунного ответа антигенпрезентирующими клетками (дендритные клетки, макрофаги и др.). Основным цитокином, обеспечивающим активацию иммунного ответа, является интерлейкин-1 (IL-1). В свою очередь факторы адаптивного иммунитета усиливают эффекты врожденного на несколько порядков, облегчая процессы фагоцитоза и антителозависимой цитотоксичности через привлечение в процесс белков системы комплемента [4].
Таким образом, развитие воспаления есть проявление недостаточности различных звеньев многоступенчатого барьера пограничных тканей.
На кафедре оториноларингологии БГМУ на протяжении тридцати лет проводятся исследования, посвященные иммунопатогенезу хронической воспалительной патологии верхних дыхательных путей и способам иммунокоррекции выявленных нарушений.
Приоритетное значение оценки состояния местного иммунитета слизистой оболочки имеют иммуноцитологический метод (данные цитограмм со слизистой оболочки) и количественное определение гуморальных факторов методом иммуноферментного анализа [4]. Предложен способ оценки резервных возможностей фагоцитов по данным цитограмм — незавершенный фагоцитоз (деструктированный нейтрофил во внеклеточном пространстве содержит в своей цитоплазме бактерии) [5]. В последнее время подобное состояние фагоцита описывается как внеклеточная нейтрофильная ловушка [6].
Установлено, что несмотря на общность формирования иммунной защиты на слизистой оболочке верхних дыхательных путей имеются особенности в зависимости от места локализации (нос, глотка, гортань). Так, на слизистой оболочке носа и ротоглотки ведущая роль защиты отводится нейтрофилам, секреторным антителам класса А и интерферонам [7, 8]. На слизистой оболочке гортани иммунная защита определяется прежде всего антителами, рекрутируемыми из кровеносного русла (IgG), и активной задействованностью в воспалительном ответе реагиновых антител (IgE) [9]. Полученные данные позволяют понять механизм гиперэргической настроенности слизистой оболочки гортани при воспалении, особенно у детей, иногда вплоть до выраженного отека гортани при атопическом варианте реагирования, когда приходится применять срочные лечебные мероприятия (гормональная терапия), а иногда даже и реанимационные.
Показаны этапы формирования местной иммунной защиты у новорожденных [10]. Установлено, что уже на 5-е сутки у детей на слизистой оболочке носа выявляются фагоциты (нейтрофилы) и антитела (IgE, IgM, sIgA, IgA и IgG). Однако отмечается сниженная функциональная способность нейтрофилов — способность к фагоцитозу выявлена лишь у 10% клеток и в большинстве (60—70%) в виде внеклеточных нейтрофильных ловушек. А антитела у здорового ребенка на слизистой оболочке носа выявляются в следовых количествах (sIgA — 1,06±0,42, мкг/мл).
К окончанию 1-го месяца жизни ребенка факторы врожденного иммунитета уже практически сформированы — способность к фагоцитозу увеличивается до 40% (у взрослых 36,8±4,7%) и большинство (до 70%) фагоцитов становятся функционально полноценными. В десятки раз увеличивается уровень секреторных антител, однако их концентрация по-прежнему очень мала (10,15±2,75 мкг/мл) и их количество достигает значений взрослых (239,2±64,6 мкг/мл) только к возрасту 5—7 лет. Исследования, посвященные регуляции иммунной системы на слизистой оболочке носа, свидетельствуют о наличии цитокиновой сети уже на 5-е сутки жизни ребенка [11]. Цитокины — межклеточные медиаторы, обеспечивают запуск и направленность иммунного ответа по Тh1-пути — противовирусный и Тh2 — противобактериальный. Установлено, что у новорожденных при воспалении формируется Тh1-путь иммунного ответа (превалирование продукции γ-интерферонов).
Следовательно, диагностическими маркерами этапов иммунного ответа в зависимости от антигенной респираторной нагрузки могут служить уровень IgE, активность внеклеточных пероксидаз и количество внеклеточных нейтрофильных ловушек на местном уровне. У практически здоровых лиц в ответ на антигенную нагрузку реагируют основные защитные антитела — увеличивается уровень sIgA и IgG и повышается количество фагоцитирующих нейтрофилов. Показатели местного иммунитета носа у больных с хроническим воспалением сопровождаются значительным повышением провоспалительных факторов — уровня IgE, активности внеклеточных пероксидаз и количества внеклеточных нейтрофильных ловушек.
В настоящее время показано, что основой адекватного иммунного ответа при воспалительной патологии является цитокиновая регуляция [12]. Постоянно существует цитокиновая сеть, состоящая из про- и противовоспалительных компонентов, обеспечивающих балансировку иммунной защиты. Для инициации воспалительного процесса необходимы цитокины (межклеточные медиаторы) провоспалительного характера, которые обеспечивают запуск иммунного ответа, его силу и направленность. Для завершения иммунного ответа повышается продукция противовоспалительных белков, которые блокируют эффекты иммунной защиты, переводя их в состояние толерантности. Показано, что хроническое гнойное воспаление сопровождается изменением продукции цитокинов семейства интерлейкин-1, а именно провоспалительного IL-1β и его рецепторного антагониста — IL-1Ra. Выявлено превалирование противовоспалительного цитокина IL-1Ra над IL-1β (либо за счет сниженной продукции IL-1β , либо за счет повышения продукции IL-1Ra) [13]. Установлены особенности клинических проявлений в зависимости от спектра цитокинов. Затяжное течение острого риносинусита характеризуется высокой продукцией IL-1Ra, тогда как рецидивирующий хронический риносинусит — низкой продукцией IL-1β. Установлена генетическая детерминированность продукции цитокинов — выявлена связь нарушения соотношения цитокинов с наличием мутации в полиморфных локусах +3953C>T и -511C>T гена IL-1β и VNTR-локуса гена IL-1RA.
Изучены особенности иммунного реагирования при хронической воспалительной патологии гортани [9]. Установлено, что хроническое воспаление слизистой оболочки гортани сопровождается активацией адаптивного иммунитета на местном уровне в виде увеличения продукции IgE и повышенного рекрутирования антител из кровеносного русла. Факторы, обеспечивающие первую линию защиты — фагоциты и sIgA — практически не меняются.
В связи с известной ролью лимфоидных органов, ассоциированных со слизистыми оболочками (MALT, небные миндалины и др.) в обеспечении местного иммунитета верхних дыхательных путей, представляется важным изучение иммунологической реактивности небных миндалин в норме и при различных патологических состояниях. Установлена роль небных миндалин при воспалительной патологии верхних дыхательных путей. Так, при гнойном воспалении носа и околоносовых пазух (риносинуситах) была выявлена выраженная активация лимфоцитов небных миндалин по Тh1-пути иммунного ответа (клеточный), обеспечивающая противовирусный иммунный ответ как на слизистой оболочке носа, так и в самих небных миндалинах.
Полученные данные позволили рассмотреть иммунопатогенез паратонзиллярного абсцесса с позиции вирусно-бактериальной ассоциированной инфекции, сопровождающейся дисбалансом звеньев иммунной защиты — гиперреактивностью в виде повышения концентрации IgE и недостаточностью Т-клеточного и гуморального (IgG).
Таким образом, установлены особенности адаптационных механизмов местного иммунитета слизистой оболочки верхних дыхательных путей в зависимости от локализации и остроты воспалительного процесса, что является основой для выбора направленной иммунокорригирующей терапии при хроническом воспалении и повышения корректности ее применения в отношении острого процесса.
Новые пути влияния на местные факторы защиты у детей с патологией лимфоглоточного кольца
За последнее десятилетие отмечено стремительное ухудшение состояния здоровья детей в России и рост хронической носоглоточной патологии. Хроническая носоглоточная инфекция среди часто болеющих детей достигает 50,5%.
За последнее десятилетие отмечено стремительное ухудшение состояния здоровья детей в России и рост хронической носоглоточной патологии. Хроническая носоглоточная инфекция среди часто болеющих детей достигает 50,5%. До настоящего времени отсутствует возрастной подход в стратегии лечебных программ по ведению детей с патологией лимфаденоидного кольца. Все это побудило нас подвергать более тщательному обследованию часто болеющих респираторными заболеваниями детей с патологией ЛОР-органов.
Глоточная миндалина является периферическим органом иммунной системы, обеспечивающим слизистые оболочки иммунокомпетентными клетками и контролирующим адекватность местного иммунного ответа, известного как мукозальный иммунитет [9]. Ведущая роль всего лимфатического глоточного кольца в создании иммунного барьера слизистых оболочек верхних дыхательных путей и в его регуляции диктует необходимость консервативной тактики лечения хронического аденоидита, особенно в период раннего детства. Аденоидные вегетации даже при самом тщательном их удалении остаются в толще свода носоглотки, что объясняется отсутствием капсулы. Аденотомия является инвазивным методом, ведет к иммунодепрессии местных факторов защиты слизистых оболочек верхних дыхательных путей. Воспаление глоточной миндалины не возникает изолированно и, как правило, сопровождается гипертрофией небных миндалин, хроническим тонзиллитом. Аденоиды, как и хронические аденоидиты, являются заболеванием всего организма. Увеличение глоточной миндалины напрямую связано c возрастающим экологическим неблагополучием среды обитания человека, увеличением иммунодефицитов с компенсаторным увеличением лимфоидных образований, нарастанием лимфотропной вирусной инфекции. При хроническом аденоидите, несмотря на воспаление, глоточная миндалина активно участвует в становлении иммунитета [9].
Целью настоящего исследования была оценка эффективности применения Полиоксидония у часто болеющих детей с патологией лимфоглоточного кольца.
Материалы и методы. Изучение эффективности применения Полиоксидония в лечении патологии лимфоглоточного кольца у детей проведено в период с 2009 г. по 2010 г. В 1-ю группу было включено 140 пациентов в возрасте 3-6 лет с хронической носоглоточной инфекцией (хронический аденоидит, гиперплазия глоточной миндалины II степени, сочетание хронического аденоидита и хронического тонзиллита). Все пациенты этой группы получали Полиоксидоний интраназально в дозе 0,15 мг/кг в сутки ежедневно в течение 10 дней. До лечения Полиоксидонием, а также на 10-й, 30-й и 105-й дни (3,5 месяца) после окончания приема препарата проводили мониторинг местных факторов защиты. Во вторую группу вошли 43 школьника с хронической носоглоточной инфекцией, которым назначали симптоматическую терапию, включавшую сосудосуживающие препараты (0,1% раствор Називина), промывание носоглотки изотоническим 0,9% раствором натрия хлорида. Группы были сопоставимы по полу, возрасту детей, этиологии, характеру воспаления и состоянию местных факторов защиты. Для сопоставления ряда показателей местного иммунитета слизистых оболочек верхних дыхательных путей обследовано 30 ЭБД. Контроль за эффективностью осуществляли по данным общеклинического обследования, динамического наблюдения отоларингологом, состоянию местных факторов защиты, назоцитограммам, результатам бактериологического посева со слизистой носа и зева. Для изучения местных факторов защиты применяли методы, исключающие необходимость взятия крови, которое негативно воспринимается родителями и детьми. Для получения назального секрета в каждую ноздрю ребенка закладывали по одному ватному тампону на 10 мин, затем тампоны помещали в стерильный флакон с физиологическим раствором. После центрифугирования флакона промывные воды замораживали. В назальном секрете и слюне определяли активность лизоцима (в процентах) нефелометрическим способом по методу В. Г. Дорофейчук. Концентрации секреторного IgA (sIgA), а также IgG и IgA определяли методом радиальной иммунной диффузии по Манчини и выражали в граммах на 1 л, проводили цитологическое исследование мазков-отпечатков со слизистой оболочки носа по методу Л. А. Матвеевой [6]. Статистическую обработку полученных данных осуществляли с использованием компьютерных программ общепринятыми методами по критерию Стьюдента.
Результаты и обсуждение
Как видно из табл. 1, применение Полиоксидония принципиально изменяет течение заболеваний носоглоточной области. Оценку эффективности терапии проводили по 4-балльной шкале: 3 балла — отличный эффект (нормализация дыхания через нос, нормализация размеров глоточной миндалины, отсутствие эпизодов аденоидита, обострений хронического тонзиллита); 2 балла — хороший эффект (нормализация дыхания через нос, уменьшение размеров глоточной и небных миндалин, отсутствие эпизодов аденоидита и обострений хронического тонзиллита); 1 балл — удовлетворительный эффект (нормализация дыхания через нос, уменьшение размеров глоточной и небных миндалин, один эпизод обострения хронического аденоидита, хронического тонзиллита за время наблюдения (3,5 месяца); 0 баллов — неудовлетворительный эффект (размеры глоточной и небных миндалин не изменились или увеличились, два и более эпизодов аденоидита или обострения хронического тонзиллита в течение 3,5 месяцев). На фоне применения препарата у 46% больных отмечены отличные результаты, у 39% — хорошие, у 15% — удовлетворительные. На фоне симптоматического лечения купировались явления ринита, но не изменялись размеры глоточной миндалины и показатели местного иммунитета, что позволило оценить результаты во 2-й группе как неудовлетворительные.
Особенностью эффекта препарата было улучшение самочувствия после закапывания в нос Полиоксидония с уменьшением головной боли и симптомов интоксикации. В первые 2 ± 3 суток нормализация носового дыхания сохранялась в течение 2 ± 3 часов после применения препарата. К 4-му дню лечения свободное дыхание через нос было постоянным.
На фоне приема Полиоксидония отмечена более благоприятная динамика клинических симптомов заболевания по сравнению с пациентами контрольной группы. Носовое дыхание нормализовалось у всех больных (в среднем через 4,25 ± 0,45 дня), в контрольной группе нормализации носового дыхания не произошло. Катаральные явления на фоне приема Полиоксидония продолжались 5,2 ± 0,75 дня. У детей контрольной группы гиперемия слизистой задней стенки глотки и мягкого неба наблюдалась в течение 10,3 ± 1,1 дня.
Оценка местных факторов защиты представлена согласно выделенным группам. В назоцитограммах детей с хронической носоглоточной инфекцией часть плоского эпителия, адсорбировавшего на себе микрофлору, составила 11,5 ± 2,3% от его общего числа, что достоверно превышало аналогичный показатель у ЭБД (4,95 ± 1,2%, p < 0,01) и подтверждало значительную микробную обсемененность у них верхних дыхательных путей (табл. 3).
При исследовании микробного пейзажа полости носа и глотки были отобраны эпизодически болеющие дети и дети дошкольного возраста с хронической носоглоточной инфекцией, которым проводилось лечение Полиоксидонием. Преобладающей флорой полости носа у детей с хроническими аденоидитами был S. aureus. Значительное количество стафилококка в полости носа у больных и ЭБД объясняется тем, что данный микроорганизм, являясь факультативным анаэробом, именно здесь находит подходящие условия своего существования. После лечения Полиоксидонием уменьшилось число носителей данного микроорганизма. У детей с хронической носоглоточной инфекцией из носа в большом количестве (35,7%) высевался бета-гемолитический стрептококк, что могло способствовать поддержанию воспалительного процесса в носоглотке. Присутствие в полости носоглотки бета-гемолитического стрептококка у 20% ЭБД создавало опасность его передачи от носителя к детям из группы часто болеющих. При бактериологическом анализе отделяемого, взятого из носа непосредственно после лечения Полиоксидонием и через один месяц, роста патогенной флоры практически не отмечалось, что подтверждало купирование воспалительного процесса в носоглоточной миндалине. У большого процента больных дошкольников высевался альфа-гемолитический стрептококк, который, по данным различных источников, относится к нормальной и облигатной микрофлоре носоглотки. В глотке у значительного количества детей с хроническими аденоидитами, хроническими тонзиллитами встречаются бета-гемолитические и альфа-гемолитические стрептококки. При бактериологическом анализе отделяемого из глотки после лечения Полиоксидонием роста патогенной флоры не обнаруживалось. На фоне симптоматического лечения микробный пейзаж носоглотки достоверно не изменялся. Отмечено, что у дошкольников с хронической патологией носоглотки богаче микробные ассоциации: у 30% детей из глотки высевались три микроорганизма (S. aureus, альфа-гемолитический и бета-гемолитический стрептококки), у 20% — два микроорганизма (S. aureus, альфа-гемолитический стрептококк). После лечения сочетание микробных ассоциаций в глотке приближалось к облигатной флоре. Из глотки у детей с хронической носоглоточной инфекцией высевались грибы Candida albicans (5%), которые не встречались у ЭБД и после лечения Полиоксидонием.
Таким образом, эндоназальное применение Полиоксидония ведет к активации неспецифических факторов защиты слизистых и улучшает состояние местного гуморального иммунитета. На фоне применения Полиоксидония отмечена нормализация состава микробного пейзажа носоглотки с исчезновением бета-гемолитического стрептококка. Полиоксидоний благоприятно влиял на течение хронических воспалительных заболеваний лимфоэпителиального кольца. На фоне применения Полиоксидония уменьшились размеры гипертрофированной глоточной миндалины, снижались частота и тяжесть течения ОРВИ. Благоприятное влияние ПО на течение хронических воспалительных заболеваний носоглотки и состояние лимфоэпителиального кольца сохранялось при назначении препарата на фоне вирусных инфекций. Ни в одном из наблюдений ни общих, ни местных побочных реакций не отмечено. Предложенный органосохраняющий метод тонзиллярной болезни с помощью иммуномодулятора Полиоксидония соответствует современным представлениям о важных функциях лимфаденоидного кольца.
- Матвеева Л. А. Местная защита респираторного тракта у детей. Томск, 1993.
- Петров Р. В., Хаитов Р. М., Некрасов А. В., Пинегин Б. В. Полиоксидоний: современные представления о механизме действия // Аллергология и иммунология. 2000, т. 1, № 2, с. 17.
- Пинегин Б. В. Отечественный иммуномодулятор «Полиоксидоний»: механизм действия и клиническое применение. М., 2000.
- Вавилова В. П., Перевощикова Н. К., Добряк Т. А. Стратегия иммунореабилитации детей с хронической патологией лимфоглоточного кольца. Материалы X Национального конгресса по болезням органов дыхания. СПб., 2000. С. 190.
- Вавилова В. П., Перевощикова Н. К., Ризо А. А., Вакулова Т. М., Нечаева И. А. Возможности профилактики гиперплазии глоточной миндалины у дошкольников. XII Национальный конгресс по болезням органов дыхания, М., 2002. С. 198.
- Вавилова В. П. Современные технологии в программе реабилитации патологии лимфоглоточного кольца у часто болеющих респираторными заболеваниями детей // Вестник отоиноларингологии. 2003, № 4, с. 25-29.
- Вавилова В. П., Вавилов А. М., Нечаева И. А. Современные методы реабилитации детей с патологией лимфоглоточного кольца, часто болеющих острыми респираторными вирусными инфекциями // Российская оториноларингология. 2006, № 3 (22), с. 70-74.
- Вавилова В. П., Перевощикова Н. К., Кочемасова О. И., Нечаева И. А., Попова Е. И. Современный подход к реабилитации часто болеющих детей дошкольного возраста. Материалы Х конгресса педиатров России. М., 2005. С. 74.
- Bernstein J. M. Mucosal immunology of the upper respiratory tract // Respiration. 1992, vol. 59, suppl. 3, p. 3-13.
В. П. Вавилова*, доктор медицинских наук, доцент
О. С. Чернюк***
Т. А. Караульнова**
Н. И. Тарасов*, доктор медицинских наук, профессор
*КМА, **МУЗ детская клиническая больница № 7, ***ООО «Клиника современных медицинских технологий», Кемерово
Коррекция местного иммунитета в ЛОР-практике

Н.Л. КУНЕЛЬСКАЯ, д.м.н., профессор, Г.Н. ИЗОТОВА, к.б.н., Ю.В. ЛУЧШЕВА, к.м.н., Г.Б. ШАДРИН, к.м.н., Научно-исследовательский клинический институт оториноларингологии им. Л.И. Свержевского Департамента здравоохранения г. Москвы
В последнее десятилетие практикующие ЛОР-врачи все чаще и чаще сталкиваются с нетипично затяжными, не поддающимися стандартным схемам лечения, с длительным периодом восстановления воспалительными заболеваниями ЛОР-органов. Сюда же относятся такие проблемы, как часто болеющие дети (рекуррентные респираторные инфекции у детей), а также более частая хронизация воспалительного процесса в околоносовых пазухах и полости носа («вечно сопливый нос»), глотке (хронический тонзиллит, фарингит) у взрослых.
На амбулаторном приеме теперь редко можно увидеть здоровые небные миндалины, если они не удалены. Все чаще мы констатируем факт «поломки» как системного, так и местного иммунитета. И это не удивительно в современном мире химических, радиационных, магнитных загрязнений экосферы. Сами «разумные» люди «подливают масло в огонь» -- упорно отравляют и себя, и окружающих табакокурением и другими «излишествами».
С другой стороны, все актуальнее становится проблема неэффективности местной и системной противомикробной терапии за счет поливалентной антибиотикорезистентности, невозможности создания новых формул антибактериальных, притивогрибковых, противовирусных препаратов. Поэтому мы вынуждены обращаться к внутренним силам организма пациента, т. е. к факторам саморегуляции иммунитета, функции покровного эпителия и др.
Инфекционное воспаление -- это защитная реакция, развивающаяся в ответ на повреждение ткани, вызванное инфекцией: бактериями, вирусами, грибами или простейшими. Цель реакции -- закрыть возникшее повреждение, уничтожить инфекцию, удалить разрушенные клетки, заменить поврежденную ткань новой, а если это невозможно, то хотя бы соединительной тканью. На всех стадиях воспалительной реакции решающую роль играет система иммунитета. В здоровом организме воспаление успешно завершается в течение 7--15 дней. Успех означает полную победу организма над вторгшейся инфекцией, восстановление поврежденной ткани. Такое воспаление называют острым. Оно должно завершиться выздоровлением.
В то же время широкое использование различных методов иммунодиагностики, приемов восстановления, а при необходимости и подавления иммунной системы в практическую клиническую медицину привело к тому, что не всегда обоснованно специалисты различного профиля стали использоваться высокоактивные фармакологические препараты, влияющие в той или иной степени на работу иммунной системы. Зачастую увлекшись звучанием слов «иммуномодуляция», «иммуностимуляция» или «иммунокоррекция», не зная ничего о клинико-иммунологических особенностях состояния своих пациентов, не контролируя состояние их иммунного статуса, не зная особенностей индивидуальной активности иммунной системы пациента, специалистами различного профиля вслепую назначаются курсы иммунотропной терапии. Некорректное применение такого вида лечения способно нанести непоправимый вред больному, например запустить тяжелый аутоиммунный процесс у лиц часто и длительно болеющих и имевших прежде минимальные клинические и иммунологические признаки нарушения аутоиммунитета. Есть опасность надолго «парализовать» продукцию собственных интерферонов, по существу, обезоружить больного, заблокировав его противовирусную и противоопухолевую защиту [12].
Достаточно распространенный фактор риска развития рекуррентных респираторных инфекций у детей, атопии у детей и взрослых, склонности к хронизации очагов воспаления -- это задержка созревания адаптивной иммунной системы в постнатальном периоде: неонатальные NK-клетки отличаются аномальной продукцией цитокинов, неонатальные дендритные клетки не обладают достаточной способностью к представлению антигенов Т-клеткам, незрелые Т-клетки имеют «неразборчивые» рецепторы, отвечающие на спектр пептидных сигналов, зрелые Т-клетки несут высокоспецифичные рецепторы к антигенам, неонатальные Т-клетки вместо того, чтобы превращаться в долгоживущие клетки памяти, подвергаются апоптозу, поэтому в течение первых 2-х лет жизни адаптивная иммунная система ребенка отличается преобладанием активности Th 2-го типа за счет активной супрессии Th 1-го звена. В результате высвобождаются ИЛ-4 и IgE -- реализуется деффектный противоинфекционный иммунный ответ, в то время как должны высвобождаться ИЛ-2 и ИФН-γ, а также IgM, IgG и IgA -- при эффективном иммунитете. [3].
Эпителиальный покров верхних дыхательных путей осуществляет задержку микробов и вирусов от проникновения. В условиях нормально функционирующей иммунной защиты при наличии зрелых факторов воспаления патологические изменения в эпителиальной выстилке завершаются восстановлением структурной целостности эпителия или формированием иммунной реакции и выработкой антител. При различных отклонениях в системе иммунного гомеостаза происходит формирование различных вариантов затяжного и хронического воспаления, при котором меняется структурная организация самого органа.
Важнейшим фактором неспецифической защиты в системе местного иммунитета является нормальная выработка слизи, которая механически затрудняет доступ микробов к клеткам эпителия верхних дыхательных путей. Ряд соединений, секретирующихся в составе слизи, например полисахариды, могут блокировать микробные рецепторы, ответственные за адгезию. Как известно, без адгезии микроба к эпителиальной клетке не может начаться инфекционный процесс. К неспецифическим факторам естественной резистентности относится выработка серозными железами таких бактерицидных веществ, как лактоферрин, лизоцим, способные лизировать клеточные стенки микробов. В осуществлении мукоцилиарного транспорта слизи определен¬ную роль играют клетки фагоцитарного ряда, осуществляющие фагоцитарное и контактное разрушение патогена.
Неспецифические факторы составляют первый «эшелон», который далее кооперируется со специфическими факторами защиты, а именно с антигенспецифическими реакциями лимфоидной ткани небных миндалин и лимфоидных образований на задней стенке глотки, глоточной, язычной и тубарных миндалин, что является отражением функционирования местного иммунитета. Важную роль в обеспечении неспецифической защиты играет также воспалительная реакция в месте внедрения возбудителя, сопровождающаяся миграцией воспалительных клеток в патологический очаг и образованием различных воспалительных медиаторов [6].
Ведущим звеном в реализации местного иммунитета являются секреторные антитела, т. е. специфические иммуноглобулины классов А и М, сцепленные с секреторным компонентом -- гликопротеином, который секретируют клетки респираторного эпителия. Доказано, что секреторные иммуноглобулины классов А и М имеют местное происхождение и являются совокупным продуктом клеток, входящих в состав слизистой оболочки, а именно: местных эпителиальных клеток, бокаловидных клеток респираторного эпителия и плазматических клеток собственной пластинки.
Секреторный иммуноглобулин класса А отличается от циркулирующих в крови иммуноглобулинов того же класса присутствием секреторного компонента (SC) и j-пептида. Основная функция j-пептида заключается в связывании мономерных молекул IgA в димеры и полимеры. Кроме того, SC-пептид защи¬щает молекулу иммуноглобулина А от протеолитической дегра¬дации, т. е. от литического действия местной микробной флоры.
Секреторные антитела -- sIgA и sIgM образуют пер¬вую линию иммунологической защиты слизистой оболочки лимфатических скоплений, входящих в кольцо Вальдейера-Пирогова [8]. Их биологическая функция заключается в инактивировании, связывании антигенов путем блокады соответ¬ствующих поверхностных рецепторов бактерий. Другим предпо¬лагаемым механизмом, связанным с sIgA независимо от компле¬мента, является его способность ускорять фагоцитоз.
Экологическая ниша, какой является слизистая оболочка, покрывающая верхние дыхательные пути, имеет специфические особенности. Микроорганиз¬мы могут проникать сюда беспрепятственно, поэтому здесь имеются сложные ассоциации сожительствующих микробов, образующие биопленки, имеющие поливалентную устойчивость к антибактериальным, антимикотическим и противовирусным препаратам.
Существуют и естественные факторы защиты от патогенов. Таковыми являются целостные, нормально функционирующие пограничные ткани -- слизистая оболочка, а также наличие представителей нормальной микрофлоры -- основных антагонистов патогенной микрофлоры (колонизационный иммунитет) [9].
Принимая во внимание все хитросплетение системного и местного иммунитета, крайне оправдано применение таких иммуномодуляторов, как Полиоксидоний. Полиоксидоний создан в Государственном научном центре Института иммунологии МЗ РФ Петровым Р. В., Хаитовым Р.М., Некрасовым А.В., Атауллахановым Р.И., Пучковой Н.Г. и Ивановой А.С. Патент на препарат выдан в 1997 году [10]. Полиоксидоний обладает выраженной иммуномодулирующей активностью и, прежде всего, действует на систему врожденного иммунитета (факторы неспецифической защиты организма, доиммунные факторы резистентности к инфекциям): клетки моноцитарно-макрофагальной системы, нейтрофилы и естественные киллеры. При его воздействии регистрируется усиление продукции провоспалительных цитокинов, то есть цитокинов, продуцируемых преимущественно клетками моноцитарно-макрофагальной системы (ИЛ-1, ИЛ-6, фактора некроза опухоли-α -- ФНО-α и интерферонов) [11, 12, 13, 16, 19]. Препарат активирует синтез указанных цитокинов только при исходно низких или средних уровнях, в то время как при исходно повышенных уровнях не оказывает влияния или даже несколько снижает продукцию цитокинов. Наряду с активацией клеток моноцитарно-макрофагального ряда и естественных киллеров происходит усиление функциональной активности как клеточного, так и гуморального иммунитета. Одним из главных биологических свойств препарата является его способность стимулировать антиинфекционную резистентность организма. Полиоксидоний в 1,5--2 раза усиливает способность фагоцитов периферической крови нормальных доноров убивать S. аureus, и это усиление носит дозозависимый характер. Препарат обладает способностью активировать кислородонезависимые механизмы бактерицидности лейкоцитов [12]. Полиоксидоний подавляет образование внеклеточных, но стимулирует образование внутриклеточных активных форм кислорода, от которых зависит гибель бактерии в клетке. Ингибирование образования внеклеточных активных форм кислорода лейкоцитами можно рассматривать как положительный эффект этого иммуномодулятора, так как их избыточное образование лежит в основе повреждающего действия активированных нейтрофилов на различные ткани и органы. В конечном итоге под действием Полиоксидония активируется вся иммунная система организма. Данная активация аналогична формированию иммунной реакции в ответ на антигенный (патогенный) фактор [4].
Помимо иммуномодулирующего эффекта полиоксидоний обладает детоксицирующими, антиоксидантными и мембранопротекторными свойствами, обусловленными его полимерной природой и рядом особенностей его химической структуры [1, 14, 15].
Исследования показывают, что Полиоксидоний можно назначать как после, так и перед приемом антибиотиков или противовирусных препаратов, но наиболее эффективно его назначение одновременно с этиотропными препаратами. В этом случае по возбудителю наносится «двойной» удар: антибиотик или другое химиотерапевтическое средство понижает функциональную активность микроба, а иммуномодулятор повышает функциональную активность фагоцитарных клеток, за счет чего достигается более эффективная элиминация возбудителя из организма [18].
Таким образом, Полиоксидоний обладает завидной универсальностью, его можно применять при любом заболевании, связанном с изменением иммунитета. Полиоксидоний можно применять в сочетании с любыми другими лекарственными средствами, начиная с 6 месяцев жизни. Полиоксидоний входит в перечень ЖНВЛП, признан ВОЗ (Всемирной организацией здравоохранения).
Р.М. Хаитов с соавт. [15] считают, что основным критерием для назначения любого иммуномодулятора является клиническая картина заболевания, проявляющаяся в наличии хронического инфекционного воспалительного процесса, трудно поддающегося адекватному антиинфекционному лечению.
Учитывая особенности строения слизистой ротоглотки, а также процессы активации и миграции лимфоцитов в организме, целесообразным является включение иммуномодуляторов местного действия, в частности сублингвальных таблеток Полиоксидония, в комплексную терапию хронических ЛОР-болезней.
При сублингвальном применении Полиоксидоний активирует лимфоидные клетки, находящиеся в бронхах, носовой полости, евстахиевых трубах, т. е. в тех областях, которые являются входными воротами для любой инфекции из окружающей среды, следствием чего является повышение устойчивости этих органов к инфекционным агентам.
В России проведен целый ряд исследований по топическому применению Полиоксидония в виде эндоназальных вливаний (В. П. Вавилова с соавт. (2002 г.) [2], сублингвального применения препарата при хроническом тонзиллите и фарингите, хроническом среднем отите (Гришина Т.И. с соавт.) [5].
Все исследования доказывают безопасность применения Полиоксидония и высокую его эффективность.
После проведенного лечения отмечено улучшение клинического состояния пациентов, уменьшение гипертрофии глоточной миндалины, уменьшение бактериальной колонизации слизистой оболочки верхних дыхательных путей, нормализация показателей местного гуморального иммунитета, активация неспецифических факторов защиты слизистых (лизоцима), снижение частоты ОРВИ, уменьшение тяжести их течения.
Установлено снижение в слюне практически до нормы показателей перекисного окисления липидов (липиды, перекиси), значительно снизилось количество метаболитов коллагена, характеризующих активность воспалительного процесса. Снизилась активность щелочной фосфатазы и фосфолипаз А и С, заметно уменьшилась активность лактатдегидрогеназы. Указанные изменения сочетались с достоверным снижением до нормы количества лактата и пирувата, а также с увеличением на 20-40% количества лизоцима и секреторного иммуноглобулина А в слюне.
Полиоксидоний® таблетки 12 мг применяется у взрослых и подростков старше 12 лет для лечения и профилактики инфекционно-воспалительных заболеваний (вирусной, бактериальной и грибковой этиологии), не поддающихся стандартной терапии. Полиоксидоний® используется как в стадии обострения, так и в стадии ремиссии в составе комплексной терапии:
• острых и хронических рецидивирующих инфекционно-воспалительных заболеваний ротоглотки, околоносовых пазух, верхних дыхательных путей, внутреннего и среднего уха;
• аллергических заболеваний, осложненных рецидивирующей бактериальной, грибковой и вирусной инфекцией (в том числе поллиноза, бронхиальной астмы);
• для реабилитации часто и длительно (более 4--5 раз в год) болеющих лиц;
в виде монотерапии:
• для профилактики рецидивирующей герпетической инфекции;
• для сезонной профилактики обострений хронических очагов инфекций ротоглотки, околоносовых пазух, верхних дыхательных путей, внутреннего и среднего уха;
• у иммунокомпрометированных лиц для профилактики гриппа и других острых респираторных инфекций в предэпидемический период;
• для коррекции вторичных иммунодефицитов, возникающих вследствие старения или воздействия неблагоприятных факторов.
Рекомендуемые схемы лечения
Сублингвально:
• При воспалительных процессах ротоглотки (бактериальной, вирусной и грибковой природы) -- по 1 таблетке 2 раза в день через 12 ч в течение 10--14 дней. При тяжелых формах герпетической и грибковой инфекции ротовой полости -- по 1 таблетке 3 раза в день через 8 ч в течение 15 дней.
• При хронических заболеваниях околоносовых пазух и хронических отитах -- по 1 таблетке 2 раза в день через 12 ч в течение 5--10 дней.
• При хроническом тонзиллите -- по 1 таблетке 3 раза в день через 8 ч в течение10--15 дней.
• При хронических заболеваниях верхних дыхательных путей -- взрослым по 2 таблетки 2 раза в день, подросткам по 1 таблетке 12 мг 2 раза в день через 12 ч в течение 10--14 дней.
• Для профилактики гриппа и острых респираторных инфекций - иммунокомпрометированным лицам, болеющим ОРЗ более 4-х раз в год, в предэпидемический период взрослым по 2 таблетки, подросткам по 1 таблетке 2 раза в день через 12 ч в течение 10-15 дней (Инструкция утверждена ФГК 28.11.01, протокол N17).
В целом Полиоксидоний является уникальным иммуномодулирующим препаратом, сочетающим в себе множество положительных качеств. Полиоксидоний занял достойное место в арсенале отечественных лекарственных средств и среди иммуномодуляторов бесспорно является препаратом первого выбора. Без сомнения, по мере широкого медицинского применения этого препарата клинические показания для его использования будут расширяться, будут уточняться схемы и дозы его назначения, но уже сегодня можно с уверенностью сказать, что применение Полиоксидония позволило существенно повысить эффективность лечения и профилактики ряда заболеваний, связанных с нарушениями иммунной системы [15].
Читайте также:
- Сомато-неврологические нарушения у глухих. Профилактика психических отклонений у тугоухих детей
- Показания к досрочному родоразрешению при гестозе. Выбор метода родоразрешения при гестозе.
- Антигены опухоли. Виды антигенов опухоли.
- Синдром Унны (Unna)
- Обызвествление при нарушении обмена. Подагра и ее особенности
