Аллерген для диагностики туберкулеза животных
Аллергическая диагностика. Основным методом прижизненной диагностики туберкулеза крупного рогатого скота является внутрикожная проба с ППД туберкулином для млекопитающих. В настоящее время туберкулин получают из культурального фильтрата микобактерий, выращенных на синтетической питательной среде, путем осаждения протеиновой фракции (PPD) трихлоруксусной кислотой и сульфатом аммония /А.С. Донченко, 1989; А.Н.Шаров, 1989; А.Х.Найманов, 1993; И.И.Румачик, 1993, 1997; Л.П.Ходун, 1997/.
Туберкулин, при внутрикожном введении, позволяет выявлять инфицированных животных задолго до появления других признаков заболевания. В тоже время эффективность метода во многом зависит от комплекса взаимосвязанных причин: степени распространения инфекции в стаде, характера течения туберкулеза, формы и вида персистирования микобактерий, от механизмов иммунного ответа, различия путей, доз и кратности инфицирования, времени года, физиологического состояния животных, их возраста.
В разных странах для аллергической диагностики туберкулеза крупного рогатого скота применяют дозы от 2000 до 10000 ME туберкулина для млекопитающих. Выбор дозы зависит от эпизоотической ситуации и иммунологической реактивности животных в конкретном регионе. Оптимальной считают такую дозу туберкулина, которая выявляет наибольшее число животных, зараженных возбудителем туберкулеза и минимальное количество здоровых особей или инфицированных атипичными микобактериями.
Существует мнение о том, что при уменьшении дозы туберкулина ниже 10000 МЕ, часть зараженных животных может не реагировать и остается в стаде, что растягивает сроки оздоровления. Однако в стадах с сильным распространением болезни туберкулин в дозе 10000МЕ одномоментно не выявляет всех инфицированных животных, а средняя чувствительность теста составляет 70-77%. Вместе с тем, регулярная туберкулинизация с интервалом в 30-60 дней позволяет выявить практически всех инфицированных и больных животных. Истинная анергия отмечается не более, чем у 3-4% больных коров.
В неблагополучных по туберкулезу хозяйствах допускается применение двукратной туберкулиновой пробы с целью максимального выявления реагирующих животных (гипердиагностика), которая ранее была обязательной при исследовании скота на туберкулез во всех категориях хозяйств. При учете реакций на первое введение через 72 часа нереагирующим животным повторно вводят туберкулин в той же дозе и в то же самое место и реакции учитывают через 24 часа.
Согласно рекомендаций (МЭБ, 1996), в странах ЕС доза туберкулина была снижена до 2000-2500 МЕ. Для Белоруссии, при улучшении эпизоотической ситуации, оптимальной дозой может быть 5000 МЕ, использование которой без существенного снижения чувствительности на 30-50% уменьшает число неспецифических реакций на туберкулин.
Аллергические реакции на туберкулин у животных могут быть обусловлены не только возбудителем туберкулеза, но и атипичными микобактериями. Обычно применяемая внутрикожная туберкулиновая проба не дает возможности дифференцировать парааллергические реакции у крупного рогатого скота. /А.С. Донченко, 1989; А.И.Завгородний, 1987; А.Н.Шаров, 1989; Ю.Я. Кассича, 1990; А.Х.Найманов, 1993; И.И.Румачик, 1993, 1997; Л.П.Ходун, 1997/.
Для прижизненной дифференциальной аллергической диагностики у животных и птиц применяется симультанная внутрикожная проба: введение туберкулина для млекопитающих как основного аллергена для выявления больных туберкулезом животных (у птиц - туберкулина для птиц), и другого аллергена (туберкулина для птиц, КАМа, других сенситинов), способного в большей степени выявлять особи, инфицированные другими (нетуберкулезными) видами микобактерий. Препараты вводят внутрикожно в симметричные участки шеи с разных сторон. Учет реакции проводят через 72 часа, сравнивая наличие и интенсивность реакций. При отсутствии в стаде туберкулезной инфекции интенсивность реакций у животных будет более выражена на КАМ или туберкулин для птиц, и, наоборот, - при наличии туберкулезной инфекции в стаде - на туберкулин для млекопитающих.
Для дифференциации парааллергических туберкулиновых реакций в ветеринарной практике уже давно используется симультанная проба с применением туберкулина для птиц. /Г.В.Чепик, 1980; И.И.Румачик, 1993, 1997/. Оценку результатов этой пробы проводится по количественному и качественному проявлению реакции на туберкулин как в целом по стаду, так и индивидуально по каждому животному. Животные, инфицированные возбудителем туберкулеза или атипичными микобактериями, реагируют на гомологичный туберкулин в большем количестве и интенсивнее. Преимущественное реагирование крупного рогатого скота только на ППД туберкулин для птиц (более 85%) и незначительное (до 15%) его реагирование на оба туберкулина, при более выраженной интенсивности реакций на туберкулин для птиц и отсутствие или наличии единично реагирующих животные только на ППД туберкулин для млекопитающих со слабо выраженными реакциями, давали основание для предварительного заключения об инфицированности скота данного стада атипичными микобактериями (возбудитель туберкулеза птичьего вида - M.avium -отнесен к III группе атипичных микобактерий по классификации Runyon (1959 г.).
И наоборот, если имеет место преимущественное реагирование скота на ППД туберкулин для млекопитающих, то можно предварительно судить об инфицированности (или заболевании) животных возбудителем туберкулеза (M.bovis или M.tuberculosis).
Если животные реагировали в одинаковой степени на оба туберкулина без какой-либо закономерности, то можно было предположить, что в стаде (на ферме) имеет место смешанная микобактериальная инфекция, т.е. инфицирование животных возбудителем туберкулеза бычьего или человечьего вида и одновременно атипичными микобактериями.
Комплексный аллерген из атипичных микобактерий (КАМ), разработанный и внедренный в практику в конце 70-х годов (А.Н.Шаров, 1979, 1980), получил широкое применение для дифференциальной диагностики туберкулеза крупного рогатого скота в симультанной аллергической пробе. Симультанную аллергическую пробу с КАМ проводят в соответствии с наставлением. Ее применение рекомендовано через 30-45 дней после первого (или второго) планово исследования при условии выделения реагирующих на туберкулин животных. Хотя в приложении к инструкции (1988 г.) указывается на возможность проведения первичного исследования поголовья сразу симультанно, если ранее постоянно выявлялись реагирующие на туберкулин животные, но бактериологическим исследованием материала от них, диагноз не был подтвержден, а были выделены атипичные микобактерии.
Проводимые сравнительные испытания эффективности ППД туберкулина для птиц и КАМ в симультанной аллергической пробе у крупного рогатого скота явного предпочтения одному из них не дали. Эти аллергены могут в одинаковой степени быть использованы для дифференциации туберкулиновых реакций у скота. Однако обе методики - как с КАМ, так и с туберкулином для птиц - не лишены недостатков.
При математическом анализе результатов симультанной пробы и оценки достоверности интенсивности реакций с КАМ не принимаются во внимание животные, реагирующие только на КАМ и с одинаковой интенсивностью реакций на оба аллергена; при использовании методики симультанной пробы с туберкулином для млекопитающих не учитывались реагирующие только на туберкулин для млекопитающих, только на туберкулин для птиц и реагирующие на оба туберкулина в одинаковой степени. Учитывались только животные, реагировавшие одновременно на оба туберкулина с разной интенсивностью реакций. Такой методический подход более правильный.
Для массовой аллергической диагностики предложен также "Туберкулин очищенный для млекопитающих" Разработанный препарат обладает целым рядом преимуществ, в том числе и по стоимости. "Туберкулин очищенный для млекопитающих" за счет очистки методом ультрафильтрации и высокой специфической активности на 30% дешевле ППД туберкулина. Апробация препарата более, чем на 10000 головах крупного рогатого скота в хозяйствах с разной эпизоотической ситуацией показала, что при равной специфичности с ППД туберкулином Курской биофабрики он обладает достоверно большей специфической активностью, то есть полнее выявляет больных животных в неблагополучном стаде /А.П.Лысенко, Т.Н.Агеева, Г.В.Карпова и др.1997; А.Н.Притыченко, 2002/.
Особенностью аллергической диагностики туберкулеза у свиней является то, что у этого вида животных до сих пор применяется введение одновременно (симультанно) двух аллергенов: ППД туберкулинов для млекопитающих и для птиц. А поскольку в республике туберкулез у свиней отсутствует, то, естественно животные реагируют, в основном, на туберкулин для птиц. Это создает много искусственно надуманных, ничем научно и практически необоснованных ситуаций. В инструкции и наставлении по туберкулезу животных много в этом плане противоречивых пунктов, хотя диагноз на туберкулез у свиней устанавливается на основании п.3.3. Следует в то же время отметить, что у крупного рогатого скота при инфицировании его атипичными микобактериями, в том числе и возбудителем туберкулеза птичьего вида, никаких ограничений не устанавливается (п. 6.6 инструкции), даже молоко от таких животных (стад) идет на общих основаниях.
Анализ научно-практической работы по туберкулезу свиней позволил нам сделать заключение о том, что этот вид животных достаточно исследовать на туберкулез аллергически только одним туберкулином для млекопитающих и это не приведет к ущербу в диагностике и профилактике туберкулеза.
Туберкулез – широко распространенное инфекционное заболевание человека и жи-вотных, вызываемое микобактериями туберкулезного комплекса (Mycobacterium tubercu-losis complex – MTBC). От больных туберкулезом животных могут заражаться люди, для них наиболее опасны Mycobacterium bovis (микобактерии туберкулеза бычьего). От лю-дей, больных туберкулезом, микобактериями туберкулеза человека – Mycobacterium tu-berculosis может заражаться крупный рогатый скот. Диагноз на туберкулез у крупного ро-гатого скота ставят на основании результатов аллергических, патолого-анатомических, гистологических и бактериологических исследований с учетом эпизоотологических данных и клинических признаков.
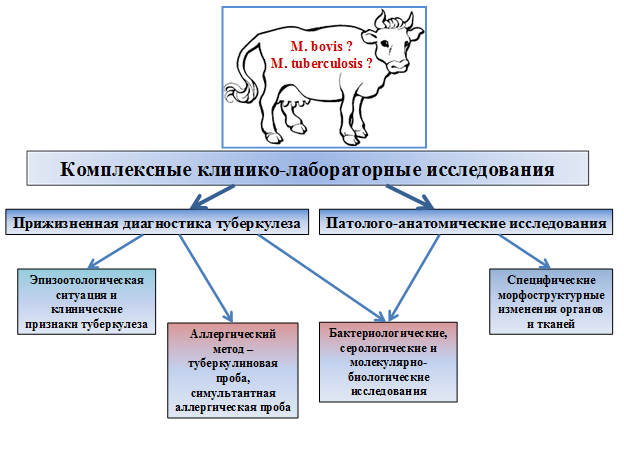
Рис. 1. Схема комплексных исследований крупного рогатого скота на туберкулез
Прижизненная диагностика туберкулеза у крупного рогатого скота проводится аллергическим методом.
Аллергический метод – внутрикожная туберкулиновая проба с применением Пурифиед Протеин Дериватив – туберкулина (ППД-туберкулин) для млекопитающих. Туберкулин вводят крупному рогатому скоту в середину шеи (рис. 2). Учет и оценку реакции на введение туберкулина проводят через 72 часа. Животных считают положительно реагирующими на туберкулин при утолщении кожной складки на 3 мм и более. Толщину кожной складки в месте введения туберкулина измеряют кутиметром, а полученный показатель сравнивают с толщиной кожной складки рядом с местом введения препарата [3, 4].

Рис. 2. Туберкулиновая проба у крупного рогатого скота [6]
Для дифференциации парааллергических реакций у крупного рогатого скота используется симультанная проба с одновременным применением двух туберкулинов – для млекопитающих и для птиц или туберкулина для млекопитающих и комплексного аллергена из атипичных микобактерий (КАМ).
Симультанная проба проводится в том же порядке, что и туберкулиновая (рис. 3). Проба является групповой и дает возможность оценить ситуацию по туберкулезу лишь в целом по стаду или по группе (не менее 6 голов) обследуемых животных. Под достоверностью различия понимают такое различие в величине показателей интенсивности реакций на туберкулин и КАМ, которое дает возможность с уверенностью не менее чем на 95 % сделать заключение о состоянии по туберкулезу обследуемой группы животных [3].
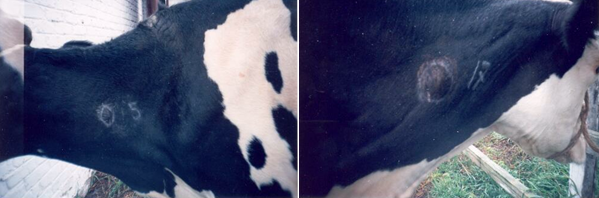
Рис. 3. Симультанная аллергическая проба с использованием ППД-туберкулина и комплексного аллергена из атипичных микобактерий [11]
Офтальмопроба на туберкулез (глазной метод туберкулинизации).
Туберкулин в количестве 3–5 капель наносится на конъюнктиву нижнего века или на поверхность роговицы глаза животного. Проводится офтальмопроба двукратно с 5–6-дневным интервалом [2, 4, 5]. Результаты офтальмопробы оценивают через 6, 9, 12 и 24 часа после первого и через 3, 6, 9 и 12 часов после повторного введения туберкулина. Реакция считается положительной, если образуется гнойный или слизисто-гнойный секрет, который накапливается в конъюнктивальном мешке или вытекает в виде шнура из внутреннего угла глаза. Кратковременная гиперемия слизистых оболочек глаза и слезотечение с образованием небольшого количества слизистого секрета рассматриваются как отрицательная реакция [3].
Факторы, обуславливающие проявление неспецифических реак-ций на туберкулин у КРС
В многочисленных исследованиях было показано, что проявления неспецифических реакций на туберкулин у крупного рогатого скота обусловлены многочисленными факторами внешней среды и индивидуальными особенностями организма животного [2, 3, 5]. Неспецифические реакции подразделяются на две основные группы: парааллергические и псевдоаллергические (см. таблицу).
Причины возникновения неспецифических реакций у крупного рогатого скота на введение туберкулина
| Неспецифическая реакция | Фактор, обуславливающий проявление неспецифической реакции | Особенности неспецифической реакции |
|---|---|---|
| Парааллергическая | Атипичные (нетуберкулезные) виды микобактерий и их ассоциации.
Mycobacterium tuberculosis (микобактерии туберкулеза человека). Mycobacterium avium (микобактерии туберкулеза птичьего) | Непостоянство реакции на туберкулин.
Сенсибилизация организма животного сохраняется от 1 до 3 месяцев после инфицирования [5]. Выявление наибольшего количества животных с выраженными реакциями на КАМ |
| Псевдоаллергическая | Наличие гельминтов (фасциол, дикроцелий, эхинококков). Актиномикоз. Микологические поражения легких. Гнойные или гнойно-некротические процессы во внутренних органах. Нарушения обмена веществ | В благополучных по туберкулезу стадах у отдельных животных регистрируется увеличение толщины кожной складки на месте введения туберкулина на 3–4 мм, признаки воспаления отсутствуют |
Лабораторные методы диагностики туберкулеза КРС
К лабораторным методам диагностики туберкулеза относятся бакте-риологическое исследование, серологическое исследование и молеку-лярно-биологическое исследование.
Бактериологическое исследование проводится с целью выделения возбудителя туберкулеза (рис. 4).
Отбор проб биоматериалов для бактериологического исследования производят как от животных с клиническими признаками туберкулеза, так и от животных, вызывающих подозрение на туберкулез. Исследуют молоко, мокроту, мочу. От павших и убитых животных для исследования отбирают пораженные участки органов на границе со здоровой тканью и измененные лимфатические уз-лы.
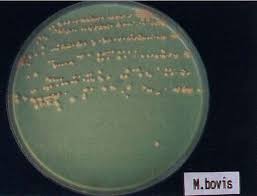
Рис. 4. Культура Mycobacterium bovis. Среда роста Гельберга [10]
При наличии характерных для туберкулеза изменений исследуются портальные, предлопаточные, надвыменные, поверхностные паховые лимфатические узлы и фрагменты внутренних органов – легких, печени, почек.
Бактериологическое исследование биоматериалов на туберкулез за-нимает срок до 3 месяцев. Заболевание животных туберкулезом считается установленным в случаях выделения микобактерий туберкулеза бычьего или человеческого из материала от убитых животных [3, 4, 8].
Серологическое исследование на туберкулез проводится в реакции связывания комплемента (РСК).
РСК применяется в двух вариантах:
1) для обнаружения в сыворотке больного животного специфических антител к возбудителю туберкулеза;
2) для выявления и идентификации в исследуемом материале антигена возбудителя туберкулеза.
Молекулярно-биологическое исследование на туберкулез.
Полимеразная цепная реакция (ПЦР) является одним из высокочувствительных и специфичных методов диагностики туберкулеза. Чувствительность метода ПЦР – от 10 до 100 микроорганизмов в пробе (чувствительность микроскопического метода – от 103 до 105 микроорганизмов). В основе метода лежит амплификация специфических участков ДНК возбудителя, которые содержатся в исследуемой пробе. В настоящее время в лабораторной практике применяются тест-системы как для выявления ДНК конкретного вида, так и для дифференцирования видов, входящих в Mycobacterium tuberculosis complex: микобактерий человеческого вида (M. tuberculosis), бычьего вида (M. bovis) и вакцинного штамма микобактерий бычьего вида (M. bovis BCG). Для проведения анализа используют следующие образцы биопроб от крупного рогатого скота: цельную кровь, молоко, фарингеальные смывы, мочу, фекалии, носовую слизь и биопсийные материалы, в том числе лимфатические узлы [3].
Молекулярно-биологическое исследование позволяет значительно ускорить раннюю диагностику туберкулеза, дифференцировать пара- и псевдоаллергические реакции на туберкулин, снизить количество подозреваемых в заражении туберкулезом и подвергаемых диагностическому убою животных [4, 5].
Патолого-анатомические исследования
Для убоя с диагностической целью отбирают животных по результатам вышеизложенных методов исследования.
Патолого-анатомические изменения в организме больного туберкулезом животного зависят как от его возраста, так и от стадии инфекционного процесса.
В начальных стадиях инфекционного процесса туберкулы имеют вид серых полупрозрачных узелков размером от булавочной головки до чечевичного зерна. Затем они становятся мутными, приобретают бело-желтый цвет, заполняются некротизированной сухой творожистой массой. В легких туберкулезные очаги поражения чаще выделяются над плеврой по тупому краю органа (рис. 5).
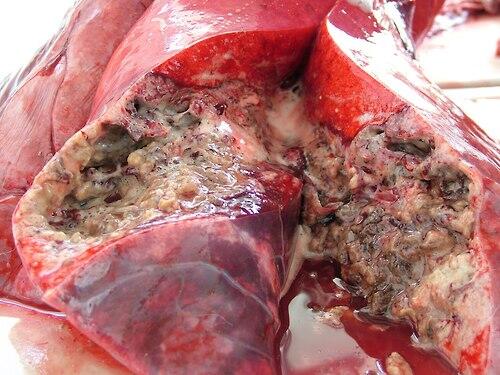
Рис. 5. Легкое крупного рогатого скота при туберкулезном поражении тканей [9]
Гистологические исследования проводят для дифференциации туберкулезных патолого-анатомических изменений от сходных изменений, наблюдаемых при других заболеваниях, например для дифференциации от гранулем паразитарного и микотического происхождения. В положительных случаях в гистологических препаратах, окрашенных по Цилю – Нильсену, находят гранулемы с некротизированным центром, окруженные зоной эпителоидных, отдельных гигантских лимфоидных клеток и соединительно-тканной капсулой.
Вместо заключения
Осуществление плановых профилактических диагностических иссле-дований на туберкулез способствует снижению риска инфицирования людей туберкулезом, ограничению распространения возбудителя из очагов инфекции, раннему выявлению неблагополучных по туберкулезу населенных пунктов.
А.Х. Найманов, доктор ветеринарных наук, профессор, заведующий лабораторией микобактериозов
Г.И. Устинова, кандидат биологических наук, ведущий научный сотрудник лаборатории биохимии и молекулярной биологии
Н.Г. Толстенко, кандидат ветеринарных наук, ведущий научный сотрудник лаборатории микобактериозов
Е.П. Вангели, кандидат биологических наук, ведущий научный сотрудник лаборатории микобактериозов
О.Д. Кучерук, кандидат ветеринарных наук, старший научный сотрудник лаборатории биохимии и молекулярной биологии
В.М. Калмыков, кандидат ветеринарных наук, старший научный сотрудник лаборатории микобактериозов
ФГБНУ Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. Я.Р.Коваленко (ВИЭВ)
109428, Российская Федерация, Москва, Рязанский проспект, 24, к.1
РЕЗЮМЕ
В целях совершенствования симультанной туберкулиновой пробы для дифференциации неспецифических реакций на туберкулин, изготовлены лабораторные серии двух комплексных аллергенов из нетуберкулезных микобактерий (НТМБ) КАМ-2 и КАМ-3. КАМ-2 изготовлен из наиболее часто выделяемых от реагирующих животных и обладающих наибольшими сенсибилизирующими свойствами атипичных микобактерий 2, 3 и 4 групп по классификации Раньена (M. scrofulaceum – 2 гр., M. intracellulare – 3 гр., M. smegmatis и M. fortuitum – 4 гр.). КАМ-3 изготовлен из 3-х основных видов микобактерий, входящих в состав ППД туберкулина для птиц, КАМ и КАМ-2 (M. scrofulaceum – 2 гр., M. avium – 3 гр. и M. fortuitum – 4 гр.).
При сравнительном изучении диагностической ценности лабораторных серий КАМ-2 и КАМ-3 с биофабричными КАМ и ППД туберкулином для птиц на сенсибилизированных различными видами микобактерий морских свинках, установлено, что КАМ-3 по биологической активности и специфичности превосходит все испытанные аллергены.
Ключевые слова: туберкулез, атипичные микобактерии, морские свинки, сенсибилизация, неспецифические реакции, ППД туберкулин для млекопитающих, ППД туберкулин для птиц, КАМ, КАМ-2, КАМ-3.
Материалы и методы
В лаборатории микобактериозов была выращена бакмасса культур различных видов микобактерий: M. bovis БЦЖ, M. avium, M. scrofulaceum, M. intracellulare, M. smegmatis и M. fortuitum. В лаборатории биохимии и молекулярной биологии из убитых автоклавированием культур изготовлены опытные лабораторные серии КАМ-2 и КАМ-3.
В Вышневолоцком отделе ВИЭВ провели сенсибилизацию 25 морских свинок взвесью культур различных видов микобактерий: M. bovis BCG – 5 голов, M. avium – 5 голов, M. intracellulare – 5 голов, M. scrofulaceum – 5 голов и M. fortuitum – 5 голов. Сенсибилизацию проводили двукратно с интервалом 14 дней между первым и вторым подкожным введением суспензии взвеси микобактерий на физиологическом растворе, в дозе 5 мг/мл.
Через месяц на сенсибилизированных морских свинках провели сравнительное изучение диагностической ценности опытных лабораторных серий аллергенов КАМ-2 и КАМ-3 в сравнении с биофабричными аналогами. При этом сенсибилизированных морских свинок исследовали: ППД туберкулином для млекопитающих, ППД туберкулином для птиц, КАМ, КАМ-2 и КАМ-3. Каждой морской свинке вводили внутрикожно в область брюшка, справа и слева, 5 аллергенов в соответствующей дозе. Учет результатов внутрикожной пробы проводили через 24 и 48 часов после введения аллергенов. Реагирующими считали животных при выявлении характерной припухлости и покраснения в месте внутрикожного введения аллергенов диаметром на 5 мм и больше. Результаты проведенных исследований представлены в таблице 1. 
Анализ данных таблицы 1 показывает, что из 5 сенсибилизированных M. bovis БЦЖ морских свинок – 2 пали в процессе опыта, остальные 3 реагировали с реакцией 8-20 мм на ППД туберкулин для млекопитающих, на ППД для птиц реагировала одна морская свинка с реакцией 5,5 мм, на КАМ реагировала одна морская свинка с реакцией 5,5 мм. На КАМ-2 и КАМ-3 сенсибилизированные M. bovis БЦЖ морские свинки не реагировали.
Из 5 сенсибилизированных M. avium морских свинок – 2 пали, а оставшиеся 3 дали положительные реакции на ППД для птиц, КАМ, КАМ-2 и КАМ-3. Причем реакции на КАМ-3 были более выражены, чем на другие аллергены (от 13,5 до 21,0 мм). На ППД для млекопитающих сенсибилизированные M. avium морские свинки не реагировали.
Из 5 сенсибилизированных M. intracellulare морских свинок, 2 –реагировали на ППД для млекопитающих, 3 – на ППД для птиц, 3 – на КАМ, все 5 реагировали положительно на КАМ-2 и КАМ-3. Причем реакции на КАМ-3 были выражены более интенсивно, чем на другие аллергены (от 10,0 до 17,0 мм).
Из 5 сенсибилизированных M. scrofulaceum морских свинок - одна пала, 4 реагировали на ППД для млекопитающих, 1 – на ППД для птиц, 3 – на КАМ, а на КАМ-2 и КАМ-3 реагировали все 4 морские свинки. Причем на КАМ-3 реакции были с наибольшей интенсивностью (от 13,0 до 19,5 мм).
Из 5 сенсибилизированных M. fortuitum морских свинок – одна пала, 2 реагировали на ППД для млекопитающих, 1 – на ППД для птиц, 2 – на КАМ, все 4 реагировали на КАМ-2 и КАМ-3. Причем на КАМ-3 реагировали с наибольшей интенсивностью реакций (от 12,0 до 14,0 мм).
Анализ результатов проведенных исследований показывает, что по активности и специфичности КАМ-3 превосходит все испытанные аллергены. Так, все сенсибилизированные M. bovis БЦЖ морские свинки не реагировали на КАМ-2 и КАМ-3. Морские свинки, сенсибилизированные M. avium и атипичными микобактериями, реагировали на ППД для птиц, КАМ, КАМ-2 и КАМ-3. Причем, интенсивность проявления аллергических реакций была в большей степени выражена на КАМ-3 (от 10,0 до 21,0 мм). Полученные результаты исследований доказывают, что КАМ-3 более активный и специфичный аллерген для дифференциации неспецифических реакций на туберкулин.
В настоящее время проводятся сравнительные испытания диагностической ценности биофабричного КАМ и опытных лабораторных серий КАМ-2 и КАМ-3 ВИЭВ в благополучных по туберкулезу хозяйствах РФ.
Выводы:
1. В связи с широким распространение во внешней среде и выделением от реагирующих животных с неспецифическими реакциями атипичных микобактерий, для дифференциации неспецифических реакций целесообразно использование симультанной пробы с ППД для млекопитающих и КАМ.
2. В связи с тем, что сенсибилизацию организма крупного рогатого скота вызывают НТМБ 2, 3 и 4 гр., следует готовить комплексный аллерген из микобактерий 2, 3 и 4 групп по классификации Раньона.
3. На сенсибилизированных различными видами НТМБ морских свинках КАМ-3 по активности и специфичности превосходит ППД туберкулин для птиц, КАМ и КАМ-2.

Туберкулез (Tuberculosis) — высококонтагиозное, хронически протекающее бактериальное заболевание, которому подвержены все виды теплокровных животных, дикие, домашние птицы. Относится к группе антропозоонозов. Представляет опасность для человека. Болезнь характеризуется образованием на коже, в различных внутренних органах специфических узелков (туберкул), которые подвергаются казеозному некрозу и обызвествлению. Туберкулезом болеют все возрастные группы с/х и домашних животных. Заболевание наносит большой экономический ущерб фермерским хозяйствам. Лечение не разработано, поэтому все силы в борьбе с туберкулезом нужно направить на профилактику.
Описание возбудителя
Туберкулез животных вызывают микобактерии (Mycobacterium tuberculosis), которые не только широкого распространены в окружающей среде, но и сохраняют свою активность длительный период времени при благоприятных условиях. Так, в почве они сохраняются до 2 лет, в воде — до 5 лет, в соленом мясе — до 18 месяцев, в сырах — 250 суток. В навозе сохраняют вирулентность до нескольких лет. Микобактерии быстро гибнут под воздействием высоких температур. При 75 градусах инактивируются в течение нескольких минут. При 100 градусах Цельсия микобактерии погибают мгновенно. Большинство сильнодействующих химических средств также губительно воздействуют на паразитов.

Микобактерии, вызывающие туберкулез, имеют вид продолговатых неподвижных согнутых под углом палочек, длина которых составляет от 0,5 до 8 нм. В мазках располагаются отдельными небольшими группами.
Микобактерии относятся к кислотоспиртоустойчивым строгим анаэробам, то есть их развитие происходит без доступа кислорода. Не образуют спор, капсул. Не имеют ресничек, жгутиков, других приспособлений для передвижения.
Инфекционное заболевание у животных вызывает несколько серотипов бактерий. Род микобактерий включает более 30 различных видов патогенных и непатогенных микроорганизмов. По морфологии, культуральным свойствам патогенные микобактерии всех видов во многом схожи между собой.
Важно! В природной среде помимо туберкулезных существуют также условно-патогенные атипичные, сапрофитные микобактерии. Животные, инфицированные ими, могут реагировать на туберкулин для млекопитающих, что вызывает определенные трудности при постановке диагноза, а именно при аллергической диагностике туберкулеза.
Видовую принадлежность туберкулеза определяют особенностью роста их на питательных культуральных средах, а также по степени патогенности отдельных видов возбудителя на лабораторных животных различных видов.
Туберкулезом болеют все виды домашних, диких, сельскохозяйственных животных, независимо от породной принадлежности, возраста. Болезнь имеет природно-очаговый характер. Микобактерии поражают кошек, собак, крупный рогатый скот, кроликов, овец, коз, пушных зверей, домашнюю птицу, грызунов. Дикие птицы менее восприимчивы к данной инфекции.
Так, туберкулез КРС провоцирует бычий вид (M. bovis). Бактерия, проникнув организм коровы, становится причиной развития серьезный системных, функциональных нарушений.
Также стоит отметить, что крупные рогатые с/х животные (КРС) заболевают при попадании в организм туберкулиновых палочек человеческого типа (Mycobacterium tuberculosis). При этом инфекция протекает с менее выраженной клинической симптоматикой.
Морфологическая и функциональная характеристика у обоих видов идентична. Бактерии анаэробны, формируют небольшие цепочки, реже представлены в виде отдельных особей. В замороженном мясе сохраняются более года.
Как происходит заражение животных
Заразиться туберкулезом домашние, дикие, сельскохозяйственные животные могут при непосредственном контакте и инфицированными особями, латентными бактерионосителями.
Микобактерии продолжительный период времени сохраняются в организме в виде £- форм. При этом зараженные особи часто остаются не выявленным источником возбудителя туберкулеза. При неблагоприятных условиях £-формы микобактерий могут реверсировать в классическую форму. Поэтому вирусоносители, у которых болезнь проявляется до определенного момента без явной клинической симптоматики, становятся потенциальной причиной возникновения туберкулеза.
Основными факторами передачи микобактерий являются:
- инфицированные корма, питьевая вода;
- пастбища, подстилка, навоз;
- предметы быта, инвентарь, одежда работников ферм.
Заражение молодняка крупного рогатого скота в основном происходит через молоко, кисломолочные продукты, обрат, которые были получены от инфицированных туберкулиновыми палочками особей.
В организм возбудитель туберкулеза попадает преимущественно через поврежденные слизистые оболочки дыхательных путей, а также через пищеварительный тракт. Туберкулез крупного рогатого скота передается аэрогенным, алиментарным путем. Возможно трансплацентарное (внутриутробное) заражение. Маленькие телята могут инфицироваться микобактериями через молозиво, молоко матери.
В группу риска попадают:
- молодняк с неокрепшей, несформированной иммунной системой;
- животные после перенесенных вирусно-бактериальных, паразитарных заболеваний по причине пониженной резистентности организма;
- истощенные животные, птицы.
Туберкулезом могут заболеть с/х животные, которые получают несбалансированный рацион питания, некачественные корма, мясные продукты сомнительного происхождения, не прошедшие предварительной термической обработки.
Риск инфицирования повышается, если КРС, другие виды теплокровных животных содержатся в неблагоприятных условиях при групповом скученном содержании. Отсутствие правильно обустроенных выгульных площадок, нормального температурного режима, вентиляции, холод, сырость, повышенная влага в помещениях, другие ошибки, допущенные при содержании с/х и домашних животных, также могут стать причиной инфицирования.
Зараженные микобактериями особи (больные, скрытые вирусоносители) выделяют возбудителя туберкулеза с мочой, молоком, мокротами, каловыми массами, спермой во внешнюю среду.
Вспышки заболевания регистрируют независимо от времени года. При этом наиболее часто туберкулезом болеют животные в весенне-летний период.
Инфекционный процесс туберкулеза развивается медленно — месяцами или даже годами. Заражению возбудителем туберкулеза и распространению болезни способствуют: неполноценное кормление, скученное содержание животных, сырость, холод, сквозняки в помещении, антисанитарные условия содержания животных.
Патогенез
После проникновения в организм инфицированных животных микобактерии с кровотоком, лимфогенным путем разносятся к различным внутренним органам и системам. Поражаются не только легкие, но и печень, селезенка, почки, региональные лимфоузлы.
При этом наибольшую локализацию туберкулиновых палочек отмечают в легких. В местах их дислокации развивается острое воспаление. В тканях происходят деструктивно-дегенеративные процессы. При вскрытии трупов животных в легких заметны обширные очаги поражения, некротические участки.

Туберкулез характеризуется образованием в тканях органов специфических узелков-туберкул. Они имеют плотную консистенцию, округлую форму, светло-серый цвет. По размеру их можно сравнить с чечевичным зерном. В центре туберкулы, отмершие клеточные структуры под действием эндотоксинов микобактерий превращаются в творожистую массу.
Туберкулез протекает у взрослых животных преимущественно хронически, а у молодняка остро или подостро. При этом продолжительность инкубационного периода зависит от резистентности организма, иммунного потенциала, индивидуальных физиологических особенностей. С момента инфицирования до проявления первых клинических симптомов может пройти от нескольких дней до 5–6 недель.
В некоторых случаях первые проявления туберкулеза у животных отмечают через 3–5 месяцев после инфицирования. В зависимости от резистентности, стойкости организма и вирулентности бактерий туберкулезный процесс у коровы, козы может протекать доброкачественно и злокачественно.
При доброкачественном течении инфекции туберкулезные бактерии постепенно окружаются эпителиоидными клетками, из которых в дальнейшем образуются гигантские клеточные структуры. Вся эта группа клеток окружается кольцом из лимфоцитов. Между ними отлагается экссудат, свертывается фибрин. Формирующаяся туберкулезная гранулема инкапсулируется.

Тканевые клетки в бугорке постепенно отмирают по причине отсутствия притока питательных веществ. По мере прогрессирования недуга под воздействием эндотоксинов, которые продуцируют микобактерии, образуется творожистая масса, пропитанная известковыми солями. При доброкачественном течении болезни в инкапсулированном очаге туберкулезные бактерии чаще всего погибают, и дальнейшее развитие инфекционного процесса прекращается.
Формы туберкулеза и клинические симптомы
Если животное болеет туберкулезом, симптомы зависят от первичного места проникновения бактерий, локализации возбудителя. По месту локализации патологического процесса различают легочную и кишечную форму бактериального заболевания. Реже у крупного, мелкого рогатого скота диагностируют поражения вымени, серозных покровов (жемчужница), генитальную форму или генерализованный туберкулез. Очень часто данное заболевание у коров протекает скрыто.
У КРС при туберкулезе чаще всего поражаются легкие. Для данной формы болезни характерен сильный сухой кашель, который усиливается при вдыхании холодного воздуха. На начальной стадии температура может быть в норме или повышается до 39,5–40 °С. Аппетит и продуктивность сохранены.

По мере прогрессирования инфекции при туберкулезе проявляются признаки воспаления легких и плевры. Кашель становится болезненным, дыхание поверхностное, учащенное, затрудненное, сопровождается хрипами, стонами. Выделяются мокроты. При этом приступы кашля усиливаются по утрам или в ночное время суток. В грудной клетке при перкуссии отчетливо прослушивают хрипы, участки притупления.
При поражении легких, плевры туберкулезным процессом, при пальпации, надавливании между ребрами животное будет испытывать сильный болевой синдром. Инфицированные особи быстро теряют в весе, выглядят истощенными. Кожа становится сухой, теряет эластичность. Если увеличиваются медиастинальные лимфатические узлы, это неизменно приведет к сдавливанию пищевода. Нарушается процесс отрыжки, происходит хроническое вздутие рубца.
Важно! При генерализированном туберкулезе, обширных поражениях легких инфицированные животные гибнут из-за сильной интоксикации, нарушения функции дыхательного центра, сильного истощения.
В случае поражения молочной железы отмечают увеличение надвыменных лимфоузлов, которые приобретают плотную консистенцию, становятся бугристыми, малоподвижными. Чаще всего поражается задняя часть вымени. Молочная железа краснеет, припухает, становится болезненной. При доении из молочных пакетов выделяется творожистая масса, водянистое молоко, в котором содержатся кровянистые сгустки, вкрапления, нити, сгустки фибрина.

При поражении половых органов у коров отмечают усиление половой охоты, яловость, выделяется слизь, зловонная зеленая густая масса. У бычков наблюдают орхиты, увеиты.
При генерализованной форме инфекции нижнечелюстные, заглоточные, надвыменные лимфоузлы становятся болезненными, увеличиваются в размерах.
Диагностика туберкулеза
Как правило, начало заболевания можно обнаружить у с/х животных (коров, коз, свиней) во время проведения планового осмотра, в процессе диагностических исследований. Диагноз при подозрении на туберкулез ставится на основе эпизоотологической информации по региону. Учитываются данные анамнеза, клинические проявления.
Для исследования применяют аллерген — туберкулин, который представляет собой стерильный фильтрат убитых культур возбудителя туберкулеза двух видов: сухой очищенный (ППД) туберкулин для млекопитающих и ППД-туберкулин для птиц.
Основным методом прижизненной диагностики туберкулеза у животных является аллергическое исследование внутрикожной туберкулиновой пробой. Туберкулинизации подвергают крупный рогатый скот, начиная с двухмесячного возраста. В некоторых случаях у КРС одновременно с внутрикожной пробой проводят офтальмопробу с интервалом в 5–6 дней.
При внутрикожном методе туберкулинизации препарат вводят коровам в середину шеи, быкам-производителям — в подхвостовую складку. Перед введением туберкулина в месте инъекции выстригают шерсть, кожу обрабатывают 70%-ным этиловым спиртом.
В случае выявления утолщения кожи в месте введения аллергена у крупного рогатого скота кутиметром измеряют толщину складки в мм. Определяют величину ее утолщения, сравнивая с толщиной складки неизмененной кожи вблизи места введения специфического аллергена.

Животных считают реагирующими на туберкулин, если кожная складка утолщена на 3 и более мм после первого введения туберкулина, а также на 4 мм после повторного введения.
Учитывая схожесть клинической симптоматики, при подозрении на туберкулез проводится дифференциальная диагностика.

Если в благополучных хозяйствах впервые были выявлены реагирующих на туберкулин животные, для уточнения диагноза осуществляют убой 3–5 животных с наиболее ярко выраженными реакциями на туберкулин. После забоя осматривают внутренние органы, лимфоузлы. Если нет типичных для туберкулеза изменений, отбираются кусочки органов, тканей. Материал направляют в ветлабораторию для проведения бактериологических исследований.
В пораженных органах заметны специфические уплотнения, узелки (туберкулы), имеются некротические участки. Лимфоузлы увеличены, имеют бугристую консистенцию. Патологические процессы отмечают в легких, печени, селезенке, других внутренних органах.
Лечение, профилактика
Лечение животных, у которых диагностирована любая форма туберкулеза, не предусмотрено. Больных особей направляют на убой. Трупы утилизируют согласно установленным санитарно-гигиеническим нормам. В стадах, на фермах, в населенных пунктах, где уже зарегистрирован факт болезни, животных, реагирующих на туберкулин, признают больными туберкулезом и отправляют на убой в течение двух недель.
Туберкулинизации подвергают КРС дважды в год. Птицу, пушных зверей — раз в 12 месяцев. Лошадей, коз — в зависимости от эпизоотологической обстановки в регионах.
Важно! Степень неблагополучия стад КРС ветеринары определяют с учетом распространенности бактериального заболевания. Ограниченная — при выявлении двукратной туберкулиновой пробой до 15% больных животных от поголовья в стаде, на ферме. Значительная степень — если выявлено более 15–17% инфицированных особей.
Если туберкулезом болеет менее 15% поголовья стада, оздоровление может быть проведено методом систематических исследований и убоя больных особей. Всех животных, начиная с 2-месячного возраста, через каждые 45–55 дней исследуют двойной внутрикожной туберкулиновой пробой.
Одновременно исследованию подвергают имеющихся в хозяйстве животных других видов (в том числе собак и кошек). Реагирующих на туберкулин особей признают больными. Их метят, изолируют и в течение двух недель отправляют на убой.
В случае значительного охвата поголовья (свыше 15% стада) производится полная замена коров. Всех больных животных убивают с последующей утилизацией. Молочную продукцию подвергают обязательному обеззараживанию путем получасового нагревания при 85 градусах. Запрещено заниматься разведением коров. Предусмотрен полный запрет на искусственное и естественное осеменение. На протяжении следующих 6–7 месяцев нужно отправить на убой оставшихся животных.
Если при контрольном исследовании выделяют реагирующих на туберкулин животных, их всех подвергают диагностическому убою. При обнаружении патологических изменений, характерных для туберкулеза, дальнейшие исследования проводят через каждые 33–46 дней.

При получении отрицательных результатов аллергических, серологических, лабораторных исследований, стадо объявляют благополучным по туберкулезу и снимают ограничения. Перед снятием карантина проводят комплекс ветеринарно-санитарных мероприятий.
Профилактику и меры борьбы с туберкулезом в фермерских угодьях, крупных животноводческих хозяйствах проводят согласно действующим санитарным и ветеринарным правилам (СП 3.1 093-96 и ВП 13.3 1325-96). Инструкции по профилактическим мерам предоставляют ветеринарные клиники, центры региона.
Чтобы предотвратить заражение, необходимо соблюдать санитарно-гигиенические нормы, следить за эпизоотологической ситуацией в регионе.
Читайте также:


