Диссеминированный туберкулез и пневмоцистная пневмония
Володина С.В., Тяжельникова З.М., Анциферова Л.И., Волкова Т.А.
Трудности рентгенологической верификации пневмоцистной пневмонии и туберкулёза у больных с поздней стадией ВИЧ-инфекции.
г. Красноярск, Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого , кафедра лучевой диагностики ИПО,
Возбудители пневмоцистоза широко распространены в окружающей среде, и большинство из нас носит их в легких без негативных последствий. Но при нарушении иммунной системы под действием ВИЧ эти простейшие организмы, считающиеся условно-патогенными, становятся смертельно опасными. P. с arinii заражено около 80% больных СПИДом . Пневмоцистная пневмония - это самая распространенная оппортунистическая инфекция дыхательных путей у ВИЧ - инфицированных. В числе ведущих вторичных поражений у больных ВИЧ-инфекцией фигурирует и туберкулёз, который в последние годы становится едва ли не основной причиной госпитализации и смерти больных ВИЧ-инфекцией, он уносит жизнь более 60% больных на её поздних стадиях. Всё чаще регистрируется сочетание нескольких вторичных поражений, в т.ч. пневмоцистная пневмония и туберкулёз, что затрудняет своевременную диагностику и лечение. Летальные исходы у таких больных связаны, прежде всего, с поздней дифференциальной диагностикой.
Цель нашего исследования состояла в анализе рентгенологических проявлений диссеминированного туберкулеза и пневмоцистной пневмонии на фоне ВИЧ-инфекции.
Материалы и методы:
Наши исследования основаны на анализе 43 историй болезни пациентов, имеющих различные формы специфического туберкулеза легких на фоне ВИЧ-инфекции.
Как пример сложности дифференциальной рентгенологической диагностики пневмоцистной пневмонии и туберкулёза у больной с тяжелым иммунодефицитом, обусловленным ВИЧ - инфекцией, представляем историю болезни пациентки Б., лечившейся и обследовавшейся последовательно в Городской больнице №1, инфекционном и противотуберкулёзном отделениях Городской больницы №2 г. Норильска.
Поступила в экстренном порядке в пульмонологическое отделение Городской больницы №1 с жалобами на одышку при минимальной бытовой нагрузке, слабость, непродуктивный кашель, лихорадку до 39 0 с ознобом, потерю веса до 8 кг за последние 3 недели. До поступления в стационар лечилась амбулаторно с диагнозом ОРВИ, при нарастании симптомов заболевания госпитализирована .
На рентгенограммах (прямая и боковые проекции) при поступлении: с обеих сторон по всем лёгочным полям, преимущественно в средних и нижних отделах лёгких, отмечено усиление и обогащение лёгочного рисунка за счёт интерстициального компонента, перивазальная , перибронхиальная нечёткость корней и рисунка в прикорневых отделах. С обеих сторон в S 8 – S 9 определяется очаговая инфильтрация лёгочной ткани с реакцией прилежащей плевры. Синусы свободны. Сердце и аорта без особенностей. Заключение: двухсторонняя полисегментарная пневмония, интерстициальная при системном заболевании. Дифференциальный диагноз с лимфогенным карциноматозом , туберкулёзом.
При томографическом дообследовании ср. 7,5-8: с обеих сторон, преимущественно в средних и нижних отделах и субплеврально , больше слева, на фоне интерстициального компонента определяются множественные очаговые тени, сливающиеся в фокусы без чётких контуров, распада не выявлено, бронхи 1-2 порядка проходимы. Увеличены размеры паратрахеальных и трахеобронхиальных ВГ лимфоузлов , больше справа. Закл .: Двухсторонняя полисегментарная грибковая пневмония на фоне ВИЧ-инфекции, не исключается пневмоцистная пневмония.
За период наблюдения дважды консультирована фтизиатром, данных за активный туберкулёз не выявлено.
В результате проведённого лечения клинико-рентгенологические показатели практически не улучшились, больная переведена в инфекционное отделение Городской больницы №2 с диагнозом: Внебольничная двухсторонняя полисегментарная пневмония грибковой этиологии, пневмоцистная ?, тяжёлое течение, ДН- II , туб-настороженность , Фон - ВИЧ-инфекция.
На рентгенограмме: динамика отрицательная прогрессирования интерстициального компонента, на фоне обеднения лёгочного рисунка по всем лёгочным полям определяются сливные очаговые тени, не исключается появление в вернем лёгочном поле слева фокуса с распадом. Корни малоструктурны за счёт увеличения размеров внутригрудных лимфоузлов . Дифференциальный диагноз ВИЧ-ассоциированного диссеминированного туберкулёза лёгких и пневмоцистной пневмонии. Консультация фтизиатра: Диссеминированный туберкулез легких в фазе инфильтрации и распада.
Переведена в ПТО с отрицательной динамикой для дальнейшего обследования и лечения. Дважды исследована мокрота на МБТ бактериоскопическим методом – отр . В стационаре противотуберкулезного отделения состояние пациентки резко ухудшилось и зафиксирован летальный исход.
Патологоанатомический диагноз: Основное заболевание: ВИЧ-инфекция, категория В (СПИД): СД4 4кл.(1%); двусторонняя полисегментарная субтотальная пневмония (ЦМВ + пневмоцистная ); ЦМВ - э пинефрит . Делимфотизация лимфатических узлов, селезенки, миндалин. Гранулематозный лимфаденит бифуркационных лимфатических узлов. ВИЧ - кахексия.
1. На поздних стадиях ВИЧ-инфекции рентгенологическая картина туберкулёза теряет типичные черты, а именно локализация патологических элементов меняется на средние и нижние отделы лёгких , в структуре туберкулеза в этот период исчезают формы с преимущественными продуктивными процессами. Туберкулезный процесс в легких становится более распространенным, преобладают диссеминация и поражение внутригрудных лимфатических узлов, что напоминает R -картину пневмоцистной пневмонии.
2. Дифференциальный диагноз затрудняет сходство клинических проявлений туберкулёза и оппортунистических пневмоний на данном этапе ВИЧ-инфекции.
3. Необходимо использовать КТ и МСКТ органов грудной полости как наиболее достоверные с высокой разрешающей способностью, т.к. обычная рентгенография и томография малоинформативны и неспецифичны.
4. Целесообразно внедрять в практику специфические методики определения возбудителей оппортунистических инфекций.
Диссеминация в легких у данного контингента больных свидетельствует, как правило, о генерализации туберкулезной инфекции, которая возникает на фоне глубокой иммуносупрессии и снижении количества CD4-лимфоцитов до 200 клеток/мкл и ниже. Одновременно с поражением легких у таких пациентов развиваются и внелегочные формы туберкулеза: экссудативный плеврит, выпотной перикардит, туберкулез периферических и внутригрудных лимфатических узлов, печени, селезенки, почек, мозговых оболочек, вещества мозга и др.
Проявления заболевания со стороны респираторной системы существенно не отличаются от таковых у ВИЧ-негативных лиц, основные особенности касаются интоксикационного синдрома. Температура тела у ВИЧ-инфицированных больных часто достигает высоких цифр –38-39 0 С, длительно удерживается, не реагирует на антибиотики широкого спектра действия, снижается на непродолжительное время после приема НПВС (аспирин, парацетамол). Нередко именно фебрильная температура, которая тянется неделями и даже месяцами и может сочетаться с кишечными расстройствами, потерей веса, несильным кашлем, заставляет больного обратиться за медицинской помощью. При этом до определенного периода изменений в легких может не быть, и только при внимательном изучении рентгенограммы удается заметить усиление легочного рисунка и/или увеличение внутригрудных лимфатических узлов. Выявление синдрома диссеминации иногда расценивается врачами как пневмония, и пациентам в течение нескольких недель проводят лечение антибиотиками без существенной положительной клинико-рентгенологической динамики. Особенностью температуры у лиц с ко-инфекцией туберкулез/ВИЧ является ее упорное сохранение на высоких цифрах даже на фоне противотуберкулезной полихимиотерапии. При успешном лечении туберкулеза нормализация температуры происходит постепенно, снижаясь вначале на десятые доли градуса.
Как и у ВИЧ-негативных больных, одышка не является характерным признаком диссеминированного туберкулеза легких у ВИЧ-инфицированных лиц. Этот симптом имеет значение для дифференциальной диагностики диссеминированного туберкулеза с атипичными пневмониями, которые развиваются на последних стадиях ВИЧ-инфекции и также могут проявляться синдромом диссеминации. Наличие тяжелой дыхательной недостаточности свидетельствует против туберкулезной этиологии процесса, однако при этом следует исключить другие причины ее возникновения (тяжелая анемия, сердечная недостаточность, пневмо- и гидроторакс), а также сочетание туберкулеза с атипичной (пневмоцистной) пневмонией.
Данные объективного обследования бронхо-легочной системы не отличаются от результатов ВИЧ-негативных больных. Со стороны других органов часто выявляются периферическая лимфаденопатия, кандидозное поражение полости рта, гепатоспленомегалия, пастозность или отеки нижних конечностей. Иногда наблюдается желтуха, обусловленная сопутствующими гепатитами, токсическим действием лекарственных препаратов, туберкулезным поражением печени.
При лабораторном исследовании почти у всех ВИЧ-инфицированных пациентов обнаруживается лейкопения, лимфопения, повышение СОЭ. КУБ в мокроте выявляются редко.
Под влиянием лечения антибиотиками широкого спектра действия изменения в легких остаются стабильными или же наблюдается прогрессирование процесса, которое может происходить быстрее, чем у ВИЧ-негативных лиц. Также более быстро наступает и рассасывание очагов в легких на фоне противотуберкулезного лечения.
Диссеминированный туберкулез легких у ВИЧ-инфицированных лиц необходимо отличать от атипичных пневмоний. Атипичные пневмонии составляютособую группу заболеваний, этиологическим фактором которых являются возбудители разнообразных оппортунистических инфекций (грибковых, вирусных, паразитарных).Чаще всего эти инфекции развиваются в организме ВИЧ-инфицированных людей, у которых количество CD4-лимфоцитов снижается до 100 клеток/мкл и ниже. Для выяснения этиологии пневмонии используют серологические, иммунологические, вирусологические и бактериологические методы исследований, для проведения которых необходимы специальные лаборатории. При всем разнообразии возбудителей атипичные пневмонии у ВИЧ-инфицированных пациентов имеют несколько сходных признаков, отличающих их от туберкулеза легких. Атипичные пневмонии протекают с поражением интерстициального пространства легких, поэтому сопровождаются развитием тяжелой дыхательной недостаточности.
Наиболее часто встречается пневмоцистная пневмония. Клинически она проявляется заметным диффузным цианозом, акроцианозом, одышкой, возникающей при незначительной физической нагрузке, разговоре, и даже в покое. Кашель при пневмоцистной пневмонии часто непродуктивный или с выделением небольшого количества слизистой мокроты, которая иногда напоминает нежную пену (пенистая мокрота). МБТ в мокроте всеми методами не находят. Рентгенологически определяются двусторонние интерстициальные изменения, множественные очаговые тени и/или мелкие инфильтраты с преимущественной локализацией в прикорневых отделах. В отличие от туберкулеза, для пневмоцистной пневмонии не характерно поражение верхушек легких. Уточнить диагноз помогает определение сатурации кислорода. Сатурация отражает уровень насыщения артериальной крови кислородом и определяется методом пульсоксиметрии – неинвазивного измерения процентного содержания оксигемоглобина в артериальной крови (SpO2). Норма насыщения крови кислородом для здорового человека: SpО2 – 95-99 %. В отличие от туберкулеза, при пневмоцистной пневмонии показатель сатурации кислорода снижается ниже 90 %, наиболее часто диагностический интервал составляет 85-75 %, снижаясь в тяжелых случаях до 75-55 % и ниже. Лечение атипичных пневмоний длительное, с применением лекарственных препаратов, воздействующих на наиболее частых возбудителей атипичных пневмоний, которыми являются пневмоцисты, токсоплазмы, гистоплазмы и др.
Не нашли то, что искали? Воспользуйтесь поиском:
Похожие темы научных работ по клинической медицине , автор научной работы — Бурданова Т. М., Орлова Л. С., Лемешевская М. В., Шарифулина Н. Л., Панютина М. С.
2. Чучалин А.Г. Хронические обструктивиые болезни легких. — СПб., 1998.
3. Чучалин А.Г. Хроническая обструктивная болезнь легких и сопутствующие заболевания // Пульмонология. — 2008. — № 2. — С. 5—14.
4. Шмелев Е.И., Куклина Г.М. Совершенствование лечения бронхиальной обструкции у больных туберкулезом легких // Пульмонология. — 2001. — № 1. — С. 23 — 27.
5. Шмелев Е.И. Хроническая обструктивная болезнь легких и сопутствующие заболевания // Пульмонология. — 2007. — № 2. — С. 5 — 9.
6. Malin I. et al. COPD and the Risk of Tuberculosis - A Population-Based Cohort Study // PLoS One. — 2010 Apr. - Vol. 5 (4). - P. e10138.
Т.М. Бурданова, Л.С. Орлова, М.В. Лемешевская, Н.Л. Шарифулина, М.С. Панютина,
ОСОБЕННОСТИ ТЕЧЕНИЯ ТУБЕРКУЛЕЗА И ПНЕВМОЦИСТНОЙ ПНЕВМОНИИ ПРИ ПОЗДНИХ СТАДИЯХ ВИЧ-ИНФЕКЦИИ
Иркутский государственный медицинский университет (Иркутск)
Заболеваемость ВИЧ-инфекцией во всем мире не имеет тенденции к снижению. Без специфической высокоактивной антиретровирусной терапии (ВААРТ) у всех ВИЧ-инфицированных неизбежно развитие стадий ВИЧ 4-б, 4-в, 5 (по классификации В.В. Покровского, 2001 г.), которые представляют собой развернутую картину синдрома приобретенного иммунодефицита (СПИД). Туберкулез и пневмоцистная пневмония являются СПИД-индикаторными заболеваниями, протекающими с поражением легких. Они занимают лидирующие позиции в структуре летальности у ВИЧ-инфицированных на поздних стадиях. В связи с тем, что у больных на поздних стадиях ВИЧ-инфекции характерно одновременное развитие нескольких оппортунистических инфекций, для этого контингента затруднена ранняя клиническая и дифференциальная диагностика туберкулезного процесса и пневмоцистной пневмонии, что нередко приводит к позднему или неправильному лечению, и, соответственно — к летальному исходу.
Цель: изучить и сравнить клинико-эпидемиологические и лабораторные особенности течения туберкулезной инфекции и пневмоцистной пневмонии у больных поздними стадиями ВИЧ-инфекции для совершенствования методов ранней диагностики.
МАТЕРИАЛЫ И МЕТОДЫ
При помощи общепринятых методов статистического анализа было изучено 72 истории болезни пациентов с поздними стадиями ВИЧ-инфекции, пролеченных в инфекционной больнице в 2009 — 2010 гг., среди которых у 58 больных в результате госпитализации верифицированы различны формы туберкулеза (1-я группа), а у 14 (2-я группа) — пневмоцистная пневмония. Диагноз был выставлен на основании клинико-лабораторных, рентгенологических данных, после консультации фтизиатра, в ряде случаев — подтвержден секционно.
Распределение больных по формам выявленного туберкулеза представлено в таблице 1. M. tuberculosis у больных с с этим диагнозом были обнаружены при микроскопическом исследовании мокроты в 24 случаях (42,1 %).
Клиническая форма абс. %
ТВГЛУ (осложненный бронхолегочным компонентом (экссудативным плевритом) лимфогенной диссеминацией) 3 5,2
Туберкулезный плеврит / эмпиема 5 8,6
Милиарный туберкулез 3 5,2
Диссеминированный туберкулез 12 20,7
Инфильтративный туберкулез 17 29,3
Генерализованный туберкулез 12 20,7
В обеих группах больных достоверно преобладали мужчины (74,1 % в 1-й группе и 57,1 % во 2-й). Большинство больных пришлось на возрастную группу 20-39 лет. Как в 1-й, так и во 2-й группе подавляющее большинство больных не получало ВААРТ. Частота внутривенной наркомании у больных 1-й группы достоверно превысила аналогичную у больных 2-й группы (96,6 % vs 50,0 %, р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Признак 1 группа (n = 58) 2 группа (n = 14) р
Продолжительность болезни до госпитализации, дни 14,2 ± 2,4 15,0 ± 2,5 > 0,05
Фебрильная ^ % 85,6 ± 4,1 81,5 ± 4,4 > 0,05
Кашель с мокротой % 74,4 ± 4,3 69,4 ± 4,7 > 0,05
ЧДД в разгаре болезни, абс. 19,0 ± 2,1 27,5 ± 2,1 > 0,05
Астения, % 84,4 ± 4,7 78,4 ± 4,9 > 0,05
Кахексия, % 34,4 ± 4,3 40,4 ± 6,6 > 0,05
Упорная диарея,% 24,4 ± 2,3 19,4 ± 6,2 > 0,05
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено: увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей; внедрением в практику пересадки донорских органов, трансплантации кос
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено:
- увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей;
- внедрением в практику пересадки донорских органов, трансплантации костного мозга и других форм гематологических манипуляций, выполняемых с гематопоэтической и гематопротезирующей целью;
- эпидемией СПИДа/ВИЧ-инфекции;
- врожденными нарушениями иммунитета, а также ростом числа лиц с аутоиммунными заболеваниями;
- проводимыми многолетними курсами иммуносупрессивной терапии у пациентов с болезнями соединительной ткани;
- алкоголизмом, наркоманией и расширением контингента лиц с асоциальным типом поведения [11].
Объединяющим свойством различных популяций пациентов в данном случае является их повышенная восприимчивость к различным инфекционным агентам, что объясняется снижением пороговых значений вирулентности [1, 6]. Повреждения легочной ткани как инфекционной, так и неинфекционной природы являются едва ли не самой часто описываемой патологией среди пациентов с различными нарушениями иммунитета. При этом легочная инфекция занимает лидирующее положение среди всех инвазивных инфекций, которые диагностируются у такого рода больных [6, 9, 10].
Риск возникновения инфекций нижних дыхательных путей (ИНДП) в группе больных со сниженным иммунитетом весьма различается и зависит от ряда факторов, наиболее важными среди которых являются: нейтропения, аспирация, характер и степень выраженности изменений со стороны иммунной системы (табл. 1), а также эпидемиологическая ситуация в регионе. Одним из наиболее серьезных факторов риска возникновения ИНДП у данной категории пациентов является выраженная и продолжительная нейтропения [5, 8].
Пациент с нарушениями иммунитета, с одной стороны, постоянно находится под воздействием патогенов окружающей среды, а с другой — именно наличие дефекта иммунитета определяет тип легочной инфекции, которая у него развивается. У таких пациентов наиболее распространенными причинами развития ИНДП являются: нозокомиальная инфекция, зачастую резистентная к антибиотикам; воздействие факторов окружающей среды (воздушно-капельная инфекция и/или инфекция, передающаяся через питьевую воду); инфекции, порог вирулентности которых высок среди популяции; реактивация ранее перенесенных инфекций (например, туберкулез) [10, 12].
Каковы же основные особенности респираторных инфекционных процессов у больных со сниженным иммунитетом, знание которых помогает своевременно распознать и как можно быстрее начать проводить специфическое, адекватное терапевтическое лечение.
- При выявлении незначительных по степени интенсивности затемнений легочной ткани во время обычного рентгенологического исследования органов грудной клетки (ОГК) в данной группе пациентов должна в обязательном порядке назначаться компьютерная томография ОГК.
- В случае выявления многофокусных легочных инфильтраций инфекционной (вирусной, бактериальной или грибковой) этиологии, неинфекционной природы, а также при подозрении на метастатическое поражение легочной ткани выполнение рентгенографии ОГК в сочетании с исследованием мокроты не может являться адекватной диагностической процедурой из-за низкой результативности.
- Серологическая диагностика обычно малоинформативна у этих пациентов, в организме которых не генерируется своевременная выработка антител в ответ на инфекцию; в силу этого чаще используются методики, основу которых составляет определение антигена и/или ДНК - полимеразные цепные реакции (ПЦР).
- Выполнение в наиболее сжатые сроки компьютерного томографического исследования легких, а также постановка патоморфологического диагноза (по результатам гистологического и культурального исследований полученных образцов тканей и смывов из трахеи и бронхов) в значительной степени повышают выживаемость пациентов в данной группе.
- В легочной ткани одновременно могут протекать несколько процессов, в частности инфекционный с наличием одного или нескольких патогенов (Pneumocystis сarinii/jiroveci, цитомегаловирусная инфекция (ЦМВ) и т. д.). Нередко выявляется суперинфекция на фоне течения других процессов (например, на фоне развития острого респираторного дистресс-синдрома (ОРДС) или лекарственного поражения легочной ткани).
- Использование сокращенных схем назначаемой иммуносупрессивной химиотерапии (особенно кортикостероидами) может являться столь же значительным фактором риска развития инфекции, как и назначаемая антибактериальная терапия.
Успешность проводимой эмпирической антибактериальной терапии во многом зависит от предварительно проведенного микробиологического обследования и идентификации возбудителя. В абсолютном большинстве случаев речь идет о грибковой или смешанной бактериально-грибковой флоре. Этиологическая расшифровка ИНДП у данной категории больных представлена следующим образом [1–3, 6, 11]:
- типичные бактерии - 37%;
- грибы - 12%;
- вирусы - 15%;
- Pneumocystis carinii/jiroveci - 8%;
- Nocardia asteroides - 7%;
- Mycobacterium tuberculosis - 1%;
- микст-инфекция - 20%.
Довольно часто в популяции пациентов с нейтропенией [11, 12] возникают микст-инфекции, основу которых составляют: инфекции респираторно-сентициального вируса, либо ЦМВ, или инвазия Aspergillus spp. в сочетании с грамотрицательной флорой или P. carinii/jiroveci. Пневмоцистоз в виде моноинфекции и/или в виде микст-инфекции чаще всего описывается у пациентов, получающих системную кортикостероидную терапию (это касается как длительных курсов монотерапии кортикостероидами, так и использования их в качестве составной части режима химиотерапевтической поддержки у онкологических больных).
В современной литературе описывается увеличение количества грибковых поражений и их торпидное течение у пациентов со сниженным иммунитетом, несмотря на применение новейших противогрибковых препаратов [8, 11, 12]. В настоящее время наиболее актуальными являются три инфекционных агента, вызывающих легочные изменения: Pneumocystis carinii/jirovici, представители рода Aspergillus (особенно A. fumigatus) и Cryptococcus neoformans [12, 14].
Таксономически пневмоцисты относят к грибам. В начале нового тысячелетия тип Pneumocystis carinii, вызывающий инфекции у человека, был выделен в отдельный вид Pneumocystis jiroveci — в честь чешского ученого-паразитолога Отто Йировеца, впервые описавшего этот микроорганизм как причину заболевания у человека.
P. jiroveci, являющийся внеклеточным паразитом с преимущественным тропизмом к легочной ткани, поражает пневмоциты 1-го и 2-го порядков. Сложности при проведении дифференциальной диагностики в случае подозрения на развитие у пациента пневмоцистной пневмонии (ПП) в основном объясняются тем фактом, что стандартное обследование больных малоинформативно, до 20% из них имеют стертую клинику, а рентгенологическое обследование не выявляет патологии. Первыми признаками развивающейся ПП являются медленно нарастающая гипоксемия, одышка и кашель при скудности данных физического осмотра и рентгенологических проявлений.
С клинических позиций выделяют три стадии болезни.
- Отечная стадия, продолжительностью в среднем 7-10 дней, характеризуется медленно нарастающей одышкой, которая неуклонно прогрессирует, вплоть до выраженной одышки в покое, и сопровождается сухим непродуктивным кашлем. В легких хрипы не выслушиваются, дыхание, как правило, ослабленное. Симптомы общей интоксикации незначительны (субфебрилитет, общая слабость). Рентгенологическая картина в начале заболевания неясная, чаще всего описываемая как вариант нормы; реже выявляется прикорневое снижение пневматизации легочной ткани и усиление интерстициального рисунка.
- Для ателектатической стадии (продолжительность около 4 нед) характерна выраженная одышка в покое (до 30-50 дыхательных движений в 1 мин), пациентов беспокоит малопродуктивный кашель с выделением вязкой мокроты, нередко описывается вздутие грудной клетки. Часто отмечается фебрильная лихорадка. Аускультативная картина характеризуется жестким и/или ослабленным дыханием (локально или над всей поверхностью легких), иногда выслушиваются сухие хрипы. На более поздних этапах в клинической картине заболевания на первый план выходят симптомы дыхательной и сердечно-сосудистой недостаточности. Рентгенологи на этой стадии более чем в половине случаев выявляют билатеральные облаковидные инфильтраты (симптом "бабочки"), а также - обильные очаговые тени ("ватное" легкое).
- Последняя, эмфизематозная стадия характеризуется развитием эмфизематозных лобулярных вздутий и, возможно, разрушением альвеолярных перегородок с развитием пневмоторакса. Клинически может наблюдаться некоторое улучшение состояния больных, уменьшение одышки.
Диагностические мероприятия, направленные на выявление Pneumocystis jiroveci, начинают с получения индуцированной мокроты. Материал исследуют методом прямой микроскопии окрашенных мазков. В последнее время для более точной диагностики разработаны и применяются метод ПЦР, иммунофлюоресцентные методы с моно- и поликлональными антителами. Бронхоскопия с бронхоальвеолярным лаважем в сочетании с трансбронхиальной биопсией позволяет почти в 100% случаев обнаружить возбудителя и, следовательно, является наиболее эффективным и достоверным методом диагностики ПП. В тех случаях, когда пациенты прибегали к лечению пентамидином, эффективность диагностики с использованием бронхоальвеолярного лаважа снижалась до 60%. Окончательный диагноз пневмоцистоза ставится при обнаружении цист или трофозоидов в ткани или альвеолярной жидкости [7, 9].
В настоящее время обследование пациентов с подозрением на развитие ПП проводится по следующей схеме — всем больным с пневмонией лечение назначается эмпирически, и только при тяжелом легочном процессе проводится легочная биопсия. В отсутствие адекватного специфического лечения пневмоцистоза летальность достигает 100% у пациентов с иммунодефицитами и 50% — у недоношенных детей. Прогноз остается неблагоприятным (зависит от фонового состояния), и без коррекции иммунного статуса у 15% пациентов возникают рецидивы ПП [4, 8].
У пациентов, не получающих триметоприм-сульфаметоксазол (или иные антибактериальные препараты, назначаемые в режиме химиопрофилактики при высоком риске развития пневмоцистоза (табл. 2), сохраняется высокая вероятность возникновения пневмоцистоза на фоне развития ЦМВ-инфекции, что, возможно, связано с блокировкой альвеолярных макрофагов и снижением функции CD4-лимфоцитов.
Относительно частоты выявления пневмоцистоза в группе пациентов с иммунодефицитными состояниями (в которую не вошли пациенты с ВИЧ-инфекцией), следует отметить, что при отсутствии своевременно проводимых профилактических мероприятий примерно у 5–12% пациентов развивается развернутая клиника пневмоцистоза [13]. Применение активной антиретровирусной терапии существенно снижает риск развития ПП при СПИДе. В случае снижения уровня CD4 Рисунок 1. Обзорная рентгенография органов грудной клетки от 11.11.04.
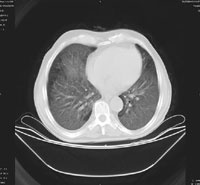
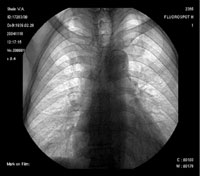
На момент госпитализации: состояние средней степени тяжести, обусловленное дыхательной недостаточностью. При осмотре кожных покровов видны сухие следы расчесов, акроцианоз. В подмышечных, паховых областях с обеих сторон пальпируются единичные, мягко-эластичной консистенции безболезненные лимфатические узлы. В легких при аускультации выслушивается жесткое дыхание, хрипов нет. Частота дыхания — 23–24 в минуту, пульс — 87 в минуту, артериальное давление — 140/80 мм рт. ст. Со стороны пищеварительной, мочеполовой, нервной систем патологии не выявлено. Больному была назначена антибактериальная терапия, включающая ципрофлоксацин, рифампицин. Помимо антибиотиков пациент получал муколитики, фестал, альмагель, бисакодил. На фоне проводимого лечения сохранялись гектические подъемы температуры, нарастала дыхательная недостаточность. С учетом затяжного течения пневмонии больной повторно был осмотрен фтизиатром, данных, подтверждающих туберкулез, снова не было выявлено. В ходе обследования методом иммуноферментного анализа и иммунного блотинга были выявлены антитела к ВИЧ, что заставило пересмотреть диагностический алгоритм и предположить развитие у больного ПП либо поражения легких в рамках ЦМВ-инфекции; окончательно не был исключен из диагностического ряда и вариант развития туберкулезного процесса в легких. Ввиду вышесказанного к проводимой терапии был добавлен бисептол в адекватных дозах. При иммунологическом исследовании выявлено абсолютное снижение CD4 до 19,3/ мкл. Все вышеперечисленное позволило диагностировать у больного ВИЧ-инфекцию в стадии 3Б (СПИД-ассоциированный комплекс), двустороннюю субтотальную пневмонию. При проведении (11.11.04) повторного рентгенологического исследования ОГК (рис. 1) отмечалась отрицательная динамика в виде нарастания объема и интенсивности инфильтрации легочной ткани. При ультразвуковом исследовании органов брюшной полости обнаружены диффузные изменения печени, поджелудочной железы, селезенки, увеличение лимфоузлов подмышечных, паховых областей. При контрольной компьютерной томографии ОГК отмечалась отрицательная динамика в виде прогрессирования диффузных изменений в обоих легких (рис. 2, 3). На фоне лечения у больного нарастала дыхательная недостаточность, сохранялись гектические подъемы температуры, развился ОРДС, в связи с чем пациент был переведен в отделение реанимации и интенсивной терапии, где осуществлялись респираторная поддержка, проводились антибактериальная, дезинтоксикационная терапия, противоязвенное и антитромботическое лечение, симптоматическая терапия. Однако, несмотря на все перечисленные мероприятия, 23.11.04 г. наступила остановка сердечной деятельности по типу асистолии.
 |
| Рисунок 4. Гиалиновые мембраны на стенках альвеол (окраска гематоксилином и эозином). Микрофотография |
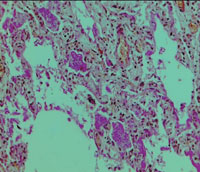 |
| Рисунок 5. Скопления Pneumocystis jiroveci в просветах альвеол (окраска PAS-методом). Микрофотография |
Согласно материалам аутопсии у больного было подтверждено наличие двухсторонней полисегментарной ПП, ОРДС: полнокровие капилляров альвеолоцитов и наличие гиалиновых мембран на стенках альвеол (рис. 4, 5).
- Collin B. A., Ramphal R. Pneumonia in the compromised host including cancer patients and transplant patients//Infect. Dis. Clin. North. Am. 1998; 12: 781.
- Junghanss C., Marr K. A. Infectious risks and outcomes after stem cell transplantation: are nonmyeloablative transplants changing the picture?//Curr. Opin. Infect. Dis. 2002; 15: 347.
- Bodey G., Rodriguez V., Chang H. et al. Fever and infection in leukemic patients: A study of 494 consecutive patients. Cancer. 1978; 41: 1610.
- Coker D. D., Morris D. M., Coleman J. J. et al. Infection among 210 patients with surgically staged Hodgkin's disease//Am. J. Med. 1983; 75: 97.
- Sickles E. A., Greene W. H., Wiernik P. H. Clinical presentation of infection in granulocytopenic patients//Arch. Intern. Med. 1975; 135: 715.
- Rubin R. H., Greene R. Clinical approach to the compromised host with fever and pulmonary infiltrates//In: Clinical Approach to Infection in the Compromised Host, 3rd edition, Rubin R. H., Young L. S. (Eds), Plenum Press, New York. 1994; 121.
- LiPuma J. J., Spilker T., Coenye T., Gonzalez C. F. An epidemic Burkholderia cepacia complex strain identified in soil//Lancet. 2002; 359: 2002.
- Escalante C. P., Rubenstein E. B., Rolston K. V. Outpatient antibiotics therapy for febrile episodes in low-risk neutropenic patients with cancer//Cancer Invest. 1997; 15: 237.
- Talcott J. A., Whalen A., Clark J. et al. Home antibiotic therapy for low-risk cancer patients with fever and neutropenia: A pilot study of 30 patients based on a validated prediction rule//J. Clin. Oncol. 1994; 12: 107.
- Rosenow E. C., Wilson W. R., Cockerill F. R. Pulmonary disease in the immunocompromised host//Mayo. Clin. Proc. 1985; 60: 473.
- Junghanss C., Marr K. A., Carter R. A. et al. Incidence and outcome of bacterial and fungal infections following nonmyeloablative compared with myeloablative allogeneic hematopoietic stem cell transplantation: a matched control study//Biol. Blood. Marrow. Transplant. 2002; 8: 512.
- Ascioglu S., Rex J. H., de Pauw B. et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus//Clin. Infect. Dis. 2002; 34: 7.
- Fishman J. A. Prevention of infection due to Pneumocystis carinii//Antimicrob. Agents. Chemother. 1998; 42: 995.
- Fishman J. A. Treatment of infection due to Pneumocystis carinii//Antimicrob Agents. Chemother. 1998; 42: 1309.
- Furrer H., Egger M., Opravil M. et al. Discontinuation of primary prophylaxis against Pneumocystis carinii pneumonia in HIV-1-infected adults treated with combination antiretroviral therapy. Swiss HIV Cohort Study//N. Engl. J. Med. 1999; 340: 1301.
А. Ф. Шепеленко, доктор медицинских наук, доцент
М. Б. Миронов, кандидат медицинских наук
А. А. Попов
Главный военный клинический госпиталь им. Н. Н. Бурденко,
ММА им. И. М. Сеченова, ГИУВ МО РФ, Москва
Читайте также:


