Идентификационный тест bd mgit tbc для диагностики туберкулеза
| Поделиться |
Закон закупки 44-ФЗЗакон, регулирующий правовые отношения в области государственных закупок.
ЗаказчикИНН: 6730009960 / КПП: 673001001
Информационная лентаПри прокрутке вниз Вы можете получить очень полезную информацию, подобранную специально для Вас нашей программой. А также самые интересные и актуальные статьи о тендерах и закупках, которые мы подобрали для Вас на просторах интернета.
|
Портал отображает информацию о закупках, публикуемых в сети интернет
и находящихся в открытом доступе, и предназначен для юрлиц и индивидуальных предпринимателей,
являющихся участниками размещения государственного и коммерческого заказа. Сайт использует Cookie, которые нужны для авторизации пользователя.
На сайте стоят счетчики Яндекс.Метрика, Google Analytics и LiveInternet,
которые нужны для статистики посещения ресурса.
1.1.1 Характеристика питательной среды, используемой в пробирке MGIT
Содержимое пробирки MGIT (Mycobacteria Growth Indicator Tube) - это питательный бульон, благодаря которому достигается более эффективное выделение микобактерий и их ускоренный рост. Пробирка содержит 7 мл стерильного питательного бульона Мидлбрук 7H9, в которую перед использованием вносится обогатительная добавка BACTEC MGIT Growth Supplement OADC (олеиновая кислота, альбумин, декстроза и каталаза). Она крайне важна для роста многих микобактерий, особенно бактерий, принадлежащих к группе M. tuberculosis. Для предотвращения контаминации необходимо добавить MGIT PANTA.
1.1.2 Принципы детекции и постановки тестов на лекарственную чувствительность к противотуберкулезным препаратам
Кроме жидкой среды Мидлбрук 7H9, в пробирке MGIT содержатся: бескислородный флюорохром, трис - 4, 7-дифенил-1, 10-фенантролин пентагидрат хлорида рутения, помещенный на дно пробирки и покрытый силиконом. Во время бактериального роста внутри пробирки происходит поглощение свободного кислорода и его замещение углекислым газом. По мере расходования свободного кислорода прекращается ингибирование флюорохрома. Флюоресценция становится видимой при облучении пробирки ультрафиолетовым светом и автоматически регистрируется фотодатчиками, встроенными в прибор BACTEC 960. Интенсивность свечения прямо пропорциональна уровню расходования кислорода и регистрируете в единицах роста (GU - growth units).
Пробирки MGIT инкубируются при температуре 37°C с последующим анализом, осуществляемым вручную при ультрафиолетовом излучении, либо путем помещения в прибор MGIT 960, где пробирки проходят инкубацию и мониторинг степени флюоресценции каждые 60 минут. Рост микобактерий и других бактерий вызывает усиление флюоресценции. В случае с M. tuberculosis в момент положительного посева пробы наблюдается около 105-106 колониеобразующих единиц (КОЕ) на 1мл среды. Прибор оценивает пробу как отрицательную при отсутствии роста в течение шести недель (42 дня). Рост бактерий также может быть определен визуально в случае неоднородности и/или помутнения среды либо наличия в ней грануловидных или хлопьевидных вкраплений. Рост некоторых нетуберкулезных микобактерий (большинство из них обладает быстрым ростом) приводит к легкой замутненности, в то время как бактерии, вызывающие контаминацию, обычно вызывают выраженную мутность среды.
В основе теста на лекарственную чувствительность микобактерий туберкулеза лежит модифицированный метод пропорций. В процессе определения происходит сравнение скорости роста микобактерий туберкулеза - в контрольной пробирке и в пробирках с лекарственными препаратами. Для проведения теста используются специальные держатели для 2, 3, 4, 5 и 8 пробирок. В первую пробирку не вносится лекарственный препарат - контрольную, в остальные пробирки добавляются известные концентрации тестируемых лекарственных препаратов, рост в которых сравнивается с ростом в контрольной пробирке. Если тестируемый лекарственный препарат активен по отношению к выделенным микобактериям, он будет ингибировать рост и подавлять флюоресценцию, при этом в контрольной пробирке рост не ингибируется и, соответственно, уровень флуоресцентности в данной пробирке будет выраженнный. Мониторинг роста осуществляется при помощи прибора BACTEC MGIT 960, который автоматически интерпретирует результаты на наличие чувствительности или резистентности к препарату.
1.1.3 Результаты и отчетность
Если в инокулируемой пробе присутствуют жизнеспособные микобактерии, они растут в питательной среде и обнаруживаются визуально, а также при помощи флюоресценции. О результатах сообщается только в том случае, если пробирка MGIT определена прибором как положительная и мазок, взятый из этой пробирки, также положителен на КУМ. В редких случаях пробирка MGIT может быть определена прибором как отрицательная, при этом мазок может быть положительный.
В таком случае сообщается о положительных результатах. Отчеты необходимо отсылать сразу после готовности результатов. Если идентификация требует дополнительного времени, о результатах можно сообщить как о культурах, положительных на КУМ, ожидающих идентификации. Предпочтительнее идентифицировать комплекс M. tuberculosis молекулярным зондом, при возможности, или другими экспресс-методами; о результатах сообщать сразу после идентификации.
Отчеты о негативных культурах составляются после получения протокола исследования и визуального осмотра негативных пробирок. Контаминированные культуры регистрируются после подтверждения мазком и субкультивированием на кровяном агаре.
a. Мазок из пробы (флюорохромное окрашивание или метод Циль-Нильсена) - сообщается о положительном либо отрицательном результате и об использованном методе окрашивания. (В течение 24 часов после получения пробы, по рекомендации Центра контроля и профилактики заболеваний, отчет нужно предоставить).
b. Культура: положительная (подтверждение - мазок на КУМ). Желательно, после выполнения идентификации - комплекс M. tuberculosis или MOTT bacilli (по рекомендации Центра контроля и профилактики заболеваний сообщить в течение приблизительно 14 дней). В дальнейшем идентифицировать микобактерии и составить отчет.
c. По завершении теста на лекарственную чувствительность определяется выявлена ли чувствительность или резистентность к каждому исследуемому препарату и сообщается в течение 28 дней (по рекомендации Центра контроля и профилактики заболеваний).
d. Культура: отрицательная после подготовки протокола об инкубации (по рекомендации Центра контроля и профилактики заболеваний в течении 42 дней).
По данным исследований, с использованием жидких сред, как правило, вырабатывается больше положительных культур, чем при использовании плотных сред, при этом имеет место значительное сокращение времени выявления положительного роста. Данные многочисленных сравнительных исследований производительности BACTEC MGIT 960, BACTEC 460 TB и обычных плотных сред представлены на научных конференциях и опубликованы в журналах.
1.1.4 Недостатки метода
a. Невозможность наблюдения структуры и окрашивания колонии в жидкой среде.
b. Если в процессе деконтаминации и ингибирования добавкой PANTA остается хотя бы одна живая контаминирующая бактерия, она может вызвать заражение всей среды. Контаминация может скрыть рост микобактерий.
c. Положительную культуру из клинической пробы невозможно соотнести с колониеобразующими единицами (КОЕ), присутствующими в пробе - иногда это используется для определения важной нетуберкулезной инфекции.
d. Пробирка MGIT, кажущаяся положительной, может содержать смесь культур более одного вида микобактерий. Микобактерии с более быстрым ростом могут вызвать положительную флуоресценцию раньше медленнорастущих микобактерий. Поэтому в случае признаков наличия более одного вида микобактерий в мазке на КУМ, взятом из культуры, большую роль играет субкультивирование положительной пробирки MGIT на агарной пластинке Мидлбрука.
e. Иногда высокая конечная рН пробы может вызвать ложную кратковременную флуоресценцию датчика.
f. Смесь антибиотиков PANTA, необходимая для подавления контаминирующих бактерий, может также оказывать ингибирующий эффект на некоторые виды микобактерий помимо комплекса M. tuberculosis. Подобное ингибирование различно у разных видов бактерий и происходит в рамках одного вида. Однако общее выделение нетуберкулезных бактерий достигается на более высоком уровне в жидкой среде, нежели в плотной.
1.1.5 Тесты на лекарственную чувствительность к препаратам первого ряда: стрептомицин, изониазид, рифампицин, этамбутол (SIRE)
Тесты на чувствительность к антибактериальным препаратам имеют исключительную важность для назначения эффективного лечения, особенно в случаях обнаружения лекарственной резистентности к противотуберкулезным препаратам. Они также важны для последующей коррекции антибактериальной терапии, в случае ее неэффективности.
Тест на чувствительность к препаратам - стрептомицину (S), изониазиду (I), рифампицину (R) и этамбутолу (E), сокращенно SIRE, проводимый при помощи прибора BACTEC MGIT 960, представляет собой быстрый и качественный метод определения чувствительности M. tuberculosis к четырем указанным лекарственным средствам в критически допустимых концентрациях. Кроме того, при необходимости можно проводить тесты с высокой концентрацией стрептомицина, изониазида и этамбутола.
1.1.5.1 Принципы проведения теста
Культуры, выделенные от пациентов, больных туберкулезом, выращиваются с добавлением известной концентрации тестового лекарственного препарата. Также используется контрольная пробирка без добавления лекарственного средства. Если изолят больного растет на контрольной пробирке, но не растет в среде с добавлением лекарственного препарата, он определяется как чувствительный к данному препарату. С другой стороны, если он растет в обеих пробирках, тем самым устанавливается его резистентность к указанному препарату.
Существуют несколько методов проведения теста на чувствительность, самый распространенный - метод пропорций. В таком методе резистентность для большинства лекарственных средств устанавливается на уровне 1 %. Это означает, что если общая тестируемая бактериальная популяция 1 % или более резистентна к лекарственному средству, она считается резистентной в клинических целях. На протяжении длительного времени в методе пропорций используется плотная агаровая среда Мидлбрук. После 3-4 недель инкубации для определения резистентности на среде, содержащей лекарственный препарат, подсчитывается процент колоний по сравнению со средой, в которой отсутствуют лекарственные препараты.
В 1980 г. был внедрен метод пропорции на основе бульона, известный под названием - радиометрический тест на чувствительность BACTEC 460 TB. В этом методе используется радиометрическая среда BACTEC 12B с субстратом класса C14.
Бактериальный инокулят в контрольном образце в 100 раз меньше инокулята в содержащей лекарственный препарат среде. CO2, образующийся во время роста и метаболизма микобактерий в такой среде, измеряется и обозначается как индекс роста (Growth Index - GI). Как только GI в контрольном образце достигает значения 30 (обычно после 4-6 дней инкубации - максимум 1 2 дней), сравнение показателей GI в содержащей лекарственный препарат среде и не содержащей его является основой пропорции резистентности.
Тест на чувствительность с использованием BACTEC MGIT 960 был внедрен на основе аналогичных принципов, при этом увеличение флуоресценции в датчике измеряется автоматически и обозначается как значение роста (Growth Value - GV).
Если лекарственный препарат добавляется в среду, обладающую бактериостатическими или бактерицидными свойствами по отношению к тестируемым микобактериям, он ингибирует рост, таким образом, кислород поглощается либо в малых количествах, либо не поглощается совсем, поэтому отсутствует флуоресценция датчика. Результаты теста на лекарственную чувствительность, полученные при использовании системы BACTEC MGIT 960, идентичны данным, получаемым при помощи системы BACTEC 460TB, длительность исследования также примерно одинаковая. Концентрации лекарственных препаратов в тесте на чувствительность SIRE с использованием BACTEC MGIT 960 несколько ниже, чем в методе пропорций на плотной среде (во избежание ложных результатов чувствительности).
Тест на чувствительность BACTEC MGIT 960 был подвергнут детальной оценке путем сравнения со средой Мидлбрук 7H10, а также с системой BACTEC 460 TB System.
1.1.5.2 Тесты, применяемые при более высоких концентрациях лекарственных препаратов
Рекомендуется всегда тестировать лекарственные препараты ряда SIRE в критических концентрациях. Однако в некоторых ситуациях показано тестирование при более высокой концентрации. Оно играет роль для изолятов, имеющих низкий уровень резистентности, т.е. изолят проявляет резистентность при предельной концентрации, но чувствителен к высокой концентрации препарата. Поэтому во многих лабораториях сначала проводится тест при критической концентрации препарата, и в случае резистентности изолята он тестируется при высокой концентрации.
При высоких концентрациях тестируют только стрептомицин, изониазид и этамбутол. Из трех данных препаратов изониазид наиболее важен, поскольку врачи-клиницисты могут посчитать необходимым продолжить использование изониазида в терапевтическом режиме, если выделенная культура пациента резистентна при критической концентрации и чувствительна при высокой концентрации (т. н. "резистентность низкого уровня"). В продаже имеются указанные высокие концентрации стрептомицина, изониазида и этамбутола для BACTEC MGIT 960.
Конечная концентрация препарата в среде должна быть следующей:
стрептомицин 4,0 мг/мл среды
изониазид 0,4 мг/мл среды
этамбутол 7,5 мг/мл среды
1.1.5.3 Учет результатов
По завершении теста (4-21 день) на приборе появится сообщение о готовности результатов. Необходимо просканируйте штрих-код держателя и распечатать отчет. В распечатке прибора указаны результаты теста на чувствительность к каждому лекарственному препарату. Результаты имеют качественный характер: чувствительный (S),резистентный (R), либо результат теста не определен (X).
Прибор интерпретирует результаты, когда единица роста (GU) в контроле роста достигает значения 400 (в течение 4-13 дней). В этот момент оцениваются показатели единицы роста флакона с лекарственным препаратом.
S-чувствительный - единица роста пробирки с лекарственным препаратом составляет менее 100.
R-резистентный - единица роста пробирки с лекарственным препаратом составляет 100 и более.
X-ошибка - неясные результаты, получаемые при определенных обстоятельствах, которые могут повлиять на процедуру теста, например, при достижении единицей роста контрольного образца величины ?400 менее чем за 4 дня. В подобных случаях тест необходимо повторить с чистой, активнорастущей культурой, которая подтверждена как комплекс M. tuberculosis. Некоторые лекарственноустойчивые штаммы растут в среде очень медленно, и со стандартным инокулятом результаты могут быть не достигнуты в течение 13 дней. В таком случае необходимо также повторить исследование.




| В закупочной документации не найдены недействующие или несуществующие стандарты и нормы |
| Продавец |
|---|
| ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ "МЕДЕЯ" ИНН 5256146449, КПП 525601001 Вероятные контактные данные: 7-831-4106752, ipserj@yandex.ru |
Протокол подведения итогов
| Наименование участника | Ценовое предложение | ИНН | КПП | Вероятные контактные данные |
|---|---|---|---|---|
| 1 | ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ "МЕДЕЯ" | 5256146449 | 525601001 | 7-831-4106752, 8-831-4106752, 7-831-4242900 , ipserj@yandex.ru, medeya@mail.ru, ipserg@yandex.ru |
опубликовано






Посмотреть все закупки заказчика
Карточка будет добавлена в Избранное
В случае публикации текущей закупки, она заменит отслеживаемую будущую, Вы получите уведомление
Понравилась закупка? Оцените свои возможности, примите решение об участии, подготовьте необходимые документы
Вы подали заявку на участие в аукционе?
Допущены к торгам?
Организатор торгов отклонил Вашу заявку и Вы не согласны с данным решением?
Аукцион! Выигрывает тот, кто предлагает наиболее выгодные условия и цену.
Ожидайте результатов аукциона, отслеживайте соблюдение сроков:
Вы победитель? Поздравляем! Предоставьте Заказчику обеспечение исполнения контракта и подпишите контракт
Строго соблюдайте сроки. Соотношение рабочих и выходных дней не принципиально:
Соотношение рабочих и выходных дней принципиально:
Преимущества для Субъектов Малого Предпринимательства и Социально Ориентированных Некоммерческих организаций:
- Сумма обеспечения - до 2% от стоимости контракта.
- Оплата закупки - не более 15 дней с момента подписания документа о приемке.
Возможно увеличение цены контракта до 15%, но не более начальной цены в случаях:
- Если продавец - организация инвалидов
- Если продавец - предприятие уголовно-исполнительной системы
- Товарам/работам/услугам, произведенным на территории государств - членов Евразийского экономического союза
В данной закупке могут принималь участие только организации - субъекты малого предпринимательства и социально ориентированные некоммерческие организации
Установлен запрет на продажу товаров, происходящих из иностранных государств, работ, услуг, соответственно выполняемых, оказываемых иностранными лицами
В отношении участников закупки установлено требование о привлечении к исполнению договора субподрядчиков (соисполнителей) из числа субъектов малого и среднего предпринимательства
Участниками закупки могут быть только субъекты малого и среднего предпринимательства

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
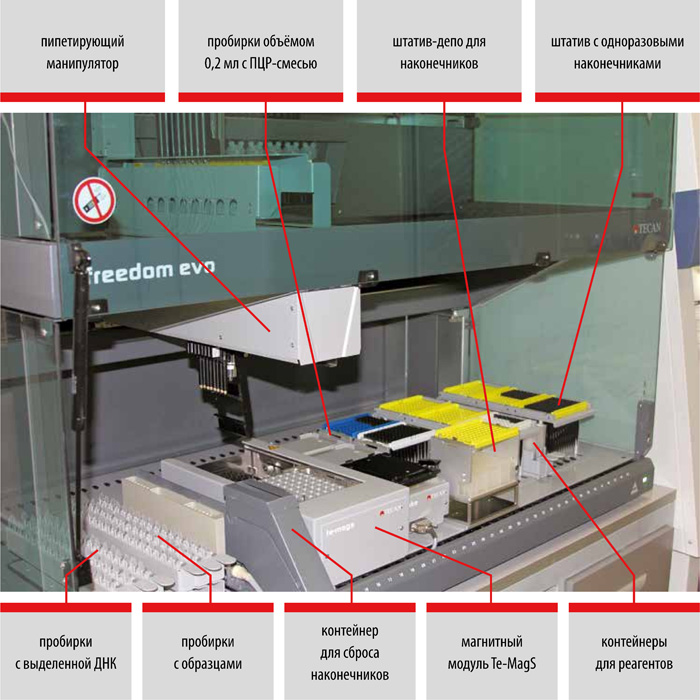
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
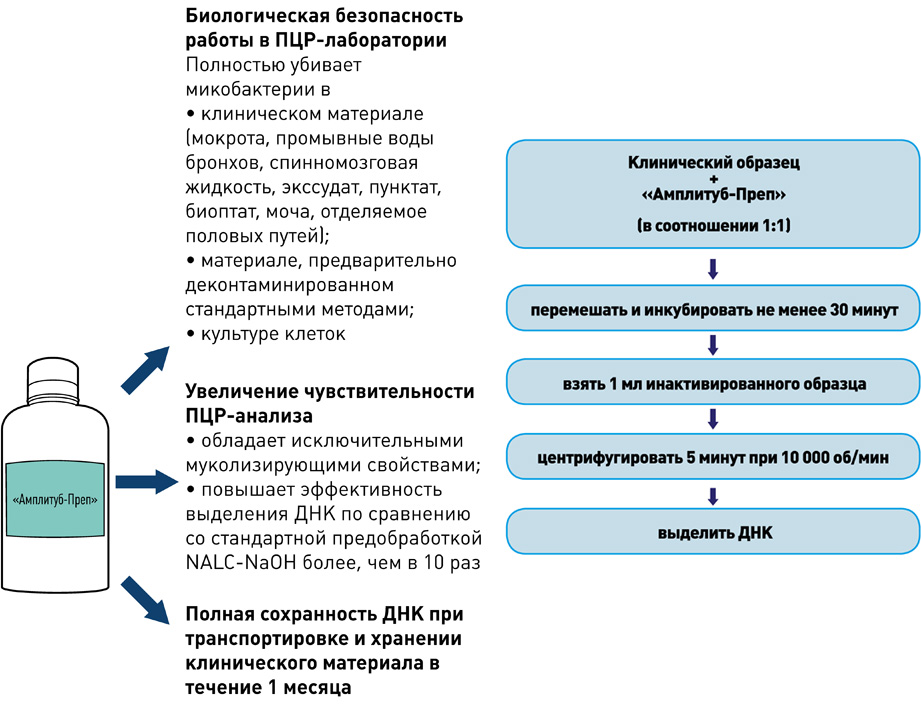
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
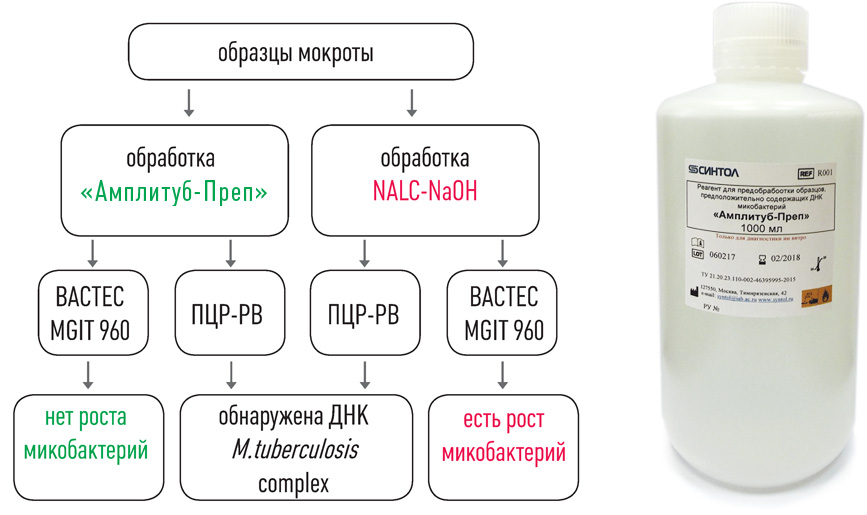
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
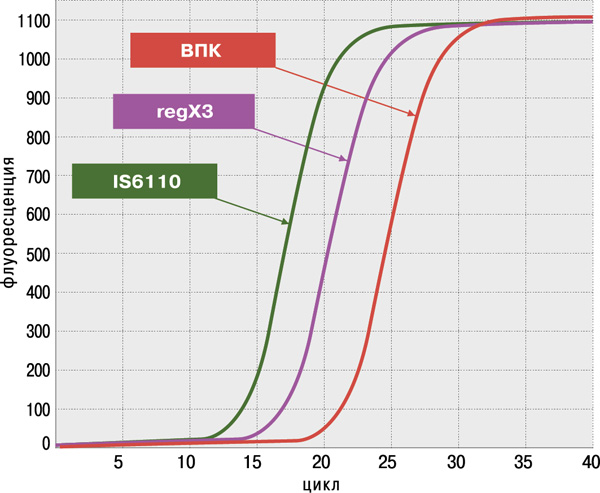
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
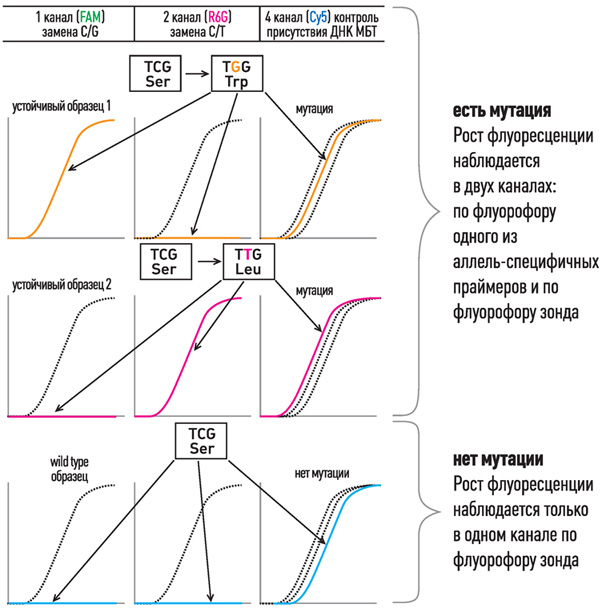
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
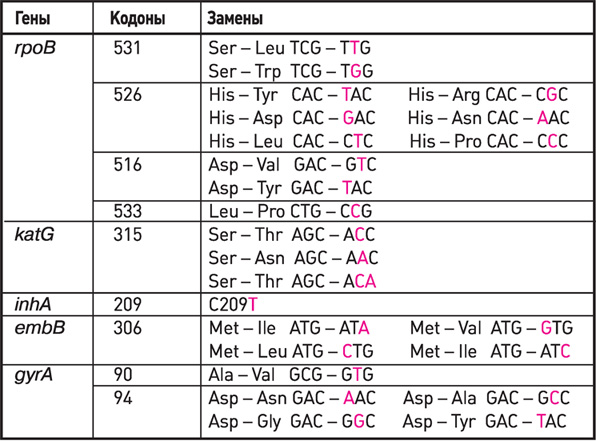
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
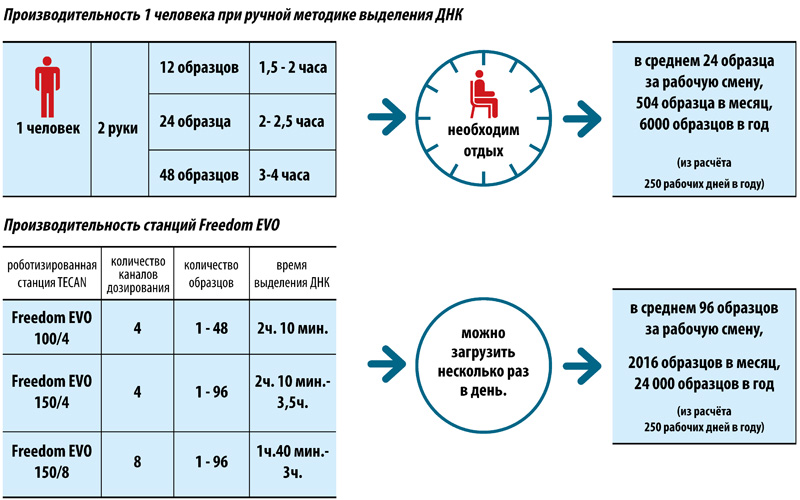

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Читайте также:


