Люминесцентная микроскопия на микобактерии туберкулеза что это такое
Консультант по гематологии,
цитохимии и микробиологии
Важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях занимают микробиологические исследования. Современная клиническая медицина предъявляет к микробиологическим (бактериологическим) исследованиям возрастающие требования по увеличению объема, повышению качества исследований, разработке и внедрению новых более совершенных методов. Это связано как с новыми научными достижениями в области эпидемиологии и бактериологии, так и с увеличением гнойно-воспалительных заболеваний, ростом госпитальных инфекций.
Материалом для изучения этиологии заболеваний дыхательных путей служат: отделяемое зева и носа; мокрота; содержимое бронхов, полученное при бронхоскопии или при отсасывании через трахеостому (у больных, находящихся на аппаратном дыхании); экссудаты; резецированные ткани и др. Материал собирают с соблюдением правил асептики в предварительно простерилизованные баночки или пробирки и доставляют в лабораторию. Хранение материала способствует размножению сапрофитирующей микрофлоры, развитию процессов гниения и брожения, что искажает результаты анализа. Интервал между взятием материала и его посевом не должен превышать 1-2 часа. Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из мокроты. При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Чувствительность метода люминесцентной микроскопии значительно выше - от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Чтобы диагностировать туберкулез, необходимо сделать все возможное для выявления возбудителя заболевания. Микробиологически диагноз может быть подтвержден на основе результатов культурального исследования на комплекс M. tuberculosis (или, при возможности, путем идентификации специфических последовательностей нуклеиновых кислот) в пробах, взятых в месте локализации патологического процесса. Однако на практике в настоящее время многие лаборатории не располагают материально-технической базой для проведения культуральных исследований. К счастью, микроскопия окрашенных препаратов мокроты доступна практически везде, поэтому диагностика туберкулеза может проводиться на основе выявления кислотоустойчивых микобактерий. На территориях с высокой распространенностью туберкулеза выявление кислотоустойчивых микобактерий в окрашенных препаратах мокроты демонстрирует высокую специфичность, поэтому положительный результат микроскопии мокроты можно рассматривать как подтверждение диагноза. Кроме высокой специфичности к комплексу M. tuberculosis, выявление кислотоустойчивых микобактерий при микроскопии играет важную роль по трем причинам: это – наиболее быстрый метод диагностики туберкулеза; позволяет выявить больных с тяжелым развитием патологии, чреватым высоким риском летального исхода; дает возможность выявить больных, являющихся распространителями инфекции.
Оценка качества работы лабораторий микроскопии должна проводиться соответствующим государственными органом (как правило, представителями национальной программы борьбы с туберкулезом).
Неправильный диагноз, поставленный перед началом лечения, приводит к риску ненужного, неправильного или неудачного лечения. Более того, подобный подход чреват несвоевременной постановкой правильного диагноза и назначением соответствующего лечения. При надлежащем подходе и контроле в большинстве случаев у детей в возрасте пяти лет и старше могут быть получены образцы мокроты. У подростков (хотя они часто относятся к детской возрастной группе, по крайней мере, до 15 лет) получить пробы мокроты не составляет большого труда. Поэтому фактор возраста не может рассматриваться как препятствие для сбора проб мокроты у детей и подростков.
Исходя из имеющихся данных, можно прийти к заключению, что для диагностики туберкулеза необходимо взять не менее двух проб мокроты. В случаях, когда имеются соответствующие возможности, можно направлять для лабораторного исследования еще и третью пробу, но исследование более трех проб мокроты вряд ли целесообразно, поскольку не может в значительной мере повысить эффективность диагностики. Кроме того, исследование третьей пробы может оказаться полезным только для подтверждения диагноза, если одна или две предыдущие пробы дали положительный результат. Крайне желательно, чтобы результаты микроскопии мокроты направлялись лечащему врачу в течение одного рабочего дня с момента отправки проб. Не меньшее значение имеет также и время сбора проб. Результаты исследований показывают, что эффективность лабораторных анализов максимальна, если пробы мокроты получены утром, после пробуждения от ночного сна. Возможно, совершенно необязательно собирать только утренние пробы, но, про крайней мере, одна из них должна быть получена утром.
Как правило, внелегочные очаги туберкулезного процесса содержат гораздо меньшее количество M. tuberculosis, поэтому микроскопическое выявление кислотоустойчивых микобактерий в пробах из внелегочных очагов весьма затруднено, и в таких случаях результаты культуральных исследований приобретают большое значение. Учитывая низкую результативность микроскопии, при внелегочном туберкулезе культуральные и морфологические исследования приобретают особое значение, например, в диагностическом исследовании проб ткани лимфатических узлов, полученных при помощи игловой биопсии.
Лечение пациентов, у которых наблюдаются тяжелое или быстро развивающееся заболевания, ассоциированные с туберкулезом, необходимо начинать немедленно, даже до лабораторного подтверждения диагноза. Лечение следует начинать до получения результатов лабораторного исследования и лишь позднее внести необходимые поправки и изменения в схему лечения с учетом результатов микроскопии.
Хотя микроскопия мокроты является наиболее доступным бактериологическим тестом, там, где ресурсы позволяют и имеются условия для качественной лабораторной диагностики, в диагностический алгоритм необходимо включать культуральные исследования мокроты, в случаях отрицательных результатов микроскопии. Правильное проведение культуральных исследований связано с определенными трудностями и дополнительными затратами, но этот метод отличается более высокой чувствительностью и повышает вероятность раннего выявления больных туберкулезом.
Микроскопия мазков мокроты по Циль-Нильсену является важнейшим элементом диагностики туберкулеза. Исследование 3 мазков мокроты позволяет выявить более 60% случаев туберкулеза легких и 95% наиболее заразных случаев (исследование одного мазка мокроты выявляет 75% наиболее заразных случаев, исследование второго мазка мокроты добавляет еще 20%, а исследование третьего - еще 5%).
Микроскопия мазков мокроты по Циль-Нильсену позволяет быстро получить результаты, выявить основные источники инфекции, является менее дорогостоящей, чем посев мокроты и широко доступна для применения. Но она должна быть надежной и хорошо контролироваться. Вероятность обнаружения МБТ при бактериоскопии мазков мокроты прямо пропорциональна концентрации возбудителя в исследуемом материале. Например, когда в 1 мл мокроты содержится от 1000 до 10000 МБТ, то вероятность получения положительного результата составляет около 40-50%. При концентрации МБТ менее 1000 в 1 мл мокроты вероятность их обнаружения резко снижается – отрицательные результаты получаются примерно в 96% случаев.
Основным и наиболее часто изучаемым биоматериалом в пульмонологической практике является мокрота. Требования к забору и качеству мокроты следующие:
1) первую пробу мокроты желательно получить до начала курса антибиотикотерапии;
2) мокроту оптимально собирать утром, до приема пищи, после тщательного туалета полости рта (полоскание кипяченой водой);
3) больным нужно доступно объяснить, что требуется получить именно содержимое нижних отделов дыхательных путей, а не ротоглотки, и, по возможности, проконтролировать их действия;
4) забор материала проводить в стерильные интактные контейнеры;
5) продолжительность хранения мокроты в контейнерах не должна превышать 2 ч (в летнее время желательно не более 1 ч);
6) в условиях лаборатории качество мокроты оценивается после окрашивания мазка по Граму (при наличии в мазке менее 25 лейкоцитов и более 10 эпителиальных клеток, при просмотре не менее 8-10 полей зрения при малом увеличении, мокрота признается некачественной, дальнейшее ее исследование нецелесообразно, так как, скорее всего, материал получен из ротовой полости);
7) высокая диагностическая ценность исследования признается при выделении возбудителя в концентрации і106 КОЕ/мл.
Вообще, в диагностике заболеваний туберкулезом можно выделить несколько этапов:
· Преаналитический этап (предварительный диагноз, выбор материала и метода исследования, забор биомтериала и его транспортировка)
· Аналитический этап (непосредственно проведение анализа)
· Постаналитический этап (оценка результатов)
Часть этих этапов проводится вне лаборатории, поэтому очень важна согласованная и качественная работа всех специалистов, привлеченных в этот процесс. Важен правильный выбор исследуемого материала. Важным этапом диагностики являются процедуры взятия и доставки материала в лабораторию.При взятии всех видов исследуемого материала следует ориентироваться на стандартные системы для этой цели: тампоны, цитощетки, тубсеры, контейнеры и т.п. Эффективность аналитического этапа во многом определяется уровнем технического оснащения лабораторий. Постаналитический этап исследования включает две составляющие: проверку достоверности полученного результата и оценку этиологической значимости выделенных штаммов. В лаборатории должен осуществляться строгий внутренний контроль качества исследований, важной составляющей которого является проверка полученных результатов на достоверность. Оценка этиологической значимости выделенных микроорганизмов принципиальна для выбора адекватной терапии. Процедура приготовления мазков начинается с подготовки предметных стекол. Необходимо использовать только новые, отмытые и обезжиренные в спирте или смеси для обезжиривания предметных стекол (производство АБРИС+) стекла без царапин и сколов. При повторном использовании стекла могут быть недостаточно хорошо отмыты от предыдущего материала, что может привести к получению ложноположительных результатов. Не рекомендуется использовать саморезанные стекла, которые приводят к значительным аберрациям исследуемого изображения. Стекла должны соответствовать ГОСТу. Стекла, на которых при микроскопическом исследовании были обнаружены кислотоустойчивые микобактерии, сохраняются в лаборатории в течение 1 года, а затем подлежат обязательному уничтожению и не должны использоваться повторно. Новые предметные стекла кипятят 15 минут в 1% растворе питьевой соды (10 г двууглекислого натрия на 1 л воды), промывают в 1% растворе соляной кислоты (к 1 л воды добавляют 10 мл концентрированной соляной кислоты), а затем промывают в проточной воде и протирают насухо.
Начиная с открытия Коха, длительное время основным и наиболее распространенным методом выявления микобактерий туберкулеза являлась бактериоскопия.
В настоящее время метод бактериоскопии считается недостаточным для диагностики туберкулеза. В практической работе противотуберкулезных учреждений необходимо чаще применять посев исследуемого материала на питательную среду, т. е. бактериологический метод.
Кроме бактериоскопии и метода посева, необходимо в ряде случаев использовать и прививки лабораторным животным, т. е. биологический метод.
Микобактерии туберкулеза можно обнаружить в различном материале, полученном от больного. Таким материалом является прежде всего мокрота. С усовершенствованием лабораторных методов удается обнаружить микобактерии туберкулеза в мокроте при незначительных изменениях в легких, а в ряде случаев — и без видимых на рентгенограмме туберкулезных поражений в легких. При отсутствии мокроты или невозможности ее получения исследуют промывные воды желудка. Этот способ после работ Арман-Делилля [Armand-Delill, 1927] имеет широкое применение в практике противотуберкулезных учреждений. Предполагали, что микобактерии туберкулеза попадают с мокротой в желудок как у взрослых, так и особенно у детей, страдающих легочным туберкулезом. Исследования и клинические наблюдения, проведенные в СССР и за рубежом, показали, что микобактерии туберкулеза в промывных водах желудка можно обнаружить не только при легочном, но и при внелегочном туберкулезе (кожи, костей, глаз, лимфатических узлов). Эти наблюдения доказывают возможность поступления микобактерии туберкулеза в желудок лимфогематогенным путем независимо от локализации туберкулезного процесса.
При отсутствии мокроты можно исследовать, кроме промывных вод желудка, слизь из гортани, а также промывные воды бронхов. Для этого больному натощак после предварительной анестезии дыхательных путей 1 % раствором дикаина орошают гортань подогретым изотоническим раствором хлорида натрия (10—15 мл) с помощью гортанного шприца. При этом необходимо создать такое положение больного, которое способствовало бы попаданию раствора в бронхи пораженного легкого. Изотонический раствор хлорида натрия, раздражая слизистую оболочку бронха, вызывает усиленное отделение слизи. Выделяемые при откашливании больным промывные воды бронха собирают в стерильный сосуд и подвергают дальнейшему исследованию.
Можно исследовать микобактерии туберкулеза, выделенные в фекальных массах, но при обнаружении в них микобактерий туберкулеза трудно решить вопрос, из каких органов последние выделяются.
Исследовать можно также мочу, спинномозговую жидкость, другие биологические жидкости и патологический материал.
Бактериоскопические методы выявления микобактерий туберкулеза
Бактериоскопические методы выявления микобактерий включают: обычную бактериоскопию мазков, окрашенных по Цилю — Нильсену, флотацию и люминесцентную микроскопию.
Обычная бактериоскопия. В мазках, окрашенных по Цилю — Нильсену, микобактерии туберкулеза могут быть обнаружены только при наличии не менее 50 000 бактериальных клеток в 1 мл патологического материала (предел чувствительности метода), причем тогда, когда микобактерии не изменены тинкториально или морфологически под влиянием антибактериальных препаратов (при лечении больного).
Для приготовления мазков мокроту выливают в чашку Петри и заостренными деревянными палочками из 5—6 участков выбирают гнойные комочки на два предметных стекла для приготовления мазков. Один препарат используют для исследования на эластические волокна. На другом стекле комочки мокроты растирают третьим стеклом и получают таким образом два препарата, один из которых окрашивают по Цилю — Нильсену, а второй, например, флюорохромными красками, если имеется возможность произвести люминесцентную микроскопию.
При окраске по Цилю — Нильсену на препарат наливают карболовый фуксин, подогревают до появления паров, обесцвечивают 6% раствором серной кислоты или 3% солянокислым алкоголем и докрашивают 0,25% раствором метиленового синего.
Окрашенные мазки микроскопируют с иммерсионной системой. При этом микобактерии туберкулеза выглядят красными на синем фоне. Типичные микобактерии имеют вид тонких, прямых или слегка изогнутых зернистых палочек.
Количество микобактерий туберкулеза, обнаруживаемых методом бактериоскопии в мокроте больного, зависит от многих причин и может колебаться в различных пределах. Учитывая возможные случайности и затруднения для определения количества микобактерий туберкулеза, мокроту больного рекомендуется исследовать повторно.
С введением в практику бактериостатических средств, препятствующих росту и размножению микобактерий туберкулеза в организме больного, определение количества их в мокроте в период лечения может быть относительным критерием эффективности антибактериальной терапии, учитывать который необходимо в комплексе с клиническими, рентгенологическими и другими лабораторными исследованиями. При отрицательных результатах бактериоскопии мокроты больных туберкулезом или лиц, подозрительных на туберкулез, рекомендуется производить повторные исследования мокроты 4—5 дней подряд или гомогенизировать мокроту при помощи химических веществ, т. е. превращать в однородную массу, и центрифугировать ее с целью концентрации микобактерий туберкулеза в небольшом объеме.
В мокроте могут быть различные форменные элементы: лейкоциты, эритроциты, эпителий, альвеолярные клетки, пылевые клетки, цилиндрический мерцательный эпителий, эластические волокна, известковые соли, кристаллы холестерина. Плоский эпителий может исходить из полости рта, глотки, гортани. У лиц, вдыхающих угольную пыль и дым, в мокроте обнаруживаются пылевые клетки. Цилиндрический эпителий может включаться в мокроту при прохождении последней через бронхи и трахею. Эритроциты, единичные и неизмененные, могут попадать в мокроту из поврежденных десен и носоглотки, но наличие эритроцитов в мокроте может быть и вследствие кровохарканья.
В мокроте могут быть, кроме описанных, эластические волокна Коплена — Джонса, или коралловидные. Они представляются толстыми, шероховатыми образованиями, заканчивающимися колбасообразно. Можно обнаружить и обызвествленные эластические волокна.
Наличие эластических волокон в мокроте указывает на разрушение легочной ткани. При свежем распаде пучки волокон сохраняют альвеолярное строение, при пролиферативных формах туберкулеза эластические волокна выделяются в виде пучков без сохранения альвеолярного строения. Волокна могут выделяться при всех формах туберкулеза; волокна Коппена — Джонса появляются преимущественно в случаях старого туберкулеза. Обызвествленные волокна можно видеть при распаде обызвествленных очагов во время обострения процесса.
Необходимо иметь в виду, что эластические волокна также можно обнаружить и при ряде нетуберкулезных заболеваний легких, например при абсцессе легких.
В мокроте больных туберкулезом можно обнаруживать известковые соли (карбонаты и сульфаты), имеющие под микроскопом вид темных зерен разной величины. Попадают они в мокроту чаще всего из старых, распадающихся обезвествленных очагов. Известковые соли от прибавления разведенной азотной кислоты растворяются.
Кристаллы холестерина в мокроте имеют вид нежных пластинок разной величины, большей частью с обломанными краями. Эти кристаллы обнаруживаются при наличии в легких старых каверн.
Метод флотации. Этот метод применяется в случаях скудного содержания микобактерий туберкулеза в исследуемом материале и при отрицательном результате бактериоскопии. По сравнению с обычной бактериоскопией микобактерии туберкулеза обнаруживаются методом флотации в патологическом материале примерно на 10—15% чаще. Для исследования методом флотации мокроту в количестве 12—15 мл помещают в колбу емкостью 250 мл, добавляют примерно равное количество 0,5% раствора едкого натра или кали и для лучшей гомогенизации встряхивают в течение 5—10 мин, затем до половины емкости колбы наливают дистиллированную воду с добавлением 0,5 мл ксилола или бензина. Все содержимое встряхивают 5—10 мин, после чего доливают дистиллированную воду до окончательного объема — 250 мл. Спустя 30—60 мин капельки бензина (ксилола) всплывают на поверхность, увлекая за собой микобактерии туберкулеза, концентрируя их в небольшом объеме образовавшегося на поверхности кольца. Полученное флотационное кольцо пипеткой переносят на два предметных стекла. Один препарат окрашивают по Цилю — Нильсену.
При флотации промывных вод, гноя, экссудата, спинномозговой жидкости и другого материала, не требующих гомогенизации, к ним добавляют меньшее количество раствора щелочи (от 1—2 капель до 1—2 мл в зависимости от количества материала). В дальнейшем поступают так же, как при флотации мокроты.
Люминесцентная микроскопия. Метод люминесцентной микроскопии основан на способности микобактерий туберкулеза, окрашенных флюорохромами, светиться под воздействием сине-фиолетовых лучей.
Этот метод позволяет дополнительно выявлять микобактерии туберкулеза на 17% чаще по сравнению с обычной бактериоскопией и на 8% чаще по сравнению с методом флотации. При люминесцентной микроскопии исследование производится при малом увеличении, что расширяет поле зрения и способствует обнаружению микобактерий туберкулеза, содержащихся в исследуемом материале в небольшом количестве.
Для люминесцентного исследования пользуются либо специальным микроскопом (МЛ-1 и МЛ-2), либо обычным микроскопом типа МБИ-1 с добавочным осветителем. Ко всем комплектам осветительной аппаратуры прилагаются наборы необходимых светофильтров.
Люминесцентным методом исследуют различный патологический материал. Фиксированные над пламенем препараты
окрашивают при легком подогревании в течение 15 мин специальной смесью: аурамин 00—0,5 г, радомин С — 0,05 г на 1000 мл дистиллированной воды. Затем мазок промывают водой и в течение полминуты обесцвечивают 3% солянокислым спиртом, снова промывают водой и докрашивают для гашения фона 0,25% раствором метиленового синего. При люминесцентной микроскопии микобактерии флюоресцируют золотисто-желтым цветом на темном нефлюоресцирующем фоне. Этот метод в настоящее время находит широкое применение.
Бактериологические методы
Больной туберкулезом в процессе антибактериального лечения может выделять микобактерии туберкулеза, измененные морфологически и в небольшом количестве, что не позволяет обнаружить их бактериоскопическими методами (обычная бактериоскопия, метод флотации, люминесцентная микроскопия). Поэтому в комплекс исследований, направленных на обнаружение микобактерий туберкулеза, в настоящее время обязательно включается посев патологического материала. Выделение культур микобактерий туберкулеза позволяет определить жизнеспособность возбудителя, его лекарственную чувствительность, ферментативную активность и вирулентность.
Для бактериологического исследования может быть использован любой патологический материал.
Поскольку обычно в посевном материале содержится и неспецифическая микрофлора, требуется его так обработать, чтобы уничтожить сопутствующую микрофлору и сохранить при этом жизнеспособность микобактерий туберкулеза.
В последние годы в связи с широким применением противотуберкулезных препаратов в 19—20% случаев наблюдается диссоциация между обнаружением микобактерий туберкулеза при бактериоскопическом исследовании и ростом их при посеве патологического материала. Это явление заключается в том, что видимые под микроскопом, они не растут на питательных средах. Такая диссоциация обусловлена воздействием на микобактерии туберкулеза лекарственных препаратов.
Биологическая проба. Наиболее чувствительным методом обнаружения микобактерий туберкулеза является заражение морских свинок. Однако не всегда удается получить развитие генерализованного туберкулеза в тех случаях, когда в патологическом материале содержатся микобактерии туберкулеза, устойчивые к препаратам гидразида изоникотиновой кислоты. В таких случаях микобактерии оказываются невирулентными для этих животных, и тогда при положительном результате посева патологического материала имеет место отрицательный исход заражения.
При развитии туберкулезного процесса после подкожного заражения в области введения материала к концу месяца прощупываются увеличенные лимфатические узлы. Аллергические реакции определяются при внутрикожном введении 0,1 мл ATK 1 : 10. При положительной биологической пробе у морских свинок развивается генерализованный туберкулез.

Микробиологические методы исследования при туберкулезе

В.Ю. Мишин
Для обнаружения возбудителя туберкулеза в биологическом материале больных применяют следующие методы: микроскопию препаратов патологического материала по методу Циля-Нельсена; люминесцентную микроскопию патологического материала; полимеразно-цепную реакцию; бактериологический (культуральный) метод.
Микроскопия препаратов патологического материала по методу Циля- Нельсена является основным методом выявления кислотоустойчивых микобактерий (КУМ).
На основании микроскопического исследования можно сделать заключение только о наличии или отсутствии в препарате КУМ. Это объясняется тем, что в природе существует большое разнообразие видов микобактерий, включая и нетуберкулезные, одинаково хорошо воспринимающих окраску раствором карболового фуксина.
Мазки патологического материала обрабатывают карболовым фуксином, а затем обесцвечивают 5% раствором серной кислоты или 3% раствором солянокислого спирта. Докрашивают мазки 0,25% раствором метиленового синего.
Окрашенные препараты просматривают в световом микроскопе с иммерсионной системой. КУМ окрашиваются в красный, а окружающий фон — в синий.
При микроскопическом исследовании препарата, окрашенного по методу Циля-Нельсена, следует просматривать не менее 100 полей зрения, что обычно вполне достаточно, чтобы обнаружить в препарате единичные КУМ. В том случае, если результат исследования оказывается отрицательным, для подтверждения необходимо просмотреть дополнительно 200 полей зрения.
Результат исследования возможно получить в течение 1 ч, но обычно его выдают через 24 ч. Значимыми преимуществами бактериоскопического выявления КУМ в патологическом материале больных туберкулезом является доступность метода, его экономичность и быстрота получения результата. Вместе с тем метод относительно малочувствителен (необходимо, чтобы в 1 мл исследуемого материала содержалось не менее 50—100 тыс. микробных тел) и недостаточно специфичен.
Люминесцентная микроскопия увеличивает разрешающую способность микроскопии по сравнению с окраской по Цилю-Нельсену на 14—30%. Для окраски используют флюорохромы — органические красители, флюоресцирующие при освещении ультрафиолетовыми, фиолетовыми или синими лучами. Такими красителями являются аурамин 00 и родамин С.
Препарат исследуют с помощью люминесцентного микроскопа: микобактерии светятся золотисто-желтым цветом на темном фоне. Количество КУМ, обнаруживаемых при микроскопическом исследовании, является очень важным информационным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания.
Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. При использовании объектива 90х-100х и окуляра микроскопии мазка мокроты 7х— 10х(общее увеличение — 630х— ЮООх) принята следующая градация результатов световой иммерсионной микроскопии по методу Циля-Нельсена, представленная в таблице: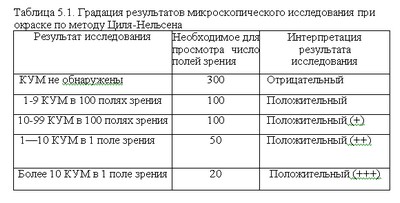
Полимеразно-цепная реакция (ПЦР) является одним из наиболее быстрых и информативных методов выявления МБТ. Принцип метода состоит в увеличении в 106—108 раз числа копий специфического участка ДНК МБТ, катализируемого in vitroRH К-полимеразой в автоматическом режиме.
В искусственных условиях воспроизведение процесса репликации специфического или определенного вида или рода возбудителей участка генома возможно при условии знания его нуклеотидной последовательности. Применение методов детекции продуктов репликации таких участков (ампликоны) позволяет констатировать наличие возбудителя в исследуемой пробе.
К достоинствам метода ПЦР относятся:
- высокая чувствительность, позволяющая определять 10—100 клеток в биологической пробе;
- высокая специфичность ДНК МБТ в исследуемом материале;
- универсальность процедуры обнаружения МБТ из одной биологических проб;
- высокая скорость анализа (4—4,5 ч).
Вместе с тем высокая разрешающая способность метода в ряде случаев может приводить к ложноположительным результатам, что ограничивает достоверность исследования.
Бактериологический (культуральный) метод выявления МБТ заключается в посеве мокроты и другого патологического материала на питательные среды. Для эффективного выделения культуры МБТ достаточно единичных жизнеспособных бактериальных клеток (20-100 микробных тел) в образце диагностического материала. Рост культуры регистрируют за 21-90 сут.
Для посева диагностического материала используют разнообразные питательные среды, среди которых можно выделить три основные группы: плотные питательные среды на яичной основе; плотные или полужидкие питательные среды на агаровой основе; жидкие синтетические и полусинтетические питательные среды. В России наиболее широкое распространение получила плотная питательная среда Левенштейна-Йенсена.
Среду Левенштейна-Йенсена применяют во всем мире в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности. Рост МБТ на этой среде проявляется в диапазоне от трех недель до трех месяцев (в среднем 1,5 мес).
Вирулентные культуры МБТ обычно растут на плотных питательных средах в виде R-колоний (от англ. rough — грубый, шершавый) различной величины и вида, имеют желтоватый или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую манную крупу или цветную капусту.
Лекарственную устойчивость МБТ определяют методом абсолютных концентраций на плотной яичной питательной среде Левенштейна— Йенсена, основанной на добавлении определенных стандартных концентраций противотуберкулезных препаратов, которые принято называть критическими при расчете на мкг/мл.
Культура МБТ считается чувствительной к той или иной концентрации противотуберкулезного препарата, которая содержится в среде, если число колоний МБТ, выросших на одной пробирке с препаратом, не превышает 20, а посевная доза соответствует 107 микробных тел.
Уровень устойчивости данного штамма МБТ в целом выражается той максимальной концентрацией препарата (количество мкг в 1 мл питательной среды), при которой еще наблюдается размножение МБТ. Для различных противотуберкулезных препаратов установлена определенная критическая концентрация. Она имеет клиническое значение, так как отражает воздействие препарата на МБТ в условиях макроорганизма.
Для метода абсолютных концентраций появление более 20 колоний на питательной среде, содержащей противотуберкулезный препарат, в критической концентрации свидетельствует о том, что данный штамм МБТ обладает лекарственной устойчивостью.
Критические концентрации противотуберкулезных препаратов при определении лекарственной устойчивости методом абсолютных концентраций на среде Левенштейна-Йенсена составляют для:
- изониазида 1 мкг/мл;
- рифампицина — 40 мкг/мл;
- пиразинамида — 200 мкг/мл;
- этамбутола — 2 мкг/мл;
- стрептомицина — 10 мкг/мл;
- канамицина — 30 мкг/мл;
- капреомицина — 30 мкг/мл;
- протионамида (этионамида) — 30 мкг/мл;
- циклосерина — 30 мкг/мл;
- ПАСК — 1 мкг/мл;
- офлоксацина — 2 мкг/мл.
В большинстве случаев метод абсолютных концентраций применяется для непрямого определения лекарственной устойчивости. Вначале производят посевы мокроты на твердые питательные среды и получают чистую культуру МБТ, которую пересевают на питательные среды, содержащие определенные концентрации противотуберкулезных препаратов.
Так как сроки выделения МБТ на питательных средах составляют
не менее 1,5 мес, то результаты определения устойчивости указанным методом обычно получают не ранее чем через 2—2,5 мес после посева материала.
Кроме описанных выше классических методов культивирования МБТ и определения лекарственной устойчивости, в России нашли свое применение следующие современные системы.
Система ВАСТЕС460 — радиометрический метод быстрого определения роста МБТ путем регистрации уровня меченного С02, образующегося в процессе утилизации субстрата с пальмитиновой кислотой, содержащей радиоактивный С14. Для роста МБТ в данной системе используют флаконы с жидкой питательной средой, которая представляет собой обогащенную среду Middlebrook 7H9, содержащую радиоактивный С14. При размножении МБТ утилизируют С14 и выделяют С1402; в этом случае учет идет по нарастанию С1402.
Полностью автоматизированный комплекс позволяет одновременно исследовать лекарственную чувствительность МБТ в 960 исследуемых образцах.
Наличие роста МБТ в системе ВАСТЕС регистрируется на 4—5-й день от момента посева. В системе ВАСТЕС, где используют те же абсолютные концентрации противотуберкулезных препаратов, учет лекарственной устойчивости идет в течение 6 нед.
В последние годы для быстрого определения лекарственной устойчивости используют метод микрочипов, основанный на молекулярно-генетическом анализе (ПЦР) выявления точечных мутаций в гроВ гене, ответственном за устойчивость к рифампицину, и в katG гене, ответственном за лекарственную устойчивость к изониазиду.
Установлено, что более 95% устойчивых к рифампицину штаммов МБТ содержат точечные мутации (делеции и вставки в гроВ гене, кодирующих Р-субъединицу РНК-полимеразы), и что более 70% устойчивых к изониазиду штаммов МБТ имеют делеции и вставки в katG гене, кодирующих каталазу/пероксидазу. Результаты метода микрочипов могут быть получены на 3-4-й день исследования.
Читайте также:


