Метод биочипов в диагностике туберкулеза
Туберкулез относится к заболеваниям, от эффективности борьбы с которыми зависит национальная безопасность любого государства (ВОЗ). Лечение туберкулеза решающим образом зависит от быстрого обнаружения возбудителя, его идентификации и определения лекарственной чувствительности Mycobacterium tuberculosis (МБТ). До последнего времени с этой целью использовали классический метод высевания анализируемых образцов на плотные питательные среды, содержащие основные противотуберкулезные препараты (ПТП) в стандартных концентрациях. Этот метод считается золотым стандартом диагностики возбудителя туберкулеза и используется практически во всех российских противотуберкулезных центрах. Однако ответ о наличии возбудителя и его лекарственной чувствительности при использовании этого метода может быть получен не ранее 6-8-й недели.
Применение автоматизированных систем с использованием жидких сред – Bactec MGIT 960 (Becton Dickinson) или BacT/Alert 3D (BioMerieux) – сокращает время обнаружения возбудителя до 2-3 нед. Определение чувствительности МБТ к ПТП первого ряда продлевает время анализа еще на 1-3 нед, и чаще всего больным назначают ПТП независимо от того, каким по лекарственной чувствительности штаммом они заражены, хотя подбор схемы лечения с учетом характера устойчивости МБТ у больного в значительной степени определяет ее эффективность.
Принципиальное решение проблемы быстрого обнаружения, идентификации возбудителя туберкулеза и определения его лекарственной чувствительности было найдено в результате разработки технологии биологических микрочипов.
Обычно для выявления или количественного анализа какого-либо вещества в окружающей среде или биологическом материале, полученном от пациента, проводят реакцию с реактивом, специфически взаимодействующим с этим веществом. В результате такой реакции образуется вещество с новыми физическими или химическими свойствами, количество которого определяют с помощью анализатора. В случае если образующееся вещество обладает цветом или может светиться под действием возбуждающего света, обнаружение и количественный анализ образовавшегося продукта определяют с помощью спектрофотометров или флуориметров. По количеству образовавшегося продукта судят о наличии и содержании в анализируемом образце того или иного вещества.
По такому же принципу работает и биологический микрочип. Он представляет собой твердую подложку с небольшими ячейками. В каждой ячейке иммобилизовано (закреплено) собственное вещество-реагент, которое служит зондом (щупом, пробой) для проведения той или иной реакции. Все реагенты расположены в определенном порядке и взаимодействуют с анализируемым образцом как ключи с замком. В том месте чипа, где есть соответствие (комплементарность) между молекулами исследуемого вещества и молекулами зонда, образуется новый продукт – дуплекс, который и определяется анализирующим оборудованием. Картина распределения ячеек биочипа, содержащих дуплексы, является индивидуальной характеристикой анализируемого образца.
Первые биологические микрочипы появились в конце прошлого века, а сейчас уже десятки компаний выпускают различные типы чипов, отличающиеся друг от друга по методике изготовления и методу, с помощью которого регистрируют результат взаимодействия чипа с образцом.
Существуют биочипы, изготавливаемые методом синтеза зондов непосредственно на подложке. Плотность ячеек в таком чипе очень высока: на площади 1 мм2 может быть расположено более тысячи ячеек, а весь чип содержит миллионы ячеек. Такие биочипы предназначены для анализа крупных фрагментов ДНК, иногда для анализа всего генома организма. Стоимость таких чипов, как и анализирующего оборудования, очень высока, и лишь очень богатые страны могут позволить себе проводить анализы с помощью этой технологии.
По технологии, разработанной под руководством А.Д. Мирзабекова, зонды микрочипа расположены в ячейках, состоящих из геля. Объем каждой ячейки составляет примерно один нанолитр (миллионная доля литра). Биочип, содержащий трехмерные ячейки, обладает существенными преимуществами по сравнению со стандартными двумерными чипами. Взаимодействие исследуемых образцов с зондами, иммобилизованными в геле, имеет больше сходства с процессами, протекающими в растворе, чем в том случае, когда иммобилизованные зонды находятся на поверхности стекла, вследствие чего достигается высокая специфичность их взаимодействия с молекулами из анализируемого образца. Каждая ячейка содержит гораздо большее количество молекул зонда по сравнению с зондами, прикрепленными к двумерной поверхности. В водном окружении молекулы сохраняют свою активность, с ними можно проводить любую ферментативную реакцию. Трехмерные биочипы позволяют изучать кинетику и термодинамику реакций, протекающих в индивидуальных ячейках, в том числе образование дуплексов нуклеиновых кислот.
Каждая ячейка отделена от соседних ячеек гидрофобной поверхностью, что позволяет осуществлять в ячейках трехмерных биочипов разнообразные реакции, в т. ч. полимеразную цепную реакцию с различными праймерами и др.
В зависимости от того, какие молекулы содержится в ячейках биочипа и служат в качестве зондов, он может быть применен для разных целей. Если в ячейках содержатся фрагменты ДНК, идентичные тем, которые имеются в геноме возбудителей инфекционных болезней, биочип может быть использован для обнаружения и идентификации этих возбудителей. Так, уже разработаны биочипы для выявления возбудителей туберкулеза, неонатальных инфекций, оспы, гриппа, гепатита, герпеса, ряда др.
В качестве зондов можно использовать фрагменты ДНК с последовательностями, характерными при наследственных или обменных заболеваниях человека. В этом случае биочип может служить для обнаружения соответствующей болезни или для выявления предрасположенности к ней. Так, например, имеются чипы для выявления хромосомных мутаций при лейкозах, обнаружения предрасположенности к гипертонии и другим кардиологическим заболеваниям и т. д.
Поскольку молекулы сохраняют свою активность внутри ячеек биочипа, существует возможность создания белковых биочипов, содержащих в качестве зондов антигены или антитела. Такие биочипы могут применяться для проведения иммунохимических анализов, например для количественного анализа свободных и связанных специфических антител, онкомаркеров, биологических токсинов.
Еще одним важным достоинством трехмерных чипов является их высокая чувствительность, что позволяет использовать для регистрации результатов относительно простое оборудование и проводить сотни анализов в день. Эта технология предназначена для обследования больших групп населения с минимальными финансовыми затратами.
Результат взаимодействия биочипа с исследуемым образцом регистрируют анализатором биочипов по интенсивности флуоресценции красителя, присоединенного к анализируемому веществу. Специализированная компьютерная программа автоматически обнаруживает контрольные ячейки биочипа и определяет правильность проведения анализа. Затем эта же программа определяет интенсивность всех ячеек биочипа и детектирует, в каких из них произошло образование специфических дуплексов. На основании этих данных на мониторе компьютера появляется результат анализа в удобном для врача виде.
В настоящее время известно, что резистентность МБТ к изониазиду определяется мутациями в четырех основных генах: katG, inhA, ahpC/oxyR, kasA, а также в менее изученных furA и ndh.
В более 95% случаев резистентность МБТ к рифампицину у больных туберкулезом обусловлена мутациями в коротком фрагменте (81 пара нуклеотидов) гена rpoB, кодирующего β-субъединицу РНК-полимеразы МБТ.
Таким образом, сегодня фтизиатры имеют уникальный инструмент для определения лекарственной чувствительности МБТ непосредственно после поступления больного туберкулезом в клинику, что позволяет немедленно начать направленную противотуберкулезную терапию и уменьшить риск внутрибольничного заражения туберкулезом. Эта же тест-система может быть использована для контроля эффективности применяемой терапии и своевременного обнаружения у пациента лекарственно устойчивых МБТ.
К тому же возможности разработки новых биочипов для идентификации микобактерий, контроля проводимого лечения далеко не исчерпаны. В связи с этим лабораторная диагностика туберкулеза стоит на пороге эры молекулярно-биологических методов, имеющих огромные перспективы.
статья размещена в номере 20 за октябрь 2007 года, на стр. 62
Аннотация научной статьи по прочим медицинским наукам, автор научной работы — Смазнова И. А., Терешин В. С., Полозов А. И., Гаврилюк С. В., Заякин В. В.
Похожие темы научных работ по прочим медицинским наукам , автор научной работы — Смазнова И. А., Терешин В. С., Полозов А. И., Гаврилюк С. В., Заякин В. В.
The biochip method has been used to diagnosticate of the tuberculosis mycobacteria forms and their drug resistance . Samples of the Bryansk region TB dispensary patients were analysed in the Moscow developmental tuberculosis centre. The biochip method specified by high productivity and sensibility takes 1-2 workdays for results. Results are in agreement in early microbiologic investigations and used for antituberculosis strategy.
УДК - 577.29 + 616-002.5 + 616-078
ВНЕДРЕНИЕ В БРЯНСКОЙ ОБЛАСТИ МЕТОДА БИОЧИПОВ ДЛЯ РАННЕЙ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА И ОПРЕДЕЛЕНИЯ ФОРМ МИКОБАКТЕРИЙ, РЕЗИСТЕНТНЫХ К ЛЕКАРСТВЕННЫМ СРЕДСТВАМ
И.А. Смазнова, B.C. Терешин, А.И. Полозов, С.В. Гаврилюк, В.В. Заякин, А.М. Мороз, И.Я. Нам
Ключевые слова: биочипы, бионанотехнология, туберкулез, диагностика, устойчивость к антибиотикам Введение
Туберкулез является опасным, социально значимым заболеванием человека. Эпидемия туберкулеза стала проблемой национальной безопасности в России.
В Брянской области, по данным главного врача Брянского областного противотуберкулезного диспансера Гаврилюка С.В., в связи с аварией на Чернобыльской АЭС длительное время было запрещено флюорографическое обследование населения, что привело к значительному росту больных туберкулезом в регионе. В настоящее время проводится регулярное флюорографическое обследования жителей области, и ежегодно по Брянской области выявляется более одной тысячи заболевших. Заболеваемость населения Брянской области туберкулезом находится на среднем в ЦФО уровне и составляет 89 человек на 100 тыс., смертность — 17 человек на 100 тыс. населения.
Эффективность лечения туберкулеза и борьбы с распространением лекарственноустойчивых штаммов микобактерий туберкулеза во многом зависит от скорости обнаружения микобактерии, идентификации типа возбудителя и определения лекарственной чувствительности. Таким образом, оперативность, достоверность и точность диагностики являются определяющими факторами для успешного лечения больных туберкулезом.
В настоящее время в абсолютном большинстве бактериологических лабораторий Российской Федерации для определения лекарственной чувствительности микобактерий туберкулеза используется культуральная диагностика с посевом анализируемого материала на плотные питательные среды, содержащие чистые субстанции основных противотуберкулезных препаратов в стандартных концентрациях [1]. Ответ о наличии возбудителя и его лекарственной чувствительности при использовании данного метода может быть получен не ранее 8-12 недель [2]. При этом до получения результатов определения лекарственной чувствительности микобактерий туберкулеза больным обычно назначают противотуберкулезные препараты первого ряда (рифампицин и изониазид) в составе I режима химиотерапии, независимо от того, каким по лекарственной чувствительности штаммом они заражены, хотя подбор схемы лечения с учетом характера устойчивости микобактерий туберкулеза в значительной степени определяет ее эффективность [3]. Применение I режима химиотерапии при высоким уровне первичной множественной лекарственной устойчивости микобактерий туберкулеза приводит к индукции лекарственной устойчивости и создает условия для формирования большого контингента хронически больных туберкулезом легких, в том числе с — множественной лекарственной устойчивостью.
Принципиально проблема быстрого обнаружения, идентификации возбудителя туберкулеза и определения его лекарственной чувствительности была решена в результате разработки технологии биологических микрочипов [4].
Идея создания биологического микрочипа возникла в конце 1980-х годов одновременно в Великобритании, Югославии и СССР. В Советском Союзе эти работы были инициированы и
Устойчивость МБТ к изониазиду обусловлена мутациями, по меньшей мере, в трех генах: около половины всех устойчивых к препарату МБТ содержат мутации в гене katG, кодирующем каталазу-пероксидазу. В результате мутации изменяется кристалическая структура фермента, что, в свою очередь, ведет к снижению способности каталазы-пероксидазы окислять изониазид, и, как следствие, у МБТ возникает устойчивость к препарату. Мутации расположены на всем протяжении гена, наиболее часты замены в кодонах 65, 125, 511, 513, 521 и 617 гена katG;
ген inhA, кодирующий редуктазу белка-переносчика еноилацильного радикала (БПА). Около 20% штаммов возбудителя, устойчивых к изониазиду, содержат мутации в данном гене, и почти все они происходят в области промотора, по всей видимости, увеличивая его экспрессию;
мутации в генах oxyR и ahpC являются компенсаторной реакцией на снижение каталазно-пероксидазной активности, контролируемой генами katG и inhA. Мутации промотора, вызывающие сверхрегуляцию ahpC, были выявлены приблизительно у 10% штаммов возбудителя, устойчивых к изониазиду.
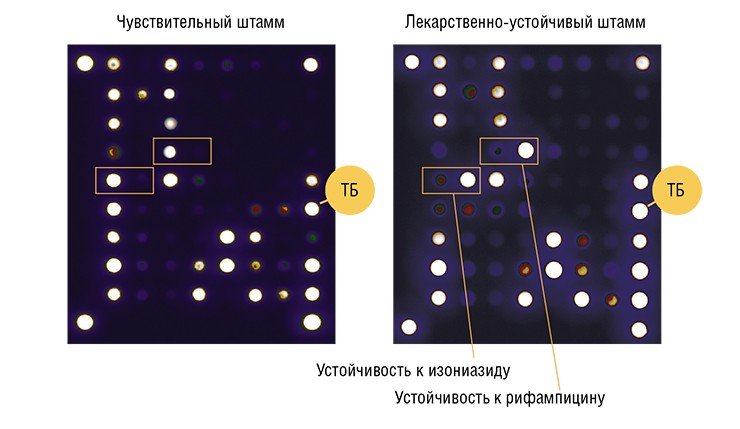
Интерпретация результатов гибридизации осуществляется при сравнении интенсивности флуоресцентных сигналов в ячейках, принадлежащих к одной группе. Максимальный флуоресцентный сигнал свидетельствует о наличии совершенного гибридизационного дуплекса.
Анализ биочипов занимает около суток [8, 9], вто время как стандартный микробиологический анализ требует нескольких недель, что совершенно неприемлемо при быстром течении болезни. Метод биочипов прост, сравнительно недорог и ускоряет время проведения анализа от нескольких недель до 1 дня [10, 11]. Метод был апробирован в ряде клиник, головным учреждением является отдел проблем лабораторной диагностики Московского городского научно-практического Центра борьбы с туберкулезом.
Результаты и их обсуждение
Диагностика образцов пациентов ГУЗ БОПТД методом биочипов была проведена в отделе проблем лабораторной диагностики МГНПЦБТ. Каждый пациент обследовался троекратно, на образцах мокроты от 31 пациента отделения №1 БОПТД было проведено 93 анализа с помощью метода биочипов, определены штаммы микобактерии, лекарственная чувствительность микобактерий туберкулеза к изониазиду и рифампицину.
В данном исследовании были включены больные, у которых микобактерии туберкулеза были выделены методом микроскопии — 23 человека. Эти пациенты составили первую группу (основную). Вторую группу составили больные, у которых микобактерии туберкулеза в мокроте методом микроскопии не обнаружены — 8 человек.
Из 31 обследованного больного мужчин было 24 (77,4%) и 7 женщин (22,6%).
Преобладал инфильтративный — 13 (41,9%), и диссеминированный туберкулез — 11 (35,4%), фиброзно-ковернозный туберкулез обнаружен у 4 (12,7%) больных, казеозная пневмония, цирротический туберкулез, множественные туберкулемы выявлены у 1 больного, соответственно (по 3,2%) (рис.1).
в Инфильтративный ^ Диссеминированный о Цирротический В Фиброзно-ко-вернозный И Казеозная пневмония □ Множесвенные туберкулемы
Рис. 1 Характеристика пациентов по клиническим формам туберкулеза.
На рис. 2 приведены данные по мутациям МБТ, которые определяют устойчивость к разным антибиотикам и их сочетанию.
Лекарственная устойчивость к изониазиду выявлена в 28 пробах в гене ка! О, в 11 пробах в гене тЬ А, мутаций в гене оху Я - аЬр С выявлено не было.
Одновременное выявление мутаций в генах ка! О и тЬ А обнаружено в 8 пробах у 3 больных. Всего мутаций в генах ка! О выявлено у 13 больных, а в генах тЬ А у 4 больных. Мутации в гене гро В, ответственным за устойчивость к рифампицину, выявлено в 24 пробах клинического материала, у 9
Рис 2. Характеристика мутаций в генах ка! в, шЬ А, оху Я - аЬр С и гро В.
Сочетание мутаций в генах гро В, ка! О, 1пЬ А, ответственные за возникновение множественной лекарственной устойчивости обнаружено в 20 пробах у 9 больных. Сочетание гро В + ка! О встречалось в 13 случаях (6 больных), а сочетание гро В + тЬ А в 3 пробах (1 больной). Сочетание гро В + ка! О + тЬ А в 6 пробах (2 больных).
В таблице 1 приведены сводные результаты обследования больных по типам мутаций:
Результаты анализа проб больных туберкулезом БОПТБ методом биочипов
№ группы Типы мутаций Устойчивость Кол-во больных
rpoB katG inhA oxyRahpC изониазид рифамп.
2 wt wt wt wt - - 9
3 wt Ser3l5Thr Tl5 wt + 4
wt Ser3l5Thr wt wt +
4 His526Cys Ser3l5Thr wt wt + + 8
Ser53lLeu wt Tl5 wt + +
Asp5l6Val Ser3l5 Thr wt wt + +
Ser53lLeu wt wt wt + +
Ser53lLeu Ser3l5Thr wt wt + +
Таким образом, полученные результаты позволяют сделать следующие выводы:
l. Технология микрочипов для выявления лекарственной устойчивости к рифампицину и изониазиду позволяет своевременно назначать адекватную химиотерапию больным туберкулезом, что приводит к быстрому абсциллированию, уменьшению сроков стационарного лечения, а в конечном итоге, к значительному экономическому эффекту.
2. Своевременное назначение резервных противотуберкулезных препаратов по эффективности действия сопоставимо с результатами лечения впервые выявленных больных с лекарственно-чувствительным туберкулезом. Своевременное назначение препаратов резервного ряда сокращает сроки абсциллирования мокроты, значительно ускоряет темпы респираторных процессов в легких по сравнению с группой больных, у которых коррекцию лечения производили по результатам метода абсолютных концентраций спустя 2-3 месяца лечения.
3. Совпадение результатов молекулярно-генетического и классического бактериологического методов составляет 95,3% случаев.
4. С помощью микрочиповой технологии удается выявить 80-85% всех случаев наличия множественной лекарственной устойчивости микобактерий туберкулеза у обследуемых больных туберкулезом в течение 2 суток, что соответствует данным, полученным в нашем исследовании.
сроки определения чувствительности - 1 сутки;
возможность анализа ДНК микобактерий туберкулеза, выделенной из любого биологического материала при поступлении пациента в диспансер;
высокая чувствительность анализа.
Работа проводилась при поддержке грантов: ФЦП № 02.740.11.0285, АВЦП № 2.1.1./224.
The biochip method has been used to diagnosticate of the tuberculosis mycobacteria forms and their drug resistance. Samples of the Bryansk region TB dispensary patients were analysed in the Moscow developmental tuberculosis centre. The biochip method specified by high productivity and sensibility takes 1-2 workdays for results. Results are in agreement in early microbiologic investigations and used for antituberculosis strategy.
The key words: biochips, bionanotechnology, tuberculosis, diagnostic, drug resistance.
1 Козулицына Т.И. Микробиологические исследования / В руководстве для врачей: Туберкулез органов дыхания. М., 1981. с.136-149.
2 Иртуганова О. А., Смирнова Н. С., Слогоцкая Л. В. и др. Бактериологические методы определения лекарственной устойчивости микобактерий туберкулёза // В сб.: Туберкулёз сегодня: проблемы и перспективы. М. 2000. С. 73-75.
5 Мирзабеков А., Прокопенко Д., Чечеткин В. Применение матричных биочипов с иммобилизованной ДНК в биологии и медицине// В сб.: Информационные медико-биологические технологии, под общ. ред. В.А. Княжева, К.В. Судакова, (2002) стр. 166-197. Изд. Дом ГЭОТАР-МЕД, Москва.
6 Mirzabekov, A. DNA sequencing by hybridization- a megasequencing method and a diagnostic tool? // Trends in Biotechnology ,1994, 12, 27-32.
7 О.И. Скотникова, A.C. Заседателев, B.M. Михайлович, А. Ю., Соболев, Д. А. Грядунов, E. Л. Исаева, С.А. Лапа. Методы для идентификации мутаций // Под редакцией В.И.Литвинова,
8 Мороз А.М., Носова Е.Ю., Галкина К.Ю., Краснова М.А., Букатин А.А. Определение лекарственной чувствиетльности Micobacterium tuberculosis с помощью биочипов./Методические рекомендации№42. М. 2008. с. 3-12.
10 Под ред. Перельмана М.И. Фтизиатрия: национальное руководство. М.: ГЭОТАР -МЕДИА, 2007. с. 153-180.
11 Скотникова О.И., Носова Е.Ю., Бадлеева М.В., Дорожкова И.Р., Мороз А.М. Новые технологии определения лекарственной чувствительности // Пробл.туберкулеза. - 2004. - № 6. -с.15-18.
Смазнова И.А. - Брянский государственный университет имени академика. И.Г. Петровского, iyanam 1 @yandex.ru
Заякин В.В. - Брянский государственный университет имени академика. И.Г. Петровского, iyanam 1@yandex.ru
Мороз А.М. - Московский городской научно-практический Центр борьбы с туберкулезом
Открытие функционального значения тысяч генов и молекулярных механизмов действия множества ферментов стало революционным событием в биологии, оказавшим и продолжающим оказывать огромное влияние на развитие медицины XXI в. Перед учеными и медиками открылись уникальные возможности для выяснения причин многих инфекционных и наследственных заболеваний, а также разработки эффективных методов их лечения. В свою очередь, развитие новых диагностических методов потребовало и создания новых технологий многопараметрического анализа биологических образцов, с помощью которых можно одновременно исследовать множество белковых и ДНК-маркеров различных заболеваний, функционально-значимых биологических макромолекул и их комплексов. Так появилась технология биологических микрочипов, способных, подобно микрочипам электронным, извлекать и обрабатывать огромные массивы информации из одного небольшого образца биологического материала, полученного от конкретного пациента
За последние десятилетия был накоплен огромный объем знаний о молекулярных основах биохимических процессов в живых организмах. Это дало возможности не только точно диагностировать то или иное заболевание, но и оценить вероятность его возникновения еще до проявления у пациента клинических симптомов, а также подобрать эффективную терапию. Подавляющую часть такой информации получают с помощью лабораторной диагностики, на которую в мире ежегодно расходуется свыше 100 млрд долларов. В России в 1970 г. она насчитывала 81 биохимический / молекулярный тест, в 2000 г. – 170, а сегодня число тестов измеряется тысячами!
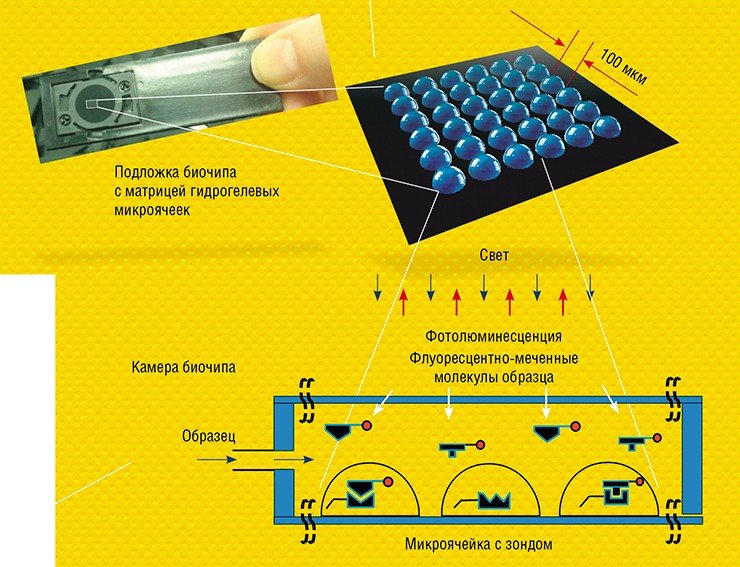
Сегодня ведущие научные журналы регулярно публикуют обзоры, посвященные биологическим микрочипам, которые производят многие десятки компаний, а объем продаж составляет сотни миллионов долларов в год. Вместе с тем сама идея создания биочипов родилась лишь четверть века назад, и одним из мест рождения этой технологии стал Институт молекулярной биологии им. В. А. Энгельгардта Российской академии наук.
С самого начала подход российских исследователей отличался удачным выбором ключевых технологических решений, благодаря которым технологии биочипов ИМБ РАН продолжают оставаться конкурентоспособными в мировой науке. Многие из этих подходов (например, замена радиоактивных меток на флуоресцентные, применение гидрогеля и элементов сферической формы) стали использовать в своей работе другие исследователи, занимающиеся разработкой биочипов. А с 2000 г. в ИМБ РАН при поддержке Международного научно-технического центра начались работы по созданию биочипов для медицинской диагностики возбудителей социально значимых заболеваний.
Биочипы в деле
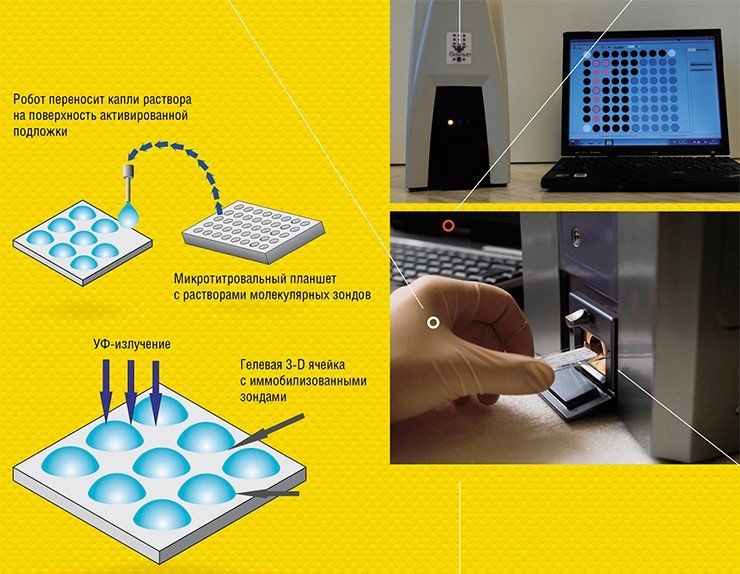
Для регистрации результатов анализа используют флуоресцентные метки, которые вводят в молекулы образца. Если зонд специфично распознает и свяжется с мишенью, в ячейке возникает флуоресценция. Интенсивность свечения ячеек биочипа измеряется с помощью специальных аппаратно-программных комплексов-анализаторов, которые и выдают отчет о присутствии в исследуемом образце специфичных молекулярных мишеней, информирующих о наличии микроорганизмов или генных мутаций, онкомаркеров или аллергенов и т. п.

Оригинальная технология создания таких гелевых чипов, разработанная в ИМБ РАН, была запатентована и сертифицирована по европейским стандартам. Биочипы, созданные по этой технологии, занимают отдельную нишу диагностических микроматриц и применяются в российских клиниках. Коммерческие микроматрицы, произведенные ведущими научно-производственными корпорациями Германии и США применяются, в основном, в исследовательских целях.
Туберкулез и лекарственная устойчивость
Почему внимание исследователей привлек именно туберкулез? Дело в том, что многие десятилетия для борьбы с этой болезнью использовали комбинированное лечение сразу несколькими химиопрепаратами, чтобы повысить его эффективность. При монотерапии больные быстро приобретали устойчивость к лекарству. Однако такая стратегия привела к тому, что уже в конце прошлого века в мире, в том числе и в России, начал повсеместно распространяться туберкулез со множественной лекарственной устойчивостью. Именно этот фактор в наши дни чаще всего является причиной неудачного исхода лечения и возникновения рецидива болезни, от которой ежегодно в мире умирает более 3 млн человек.

От гепатита до рака и аллергий
Еще одной актуальной проблемой мирового здравоохранения является лечение больных гепатитом С. Возбудитель этого вирусного заболевания может долгое время размножаться в печени, ничем не выдавая себя, а первые признаки болезни обнаруживаются лишь спустя пару месяцев после заражения. Еще недавно гепатит С считался практически неизлечимой болезнью, а основным терапевтическим средством служила комбинация из интерферона и рибавирина, которая зачастую оказывалась неэффективной и имела много негативных побочных эффектов.

Сегодня созданы новые антивирусные препараты, обладающие так называемым прямым противовирусным действием и блокирующие ключевые внутриклеточные этапы размножения возбудителя. Но вся сложность в том, что вирус гепатита С имеет 7 вариантов генотипа, при этом каждый генотип имеет еще несколько подтипов. Более того, разные генотипы/подтипы обладают и разной чувствительностью к традиционным и новым препаратам, и выбор противовирусной терапии должен проводиться в соответствии с генотипическими особенностями возбудителя.
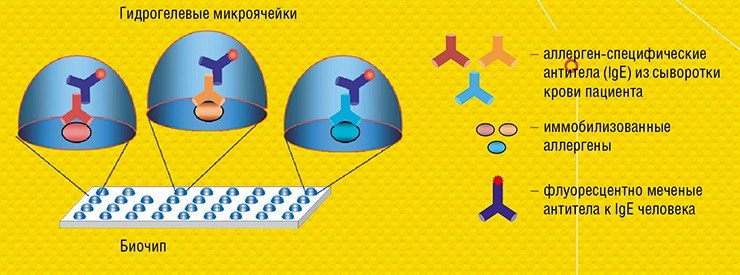
Важнейшим направлением приложения технологии гидрогелевых биочипов служит анализ мутаций и полиморфизмов ДНК самого человека: ДНК-маркеров, ассоциированных с возникновением различных неинфекционных заболеваний.
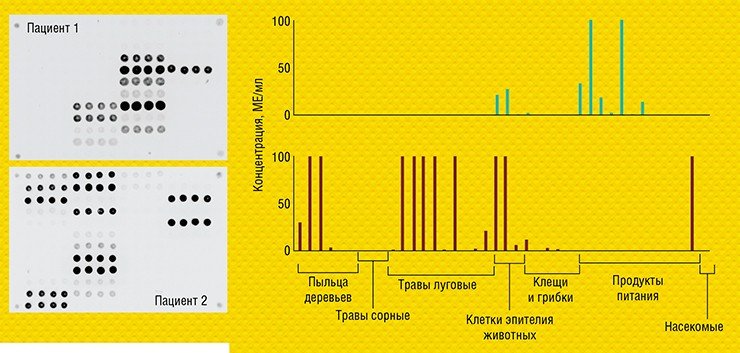

Важно, что для анализа антител на 30 и более аллергенов на биочипе требуется очень небольшой (всего 60 мкл) объем сыворотки крови – ровно столько, сколько требуется для анализа на один аллерген традиционным иммуноферментным методом! Такое отличие особенно значимо в педиатрии. Лабораторный вариант этой тест-системы уже проходит доклинические испытания в Детской городской клинической больнице № 13 им. Н. Ф. Филатова (Москва).
Двенадцать специализированных тест-систем, созданных на основе технологии гидрогелевых биочипов в ИМБ РАН, получили разрешение к применению как медицинские изделия для лабораторной диагностики. Эти тест-системы успешно используются более чем в 50 научно-исследовательских и медицинских центрах РФ, стран СНГ и ЕС.
Технологии биочипов, разработанные в ИМБ РАН, защищены 42 отечественными и международными патентами. И эти технологии продолжают интенсивно развиваться. Разрабатываются новые подходы, позволяющие упростить и ускорить методики, интегрировать в единую процедуру все стадии проведения анализа: от обработки биологического образца до количественной идентификации в режиме реального времени.
Грядунов Д. А., Зименков Д. В., Михайлович В. М. и др. Технология гидрогелевых биочипов и ее применение в медицинской лабораторной диагностике // Медицинский алфавит. 2009. № 3. С. 10—14.
Заседателев А. С. Биологические микрочипы для медицинской диагностики // Наука и технологии в промышленности. 2005. № 1. С. 18—19.
Колчинский А. М., Грядунов Д. А., Лысов Ю. П. и др. Микрочипы на основе трехмерных ячеек геля: история и перспективы // Молекулярная биология. 2004. Е. 38 № 1. С. 5—16.
Arenkov P., Kukhtin A., Gemmell A., et al. Protein microchips: use for immunoassay and enzymatic reactions // Analytical Biochemistry. 2000. V. 278. N. 2. P. 123—131.
Emelyanova M., Ghukasyan L., Abramov I. et al. Detection of BRAF, NRAS, KIT, GNAQ, GNA11 and MAP2K1/2 mutations in Russian melanoma patients using LNA PCR clamp and biochip analysis // Oncotarget. 2017. V. 32. N. 8. P. 52304—52320.
Feyzkhanova G., Voloshin S., Smoldovskaya O. et al. Development of a microarray-based method for allergen-specific IgE and IgG4 detection // Clinical proteomics. 2017. doi: 10.1186/s12014-016-9136-7.
Gryadunov D., Dementieva E., Mikhailovich V. et al.Gel-based microarrays in clinical diagnostics in Russia // Expert review of molecular diagnostics. 2011. N. 11 P. 839—853.
Khrapko K. R., Lysov Yu. P., Khorlyn A. A. An oligonucleotide hybridization approach to DNA sequencing // FEBS Letters. 1989. V. 256. N. 1-2. P. 118—122.
Zimenkov D. V., Kulagina E. V., Antonova O. V., et al. Simultaneous drug resistance detection and genotyping of Mycobacterium tuberculosis using a low-density hydrogel microarray // Journal of antimicrobial chemotherapy. 2016. V. 71. N. 6. P. 1520—1531.
Читайте также:


