Методы диагностики туберкулеза у животных пцр
Серологическая диагностика. Благодаря эффективности серологических методов при некоторых инфекционных заболеваниях еще в конце 19 начале 20 века были сделаны первые попытки серологической диагностики туберкулеза человека и животных в РА и РСК. Было установлено, что в сыворотках крови 50-90% больных содержатся специфические антитела. В разное время, для серологической диагностики туберкулеза животных, были разработаны и применялись следующие методы: реакция агглютинации (РА), реакция геммагглютинации (РГА), реакция непрямой геммагглютинации (РНГА), реакция иммунодиффузии в агаровом геле (РИД), реакция связывания комплемента (РСК) /Ю.Я.Кассич,1979; Н.П.Овдиенко, А.И.Козин, 1979; Р.В.Тузова, 1983; А.П.Лысенко, 1994; Л.П.Ходун,1997/. Последняя даже вошла в наставление по диагностике туберкулеза (от 25.02.1986г.), где в качестве основного компонента использовали комплексный туберкулезный аллерген (КТА) для РСК. Эта реакция была рекомендована как дополнительный тест, причем не для диагностики туберкулеза вообще, а лишь как метод для отбора реагирующих на туберкулин животных для контрольного диагностического убоя. Однако ее применение было ограничено, затем приостановлено вообще. С одной стороны из-за громоздкости постановки самой методики, а с другой - из-за неопределенности в большинстве случаев получаемых результатов.
Мнения об эффективности серологической диагностика туберкулеза значительно различались. Так, многие исследователи указывали на отсутствие совпадения результатов РСК, туберкулиновой пробы и данных убоя животных. Отмечено, что РСК не всегда выявляет всех больных коров, а также положительная РСК может отмечаться и у здоровых животных / Ю.Я.Кассич,1979/. Исходя из выше сказанного, серологические методы рекомендовались, как дополнительные в комплексе с другими методами диагностики.
Особенную значимость серологические методы и, в частности PC^ приобрели при выявлении больных животных, энергичных к введению туберкулина. Оказалось, что этим методом можно довыявить 2-6% больных животных.
Низкая результативность серологической диагностики туберкулеза, по видимому, связана с быстрым включением, на определенных этапах инфекционного процесса, синтезирующихся антител в иммунные комплексы с антигенами возбудителя /Авербах М.М., Романова Р.Ю., Инсанов А.Б., 1984; Т.Н.Агеева, 1993; А.П.Лысенко, 1994/.
Тем не менее, в практике профилактики туберкулеза животных достаточно часто встречаются ситуации, когда необходимо быстро выяснить причину реакций на туберкулин для уточнения эпизоотической и эпидемиологической ситуации и выявления активации инфекционного процесса. Это можно сделать, только исследовав особенности гуморального иммунного ответа, то есть, определив уровни и специфичность антимикобактериальных антител, а также прямым обнаружением в организме животных ДНК возбудителя туберкулеза. Поэтому необходимо дальнейшее совершенствование и разработка новых, более эффективных и информативных методов серологической диагностики туберкулеза, ведь своевременное выявление и удаление из стада инфицированных возбудителем туберкулеза животных - основа профилактики заболевания.
Новым направлением в серологической диагностике является иммуноферментный анализ (ИФА). Сущность метода заключается в использовании антител или антигена, меченых ферментом, для выявления комплексов антиген-антитело. Существует несколько разновидностей постановки реакции, с использованием в качестве твердой фазы полистироловых панелей, на которых фиксируют антиген или антитела. Для осуществления метода применяют соответствующие специфические антигены и антитела или вещества, связывающиеся с иммуноглобулинами (белок А) также меченые ферментом /непрямой вариант/. Фермент, взаимодействующий с субстратом, дает характерное окрашивание, интенсивность которого прямо пропорциональна содержанию комплекса антиген-антитело. Метод позволяет определять до 4-9 нанограммов сухого вещества /Г.Фримель,1987/. Сравнительно невысокая стоимость и возможность автоматизации обеспечила широкое распространение ИФА для диагностики многих заболеваний.
При диагностике туберкулеза человека впервые ИФА применили E. Nassau et.al. в 1976 году. В ветеринарной практике впервые для диагностики туберкулеза у баранов ИФА применил J. Мorris et. al в I979 году. Они обнаружили положительную реакцию у 20 из 30 инфицированных баранов, однако, положительная реакция была и у 3 из II здоровых животных. Таким образом, ухе первые исследования показали, что в ИФА не удается выявить всех больных с одной стороны, а с другой стороны наблюдаются положительные реакции у здоровых субъектов. Поэтому, исследования были направлены на изыскание лучших антигенов и подбор оптимальных условий реакции.
Для иммуноферментной диагностики туберкулеза у человека и животных испытывались микобактериальные антигены разной специфичности и степени очистки в том числе: ППД туберкулины, суспензии инактивированных клеток, культуральные фильтраты, ультрозвуковые лизаты, препараты цитоплазмы, очищенные индивидуальные антигены (5, БЦЖ60, МРТ 59, МРТ64, МРВ 70, ESAT6, Tb38, LAM, TB10, BCG65, TB70) [Daniel T., Debanne S., 1987, Harboe et al, 1990, Mustafa A, et al. 1999]. Как правило, применение препаратов, содержащих комплексы антигенов, было предпочтительным, так как они обеспечивали 30-96% чувствительности и 70-100% специфичности методов. Использование высокоочищенных видоспецифических антигенов микобактерий не нашло широкого применения из-за их невысокой чувствительности (18-35%) при выявлении больных животных в серологических тестах [Harboe, 1991; Fifis et al., 1994; А.П. Лысенко, 1994].
Внимание исследователей привлекают так называемые иммунодоминантные антигены с видоспецифическими эпитопами, стимулирующие выраженный гуморальный ответ. Современные достижения в области фракционирования и фрагментирования макромалекул делают вполне, возможным создание препаратов и методов диагностики, позволяющих достичь максимальной чувствительности и специфичности. В последние годы удалось обнаружить и идентифицировать ряд антигенов микобактерий, выявляющих антитела у 85 - 90 % инфицированных животных, а так же, получить их в частично очищенном виде. Испытание антигенов в ИФА подтвердило возможность использования их не только для диагностики, но и дифференциации туберкулиновых реакций. На основании полученных результатов были разработаны новые направления в ИФА диагностики туберкулеза /А.П.Лысенко, Т.Н.Агеева/.
Разработаны методы диагностики болезни и на основе обнаружения ДНК возбудителя туберкулеза с применением полимеразной цепной реакции (ПЦР). Чувствительность метода позволяет проводить прижизненную диагностику болезни путем исследования крови или бронхиальной слизи. Однако приобретение дорогих высокоспецифических диагностикумов для этой реакции и дороговизна оборудования ограничивает ее применение.
Марина Станиславовна Калмыкова, к.в.н., доцент кафедры радиобиологии и вирусологии им. академиков А.Д. Белова и В.Н. Сюрина ФГБОУ ВПО МГАВМиБ
Елена Петровна Вангели, к.б.н., ведущий научный сотрудник лаборатории микобактериозов ВИЭВ
Нина Гавриловна Толстенко, к.в.н., ведущий научный сотрудник лаборатории микобактериозов
Анализ литературных данных и проведенных собственных исследований показывает, что при применении ПЦР при диагностике туберкулеза крупного рогатого скота разными исследователями были получены неоднозначные результаты. Поэтому до настоящего времени единого мнения о диагностической значимости ПЦР не имеется, и этот метод не нашел широкого применения в ветеринарной практике нашей страны и за рубежом более чем за 30-летний период изучения.
Тем не менее, ПЦР считается наиболее современным диагностическим тестом, позволяющим выявлять даже единичные клетки возбудителя многих инфекционных заболеваний, за счет многократного увеличения количества копий тестируемых специфических последовательностей ДНК. Тест-системы, основанные на принципе амплификации ДНК, позволяют обнаружить патогенные бактерии и вирусы даже в тех случаях, когда другими способами (иммунологическим, бактериологическим, микроскопическим) их выявление невозможно. Это преимущество достигается за счет высокой чувствительности ПЦР-системы, которая составляет около десяти бактериальных клеток, в то время как чувствительность иммунологических и бактериологических тестов колеблется в пределах 10 3 -10 6 клеток. Тест-системы ПЦР эффективны при диагностике труднокультивируемых, не ультивируемых и персистирующих форм бактерий. ПЦР-диагностикумы позволяют избегать сложности, связанной с неспособностью таких бактерий размножаться в лабораторных условиях.
К недостаткам, ограничивающим применение ПЦР при диагностике туберкулеза крупного рогатого скота, многие авторы относят выявление ложноположительных и ложноотрицательных результатов, неспособность ПЦР дифференцировать жизнеспособных микобактерий от нежизнеспособных.
Кроме того, следует учитывать и тот факт, что при ПЦР-диагностике размножению подвергается не микобактерия, а только ее ДНК, причем даже не вся молекула, а только определенный фрагмент, являющийся маркером данного возбудителя.
А.Х. Найманов и соавт. (2009, 2014) считают, что выделение возбудителя туберкулеза, тем более его ДНК, не может являться основанием для установления диагноза, так как, в соответствии с утвержденными нормативными документами, даже при выделении возбудителя необходимо доказать его патогенность на чувствительных к заражению лабораторных животных (из-за возможного наличия L-форм M. bovis и M. tuberculosis).
Следует отметить, что наличие L-форм микобактерий возбудителей туберкулеза является актуальной проблемой при установлении диагноза в благополучных хозяйствах и, особенно, при проведении оздоровительных мероприятий в неблагополучных по этому заболеванию хозяйствах.
В последние годы многими авторами было доказано, что микобактерии туберкулеза образуют L-формы, которые длительное время могут выживать в организме человека, животных и во внешней среде с сохранением способности реверсии в бактериальную клетку (З.Н. Кочемасова, 1970; И.Р. Дорожкова и соавт., 1984; В.С. Федосеев, 1983;И.Н. Рубцова, 1983; М.М. Гертман, 1988; А.С. Донченко и соавт., 1994, 2004; Е.А. Асташова и соавт., 1990; Н.П. Овдиенко и соавт., 1995; Ю.А. Макаров, 1997; Л.А. Таллер, 2003; Л.В. Галатова и соавт., 2004; Е.Ю. Секин, 2006).
И.А. Бакулов и соавт. (1980), В.П. Урбан (1980), В.С. Федосеев и соавт. (1981), В.Г. Ощепков и соавт. (2009) и др. указывают, что при проведении оздоровительных мероприятий возбудитель туберкулеза подвергается воздействию защитных сил организма хозяина и различных внешних факторов окружающей среды. В результате большинство микобактерий погибает, однако остается много поврежденных, но живых клеток, которые сохраняют способность к проникновению в организм животных и реверсии в исходную патогенную форму.
Известно, что L-формы M. bovis выявляются в благополучных и неблагополучных по туберкулезу хозяйствах. Так, Е.Ю. Секин (2006) при исследовании 223 проб из 16 хозяйств с различной эпизоотической ситуацией по туберкулезу из объектов животноводческих помещений выявлял L-формы микобактерий в 53% случаев, т.е. даже чаще, чем в бактериальной форме.
В связи с широким распространением и выявлением L-форм микобактерий в благополучных и неблагополучных по туберкулезу хозяйствах возникает естественный вопрос: что делать в хозяйствах (особенно в благополучных), где выделяются L-формы M. bovis? Ведь мы не знаем и не можем знать, когда L-формы M. bovis будут (а может и не будут) реверсировать в бактериальную форму. Вопрос остается открытым. Тем более, что практические ветеринарные лаборатории L-формы не выделяют (т.к. эти микобактерии растут только на специальных питательных средах).
Дж. Уотсон (1978), Б. Альбертс и соавт. (1986) при электронной микроскопии и фотографировании установили, что снаружи бактерии окружены жесткой защитной оболочкой, состоящей из белков, полисахаридов и липидов. За оболочкой находится эластичная клеточная мембрана. Эта мембрана полупроницаемая и определяет, какие молекулы поступают в клетку или выходят из нее. Приблизительно одна пятая часть внутреннего объема клетки занята ДНК (ответственной за передачу генетической информации от одной клетки к другой), а также РНК, белками и малыми молекулами.
В завершении публикации считаем целесообразным привести некоторые выдержки из статьи Б.И. Антонова (2002), которые, по нашему мнению, остаются актуальными и в настоящее время:
С учетом всего указанного мы завершаем свою публикацию следующим заключением.
Заключение: на современном этапе борьбы с туберкулезом крупного рогатого скота диагностика должна быть комплексной, с использованием всех классических методов, а ПЦР-метод может использоваться как дополнительный лабораторный экспресс-метод.
ПЦР целесообразно использовать в целях индикации возбудителей туберкулеза и их дифференциации от других видов нетуберкулезных микобактерий, а также как дополнительный сигнальный экспресс-метод при исследовании биоматериала от убитых с диагностической целью животных.
3. Асташова Е.А. Персистенция L-форм микобактерий туберкулеза в организме телят / Е.А. Асташова, А.М. Кадочкин, В.С. Суворов // Бюллетень ВИЭВ. – 1990. - № 73-74. – С. 58-60.
4. Галатова Л.В. Выделяемость L-форм микобактерий из биоматериала и объектов внешней среды в зоне Южного Урала / Л.В. Галатова, А.А. Петров // Ветеринарная патология. – 2004. - № 1-2. – С. 159-161.
5. Гертман М.Н. Биологические свойства L-форм Mycobacterium bovis: автореф. дис. … канд. вет. наук: 16.00.03 / Мария Ивановна Гертман. – Москва, 2004. – 19 с.
6. Найманов А.Х. ПЦР на современном этапе борьбы с туберкулезом крупного рогатого скота / А.Х. Найманов, М.С. Калмыкова, Е.П. Осипова // Современные проблемы диагностики и профилактики хронических зооантропонозных инфекций. – Омск. – 2009. – С. 133-140.
7. Найманов А.Х. Проблемы диагностики микобактериальных инфекций крупного рогатого скота / А.Х. Найманов, Н.Г. Толстенко, Е.П. Вангели [и др.] // Ветеринария. – 2014. - №6. – С. 3-8.
8. Ощепков В.Г. L-трансформация патогенных и атипичных микобактерий под действием физических и химических факторов / В.Г. Ощепков, Е.Ю. Секин, Л.А. Таллер, А.С. Шевцов // Современные проблемы диагностики и профилактики хронических зооантропонозных инфекций. – Омск. – 2009. – С. 146-155.
9. Секин Е.Ю. L-трансформация микобактерий, свойства и способы культивирования L-форм: автореф. дис. … канд. вет. наук: 16.00.03 / Евгений Юрьевич Секин. – Новосибирск. – 2006. – 18 с.
Туберкулез – широко распространенное инфекционное заболевание человека и жи-вотных, вызываемое микобактериями туберкулезного комплекса (Mycobacterium tubercu-losis complex – MTBC). От больных туберкулезом животных могут заражаться люди, для них наиболее опасны Mycobacterium bovis (микобактерии туберкулеза бычьего). От лю-дей, больных туберкулезом, микобактериями туберкулеза человека – Mycobacterium tu-berculosis может заражаться крупный рогатый скот. Диагноз на туберкулез у крупного ро-гатого скота ставят на основании результатов аллергических, патолого-анатомических, гистологических и бактериологических исследований с учетом эпизоотологических данных и клинических признаков.
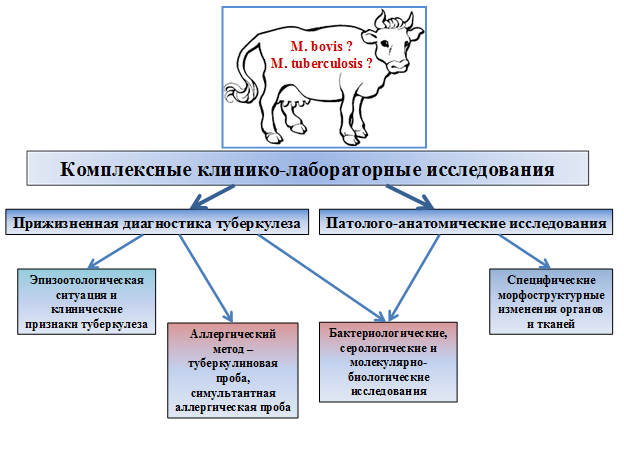
Рис. 1. Схема комплексных исследований крупного рогатого скота на туберкулез
Прижизненная диагностика туберкулеза у крупного рогатого скота проводится аллергическим методом.
Аллергический метод – внутрикожная туберкулиновая проба с применением Пурифиед Протеин Дериватив – туберкулина (ППД-туберкулин) для млекопитающих. Туберкулин вводят крупному рогатому скоту в середину шеи (рис. 2). Учет и оценку реакции на введение туберкулина проводят через 72 часа. Животных считают положительно реагирующими на туберкулин при утолщении кожной складки на 3 мм и более. Толщину кожной складки в месте введения туберкулина измеряют кутиметром, а полученный показатель сравнивают с толщиной кожной складки рядом с местом введения препарата [3, 4].

Рис. 2. Туберкулиновая проба у крупного рогатого скота [6]
Для дифференциации парааллергических реакций у крупного рогатого скота используется симультанная проба с одновременным применением двух туберкулинов – для млекопитающих и для птиц или туберкулина для млекопитающих и комплексного аллергена из атипичных микобактерий (КАМ).
Симультанная проба проводится в том же порядке, что и туберкулиновая (рис. 3). Проба является групповой и дает возможность оценить ситуацию по туберкулезу лишь в целом по стаду или по группе (не менее 6 голов) обследуемых животных. Под достоверностью различия понимают такое различие в величине показателей интенсивности реакций на туберкулин и КАМ, которое дает возможность с уверенностью не менее чем на 95 % сделать заключение о состоянии по туберкулезу обследуемой группы животных [3].
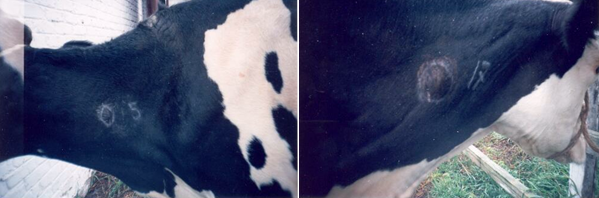
Рис. 3. Симультанная аллергическая проба с использованием ППД-туберкулина и комплексного аллергена из атипичных микобактерий [11]
Офтальмопроба на туберкулез (глазной метод туберкулинизации).
Туберкулин в количестве 3–5 капель наносится на конъюнктиву нижнего века или на поверхность роговицы глаза животного. Проводится офтальмопроба двукратно с 5–6-дневным интервалом [2, 4, 5]. Результаты офтальмопробы оценивают через 6, 9, 12 и 24 часа после первого и через 3, 6, 9 и 12 часов после повторного введения туберкулина. Реакция считается положительной, если образуется гнойный или слизисто-гнойный секрет, который накапливается в конъюнктивальном мешке или вытекает в виде шнура из внутреннего угла глаза. Кратковременная гиперемия слизистых оболочек глаза и слезотечение с образованием небольшого количества слизистого секрета рассматриваются как отрицательная реакция [3].
Факторы, обуславливающие проявление неспецифических реак-ций на туберкулин у КРС
В многочисленных исследованиях было показано, что проявления неспецифических реакций на туберкулин у крупного рогатого скота обусловлены многочисленными факторами внешней среды и индивидуальными особенностями организма животного [2, 3, 5]. Неспецифические реакции подразделяются на две основные группы: парааллергические и псевдоаллергические (см. таблицу).
Причины возникновения неспецифических реакций у крупного рогатого скота на введение туберкулина
| Неспецифическая реакция | Фактор, обуславливающий проявление неспецифической реакции | Особенности неспецифической реакции |
|---|---|---|
| Парааллергическая | Атипичные (нетуберкулезные) виды микобактерий и их ассоциации.
Mycobacterium tuberculosis (микобактерии туберкулеза человека). Mycobacterium avium (микобактерии туберкулеза птичьего) | Непостоянство реакции на туберкулин.
Сенсибилизация организма животного сохраняется от 1 до 3 месяцев после инфицирования [5]. Выявление наибольшего количества животных с выраженными реакциями на КАМ |
| Псевдоаллергическая | Наличие гельминтов (фасциол, дикроцелий, эхинококков). Актиномикоз. Микологические поражения легких. Гнойные или гнойно-некротические процессы во внутренних органах. Нарушения обмена веществ | В благополучных по туберкулезу стадах у отдельных животных регистрируется увеличение толщины кожной складки на месте введения туберкулина на 3–4 мм, признаки воспаления отсутствуют |
Лабораторные методы диагностики туберкулеза КРС
К лабораторным методам диагностики туберкулеза относятся бакте-риологическое исследование, серологическое исследование и молеку-лярно-биологическое исследование.
Бактериологическое исследование проводится с целью выделения возбудителя туберкулеза (рис. 4).
Отбор проб биоматериалов для бактериологического исследования производят как от животных с клиническими признаками туберкулеза, так и от животных, вызывающих подозрение на туберкулез. Исследуют молоко, мокроту, мочу. От павших и убитых животных для исследования отбирают пораженные участки органов на границе со здоровой тканью и измененные лимфатические уз-лы.
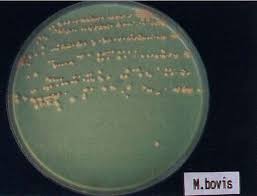
Рис. 4. Культура Mycobacterium bovis. Среда роста Гельберга [10]
При наличии характерных для туберкулеза изменений исследуются портальные, предлопаточные, надвыменные, поверхностные паховые лимфатические узлы и фрагменты внутренних органов – легких, печени, почек.
Бактериологическое исследование биоматериалов на туберкулез за-нимает срок до 3 месяцев. Заболевание животных туберкулезом считается установленным в случаях выделения микобактерий туберкулеза бычьего или человеческого из материала от убитых животных [3, 4, 8].
Серологическое исследование на туберкулез проводится в реакции связывания комплемента (РСК).
РСК применяется в двух вариантах:
1) для обнаружения в сыворотке больного животного специфических антител к возбудителю туберкулеза;
2) для выявления и идентификации в исследуемом материале антигена возбудителя туберкулеза.
Молекулярно-биологическое исследование на туберкулез.
Полимеразная цепная реакция (ПЦР) является одним из высокочувствительных и специфичных методов диагностики туберкулеза. Чувствительность метода ПЦР – от 10 до 100 микроорганизмов в пробе (чувствительность микроскопического метода – от 103 до 105 микроорганизмов). В основе метода лежит амплификация специфических участков ДНК возбудителя, которые содержатся в исследуемой пробе. В настоящее время в лабораторной практике применяются тест-системы как для выявления ДНК конкретного вида, так и для дифференцирования видов, входящих в Mycobacterium tuberculosis complex: микобактерий человеческого вида (M. tuberculosis), бычьего вида (M. bovis) и вакцинного штамма микобактерий бычьего вида (M. bovis BCG). Для проведения анализа используют следующие образцы биопроб от крупного рогатого скота: цельную кровь, молоко, фарингеальные смывы, мочу, фекалии, носовую слизь и биопсийные материалы, в том числе лимфатические узлы [3].
Молекулярно-биологическое исследование позволяет значительно ускорить раннюю диагностику туберкулеза, дифференцировать пара- и псевдоаллергические реакции на туберкулин, снизить количество подозреваемых в заражении туберкулезом и подвергаемых диагностическому убою животных [4, 5].
Патолого-анатомические исследования
Для убоя с диагностической целью отбирают животных по результатам вышеизложенных методов исследования.
Патолого-анатомические изменения в организме больного туберкулезом животного зависят как от его возраста, так и от стадии инфекционного процесса.
В начальных стадиях инфекционного процесса туберкулы имеют вид серых полупрозрачных узелков размером от булавочной головки до чечевичного зерна. Затем они становятся мутными, приобретают бело-желтый цвет, заполняются некротизированной сухой творожистой массой. В легких туберкулезные очаги поражения чаще выделяются над плеврой по тупому краю органа (рис. 5).
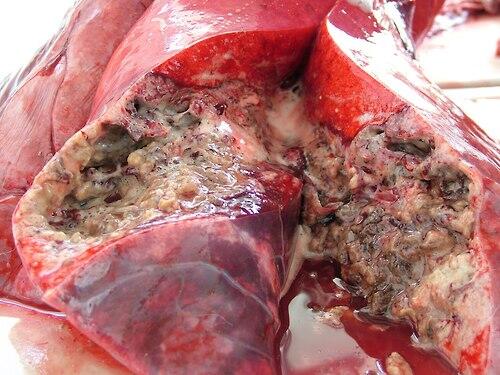
Рис. 5. Легкое крупного рогатого скота при туберкулезном поражении тканей [9]
Гистологические исследования проводят для дифференциации туберкулезных патолого-анатомических изменений от сходных изменений, наблюдаемых при других заболеваниях, например для дифференциации от гранулем паразитарного и микотического происхождения. В положительных случаях в гистологических препаратах, окрашенных по Цилю – Нильсену, находят гранулемы с некротизированным центром, окруженные зоной эпителоидных, отдельных гигантских лимфоидных клеток и соединительно-тканной капсулой.
Вместо заключения
Осуществление плановых профилактических диагностических иссле-дований на туберкулез способствует снижению риска инфицирования людей туберкулезом, ограничению распространения возбудителя из очагов инфекции, раннему выявлению неблагополучных по туберкулезу населенных пунктов.
Цель занятия: изучить методы диагностики туберкулеза.
Материалы и оборудование: безыгольные инъекторы, туберкулины, наборы для туберкулинизации, животные сельскохозяйственные или лабораторные (морские свинки).
Место проведения занятия: лаборатория кафедры эпизоотологии, виварий или
Хозяйство, неблагополучное по туберкулезу.
Туберкулез—инфекционная болезнь, вызываемая микобактериями некоторых видов. Восприимчивы сельскохозяйственные, домашние и дикие животные всех видов, в том числе птицы, а также человек. Ввиду того что у животных, как правило, встречается хроническое течение болезни, самое важное в системе мероприятий — своевременно выявить зараженных животных и удалить их из стада как возможных источников возбудителя инфекции.
Первичный диагноз на туберкулез в ранее благополучных хозяйствах устанавливают комплексным методом — на основании эпизоотологического, клинического, аллергического, патологоанатомического и лабораторного исследований.
При эпизоотологическом методе диагностики особое внимание обращают на условия комплектования стада: когда, где были приобретены животные, с какими документами поступили, когда исследованы на туберкулез. Тщательно анализируют качество кормов, особенно обезжиренного молока, поступающего с молокозаводов, и кормовых отходов мясокомбинатов, оценивают состояние водоемов, предназначенных для водопоя, и смежных
Уточняют эпизоотическую ситуацию по туберкулезу в индивидуальном секторе и соседних хозяйствах, а также эпидемиологическую обстановку, особенно среди животноводов. Выясняют, нет ли вблизи туберкулезных санаториев или диспансеров.
При клиническом методе осматривают всех животных, обращая внимание на органы дыхания, пищеварения, лимфатические узлы, доступные для исследования. Выраженные клинические признаки туберкулеза могут проявляться в различные сроки: от 30 дней до 1 года и более, что зависит от вирулентности возбудителя болезни и резистентности организма животного.
Для лабораторного исследования отправляют взятые при вскрытии кусочки пораженного органа вместе с очагом поражения. Если видимых поражений не обнаружено, пробы размером (10…15) х (5…10) х (3…9) мм берут из заглоточных, средостенных, бронхиальных, брыжеечных лимфатических узлов и ткани легкого.
Для прижизненной диагностики отправляют пробы трахеальной слизи и молока, а иногда мочи и кала.
Пробы, взятые для гистологического исследования, помещают в 10%-й раствор формалина (10мл 40%-го формалина +90 мл воды), соотношение проба—консервант 1:10; для бактериологических исследований — в 30%-й водный раствор глицерина.
Поступивший в лабораторию материал исследуют бактериоскопическим (световая и люминесцентная микроскопия), бактериологическим (выращивание на искусственных питательных средах), биологическим (биопроба на морских свинках, кроликах и курах) и гистологическим методами.
Методом биопробы обнаруживают в исследуемом биоматериале возбудителя болезни и определяют его видовую принадлежность. Биопробу с исследуемым материалом ставят следующим образом. Сначала двух морских свинок массой 300…500 г (желательно светлой масти) исследуют на туберкулез: им вводят внутрикожно 25 ТЕ туберкулина для млекопитающих в 0,1 мл растворителя или стерильного физиологического раствора. Реакцию учитывают через 24 ч. Положительная реакция проявляется гиперемией кожи в месте введения аллергена и образованием уплотненной припухлости диаметром 5 мм и более, иногда с некрозом в центре.
При отрицательной реакции 1 мл суспензии исследуемого материала вводят морским свинкам подкожно в область паха. За животными наблюдают в течение 3 мес. Через 30 сут свинок вновь исследуют на туберкулез, как указано ранее. При развитии клинических признаков заболевания или положительной реакции на аллерген одно из животных после убоя исследуют патологоанатомическим методом. Если обнаруживают характерные туберкулезные изменения, из пораженных участков органов и лимфатических узлов готовят мазки и окрашивают по Цилю—Нильсену. При положительном результате бактериоскопии дают положительное заключение на туберкулез и биологическое исследование прекращают. При отсутствии характерных патологических изменений в органах и лимфатических узлах животного и отрицательной бактериоскопии мазков из материала продолжают наблюдать за второй свинкой. Ее убивают через 3 мес после заражения и на основании результатов вскрытия и бактериоскопии мазков дают заключение.
Чтобы определить вид микобактерий, выделенных из исходного материала, заражают двух морских свинок подкожно, двух кроликов в краевую вену уха, а при исследовании культур, выделенных от свиней, — двух кур в подкрыльцовую вену по 1 мг микобактерий, суспендированных в 1 мл физиологического раствора. За подопытными животными наблюдают 3 мес. Вид микобактерий туберкулеза определяют, как указано в таблице 5.
Для массовых прижизненных исследований на туберкулез используют аллергическую диагностическую пробу, которую на протяжении многих лет считали основным и надежным методом диагностики болезни. Однако в последние 10…15 лет наблюдают, с одной стороны, массовые неспецифические реакции на туберкулин, с другой — снижение аллергической реактивности у животных, зараженных туберкулезом.
На практике используют два метода туберкулинизации: внутрикожный — для диагностики туберкулеза у животных всех видов (кроме лошадей и птиц) и глазной (офтальмопробу) —для диагностики туберкулеза у лошадей. Птицам туберкулин инъецируют в бородку. В некоторых случаях крупный рогатый скот исследуют одновременно с помощью глазной и внутрикожной проб.
Для дифференциации неспецифических туберкулиновых реакций ставят симультанную пробу с двумя аллергенами — ППД для млекопитающих и аллергеном КАМ, изготовленным из нескольких штаммов атипичных микобактерий.
5. Основные свойства микобактерий туберкулеза.
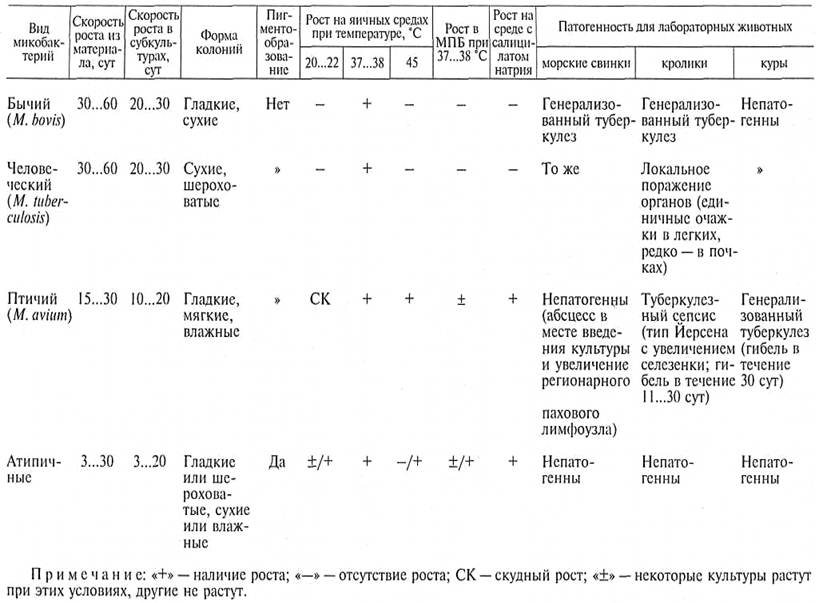
Ученые не прекращают интенсивный поиск эффективных и нетрудоемких методов диагностики туберкулеза: испытывают туберкулезные антигены для серологических исследований и более современные методы — иммуноферментный анализ (ИФА), полимеразно-цепную реакцию (ПЦР), метод дактилоскопии и др.
Согласно методическим указаниям диагноз на туберкулез считают установленным, если выделена культура возбудителя из патматериала или получены положительные результаты биопробы. У крупного рогатого скота, буйволов и верблюдов диагноз также считают установленным при обнаружении в органах и тканях изменений, типичных для туберкулеза. В пунктах, неблагополучных по туберкулезу, всех животных, положительно реагирующих на туберкулин, считают больными туберкулезом.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
В период производственной практики освоить методы туберкулинизации животных разных видов и составление отчетной документации.
Читайте также:


