При чувствительной форме туберкулеза
Способность бактерий туберкулеза быстро развивать устойчивость к лекарственным препаратам – одна из причин широкого распространения инфекции, снижения эффективности и удорожания лечения.

Когда у пациента диагностируется лекарственно-устойчивый туберкулез, то это означает, что лечение предстоит долгое, затратное и без гарантий эффективности. Чаще эта форма выявляется у пациентов с длительным анамнезом заболевания. Но иногда туберкулез, устойчивый к препаратам, диагностируется у здоровых, ранее не лечившихся людей.
Почему туберкулезная палочка приобретает устойчивость?
Лекарственно-устойчивый туберкулез формируется тогда, когда из-за спонтанных мутаций появляются бактерии, нечувствительные к лекарству, или когда не удается поддерживать необходимую концентрацию препарата в крови. В результате гибнут не все возбудители, менее чувствительные выживают. Если применяется несколько антибиотиков, то устойчивые бактерии могут быть уничтожены ими.
При монотерапии или при неправильно подобранной схеме выжившие палочки размножаются, и их потомки наследуют свойство резистентности к данному лекарству. Невосприимчивость туберкулезной палочки закрепляется генетически. Так формируется лекарственная устойчивость микобактерий туберкулеза.
Формированию устойчивости способствуют некоторые клинические ситуации. Знание этих условий необходимо для предотвращения перехода заболевания в устойчивую форму:
- недостаточная продолжительность курса лечения,
- пропуски в приеме препаратов,

использование дозы лекарства, ниже рекомендованной,- использование некачественных лекарственных средств,
- назначение сочетаний химиопрепаратов без проверки чувствительности к ним (если один из препаратов неэффективен, вероятность формирования резистентности к другому велика),
- назначение нерациональных схем,
- использование противотуберкулезных антибиотиков с широким спектром антимикробной активности (фторхинолонов) для лечения других бактериальных инфекций (например, пневмонии) с нераспознанным туберкулезом,
- перекрестная резистентность – если появляется резистентность к одному химиопрепарату может возникнуть резистентность и к другому из того же класса.
Стоит помнить, что одна из основных причин развития лекарственно-устойчивого туберкулеза – недостаточная приверженность терапии.
Больные, достигая положительных результатов терапии, часто перестают адекватно оценивать серьезность ситуации и начинают пропускать прием лекарств, а то и вовсе бросают лечение. Если к этому моменту не наступило выздоровление, через некоторое время заболевание снова начинает прогрессировать, но уже в виде устойчивой формы туберкулеза. Есть и другие причины формирования устойчивости (врачебные ошибки, недочеты в организации лечебного процесса, отсутствие лекарств).
Особую значимость в появлении лекарственно устойчивого туберкулеза имеет заболеваемость в местах лишения свободы. В появлении и распространении форм туберкулеза, устойчивого к лечению, среди лиц из МЛС участвуют следующие факторы:

высокая скученность зараженных людей,- пребывание социально неадаптированных лиц с высоким уровнем заболеваемости совместно с относительно благополучными заключенными,
- недостаточное обеспечение медикаментами,
- отсутствие преемственности в лечении (некоторая часть туберкулезных больных не обращаются в диспансеры после освобождения и не лечится).
Эта группа людей служит постоянным источником устойчивых штаммов возбудителя. В результате, излечение вновь заразившихся больных становится все более проблематичным, растет уровень заболеваемости, количество тяжелых форм и летальных исходов.
Важно! Заражение человека микобактерией, устойчивой к препаратам, ведет к заболеванию первично резистентным туберкулезом, который даже при выявлении на ранних стадиях очень плохо поддается лечению.
Виды лекарственно устойчивого туберкулеза и их терапия
Туберкулезная палочка может приобретать резистентность к нескольким химиопрепаратам. Чем более устойчива палочка, тем сложнее подобрать схему лечения. В зависимости от того, к каким препаратам возбудитель нечувствителен, выделяется 3 формы лекарственно-устойчивого туберкулеза:

Туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ). Эта форма диагностируется при устойчивости микобактерии к двум самым сильным противотуберкулезным химиопрепаратам первой линии – Изониазиду и Рифампицину, независимо от наличия или отсутствия устойчивости к другим препаратам этой группы.- Туберкулез с широкой лекарственной устойчивостью (ШЛУ-ТБ). Она диагностируется при устойчивости к Изониазиду, Рифампицину и другим препаратам – любому из фторхинолонов и любому из инъекционных антибиотиков третьей линии (Канамицину, Амикацину или Капреомицину).
- Абсолютно устойчивый туберкулез. Этот термин не является официально признанным медицинским сообществом, но он хорошо отражает ситуацию – микобактерия резистентна ко всем химиопрепаратам, тестирование на лекарственную чувствительность (ТЛЧ) к которым проводилось.
Кроме этого, различают первичную, когда больной изначально инфицирован устойчивой бактерией, и приобретенную устойчивость, появившуюся минимум после месяца лечения, монорезистентность (к одному из препаратов) и полирезистентность (к нескольким лекарственным средствам). Выделение туберкулеза МЛУ производится для стандартизации стратегий лечения этих больных.
Клинически эта форма болезни в момент постановки диагноза ничем не отличается, разница – в ответе на лечение. Заподозрить лекарственно-устойчивый туберкулез можно при отсутствии эффекта от терапии в течение 4–6 месяцев, при прогрессировании процесса на фоне приема лекарств, при продолжающемся бактериовыделении свыше 4 месяцев.
В идеале, тестирование на лекарственную чувствительность должно проводиться всем больным при установлении диагноза, по крайней мере, к основным химиопрепаратам. Организационно это не всегда возможно, поэтому определение чувствительности должно проводиться как минимум больным из групп риска:

больным, ранее получавшим лечение по поводу туберкулеза,- ВИЧ-инфицированным,
- работникам медицинских учреждений,
- пациентам, бывшим в контакте с больными устойчивыми формами или с умершим от МЛУ-ТБ,
- больным, продолжающим выделять микобактерию после 4 месяцев лечения,
- освободившиеся из МЛС.
Лечение больных с МЛУ–ТБ проводится в соответствии со стандартными схемами. В разработке стратегии лечения должны учитываться не только аспекты подбора препаратов и режима дозирования.
Важно! Для успешного лечения необходимо уделять внимание мотивации больных к соблюдению режима приема лекарств и выдерживанию необходимой продолжительности курса.
Основные принципы терапии лекарственно устойчивого туберкулеза:
- назначается одновременно 5 химиопрепаратов с доказанной чувствительностью к выделенному штамму, а при эмпирическом лечении или при тяжелых формах поражения – и более пяти препаратов,
- применяют максимальные дозы,
инъекционные антибиотики продолжают вводить еще 6 месяцев после прекращения бактериовыделения,- после получения отрицательного посева мокроты лечение продолжается еще 18 месяцев, общая продолжительность составляет около 2 лет,
- прием лекарств производится под контролем медицинского персонала 6 дней в неделю 2–3 раза (в зависимости от схемы) в день,
- обязательно получение информированного согласия на лечение,
- учет этих больных в единой базе данных.
Количество больных туберкулезом во всем мире постоянно увеличивается, в том числе и из-за роста числа больных, инфицированных устойчивыми штаммами. Кроме того, заболеваемость туберкулезом имеет довольно выраженный социальный характер. Ему подвержены в большей степени как раз именно те люди, лечение которых сложнее контролировать. Знание этих фактов, понимание механизмов развития устойчивости и строгое следование рекомендациям, разработанным научным сообществом – инструменты, дающие надежду на обретение контроля над этой болезнью.
При лабораторной диагностике туберкулеза недостаточно дать ответ, констатирующий, обнаружены или нет тем или иным методом микобактерий туберкулеза. Для клиники туберкулеза, детального представления о характере микобактериальной популяции и определения прогноза заболевания необходимо изучение различных свойств культур, выделенных от больного: лекарственной чувствительности, ферментативной активности, вирулентности, видовой принадлежности. В некоторых случаях необходимо дифференцировать выделенные культуры и установить характер атипичных культур. Все это обусловливает то разнообразие исследований, которые необходимо проводить при лабораторной диагностике туберкулеза.
Определение лекарственной чувствительности выделенных штаммов микобактерий является необходимым и весьма важным этапом микробиологических исследований. Развитие лекарственной устойчивости обусловлено многими факторами: селекцией устойчивых вариантов в микобактериальной популяции, вегетирующей в организме больного; индукцией противотуберкулезными препаратами или антибиотиками, применяемыми в процессе химиотерапии; передачей эписомного R-фактора чувствительным особям (нехромосомная устойчивость) и др. Следует отметить, что снижение чувствительности микобактерий туберкулеза отмечается ко всем противотуберкулезным препаратам, однако оно может отличаться по степени, характеру, частоте и скорости появления. Известно, что из патологического материала от больных туберкулезом выделяются неоднородные по лекарственной чувствительности микобактерий: устойчивые к одному лекарственному препарату, или моноустойчивые, варианты с истинной двойной или полиустойчивостью, а также смесь вариантов, устойчивых к различным препаратам.
Определение спектра и степени чувствительности микобактерий туберкулеза к противотуберкулезным препаратам имеет важное значение для тактики химиотерапии больных, контроля за эффективностью лечения и определения прогноза заболевания. Степень лекарственной чувствительности микобактерий туберкулеза определяется в соответствии с установленными критериями, которые зависят как от противотуберкулезной активности лекарственного препарата, так и его концентрации в очаге поражения, величины максимальной терапевтической дозы, фармакокинетики препарата и др.
Определение лекарственной чувствительности в настоящее время проводится бактериологическими методами — методом разведений на плотной питательной среде и методом разведений (или абсолютных концентраций) на жидких питательных средах. Имеется много модификаций обоих методов. В качестве унифицированного в России применяют рекомендованный Комитетом по химиотерапии ВОЗ метод определения лекарственной чувствительности микобактерий на плотной среде Левенштейна — Йенсена (без крахмала), в которую перед свертыванием добавляют различные концентрации препаратов. Минимальный набор состоит из 2—3 пробирок с разными концентрациями каждого из используемых в данной клинике препаратов, одной контрольной пробирки со средой без препарата.
Этот метод достаточно точен. Он позволяет применять патологический материал, содержащий любое количество микобактерий, поскольку для определения лекарственной чувствительности используются микобактерий, предварительно выделенные из патологического материала. Поскольку сроки выделения возбудителя на питательных средах составляют не менее 1—1,5 мес, результаты определения лекарственной чувствительности указанным методом можно получить не ранее чем через 2—2,5 мес после забора материала. В этом заключается один из основных недостатков метода. Описанный метод определения лекарственной чувствительности микобактерий после выделения их чистой культуры получил название непрямого метода.
При массивном бактериовыделении (не менее 1—5 микобактерий в каждом поле зрения) применяют прямое определение лекарственной чувствительности при выделении возбудителя непосредственно из патологического материала. Для этого используют метод глубинного посева и метод культивирования на стеклах в жидких питательных средах. Эти методы более трудоемки, требуют дополнительного приготовления мазков, окраски и микроскопирования последних и, кроме того, менее точны, так как невозможно дозировать засев микобактерий. Однако результаты можно получить в более короткие сроки (через 12 дней). Практикуется также прямое определение лекарственной устойчивости на плотных средах, в этом случае результаты можно получить через 3 нед.
Лекарственно-чувствительные штаммы дают рост на средах с препаратами в пределах определенной концентрации, различной для каждого препарата. Штаммы, которые растут при соответственно более высоком содержании этих препаратов в питательной среде, относят к лекарственно-устойчивым. Устойчивость определяют по наличию макроскопически видимого роста на плотных и микроскопического роста — на жидких средах.
Устойчивость данного штамма в целом выражается той максимальной концентрацией препарата (количество микрограмм в 1 мл питательной среды), при которой еще наблюдается размножение микобактерий (по числу макроколоний при посеве на плотные среды и микроколоний при посеве на жидкие среды). Лекарственно устойчивые микроорганизмы способны размножаться при таком содержании препарата в среде, которое оказывает на чувствительные особи бактериостатическое или бактерицидное воздействие. При определении лекарственной устойчивости микобактерий на плотных средах культура считается чувствительной к той концентрации препарата, которая содержится в среде, если число колоний микобактерий, выросших на одной пробирке с препаратом, не превышает 20. Только при наличии более 20 колоний культура расценивается как устойчивая.
Для различных препаратов установлена определенная предельная концентрация, при которой еще наблюдается размножение чувствительных к этому препарату микобактерий. Границей, или критерием устойчивости, называют те первые концентрации препарата в питательной среде, выраженные в микрограммах на 1 мл, при которых начинают размножаться устойчивые особи. Для плотной среды Левенштейна—Йенсена установлены следующие концентрации (мкг/мл):
- стрептомицин — 5;
- изониазид — 1;
- этионамид — 30;
- протионамид — 30;
- циклосерин — 50;
- канамицин — 30;
- флоримицин (виомицин) — 30;
- тиоацетазон (тибон) — 2;
- этамбутол — 2;
- рифампицин — 20.
Наряду с анализом лекарственной чувствительности все выделенные при посеве медленно растущие штаммы микобактерий подлежат первичной идентификации для определения их видовой принадлежности (М. tuberculosis, М. bovis, М. africanum, М. microti), так как принадлежность возбудителя к тому или иному виду существенно влияет на тактику химиотерапии, прогноз заболевания и др. Одним из основных лабораторных тестов, позволяющих дифференцировать М. tuberculosis и М. bovis и микобактерии всех других видов, служит ниациновый тест. Он основан на уникальной способности микобактерии человеческого типа синтезировать ниацин (никотиновую кислоту) в значительно больших количествах, чем микобактерии бычьего типа и нетуберкулезные микобактерии.
Биологическая проба. При отрицательных результатах бактериоскопии и посева материала, исследуемого на микобактерии туберкулеза, если все же подозревается туберкулез, ставят опыты на животных (так называемая биологическая проба). Это наиболее чувствительный метод выявления возбудителя туберкулеза. Самым чувствительным к туберкулезной инфекции лабораторным животным является морская свинка. Считается, что заражение морской свинки позволяет диагностировать туберкулез даже при наличии в материале, использованном для заражения, 1—5 микробных клеток.
Биологический метод широко применяется в диагностике туберкулеза со времени открытия возбудителя этой инфекции. Он не потерял своей ценности и в настоящее время. Более того, сейчас этот метод с успехом применяется для выявления не только типичных неизмененных, но и разнообразных биологически измененных форм возбудителя, в частности L-трансформированных и фильтрующихся форм. Кроме того, этот метод является основным при определении видовой принадлежности микобактерии, их вирулентности, изучении патогенности атипичных культур. Он широко используется для воспроизведения туберкулеза отдельных органов, исследования аллергических реакций, иммунитета и эффективности химиотерапии при туберкулезе. В последние годы метод применяется при проведении биологических пассажей в процессе изучения биологически измененных форм возбудителя в целях получения биологической реверсии.
При любом методе заражения морских свинок микобактериями туберкулеза у животных развивается генерализованный туберкулезный процесс, заканчивающийся гибелью. Однако следует иметь в виду, что возбудители туберкулеза, устойчивые к препаратам изоникотиновой кислоты, вследствие снижения или потери вирулентности могут не вызывать заболевание у морских свинок и дать отрицательные результаты биологической пробы при одновременном наличии роста на питательных средах при посеве. Это обстоятельство диктует необходимость дифференцированного подхода к результатам биологической пробы и одновременного использования метода посева при проведении заражения животного в диагностических целях.
Для повышения частоты обнаружения микобактерий туберкулеза в патологическом материале многие авторы используют, помимо подкожного, интратестикулярное заражение. При этом в патологическом материале удается чаще выявлять изониазидоустойчивые слабовирулентные микобактерий. Кроме того, для повышения чувствительности биологического метода рекомендуется искусственно снижать естественную резистентность морских свинок ежедневным введением больших доз кортизона (12,5 мг), что позволяет повысить результативность биологической пробы на 15—29% (по данным разных исследователей). Наконец, результативность биологической пробы можно повысить, применяя метод последовательных биологических пассажей. Для этого заражение каждой последующей морской свинки производится гомогенатом органов от предыдущего животного, использованного в биологической пробе. По мере увеличения числа пассажей нарастает выраженность специфических изменений в органах.
Следует подчеркнуть, что особую ценность биологическая проба представляет для диагностического исследования олигобациллярного материала.
Перед заражением морским свинкам с массой 200—250 г ставят реакцию Манту, вводя 0,02 мл альттуберкулина Коха внутрикожно в наружную поверхность бедра, освобожденную от волосяного покрова; контроль — введение такого же количества бульона в другую лапку. При отрицательной реакции через 48 ч свинку можно брать в опыт. Для заражения в диагностических целях можно использовать различный патологический материал: мокроту, мочу, промывные воды, отделяемое ран и др. Исследуемый материал обычно обрабатывают 3% раствором серной кислоты так же, как и для посева. Затем осадок 2 или (лучше) 3 раза отмывают стерильным изотоническим раствором NaCl и центрифугируют. Такое отмывание является обязательной процедурой, поскольку при попадании кислоты животному под кожу может развиться некроз. К отмытому осадку добавляют изотонический раствор NaCl и вводят эту смесь под кожу правой паховой области. За свинками проводят систематическое наблюдение, проверяя появление местного инфильтрата в месте введения материала, изъязвление этого инфильтрата, состояние регионарных лимфатических узлов и места введения материала; повторно ставят реакцию Манту. То же повторяют через 6 нед и далее. При положительных туберкулиновых пробах и наличии местных изменений свинок забивают через 1—1,5 мес, при отсутствии признаков развивающегося туберкулеза — через 3 мес.
Туберкулиновые пробы при наличии туберкулезного процесса становятся положительными через 2 нед — 1 мес после заражения.
На вскрытии свинок, погибших от туберкулеза, наблюдается картина генерализованного туберкулеза. Если при заражении в материале были слабовирулентные микобактерии туберкулеза, то развитие процесса может ограничиться увеличением лимфатических узлов и единичными очажками в органах. Во время вскрытия делают мазки-отпечатки из органов для бактериоскопических исследований. Кроме того, кусочки лимфатических узлов, селезенки, печени и легких вырезают стерильным инструментом, помещают в стерильную ступку, гомогенизируют и засевают на плотные питательные среды. Посевы производят обязательно при отсутствии в органах макроскопически видимых изменений туберкулезного характера. Кроме того, в сомнительных случаях проводят гистологическое исследование тканей.
Для оценки распространенности и характера туберкулезного поражения у морских свинок предложено несколько схем учета макроскопических изменений в органах. Наибольшее распространение в нашей стране получили схемы, разработанные М.В. Триус и Ю.К. Вейсфейлером. По этим схемам специфические изменения в органах и лимфатических узлах оцениваются в зависимости от степени их выраженности плюсами, которые затем переводятся в цифровые показатели.
Микробиологическая диагностика b-трансформированных и фильтрующихся вариантов микобактерии. Все изложенное выше касается разнообразных методов выявления и идентификации классических бактериальных форм возбудителя туберкулеза, не учитывая многообразные формы, возникшие в результате морфологической, тинкториальной и биологической изменчивости микобактерии.
В настоящее время традиционные методы выделения микобактерии туберкулеза все меньше удовлетворяют нужды клиники, так как информативность микробиологических исследований явно недостаточна. Применяемые методы малоэффективны и не позволяют составить представление об истинном состоянии микобактериальной популяции, вегетирующей в организме больного. Это объясняется, с одной стороны, недостаточной чувствительностью ряда методов, а с другой (в значительно большей степени), тем, что большинство таких методов не позволяет выявить возбудитель, находящийся в b-трансформированном состоянии.
b-трансформация
b-трансформация — закономерный этап жизненного цикла микобактерии.
b-формы — это варианты бактерий с дефектом клеточной стенки. Им придают особое значение в патологии человека и животных в связи с их способностью длительно существовать в макроорганизме и реверсировать в исходный вид с восстановлением свойственной ему вирулентности. Возможность попеременного или одновременного существования возбудителя в бактериальной и b-форме не только значительно затрудняет диагностику, но и влияет на развитие эпидемического процесса, создавая ложное впечатление об абациллировании источников и стерилизации очагов инфекции.
Таким образом, результаты бактериологических исследований, рассчитанных на выделение только бактериальных форм возбудителя, не могут служить основанием для исключения туберкулезной инфекции и должны дополняться данными, полученными специальными методами, которые направлены на выявление b-форм микобактерий. Последние, как известно, являются закономерно существующей формой возбудителя при разных клинических проявлениях туберкулезного процесса, а также основной формой персистирования микобактерий.
Установлено, что b-трансформация микобактерий закономерна и при использовании специальных методов исследования она может быть выявлена. Из-за биологических особенностей b-форм, для которых характерны резко измененная морфология бактериальных клеток и сниженный метаболизм, выделение их требует специальных методов культивирования и идентификации. b-формы могут обнаруживаться в виде гигантских зернистых тел, скоплений различных по размеру, гомогенности и оптической плотности шаров, гранул, сферопластоподобных образований, светопреломляющих тел и др, b-фюрмы и близкие к ним варианты возбудителя туберкулеза характеризуются повышенной хрупкостью и требуют применения особых методов выделения и условий культивирования: щадящих методов обработки материала, элективных питательных сред, наличия нативных белков и осмотических стабилизаторов.
b-формы выделяются преимущественно у больных, недавно прекративших выделять бактериальные формы. У данного контингента больных с сохранившимися полостями деструкции и воспалительными изменениями в легочной ткани выделение b-форм продолжается еще в течение 3—4 мес и более после прекращения выделения бактериальных форм. Таким образом, целенаправленные поиски b-форм микобактерий показаны у больных, не выделявших или прекративших выделять бактериальные формы, но имеющих явные клинические признаки активного туберкулезного процесса. К таким признакам относится наличие участков деструкции легочной ткани, каверн с неравномерно широкими стенками и с эволютивными воспалительными изменениями в окружающей легочной ткани.
Поиски b-форм микобактерий туберкулеза должны проводиться повторно, многократно, так как выделение их носит периодический характер. В настоящее время разработаны и применяются разнообразные методы микробиологической диагностики b-трансформированных вариантов: бактериоскопические, культуральные, биологические, серологические, иммунофлюоресцентные, гистологические. Разработаны методические основы культурального выделения b-форм, сконструированы элективные питательные среды, предложены методы обработки материала, подобраны адекватные детергенты и осмотические стабилизаторы, разработана схема посева и контролей. Предложены методы окраски b-форм в чистой культуре и патологическом материале; разработаны стандартные и ускоренные методы реверсии и др. Все это позволяет выделять b-формы из разнообразного патологического материала и устанавливать их видовую специфичность.
Исследованиями последних лет (А.Г. Хоменко, В. И. Голышевская) установлено, что при многих клинических проявлениях туберкулеза (особенно на фоне длительной комбинированной химиотерапии) в организме больных и экспериментальных животных обнаруживаются и ультрамелкие формы возбудителя, проходящие через бактериальные фильтры. Частота обнаружения этих микроорганизмов варьирует в зависимости от формы процесса и особенно от лекарственного режима.
Для выделения ультрамелких форм разработаны культуральный и биологический методы. Основной принцип этих методов заключается в том, что исследованию подвергается материал, последовательно профильтрованный через мембранные фильтры с размером пор 0,65; 0,45 и 0,22 мкм. При этом исследуемый субстрат полностью очищается от бактериальных форм возбудителя, осколков микобактерий и других вариантов изменчивости, в материале остаются только фильтрующиеся формы. Полученный фильтрат засевают на специальные питательные среды или вводят морской свинке. Результаты оценивают по данным бактериоскопии мазков, приготовленных из культивированного фильтрата или в результате реверсии возбудителя в бактериальную форму.
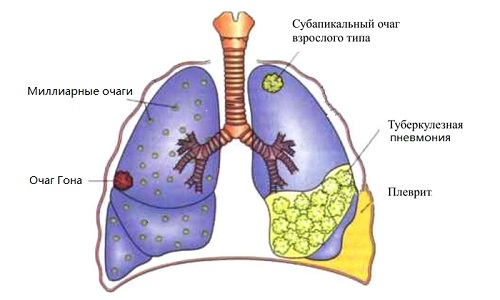
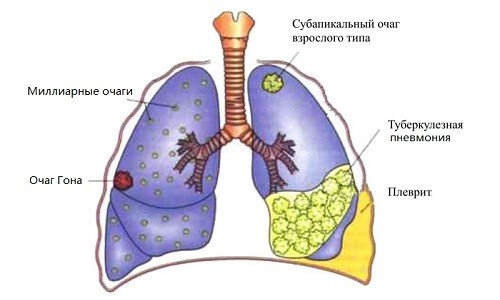
- Что такое туберкулез?
- Стадии туберкулеза
- Основные симптомы
- Причины и пути заражения
- Диагностика, лечение и профилактика туберкулеза
- Главные проблемы борьбы с туберкулезом
В последнее время большое распространение получила скрытая форма туберкулеза, симптомы которой выражены незначительно, что затрудняет диагностику на ранних этапах и провоцирует переход заболевания в более тяжелую открытую форму.
Появление большого количества людей, инфицированных этим страшным (но излечимым) заболеванием, является серьезной проблемой как с медицинской, так и с социальной стороны.
Что такое туберкулез?
Туберкулез является болезнью инфекционного характера. Поражает палочка Коха в основном бронхиальную и легочную системы. В редких случаях заболевание переходит и на другие органы: суставы, кости, мочеполовую и лимфатическую системы, глаза. Туберкулез существует на планете с самых древних времен. Опираясь на статистические исследования, можно утверждать, что ежегодно по всему миру заболевают туберкулезом около 9 млн. человек. По данным ВОЗ носителями туберкулезной инфекции являются около 2 млрд. человек, это почти треть населения Земли. При этом с каждым годом количество инфицированных увеличивается, а в 3 млн. случаев болезнь ведет к летальному исходу. Специалисты связывают это с возникновением таких факторов, как:
- общее снижение качества жизни людей, негативно влияющее на уровень питания, и другие неблагоприятные тенденции в социальной сфере;
- уменьшение количества мероприятий, направленных на профилактику туберкулеза;
- возникновение новых штаммов, проявляющих повышенную стойкость к специфической терапии;
- индивидуальные особенности организма человека, имеющие повышенную чувствительность к туберкулезу, одной из которых является СПИД.
Стадии туберкулеза
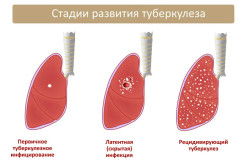
- Первичное туберкулезное инфицирование представляет собой локальное воспаление в месте инфильтрации инфекции. Палочка попадает в близлежащие лимфатические узлы и формирует первичный туберкулезный комплекс. Основная опасность этой стадии заключается в том, что общее самочувствие в большинстве случаев остается удовлетворительным. Возможно появление астенических расстройств, связанных с быстрой утомляемостью, снижением веса вследствие потери аппетита. Иногда инфицированный человек отмечает ночную потливость и сухость кожных покровов. Как правило, инфекционный процесс затихает на этой стадии.
- Латентный туберкулез (скрытая форма). При сниженных иммунных способностях организма возбудитель легко распространяется и начинает формировать туберкулезные очаги в различных системах (легкие, селезенка, печень, головной мозг, мозговые оболочки, костная система и т.д). При закрытой форме туберкулеза человек не может заразить окружающих. При этом инфекция малоактивна и располагается внутри очага. Разрушительные процессы в клетках протекают медленно, болезнь может как рецидивировать, так и затихать. Эта форма туберкулеза уже отличается хроническим характером.
- Рецидивирующий туберкулез поражает различные органы. Чаще всего повреждению подвергается легочная ткань, образуются полости (каверны), которые прорываются в бронхиальную систему. Туберкулез открытой формы можно определить по наличию бацилл в мокроте больного, выделяемой в окружающую среду со слюной при кашле, чихании или отхаркивании. В этом случае больной человек является открытым носителем инфекции и служит источником заражения окружающих.
Основные симптомы

Скрытый туберкулез, как и открытый, может быть первичным и вторичным. Такая градация имеет важное значение в клинической картине заболевания. На первичной стадии болезнетворная палочка только проникает в человеческий организм и поражает какую-либо определенную систему (чаще всего дыхательную или лимфатическую). При заживлении очагов образуются уплотнения. На вторичной стадии инфекция распространяется по кровеносной системе, образуя множественные очаги поражения. Риск инфицирования и скорость перехода из одной стадии в другую находятся в прямой зависимости от состояния иммунной системы человека.
Первичная стадия закрытой формы туберкулеза в основном проходит бессимптомно, отсутствует кашель, температура держится в пределах нормы. Больной может не подозревать о наличии инфекции в течение нескольких месяцев. И даже при появлении первичных симптомов не каждый инфицированный человек своевременно обращает внимание на ухудшение самочувствия и обращается к доктору.
В дальнейшем скрытый туберкулез приобретает вполне конкретные симптомы:
- появление болевых ощущений при дыхании, на поздних стадиях — кровохарканье;
- скопление жидкости в легких (туберкулезный плеврит);
- незначительное повышение температуры тела (к вечеру, до 37-38 °С);
- постоянное ощущение слабости;
- снижение работоспособности;
- ночная потливость;
- потеря аппетита.
Причины и пути заражения
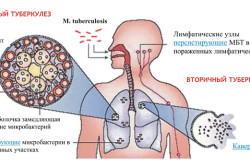
Источником заражения являются люди, инфицированные открытой формой туберкулеза. Один больной в течение суток может заразить до 20 здоровых человек. В личный контакт с инфицированным вступать необязательно, заразиться можно через посуду и предметы, используемые больным. Определенный риск в этом случае представляют собой точки общественного питания. Помимо этого заражение может произойти от животных, пищевых продуктов, произведенных из зараженных животных (мясо, молоко). Переносить это опасное заболевание могут и насекомые (мухи, тараканы).
Инфекция проникает в организм в основном через органы дыхания, реже — пищеварительный тракт, слизистые оболочки и поврежденные участки кожи.
Туберкулезная палочка устойчива к холоду, теплу, влаге и свету. В уличной пыли, на книжных страницах она может поддерживать свою жизнеспособность до 3 месяцев.
Как упоминалось выше, больше всего туберкулезу подвержены люди со слабым иммунитетом. Если иммунная система человека функционирует хорошо, болезнь длительное время остается в организме, а человек является носителем. Развитию болезни могут способствовать сильные стрессы, злоупотребление алкоголем, нерациональный режим питания. Заболевание носит сезонный характер, периоды обострения приходятся на весну и осень.
Диагностика, лечение и профилактика туберкулеза
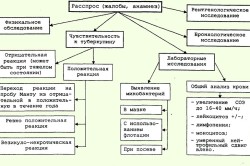
Диагностировать заболевание можно несколькими способами:
1. Туберкулиновая проба (реакция Манту);
2. Мазок мокроты;
3. Рентгенологическое обследование;
4. Взятие посева мокроты.
Терапию туберкулеза делят на 2 фазы: интенсивное лечение и поддерживающая терапия. Туберкулезные бактерии нельзя уничтожить с помощью обычных антибиотиков.
На начальном этапе назначаются изониазид, рифампицин, пиразинамид, этамбутол. На втором этапе — изониазид+рифампицин или изониазид+этамбутол.
Для предупреждения заболевания необходимо ежегодно проходить флюорографическое обследование. Первые профилактические меры по борьбе с туберкулезом принимают еще в родильном отделении. Всем новорожденным делают прививку БЦЖ. Она не дает 100% иммунитета к заболеванию, но позволяет снизить риск инфицирования в 7-8 раз. Главной профилактикой туберкулеза является поддержание иммунитета. Необходимо соблюдать полноценный рацион питания, употреблять в пищу продукты, богатые белком, животными жирами и витаминами; чаще бывать на свежем воздухе и полностью отказаться от курения. Никотиновая зависимость повышает риск летального исхода заболевания в 4 раза.
К народным методам профилактики можно отнести регулярное употребление в пищу лука и чеснока, зеленого чая, киви и цитрусовых, кисломолочных продуктов, морепродуктов и рыбы, свежих овощей, зелени, пряностей и злаковых.
Главные проблемы борьбы с туберкулезом
Шестимесячный курс терапии от туберкулеза стоит около 100 $ США. Даже такие расходы являются непосильными для систем здравоохранения многих развивающихся стран.
Главные методы диагностики заболевания остаются неизменными на протяжении века. Болезнь, в отличие от СПИДа и малярии, нельзя диагностировать с помощью недорогих экспресс-тестов. Набор антибиотиков для лечения туберкулеза остается неизменным в течение нескольких десятилетий.
Своевременно выявленный туберкулез не является неизлечимым заболеванием и поддается лечению антибиотиками. Но при отсутствии должного лечения он приводит к полной потере трудоспособности и смерти больного.
Читайте также:


