Синдром восстановления иммунитета при туберкулезе
Аннотация научной статьи по клинической медицине, автор научной работы — Савинцева Елена Валерьевна, Баданов Сергей Владимирович, Егорина Алёна Александровна, Токарева Алина Сергеевна, Русских Олег Евгеньевич
В статье рассматривается клинический случай больного сочетанной патологией ВИЧ/ТБ, где антиретровирусная терапия (АРВТ), направлена на угнетение репликации ВИЧ. У представленного пациента данное лечение привело к ухудшению состояния и формированию синдрома восстановления иммунитета (СВИ).
Похожие темы научных работ по клинической медицине , автор научной работы — Савинцева Елена Валерьевна, Баданов Сергей Владимирович, Егорина Алёна Александровна, Токарева Алина Сергеевна, Русских Олег Евгеньевич
A CLINICAL CASE OF IMMUNE RECOVERY SYNDROME IN A PATIENT WITH A COMBINED HIV/TUBERCULOSIS INFECTION
The article considers a clinical case of a patient with combined HIV/TB pathology, where antiretroviral therapy (art) is aimed at suppressing HIV replication. In the presented patient, this treatment led to a deterioration of the condition and the formation of the immune recovery syndrome (SVI).
Савинцева Елена Валерьевна
ассистент кафедры фтизиатрии Ижевская Государственная Медицинская Академия, Россия, г. Ижевск
Баданов Сергей Владимирович ординатор кафедры фтизиатрии Ижевская Государственная Медицинская Академия, Россия, г. Ижевск
Егорина Алёна Александровна Студентка 7 курс
Ижевская Государственная Медицинская Академия, Россия, г. Ижевск
Токарева Алина Сергеевна
Студентка 7 курс
Ижевская Государственная Медицинская Академия, Россия, г. Ижевск Научный руководитель: Русских Олег Евгеньевич Доктор медицинских наук доцент заведующий кафедры фтизиатрии Ижевская Государственная Медицинская Академия, Россия, г. Ижевск
DOI: 10.24411/2520-6990-2020-11365 КЛИНИЧЕСКИЙ СЛУЧАЙ СИНДРОМА ВОССТАНОВЛЕНИЯ ИММУНИТЕТА У БОЛЬНОГО С СОЧЕТАННОЙ ИНФЕКЦИЕЙ ВИЧ/ТУБЕРКУЛЁЗ.
Savintseva Elena Valerevna
assistant of the Department of Phthisiology Izhevsk State Medical Academy, Russia, Izhevsk Badanov Sergey Vladimirovich resident of the Department of Phthisiology Izhevsk State Medical Academy, Russia, Izhevsk Egorina Alena Aleksandrovna Student 7th year Izhevsk State Medical Academy, Russia, Izhevsk Tokareva Alina Sergeevna Student 7th year Izhevsk State Medical Academy, Russia, Izhevsk
Scientific Director: Russkikh Oleg Evgenievich
Doctor of medical Sciences, associate Professor head of the Department of Phthisiology Izhevsk State Medical Academy, Russia, Izhevsk
A CLINICAL CASE OF IMMUNE RECOVERY SYNDROME IN A PATIENT WITH A COMBINED
В статье рассматривается клинический случай больного сочетанной патологией ВИЧ/ТБ, где анти-ретровирусная терапия (АРВТ), направлена на угнетение репликации ВИЧ. У представленного пациента данное лечение привело к ухудшению состояния и формированию синдрома восстановления иммунитета (СВИ).
The article considers a clinical case of a patient with combined HIV/TB pathology, where antiretroviral therapy (art) is aimed at suppressing HIV replication. In the presented patient, this treatment led to a deterioration of the condition and the formation of the immune recovery syndrome (SVI).
Ключевые слова: клинический случай, туберкулёз, ВИЧ-инфекция, синдром восстановления иммунитета
Keywords: clinical case, tuberculosis, HIV infection, immune recovery syndrome
а с 2008 года (85,1 на 100 000 населения), снижение составило 47,8%.
В 2018 г. умерли от туберкулеза 8 617 чел. (2017 г. - 9 614 чел.). Показатель смертности от туберкулеза составил 5,9 на 100 000 населения (2017
г. - 6,5 на 100 000 населения). Показатель снизился по сравнению с 2017 г. на 9,2%, а с 2005 г., когда отмечался пик показателя (22,6 на 100 000 населения) - смертность от туберкулеза снизилась в 3,8раза. Показатель смертности от туберкулеза постоянного населения снизился на 11,1% (с 5,4 в 2017 г. до 4,8 на 100 000 населения в 2018 г.).
Отмечен рост показателя заболеваемости туберкулезом при сочетании с ВИЧ-инфекцией среди постоянного населения России (вместе с посмертной диагностикой ВИЧ-инфекции): 2009 г. - 4,4; 2017 г. - 8,4; 2018 г. - 8,6 на 100 000 населения.
За 2016-2018 гг. в Удмуртской Республике, так же как и в Российской Федерации в целом, отмечается снижение заболеваемости, распространенности и смертности населения от туберкулеза, а также некоторых других индикаторов, свидетельствующих об улучшении эпидемической ситуации по туберкулезу.
Одним из важных показателей, характеризующих тяжесть эпидемической ситуации по туберкулезу, является смертность от этого заболевания. В 2016-2018гг. в Удмуртской Республике значение показателя смертности населения от туберкулеза сохраняет тенденцию снижения. По данным Рос-стата РФ в 2018г. по УР 93 человека умерли от туберкулеза, показатель смертности составил 6,1 на 100 тыс. населения, снижение на 7,6%.
Сочетание ВИЧ - инфекции и туберкулеза, наряду с ростом распространенности лекарственно
- устойчивого туберкулеза, низкой результативностью лечения больных, является одной из предпосылок усиления влияния данного инфекционного заболевания на здоровье.
Заболеваемость туберкулезом среди ВИЧ инфицированных в УР в 2018г. составил 1806,3 на 100 тыс. ВИЧ инфицированных (2017г. - 1689,4, 2016г.
- 1862,5) рост на 6,9%.
Лечение ВИЧ - инфекции является немало важным этапом оказания медицинской помощи больным туберкулезом.
или ранее пролеченных оппортунистических инфекций, вторичных и соматических заболеваний на фоне эффективной антиретровирусной терапии (АРВТ) в течении первых трех месяцев лечения.
Начало АРВТ у большинства ВИЧ-инфицированных пациентов приводит к угнетению репликации вируса, увеличению пула CD4лимфоцитов и восстановлению протективной функции иммунной системы, в следствии чего снижается частота возникновения оппортунистических инфекций. На этом построена современная стратегия лечения больных с ВИЧ-инфекцией. Однако, у многих пациентов, начавших АРВТ, дисре-гуляция иммунитета приводит к развитию СВИ. Отличительный признак синдрома — парадоксальное ухудшение на фоне уже ранее диагностированного инфекционного заболевания или развитие новой инфекционной патологии вскоре после начала терапии.
Частота развития СВИ у пациентов, начавших АРВТ, составляет 10-32% . По некоторым данным частота развития туберкулез-ассоциированного СВИ достигает 45- 50% . Такой широкий процентный диапазон отчасти связан с:
- отсутствием общепринятых критериев и сложностями в диагностике;
- началом и составом схемы АРВТ;
- эпидемической обстановкой по туберкулезу;
- степенью приверженностью больных к АРВТ;
Это подтверждает, что до настоящего времени
эффективной терапии не существует, и в лечении к каждому больному нужен индивидуальный подход.
Цель исследования: изучить особенности начала, течения и лечения СИНДРОМА ВОССТАНОВЛЕНИЯ ИММУНИТЕТА у больного А. с сочетанной патологией туберкулез и ВИЧ-инфекция (ТБ-ВИЧ).
Материалы и методы: проведен анализ истории болезни, выписанной с сочетанной патологией ТБ-ВИЧ за период с ноября 2018г. по июль 2019 г.
Результаты исследования и их обсуждение. Больной А., 27 лет, житель деревни, образование среднее, официально не работает, поступил в РКТБ
г. Ижевска 19.11.18г. с жалобами на общую слабость, повышение температуры до 38,2, кашель, боли в грудной клетке и снижение массы тела (на 15кг).
Из анамнеза жизни: Проживает в И-м районе в
д. Б, образование среднее, женат, но детей нет. В армии не служил - псориаз. Живет в частном доме с родителями (теща). Работает на стройке. Вредные привычки - курение.
Из анамнеза заболевания ранее выяснено, что туберкулезом не болел. Туб контакт не установлен. Сифилис, ЯБ отрицает. ВИЧ у пациента впервые диагностирована в 2018г. Путь инфицирования - не известен. Данных о том, что больной состоял на учете в центре по профилактике и борьбе со СПИДом нет, АРВТ прервал. Предыдущее флюорографическое обследование в 2014г. Из сопутствующих заболеваний - хронический гепатит С.
Заболел остро в середине февраля с повышением температуры тела до 38, обратился медицинской помощью в ЦРБ. Был госпитализирован с 22.02.18г. по 05.03.18г. в стационар с диагнозом: Внебольничная левосторонняя верхнедолевая пневмония, средней степени тяжести. На фоне лечения самочувствие улучшилось, температура тела нормализовалась, но на рентгенограмме изменения сохранились, проведено СКТ органов грудной клетки. В результате исследования был направлен в 4 отделение РКТБ г. Ижевска для дальнейшей диагностики и основного курса лечения. С 19.03.18г. по 07.05.18г. стационарное лечение по 3 режиму ХТ. 20.03.18г. посев мокроты МБТ (+) установлена устойчивость к Н, Е, Я, 2. Переведен на 4 режим ХТ. Выписан за нарушение режима 25.05.18г. по причине: самовольный уход из отделения. Далее у участкового фтизиатра не наблюдался и лечение не принимал.
Пациент правильного телосложения, истощен. Кожные покровы бледные, периферические лимфоузлы не увеличены, периферических отеков нет, температура тела - 38,2. Грудная клетка правильной формы. Обе половины равномерно участвуют в
акте дыхания. При перкуссии обнаруживается легочной звук, при аускультации дыхание жесткое, выслушиваются сухие хрипы. Частота дыхательных движений 22 в минуту. Тоны сердца приглушены, ритмичные. ЧСС 80 в минуту. АД 100/80 мм. рт. ст. Язык обложен белым налетом. Живот правильной формы, не увеличен, симметричный, участвует в акте дыхания, при пальпации мягкий и безболезненный. Печень выступает на 2,5 см из под края реберной дуги. Селезенка не пальпируется. Симптом сотрясения отрицательный с обеих сторон.
Общий анализ крови за ноябрь: HB 88г/л Эр 3,56*1012/л, ЦП 0,7, Ле 13,8* 109/л, СОЭ 69 мм/ч. Биохимический анализ крови: АСТ 51 ед/л, АЛТ 62 ед/л, Глюкоза 4,62 ммоль/л, Общий билирубин 15,54 мкмоль/г, Прямой билирубин 5,1 мкмоль/г, Непрямой билирубин 10,4 мкмоль/г, креатинин 88 мкмоль/г. Диастаза 20.11.18г. 32 ед. В мокроте методом люминесцентной микроскопии обнаружены КУМ (2+). Реакция манту - 10 мм (положительная).
На обзорной рентгенограмме ОГК от 19.11.18г. - Заключение: инфильтративный туберкулез S1-2 левого легкого в фазе распада и обсеменения в правое легкое (рис. 1).
Больному назначена противотуберкулезная терапия по 4 режиму (локсидон 0,3-0,6 мг в сутки, ле-вофлоксацин 0,5 мг вв капельно, пизин 0,5-1,0 мг в сутки, амикацин 1,0 мг вм в сутки). 20.11.-27.11.18г. так же к лечению добавлено симптоматическая терапия (цефазолин, карсил, аллохол, омез, глюконат кальция, гипотиазид, эуфиллин, преднизолон, дро-таверин, апротекс).
При сопоставлении клинико-лучевой картины и данных лабораторного обследования выставлен диагноз: Инфильтративный туберкулез 81-2 левого легкого в фазе обсеменения в правое легкое. Лим-фоаденопатия средостения. Двусторонняя полисегментарная пневмония. 1А МБТ(+). ВИЧ 4Б ст. фаза прогрессирования при отсутствии АРВТ?
На фоне противотуберкулезной и симптоматической терапии отмеченная положительная динамика в виде послабления лихорадки до субфебриль-ных цифр, уменьшения слабости, болевого синдрома. Бактериовыделение через мес уменьшилось до МБТ(1+). Через 3 недели после начала противотуберкулезной терапии к лечению добавлена 03.12.18г. антиретровирусная терапия по схеме: те-нофовир, ламивудин, эфавиренз, регаст.
Через 1 нед отмечено после начала АРВТ ухудшение состояния больного: появление лихорадки до 39, 5, нарастание слабости, усилился кашель с мокротой, боли в левой половине грудной клетке, одышка при физической нагрузке. Рентгенологически через 1 нед после начала АРВТ выраженная отрицательная динамика, процесс прогрессирует.
>#416)),2Ш§ / MEDICAL SCIENCES_
Справа в верхней доле и 6 сегменте малая инфиль- очаги сливного характера. Слева в верхней доле ин-трация с полостями распада и дорожкой к корню, фильтрация легочной ткани. -10.12.18г. (Рис. 2 ).
Заключение УЗИ плевральных полостей 29.01.19г. В плевральной полости справа визуализируется свободной жидкости условно объемом 230 см3, слева визуализируется жидкость с перегородками услов объемом 190 см3.
Заключение УЗИ органов брюшной полости от 05.12.19г.: УЗИ признаки гепатомегалии, диффузных изменений печени, лимфоаденопатии забрю-шинных лимфоузлов, Гидроторакс слева.
При оценке показателей системы крови за январь Ж 49г/л, Эр 1,62*1012/л, СОЭ 84 мм/ч, АСТ 26 ед/л АЛТ 13 ед/л Общий билирубин 13 мкмоль/г. Заключение ЭКГ от 21.01.19г. Синусовая тахикардия. ЧСС 110 в минуту. ЭКГ признаки хроническая гипоксия миокарда.
Больному была усилена противотуберкулезная терапия за счет присоединения циклосерина и про-тионамида к лечению добавлен курс НПВС, витамины группы В, для восполнения ОЦК и интоксикация проведено переливание гемодез 200 мл и эритроцитарная масса 303 мл в/в. продолжена АРВТ.
За время лечения нормализовалась температура, уменьшилась слабость, недомогание, боли в грудной клетке, продолжил стационарное лечение по 4 режиму ХТ интенсивный курс до 240 доз. Рентгенологически: положительная динамика с обеих сторон, очаги и инфильтрация рассасывается. 18.03.19г. (Рис. 3)
При оценке показателей системы крови за февраль по март Ж 82г/л, СОЭ 77 мм/ч, АСТ 54 ед/л АЛТ 25 ед/л Общий билирубин 5,1 мкмоль/г. CD 4 от 05.03.19г. 7 кл/мкмл. Вирусная нагрузка 4700
коп/мл. Заключение ЭКГ от 14.03.19г. Синусовая тахикардия. ЧСС 102 в минуту. Промежуточное положение ЭОС. ЭКГ признаки хроническая гипоксия миокарда.
Заключение УЗИ плевральных полостей 21.02.19г. В плевральной полости справа визуализируется свободной жидкости условно объемом 100 мл, слева визуализируется жидкость с перегородками услов объемом 60 мл.
Больному снова была усилена противотуберкулезная терапия за счет канамицина и левофлокса-цина, также к тому лечению был добавлен бисеп-тол, панкреатин, кларитромицин, сульфасалазин. АРВТ продолжена.
С мая по июль отмечено постепенное ухудшение состояния, 21.06.19г. появились боли в области живота, отсутствие аппетита, повышение температуры до 39, снижение АД 90/60 мм.рт.ст. 30.06.19г. направлен в дежурную хирургию острый живот исключен. Продолжил стационарное лечение по 4 режиму ХТ интенсивный курс до 240 доз. Рентгенологически: от 15.05.19г. отрицательная динамика с обеих сторон. Слева в 1 -2 сегменте появился инфильтрат нечеткими контурами до 30 мм с полостью распада, очаги различной полости, в нижних отделах за счет плевро-кардиальных и кардиофраг-мальных спаек, по задней поверхности плевральной полости тень осумкованной жидкости (в динамике уменьшилась). От 01.07.19г. (снимка нет) положительная динамика справа, слева сомнительная полость распада уменьшилась, но появляется инфильтрация в С6 (в двух проекциях) (Рис. 4)
При оценке показателей системы крови с мая по июль НВ 43г/л, СОЭ 76 мм/ч, Ле 11,2*109/л АСТ 51 ед/л АЛТ 50 ед/л Общий билирубин 27,37
мкмоль/г Непрямой билирубин 22,34 мкмоль/г. Диастаза 01.07.19г. 256 ед. Заключение ЭКГ от 28.05.19г. Синусовая тахикардия. ЧСС 120 в минуту. ЭКГ признаки хроническая гипоксия миокарда. УЗИ органов брюшной полости от 25.06.19г. УЗИ признаки диффузных изменений поджелудочной железы, гепатоспленомегалия, портальная ги-пертензия, хронического холецистита.
При сопоставлении клинико-лучевой картины и данных лабораторного обследования выставлен клинический диагноз за 02.07.19г. инфильтратив-ный туберкулез 81-2 левого легкого в фазе распада и обсеменения в правое легкое. АПС? Туберкулез МВС. Паренхиматозный туберкулез почек. 1А МБТ(+). Мезоденит. Устойчивость НЕЯ02К.
Сопутствующие заболевания: ВИЧ 4Б ст. фаза прогрессирования с АРВТ. Анемия хронических болезней 11ст. Хронический гепатит смешанного генеза, минимальной степени активности. Хронический бронхит, смешанного генеза, ремиссия. Токсическая кардиомиопатия. Синусовая тахикардия. ХСН I. Ангиопатия сетчатки Ои. Хроническая смешанная тугоухость 2-3 ст.
Осложнения: ДН2. Левосторонний экссуда-тивный плеврит.
Выводы: Представленное клиническое наблюдение демонстрирует неустойчивое состояние здоровья, отмечая и улучшение и ухудшение течения туберкулезного процесса на фоне АРВТ, которое было расценено как проявление парадоксального синдрома восстановления иммунной системы.
Поэтому больным следует проводить расширенные диагностические исследования с целью выявления латентных и субклинических форм оппортунистических инфекций до начала АРВТ. Пациентов с высоким риском развития синдрома необходимо вовремя выявлять и определять правильное время назначения и присоединения АРВТ с уже имеющимися оппортунистическими инфекциями. ВИЧ-инфицированным пациентам следует назначать лечение в раннем начале АРВТ и стараться не прерывать необходимую продолжительную терапию, что приведет к уменьшению рисков развития синдрома восстановления иммунитета.
1. Е.А. Тюлькина, И.В. Радионова, В.В. Данилова. Эпидемическая ситуация по туберкулёзу в Удмуртской республике за 2018г
2. О.Б. Нечаева. ЭПИДЕМИЧЕСКАЯ СИТУАЦИЯ ПО ТУБЕРКУЛЕЗУ В РОССИИ. Туберкулез и болезни легких. 2018;96(8):15-24.
На антиретровирусную терапию была направлена 27-летняя ВИЧ-инфицированная жительница поселка в Южной Африке, которая двумя годами ранее прошла успешный курс лечения туберкулеза легких.
Перед началом терапии пациентка жалоб не предъявляла, при осмотре единственным отклонением от нормы была небольшая степень истощения. Число лимфоцитов CD4 составляло 58/мкл, вирусная нагрузка в плазме — 113 375 копий/мл, определялась легкая нормохромная анемия. Пациентке были назначены зидовудин, ламивудин и невирапин, кроме того, она продолжала профилактическое лечение триметопримом/ сульфаметоксазолом. Больная строго выполняла все предписания; при осмотре спустя 4 нед. жалобы отсутствовали, пациентка отмечала, что ощущает прилив сил. Ее масса тела и уровень гемоглобина значительно повысились.
Однако через 6,5 нед. лечения у пациентки возник кашель и дискомфорт в правой половине грудной клетки, повысилась температура тела. При микроскопии мокроты кислотоустойчивые палочки не обнаружены. В ожидании результатов посева мокроты на основании рентгенологических данных был установлен предварительный диагноз туберкулеза легких. Назначена химиотерапия, включавшая рифампицин (по схеме повторного лечения). При осмотре через 8 нед. после начала лечения состояние пациентки было крайне тяжелым: лихорадка (39,1 °С), выраженная дыхательная недостаточность, патологические симптомы при обследовании передней стенки правой половины грудной клетки и отеки ног. В стационаре состояние пациентки продолжало быстро ухудшаться, наступила смерть. Впоследствии из мокроты были выделены Mycobacterium tuberculosis, чувствительные к лекарственным препаратам.
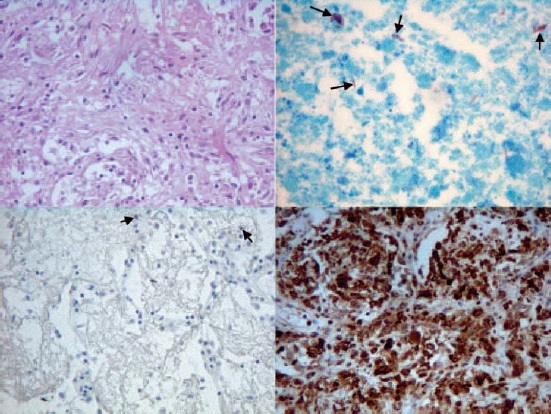
Рис. 1. Гистологическое исследование срезов пораженного легкого. Врастание грануляционной ткани в альвеолы, приводящее к закупорке воздухоносных путей, и отложение коллагена (левый верхний сектор, окраска гематоксилином и эозином, х 20). Подобная гистологическая картина характерна для облитерируюшего бронхиолита с организующейся пневмонией. В препарате, окрашенном по Пилю—Нильсену (верхний правый сектор), многочисленные кислотоустойчивые палочки (указаны стрелками). При применении метода иммунного окрашивания в препарате определяется незначительное количество Т-лимфоиитов CD3 (CD4 и CD8). В данном поле зрения видно всего 2 клетки (указаны стрелками), которые согласно результатам окрашивания являются лимфоцитами CD4 (нижний левый сектор). При специфическом иммунном окрашивании лимфоцитов CD68 видно, что подавляющее большинство клеток в препарате относится к макрофагам (нижний правый сектор) правожелудочковой сердечной недостаточностью, вторичной по отношению к дыхательной недостаточности. Гистологическое исследование срезов легкого выявило множественные обширные очаги казеозного некроза, мононуклеарные инфильтраты и многочисленные кислотоустойчивые палочки (рис. 1). Наблюдались врастание грануляционной ткани в альвеолы, приводящее к закупорке воздухоносных путей, и альвеолярный отек. Подобная гистологическая картина характерна для облитерирующего бронхиолита с организующейся пневмонией. Кроме того, в бронхиальных лимфоузлах были обнаружены свежие гранулемы, однако кислотоустойчивые палочки отсутствовали.
Методом иммунного окрашивания в срезах пораженных участков легкого были выявлено незначительное количество лимфоцитов CD3 (CD4 и CD8), исследование на естественные киллеры (лимфоциты CD56) результатов не дало. При этом подавляющее большинство клеток в очагах воспаления четко окрашивалось с помощью анти-С068-антител. Это свидетельствует о том, что они являются макрофагами (см. рис. 1).
Несмотря на хороший начальный ответ на антиретровирусную терапию, на протяжении второго месяца лечения у пациентки развился туберкулез легких. Последующее быстрое ухудшение состояния пациентки и смерть были обусловлены нетипичным высокоактивным воспалительным процессом в легких, который был напрямую связан с микробиологически подтвержденным туберкулезом. Данная совокупность симптомов соответствует диагнозу тяжелого демаскирующего синдрома восстановления иммунитета, спровоцированного антиретровирусной терапией, причиной которого предположительно является нарушение регуляции иммунного ответа организма на протекающую субклинически активную инфекцию.
Вызывают интерес некоторые особенности этого случая, а именно нетипично тяжелое клиническое течение синдрома, гистологическая картина и тип клеток, преобладающих в очагах воспаления. Как мы уже сообщали, туберкулез легких в течение первых недель антиретровирусной терапии развивается чрезвычайно часто; предполагают, что причиной этого феномена является переход туберкулеза из латентной формы в клинически выраженную под воздействием иммунной системы. Согласно нашим наблюдениям, у большинства таких пациентов воспалительный процесс не бывает тяжелым или высокоактивным. Однако данный случай свидетельствует о том, что синдром восстановления иммунитета иногда может быть тяжелым и угрожающим жизни больного, что также описано в недавнем сообщении из Лондона.
Ранее мы уже наблюдали тяжелое некротическое воспаление в образцах тканей нескольких пациентов с синдромом восстановления иммунитета, вызванным иммунной реакцией на микобактерии. Однако ярко выраженный воспалительный процесс в сочетании с изменениями, характерными для облитерирующего бронхиолита с организующейся пневмонией, является экстраординарной находкой. Облитерирующий бронхиолит с организующейся пневмонией характеризуется определенной совокупностью гистопатологических изменений, это заболевание может быть связано с широким спектром кровоизлияний в легкое, кроме того, встречается в идиопатической форме.6 О случаях облитерирующего бронхиолита с организующейся пневмонией в сочетании с туберкулезом легких или синдромом восстановления иммунитета ранее не сообщалось. Важной особенностью облитерирующего бронхиолита с организующейся пневмонией является высокая эффективность кортикостероидной терапии в большинстве случаев данной патологии. Возможно, если бы в начале лечения этой пациентке были назначены кортикостероиды, ее удалось бы спасти.
Известно, что при синдроме восстановления иммунитета, проявляющемся в виде легочного туберкулеза, наблюдается значительное повышение числа лимфоцитов CD4 в периферической крови, однако иммунопатологические механизмы поражения легких при этом синдроме все еще не установлены. Нам неизвестно, чтобы ранее публиковались сообщения о случаях синдрома восстановления иммунной системы, проявляющегося в виде туберкулеза легких, при которых бы определяли фенотип клеток в патологических очагах методом иммунного окрашивания. Вопреки широко распространенному мнению о том, что причиной синдрома восстановления иммунитета является усиление функции клеточного звена иммунной системы, мы обнаружили в очагах поражения большое количество макрофагов CD68 и незначительное количество Т-лимфоцитов. Данный случай свидетельствует в пользу альтернативной гипотезы, согласно которой важным механизмом развития заболевания является быстрое восстановление функции врожденного неспецифического иммунитета9. В будущих исследованиях, посвященных иммунопатогенезу синдрома восстановления иммунитета, проявляющегося в виде легочного туберкулеза, следует уделить пристальное внимание роли макрофагов в поражении легких.
студент III курса лечебного факультета Пермский государственный медицинский университет им. ак. Е.А. Вагнера,
студент III курса лечебного факультета Пермский государственный медицинский университет им. ак. Е.А. Вагнера,
студент III курса лечебного факультета Пермский государственный медицинский университет им. ак. Е.А. Вагнера,

MODERN SUBMISSION ON IMMUNOPATHOGENESIS OF THE IMMUNE RECONSTITUTION SYNDROME DURING ARVT TREATMENT
Nikita Suslov
third year student of medical faculty Perm State Medical University named by ac. E.A. Wagner,
Igor Troshin
third year student of medical faculty Perm State Medical University named by ac. E.A. Wagner,
Maria Markelova
third year student of medical faculty Perm State Medical University named by ac. E.A. Wagner,
АННОТАЦИЯ
Данное исследование выполнено с целью анализа современного представления об иммунопатогенезе синдрома восстановления иммунитета на фоне антиретровирусной терапии. На достаточном уровне была изучена литература по данной проблеме. Проанализированы особенности иммунопатогенеза.
ABSTRACT
This study was performed in order to analyze the current understanding of immunity reconstitution inflammatory syndrome immunopathogenesis under antiretroviral therapy. The literature about this topic was studied at a sufficient level. Were analyzed the features of immunopathogenesis.
Ключевые слова: ВИЧ, Синдром восстановления иммунитета, оппортунистические инфекции, вторичные инфекции.
Keywords: HIV, Immune reconstitution syndrome, opportunistic infections, secondary infections.
Актуальность. Антиретровирусная терапия (АРТ), направленная на угнетение репликации ВИЧ, способствует частичному восстановлению или активации функции иммунной системы [1, с.14].
В начале приёма АРТ у ВИЧ-инфицированных пациентов отмечается повышение CD4- лимфоцитов и восстановление защитных иммунных реакций против широкого спектра патогенов. Это приводит к тому, что снижается частота развития оппортунистических инфекций и увеличивается продолжительность жизни.
Воспалительный синдром восстановления иммунной системы остается клинически важным для лиц, инфицированных вирусом иммунодефицита человека, начинающих комбинированную антиретровирусную терапию (кАРТ), особенно, когда кАРТ начинается у пациентов с тяжелым иммунодефицитом [12, с. 1159]. Синдром восстановления иммунитета характеризуется повышенной воспалительной реакцией с разрушением тканей организма [7, с. 150]. Существуют различные сообщения о частоте встречаемости СВИ у ВИЧ-инфицированных лиц, начинающих кАРТ. По последним данным синдром восстановления иммунитета при ВИЧ-инфекции встречается у 10-32 % пациентов, начавших антиретровирусную терапию [14, с. 142-143; 20, с. 403].
По некоторым данным частота развития туберкулез-ассоциированного синдрома восстановления иммунитета достигает 45-50 % [3, с. 45]. Такой широкий процентный диапазон отчасти связан с [11, с. 101-102; 14, с. 142]:
- отсутствием общепринятых критериев и сложности в диагностике;
- началом и составом схемы антиретровирусной терапии;
- эпидемической обстановкой по туберкулезу;
- степенью приверженности больных к антиретровирусной терапии;
- социальными условиями пациента и др.
Отличительной чертой данного синдрома является парадоксальное ухудшение процесса течения существующей инфекции или появление нового инфекционного процесса после начала АРТ [5, с. 144; 19, с. 168].
Общая смертность, связанная с синдромом восстановления иммунитета, низкая; однако пациенты с поражением центральной нервной системы с повышенным внутричерепным давлением при криптококковом и туберкулезном менингите и дыхательной недостаточности в результате острого респираторного дистресс-синдрома (ОРДС) имеют плохой прогноз и требуют агрессивного ведения, в том числе применения кортикостероидов.
Цель работы: проанализировать современное представление об иммунопатогенезе синдрома восстановления иммунитета, развивающегося на фоне антиретровирусной терапии.
Материалы и методы. Нами изучены литературные источники по проблеме иммунопатогенеза синдрома восстановления иммунитета при антиретровирусной терапии, в которых найдены ответы на такие вопросы, как предрасполагающие факторы, современное представление об иммунопатогенезе, клинико-лабораторной характеристике, течении и прогнозе СВИ. Проведена выборка и анализ 21 статьи.
Результаты исследований. В настоящее время нет точных данных о количестве пациентов с синдромом восстановления иммунитета. Заболеваемость зависит от ряда факторов [2, с. 141; 10, с. 1853-1854; 16, с. 608]:
- наличие оппортунистических и СПИД-ассоциированных инфекций, наиболее частые – это Mycobacterium tuberculosis и Cryptococcus neoformans;
- наличие опухолей;
- продвинутые стадии заболевания (4Б, 4 В);
- недостаточный интервал времени между лечением оппортунистических инфекций, вторичных заболеваний и началом антиретровирусной терапии;
- крайне низкое исходное количество CD4 T-лимфоцитов ( 100 000 копий/мл);
- несовершенство функционального статуса иммунной системы;
- генетическая предрасположенность. Синдром встречается чаще у молодых мужчин и у лиц молодого возраста.
- наркопотребление, алкоголизм;
- асоциальный образ жизни.
Иммунопатогенез данного состояния до конца не ясен и требует дополнительных исследований. Известно, что множество цитокинов и хемокинов участвуют в патофизиологии синдрома восстановления иммунной системы, поэтому они могут служить в качестве биомаркеров для СВИ, при котором повышаются уровни С-реактивного белка (СРБ), интерлейкина (IL)-6, IL-12, TNF-α (фактор некроза опухоли - tumor necrosis factor(TNF)), и IFN-γ (interferon-γ). В частности, из-за высокого уровня IL-12, TNF-α и INF-γ, Th-1 ответ, как полагают, ассоциируется с синдромом восстановления иммунной системы [6, с. 203].
Предполагается, что пусковым фактором является дисрегуляция иммунного ответа на воздействие антигенных стимулов на фоне начала антиретровирусной терапии. Патофизиология процесса предполагает вовлечение нескольких факторов, таких как [12, с. 1159-1163]:
- восстановление числа иммунокомпетентных клеток;
- функциональное перераспределение Т-лимфоцитов;
- дефект в регуляторной функции;
- изменение Th-клеточного профиля;
- высокий уровень РНК ВИЧ
- генетическая предрасположенность
Восстановление числа иммунокомпетентных клеток. Модель синдрома восстановления иммунитета представлена на рисунке 1.

Рисунок 1. Модель синдрома восстановления иммунной системы [7, с.154].
У пациентов, дефицитных по CD4+ T- лимфоцитам, во время микобактериальной инфекции происходит разобщение врожденных и приобретённых иммунных реакций, что даёт основу для парадоксального воспаления при восстановлении CD4+ T- клеток. а| Миелоидным клеткам – макрофагам требуется два сигнала, чтобы стать активированными. Первый включает в себя распознавание микробных продуктов через рецепторы распознавания паттерна, которые запускают клетки для дальнейшей активации. Второй включает взаимодействие с CD4+ T-клетками, продуцирующими INF-γ, после чего макрофаги становятся полностью активированными и продуцируют высокие уровни провоспалительных медиаторов, таких как фактор некроза опухоли (tumor necrosis factor (TNF)) и интерлейкин-6 (IL-6). После бактериальной инфекции у здорового пациента с нормальной иммунной системой макрофаги поглощают бактерии и быстро взаимодействуют с эффекторными CD4+ T-лимфоцитами, что приводит к сдерживанию возбудителя. b| У пациентов, дефицитных по CD4+ T-лимфоцитам, микробные продукты первично активируют макрофаги, но они никогда не станут полностью активированными для осуществления своих провоспалительных эффекторных функций, из-за отсутствия второго звена. По мере прогрессирования неконтролируемой инфекции это может привести к заболеванию вследствие высокого уровня репликации патогена. Однако со временем, когда в тканях хозяина накапливается все больше первично- активированных макрофагов, это создает состояние гиперчувствительности к CD4+ T-лимфоцитам. Когда иммуносупрессия прекращается и антиген-специфичные CD4+ T-клетки восстанавливаются, то они начинают продуцировать IFN-γ, и происходит завершение активации макрофагов. Это приводит к гиперпродукции провоспалительных медиаторов, что приводит к синдрому восстановления иммунитета. c| Острый воспалительный ответ, являющийся причиной развития синдрома восстановления иммунной системы (СВИС), обычно не возник бы у хозяина, не имеющего дефицита по CD4+ T‑лимфоцитам. Таким образом, быстрая кинетика данного процесса активации может быть важным фактором, вызывающим СВИС.
Функциональное перераспределение Т-лимфоцитов. В большей части иммунопатогенез синдрома восстановления иммунитета определяется наличием конкретного патогена. Развитие синдрома восстановления иммунитета ассоциировано с CD4 (Th1) – опосредованным иммунным ответом, но, как правило, в процесс вовлекаются CD4- и CD8-эффекторные клетки. Формирование СВИ связано с несбалансированным иммунным восстановлением эффекторных и регуляторных Т-лимфоцитов. Существуют два типа клеток, играющих важную роль в развитии данного синдрома: провоспалительные Th17-клетки и регуляторные T-клетки.
В норме Т-регуляторные Foxp3+CD25+CD4-клетки поддерживают физиологическое равновесие и Т-клеточный гомеостаз, а также предотвращают избыточный воспалительный ответ. В процессе течения иммунной реконституции уменьшается количество и угнетается функция Т-регуляторных лимфоцитов, что приводит к несостоятельности их супрессивной активности и к высвобождению провоспалительных цитокинов [2, с. 141; 21, с. 254].
Дефект в регуляторной функции и изменение Th-клеточного профиля. Важнейшим фактором контроля за чрезмерной пролиферацией Т-лимфоцитов и гиперактивацией иммунной системы служат регуляторные CD4+ Т-лимфоциты (Трег), экспрессирующие α-цепь рецептора IL-2 (CD25) и транскрипционный фактор forkhead box P3 (Foxp3). В норме при внедрении в организм патогенов и развитии инфекционного процесса происходит активация Трег и подавление ими избыточной активации иммунной системы для нормального завершения противоинфекционного иммунного ответа и предотвращения повреждения тканей. В иммунопатогенезе ВИЧ-инфекции роль Трег может рассматриваться по-разному. С функциями Трег может быть связан неэффективный противовирусный ответ, но с другой стороны, Трег могут иметь положительное действие в плане подавления гиперактивации иммунной системы у ВИЧ-инфицированных. Также важно, что Трег являются субпопуляцией CD4+ T-лимфоцитов, экспрессирующих хемокиновые рецепторы CXCR4 и CCR5, и, следовательно, сами могут быть инфицированы вирусом иммунодефицита человека с нарушением фенотипа и функциональных характеристик [17, с.2021]. Возможно, нарушенная функциональная активность Трег служит причиной отсутствия должного контроля за гиперактивацией иммунной системы при ВИЧ-инфекции [4, с. 25; 15, с. 3] и это может являться одной из причин для развития синдрома восстановления иммунитета.
В исследовании [12, с. 1160], посвященном ассоциации плазменных цитокинов и микробных биомаркеров, связанных с транслокацией микроорганизмов с воспалительным синдромом восстановления иммунной системы наблюдалось увеличение индуцированного интерфероном-γ протена 10 (interferon-γ-inducible 10[IP-10]) ‑ CXCL10), IFN-α2, маркеров микробной транслокации (липополисахарида (LPS) и рибосомальной 16S ДНК), маркеров активации моноцитов (растворимого рецептора sCD14) с высокими рисками развития данного синдрома.
Предполагается, что значительный вклад в развитие СВИ привносят макрофаги. После их инфицирования ВИЧ происходит сдвиг исходного фенотипа (CD14++CD16-) в направлении клеток с провоспалительными фенотипами (CD14+CD16+) и (CD14++CD16+), экспрессирующих также маркер апоптоза PD1 [9, с. 4] и синтезирующих провоспалительные цитокины IL-1, IL-6, TNF-α. Также в развитии синдрома восстановления иммунитета определённая роль отводится натуральным киллерам (NK-клетки), экспрессирующим на поверхность специфические молекулы, способные усиливать или подавлять их функцию. Особое место NK-клеткам отводится в патогенезе герпес-ассоциированного СВИ. В свою очередь нарушение активности макрофагов играет важную роль в развитии туберкулёз-ассоциированного синдрома восстановления иммунной системы (ТБ-СВИ) [4, с. 26-27].
Парадоксальный ТБ-ассоциированный СВИ связан с активностью интерлейкинов (IL-4, IL-6, IL-7, IFN-γ, TNF-α). В исследовании Haddow L.J.et al. [13, с. 107] отмечены высокий уровень IFN-γ и С‑реактивного белка в плазме крови у пациентов с развившимся синдромом восстановления иммунной системы на фоне латентно протекавшего туберкулеза и низкий уровень биомаркеров моноцитов и Т-клеточной активности у пациентов с парадоксальным ТБ-СВИ. Схожим течением обладает криптококк-ассоциированный синдром восстановления иммунитета, провоцирующий выработку провоспалительных цитокинов, включая Th1-цитокины. В проспективном исследовании Boulware D.R. et al. [8, с.1] отмечено, что увеличиваются Th 17 и Th 2 ответы (например, IL-17, IL-4), повышается уровень С-реактивного белка, и отсутствуют провоспалительные цитокиновые ответы (например, TNF-α, G-CSF, GM-CSF, VEGF) у пациентов до начала антиретровирусной терапии, которые предрасполагают людей к последующему цитомегаловирус-ассоциированному синдрому восстановления иммунной системы. Также данные биомаркеры могут быть объективным инструментом для стратификации риска криптококк-ассоциированного менингита при синдроме восстановления иммунной системы и смерти, и могут использоваться клинически, чтобы указывать, когда начинать антиретровирусную терапию или использовать профилактические вмешательства.
Генетическая предрасположенность. Синдром встречается чаще у молодых мужчин и у лиц молодого возраста [2, с. 141]. Не исключено, что развитие СВИ связано с наличием определенного лейкоцитарного антигенного профиля (HLA) и полиморфизмом генов регуляции цитокинов. Цитомегаловирус-ассоциированный синдром восстановления иммунной системы чаще развивается у носителей гена HLA-B44 и гаплотипа HLA-A2, B44, DR4. У пациентов с микобактериальным СВИ реже встречаются TNF-a-308*2 и IL-6-174*G. Эти аллели определяют низкую продукцию цитокинов. Наблюдения показали важную роль IL-12 в прогрессировании ЦМВ-СВИ, IL-6 и TNF-a в развитии микобактериального СВИ [12, с. 1161; 18, с. 807].
В исследовании [7, с. 152] сравнивали две группы мышей с нормальным и дефектным TCR-α (рис. 2). Для экспериментального воспроизведения синдрома восстановления иммунной системы необходима хроническая микобактериальная инфекция и лимфопения. Воспалительный синдром восстановления иммунитета можно экспериментально индуцировать у мышей с дефицитом Т-клеток, имеющих хроническую Mycobacterium avium инфекцию, путём инъекции очищенных CD4+ T-лимфоцитов. Важно отметить, что синдром восстановления иммунитета не встречается у мышей дикого типа, инфицированных до или после переноса CD4+ T- клеток. Кроме того, у мышей с дефицитом Т-лимфоцитов не наблюдается никаких симптомов, связанных с СВИ, когда Т-клетки переносятся до или сразу после заражения. Синдром восстановления иммунной системы возникает только после передачи CD4+ Т-лимфоцитов мышам с лимфопенией, которые были заражены несколькими месяцами ранее.

Рисунок 2. Экспериментальное воспроизведение синдрома восстановления иммунитета у мышей [7, с. 152]
Вывод. Проанализировав современное представление об иммунопатогенезе синдрома восстановления иммунной системы, развивающегося на фоне антиретровирусной терапии мы пришли к выводу, что начало АРВТ и активация иммунитета может сопровождаться появлением или усугублением оппортунистических, сопутствующих инфекций и заболеваний, приводящих к неблагоприятным исходам. В настоящее время, отсутствие понимания патологии синдрома восстановления иммунитета затрудняет разработку методов прогнозирования, диагностики и лечения этой болезни. На многие вопросы недостаточно ответов, полученных в результате клинических наблюдений, они требуют воспроизведения СВИ у лабораторных животных. Продолжающиеся исследования относительно иммунопатогенеза синдрома восстановления иммунной системы, вероятно, будут выявлять более рациональные подходы к пониманию данного заболевания, а также методы терапии данного синдрома.
Читайте также:


