Туберкулез гранулематозное воспаление причины развития морфология профилактика
В странах, где молоко пастеризуют, первичный туберкулез почти всегда начинается в легких. Как правило, бациллы, попавшие в легкие при вдыхании, внедряются в субплевральные дистальные отделы нижней части верхней доли или верхней части нижней доли, где возникает очаг консолидации 1-1,5 см в диаметре, который называют первичным туберкулезным аффектом или очагом Гона. В большинстве случаев в его центре есть казеозный некроз.
Туберкулезные бациллы, свободные или в пределах фагоцитов, распространяются по лимфатическим сосудам в регионарные лимфатические узлы, которые также часто подвергаются казеозному некрозу. Комбинация первичного туберкулезного аффекта, лимфангиита и лимфаденита носит название первичного туберкулезного комплекса или комплекса Гона. В первые недели развития первичного туберкулеза может происходить лимфогенное и гематогенное распространение инфекции в другие органы.
Приблизительно в 95% случаев клеточный иммунитет ограничивает инфекцию, при этом первичный туберкулезный комплекс подвергается фиброзированию и кальцификации, выявляемым при радиологическом исследовании. На этом этапе комплекс называют зажившим туберкулезным комплексом или комплексом Ранке. При гистологическом исследовании отмечается характерная гранулематозная воспалительная реакция с формированием казеозных и неказеозных гранулем. Сначала отдельные гранулемы видны только при микроскопическом исследовании, но когда множественные гранулемы сливаются, они становятся макроскопически видимыми.
В гранулемах, обычно окруженных лимфоцитами, присутствуют многоядерные гигантские клетки. У лиц с ослабленным иммунитетом гранулемы не формируются.
При вторичном туберкулезе начальное поражение обычно представляет собой очаг консолидации менее 2 см в диаметре в пределах 1-2 см от апикальной плевры. Такие очаги четко ограничены, имеют серо-белый или желтоватый цвет, разную степень выраженности казеозного некроза и периферического фиброза. У иммунокомпетентных лиц такой очаг подвергается прогрессирующему фиброзу и кальцификации.
Гистологически в активных очагах вторичного туберкулеза обнаруживаются сливающиеся гранулемы с казеозным некрозом в центре. Туберкулезные бациллы часто можно идентифицировать на ранних фазах формирования гранулемы при окрашивании по Цилю-Нильсену, но в гранулемах поздних стадий с фиброзом и кальцификацией возбудитель не выявляется. Ограниченный апикальный вторичный туберкулез легких может разрешиться спонтанно или после терапии, однако болезнь способна прогрессировать и распространяться интраканаликулярно (по бронхам при откашливании), а на поздних стадиях — гематогенно.
Прогрессирующий вторичный туберкулез наблюдается у пожилых и пациентов с иммуносупрессией. Апикальное поражение расширяется на смежные участки и в другое легкое и в конечном счете распространяется на бронхи и сосуды. Казеозные массы эвакуируются по бронхам, что приводит к образованию каверн с тонкими неровными стенками в фиброзной ткани. Эрозия кровеносных сосудов ассоциируется с кровохарканьем.
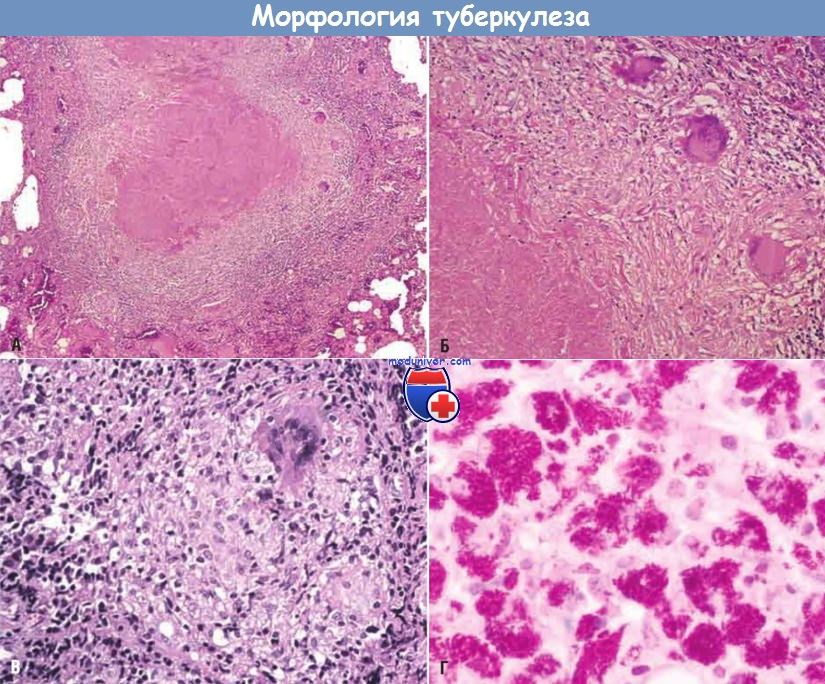
Спектр морфологии туберкулеза.
Туберкулезная гранулема при малом (А) и большом (Б) увеличении. Виден центральный казеозный некроз, окруженный эпителиоидными и многоядерными гигантскими клетками.
Это обычная реакция организма больных с клеточно-опосредованным иммунитетом к этому микроорганизму.
(В) Не все туберкулезные гранулемы характеризуются центральным казеозным некрозом, следовательно, независимо от наличия или отсутствия казеозного некроза при обнаружении туберкулезной гранулемы необходимо проводить окрашивание на кислотоустойчивые бактерии.
(Г) При таком окрашивании улиц с иммуносупрессией и отсутствием клеточного иммунитета видны макрофаги, забитые микобактериями.
При адекватном лечении процесс может быть остановлен, хотя заживление сопровождается выраженным фиброзом, что приводит к деформации структуры легких. Каверны, свободные от казеоз-ных масс, могут сохраниться с развитием фиброза их стенок. При неэффективном лечении или снижении защитных сил организма процесс может распространяться по дыхательным путям, лимфатическим каналам или сосудистой системе.
Милиарный туберкулез развивается, когда микроорганизмы по грудному лимфатическому протоку попадают в венозную кровь, а затем опять в легкие. В них появляются желто-белые очаги, которые имеют плотную консистенцию и небольшие размеры (от микроскопических до 2 мм) и рассеянны в обоих легких. Из-за внешнего сходства этих очагов с семенами проса и появилось название этой формы туберкулеза (лат. miliaris — просовидный). Милиарное поражение может захватывать большие области, даже целые доли легкого.
При прогрессировании процесса неизменно вовлекается плевральная полость, в которой развиваются серозный плеврит, туберкулезная эмпиема или облитерирующий фиброзирующий плеврит. Поражение бронхов, трахеи и гортани может развиться при лимфогенном и интраканаликулярном распространении инфекции. Слизистые оболочки бронхов, трахеи и гортани могут содержать туберкулезные гранулемы, определяемые только микроскопически. Системный милиарный туберкулез диагностируют, когда бактерии распространяются по артериальной системе. Милиарный туберкулез наиболее выражен в печени, костном мозге, селезенке, надпочечниках, мягких мозговых оболочках, почках, маточных трубах и эпидидимисе, но вовлекаться может любой орган.
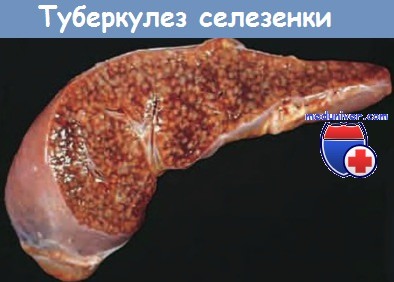
Милиарный туберкулез селезенки.
На разрезе видны многочисленные серо-белые туберкулы.
Лимфаденит — самое частое проявление внелегочного туберкулеза, обычно локализующееся в области шейных лимфатических улов. У лиц, не инфицированных ВИЧ, лимфаденит имеет тенденцию быть отграниченным и унифокальным. У ВИЧ-инфицированных лиц, напротив, почти всегда поражено большое количество лимфоузлов, а также отмечаются системные симптомы и поражение туберкулезом легких или других органов.
Туберкулез кишечника, возникающий после употребления в пищу зараженного молока, был довольно распространенной причиной болезни. В странах, где используют пастеризованное молоко, туберкулез кишечника чаще ассоциируется с проглатыванием откашлянного инфекционного материала больными с распространенным туберкулезом легких. Как правило, микроорганизмы заселяют лимфоидную ткань, ассоциированную со слизистой оболочкой тонкой кишки и толстой кишки, где развивается гранулематозное воспаление, приводящее к образованию язв, чаще всего в подвздошной кишке.
Реакция в месте локализации МБТ сначала должен неспецифический характер. Такая реакция наблюдается в тканях независимо от вида возбудителя. Происходят нарушения микроциркуляции, повышение проницаемости сосудистой стенки, локальный отек тканей инфильтрация зоны поражения лейкоцитами, моноцитами и другими форменными элементами крови. Первые специфические морфологические признаки туберкулезного воспаления появляются позже, через 2-3 недели после инфицирования МБТ.
Развитие специфического для туберкулеза воспаление обусловлено иммунологическими сдвигами, которые возникают при взаимодействии макроорганизма с туберкулезным возбудителем. В связи с этим специфическую воспалительную реакцию при туберкулезе характеризуют как классический пример воспаления на иммунной основе.
Туберкулезная гранулема
Главным морфологическим элементом туберкулезного воспаления является бугорок, который чаще называют туберкулезной гранулемой.
Визуализация туберкулезной гранулемы возможна при световой микроскопии. Важнейшей отличительной чертой туберкулезной гранулемы является наличие центральное расположенной зоны серчатого или казеозного, некроза — плотного аморфного клеточного детрита, образовавшегося вследствие повреждения и гибели фагоцитов. Зона казеозного некроза окружена несколькими слоями эпителиоидных клеток, макрофагов, лимфоцитии и плазматических клеток. Среди эпителиоидных клеток находятся крупные многоядерные клетки Пирогова-Лангханса.
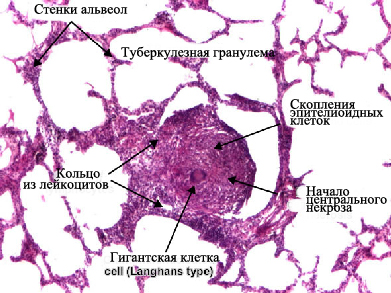
В наружных отделах клеточного слоя можно увидит полинуклеарные лейкоциты и фибробласты. Клеточные элементы, расположенные вокруг зоне казеозного некроза, образуют грануляционную ткань. В клетках, расположенных ближе к казеозно-некротическим массам, отмечаются признаки дистрофии и деструкции. Специфическое воспаление захватывает различные морфологические структуры пораженного органа: клетки паренхимы, лимфатические и кровеносные сосуды. При туберкулезе легких в специфическую воспалительную реакцию также привлекаются бронхи.
Иммуноморфологические особенности специфического воспаления позволяют считать туберкулез гранулематозным заболеванием. Функциональное состояние паренхиматозных клеток в зоне поражения существенно нарушается. В них отчетливо проявляются признаки дистрофии и деструкции. Резко снижается ресорбативная функция лимфатических капилляров. Возникают повреждения эндотелия лимфатических капиляров с выходом лимфы в межклеточное пространство. Наблюдаются грубые нарушения микроциркуляции с тромбозом мелких кровеносных сосудов.
Повреждения кровеносных сосудов обусловлено фиксацией в их базальном слое циркулирующих иммунных комплексов (ЦИК), которые можно обнаружить при электронной микроскопии. Кровеносные капилляры в туберкулезной гранулеме практически отсутствуют. Питание клеточных элементов осуществляется в основном путем омывания их межклеточной жидкостью.
Клеточный состав гранулемы подвергается динамическим изменениям на разных стадиях ее развития. С преимуществом того или иного типа клеточных элементов выделяют эпителиоидно-клеточные, лимфоидные и гигантоклеточные туберкулезные гранулемы. В случаях преимущества зоны некроза гранулемы называют некротическими. Особенности клеточного состава гранулемы и выраженность некротических изменений зависят от характера клеточной реакции в зоне поражения. При продуктивной клеточной реакции в гранулеме преобладают эпителиоидные, макрофагальные, многоядерные гигантские клетки. Внешний отдел клеточного слоя содержит фибробласты, синтезирующие коллаген. Некротические изменения в центре гранулемы выражены слабо, а иногда отсутствуют. Преимущество экссудативной клеточной реакции проявляется увеличением зоны некроза. Она занимает 1/3 или 1/2 общего объема гранулемы.
В клеточном слое преобладают макрофаги и лимфоидные элементы с ограниченным присутствием эпителиоидных и гигантских клеток на границе с зоной казеозного некроза. Преимущественно альтеративная реакция характеризуется формированием некротических гранулем, в которых клеточный вал выражен крайне слабо, а иногда практически отсутствует.
Преобладание экссудативной тканевой реакции свидетельствует о прогрессировании туберкулезного воспаления. Ткань, окружающая отдельные гранулемы, просачивается серозно-фибринозным экссудатом. Постепенно происходит слияние гранулем. В результате формируется туберкулезный очаг — патологическое образование диаметром до 1 см. Прогрессирование очагов проявляется расширением зоны перифокального воспаления, еще в начале может быть серозным, фибринозным или гнойным.
Признаки специфического воспаления
Затем возникают признаки специфического воспаления — образуются новые туберкулезные гранулемы с выраженной зоной некроза, окруженной слоем из немногочисленных эпителиоидных и единичных гигантских клеток. Грануляционная ткань инфильтрируется макрофагами, лимфоидными элементами, а также полинуклеарами. Прогрессирование процесса приводит к слиянию очагов и формирование туберкулезных инфильтратов с участками казеозного некроза. В дальнейшем происходит инфильтрация казеозных масс полинуклеарными лейкоцитами.
Протеолитические ферменты, выделяемые лейкоцитами, вызывают расплавление казеозных масс. При отторжении формируются язвы или полости распада, которые затем могут трансформироваться в каверны. Резкое угнетение клеточного иммунитета приводит к быстрому прогрессированию патологического процесса с возникновением некротических гранулем. Довольно быстро в пораженном органе формируются обширные зоны казеозного некроза.
Интенсивность развития туберкулезного воспаления, выраженность и изменение воспалительных тканевых реакций — пролиферации, экссудации и альтерации — в значительной степени зависят от количества МБТ, попавших в организм, и их вирулентности. В эксперименте установлено, что туберкулезная гранулема в легкие животных (собаки) формируется при введении 1 МБТ, большой очаг — 106, каверна — 108 микобактерий. Экссудативная и альтернативное тканевая реакция доминирует при увеличении микобактериальной популяции, высокой вирулентности микобактерий, повышенной чувствительности клеток к возбудителю туберкулеза в сочетании с недостаточной эффективностью фагоцитоза. В этих условиях туберкулезный процесс прогрессирует и при отсутствии лечебных мероприятий часто приводит к летальному исходу.
Обратное развитие туберкулезного воспаления
Обратное развитие туберкулезного воспаления в большинстве случаев сопровождается постепенным рассасыванием экссудата, уплотнением зоны казеозного некроза и формированием вокруг туберкулезных гранулем и очагов соединительнотканной капсулы. В заживлении и последующем рубцевании гранулематозных очагов большое значение имеет инфильтрация их фибробластами, обеспечивающих формирование коллагеновых волокон. Вследствие обратного развития патологического процесса они подвергаются гиалиноза. В капсуле, окружающей туберкулезные гранулемы и очаги, иногда можно обнаружить скопления лимфоцитов, их появление обычно обусловлено высокой эффективностью защитных иммунологических реакций. Рассасывания экссудата с трансформацией туберкулезных грануляций в соединительную ткань может привести к фиброзным (цирротическим) изменениям в пораженном органе.
Остаточные посттуберкулезные изменения являются резервуаром эндогенной туберкулезной инфекции. Они поддерживают противотуберкулезный иммунитет, а при неблагоприятных для макроорганизма условиях создают угрозу повторного заболевания туберкулезом.
Инволюция туберкулезного воспаления с полным рассасыванием патологических очагов без каких-либо остаточных изменений и полной элиминацией микобактерий из организма — большая редкость. Такой результат иногда возможен при неосложненных первичных формах туберкулеза и быстром восстановлении иммунитета, нарушенного в начале заболевания.
Проникновение в организм МБТ нередко вызывает различные неспецифические изменения в тканях. Эти изменения этиологически обусловленные присутствием микобактерий, однако признаков специфического воспаления нет. В связи с этим их принято называть параспецифическими.
Параспецифические тканевые реакции
Параспецифические тканевые реакции могут развиваться в сердечно-сосудистой системе, различных паренхиматозных органах. Чаще всего они возникают при первичном или диссеминированном туберкулезе. Морфологические признаки параспецифических реакций представлены токсико-аллергическим тромбоваскулит, а также периваскулярными узловатыми или диффузными инфильтратами с мононуклеарными макрофагами, лимфоцитами и плазматическими клетками. Наиболее выражены такие изменения в лимфатических узлах.
При своевременной диагностике туберкулеза и адекватном лечении параспецифические изменения довольно быстро подвергаются обратному развитию без каких-либо остаточных изменений. При отсутствии лечения в зоне параспецифических изменений впоследствии могут возникнуть поражения специфического характера.
Выделение в течении туберкулеза двух последовательных периодов — первичного и вторичного — находит отражение и в особенностях патоморфологической картины.
Первичный туберкулез всегда привлекает в патологический процесс лимфатическую систему. Ограниченный или тотальный казеозный некроз лимфатических узлов — важнейшая черта первичного туберкулеза. Наличие большой перифокальной воспалительной реакции вокруг основного очага — также важная отличительная черта первичного туберкулеза.
При легочном поражении первичный аффект преимущественно локализуется в хорошо вентилируемых отделах, т.е. в средних и нижних долях легкого. Вследствие бактериемии, характерной для первичного периода туберкулезной инфекции, в легких и других органах формируются гематогенные очаги-отсевы. Нередко возникают распространенные параспецифические реакции. Остаточные посттуберкулезные изменения при первичном туберкулезе формируются медленно. Они постепенно рассасываются, рубцуются или извествляются, иногда подвергаются осификации.
Вторичный туберкулез развивается на фоне остаточных изменений, сформировавшихся в процессе первичного туберкулеза. При вторичном туберкулезе специфический процесс возникает на фоне ослабленного противотуберкулезного иммунитета. Регионарные лимфатические узлы в патологический процесс не вовлекаются. Туберкулезное поражение чаще имеет органный характер с образованием очага, инфильтрата, каверны. В развитии вторичного туберкулеза большое значение имеет бронхогенный путь распространения МБТ. В большинстве случаев вторичный туберкулез поражает, легкое, в основном верхние и задние отделы. В остаточных изменениях, формируются в результате вторичного туберкулеза, обычно отсутствуют признаки кальцинации или осификации.
Учебная медицинская литература, онлайн-библиотека для учащихся в ВУЗах и для медицинских работников
Туберкулез — инфекционный гранулематоз с хроническим течением, полиморфизмом локализаций, клинических проявлений и исходов.
Этиология.
Основной возбудитель туберкулеза — Mycobacterium tuberculosis, реже — М. bovis, M. africanum, M. microti и М. canetti. Из числа многочисленных нетуберкулезных микобактерий (71 вид) сходное с туберкулезом заболевание вызывает М. avium intracellulare.
Микробиология.
Микобактерия туберкулеза (МБТ) имеет вид палочки (рис. 1) 0,2—0,6 — 1,0—10 мкм, обладает полиморфизмом (кокковые, мелкозернистые, L — трансформированные и мицелиоподобные формы), растет на специальных питательных средах. МВТ — кислотоустойчивый аэроб. Сложная структура МБТ, в том числе большое количество липидов и восков, обеспечивает высокую фено- и генотипическую устойчивость. МВТ устойчивы к действию физико-химических факторов и действию противотуберкулезных препаратов. Выделяют первичную лекарственную устойчивость как феномен резистентности до начала терапии, и вторичную лекарственную устойчивость, развивающуюся в процессе терапии. В эпидемиологии распространения лекарственно устойчивых МБТ отмечается рост лекарственной полирезистентности. Лекарственная устойчивость МБТ — одна из основных причин неэффективности химиотерапии Т. При бактериоскопии патогенного материала используют окраски карболфуксином по Цилю-Нильсену и флюоресцентными красителями аурамином-родамином (рис. 2, 3). Количественные исследования показали, что бактериоскопия эффективна при наличии от 5 000 до 10 000 МБТ в 1 мл патогенного материала; культуральное исследование выявляет МБТ при исходном содержании от 10 до 100 микобактерий на 1 мл. Популяция МБТ в очагах туберкулезного воспаления неоднородна и включает субпопуляции с вне- и внутриклеточной локализацией, различиями в активности метаболизма и лекарственной устойчивости. Соотношения между субпопуляциями МВТ меняются в процессе химиотерапии.
Эпидемиология
Фактор риска — общее обозначение факторов не являющихся непосредственной причиной развития конкретного заболевания, но повышающих вероятность его возникновения.
Факторы, способствующие трансмиссии М. tuberculosis:
Патогенез.
Патогенез туберкулез определяет проникновение МБТ в организм и особенности общих и местных реакций организма на туберкулезную инфекцию (формирование очагов специфического воспаления и развитие очерченных клинико-анатомических форм заболевания). Первичное попадание МБТ в ткани ранее неинфицированного организма сопровождается повреждением ткани, развитием неспецифического воспаления, затем — гранулематозного, с формированием гранулем. Развитие иммунного ответа требует присутствия в организме от 10 до 100 000 микобактерий, клеточную иммунную реакцию при этом выявляет постановка кожной туберкулиновой пробы. МБТ вызывает в организме сложный комплекс иммунных реакций на основе ГЗТ и ГНТ. В основе ГНТ лежат экссудативно-некротические изменения. Смена видов тканевой реакции отражает волнообразное клиническое течение Т. Лимфо- и гематогенная диссеминация сопровождаются прогрессированием заболевания и возникновением очагов отсева. Как повреждение на месте первичного поражения очага отсева заживают или превращаются в потенциальный источник поздней реактивации.
Патогенез туберкулезного воспаления, развивающегося после инфицирования, характеризует стадийность развития:
Иммунопатология туберкулеза.
Центральным звеном резистентности к микобактериям являются клетки, сенсибилизированные к микобактериальным антигенам. В клетках этого типа гибнут микобактерии; небактерицидные системы указанных клеток ингибируют размножение МБТ.
Сенсибилизированные МБТ Т-лимфоциты оказывают стимулирующее влияние на макрофаги — их миграцию и фагоцитоз. Между особенностями иммунологической реактивности и клинико-анатомической характеристики туберкулезного процесса существует прямая зависимость. При ограниченных, с благоприятным прогнозом и течением, формах первичного туберкулеза с излечением в 100%, а также очагового и инфильтративного туберкулеза не нарушаются соотношения Т- и B- лимфоцитов, Т-хелперов и Т-супрессоров, не выявляется нарушение функций Т- и В-клеток, не нарушены функции макрофагов, выражена кожная ГЗТ. Прогрессирующее течение деструктивных форм туберкулеза легких коррелирует с супрессией Т-системы за счет Т-хелперов: соотношение Т-хелперов к Т-супессорам меняется в сторону супрессорных клеток, нарушаются функции макрофагов. Интенсивность кожной ГЗТ падает или развивается анергия.
Наследственность при туберкулезе.
Восприимчивость к туберкулезу и его течение связаны с генами HLA-системы и их этнической специфичностью.
Наиболее типичное проявление туберкулеза — гранулема , скопление эпителиоидных и лимфоидных клеток с примесью макрофагов и плазматических клеток, присутствием многоядерных гигантских клеток Лангханса и казеозным некрозом в центре.
Проявления туберкулезного воспаления в тканях многообразны: милиарные бугорки-гранулемы, разновеликие очаги, пневмония, каверны, язвы, свищи, секвестры, экссудаты. Характер воспаления при этом всегда смешанный (сочетание экссудативной и продуктивной реакций) и определяется фазой процесса. Локальные проявления туберкулеза не совпадают по степени активности процесса.
Исход — фибротизация, кальцификация, частичное рассасывание. При прогрессировании — нарастание экссудативно-деструктивных проявлений специфического процесса.
Распространенная деструкция и избыточный фиброз ведут к функциональным нарушениям пораженного органа или системы.
Патоморфоз туберкулеза.
К группе внешних факторов риска отнесены МБТ с их особенностями, образ жизни (социально-экономический фактор), среда обитания, лечебно -профилактические мероприятия. В группу внутренних факторов риска входят иммунодефицитные состояния — первичные, связанные со структурой гено- и фенотипа, и вторичные, обусловленные различными видами патологии.
Патоморфоз туберкулеза как инфекционного заболевания характеризуется совокупностью эпидемиологических, клинических и патологоанатомических особенностей. Эпидемиологические особенности туберкулеза в современных условиях отличает негативная динамика эпидемиологических показателей, повышение роли экзогенной инфекции и эпидемиологического значения групп риска по отношению к заболеванию Т, особенности МБТ (лекарственная устойчивость, появление микробных ассоциаций). Особенности клинических проявлений туберкулеза — рост острых, деструктивных и распространенных форм заболевания, снижение эффективности терапии, изменение структуры контингентов и форм заболевания, рост числа сопутствующих туберкулезу болезней (особенно токсикоманий и ВИЧ-инфекции).
Группа риска — группа населения, выделенная на основе наличия фактора/факторов риска какого-либо заболевания. По отношению к туберкулезу выделены три основные группы повышенного риска.
- Социальная — лица БОМЖ, мигранты, лишенные свободы, больные из наркологических и психиатрических учреждений и пр.
- Медицинская — лица с профессиональными заболеваниями легких, сахарным диабетом, ВИЧ-инфицированные, получающие иммуносупрессивную или лучевую терапию и пр.
- Контакты с больными туберкулезом.
К патологоанатомическим особенностям патоморфоза туберкулеза относят: снижение патогенетической значимости реинфекта в развитии форм вторичного туберкулеза, нарастание тканевых реакций, протекающих на основе ГНТ, неполноценность репаративных процессов, преобладание среди причин смерти прогрессирования туберкулеза, рост ятрогенной патологии, трудности дифференциальной диагностики в связи с увеличением спектра гранулематозных заболеваний.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.








Различные гранулематозные болезни, в частности туберкулез и саркоидоз, нередко имеют сходные клинические и морфологические проявления, что в значительной мере затрудняет их дифференциальную диагностику [2,3,4]. При саркоидозе клинические проявления, рентгенологическая картина, изменения лабораторных показателей могут быть весьма разнообразными [1]. Остается неясным соответствуют ли такой неоднородности клинических проявлений саркоидоза какиелибо структурные особенности гранулематозного воспалительного процесса.
Целью настоящего исследования было выявить особенности и различия морфологических проявлений гранулематозного воспаления при саркоидозе и туберкулезе.
Результаты исследования. Патоморфологические изменения в лимфатических узлах больных сар коидозом характеризовались комплексом стереотипных тканевых реакций, определялись четко очерченные эпителиоидноклеточные гранулемы, поля фиброза и гиалиноза. В гранулемах всегда присутствовали лимфоциты, в части случаев - гигантские клетки ПироговаЛангханса. Были выделены два варианта тканевых реакций: с выраженным фиброзом и со слабо выраженным фиброзом.
Морфологическими критериями этих вариантов тканевых реакций при саркоидозе являются выраженность фиброза, неказеозные, четко очерченные эпителиоидноклеточные гранулемы с явлениями перигранулематозного склероза. В паренхиме легких, прилежащих к гранулемам, определялась картина альвеолита разной степени выраженности. При туберкулезе, в отличие от саркоидоза с выраженным фиброзом, гранулематозный воспалительный процесс в лимфатических узлах характеризовался меньшей обьемной плотностью фиброза и большей распространенностью альвеолита и казеозного некроза.
Заключение. Таким образом, по морфологическим данным, продуктивнотканевая реакция при саркоидозе, в отличие от туберкулеза, характеризовался выраженным фиброзом, гиалинозом, меньшими размерами гранулем и неказеозным продуктивным процессом.
Список литературы
- Гончарова Е.В., Борисов С.Е. и др. Материалы 4-ого сьезда научно-медицинской ассоциации фтизиаторов.1998.
- Соловьева И.П., Бряцде В.И. Дифференциальная диагностика гранулематозных заболеваний легких. Методические рекомендации. М. 1999.
- Струков А.И., Кауфман О.Я. Гранулематозное воспаление и гранулематозные болезни. М. 1989.
- Wilson R. Tuberculosis. Amsterdam, 1988.
Читайте также:


