100 вирусных частиц это
Так как вирусы не относятся к клеточной форме жизни, в качестве обозначения дискретной вирусной частицы используется термин "вирион". Это понятие было введено в 1962 г. французом Андре Львовым.
Вирус существует в этом виде не постоянно, а лишь на определенном этапе своего жизненного цикла.
Что такое вирион
Вирион представляет собой конечную фазу развития вируса, включающую полный набор структурных и функциональных элементов, упакованных в единую частицу. Такая форма характерна для внеклеточной стадии жизненного цикла вируса, однако какое-то время после сборки вирион может существовать и внутри инфицированной клетки.
Так как вирион – это всего лишь обозначение морфологической единицы, его не стоит отождествлять с понятием "вирус". Последний включает всю совокупность биологических свойств, характеризующих этот таксон, а не только особенности строения.
Строение вириона
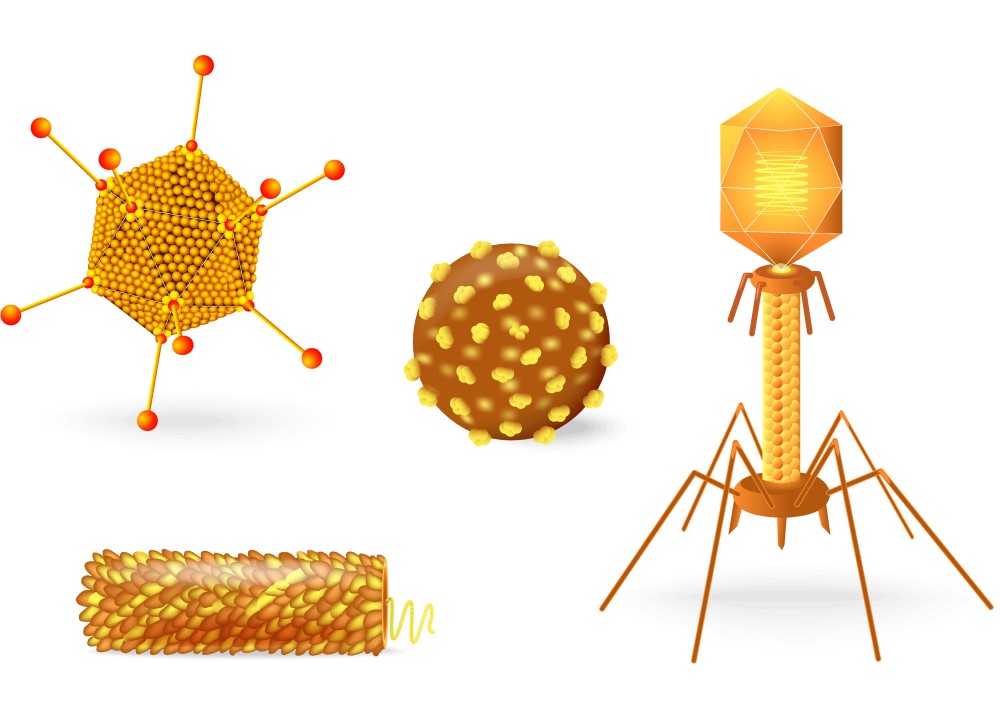
Вирусная частица состоит из нуклеиновой кислоты (РНК или ДНК), окруженной белковым слоем (капсидом), который выполняет защитные функции и обеспечивает взаимодействие с клеткой хозяина. Некоторые вирионы имеют дополнительную оболочку в виде билипидной мембраны, пронизанной торчащими наружу шипами белков вируса. Эта структура имеет клеточное происхождение и называется суперкапсидом. Размеры вирусных частиц варьируются в пределах от 20 до 200 нм.
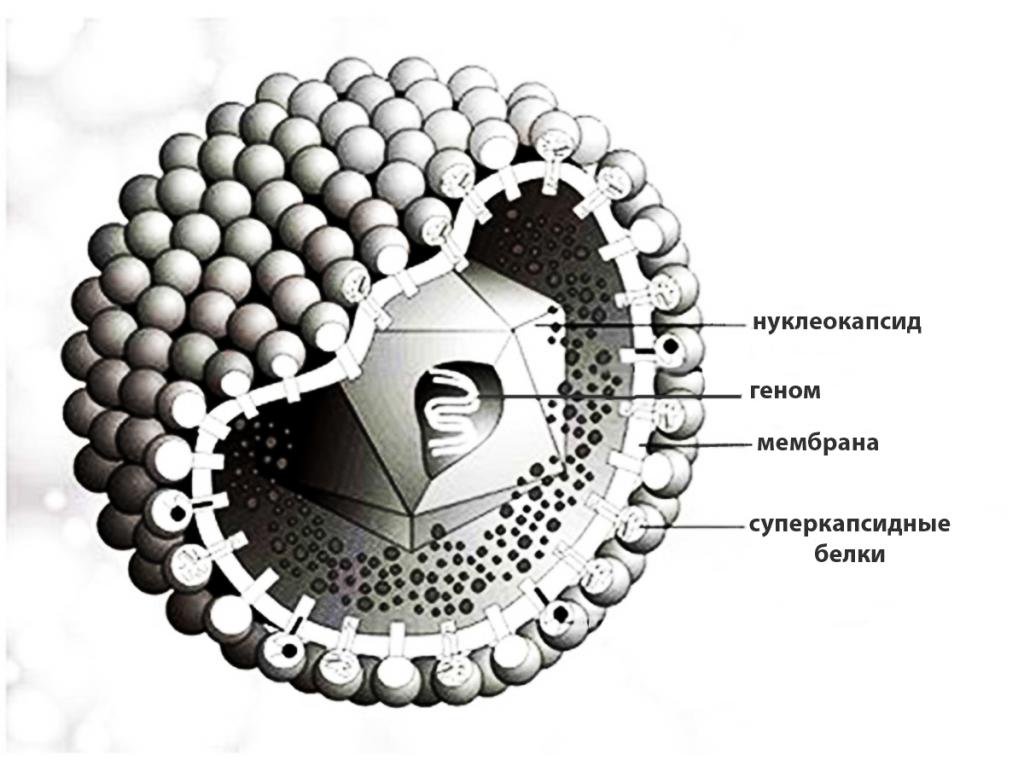
Белковые субъединицы оболочки вириона могут складываться в различные пространственные конфигурации, на основании которых строится морфологическая классификация вирусов. По типу структурной организации выделяют вирионы:
- со спиральной симметрией – белковые единицы располагаются по спирали, в центре которой пролегает аналогично структурированная нуклеиновая кислота;
- с кубической симметрией – сформированные из белковых молекул равносторонние треугольники (капсомеры) образуют различные формы многогранников (тетраэдры, октаэдры, икосаэдры и др.);
- с бинарной (смешанной) симметрией – совмещение обоих типов организации в одной вирусной частице (характерно для бактериофагов);
- сложно организованные, покрытые суперкапсидом.
Помимо структурных субъединиц оболочки некоторые вирионы содержат ферменты, необходимые для транскрипции генетического материала.
Пространственная структура, белковый состав и тип нуклеиновой кислоты вириона – это основные таксономические признаки биологической дифференциации вирусов. Дополнительными критериями являются особенности жизненного цикла и спектр хозяев.
Генетический материал вирусных частиц
В отличие от генетического материала других организмов, вирионы вирусов содержат только один тип нуклеиновой кислоты: ДНК либо РНК. Эти молекулы могут быть кольцевыми или линейными, фрагментированными или цельными, с замкнутыми (полностью или частично) или свободными концами, содержать как две цепочки, так и одну. Такое разнообразие организации нуклеиновых кислот характерно только для вирусов.
Вирусный геном также имеет и функциональную характеристику. Так, РНК вириона может быть позитивной, то есть транслироваться в клетке хозяина с образованием вирусных белков, и негативной, не обладающей матричной активностью (в данном случае трансляции предшествует синтез позитивной РНК входящим в состав вируса ферментом – транскриптазой).
В зависимости от комбинации этих характеристик в составе вирионов различают 6 типов РНК:
- одноцепочечная нефрагментированная позитивная;
- одноцепочечная нефрагментированная негативная;
- одноцепочечная фрагментированная негативная;
- двуцепочечная фрагментированная негативная;
- одноцепочечная двойная позитивная;
- одноцепочечная кольцевая дефектная.
В ДНК-геноме различают "+" и "-" цепи и выделяют следующие типы молекулярной организации:
- частично одноцепочечная кольцевая;
- сверхспиральная замкнутая кольцевая;
- одноцепочечная линейная;
- линейный дуплекс;
- линейный дуплекс с ковалентно сшитыми концами;
- одноцепочечная линейная;
Среди всех типов геномов выделяют группы, для каждой из которых характерен определенный механизм репликации в инфицированной клетке.
Сборка вириона внутри клетки-хозяина
Формирование вирусных частиц осуществляется за счет ферментов и механизмов биосинтеза зараженной клетки, которые вирус заставляет работать на себя. Этот процесс включает несколько этапов.
Вначале генетический материал вириона попадает в клетку хозяина. При этом у простых вирусов белковая оболочка остается за пределами, а у сложных проникает внутрь благодаря слиянию суперкапсида с плазматической мембраной (рецепторный эндоцитоз). В последнем случае оказавшийся в цитоплазме капсид разрушается под действием литических ферментов фагосомы.
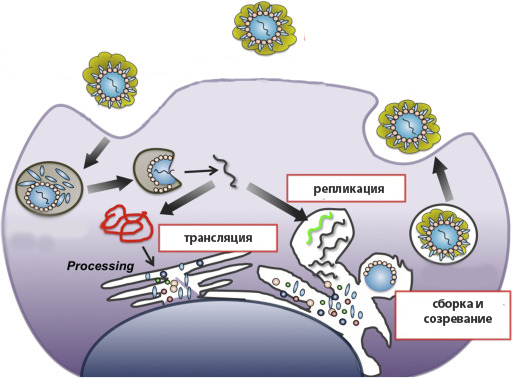
На основе нуклеиновой кислоты параллельно протекают 2 процесса: репликация генома (создание множества копий генетических молекул ДНК или РНК) и трансляция белков вириона в рибосомном аппарате клетки-хозяина.
Синтезированные белковые и генетические элементы соединяются в нуклеокапсид – полноценный вирион простых вирусов. У сложных сборка завершается в момент выхода частицы из клетки, в процессе которой происходит обволакивание капсида плазматической мембраной, содержащей заранее встроенные в нее рецепторные белки.
Научно-производственное объединение "Вирион"
Научно-исследовательское предприятие "Вирион" – это крупнейший фармацевтический комплекс по созданию и производству иммунобиологических препаратов в России. В 1906 году он был основан как Томский бактериологический институт имени Ивана и Зинаиды Чуриных, а в 1953 году получил статус НИИ вакцин и сывороток. В 1988 году институт переименовали в научно-производственное объединение (НПО) "Вирион", которое впоследствии стало филиалом Московского ФГУП НПО "Микроген".

К основным направлениям работы компании относятся создание и производство иммуноглобулинов, противовирусных вакцин, пробиотиков, психотропных лекарств и различных препаратов для диагностики. Предприятие расположено по адресу г. Томск, улица Ивановского 8.
В настоящее время производственный комплекс "Вирион" – это известная крупная компания с высокотехнологичной базой производства и профессиональным штатом сотрудников из 600 человек.
В России не будет нарастания эпидемии коронавируса по типу ядерной реакции, но есть тип вызываемой им инфекции, при которой летальность — 100%, уверен вирусолог Виктор Зуев.
Итальянского варианта в России не будет
Нарастание случаев заражения связано с возвращающимися в Россию туристами. Как только они пройдут карантин, Россия пройдет пик эпидемии COVID-19, сказал в прямом эфире программы "Точка зрения" вирусолог, доктор медицинских наук, профессор Центра эпидемиологии и микробиологии им. Гамалеи Виктор Зуев.
Это случится, по его словам, до начала мая.
Россия имеет самую лучшую эпидемиологическую медицину в мире, напомнил эксперт, в 60-е годы СССР справился с начинающейся эпидемией оспы. Для борьбы с новой инфекцией Россия готова, так как имеется достаточное количество мест для госпитализации и соответствующее оборудование.
Итальянский вариант развития болезни, то есть, когда идет заражение в геометрической прогрессии, в России исключен, так как приезжающим туристам не дают общаться с окружением, их сразу помещают на карантин и очень строго следят за режимом изоляции, сказал Виктор Зуев.
Он призывает соблюдать карантин, то есть, сидеть дома, а если надо в магазин, то ходить туда надо, когда там мало покупателей.
"Это чрезвычайно важно", — отметил Виктор Зуев.
Осенью коронавирус уже не будет страшен
Грипп (а именно его вызывает вирус) нас посещает весной и осенью, напомнил вирусолог, летом его нет. Осенью уже нам этот грипп не страшен, потому что уже будет коллективная иммунная прослойка и коронавирус станет ослабленным.
Виктор Зуев сказал, что каждый год делает прививку от гриппа, несмотря на то, что "не всякий раз вакцинный штамм попадает в штамм эпидемический".
"Но дело в том, что помимо тех двух антигенов, от которых зависит уровень антител, которые нас защищают, есть еще внутренние вирусные белки, а они мало отличаются у разных штаммов, поэтому какая-то защита всегда есть", — сказал вирусолог.
Четыре типа вирусной инфекции
По словам Виктора Зуева, вирус дает разные реакции организма:
- острая болезнь с высокой температурой,
- хроническая форма, когда утром просыпаешься, температура "смешная", голова болит и на работу не хочется идти, но "стыдно отпрашиваться",
- скрытая форма, латентная, например, вирус герпеса, он начинает активно размножаться, когда у нас падает иммунитет,
- медленная вирусная инфекция*, которая летальна на 100%.
Виктор Зуев не согласен с точкой зрения, что надо всем дать переболеть, так как это неизбежно, и тогда у человечества быстро появится иммунитет.
"Не от большого ума Борис Джонсон (премьер Великобритании) заявлял об этом. Хорошо рассуждать, сидя в теплой квартире, но, ведь, при этом имеет место быть и смертность. А если это коснется вашей семьи?", — сказал Виктор Зуев.
По его словам, для профилактики гриппа, надо принимать иммуномодуляторы и рационально питаться — овощи, фрукты, чеснок. Алкоголь не помогает.
Лекарства от вируса нет
Эксперт напомнил, что не существует противовирусного лекарства, и это связано с тем, что надо создать три условия:
- чтобы это лекарство попадало внутрь клетки,
- обладало способностью "не ломать обмен клетки"
- препятствовало обмену вирусов внутри клетки. Вирус это внутриклеточный паразит, вне клетки вирус "не работает".
Специалист считает, что новый коронавирус возник естественным путем в Китае путем мутации вируса летучей мыши. Он советует:
"Если болезнь легко протекает болезнь, можно дома лечиться, но не контактируя с семьей. Маски защищают не от вируса, а от слюней, маски нужны больному человеку, надо мыть руки перед едой — это лучшая профилактика", — резюмировал Виктор Зуев.
*Медленные инфекции - это своеобразное взаимодействие определенных вирусов с организмом, характеризующееся длительным инкубационным периодом, тянущимся многие месяцы и даже годы, и последующим медленным, но неуклонным развитием симптомов заболевания, ведущим к тяжелому нарушению функций органов и летальному исходу.

Вирусы — это микроскопические патогены, заражающие клетки живых организмов для самовоспроизводства. Они состоят из одного вида нуклеиновой кислоты (или ДНК или РНК, но не обе вместе), которая защищена оболочкой, содержащей белки, липиды, углеводы или их комбинацию. Размер типичного вируса варьируется от 15 до 350 нм, поэтому его можно увидеть только с помощью электронного микроскопа.
В 1892 году русский ученый Д.И. Ивановский впервые доказал существование ранее неизвестного типа возбудителя болезней, это был вирус мозаичной болезни табака. А в 1898 году Фридрих Лоффлер и Пол Фрош нашли доказательства того, что причиной ящура у домашнего скота была инфекционная частица, которая меньше, чем любая бактерия. Это были первые шаги к изучению природы вирусов, генетических образований, которые лежат где-то в серой зоне между живыми и неживыми состояниями материи. На текущий момент описано около 6 тыс. вирусов, но их существует несколько миллионов.
Строение вирусов
Вне клеток-хозяев вирусы существуют в виде белковой оболочки (капсида), иногда заключенного в белково-липидную мембрану. Капсид обволакивает собой либо ДНК, либо РНК, которая кодирует элементы вируса. Находясь в такой форме вне клетки, вирус метаболически инертен и называется вирионом.
Простая структура, отсутствие органелл и собственного метаболизма позволяет некоторым вирусам кристаллизоваться, т.е. они могут вести себя подобно химическим веществам. С появлением электронных микроскопов было установлено, что их кристаллы состоят из тесно прижатых друг к другу нескольких сотен миллиардов частиц. В одном кристалле вируса полиомиелита столько частиц, что ими можно заразить не по одному разу всех жителей Земли.
Формы вирусов
Вирусы встречаются в трех основных формах. Они бывают:
- Сферическими (кубическими или полигидральными). Вирусы герпеса, типулы, полиомы и т.д.
- Спиральными (цилиндрическими или стержнеобразными). Вирусы табачной мозаики, гриппа, эпидемического паротита и др.
- Сложными. Например, бактериофаги.
Проникновение вирусов в клетку-хозяина
Капсид в основном защищает нуклеиновую кислоту от действия клеточного нуклеазного фермента. Но некоторые белки капсида способствуют связыванию вируса с поверхностью клеток-хозяев, и работают, как ключики, вставляемые в нужные замочки. Другие поверхностные белки действуют как ферменты, они растворяют поверхностный слой клетки-хозяина и таким образом помогают проникновению нуклеиновой кислоты вируса в клетку-хозяина.
Жизненный цикл вирусов сильно отличается у разных видов, но существует шесть основных этапов жизненного цикла вирусов:
Присоединение к клетке-хозяину представляет собой специфическое связывание между вирусными капсидными белками и рецепторами на клеточной поверхности. Эта специфика определяет хозяина вируса.
Проникновение следует за прикреплением: вирионы проникают в клетку-хозяина через рецептор-опосредованный эндоцитоз или слияние мембран. Это часто называют вирусной записью.
Проникновение вирусов в клетку достигается за счет:
Размножение вирусов
После того, как вирусный геном освобождается от капсида, начинается его транскрипция или трансляция. Именно эта стадия вирусной репликации сильно различается между ДНК- и РНК-вирусами и вирусами с противоположной полярностью нуклеиновой кислоты. Этот процесс завершается синтезом новых вирусных белков и генома (точных копий внедрённых).
Механизм репликации зависит от вирусного генома.
- ДНК-вирусы обычно используют белки и ферменты клетки-хозяина для получения дополнительной ДНК, она транскрибируется в РНК-мессенджер (мРНК), которая затем используется для управления синтезом белка.
- РНК-вирусы обычно используют ядро РНК в качестве матрицы для синтеза вирусной геномной РНК и мРНК. Вирусная мРНК направляет клетку-хозяина на синтез вирусных ферментов и капсидных белков и сборку новых вирионов. Конечно, есть исключения из этого шаблона. Если клетка-хозяин не обеспечивает ферменты, необходимые для репликации вируса, вирусные гены предоставляют информацию для прямого синтеза отсутствующих белков.
Чтобы преобразовать РНК в ДНК, вирусы должны содержать гены, которые кодируют вирус-специфический фермент обратной транскриптазы. Она транскрибирует матрицу РНК в ДНК. Обратная транскрипция никогда не происходит в неинфицированных клетках. Необходимый фермент, обратная транскриптаза, происходит только от экспрессии вирусных генов в инфицированных клетках.
Вироиды
Вироиды заражают только растения. Одни вызывают экономически важные заболевания сельскохозяйственных культур, в то время как другие являются доброкачественными. Двумя примерами экономически важных вироидов являются кокосный cadang-cadang (он вызывает массовую гибель кокосовых пальм) и вироид рубцовой кожицы яблок, который безнадежно портит товарный вид яблок.
30 известных вироидов были классифицированы в две семьи.
- Члены семейства Pospiviroidae, названные по имени вироида клубневого веретена картофеля, имеют палочковидную вторичную структуру с небольшими одноцепочечными областями, имеет центральную консервативную область, и реплицируются в ядре клетки.
- Avsunviroidae, названный в честь вироида авокадо, имеет как палочковидную, так и разветвленную области, но не имеет центральной консервативной области и реплицируется в хлоропластах растительной клетки.
В отличие от вирусов, которые являются паразитами механизма трансляции хозяина, вироиды являются паразитами клеточных транскрипционных белков.
Бактериофаги

Существуют тысячи разновидностей фагов, каждый из которых может заразить только один тип или несколько близких типов бактерий или архей. Фаги классифицируются по ряду семейств вирусов; например:
Как и все вирусы, фаги являются простыми организмами, которые состоят из ядра генетического материала (нуклеиновой кислоты), окруженного капсидом белка. Нуклеиновая кислота может представлять собой либо ДНК, либо РНК, и может быть двухцепочечной или одноцепочечной.
Существует три основных структурных формы фага:
- Икосаэдрическая (20-сторонняя) головка с хвостом
- Икосаэдрическая головка без хвоста
- Нитевидная форма
Во время заражения фаг прикрепляется к бактерии и вставляет в нее свой генетический материал. После этого фаг обычно следует одному из двух жизненных циклов: литическому (вирулентному) или лизогенному (умеренному).
Литические, или вирулентные, фаги захватывают механизм клетки, чтобы скопировать компоненты фага. Затем они разрушают или лизируют клетку, высвобождая новые частицы фага.
Лизогенные, или умеренные, фаги включают свою нуклеиновую кислоту в хромосому клетки-хозяина и реплицируются с ней как единое целое, не разрушая клетку. При определенных условиях лизогенные фаги могут индуцироваться в соответствии с литическим циклом.
Существуют и другие жизненные циклы, в т.ч. псевдолизогенез и хроническая инфекция. При псевдолизогении бактериофаг проникает в клетку, но не использует механизм репликации клеток и не интегрируется в геном хозяина, просто как бы прячется внутри бактерии, не нанося ей никакого вреда. Псевдолизогенез возникает, когда клетка-хозяин сталкивается с неблагоприятными условиями роста и, по-видимому, играет важную роль в выживании фага, обеспечивая сохранение генома фага до тех пор, пока условия роста хозяина снова не станут благоприятными.
При хронической инфекции новые фаговые частицы образуются непрерывно и длительно, но без явного уничтожения клеток.
Вскоре после открытия фаги начали использовать для лечения бактериальных заболеваний человека, таких как бубонная чума и холера. Но фаговая терапия тогда не была успешной, и после открытия антибиотиков в 1940-х годах она была практически заброшена. Однако с появлением устойчивых к антибиотикам бактерий терапевтическому потенциалу фагов уделяется все больше внимания.
Наше время с антибиотиками заканчивается. В 2016 году женщина в штате Невада умерла от бактериальной инфекции, вызванной Klebsiella pneumoniae, которая была устойчивой ко всем известным антибиотикам. Бактерии, устойчивые к колистину, антибиотику последней инстанции, были обнаружены на свинофермах в Китае. В настоящее время бактерии приспосабливаются к антибиотикам быстрее, чем когда-либо.
Покажите ножницы которыми вирусы разрезают молекулу РНК что бы встроиться для мутации.Может что нибудь придумаете другое.К примеру деление цепочка аминокислот получив энергию из вне как одноименные заряды распадается на две. К каждой соединятся только те какие были ранее (другие проскочат мимо),казалось бы копии,но внутренняя энергия разная(уменьшается увеличивается) поэтому распад и создание. Вся химия углерода на этом построена 1000 орган соединений создает у других хим элементов этого свойства нет. Иммунная система делает накладку(интерференция)с помощью энергии интерферонов пытаясь разрушить цепочку РНК вируса.Надо помочь организму но не вакциной(вирус быстро мутирует)
Алексей! Я полный профан в этой области! И если вы сможете, ответьте мне на вопрос: вирусы состоят из молекул?Ещё раз говорю: если с Вашей точки зрения мой вопрос дурацкий, посмейтесь и,если не трудно,ответьте доступным языком. Спасибо!

Коронавирус становится поводом пошутить над незнакомцем, ему посвящают мемы, о нем слагают песни. Вирус проникает не только в организмы живых существ, но и в поп-культуру. Однако пройдет время, и о нем все забудут, как когда-то перестали говорить о вирусе Эбола, атипичной пневмонии и оспе.
Север Туркмении, 1980-е годы. В Средней Азии возникла вспышка ранее неизвестного вируса. Обстановка сложная и напряженная. Вирус передается через зараженную воду. Из-за ее употребления количество заболевших резко растет. В большинстве случаев болезнь протекает относительно благополучно, но ужас в том, что умирают в основном женщины в третьем триместре беременности.

Михаил Фаворов,
эпидемиолог, доктор медицинских наук
Сегодня Михаил Фаворов живет в США, занимает пост президента компании DiaPrep System Inc и продолжает активно работать в области диагностики, контроля и профилактики инфекционных заболеваний.
Вирус — простейшая форма жизни. Принято считать, что если он находится внутри человека или животного, то становится живым существом — размножается и обменивается информацией. Но когда вирус находится вне организма, он считается неживым. О вирусах мы узнали сравнительно недавно, около 100 лет назад. М икробиолог Дмитрий Ивановский опубликовал исследование о существовании некой субстанции, которая проходит через фильтры, задерживающие бактерии, и назвал ее вирусом. В то время как чума человечеству известна многие тысячелетия, у нее другая природа — она вызывается бактериями, которые являются более сложным и крупным организмом. Ее распространение было связано с низким уровнем жизни и плохой гигиеной. Процент летальности достигал 25%, то есть при легочной форме погибал каждый четвертый.

Среди вирусных инфекций самой страшной была оспа, которая затронула все страны мира. Вызывалась она вирусом натуральной оспы. Вакцину удалось изобрести благодаря случайному знакомству с коровьей оспой. Вирус животных, которые выступали переносчиками, вводили в организм человека, но вакцинированные не заболевали человеческой формой болезни: организм защищали антитела введенного вируса. Уникальность натуральной оспы в том, что это антропонозный вирус — им болели только люди. Поэтому, когда произвели вакцину, оспу удалось искоренить. В 1950-х годах в Африке были вакцинированы последние контактировавшие с больными, а с 1978 года вирус был полностью ликвидирован. Оспа исчезает, когда у последнего заболевшего появляются антитела, — он выздоравливает и перестает быть переносчиком.
Рецепты с летучей мышью

Тепло наших тел
По уровню плотности населения Китай и Индия превосходят все остальные регионы планеты, а разнообразие видов животных в Африке настолько велико, что большинство из нас вряд ли догадываются о существовании некоторых из них, например окапи, виверр, руконожек. Как редкие животные, так и плотность населения становятся дополнительными стимулами высокой скорости распространения заражения. Вирусы не поражают отдельно китайцев или представителей других наций, вирусы аполитичны и не имеют вероисповедания. Они умеют приспосабливаться к любым изменениям среды не хуже человека. Все, что им нужно, — тепло наших тел и, возможно, определенные рецепторы.
Вспышка эпидемий — это не просто случайность, а стечение обстоятельств.
Все закрыто: рынки, магазины, метро. Остановки общественного транспорта абсолютно пусты. По тротуарам проплывает только мусор, гонимый ветром, исчезающий в желтоватой дымке. Странно, если учесть, что в городе проживают миллионы человек. Изредка на улице появляются люди в респираторных масках, некоторые сделаны из подручных средств. Однажды увидев такую картину, вряд ли возможно спутать с чем-то эпицентр распространения респираторного заболевания, и защищаться надо незамедлительно.
Чтобы обезопасить себя и свою семью во время респираторной эпидемии, главное — находиться на расстоянии не ближе 2 м от заболевшего, чихающего или кашляющего человека, мыть руки каждые два часа, проветривать помещения, минимально контактировать с людьми.

История человечества насчитывает десятки тысяч кровавых войн, но самые страшные по потерям, пожалуй, — войны с паразитами. По некоторым данным, от чумы умерло больше людей, чем в результате всех войн, вместе взятых, — около 186 млн человек. От одной Юстиниановой чумы, первой зарегистрированной в истории, погибли 100 млн человек. Разработка защиты от биологической угрозы требует больших затрат, поэтому вакцины создаются только для тех вирусов, которые представляют реальную опасность. Более того, к некоторым вакцинам вирусы привыкают, становятся устойчивыми и меняют свою структуру, поэтому человечеству приходится постоянно быть начеку и придумывать что-то новое.
Респираторная маска вполне может защитить, но проблема в том, что надежна она всего 20 минут.
На уроках биологии нам говорили, что жизнь — это способ существования нуклеиновых кислот. Один из вариантов существования нуклеиновых кислот — это вирусы, которые живут на других организмах. Они совершенно не заботятся о нашем благополучии, они пытаются приспособиться, как и все живые существа на планете. Единственное, за что стоит их благодарить, — эволюционное совершенство иммунной системы человека. Веками, когда появлялось какое-либо заражение, организм человека вырабатывал антитела и формировал клеточный иммунитет. Все знают, что если держать человека в стерильной среде, а потом выпустить на улицу, он вскоре умрет, потому что у него не будет механизма выработки защиты. Но это не цель существования вирусов, скорее побочный эффект.

Прогнозировать возникновение вспышек вирусов еще сложнее, чем рассуждать о высших смыслах. Это всегда уникальная ситуация, которая происходит в результате изменения состояния окружающей среды, при которой человек попадает в новые условия взаимодействия с другими видами животных. А сегодня антропогенное воздействие на окружающую среду достигло абсолютно несопоставимых масштабов по сравнению с предыдущими поколениями, к тому же человек как вид постоянно растет. У ученых есть возможность наблюдать за попытками вирусов совершить кроссвидовой переход благодаря лабораторным методам слежения. Врачи ликвидировали оспу и почти победили вирус полиомиелита — это внушает надежду, что с новым вирусом можно будет хотя бы договориться. Как бы ни сложились эти взаимоотношения, стоит помнить: пока человек будет существовать как вид, всегда найдутся те, кто захочет на нем паразитировать.
Как защититься от коронавируса? Узнайте здесь.
BJC получил финансирование исследований от MedImmune Inc. и консультирует Crucell MV. Авторы заявляют, что никаких других конкурирующих интересов не существует. Это не меняет нашу приверженность всем политикам PLoS Pathogens по обмену данными и материалами.
Задуманные и разработанные эксперименты: DKM MPF JJM. Выполнили эксперименты: DKM MPF JJM. Проанализированы данные: DKM. Написал документ: DKM MPF BJC MLG JJM. Выполненные подтверждающие эксперименты: MLG Предоставлял статистическую консультацию: BJC.
CDC рекомендует, чтобы настройки здравоохранения предоставляли пациентам с гриппом лицевые маски как средство сокращения передачи персонала и другим пациентам, а в недавнем докладе было показано, что хирургические маски могут захватывать вирус гриппа в большом аэрозоле с каплями. Тем не менее, имеются минимальные данные об утечке аэрозолей вируса гриппа, заражении выдыхаемых аэрозолей и ни о каком влиянии лицевых масок на пролиферацию вирусных аэрозолей у пациентов с сезонным гриппом.
Мелкие частицы, содержащие 8,8 (95% ДИ от 1,1 до 19), сбрасывают больше вирусных копий, чем крупные частицы. Хирургические маски уменьшали число вирусных копий в мелкой фракции в 2,8 раза (95% ДИ от 1,5 до 5,2) и в крупной фракции в 25 раз (95% ДИ от 3,5 до 180). В целом, маски продуцировали снижение вирусного аэрозоля в 3,4 раза (95% ДИ от 1,8 до 6,3). Корреляции между нозофарингеальным тампоном и номерами копий аэрозольной фракции были слабыми (r = 0,17, грубое, r = 0,29, мелкая фракция). Копия номера в выдыхаемом дыхании быстро снижалась с днем после начала болезни. Два субъекта с наивысшими номерами копий дали образцы положительной тонкой частицы культуры.
Хирургические маски, которые носят пациенты, уменьшают выброс аэрозолей. Обилие вирусных копий в аэрозолях тонкодисперсных частиц и доказательство их зараженности указывают на важную роль в передаче сезонного гриппа. Мониторинг выдыхаемых вирусных аэрозолей будет важен для проверки экспериментальных исследований передачи крови у людей.
Относительная важность прямого и косвенного контакта, большого аэрозоля с каплями и аэрозолей в качестве способов передачи гриппа неизвестна, но важна при разработке эффективных вмешательств. Хирургические лицевые маски, которые носят пациенты, рекомендуются CDC как средство снижения распространения гриппа в медицинских учреждениях. Мы стремились определить общее количество копий вирусной РНК, присутствующих в выдыхаемом воздухе и аэрозолях от кашля, независимо от того, представляют ли РНК в аэрозолях тонкодисперсных частиц инфекционный вирус, и позволяют ли хирургические лицевые маски уменьшить количество вирусов, пролитых в аэрозоли людьми, зараженными сезонными вирусами гриппа , Мы обнаружили, что общие вирусные копии, обнаруженные молекулярными методами, были в 8,8 раза более многочисленными в тонких (≤5 мкм), чем в крупных (> 5 мкм) аэрозольных частицах, и что мелкие частицы из случаев с наибольшим общим количеством вирусных копий РНК содержали инфекционные вирус. Хирургические маски уменьшили общее количество копий РНК в 3,4 раза. Эти результаты свидетельствуют о важной роли аэрозолей в передаче вируса гриппа и о том, что хирургические лицевые маски, которые носят инфицированные лица, потенциально являются эффективным средством ограничения распространения гриппа.
Передача вируса гриппа между людьми может происходить по трем направлениям: (1) прямой или косвенный контакт между инфицированным и восприимчивым человеком, обычно приводящий к загрязнению рук восприимчивого человека, за которым следует контакт с респираторной слизистой; (2) большой аэрозоль с каплями, в котором капельки дыхательной жидкости, превышающие приблизительно 100 мкм в диаметре, высвобождаются с достаточным импульсом для прямого попадания на слизистую оболочку дыхательных путей; и (3) аэрозоли, образующиеся при высвобождении меньших, содержащих вирус капель, которые могут возникать во время приливного дыхания и кашля [1], [2], которые быстро испаряются в остаточные частицы (ядра капель), которые вдыхаются и осаждаются в дыхательные пути [3] — [6]. Для каждого из этих маршрутов имеются существенные доказательства [7], [8], но их относительная значимость неизвестна [3]. В результате Институт медицины рекомендовал, чтобы медицинские работники, контактирующие с пациентами 2009-H1N1, использовали защиту от всех возможных путей заражения, включая использование подходящих респираторов N95 [3]. Через год после пандемии 2009 года не было большей ясности в отношении важности различных способов передачи [9].
Недавно Центры США по контролю и профилактике заболеваний профинансировали экспериментальное исследование передачи от человека к человеку, чтобы устранить этот важный пробел в знаниях [10]. Однако экспериментальное исследование с использованием интраназальной инокуляции для инфицирования экспериментальных доноров [11] должно будет показать, что доноры и люди с естественным заражением проливают подобные вирусные аэрозоли в отношении количества, распределения частиц по размерам и инфекционности, учитывая, что ранее эксперименты предполагали, что интраназальная инокуляция требует количественно больших доз и производит качественно более мягкое заболевание, чем инокуляция через аэрозоль [12].
В контексте гигиены труда личная защита, как правило, является последней инстанцией, после устранения источников и контроля окружающей среды [13]. Таким образом, стоит рассмотреть вопрос о том, эффективны ли хирургические лицевые маски как средство контроля источника. CDC рекомендует лицам с гриппом носить хирургические маски при контакте с чувствительными лицами [14], [15]. Тем не менее, есть только одно сообщение, в котором изучается влияние маски на сдерживание инфекционного крупнозернистого спрея во время заражения гриппом [16], а также данные о воздействии хирургической маски на выброс инфекционных вирусных аэрозолей.
В текущем исследовании пациентов, инфицированных сезонным гриппом, мы описываем количество копий вирусной РНК в двух фракциях размера аэрозоля, сообщают о культурной способности вируса в мелкодисперсной фракции и о влиянии хирургических масок.
Мы провели скрининг 89 добровольцев: 33 (37%) дали положительный результат на грипп, используя экспресс-тест (20 гриппов А и 13 гриппа В), и им было предложено предоставить образцы выдыхаемого воздуха. Также было приглашено восемь дополнительных добровольцев с отрицательными экспресс-тестами, которые сообщили о кашле и которые имели температуру ≥37,8 ° C. Всего было подтверждено, что 38 добровольцев заразились вирусом гриппа ПЦР носоглоточных образцов. Данные о выдыхаемом дыхании с хирургической маской и без нее завершены для 37 из 38 добровольцев (21 грипп A, 16 случаев гриппа B); данные для одного добровольца были исключены из-за лабораторных ошибок при обработке образцов. Один из инфицированных субъектов сообщил о получении вакцины против гриппа в текущем году. Ни один из участников не чихал во время сбора проб. В таблице 1 показаны показатели пола, симптомов и лихорадки, а также тип вируса гриппа, а в таблице 2 приведены описательные статистические данные о количестве копий возрастных и вирусных РНК в мазках и выдыхаемых аэрозольных фракциях 37 добровольцев с подтвержденной инфекцией гриппа. Номера вирусных копий в каждом из пяти экземпляров для всех 37 случаев показаны в таблице S1.
Во время измерения выдыхаемого воздуха.
Во время измерения выдыхаемого воздуха.
Мы обнаружили РНК РНК вируса гриппа в крупной фракции (частицы размером более 5 мкм), собранной у 11% (4 из 37 добровольцев) при ношении хирургических масок и от 43% (16 из 37) при отсутствии маски (относительный риск для обнаружения вируса с маской = 0,25, доверительный интервал 95% (ДИ) 0,09-0,67, тест МакНемара p = 0,003). Среднее количество вирусных копий крупной фракции (рис. 1) было ниже предела обнаружения с помощью лицевых масок и без них; 75-й процентиль снизился с 37 до уровня ниже предела с использованием хирургических масок. Используя анализ Товита, мы подсчитали, что среднее число экземпляров геометрической средней крупной фракции без маски для лица составляло 12 (95% доверительный интервал (ДИ), от 4 до 37) и что эффект лицевых масок заключался в том, чтобы получить статистически значимое сокращение в 25 раз в копии (95% ДИ от 3,5 до 180, p = 0,002) до 50 мкм), которые мы бы не обнаружили. Кроме того, ни один из наших подданных не чихал; эффективный способ получения капель из верхних дыхательных путей. Это может означать, что более мелкие капельки, которые мы обнаружили, были сгенерированы в нижних дыхательных путях и что вирусная нагрузка в этом месте не сильно коррелирует с носоглоточной нагрузкой. Альтернативно, пролитие в аэрозольные капли может приводиться в действие другими факторами хозяина (например, астмой, серьезностью симптомов и иммунным ответом), коинфекцией других агентов, вирусными факторами, влияющими на высвобождение из эпителия, или природой резидентного микробиома. Если пролитие в аэрозоль в значительной степени определяется расположением инфекции в дыхательных путях, это может иметь последствия для экспериментальных исследований передачи [11], [28]. Такие исследования должны будут отслеживать выброс аэрозолей, чтобы определить, приводит ли назальная прививка к донорам аэрозоль, который имитирует зараженную природой инфекцию, чтобы подтвердить экспериментальную конструкцию и помочь интерпретировать результаты.
Большая часть вирусной аэрозоли, которую мы наблюдали, наблюдалась в первые дни симптоматической болезни (таблица 3), что согласуется с исследованиями пролития, контролируемыми носовыми промывками [29]. Мы изучали каждого человека только один раз и по своему составу имели мало данных за день. Дальнейшие продольные исследования генерации вирусных аэрозолей необходимы для подтверждения этих результатов. Новые исследования потребуются для изучения генерации аэрозолей до и в день появления симптомов в общинной инфекции. Ограничением нашего исследования является то, что мы завербовали пациентов с определенными признаками и симптомами или которые были положительными при экспресс-тестировании или имели лихорадку, и поэтому наши данные могут быть предвзятыми к пациентам с более высокими вирусными нагрузками [21]. Тем не менее, мы по-прежнему наблюдали значительные межличностные изменения и моделирование, что случаи с более высокими вирусными нагрузками непропорционально важны в распространении гриппа [30], [31]. Дополнительные исследования также необходимы для определения того, как генерация аэрозолей коррелирует с симптомами (включая более умеренное заболевание), наличием других состояний здоровья, возрастом (мы изучали узкое распределение по возрасту) и коинфекцией других респираторных вирусов, чтобы рекомендации по инфекционному контролю могли критически оцениваться.
Мы приняли на работу добровольцев с гриппоподобной болезнью из сообщества Лоуэлл, штат Массачусетс, прежде всего среди студентов и сотрудников Массачусетского университета, начиная с 29 января и заканчивая 12 марта 2009 года. Протокол исследования был одобрен Институциональными комиссиями по обзору Университета Массачусетс Лоуэлл, больница Лоуэлла и госпиталь Мемориала святых, Лоуэлл, Массачусетс. Устное информированное согласие было получено путем предоставления каждому субъекту подробной формы информации согласия. Сбор подписанной копии формы был отменен, потому что это была бы единственная личная информация, сохраненная этим минимальным рисковым исследованием.
Волонтеры узнали об исследовании с помощью листовок и уведомлений, размещенных в кампусе, и путем направления от поставщиков медицинских услуг. Мы проводили скрининг самозванных добровольцев по телефону на гриппоподобную болезнь (ILI). Лица, которые сообщили о начале лихорадки и кашле в течение предшествующих 72 часов или были направлены поставщиком медицинских услуг, были приглашены в лабораторию для тестирования. Мы собрали носоглоточный образец с помощью флокированного тампона (501CS01, Copan Diagnostics, Murrieta, CA), и температуру брали с помощью цифрового термометра уха (модель 18-200-000, Mabis Healthcare, Waukegan, IL). Все добровольцы с температурой ≥ 37,8 ° C и кашель и добровольцы без лихорадки, которые предоставили носоглоточный образец, положительный для гриппа, методом точечной терапии (QuikVue Influenza A / B, Quidel Corp., San Diego, CA), были приглашены для выдоха образцы дыхательных путей, ответы на вопросник и предоставление второго образца носоглотки для анализа с помощью ПЦР. В анализ данных были включены только испытуемые с инфекцией гриппа, подтвержденные ПЦР.
Каждый волонтер сидел, как показано на лицевой стороне внутри входного конуса пробоотборника воздуха выдыхаемого воздуха человека в кабине, снабженной фильтром HEPA, увлажненным воздухом в течение 30 мин при ношении хирургической маски с ушной петлей. Три раза в течение 30 мин каждый испытуемый просил кашлять 10 раз. После того, как следователи сменили коллекцию, волонтер снова сел в конус, не надев хирургическую маску, еще на 30 мин с кашлем, как и раньше.
Выдыхаемые частицы собирали в течение 30 минут, в то время как испытуемый носил хирургическую маску с ушной петлей (Kimberly-Clark, Roswell, GA), а затем в течение 30 минут без маски. Субъектов просили кашлять 10 раз примерно с 10-минутными интервалами в общей сложности 30 кашля в течение каждого 30-минутного образца. Один субъект часто кашлянул, так что принудительного кашля не требовалось. Никаких субъектов не было чихать.
Сразу же после сбора поверхность имплантации тефлона удаляли и временно хранили при -20 ° C. Импакторы были очищены с помощью флокированного мазка, смоченного фосфатным буферным раствором Дульбекко с кальцием и магнием (Hyclone, Thermo Scientific, Waltham, MA) с 0,1% бычьим сывороточным альбумином (DPBS ++ BSA). Мазок был элюирован в 600 мкл DPBS ++ BSA в течение 1 минуты при встряхивании. Полученный образец хранили при -80 ° С.
Фракцию тонкодисперсных частиц, собранную в буфере DPBS ++ BSA (объем от 100 до 150 мл), поддерживали при 4 ° С и концентрировали ультрафильтрацией с использованием фильтрующих блоков Amicon Ultra 15 с молекулярной массой, отрезанной от 100 кДа (Millipore, Bedford, MA) до объема приблизительно 400 мкл. После ультрафильтрации фильтр промывали 200 мкл DPBS ++ BSA и промывочный раствор объединяли с ретентатом. Образцы хранили при -80 ° C.
Выделение РНК в Trizol-chloroform, обратной транскрипции и количественной ПЦР выполняли, как описано ранее [1], [32]. Количественную ПЦР проводили с использованием системы обнаружения Applied Biosystems Prism 7300 (Foster City, CA) для образцов грубой фракции или LightCycler 480 (Roche, Indianapolis, IN) для фракции мелких частиц. Дублированные образцы анализировали с использованием праймеров гриппа А и В, описанных van Elden et al. [33] Стандартная кривая была построена в каждом анализе с кДНК, извлеченной из запаса гриппа A (A / Пуэрто Рико / 8/1934, Advanced Biotechnologies Incorporated, Columbia, MD) с концентрацией 3,0 × 1011 частиц вируса на мл или запасы гриппа B (B / Lee / 1940, Advanced Biotechnologies Incorporated, Columbia, MD) с концентрацией 8,6 × 1010 частиц вируса на мл, как определено с помощью электронной микроскопии. Результаты выражаются как общее количество частиц вируса по стандартной кривой, округленное до ближайшего целочисленного значения. Пределы обнаружения составили 6 и 11 копий вирусной РНК на лунку qPCR для гриппа A и B соответственно. Образцы тонких частиц от всех испытуемых культивировали для инфекционного вируса на клетках MDCK. Конфлюэнтные клетки в 24-луночных планшетах (Corning, NY, USA) инокулировали 0,1 мл концентрированного образца, разбавленного 1:1 в среде OptiMEM® I (Invitrogen, Carlsbad, California). Планшеты инкубировали при 37 ° С в течение 1 ч с качанием каждые 15 мин и к каждой лунке добавляли 0,8 мл среды OptiMEM® I с 1 мкг / мл TPCK-трипсина и инкубировали в течение 72-96 часов. Клетки ежедневно проверяли на цитопатический эффект (CPE), и если ни один не был обнаружен, два слепых канала выполняли с использованием клеточного супернатанта. В каждом проходе супернатанты тестировали на вирус гриппа анализом гемагглютинации (HA) с использованием 0,5% куриных эритроцитов. Положительные образцы были подтверждены анализом полосок Flu DETECT (Synbiotics, CA, USA) и амплификацией гена гемагглютинации (HA) с помощью RT-PCR с последующим секвенированием.
Мы проанализировали влияние хирургических масок как а) логарифмический относительный риск для производства любых вирусных аэрозолей, предполагающих биномиальное распределение, с использованием обобщенных оценочных уравнений со взаимозаменяемой внутризависимой корреляцией для учета повторных мер и б) среднее геометрическое количество обнаруженных вирусных частиц в выдыхаемом дыхании qPCR и дробное сокращение числа копий с использованием регрессионного анализа Товита на номер копии журнала со случайным эффектом для учета изменчивости между индивидуумами. Анализ Товита также использовался для сравнения крупнозернистых и мелкозернистых фракций. Регрессия Тобита позволяет избежать смещения, которое может возникнуть в результате назначения образцов ниже предела обнаружения определенного значения, такого как нуль или предел, деленный на квадратный корень из 2. Использование хирургической маски было зависимой переменной. Мы также вычислили тест МакНемара для парных образцов для изучения эффекта маски и коэффициента корреляции Спирмена для изучения взаимосвязи между нагрузкой в носоглоточных мазках и аэрозольных фракциях. Статистический анализ проводился с использованием SAS (Procs GenMod, NLMixed, Lifereg, Freq, Corr и средств, версия 9.2, Cary, NC).
Количество копий и тип гриппа в пяти анализируемых образцах на одного субъекта.
Щелкните здесь для получения дополнительных данных.
Мы хотим признать обширный лабораторный вклад Приянки Чинты, без которого это не было бы завершено; Мэтью Ангел и его наставник, Дэниэл Р. Перес, доктор философии, который предоставил экспертную помощь в области вирусной культуры, средства и клетки. Мы также благодарим Ashook Chockalingam, Sara Schloth, Kesava Kalluri, Benjamin Kozak и Linda Haggerty за их время и энергию, посвященные этому проекту, и Ричарда Мартинелло за полезные комментарии к ранним черновикам рукописи.
Читайте также:


