Антинуклеарный фактор при гепатите

Иммунная система человека – уникальный слаженный механизм, способный реагировать на любые внешние внедрения патогенных факторов, тем самым защищая организм от целого ряда заболеваний. Но как известно, из каждого правила есть исключения, и в данном случае они выглядят как реагирование иммунитета на собственные клетки, что получило название аутоиммунные болезни.
При данных патологиях идет выработка антител, атакующих здоровые клетки, поражая или уничтожая их. В результате происходит нарушение функционирования отдельных тканевых структур и даже органов. Такие патологии из-за своей распространенности и вовлеченности в процесс нескольких органов или систем получили название системных заболеваний.
Основные понятия, характеризующие СЗСТ
Как уже описывалось выше, патогенез данных патологий берет свое начало со сбоев функционала иммунной системы, и выработке защитных антител к определенным компонентам собственных клеток. Такие клетки за особенность своего происхождения имеют второе название – аутоантитела. В процессе иммунного сбоя они вступают в контакт с белковыми соединениями ядра, нуклеиновыми кислотами и антигенами цитоплазмы, что приводит к появлению симптомов воспалительных заболеваний, таких как:
- структурные изменения тканей и органов;
- выраженное необоснованное утомление;
- болевые ощущения в мышцах и суставах;
- поражение кожных покровов;
- снижение веса тела и другие.
Антинуклеарные антитела (АНА) могут образовываться при довольно обширном спектре аутоиммунных патологий, но наибольшая вероятность их появления при системной красной волчанке (СКВ).
Справка! По статистике, более чем у 90% пациентов, страдающих СЗСТ, определяется патологическая выработка подобных антител. На текущий момент изучено около 200 их видов, которые получили обобщенное название – антинуклеарный фактор. В основном они представлены иммуноглобулинами класса G, но иногда встречаются М или А.
Суть анализа крови на антинуклеарный фактор
Прежде чем углубляться в особенности проведения исследования на АНФ, стоит отметить, что методика была изобретена и начала применяться довольно давно – в 60-х годах прошлого века. Но широкое распространение в диагностической практике получила лишь в начале 80-х годов XX века после усовершенствования. В качестве субстрата еще в 1961 году ученый Beck применял клетки лабораторных животных, и только в 1982 году Tan воспользовался перевиваемой клеточной линией человека HEp-2 для поиска АНФ.
Хотя основная цель использования данного теста – это установление диагноза красная волчанка, все же он считается универсальной методикой и для других коллагенозов (СЗСТ). К последним относятся:
- склеродермия;
- дерматомиозит;
- узелковый периартериит;
- хронический активный гепатит и т. д.
Одной из наиболее удобных, и поэтому чаще всего используемых методик для определения в крови пациентов антинуклеарного фактора, считается непрямая иммунофлюорестенция. Исследование проводится при нанесении сыворотки крови на клетки перевиваемой эпителиоидной линии аденокарциномы гортани человека НЕр-2 (содержащих определенный ряд ядерных антигенов) с применением меченого коньюгата (соединения) с антителами.
Этот выбор сделан неслучайно – клетки НЕр-2 – очень удобный субстрат для изучения биоматериала. Они имеют довольно крупные ядра, и при высадке на лабораторных стеклах растут однослойно. В качестве субстрата можно использовать и другие клеточные линии человека, но удачная морфология и культивирование однозначно делает именно НЕр-2 – незаменимым материалом.
В ходе диагностики при инкубации сыворотки обследуемого с клеточным субстратом, при наличии АНА происходит их соединение с соответствующими нуклеарными антигенами. Места связки АНФ с НЕр-2 определяются при использовании меченого флюоресцеином (красителем) коньюгата. Для выполнения оценки результатов произошедших реакций применяется люминесцентный микроскоп, позволяющий дифференцировать характер и степень получившихся связок.
Справка! HEp-2 человека, в отличие от тканевых криосрезов животных, имеют более высокую скорость деления клеток, что дает возможность обнаружить антитела к антигенам, которые экспрессируются лишь при делении. Также в субстрате человека отсутствует клеточный матрикс, снижающий качество визуализации изучаемого свечения.
Какие группы антигенов используются при исследовании?
При расшифровке материалов всегда необходимо брать во внимание, что в спектр АНА входит довольно большая группа аутоантител к нуклеопротеидам, рибонуклеопротеидам, гистонам, ДНК и другим структурным единицам ядра. Из этого следует, что функционал теста направлен на выявление антител к составляющим ядра и цитоплазмы, которые изначально были определены при СКВ.
Позже диагностические возможности исследования были расширены, что обусловлено определением подобных антител при других СЗСТ. В скрининговых методиках для обнаружения суммарных АНА, как правило, применяется определенный набор антигенов, принятых за основные маркеры аутоиммунных ЗСТ.
К ним относятся антитела класса IgG:
- SS-A (Ro) – ядерные рибонуклеопротеины;
- SS-B (La) – ядерные белки;
- Scl-70 – белок-фермент (топоизомераза-1);
- нативная двухцепочная ДНК;
- RNP/Sm – комплекс антигенов;
- Jo-1 – фермент РНК – синтетаза;
- CENP-B (центромера)
- Hep-2 клетки;
- митохондрии (PDC).
АНА практически безвредны для организма – они не способны проникать в живые ткани. Но в отдельных случаях могут соединяться в комплексы антиген-антитело, что в результате приводит к структурным разрушениям тканей. Одним из таких примеров является поражение паренхимы почек при СКВ. Так как при СЗСТ в процесс вовлечено несколько органов, то выявление АНА не является первостепенно важным для диагностики, а считается лишь подтверждением определенной симптоматики.
Изучение полученных результатов
После проведения всех необходимых процедур – взятия биоматериала и его лабораторной подготовке к исследованию, проводится оценка и интерпретация результатов. Сюда входит определение титра (концентрации) антител и типа свечения. Значимым параметром для диагностики является показатель концентрации свыше 1:160. К примеру, при обострении ревматизма он может превышать отметку 1:640, тогда как в ремиссионном периоде наблюдается понижение до 1:160–1:320.
Тип свечения показывает мишени АНА, что является особо важным клиническим моментом, направляющим последующие действия врача в назначении диагностических мероприятий. По характеру свечения ядер при использовании НЕр-2 определится свыше 20 вариантов ядерного окрашивания, в зависимости от видов присутствующих антител в биоматериале. К основным из них относятся следующие типы свечения.
- Периферическое. Свечение свидетельствует о наличии анти-ДНК-антител, что подтверждает СКВ. Основным видом антигенов для периферического типа являются гистоновые белки и ДНК.
- Диффузное (гомогенное). Такое свечение наблюдается при СКВ, сопровождающейся поражением структуры почек и похожих ЗСТ, нефрите, склеродермии, а также лекарственно-индуцированной СКВ. Антигены при данном типе представлены дсДНК, гистонатами и нуклеосомами.
- Ядрышковое (нуклеарное). Данный тип характерен для системной формы склеродермии, и определяется при присутствии у пациентов антител – PHК полимераза 1, PM/Scl, NOR, U3RNP.
- Цитоплазматическое. Подобный тип подсвечивания указывает на наличие АНА к тРНК–синтетазам, а именно Jo-1, и наблюдается при полимиозите.
- Гранулярное. Определяется при синдроме Шегрена, инфекционном мононуклеозе, смешанном ЗСТ (Sharp-синдром, MCTD) и лекарственном волчаночном синдроме. Преимущественно присутствующие антигены для этого типа – SS-A, SS-B, Sm, U1-RNP, и PCNA.
- Крупногранулярное. Характерно для смешанных ЗСТ и, по мнению многих ученых, связано с наличием антигена RNP.
- Мелкогранулярное. Определяется присутствие антител, образующихся против рибонуклеиновых белков – АSSP (АЦЦП), SS-A, SS-B и других. Такие антитела характерны для СКВ, также ее специфических кожных формах, ревматоидном артрите, склеродермии, полимиозите, синдроме Шегрена.
- Центромерное. Данный тип в основном отмечается при склеродермии. Хотя в одном образце крови, особенно у обследуемых с диффузными ЗСТ, в отделенной плазме могут определяться антитела к различным ядерным компонентам.
- Точечные вкрапления в ядре. Этот тип преимущественно выявляется при болезнях печени аутоиммунного характера. При нем могут сочетаться несколько флюоресцентных типов, к примеру, ядрышковый и мелкогранулярный, что обусловлено антителами к Scl-70.

Факторы, способные исказить результаты
На достоверность полученных в ходе исследования данных могут повлиять всего несколько факторов, способных показать и ложноположительный и ложноотрицательный результат. Так, неправдоподобные ответы со сдвигом вверх наблюдаются у пожилых пациентов в возрасте от 60 лет (по статистике в 10–37% случаях) и при приеме медпрепаратов, вызывающих лекарственную волчанку (некоторые антибиотики, контрацептивы, сульфаниламиды, тиазидные диуретики).
Отмечено, что у 5–55% особ женского пола, имеющих грудные имплантаты, повышается уровень концентрации АНА. К ошибочной диагностике со сдвигом вниз может привести употребление глюкокортикоидных препаратов – Преднизолона, Метипреда или Дексаметазона.
В медицине различают специфические состояния, при которых защитные клетки начинают атаковать собственный организм, — аутоиммунные заболевания. Большинство таких болезней протекают в хронической форме и являются потенциально опасными, так как способны вызвать серьезные проблемы работы определенных органов и систем. Это нередко приводит к инвалидности и тяжелым последствиям.
Возможности современной медицины велики, и выявить все эти изменения удается на ранней стадии и своевременно начать лечение. Одним из самых частых исследований, которые применяются для диагностирования этих состояний, служит анализ на антинуклеарные антитела, сокращенно АНА.
Описание
Анализ АНА — это самый информативный метод постановки диагноза при подозрении на любые аутоиммунные расстройства, в основном, это заболевания соединительной ткани. Но встречаются также наличие антител при злокачественных процессах, инфекционных и т.д.

Самая большая чувствительность антител к таким недугам:
- Системной красной волчанки.
- Ревматоидному артриту.
- Болезни Шегрена.
Эти клетки могут быть обнаружены также примерно у трети пациентов, страдающих хронической формой гепатита.
На увеличение показателей влияют разные факторы. В частности, малярия, лейкоз, инфекционный мононуклеоз и многое другое.
Читайте также: Секреты лечения суставов лазером
Вместе с выявлением АНА при выполнении исследования важно оценить уровень содержания таких иммуноглобулинов, как IgA, IgM, IgG. Выявление данных составляющих в крови у пациентов может указывать на большие шансы появления ревматических патологий и коллагенозов.
Если же взаимосвязь между содержанием антител и симптомами не была выявлена, само наличие АНА в крови указывает на выбор правильной тактики лечения. Длительное сохранение высоких титров говорит о неутешительном положении дел. Понижение этих титров говорит о ремиссии патологии, гораздо реже о скорой смерти.
Вместе с тем данные антитела могут быть выявлены у определенного процента здоровых лиц и титры АНФ могут выходить за пределы нормы.
Показания к проведению исследования
Трактовать результаты вправе врач иммунолог и любой дипломированный специалист, в зависимости от области поражения.
Показаниями для проведения данного исследования служат:
- Выявление системных заболеваний, а также аутоиммунных нарушений без явных симптомов.
- Обнаружение системной красной волчанки и ее комплексное исследование, подбор стратегии лечения.
- Выявление лекарственной волчанки.
- Наличие определенных клинических проявлений, таких как, длительная лихорадка без явной на то причины, ломкость суставов и их болезненность, кожная сыпь, ломота мышц, высокая степень утомляемости.
- Признаки симптоматических проявлений смешанных заболеваний: болезни кожи и внутренних органов, судорожные состояния, увеличение температурных показателей.
- Назначение медикаментов дизопирамид, гидралазином и прочее.
Виды обследования
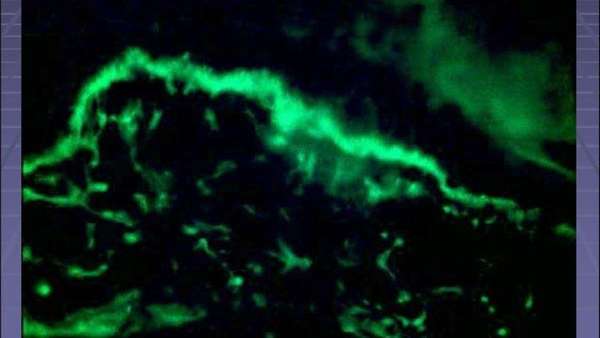
Обнаружить антитела в крови удается двумя способами. Первая методика называется непрямая иммунофлуоресцентная микроскопия. При наличии антител они будут связываться со специфическими ядерными антигенами. Используются элементы, которые светятся в отдельном световом спектре. Под микроскопом появляется возможность выявления типа свечения.
Подробнее про то, что такое миофасциальный синдром и как его лечат читайте тут.
Этот способ признан самым лучшим для определения значения антинуклеарных антител. Также методика получила второе название — волчаночные тест-полосы. Вторым методом диагностирования выступает ферментный иммунный анализ. Его смысл заключается в том, что антитела, находящиеся в крови, попадают во взаимосвязь с антигеном и в итоге раствор меняет свой оттенок.
Важно подчеркнуть, что положительный скрининг не может быть единственным поводом для постановки диагноза.
Обязательно назначается дополнительное исследование, с помощью которого удается определить недуг на ранней стадии. В случае отрицательного скрининга можно предполагать полное отсутствие нарушений. Однако и это вовсе не исключает наличия у пациента аутоиммунного заболевания.
Сдается кровь на антинуклеарный фактор совместно с другими анализами. Но на конечный результат оказывает влияние прием некоторых медикаментов и наличие у пациента патологий хронического и острого течения. Разобрать все эти моменты поможет специалист, затем установит верный диагноз и посоветует, как поступить дальше.
Материалом для анализа выступает венозная кровь.
Особенности подготовки:
- Материал берут на голодный желудок. После последней трапезы должно пройти, как минимум, 8 часов. Допустимо пить качественную фильтрованную воду без газа.
- Предварительно за два часа перед забором крови исключается курение и использование никотиновых продуктов.
- За несколько дней до совершения манипуляции исключается потребление спиртных напитков и энергетиков, запрещено заниматься тяжелым физическим трудом.
- За две недели должен полностью исключаться прием фармацевтических средств, в частности, гормонов, антибиотиков и прочих медикаментов.
- В целях подтверждения исследования важно повторить скрининг через две недели.
Ожидайте результатов в течение 48 часов после процедуры. Возможно получение данных в экстренном порядке в течение 3 часов.
Трактовка результатов
При качественном исследовании могут быть получены такие результаты:
- ниже 0,9 —отрицательный, норма,
- значения от 0,9 до 1,1 — сомнительный,
- свыше 1,1 — позитивный.
Пациенты часто задают вопрос: антинуклеарный фактор 1:160 норма или нет? Все, что выше этого показателя, выходит за пределы нормы.
Читайте также: Как лечить эпидурит позвоночника
Стоит также учитывать, что неправильная подготовка и некоторые нюансы могут повлиять на результаты:
- Нарушение принципов подготовки.
- Несоблюдение правил алгоритма инъекции медицинским специалистом.
- Прием определенных фармацевтических средств.
- Диагноз уремия может также исказить результаты.
Положительный скрининг на антиядерные антитела может говорить о наличии таких недугов, как красная волчанка, патология поджелудочной железы, наличие нарушений функциональности щитовидной железы, патологии печени, синдром Шегрена, поражение тканей легких, суставов и многое другое. Только доктор может интерпретировать результаты и назначать дальнейшее лечение.
В ходе расшифровки данного исследования стоит учитывать, что в случае отрицательных значений вероятность наличия недуга не исключается.
Как применять крем Алезан для суставов подробно описано тут
Если скрининг на данные антитела положительный без сопровождающейся симптоматики, необходимо пройти более тщательное обследование.
Заключение
Из этой статьи вам стало известно, для чего берется кровь на анализ АНФ и что это такое. Не все антитела могут быть обнаружены при проведении данного исследования в силу их изобилия. Чтобы свести к минимуму возможность появления недостоверных результатов необходимо провести комплексное исследование совместно с другими методами.
Отсутствие высоких титров АНФ вовсе не говорит об отсутствии у пациента системных заболеваний, точно так же, как и положительный результат не может быть однозначным аргументом для постановки диагноза.
Метод исследования с использованием человеческих эпителиальных клеток HEp-2, который позволяет обнаружить антинуклеарные антитела – один из маркеров системных заболеваний соединительной ткани.
АНФ, антиядерные антитела, антинуклеарные антитела (АНА).
Antinuclear Antibodies (ANA), Hep-2 Substrate, ANA-Hep2, Fluorescent AntiNuclear Antibody detection (FANA).
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Определение антинуклеарного фактора (АНФ) является "золотым стандартом" выявления антинуклеарных антител (АНА) и диагностики аутоиммунных заболеваний.
Патогенез системных заболеваний соединительной ткани (СЗСТ) тесно связан с нарушениями в иммунной системе и повышенной выработкой антител к структурам собственных клеток. Аутоантитела к компонентам ядра клеток – антинуклеарные антитела – взаимодействуют с нуклеиновыми кислотами и белками ядра, антигенами цитоплазмы, что проявляется воспалительными изменениями в тканях и органах, болями в суставах и мышцах, выраженным утомлением, потерей веса, кожными изменениями. АНА обнаруживаются при многих аутоиммунных заболеваниях, но наиболее характерны для системной красной волчанки (СКВ). АНА встречаются более чем у 90 % больных системными заболеваниями соединительной ткани, в настоящее время описано около 200 разновидностей, которые объединены единым названием – антинуклеарный фактор.
При определении АНФ методом непрямой флюоресценции чаще используется перевиваемая линия эпителиальных клеток аденокарциномы гортани человека НЕр-2. Клетки НЕр-2 являются очень удобным субстратом для лабораторного исследования, так как обладают крупными ядрами и на стеклах растут в один слой. АНА выявляются при связывании с внутриклеточными антигенами клеток НЕр-2.
При исследовании эпителиальные клетки НЕр-2 выращивают на стеклах, фиксируют и инкубируют с разведенной сывороткой крови пациента. После удаления избытка сыворотки клетки инкубируют с меченными флюоресцеином антителами, затем снова промывают и исследуют с помощью флюоресцентного микроскопа. При этом определяется титр антител и тип свечения. Диагностически значимым считается титр более 1:160. При обострении ревматических заболеваний он превышает 1:640, а в период ремиссии снижается до 1:160-1:320. Чем больше антител, тем выше титр. По типу свечения можно установить мишени антинуклеарных антител, что имеет важное клиническое значение и определяет тактику дальнейшего обследования пациента. Основными являются периферический, гранулярный (мелко-/крупно-), ядрышковый, центромерный и цитоплазматический типы окрашивания ядра. Каждому типу свечения присущи очень характерные признаки, которые позволяют отличить один вариант от другого.
Гомогенное (диффузное) окрашивание связано с наличием антител к двуспиральной ДНК, гистонам и характерно для СКВ и лекарственной волчанки.
Периферическое свечение обусловлено периферическим распределением хроматина в ядре, связано с антителами к ДНК и специфично для СКВ. Данный тип свечения важно дифференцировать от окрашивания ядерной мембраны, которое происходит при аутоиммунных заболеваниях печени.
Гранулярное (крапчатое, сетчатое) окрашивание встречается наиболее часто и является наименее специфичным, выявляется при многих аутоиммунных заболеваниях. Аутоантигенами в данном случае выступают нуклеопротеиновые комплексы в ядре (Sm, U1-RNP, SS-A, SS-B антигены и PCNA).
Очень высокие титры АНФ с крупногранулярным типом свечения часто указывают на смешанное заболевание соединительной ткани.
Нуклеарное (ядрышковое) окрашивание обусловлено антителообразованием к компонентам ядрышка (PHК-полимераза-1, NOR, U3RNP, PM/Scl), выявляется при склеродермии, болезни Шегрена. АНА иногда повышаются при эндокринных заболеваниях (сахарном диабете 1-го типа, тиреоидите, тиреотоксикозе, полиэндокринном синдроме), кожных заболеваниях (псориазе, пузырчатке), при беременности, после трансплантации органов и тканей, у больных на гемодиализе.
Центромерное свечение появляется при наличии антител к центромерам хромосом и характерно для формы склеродермии – CREST-синдрома.
Цитоплазматический тип свечения связан с антителами к тРНК-синтетазе, в частности к Jo-1, что характерно для дерматомиозита и полимиозита. Данный тип окрашивания также определяется при наличии антител к другим компонентам цитоплазмы при аутоиммунном гепатите, первичном билиарном циррозе.
Одновременное выявление различных типов свечения указывает на присутствие разных видов антител.
У здоровых людей может быть обнаружено мелкогранулярное свечение при низких, умеренных или высоких титрах АНА, но в норме крупнозернистые или гомогенные типы свечения не должны определяться.
В зависимости от результатов оценки типа свечения разрабатывается дальнейшая тактика лечения пациента и назначаются дополнительные исследования, уточняющие спектр АНА.
Для чего используется исследование?
- Для диагностики системных заболеваний соединительной ткани.
- Для дифференциальной диагностики ревматических болезней.
- Чтобы оценить эффективность терапии аутоиммунных заболеваний.
- Для наблюдения за течением системных заболеваний соединительной ткани.
Когда назначается исследование?
- При симптомах аутоиммунного заболевания (длительное повышение температуры, боли в суставах, усталость, потеря массы тела, изменение кожных покровов).
- При выявлении изменений, характерных для системных заболеваний соединительной ткани (повышение СОЭ, уровня С-реактивного белка, циркулирующих иммунных комплексов).
Что означают результаты?
Титр: Причины повышения титра АНФ на HEp-2 клетках:
- cистемная красная волчанка (в 95 % случаев),
- дерматомиозит/полимиозит,
- системная склеродермия (в 60-90 % случаев),
- синдром Шегрена (в 40-70 % случаев)
- смешанное заболевание соединительной ткани (синдром Шарпа),
- синдром Рейно,
- дискоидная волчанка,
- лекарственная волчанка,
- ревматоидный артрит,
- некротизирующий васкулит,
- инфекционный мононуклеоз,
- лейкемия,
- злокачественные новообразования (преимущественно лимфома),
- тяжелая миастения,
- инфекционный эндокардит,
- хронический аутоиммунный гепатит,
- первичный билиарный цирроз печени,
- туберкулез,
- пневмокониоз,
- интерстициальный фиброз легких.
Тип свечения
Для чего он характерен
Для СКВ, лекарственной волчанки, системной склеродермии, хронического активного гепатита
Для СКВ, синдрома Шегрена, смешанной болезни соединительной ткани, ревматоидного артрита
Для полимиозита/дерматомиозита, склеродермии, синдрома Шегрена, СКВ
Для CREST-синдрома (кальциноза кожи, синдрома Рейно, эзофагеальной дисфункции, склеродактилии, телеангиоэктазии)
Для дерматомиозита/полимиозита, аутоиммунного заболевания печени, первичного билиарного цирроза
Что может влиять на результат?
- Ложноположительному результату способствует:
- возраст старше 60-65 лет (в 10-37 % случаев);
- применение лекарственных препаратов, которые могут привести к лекарственной волчанке (ацетазоламид, карбидопа, хлоротиазид, хлорпромазин, клофибрат, этосуксимид, соли золота, гризеофульвин, гидралазин, изониазид, соли лития, метилдопа, пероральные контрацептивы, пенициллин, фенилбутазон, фенитоин, примидон, прокаинамид, пропилурацил, хинидин, резерпин, стрептомицин, сульфаниламид, тетрациклин, тиазидные диуретики).
- Прием глюкокортикостероидов (преднизолон, дексаметазон, метипред) иногда приводит к ложноотрицательному результату.
- В 5 % случаев СКВ возможен отрицательный результат данного анализа (АНФ-отрицательная СКВ). В таких ситуациях для уточнения диагноза необходимо определить антитела к SS-антигенам (Ro).
- Положительный результат теста не является абсолютным доказательством наличия аутоиммунного заболевания. У здоровых людей в 3-13 % случаев титр АНФ повышен и достигает 1:320.
- Результаты теста необходимо оценивать в комплексе с клиническими данными и другими лабораторными показателями.
- При положительном результате исследования рекомендовано определить специфичность АНА иммуноблотом.
- Антитела к двухцепочечной ДНК (анти-dsDNA), скрининг
- Антитела к ядерным антигенам (ANA), скрининг
- Антитела к экстрагируемому ядерному антигену (ENA-скрин)
- Антитела к кардиолипину, IgG и IgM
- Антинуклеарные антитела, IgG (анти-Sm, RNP/Sm, SS-A, SS-B, Scl-70, PM-Scl, PCNA, dsDNA, CENT-B, Jo-1, к гистонам, к нуклеосомам, Ribo P, AMA-M2), иммуноблот
- Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- Скорость оседания эритроцитов (СОЭ)
- Антистрептолизин О
- С-реактивный белок, количественно
- Ревматоидный фактор
- Циркулирующие иммунные комплексы (ЦИК)
- С3 компонент комплемента
- С4 компонент комплемента
Кто назначает исследование?
Литература
- Wilson D. McGraw-Hill Manual of Laboratory and Diagnostic Tests 1st Ed Normal, Illinois, 2007: 55-57 pp.
- Mariz HA, Sato EI, Barbosa SH, Rodrigues SH, Dellavance A, Andrade LE. Pattern on the antinuclear antibody-HEp-2 test is a critical parameter for discriminating antinuclear antibody-positive healthy individuals and patients with autoimmune rheumatic diseases. Arthritis Rheum. 2011 Jan;63(1):191-200.
- Kumar Y, Bhatia A, Minz RW. Antinuclear antibodies and their detection methods in diagnosis of connective tissue diseases: a journey revisited. Diagn Pathol. 2009 Jan 2;4:1. PMID: 19121207 [PubMed].
Версия: Справочник заболеваний MedElement
Общая информация
В настоящее время аутоимунный гепатит (АИГ) определяется как "персистирующее (неразрешившееся) воспаление печени неизвестной этиологии, характеризующееся преимущественно перипортальным гепатитом или более обширным воспалительным процессом, сопровождающееся гипергаммаглобулинемией, присутствием тканевых аутоантител в сыворотке и в большинстве случаев отвечающее на иммуносупрессивную терапию".
АИГ является частью так называемого "синдрома хронического гепатита", который характеризуется устойчивым гепатоцеллюлярным воспалением в течение последних 6 месяцев и подъемом трансаминаз более чем в 1,5 раза выше верхнего предела нормы (см. рубрику "Хронический гепатит, не классифицированный в других рубриках" - K73.-). В редакциях МКБ-10 до сентября 2013 г. АИГ кодировался как "Хронический активный гепатит, не классифицированный в других рубриках" - K73.2.
Примечание 1
Первое описание хронического гепатита с "сосудистыми звездочками", высокими показателями СОЭ, гипергаммаглобулинемией, аменореей и хорошим эффектом от лечения кортикотропином у 6 молодых женщин относится к 1950 году (Waldenstrom). В последующем была отмечена ассоциация данного варианта хронического гепатита с различными аутоиммунными синдромами и наличием антинуклеарных антител в сыворотке, в связи с чем появился термин "люпоидный гепатит" (Mackay, 1956). В 1965 году был предложен термин "аутоиммунный гепатит".
Систематизированные исследования клеточной и молекулярной иммунопатологии, клинических симптомов и лабораторных показателей впоследствии привели к выделению АИГ как отдельной нозологической единицы, являющейся серологически гетерогенным заболеванием, которое требует определенной терапевтической стратегии (Strassburg, 2000). Исследования последних лет показали, что АИГ представляет гетерогенную группу заболеваний, отличающихся по антигенам и соответствующим циркулирующим в сыворотке антителам (см. раздел "Классификация").


Классификация
Вопросы классификации аутоиммунного гепатита (АИГ) остаются спорными в связи с разнородностью выявляемых иммунологических изменений.
I. Традиционно выделялось два типа АИГ (тип I и тип II). В настоящее время дополнительно выделяется тип III, что признается не всеми авторами.
В основу общепринятой классификации АИГ положен спектр выявляемых аутоантител:
АИГ-1 может развиваться в любом возрасте, но более типичен в 10-20 лет и в период постменопаузы. Формирование цирроза отмечают у 43% нелеченых больных в течение первых 3 лет. У большинства пациентов наблюдают хороший ответ на терапию ГКС , при этом у 20% сохраняется стойкая ремиссия после отмены иммуносупрессоров.
АИГ типа II (АИГ-2) характеризуется циркуляцией антител к микросомам печени и почек 1-го типа (анти-LKM-l), определяемых у 100% больных, иногда в сочетании с анти-LКМ-3 и антителами к печеночному цитозольному протеину (анти-LC-1).
АИГ-2 встречают существенно реже (10-15% больных АИГ) и преимущественно у детей от 2 до 14 лет. Взрослые составляют 20% от общего числа пациенток в Европе и лишь 4% в США.
Течение заболевания характеризуется более высокий биохимической и гистологической активностью. Цирроз за 3-летний период формируется в 2 раза чаще (у 82%), чем при АИГ-1 , что определяет худший прогноз. При АИГ-2 наблюдают более выраженную резистентность к медикаментозной иммуносупрессии; отмена препаратов обычно ведет к рецидиву.
АИГ типа III (АИГ-3) характеризуется наличием в крови антител к растворимому печеночному антигену (анти-SLA) и печеночно-панкреатическому антигену (анти-LP). Этот тип выделяют не все авторы; многие рассматривают его как подтип АИГ-1, учитывая одинаковое клиническое течение и частое (74%) выявление соответствующих серологических маркёров (ANA и SMA).
1. Синдром перекрытия АИГ и первичного билиарного цирроза (см. "Первичный билиарный цирроз" - K74.3):
1.1. Гистологические признаки АИГ положительны и одновременно серологический диагноз первичного билиарного цирроза (антимитохондриальные антитела (АМА)) также положительный.
1.2. Присутствуют гистологические признаки первичного билиарного цирроза и серологические результаты АИГ (ANA или SMA-положительные, AMA-отрицательные). Данная форма иногда считается аутоиммунным холангитом или АМА-негативным первичным билиарным циррозом.
2. Синдром перекрытия АИГ и первичного склерозирующего холангита (см. "Холангит" - K83.0): имеются серологические признаки АИГ, но гистологические результаты и нарушения, выявленные при холангиографии, характерны для первичного склерозирующего холангита.
Этиология и патогенез
Этиология аутоиммунного гепатита (АИГ) неясна.
Существует множество гипотез, пытающихся объяснить возникновение АИГ. Однако разнообразная иммунологическая картина и вариабельность ассоциированной патологии затрудняют задачу.
Вероятно, АИГ возникает вследствие сложного взаимодействия следующих факторов:
1. Генетическая предрасположенность. Гены HLA главного комплекса гистосовместимости (MHC), расположенные на коротком плече хромосомы 6, по-видимому, играют основную роль в предрасположенности к болезни. Существует также доказательство роли других, не HLA локусов, которые кодируют факторы комплемента, иммуноглобулинов и Т-клеточных рецепторов.
2. Триггеры.
В качестве возможных запускающих факторов АИГ, помимо HAV, HBV, HCV, EBV, рассматриваются также вирус простого герпеса (HSV1), цитомегаловирус (CMV) и вирус кори. При этом обращается внимание на то, что некоторые из них (в частности HAV, HCV, EBV и вирус кори) могут в течение ряда лет персистировать "незамеченными" в лимфоцитах периферической крови.
Немаловажная роль отводится лекарствам (например, оксифенизатин, миноциклин, тикринафен, дигидралазин, метилдопа, нитрофурантоин, диклофенак, атровастатин, интерферон, пемолин, инфликсимаб, эзетимиб) и некоторым травам, применяемым в народной медицине.
3. Аутоантигены. Наиболее часто рассматриваемые:
- асиалогликопротеиновый рецептор (ASGP-R) для антител против ASGP-R;
- цитохром P450 2D6 (CYP2D6) для anti-LKM-1 аутоантител.
4. Дисфункция иммунорегуляторных механизмов. АИГ может развиться как компонент синдрома аутоиммунной полиэндокринопатической эктодермальной дистрофии (APECED) у 10-20% пациентов. При этом достаточно часто в процесс вовлекается не только печень, но и крупные железы внешней и внутренней секреции, в том числе поджелудочная железа, щитовидная железа, слюнные железы.
Патогенез
Главный патогенетический механизм развития повреждения печени - потеря иммунной толерантности к собственным тканям, что обусловливает прогрессирование некро-воспаления и фиброза в печени и отражает сложное взаимоотношение между запускающими аутоиммунный процесс факторами, аутоантигенами, генетической предрасположенностью и иммунорегуляторными процессами.
Гистологические изменения, отмечающиеся при АИГ, не являются патогномоничными, однако достаточно типичны.
Наблюдается круглоклеточная инфильтрация портальных полей различной плотности (преимущественно Т-лимфоцитами). Воспалительные инфильтраты не захватывают желчные протоки или сосудистую систему, но могут проникать через основную пластинку к печеночной дольке, вызывая отшнуровку и разрушение отдельных гепатоцитов или их небольших групп (ступенчатые некрозы, часто обозначаемые как пограничный гепатит (interface hepatitis)).
В случае когда дорожки некроза соединяются с подобными участками соседних перипортальных полей, говорят о мостовидных некрозах. Они могут распространяться вплоть до центральных участков печеночной дольки.
Таким образом, АИГ характеризуется соседством перипортального и лобулярного гепатита.
В далеко зашедших стадиях очаги некроза замещаются соединительной тканью и развивается цирроз с островками паренхимы и узлами-регенератами различных размеров. Изменения желчных протоков, гранулёмы, скопления железа и меди при этом отсутствуют.
Поражение желчных протоков ранее считалось возможным признаком гистологической картины АИГ-1. В настоящее время оно исключает данный диагноз и указывает на билиарный цирроз печени. Все вышесказанное относится и к отложению меди, наблюдающемуся при всех формах холестаза и свидетельствующему о холестатическом заболевании (билиарный цирроз печени, первичный склерозирующий холангит) или перекрестном синдроме, но не об АИГ (определение Международной группы по изучению аутоиммунного гепатита, IAIHG).
Эпидемиология
Возраст: кроме младенцев
Признак распространенности: Редко
Соотношение полов(м/ж): 0.27
Частота. 1-1,9 случаев на 100 000 населения европеоидной расы в США и Европе.
Есть мнение, что заболеваемость существенно ниже в странах Азии и Африки, в связи с превалированием там вирусных гепатитов и генетических особенностей, присущих европеоидной расе.
Пол. Женщины страдают чаще, чем мужчины.
АИГ-1 является наиболее распространенной формой АИГ, и 78% больных составляют женщины (соотношение женщин и мужчин составляет - 3,6:1).
Около 95% больных АИГ-2 составляют женщины.
В среднем соотношение полов женщины/мужчины оценивается как 4:1.
Возраст. Заболеваемость АИГ характеризуется возрастной бимодальностью, то есть двумя пиками.
АИГ может развиться в любой возрастной группе, но АИГ-1 чаще всего затрагивает людей в возрасте от 10 до 30 лет и от 40 до 60 лет.
АИГ-2 поражает главным образом детей в возрасте от 2 до 15 лет.
Таким образом, наибольшая заболеваемость встречается в группе молодых девушек и женщин европеоидной расы. Тем не менее, АИГ может возникнуть у людей любого возраста, включая младенцев и пожилых людей. Не следует упускать из виду у лиц старше 70 лет, причем мужчины в этом возрасте могут быть затронуты чаще, чем женщины.
Соотношение заболеваемости АИГ-1 к АИГ-2 оценивается как 1.5-2:1 в Европе и Канаде и 6-7:1 в Северной Америке, Южной Америке и Японии.
Читайте также:


