Антитела способные поражать бактерии вирусы вырабатываются

Вирусы очень интересные существа. Они не имеют клеток, с точки зрения науки не считаются живыми… да и наука до сих пор точно не может сказать что это такое.
Всё что касается вирусов — очень сложно! Поэтому мы и наблюдаем такой ажиотаж!
Чтобы по минимуму в этом разбираться, нужно хотя бы знать следующие термины:
1) Дезоксирибонуклеиновая кислота;
2) Рибонуклеи́новая кислота;
3) капсид;
4) рецепторы и корецепторы;
5) мембрана;
6) связь ключ-замок;
7) интеграза;
8) протеаза;
9) обратная транскриптаза;
10) домен;
11) транскрипция;
12) мессенджер;
13) цитоплазма;
14) репликация;
Вирусы размножаются в клетке. Но каждый вирус специализируется на определенных клетках!
Так ВИЧ заражает Т-лимфоциты, Грипп поражает эпителий гортани и легких, коронавирус поражает эпителий верхних дыхательных путей, легких и желудочно-кишечного тракта, Герпесы поражают нервы и вызывают нейроинфекции, гепатиты поражают клетки печени и т.д.
Как вирус проникает в клетку:
Т.е. 1 вирус попав в клетку организма, превращает её в фабрику по производству новых вирусов.
Как реагирует иммунитет? Обычно если вирусов немного, то зараженные клетки успевают уничтожить лимфоциты и натуральные киллеры.
Но если доза вирусов досталась большая или иммунитет ослаблен стрессом от слива депозита во время кризиса на рынках, то фабрика эта вирусная успешно запускается!
Но не всё так плохо! В организме есть сигнализация! Если вирус попадает в клетку, то клетка начинает индуцировать и выбрасывать вокруг себя особые белки интерфероны. Эти белки дают сигнал соседний клеткам и клетки блокируют свои мембраны, не давая вирусам попасть внутрь себя. Также подается сигнал иммунным клеткам, что тут что-то не так и надо начинать работу.
Что касается интерферонов, то тут вообще всё очень сложно:
Кроме того, особыми клетками иммунитета В-лимфоцитами начинают продуцироваться особые белки иммуноглобулины (в народе — антитела), которые блокируют белки вируса, превращая их в беспомощные цели для макрофагов.
Иммуноглобулины классов A, M, G (IgA, IgM, IgG) или антитела — белки, которые вырабатываются иммунной системой организма в ответ на внедрение бактерий, вирусов, грибов и других чужеродных агентов (антигенов).
Антитела специфичны и вырабатываются к каждому конкретному антигену. Выработкой иммуноглобулинов сопровождается и аллергическая реакция. При аутоиммунных заболеваниях антитела продуцируются к собственным тканям.
Существуют пять классов антител, среди которых наибольшее диагностическое значение имеют IgA, IgG и IgM.
IgA-антитела синтезируются в дыхательных путях, желудочно-кишечном тракте, влагалище и других органах. Эти антитела защищают организм от вторжения чужеродных агентов извне. На долю иммуноглобулинов класса А приходится 10-15% всех антител. У небольшого числа людей IgA-антитела не вырабатываются — селективный дефецит иммуноглобулина A.
IgM-антитела находятся в крови и лимфатической жидкости. При попадании антигена именно иммуноглобулины М вырабатываются в первую очередь. Уровень IgM антител составляет 5-10%.
IgG-антитела обнаруживаются во всех жидкостях организма. Они являются самыми маленькими, но наиболее распространенными антителами (около 75-80% от всех иммуноглобулинов в организме). Только IgG-антитела могут проникать через плаценту беременной женщины, а, значит, и защищать плод — приблизительно до 6-месячного возраста.
Низкий уровень иммуноглобулинов может свидетельствовать о недостаточности иммунной системы. Повышенное количество иммуноглобулинов может вырабатываться при множественной миеломе (IgG, IgA), макроглобулинемии (IgM), первичном системном амилоидозе и других состояниях.
Как работают антитела:
Обычно это всё выглядит вот так: 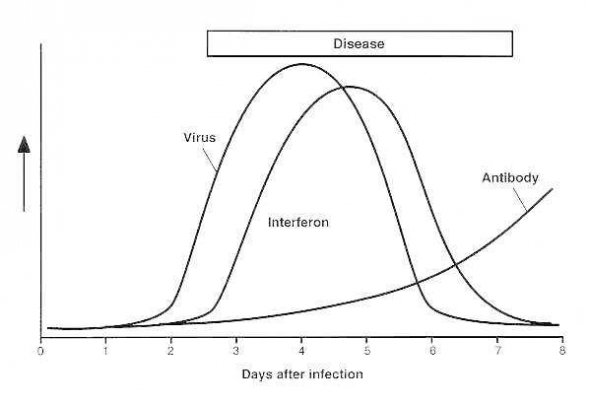
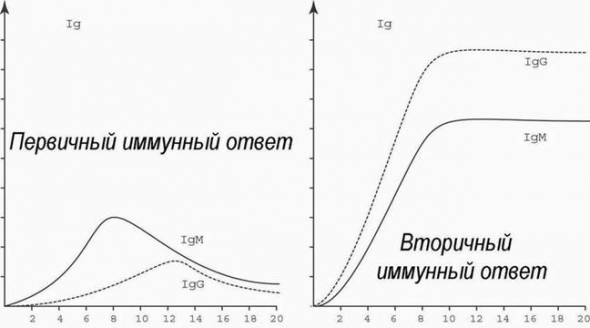
После выработки достаточно антител класса IgG — у вас теперь есть долгосрочный иммунитет от вируса!
Обычно на это у организма уходит 10-14 дней! Если вы не умерли в первые 5-8 дней, значит у вас хорошие шансы на выздоровление!
(исключение — люди болеющие СПИДом, наркоманы, алкоголики, голодающие, а также лица проживающие в неблагоприятных экологических условиях)
Теперь я надеюсь всем понятно, почему у нас столько много людей выздоровевших после коронавируса и почему всех сажают на карантин именно на 2 недели?
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
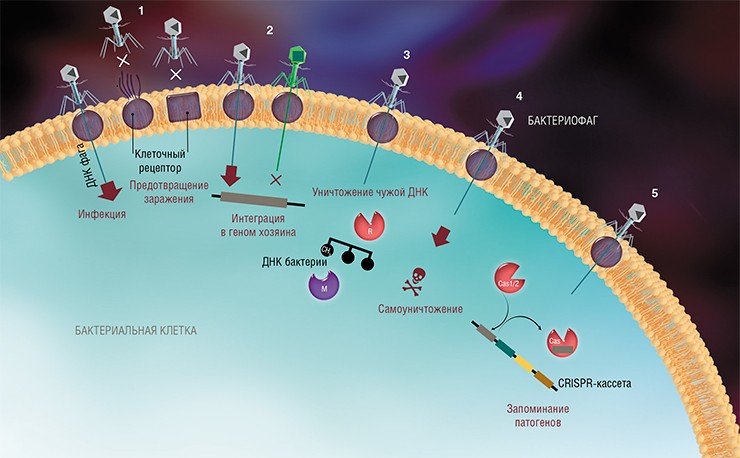
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
" title="Рисунки Владимира Орехова"/>
Все сейчас говорят о вирусах: коронавирус, грипп, ВИЧ, гепатит, ВПЧ, оспа и т.д. В мире существует более тысячи видов вирусов, способных поражать различные живые клетки, да практически все виды клеток. А что же такое вирусы и с чем их едят (в прямом и переносном смысле)? Где они живут, как попадают к нам в организм, что там делают и есть ли лекарства против них? Статей и постов в интернете много, в том числе, антинаучных и дилетантских. Поэтому ТИА обратилось за информацией в Тверской медуниверситет, к профессору кафедры микробиологии и вирусологии, доктору медицинских наук, декану фармацевтического факультета Юлии Червинец.
Что такое вирус и в чём отличие от бактерий?

Название "вирус" произошло от латинского слово virus и переводится как "яд". По сути, это мельчайшие внутриклеточные микробы-паразиты, потому что живут и размножаются они только внутри хозяина - практически во всех живых организмах (бактериях, грибах, растениях, животных и человеке). Несмотря на своё "коварство", все вирусы имеют примитивное строение: одна нуклеиновая кислота (ДНК или РНК), окруженная одной или несколькими оболочками. Различают просто устроенные вирусы (безоболочечные) и сложно устроенные вирусы (оболочечные). К простым вирусам относят: вирусы полиомиелита, гепатита А, аденовирусы. Примеры сложных вирусов: гепатит В, грипп, парагрипп, корь, ВИЧ, герпес. Различаются вирусы и по форме:
- палочковидная (вирус табачной мозаики)
- пулевидная (вирус бешенства)
- сферическая (вирусы полиомиелита, ВИЧ)
- нитевидная (филовирусы)
- в виде сперматозоида (многие бактериофаги).
Размеры вирусов настолько малы (18-400 нм), что увидеть их можно только с помощью электронного микроскопа. Единицы измерения - нанометры, в отличие от бактерий (микрометры, мкм). Кстати, вирусы приблизительно в 100 раз меньше бактерий. Наиболее мелкими вирусами являются вирус полиомиелита (20 нм), гепатита А (30 нм), гепатита С (50 нм), вирус бешенства (170 нм), наиболее крупным — вирус натуральной оспы (350 нм).
От бактерий вирусы отличаются не только размерами, но и количеством генов (минимальное у вирусов от 4 до сотни, у бактерий – от 3000); нуклеиновыми кислотами (вирусы содержат только одну - ДНК или РНК, а бактерии – обе); количеством ферментов и, конечно же, самой формой жизни: вирусы размножаются только внутри живых существ, а бактерии – свободноживущие.
Интересный факт: первооткрыватель вирусов и основоположник вирусологии - русский ученый Д.И. Ивановский. В 1892 году описал необычные свойства возбудителей болезни табака (табачной мозаики), которые проходили через бактериальные фильтры и были названы "фильтрующимися частицами".
Жизненный цикл вирусов состоит из нескольких этапов:

1. Вирус прикрепляется к поверхности чувствительной клетки. Для каждого вируса есть свои чувствительные клетки, например, для гепатита – клетки печени, для гриппа – клетки дыхательных путей и т.д.
2. Проникновение вируса в клетку: либо его оболочка сливается с мембраной клетки или клетка сама его захватывает и поглощает.
3. Далее в клетке идёт процесс как бы “раздевания” вируса от всех его оболочек и активация его нуклеиновой кислоты.
4. Начинается синтез нуклеиновых кислот и белков вируса, т.е. вирус подчиняет системы клетки хозяина и заставляет их работать на своё воспроизводство.
5. Сборка вируса — многоступенчатый процесс, включающий в себя соединение всех компонентов.
6. Последний этап - выход вирусных частиц из клетки взрывным путем или почкованием. Полный цикл размножения вирусов завершается через 5-6 ч (вирус гриппа) или через несколько суток (вирус кори). Из погибающей клетки, которая длительное время может сохранять жизнеспособность, одновременно выходит большое количество вирусов. В результате пораженные вирусом клетки в основном погибают от истощения, а новые вирусы завоевывают и разрушают другие клетки. Но возможна и так называемая онкогенная трансформация клетки: тогда в организме появляется и начинает расти из мутированных клеток раковая опухоль.
Сколько вирус может жить вне организма хозяина и где?
Как правило, большинство вирусов малоустойчивы во внешней среде: они становятся инертны и погибают от многих причин, если снова не попадут в чувствительную клетку. Некоторые вирусы во внешней среде могут образовывать кристаллы, что свойственно только неживой материи.
Вирусы быстро погибают под действием солнечных лучей, ультрафиолета, стандартных веществ для дезинфекции. В воздухе помещений вирусы могут сохраняться несколько часов. При кипячении полностью инактивируются в течение нескольких минут.
Однако вирусы устойчивы к низким температурам: сохраняют свою жизнеспособность при t +4°С в течение нескольких недель, а при замораживании - в течение нескольких месяцев, а иногда и лет (особенно супернизких температурах).
Устойчивость вируса на различных поверхностях различна и зависит от температуры. На бумаге вирус разрушается за 3 часа, на банкнотах - за 4 дня, на дереве и одежде - за 2 дня, на стекле - за 4 дня, на металле и пластике - за 7 дней. Кстати, на внутреннем слое использованной маски они могут жить 7 дней, а на внешней поверхности маски – даже более недели (данные соответствуют условиям при температуре +22 °С и влажности 65 %).
Есть и исключения. Некоторые вирусы обладают значительной устойчивостью при комнатной температуре: вирус гепатита В сохраняет жизнеспособность в течение трех месяцев, гепатита А – в течение нескольких недель. ВИЧ сохраняется в высохшей крови до двух недель, в донорской крови вирус остается жизнеспособным в течение нескольких лет.
Что такое штаммы и почему вирусы мутируют?
Штамм (от нем. Stamm - "ствол,род") — чистая культура вирусов, изолированная в определённое время и в определённом месте. Один и тот же штамм не может быть выделен второй раз из того же источника в другое время. В зависимости от среды обитания – почва, вода, воздух, время года, чувствительный организм (человек, животные, птицы) - вирусы подразделяют на штаммы. Например, водный штамм, весенний, птичий, свиной и т.п. Во внешней среде геном вируса подвержен различным воздействиям, например, ультрафиолетовое облучение, солнечная радиация, химические вещества, что приводит к различного рода мутациям, т.е. изменениям в структуре нуклеиновой кислоты. В зависимости от характера мутаций вирусы могут изменять свои свойства, скажем, сменить хозяина. Так, вирус гриппа, который поражал только птиц, стал поражать и людей.
Как часто происходит в мировом научном сообществе открытие нового вируса?
Ученые каждый год открывают новые вирусы. Так, в 1972 г. открыт вирус Эбола, 1980-1989 гг. - вирусы иммунодефицита человека, гепатита Е и С, коронавирус человека впервые был выделен в 1965 году от больных ОРВИ. В Китае 2002—2003 годах была зафиксирована вспышка атипичной пневмонии или тяжелого острого респираторного синдрома (ТОРС, SARS). Заболевание было вызвано штаммом коронавируса SARS-CoV. В результате болезнь распространилась на другие страны, всего заболело 8273 человека, 775 умерло (летальность 9,6 %). И вот в 2019 году появился новый штамм коронавируса CoViD 19, который вызвал пандемию.
Так откуда берутся вирусы?
Вопрос риторический. Пока ответа у науки нет. Может быть, они были привнесены из космоса на космических телах. Ведь при низких температурах они могут сохраняться неопределенно долгое время.
Как они попадают в организм человека/животного и т.д.?
Разными путями: воздушно-капельным (корь, грипп, ветряная оспа), половым (ВИЧ, вирус простого герпеса 2 типа), через кровь (гепатит В,С, ВИЧ), через инфицированные продукты (гепатит А, Е) или через членистоногих (скажем, клещей). Различают вирусы, вызывающие инфекции с преимущественным поражением органов дыхания (респираторные), кишечника (ротавирусы), печени (вирус гепатита), иммунной (ВИЧ) или нервной системы (бешенство, энцефалит).
Как организм реагирует на вирус?

Частицы самого вируса, а также биологически активные вещества, выделяющиеся при разрушении наших клеток, могут вызвать повышение температуры тела, тошноту, рвоту, сильную слабость, головокружение вплоть до потери сознания, нарушение работы сердечно-сосудистой системы и др. На фоне нарушения функционирования различных органов и систем к вирусной инфекции может присоединиться бактериальная (стафилококки, стрептококки, кишечные бактерии) и грибковая (дрожжевые грибы), усугубив воспалительный процесс с тяжелыми последствиями вплоть до летального исхода.
Как наш организм борется?
Однако организм человека не простая мишень для атаки болезнетворных микроорганизмов, он активно борется, и в этом нам помогает иммунная система. Вырабатываются специфические, нейтрализующие данный вирус антитела, формируются клетки-"убийцы" или Т-лимфоциты, которые уничтожают как поражённые, инфицированные клетки, так и сам вирус. Но иммунной системе нужно время, чтобы вычислить "чужака", "вирусного преступника", который не просто прячется внутри наших клеток, но и старается обмануть иммунную систему. Например, новое или мутировавшее поколение вируса наша иммунная система поначалу не видит. Конечно же, со временем все вирусные клетки распознаются, но к сожалению, с потерей драгоценного времени для нашего организма.
Возможно ли повторное заражение одним и тем же вирусом?
Наше здоровье зависит напрямую от активности и лабильности иммунной системы. Если она работает со сбоями и не справляется с негативным воздействием патогенов, заболевание может перейти в хроническую форму вплоть до смертельного исхода. Поэтому повторное заражение этим же вирусом возможно. Другая причина появления рецидива заболевания - мутации вируса. Если вирус стабилен, то наша иммунная система запоминает его и, как правило, повторных случаев инфицирования не бывает. Но если вирус подвергается изменчивости, то попав в организм человека, он воспринимается уже как новый вирус.
Есть ли лекарственные препараты для лечения вируса? Что может убить вирус?
Да есть, но не против всех вирусов. Антибиотики, применяемые при лечении бактериальных инфекций, здесь совершенно не работают, т.к. они воздействуют на структуры клетки только бактерий. В случае вирусной инфекции нужны препараты, которые блокируют различные этапы размножения вируса в клетке. Таким неспецифическим веществом является интерферон, который вырабатывается клетками организма человека (кишечника, печени).
Если выработка интерферона недостаточна, то можно применить индукторы интерферона, например: ламовакс, курантил, дибазол, адаптогены растительного (элиутерококк, оралия) и животного происхождения (вытяжка из мидий). Активно действуют при респираторных вирусных заболеваниях препараты интерферона - виферон, амиксин и др. Подавляют активность вируса гриппа на ранних стадиях ремантадин, амантадин, арбидол. Герпес подавляет ацикловир (зовиракс) и т.п. Однако пока точно неизвестны препараты, подавляющие репродукцию коронавируса. К специфическому лечению от коронавируса относится введение плазмы от переболевших людей, которая содержит антитела, но этот метод находит ограниченное применение.

Зачем нужна вакцинация? Как и из чего делают вакцины?
По сути, вакцины - это препараты для создания искусственного активного иммунитета. Термин "вакцина" произошел от французского vacca – "корова". Его ввел Л. Пастер в честь Дженнера, применившего вирус коровьей оспы для иммунизации людей против натуральной оспы человека. Вакцины – это препараты, содержащие сами микроорганизмы (убитые или живые ослабленные), части микроорганизмов, а также анатоксины (токсин, лишенный своих ядовитых свойств, но сохранивший свойства активировать иммунный ответ). После введения вакцины вырабатываются специфические антитела, которые нейтрализуют, прежде всего, поверхностные рецепторы вируса, с помощью которых он проникает в клетку. Таким образом блокируется основной механизм проникновения вируса в клетку. Многие вакцины создают пожизненный иммунитет у человека, например, вакцина от гепатита В, кори, краснухи, полиомиелита, эпидемического паротита.
Сколько времени уходит на создание вакцины?
На создание вакцины уходит 1-2 года, в течение которого должны пройти многочисленные проверки на эффективность и безопасность препарата, испытания на животных, потом на людях-добровольцах, а после – наладить массовое фармацевтическое производство.
Что представляют собой тесты на вирус? Как в лабораториях выявляют положительные результаты анализов?
Диагностика вируса основана на определении структуры вируса (специфических рецепторов и нуклеиновой кислоты), а также противовирусных антител у переболевших людей. Используются различные реакции: иммуноферментный анализ (ИФА), полимеразная цепная реакция (ПЦР). Время диагностики зависит от производителя тестов - от нескольких часов до 1 суток.
Несколько примеров самых массовых с убийственных с точки зрения эпидемий вирусов в истории человечества
Вирусы гриппа постоянно циркулируют среди населения, вызывая сезонные подъемы заболевания, периодически приобретающие характер эпидемий и даже пандемий. Эпидемии гриппа наносят огромный экономический ущерб, приводят к людским потерям. Это, прежде всего, относится к вирусам типа А, который каждые 2-3 года вызывает эпидемии, а несколько раз в столетие - пандемии с числом заболевших 1-2 млрд. человек. Эпидемии, вызываемые вирусом типа В, повторяются через 3-6 лет.
Пандемии гриппа, вызванные мутированными вирусами, против которых у людей нет иммунитета, возникают 2-3 раза в 100 лет. Пандемия гриппа 1918—1919 ("испанка", штамм H1N1) унесла жизни 40-50 миллионов человек. Предполагают, что вирус "испанки" возник в результате рекомбинации генов вирусов гриппа птиц и человека. В 1957—1958 была пандемия "азиатского гриппа", вызванная штаммом H2N2; в 1968—1969 - пандемия "гонконгского гриппа" (H3N2).
С 2009 появилось новое заболевание людей и животных, вызываемое штаммами вируса гриппа А/H1N1, А/H1N2, А/H3N1, А/H3N2 и А/H2N3, известных под общим названием "вирус свиного гриппа". Он распространён среди домашних свиней, а также может циркулировать в среде людей, птиц и др. видов; этот процесс сопровождается его мутациями.

Как уберечься от вирусов? Существуют ли действенные меры профилактики и гигиены?
Выделяют специфические и неспецифические способы профилактики вирусных инфекций. Специфические заключаются в использовании вакцин, при их наличии. При их введении у человека формируется как правило пожизненный иммунитет (вакцина от кори, краснухи, эпидемического паротита, ветряной оспы, гепатита В). Существует также экстренная профилактика. Ее проводят во время эпидемического подъема заболеваемости. Для экстренной профилактики, например, гриппа применяют противовирусные химиопрепараты: ремантадин (активен только против вирусов типа А), арбидол, амиксин, оксалиновую мазь и др. Используют также интерферон, дибазол, различные индукторы интерферона (например, элеутерококк, продигиозан).
Против многих вирусных инфекций вакцин не существует. В этом случае помогает неспецифическая профилактика. Существуют ряд общих правил:
- соблюдать личную гигиену (мойте руки перед приемом пищи, после использования туалета; не трогайте грязными, немытыми руками нос, глаза, рот).
- обязательно поддерживать здоровый образ жизни с помощью сбалансированного питания, занятий физкультурой, прогулок на свежем воздухе и многое другое.
Но для каждого вируса неспецифическая профилактика своя. Если речь идет о вирусах, передающихся воздушно-капельным путем, то необходимо придерживаться следующих правил:
- надевать маски, причем на больного человека, чтобы исключить попадание в пространство крупных частиц слюны при кашле и чихании, мелкие же частицы она не задерживает;
- тщательно убирать помещения, так как вирус любит теплые и пыльные помещения, поэтому стоит уделить время влажной уборке и проветриванию;
- избегать массовых скоплений людей и воздержаться от походов в общественные места.
Если вирус передается с помощью фекально-орального механизма, например, вирус гепатита А, то необходимо соблюдать следующее:
- употреблять чистую или кипяченую воду;
- мыть фрукты, ягоды, овощи кипяченой водой:
- поливать свой сад и огород проточной водой.
Если вирус передается через кровь, например, вирус гепатита В,С, ВИЧ, то необходимы:
- дезинфекция, стерилизация медицинских изделий;
- обследование доноров крови;
- не употреблять наркотики;
- использовать индивидуальные предметы личной гигиены;
- быть осторожными с маникюром, пирсингом и татуировками, делать это только в профессиональном салоне.
Если вирус передается половым путем, например, ВИЧ, то нужно:
- исключить незащищенные половые контакты, если вы не уверены в своём партнёре;
- использовать барьерные средства контрацепции, если вы не знаете статус своего партнера.
Читайте также:


