Биологические катализаторы и вирусы
Человеческий организм называют биохимической фабрикой совершенно не зря. Ведь каждую минуту в нем происходят тысячи, десятки и сотни тысяч процессов окисления, расщепления, восстановления и прочих реакций. Что позволяет им протекать с такой огромной скоростью, обеспечивая каждую клетку энергией, питанием и кислородом?
Понятие о катализаторах
Как в неорганической, так и в органической химии очень широко используются специальные вещества, способные ускорять протекание химических реакций в несколько тысяч, а иногда и миллионов раз. Название этих соединений - "катализаторы". В неорганической химии это оксиды металлов, платина, серебро, никель и другие.
Их главное действие - образование временных комплексов с участниками реакции, за счет понижения энергии активации процесс осуществляется в несколько раз быстрее. После этого комплекс распадается, и из сферы можно вывести катализатор в том же количественном и качественном составе, что и до начала процесса.
Существует два варианта каталитических реакций:
- гомогенные - ускоритель и участники в одном агрегатном состоянии;
- гетерогенные - ускоритель и участники в разных состояниях, есть граница раздела фаз.
Кроме того, есть и противоположные по действию соединения - ингибиторы. Они направлены на замедление необходимых реакций. Так, например, они позволяют снизить количество времени на формирование коррозии.
Биологические катализаторы по своей природе отличаются от неорганических, да и свойства их несколько специфичны. Поэтому в живых системах катализ другой.
Ферменты - что это?
Доказано, что если бы действие специальных веществ, ускоряющих обозначенные процессы, не осуществлялось внутри живых систем, то обычное яблоко в желудке переваривалось бы около двух дней. За такое количество времени начались бы процессы разложения и интоксикация продуктами гниения. Однако этого не происходит, и фрукт полностью перерабатывается уже за полтора часа. Осуществляют это биологические катализаторы, которые в большом количестве присутствуют в составе каждого организма. Но что они собой представляют и на чем основано такое действие?
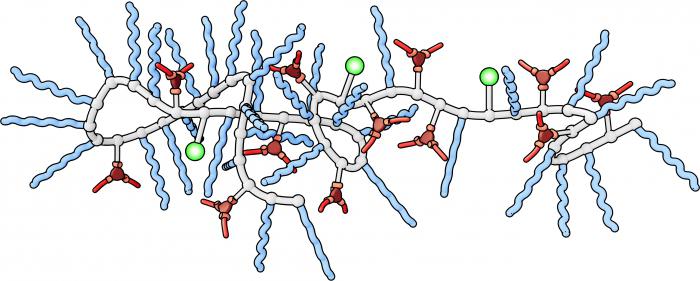
Биологические катализаторы белковой природы - это ферменты. Их основа - сложные структурная организация, обладающая рядом специфичных свойств. Проще говоря, это уникальные белки, способные снижать энергию активации процессов в живых организмах и осуществлять их со скоростью, превышающей обычные значения в несколько миллионов раз.
Можно привести множество примеров подобных молекул:
- каталаза;
- амилаза;
- оксиредуктаза;
- глюкозооксидаза;
- липаза;
- инвертаза;
- лизоцим;
- протеаза и другие.
Таким образом, можно сделать вывод: ферменты - биологические катализаторы белковой природы, которые действуют как сильные ускорители, позволяя осуществлять тысячи процессов в живых организмах с очень высокой скоростью. На их действии основано пищеварение, окисление, восстановление.
Сходства неорганических и белковых катализаторов
Ферменты как биологические катализаторы имеют ряд свойств, схожих с неорганическими. К таковым можно отнести следующие:
- Ускоряют только термодинамически возможные реакции.
- Не влияют на смещение химического равновесия в равновесных системах, а одинаково ускоряют как прямой, так и обратный процесс.
- В итоге в сфере реакции остаются только продукты, катализатор в их число не входит.
Однако, помимо схожести, существуют еще и отличительные особенности ферментов.
Различия в зависимости от природы
Биологические катализаторы имеют несколько специфических особенностей:
- Высокая степень избирательности. То есть один белок способен активизировать только какую-то определенную реакцию или группу схожих. Чаще всего работает схема "фермент - субстрат одного процесса".
- Чрезвычайно высокая степень активности, ведь некоторые виды белков способны ускорять реакции в миллионы раз.
- Ферменты сильно зависят от условий среды. Проявляют активность только в определенном интервале температур. Также сильно влияет рН среды. Существует кривая, показывающая значения минимума, максимума и оптимума по показателям для каждого фермента.
- Существуют специальные соединения, называемые эффекторами, которые способны угнетать природу биологических катализаторов либо, наоборот, положительно влиять на них.
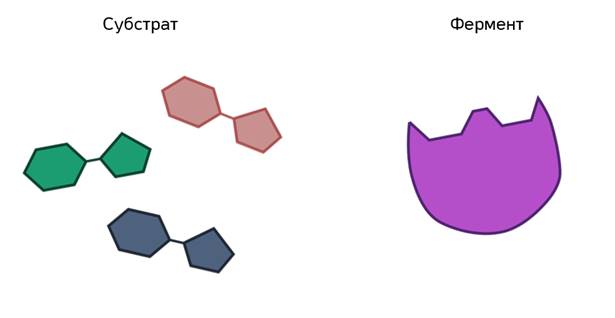
- Субстрат, на котором работает фермент, должен быть строго специфичен. Существует теория, которая носит название ключа и замка. Она описывает механизм действия фермента на субстрате. Катализатор, подобно ключу, встраивается в субстрат своим активным центром, и начинается реакция.
- После процесса фермент частично либо полностью разрушается.
Таким образом, очевидно, что значение белковых катализаторов крайне велико для живых организмов. Однако действие их подчиняется определенным правилам и ограничивается рамками условий окружающей среды.
Изучение катализа в школе
В рамках школьной программы катализаторы изучаются как на химии, так и на биологии. На уроках химии они изучаются с точки зрения веществ, позволяющих осуществлять промышленные синтезы, получать большое количество разнообразных продуктов. На уроках биологии рассматриваются именно биологические катализаторы. 9 класс подразумевает изучение молекулярной биологии и основ биохимии. Поэтому именно на данной ступени образования учащиеся и получают основы знаний о ферментах как действующих веществах в организмах живых существ.
На уроках проводятся опыты, подтверждающие химическую активность данных веществ в определенных температурных интервалах и рН среды:
- исследование действия перекиси водорода как катализатора на сырую и вареную морковь;
- воздействие на мясо (обработанное термически и сырое), картофель и прочие продукты.
Ферменты в организме человека
Каждый школьник, достаточно образованный и перешедший рубеж среднего звена образования, знает, как называются биологические катализаторы. Ферменты в организме имеют строго специфическую специализацию. Поэтому для каждого процесса можно назвать свое катализирующее вещество.
Так, все ферменты организма можно разделить на несколько групп:
- оксидоредуктазы, например, каталаза или алкогольдегидрогеназа;
- трансферазы - кеназа;
- гидролазы, важные для пищеварения: пепсин, амилаза, липопротеинлипаза, эстераза и другие;
- лигазы, например, ДНК-полимераза;
- изомеразы;
- лиазы.
Так как все эти соединения имеют белковую природу, а также комплекс витаминов в составе, то повышение температуры тела чревато денатурацией структуры, а следовательно, прекращением всех биохимических реакций. В этом случае организм близок к смерти. Поэтому высокую температуру тела обязательно сбивают во время болезни.
Использование белковых катализаторов в промышленности
Часто ферменты используются в разных отраслях промышленности:
На полках магазинов можно видеть чистящие средства и стиральные порошки с содержанием энзимов - это и есть ферменты, улучшающие качество стирки белья.
Для чего нужны биологические катализаторы?
Переоценить их значение сложно. Ведь они не только позволяют живым организмам жить, дышать, питаться, осуществлять процессы метаболизма, но и дают нам возможность уничтожать промышленные отходы, получать лекарства, защищать и оберегать свое здоровье и состояние окружающей среды.

Начнём с цитаты известного советского химика и инженера, академика Георгия Константиновича Борескова:
Неуютная картина, не правда ли? Поэтому сегодняшняя наша цель – разобраться, почему же Земля всё-таки выглядит более привычно для нашего глаза.

Для протекания многих химических реакций необходимы специальные условия. Чаще всего на скорость реакций влияют температура и давление. Чем они выше, тем быстрее протекает химическая реакция. Но её скорость можно увеличить, не изменяя внешних условий, а просто добавив к реагирующей смеси определённые вещества. Так, металлический родий почти в 10000 раз ускоряет разложение муравьиной кислоты на углекислый газ и водород. Такие вещества, увеличивающие скорость реакции, но не входящие в состав продуктов реакции, называются катализаторами.
В клетках живых организмов каждую секунду происходят тысячи химических реакций.
И это несмотря на то, что в живой клетке умеренная температура и нормальное давление. Например, бактерии из рода Азотобактер могут при обычных условиях разрывать прочнейшую молекулу азота, где атомы соединены тремя ковалентными связями и присоединять их к водороду. А для того, чтобы проделать то же самое человеку в промышленности, необходимо создать давление в 350 раз большее, чем на поверхности Земли и поднять температуру до 500 градусов Цельсия.
Естественно, бактерии не обходятся при этом без катализаторов. Кстати, люди также пытались применить их при получении аммиака. Перепробовав при этом более 20000 различных веществ.
Что же за всесильные вещества – эти катализаторы?
Катализаторами химических реакций в неживой природе могут быть самые различные вещества. Это и уже упомянутый нами экзотический родий, который используется для изготовления зеркал супермощных лазеров и обычный оксид марганца, применяемый для получения кислорода даже в школьной лаборатории.
Кроме того, неорганические катализаторы могут ускорять реакции с разными веществами. Например, родий не только эффективно разлагает муравьиную кислоту, но и борется с выбросами вредных оксидов азота в автомобильных катализаторах.
Другое дело – биологические, а значит, органические катализаторы. На них мы остановимся более подробно.
Многочисленные исследования прошлого нашей планеты говорят о том, что на начальном этапе зарождения жизни каталитической способностью обладали некоторые молекулы рибонуклеиновых кислот.

И тогда это свойство РНК имело очень важное значение. Сегодня же роль молекул РНК как катализаторов крайне мала. А основными биокатализаторами в клетке являются ферменты. Которых уже к 2013 году было описано более пяти тысяч видов.
Абсолютно все процессы в живом организме прямо или косвенно осуществляются с участием ферментов или энзимов, как их ещё называют. Это и фиксация углерода в процессе фотосинтеза, и расщепление питательных веществ в пищеварительном тракте, и синтез источника энергии для всех живых организмов – АТФ, и многое –многое другое.
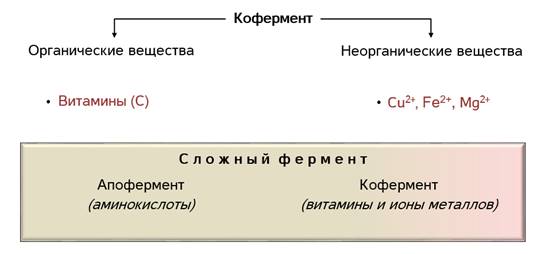
Как вы помните, по химической природе биологические катализаторы относятся к белкам. Они могут быть как простыми, состоящими только из аминокислот, так и сложными, включающими белок и небелковую часть – простетическую группу. Простетическая группа фермента называется кофермент, а белковая часть – апофермент.
В роли коферментов выступают органические и неорганические вещества. Среди органических это могут быть витамины, например, аскорбиновая кислота. А из неорганических – ионы различных металлов. Например, ионы меди, железа, магния.
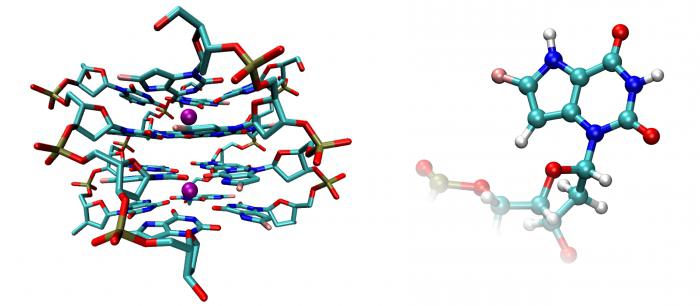
Ферменты ускоряют химические реакции за счёт тесного взаимодействия с молекулами исходных реагирующих веществ – так называемых субстратов. Зачастую размеры молекул субстратов значительно меньше размеров молекул самих ферментов, хотя, казалось бы, должно быть наоборот. Поэтому с субстратом или субстратами, потому что их может быть несколько, взаимодействует не вся молекула фермента, а лишь небольшой её участок – активный центр фермента. Построен он чаще всего из нескольких аминокислотных остатков, которые образуют его уникальную структуру. Почему уникальную? Дело в том, что форма и химическое строение активного центра таковы, что с ним могут связываться только те субстраты, структура которых подходит к структуре активного центра.
Магия этого процесса неизвестна до сих пор. Несмотря на то, что человечество в ближайшее время планирует полёты на Марс, оно не в состоянии разобраться со своим организмом. Но существует теория. Её выдвинул ещё в 1890 году немецкий химик Эмиль Фишер.
В этом комплексе молекула субстрата деформируется и в её структуре ослабляются определённые химические связи. Что приводит к облегчённому их разрыву и в конечном итоге к ускорению химической реакции.
После этого фермент-субстратный комплекс распадается на конечные продукты и свободный фермент, а активный центр последнего тут же готов принимать новые молекулы субстрата. Получаем такой же итог, как и в случае работы обычных химических катализаторов – скорость реакции увеличивается, а сам катализатор при этом не расходуется и может использоваться многократно.
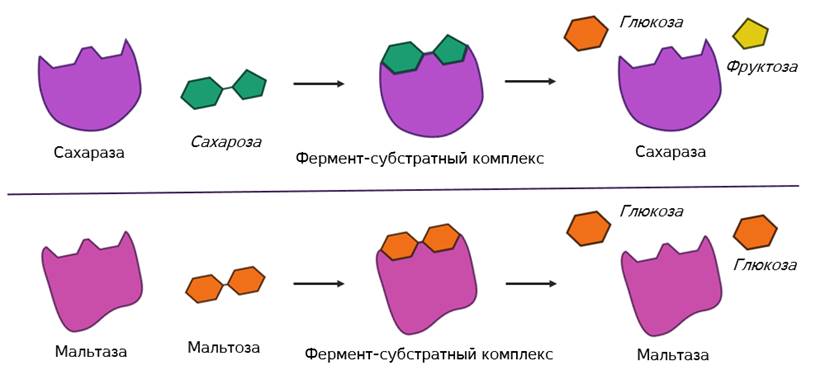
Но в самом механизме работы органических и неорганических катализаторов есть кардинальное отличие. Каждый фермент действует только на определённый тип связи и ускоряет только одну определённую реакцию. То есть обладает специфичностью. Как вы поняли, специфичность объясняется соответствием активного центра только определённым субстратам. Поэтому, например, фермент мальтаза, разлагающий дисахарид мальтозу до двух молекул глюкозы оказывается не способным разрушать молекулы сахарозы. Несмотря на то, что сахароза также является дисахаридом.
Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Например, в желудке человека соляная кислота активирует фермент пепсин. Максимальная активность которого лежит в пределах рН от полутора до двух.
Ингибирование ферментов может быть обратимым и необратимым. Если вещество-ингибитор вызывает стойкое изменение пространственной структуры фермента, то такое ингибирование будет необратимым.
А вот обратимое ингибирование, в свою очередь, бывает двух типов. Давайте их рассмотрим.
С активным центром фермента могут связываться вещества, сходные по структуре с субстратом. Никакой реакции при этом нет, но между ингибиторами и субстратом происходит конкуренция за активный центр. Поэтому такой тип ингибирования называется конкурентным.
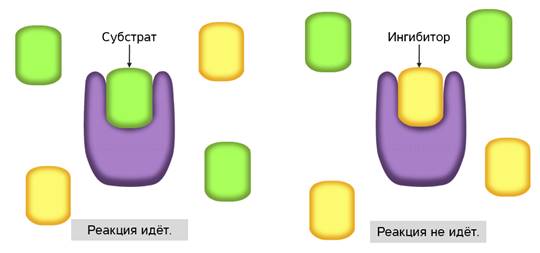
Конкурентное ингибирование широко используется в медицине. Антибиотики, противоопухолевые препараты, используемые в качестве лекарственных средств, являются конкурентными ингибиторами.
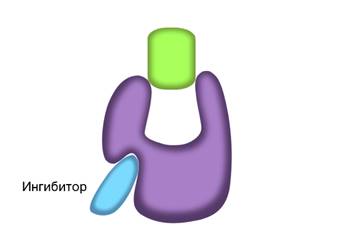
В неконкурентном ингибировании не участвуют вещества, сходные с субстратом. При таком типе ингибирования, молекулы ингибиторов присоединяются к регуляторному центру фермента. Это вызывает изменение пространственной структуры активного центра, что препятствует присоединению к нему молекул субстрата. Тем самым снижается скорость ферментативной реакции.
Уникальные способности ферментов уже много лет используются человеком в хозяйственной деятельности. В настоящее время развивается новая отрасль науки – промышленная энзимология. Которая, в свою очередь, является основой биотехнологии.
Мы уже упоминали об использовании ферментов в медицине. Фармацевтическая промышленность научилась производить искусственный аналог гормона надпочечников кортизола – преднизолон. Который используется при лечении ревматоидного артрита.
Широкое применение ферменты-энзимы находят также в пищевой промышленности. Их применяют в производстве сыров, соков, овощных и фруктовых пюре. Не обходится без применения ферментов хлебопечение, производство алкогольных напитков. Для улучшения вкуса, аромата и консистенции их применяют для обработки мяса.
В текстильной и кожевенной промышленности ферменты позволяют значительно увеличить выход овчины, а обработка кожи перед дублением делает её поверхность чистой, гладкой и тонкой.
Перспективным является применение ферментов, разлагающих целлюлозу. В результате этого из древесины, торфа, сельскохозяйственных и городских отходов можно получить ценные биотехнологические продукты: глюкозу, этанол, ацетон и другие. Особую актуальность это имеет в наши дни, когда проблема загрязнения окружающей среды выходит на передний план.
В природе существуют особые вещества белковой природы, одинаково успешно функционирующие как в живой клетке, так и за её пределами. Это ферменты. С их помощью организм переваривает пищу, выращивает и разрушает клетки, благодаря им эффективно работают все системы нашего организма и, в первую очередь, центральная нервная система. Без ферментов в мире не существовало бы йогурта, кефира, сыра, брынзы, кваса, готовых каш, детского питания. Из чего состоят и как устроены эти биокатализаторы, недавно ставшие верными помощниками биотехнологов, как их отличают друг от друга, как они облегчают нашу жизнь, об этом вы узнаете из этого урока.
Определение ферментов
Ферменты – это белковые молекулы, которые синтезируются живыми клетками. В каждой клетке насчитывается более сотни различных ферментов. Роль ферментов в клетке колоссальна. С их помощью химические реакции идут с высокой скоростью, при температуре, подходящей для данного организма.
То есть ферменты – это биологические катализаторы, которые облегчают протекание химической реакции и за счет этого увеличивают её скорость. Как катализаторы они не изменяют направление реакции и не расходуются в процессе реакции.
Ферменты-биокатализаторы – вещества, увеличивающие скорость химических реакций.
Без ферментов все реакции в живых организмах протекали бы очень медленно и не могли бы поддерживать его жизнеспособность.
Наглядный пример работы ферментов – сладковатый вкус во рту, который появляется при пережевывании продуктов, содержащих крахмал (например, риса или картофеля). Появление сладкого вкуса связано с работой фермента амилазы, которая присутствует в слюне и расщепляет крахмал (рис. 1). Крахмал является полисахаридом, и сам по себе безвкусный, но продукты расщепления крахмала (моносахариды) с меньшей молекулярной массой (декстрины, мальтоза, глюкоза) сладкие на вкус.

Рис. 1. Механизм действия амилазы
Все ферменты – глобулярные белки с третичной или четвертичной структурой. Ферменты могут быть простыми, состоящими только из белка, и сложными.
Сложные ферменты состоят из белковой и небелковой части (белковая часть – апофермент, а добавочная небелковая – кофермент). В качестве кофермента могут выступать витамины – E, K, B групп (рис. 2).

Рис. 2. Классификация ферментов по их составу
Фермент взаимодействует с субстратом, не всей молекулой, а отдельной её частью – т. н. активным центром.
Механизм действия ферментов
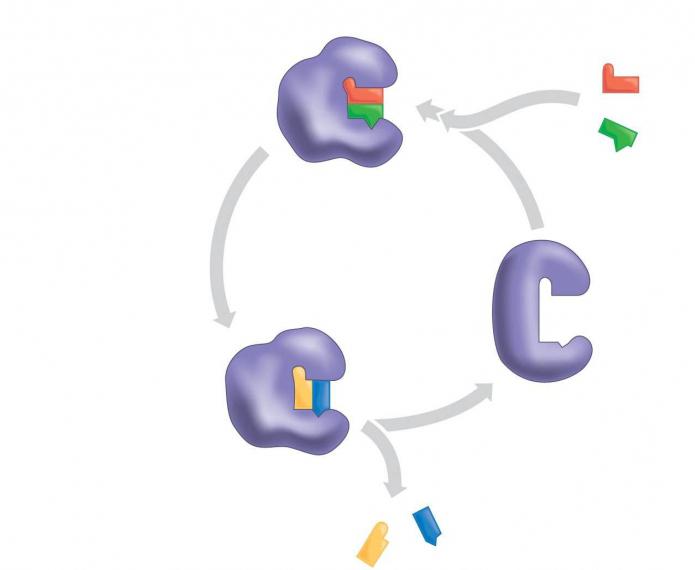
Фермент взаимодействует с субстратом и образует короткоживущий фермент-субстратный комплекс. По завершении реакции, фермент-субстратный комплекс распадается на продукты и фермент. Фермент в итоге не изменяется: по окончании реакции он остается таким же, каким был до неё, и может теперь взаимодействовать с новой молекулой субстрата (рис. 3).


Рис. 3. Механизм взаимодействия фермента и субстрата
На рисунке 3 представлен механизм работы фермента, в частности, образования пептидной связи между молекулами аминокислот. Две аминокислоты взаимодействуют между собой в активном центре фермента, между ними образуется пептидная связь. Новое вещество (дипептид) покидает активный центр фермента, поскольку оно по своей структуре не соответствует этому центру.
Особенностью ферментов является то, что они обладают высокой специфичностью, т. е. могут ускорять только одну реакцию или реакции одного типа.


Рис. 4. Гипотеза взаимодействия фермента и субстрата по принципу ключ-замок Э. Г. Фишера
Активность ферментов
В первую очередь, на активность фермента влияет температура. С повышением температуры скорость химической реакции возрастает. Увеличивается скорость молекул, у них появляется больше шансов столкнуться друг с другом. Следовательно, увеличивается вероятность того, что реакция между ними произойдет. Температура, обеспечивающая наибольшую активность фермента – оптимальная.
За пределами оптимальной температуры скорость реакции снижается вследствие денатурации белков. Когда температура снижается, скорость химической реакции тоже падает. В тот момент, когда температура достигает точки замерзания, фермент инактивируется, но при этом не денатурирует (см. видео).
В наше время для длительного хранения продуктов широко используют способ быстрого замораживания. Оно останавливает рост и развитие микроорганизмов, а также инактивирует ферменты, находящиеся внутри микроорганизмов, и предотвращает разложение продуктов питания.
Кроме этого, активность ферментов зависит ещё от pH среды (кислотности – то есть показателя концентрации ионов водорода).
В большинстве случаев, ферменты работают при нейтральном pH, т. е. при pH около 7. Но существуют ферменты, которые работают либо в кислой и сильнокислой, либо в щелочной и сильнощелочной среде. Например, один из таких ферментов – пепсин, он находится у нас с вами в желудке, работает в сильнокислой среде и расщепляет белки. Поскольку в желудке среда достаточно кислая, 1,5 – 2 pH, то этот фермент работает при сильнокислой среде.
Ферменты подвержены действию активаторов и ингибиторов. Некоторые ионы, например, ионы металлов Mg, Mn, Zn активируют ферменты. Другие же ионы (к ним относятся ионы тяжелых металлов, а именно Hg, Pb, Cd), наоборот, подавляют активность ферментов, денатурируют их белки.
Классификация ферментов
Значение ферментов
Ферменты применяются практически во всех областях человеческой деятельности, и такое широкое применение, в первую очередь, связано с тем, что они сохраняют свои уникальные свойства вне живых клеток.
Ферменты групп амилаз, протеаз и липаз применяются в медицине. Они расщепляют крахмал, белки и жиры. Все эти ферменты, как правило, входят в состав комбинированных препаратов, таких как фестал и панзинорм, и используются, в первую очередь, для лечения заболеваний желудочно-кишечного тракта (рис. 6).
Ферменты применяют для растворения тромбов в кровеносных сосудах, при лечении гнойных ран.
Особое место занимает энзимотерапия при лечении онкологических заболеваний.
Такие ферменты как амилаза расщепляют крахмал и поэтому широко используются в пищевой промышленности. В пищевой промышленности используется протеиназа, расщепляющая белки, и липазы, расщепляющие жиры. Ферменты амилазы используются в хлебопечении, виноделии и пивоварении (см. видео).
Протеазы используются для смягчения мяса и при изготовлении готовых каш.
Липазы используются в производстве сыра.
Ферменты широко используются в косметической промышленности, входят в состав кремов, некоторые ферменты входят в состав стиральных порошков.
Энзимопатология – область энзимологии, которая изучает связь между болезнью и недостаточным синтезом, или отсутствием синтеза какого-либо фермента.
Например, причиной наследственного заболевания – фенилкетонурии, которое сопровождается расстройством психической деятельности, является потеря клетками печени способности синтезировать фермент, катализирующий превращение фенилаланина в тирозин.
В результате в организме накапливаются токсические вещества. Новорожденный ребенок выглядит здоровым, а первые симптомы фенилкетонурии проявляются в возрасте от двух до шести месяцев. Это выраженная вялость, отсутствие интереса к окружающему миру, повышенная раздражительность, а также беспокойство и рвота.
Во втором полугодии жизни у ребенка выражено отставание в психическом развитии. Менее чем в 10% случаев – это слабая степень олигофрении, а у 60% развивается идиотия.
При своевременной диагностике патологических изменений можно избежать, если с момента рождения до наступления полового созревания ограничить поступление фенилаланина с пищей.
На этом уроке мы с вами выяснили, что ферменты используются в различных областях человеческой деятельности.
Они широко используются в пищевой промышленности, в медицине, в косметике и бытовой химии. Например, в стиральные порошки добавляют амилазу, которая расщепляет крахмал, протеазы, расщепляющие белки или белковые загрязнения, и липазы, очищающие ткани от жира и масла. Как правило, в состав стирального порошка входит комбинация этих ферментов, то есть ферментные препараты усиливают действие друг друга.
Сегодня наиболее изученными ферментами являются протеазы и амилазы. Липазы не всегда стабильны по качеству. Их разработкой занимаются только 10 лет, а амилаза и протеаза существуют на рынке уже более полувека. Сегодня эти две категории ферментов очень хорошо изучены и дают прекрасные результаты, чего пока что нельзя сказать о липазах. Липазы полностью справляются с загрязнениями только после двух-трех стирок, а протеазы и амилазы – за одну.
Ученые подсчитали, что добавление ферментов в стиральные порошки на 30-35% увеличивает моющую способность данного порошка.
Из истории открытия ферментов
Ферменты были открыты при изучении процессов брожения. Представления о том, что химические процессы внутри живых организмов протекают под действием каких-то особенных веществ, возникло более 200 лет назад. В XIX века Луи Пастер (рис. 7) доказал, что сбраживание дрожжами сахара в спирт катализируется веществами белковой природы. Пастер ошибочно считал, что ферменты неотделимы от живых клеток. Другой ученый, Эдуард Бухнер, доказал, что в водных экстрактах живых клеток находится набор ферментов, катализирующих превращение сахара в спирт. Именно его открытие дало начало новой науке – энзимологии.
Успехи энзимологии во второй половине XX века привели к тому, что в настоящее время выделено и очищено более 2000 ферментов, которые используются в различных отраслях человеческой деятельности.
Домашнее задание
1. Что такое фермент?
2. Как ферменты работают?
3. Как ферменты получают имена? Назовите известные вам группы ферментов.
4. Назовите ученых, которые внесли особый вклад в дело изучения ферментов.
5. К какому уровню организации можно отнести ферментативный катализ?
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
3. Интернет-портал Chem.msu.su (Источник).
Список литературы
1. Каменский А. А., Криксунов Е. А., Пасечник В. В. Общая биология 10-11 класс Дрофа, 2005.
2. Биология. 10 класс. Общая биология. Базовый уровень / П. В. Ижевский, О. А. Корнилова, Т. Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
3. Беляев Д. К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
4. Биология 11 класс. Общая биология. Профильный уровень / В. Б. Захаров, С. Г. Мамонтов, Н. И. Сонин и др. – 5-е изд., стереотип. – Дрофа, 2010. – 388 с.
5. Агафонова И. Б., Захарова Е. Т., Сивоглазов В. И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 








Описание презентации по отдельным слайдам:
Катализатором – называется явление ускорения реакции без изменения ее общего результата. Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества
В основе всех химических процессов лежат тысячи химических реакций. Они идут в организме без применения высокой температуры и давления т.е в мягких условиях. Вещества, которые окисляются в клетках человека и животных, сгорают быстро и эффективно, обогащая организм энергией и строительным материалом. Но те же вещества могут годами храниться как в консервативном (изолированном от воздуха) виде, так и на воздухе в присутствии кислорода. Возможность быстрого переваривания продуктов в живом организме осуществляется благодаря присутствию в клетках особых биологических катализаторов – ферментов.
Ферменты - обычно белковые молекулы или молекулы РНК, их комплексы, ускоряют химические реакции в живых системах.
Оксидорудуктазы Трансферазы Гидролазы Лиазы Изомераз Синтетазы
Коферменты - органические соединения небелковой природы, входящие в состав некоторых ферментов.
Активный центр – небольшой участок, на котором идет данная реакция.
Выберите книгу со скидкой:

3D-рисование. Гиперреализм Рисунки, которые оживают
350 руб. 553.00 руб.

Совушки. Раскраски, поднимающие настроение (ПР)
350 руб. 96.00 руб.

350 руб. 1087.00 руб.

Совушки. Раскраски, поднимающие настроение
350 руб. 283.00 руб.

Котики. Раскраски, поднимающие настроение
350 руб. 283.00 руб.

В цветочном вальсе. Открытки-раскраски
350 руб. 225.00 руб.

На крыльях счастья. Открытки-раскраски
350 руб. 225.00 руб.

Краски. История макияжа
350 руб. 1383.00 руб.

Рисование акварелью без помощи учителя. Академия художествъ
350 руб. 359.00 руб.

Мандалы женской силы (раскраски для взрослых)
350 руб. 248.00 руб.

Мандалы на каждый день лунного месяца (раскраски для взрослых)
350 руб. 233.00 руб.

Мандалы-раскраски для здоровья и радости
350 руб. 152.00 руб.
БОЛЕЕ 58 000 КНИГ И ШИРОКИЙ ВЫБОР КАНЦТОВАРОВ! ИНФОЛАВКА



- Ермакова Зинаида МакаровнаНаписать 0 16.03.2017
Номер материала: ДБ-270291
Добавляйте авторские материалы и получите призы от Инфоурок
Еженедельный призовой фонд 100 000 Р

Спикер: Анна Быкова (#лениваямама)
-
16.03.2017 732
-
16.03.2017 2000
-
16.03.2017 673
-
16.03.2017 353
-
16.03.2017 624
-
16.03.2017 4290
-
16.03.2017 314
Не нашли то что искали?
Вам будут интересны эти курсы:
Читайте также:


