Что представляет собой рнк вируса

Россия готовится к тотальному тестированию, новые тест-системы позволяют быстро провести масштабную проверку на вирус. К массовому выпуску приступил один из разработчиков нового продукта, два других начинают производство. Олег Гусев, ведущий научный сотрудник Научно-клинического центра прецизионной и регенеративной медицины Казанского федерального университета и института физико-химических исследований RIKEN (Япония) помог РБК Тренды разобраться в том, как устроено тестирование на коронавирус в России и в мире.
Что предлагает ВОЗ
Глава Всемирной организации здравоохранения Тедрос Гебреисус еще в середине марта призвал страны проводить как можно больше тестов на вирус, который вызывает заболевание SARS-CoV-2, даже людям без симптомов. Согласно руководству ВОЗ, анализы на коронавирус COVID-19 должны проводиться методом полимеразной цепной реакции (ПЦР) с обратной транскрипцией. Как говорится в рекомендациях, на сегодня это самый точный и надежный метод диагностики вирусной инфекции. Он позволяет определить даже очень небольшое количество РНК вируса в биологическом материале человека. Это помогает выявить болезнь в инкубационном периоде.
Изобретенный в 1983 году метод и сейчас считается фундаментальным в молекулярной диагностике. Американский ученый, который придумал способ значительного увеличения малых концентраций фрагментов ДНК в биологической пробе, получил за него Нобелевскую премию. Выявление ДНК/РНК методом ПЦР позволяет диагностировать такие заболевания, как ВИЧ, вирусные гепатиты, инфекции, передающиеся половым путем, туберкулез, боррелиоз, энцефалит и многие другие. Метод используют в археологии, криминалистике, генетике.
Как работает ПЦР-тест
Для анализа из физиологических жидкостей извлекают одноцепочечную РНК, моделируют на ее основе двуцепочечную ДНК и многократно дублируют с помощью специального фермента (полимеразы). Увеличение числа копий ДНК называется амплификацией. В результате концентрация определенных фрагментов ДНК/РНК в биологическом образце, изначально минимальная, значительно увеличивается. При исследовании копируется только необходимый для теста участок ДНК. И, конечно, дублирование происходит только в том случае, если искомый участок вирусной ДНК или РНК присутствует в исследуемом биоматериале. В случае с коронавирусом мазок для анализа берут из ротоглотки или носоглотки, поскольку в крови или в кале вирус появляется на более продвинутой стадии болезни.
Тест-система EMG — продукт совместной разработки российских и японских разработчиков, проводившейся с 2016 года, рассказывает Олег Гусев. На данный момент эти тесты включены в систему обязательного медицинского страхования в Японии.
В ближайшее время планируется производить до 2,5 млн. тестов и 1 тыс. портативных лабораторий в неделю. Сами тесты, как и многие реагенты производятся в России. Планируется, что цена на тесты EMG будет в среднем в пять раз меньше, чем на стандартные ПЦР-тесты в Европе.
Российско-японские тесты основаны на методе изотермальной молекулярной диагностики SmartAmp, превосходящем метод ПЦР по скорости работы в восемь раз, а переносная лаборатория позволяет тестировать до 20 пациентов в час, говорит Гусев.
Ключевое отличие теста EMG в том, что многие тесты, которые производятся сейчас, это тесты ИФА (имунноферментный анализ), а не ПЦР. Данные системы определяют антитела, которые организм начинает вырабатывать не ранее, чем через неделю после заражения. Российско-японская разработка позволяет получать результат уже за 30 минут, с точностью, равной почти 100%. Кроме того, тест EMG позволяет определить наличие вируса уже на самых ранних стадиях, в то время как другие системы диагностики короновируса обладают меньшей чувствительностью и не могут выявлять вирус на ранней стадии инфицирования.
Принцип технологии российско-японского теста, по сути, не отличается от классической ПЦР — это наращивание количества целевых фрагментов ДНК и их детекция. Однако в изотермической амплификации, в отличие от классической ПЦР, где необходимы циклы нагрева и охлаждения, все происходит при одной температуре. Это позволяет многократно увеличивать скорость реакции. Метод SmartAmp был изобретен более 15 лет назад (как и LAMP — другая популярная технология изотермальной амплификации, предшествующая SmartAmp). Впервые для инфекционных заболеваний эту технологию применили в 2009 году для быстрого выявления пандемического гриппа (H1N1) в Японии.
Повторные тесты необходимы при любом методе. Отрицательный тест на COVID-19 не гарантирует, что человек не заразится этим вирусом на следующий день. Поэтому, например, в японских лабораториях персонал тестируют каждые несколько дней. Повторный тест нужен и для того, чтобы подтвердить, что человек излечился.
Эта тест-система будет использоваться для диагностики COVID-19 не только в России и Японии. 40 тыс. тестов закупила Австрия, поступили заказы из других стран Европы, Ближнего Востока, и Латинской Америки. Подана заявка в Управление по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) для поставок в эту страну.
На данный момент в России прошли регистрацию еще три теста на коронавирус.
По некоторым данным, в Москве проводится около 700 тестов на коронавирус в сутки. В планах у московских властей увеличить этот показатель до 10 тыс. тестов в сутки, а затем довести его до 25—28 тыс. тестов ежедневно.
Новые разработки за рубежом
Компания Bosch выводит на рынок свой тест на коронавирус, который сначала будет доступен в Германии, а вскоре появится в других странах. В его основе лежит диагностический аппарат Vivalytic, который, по словам изготовителей, станет первым автоматизированным тестом на COVID-19. Тест распознает не только коронавирус, но еще шесть респираторных заболеваний, например, вирусы гриппа А и B. Во время лабораторных испытаний аппарата его точность составила 95%.
Как пишет издание ZME Science, анализ может проводиться прямо в стационаре или медицинском центре — не нужно отправлять образцы в лабораторию и ждать, пока придет ответ. Врачи смогут быстрее идентифицировать и изолировать зараженных, а пациентам не придется пребывать в неизвестности несколько дней. Тест прост в обслуживании и не требует специальной подготовки. Медперсоналу нужно только взять мазок из носа или горла пациента, нанести его на картридж, содержащий реагент, и вставить картридж в анализатор. Каждый аппарат может выполнять до десяти анализов за 24 часа.
Еще более оперативный тест на COVID-19 разработали в Великобритании. Он позволяет выявить COVID-19 всего за 30 минут. Чтобы провести его, достаточно портативного оборудования стоимостью около $120 и набора полосок для мазков из носа и горла по $5 каждая. Одновременно проходить тест могут до шести человек.
FDA в экстренном порядке одобрило сверхбыстрый тест на коронавирус, разработанный калифорнийской компанией Cepheid. С его помощью диагноз можно будет поставить всего за 45 минут. Как отмечает Business Insider, для обработки результатов теста не требуется специальное обучение. Нужен лишь доступ к системе Cepheid GeneXpert — в США их 5 тыс., а по всему миру — 23 тыс.
Начало тотального тестирования людей на COVID-19 во всем мире — хорошая новость как для людей, так и для национальных органов здравоохранения. До сих пор в мире нет четкого представления о том, сколько людей заражены коронавирусом и выявление тех, у кого он уже есть: их госпитализация или отправка на домашний карантин позволит быстрее оценить масштаб угрозы и вовремя принять правильные меры.

Вирусы — это микроскопические патогены, заражающие клетки живых организмов для самовоспроизводства. Они состоят из одного вида нуклеиновой кислоты (или ДНК или РНК, но не обе вместе), которая защищена оболочкой, содержащей белки, липиды, углеводы или их комбинацию. Размер типичного вируса варьируется от 15 до 350 нм, поэтому его можно увидеть только с помощью электронного микроскопа.
В 1892 году русский ученый Д.И. Ивановский впервые доказал существование ранее неизвестного типа возбудителя болезней, это был вирус мозаичной болезни табака. А в 1898 году Фридрих Лоффлер и Пол Фрош нашли доказательства того, что причиной ящура у домашнего скота была инфекционная частица, которая меньше, чем любая бактерия. Это были первые шаги к изучению природы вирусов, генетических образований, которые лежат где-то в серой зоне между живыми и неживыми состояниями материи. На текущий момент описано около 6 тыс. вирусов, но их существует несколько миллионов.
Строение вирусов
Вне клеток-хозяев вирусы существуют в виде белковой оболочки (капсида), иногда заключенного в белково-липидную мембрану. Капсид обволакивает собой либо ДНК, либо РНК, которая кодирует элементы вируса. Находясь в такой форме вне клетки, вирус метаболически инертен и называется вирионом.
Простая структура, отсутствие органелл и собственного метаболизма позволяет некоторым вирусам кристаллизоваться, т.е. они могут вести себя подобно химическим веществам. С появлением электронных микроскопов было установлено, что их кристаллы состоят из тесно прижатых друг к другу нескольких сотен миллиардов частиц. В одном кристалле вируса полиомиелита столько частиц, что ими можно заразить не по одному разу всех жителей Земли.
Формы вирусов
Вирусы встречаются в трех основных формах. Они бывают:
- Сферическими (кубическими или полигидральными). Вирусы герпеса, типулы, полиомы и т.д.
- Спиральными (цилиндрическими или стержнеобразными). Вирусы табачной мозаики, гриппа, эпидемического паротита и др.
- Сложными. Например, бактериофаги.
Проникновение вирусов в клетку-хозяина
Капсид в основном защищает нуклеиновую кислоту от действия клеточного нуклеазного фермента. Но некоторые белки капсида способствуют связыванию вируса с поверхностью клеток-хозяев, и работают, как ключики, вставляемые в нужные замочки. Другие поверхностные белки действуют как ферменты, они растворяют поверхностный слой клетки-хозяина и таким образом помогают проникновению нуклеиновой кислоты вируса в клетку-хозяина.
Жизненный цикл вирусов сильно отличается у разных видов, но существует шесть основных этапов жизненного цикла вирусов:
Присоединение к клетке-хозяину представляет собой специфическое связывание между вирусными капсидными белками и рецепторами на клеточной поверхности. Эта специфика определяет хозяина вируса.
Проникновение следует за прикреплением: вирионы проникают в клетку-хозяина через рецептор-опосредованный эндоцитоз или слияние мембран. Это часто называют вирусной записью.
Проникновение вирусов в клетку достигается за счет:
Размножение вирусов
После того, как вирусный геном освобождается от капсида, начинается его транскрипция или трансляция. Именно эта стадия вирусной репликации сильно различается между ДНК- и РНК-вирусами и вирусами с противоположной полярностью нуклеиновой кислоты. Этот процесс завершается синтезом новых вирусных белков и генома (точных копий внедрённых).
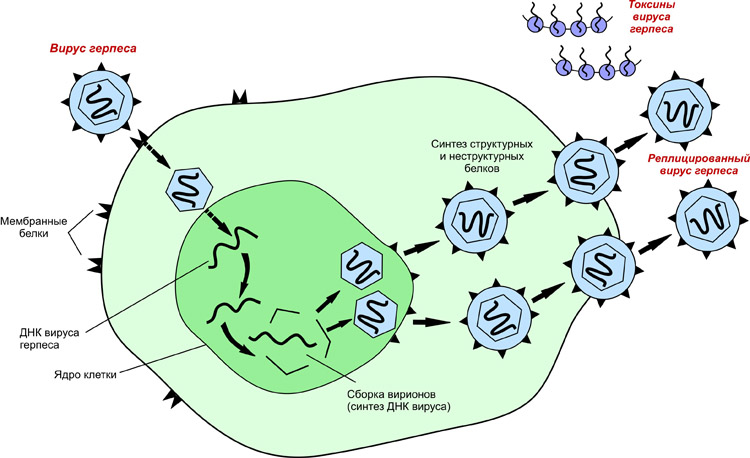
Механизм репликации зависит от вирусного генома.
- ДНК-вирусы обычно используют белки и ферменты клетки-хозяина для получения дополнительной ДНК, она транскрибируется в РНК-мессенджер (мРНК), которая затем используется для управления синтезом белка.
- РНК-вирусы обычно используют ядро РНК в качестве матрицы для синтеза вирусной геномной РНК и мРНК. Вирусная мРНК направляет клетку-хозяина на синтез вирусных ферментов и капсидных белков и сборку новых вирионов. Конечно, есть исключения из этого шаблона. Если клетка-хозяин не обеспечивает ферменты, необходимые для репликации вируса, вирусные гены предоставляют информацию для прямого синтеза отсутствующих белков.
Чтобы преобразовать РНК в ДНК, вирусы должны содержать гены, которые кодируют вирус-специфический фермент обратной транскриптазы. Она транскрибирует матрицу РНК в ДНК. Обратная транскрипция никогда не происходит в неинфицированных клетках. Необходимый фермент, обратная транскриптаза, происходит только от экспрессии вирусных генов в инфицированных клетках.
Вироиды
Вироиды заражают только растения. Одни вызывают экономически важные заболевания сельскохозяйственных культур, в то время как другие являются доброкачественными. Двумя примерами экономически важных вироидов являются кокосный cadang-cadang (он вызывает массовую гибель кокосовых пальм) и вироид рубцовой кожицы яблок, который безнадежно портит товарный вид яблок.
30 известных вироидов были классифицированы в две семьи.
- Члены семейства Pospiviroidae, названные по имени вироида клубневого веретена картофеля, имеют палочковидную вторичную структуру с небольшими одноцепочечными областями, имеет центральную консервативную область, и реплицируются в ядре клетки.
- Avsunviroidae, названный в честь вироида авокадо, имеет как палочковидную, так и разветвленную области, но не имеет центральной консервативной области и реплицируется в хлоропластах растительной клетки.
В отличие от вирусов, которые являются паразитами механизма трансляции хозяина, вироиды являются паразитами клеточных транскрипционных белков.
Бактериофаги

Существуют тысячи разновидностей фагов, каждый из которых может заразить только один тип или несколько близких типов бактерий или архей. Фаги классифицируются по ряду семейств вирусов; например:
Как и все вирусы, фаги являются простыми организмами, которые состоят из ядра генетического материала (нуклеиновой кислоты), окруженного капсидом белка. Нуклеиновая кислота может представлять собой либо ДНК, либо РНК, и может быть двухцепочечной или одноцепочечной.
Существует три основных структурных формы фага:
- Икосаэдрическая (20-сторонняя) головка с хвостом
- Икосаэдрическая головка без хвоста
- Нитевидная форма
Во время заражения фаг прикрепляется к бактерии и вставляет в нее свой генетический материал. После этого фаг обычно следует одному из двух жизненных циклов: литическому (вирулентному) или лизогенному (умеренному).
Литические, или вирулентные, фаги захватывают механизм клетки, чтобы скопировать компоненты фага. Затем они разрушают или лизируют клетку, высвобождая новые частицы фага.
Лизогенные, или умеренные, фаги включают свою нуклеиновую кислоту в хромосому клетки-хозяина и реплицируются с ней как единое целое, не разрушая клетку. При определенных условиях лизогенные фаги могут индуцироваться в соответствии с литическим циклом.
Существуют и другие жизненные циклы, в т.ч. псевдолизогенез и хроническая инфекция. При псевдолизогении бактериофаг проникает в клетку, но не использует механизм репликации клеток и не интегрируется в геном хозяина, просто как бы прячется внутри бактерии, не нанося ей никакого вреда. Псевдолизогенез возникает, когда клетка-хозяин сталкивается с неблагоприятными условиями роста и, по-видимому, играет важную роль в выживании фага, обеспечивая сохранение генома фага до тех пор, пока условия роста хозяина снова не станут благоприятными.
При хронической инфекции новые фаговые частицы образуются непрерывно и длительно, но без явного уничтожения клеток.
Вскоре после открытия фаги начали использовать для лечения бактериальных заболеваний человека, таких как бубонная чума и холера. Но фаговая терапия тогда не была успешной, и после открытия антибиотиков в 1940-х годах она была практически заброшена. Однако с появлением устойчивых к антибиотикам бактерий терапевтическому потенциалу фагов уделяется все больше внимания.
Наше время с антибиотиками заканчивается. В 2016 году женщина в штате Невада умерла от бактериальной инфекции, вызванной Klebsiella pneumoniae, которая была устойчивой ко всем известным антибиотикам. Бактерии, устойчивые к колистину, антибиотику последней инстанции, были обнаружены на свинофермах в Китае. В настоящее время бактерии приспосабливаются к антибиотикам быстрее, чем когда-либо.
Покажите ножницы которыми вирусы разрезают молекулу РНК что бы встроиться для мутации.Может что нибудь придумаете другое.К примеру деление цепочка аминокислот получив энергию из вне как одноименные заряды распадается на две. К каждой соединятся только те какие были ранее (другие проскочат мимо),казалось бы копии,но внутренняя энергия разная(уменьшается увеличивается) поэтому распад и создание. Вся химия углерода на этом построена 1000 орган соединений создает у других хим элементов этого свойства нет. Иммунная система делает накладку(интерференция)с помощью энергии интерферонов пытаясь разрушить цепочку РНК вируса.Надо помочь организму но не вакциной(вирус быстро мутирует)
Из нескольких сотен известных в настоящее время вирусов человека и животных РНК-геном содержит около 80% вирусов. Способность РНК хранить наследственную информацию является уникальной особенностью вируса.
У просто организованных и некоторых сложно организованных вирусов вирусная РНК в отсутствие белка может вызвать инфекционный процесс. Впервые инфекционная активность РНК вируса табачной мозаики была продемонстрирована X. Френкель-Конратом и соавт. в 1957 г. и А. Гирером и Г. Шраммом в 1958 г. Впоследствии положение об инфекционной активности РНК было перенесено на все РНК-содержащие вирусы, однако долголетние усилия доказать это для таких вирусов, как вирусы гриппа, парамиксовирусы, рабдовирусы (так называемые минус-нитевые вирусы), оказались бесплодными: у этих вирусов инфекционной структурой являются не РНК, а комплекс РНК с внутренними белками. Таким образом, геномная РНК может обладать инфекционной активностью в зависимости от своей структуры.
Структура вирусных РНК чрезвычайно разнообразна. У вирусов обнаружены однонитчатые и двунитчатые, линейные, фрагментированные и кольцевые РНК. РНК-геном в основном является гаплоидным, геном ретровирусов — диплоидный, т. е. состоит из двух идентичных молекул РНК.
В основном однонитчатые РНК являются линейными молекулами, однако РНК-фрагменты буньявирусов обнаружены в виде кольцевой формы. Кольцевая форма возникает за счет образования водородных связей между концами молекул.
Двунитчатые РНК.Этот необычный для клетки тип нуклеиновой кислоты, впервые обнаруженный у реовирусов, широко распространен среди вирусов животных, растений и бактерий. Вирусы, содержащие подобный геном, называют диплорнавирусы.
Общей особенностью диплорнавирусов является фрагментированное состояние генома. Так, геном реовирусов состоит из 10 фрагментов, ротавирусов — из 11 фрагментов.
Молекулярная масса РНК таких вирусов варьирует в широких пределах.
БЕЛКИ
В зараженной клетке вирусный геном кодирует синтез двух групп белков: 1) структурных, которые входят в состав вирусных частиц потомства, и 2) неструктурных, которые обслуживают процесс внутриклеточной репродукции вируса на разных его этапах, но в состав вирусных частиц не входят.
Структурные белки. Количество структурных белков в составе вирусной частицы варьирует в широких пределах в зависимости от сложности организации вириона. Наиболее просто организованный вирус табачной мозаики содержит всего один небольшой белок с молекулярной массой 17—18- 10 3 , некоторые фаги содержат 2—3 белка, просто организованные вирусы животных — 3—4 белка. Сложно устроенные вирусы, такие как вирусы оспы, содержат более 30 структурных белков.
Структурные белки делятся на 2 группы:
1) капсидные белки, образующие капсид, т. е. футляр для нуклеиновой кислоты вируса (от лат. capsa — вместилище), и входящие в состав капсида геномные белки, и ферменты;
2) суперкапсидные белки, входящие в состав суперкапсида, т. е. наружной вирусной оболочки.
Просто организованные вирусы, представляющие собой нуклеокапсид, содержат только капсидные белки. Сложно организованные вирусы содержат капсидные и суперкапслдные белки.
В составе капсида некоторых вирусов (пикорнавирусы, паповавирусы, аденовирусы) содержатся белки, ковалентно связанные с вирусным геномом (геномные белки). Эти белки являются терминальными, т. е. соединенными с концом вирусной нуклеиновой кислоты. Функции их неразрывно связаны с функциями генома и их регуляцией.
У ряда сложно организованных вирусов в составе капсида имеются ферменты, осуществляющие транскрипцию и репликацию вирусного генома — РНК и ДНК (РНК-и ДНК-полимеразы), а также ферменты, модифицирующие концы иРНК. Если ферменты и геномные белки представлены единичными молекулами, то капсидные белки представлены множественными молекулами. Эти белки и формируют капсидную оболочку, в которую у сложно организованных вирусов вставлены молекулы белков с другими функциями.
Основным принципом строения капсидной оболочки вирусов является принцип субьединичности, т. е. построение капсидной оболочки из субъединиц-капсомеров, образованных идентичными полипептидными цепями. Правильно построенные белковые субъединицы — капсомеры возникают благодаря способности вирусных капсидных белков к самосборке. Самосборка объясняется тем, что упорядоченная структура — капсид имеет наименьшую свободную энергию по сравнению с неупорядоченными белковыми молекулами. Сборка капсидной оболочки из субъединиц запрограммирована в первичной структуре белка и происходит самопроизвольно или при взаимодействии с нуклеиновой кислотой.
Принцип субъединичности в строении вирусного капсида является универсальным свойством капсидных белков и имеет огромное значение для вирусов. Благодаря этому свойству достигается огромная экономия генетического материала. Если бы капсидная оболочка была построена из разных белков, то на кодирование ее потребовалась бы основная часть генетической информации, заложенной в вирусном геноме. В действительности на кодирование, например, одной полипептидной цепи вируса табачной мозаики, расходуется менее 10% генома. Далее, в механизме самосборки заложена возможность контроля за полноценностью вирусных полипептидов: дефектные и чужеродные полипептидные цепи при таком способе сборки вирионов будут автоматически отбрасываться.
Описанная способность к самосборке в пробирке и в зараженной клетке характерна только для простых вирусов. Сборка сложно организованных вирусов является гораздо более сложным многоступенчатым процессом, хотя отдельные ее этапы, например формирование капсидов и нуклеокапсидов, также основаны на самосборке.
Суперкапсидные белки. Гликопротеиды. Суперкапсидные белки, или пепломеры, располагаются в липопротеидной оболочке (суперкапсиде или пеплосе) сложно устроенных вирусов. Они либо пронизывают насквозь липидный бислой как, например, гликопротеиды альфа-вирусов (вируса леса Семлики), либо не доходят до внутренней поверхности. Эти белки являются типичными внутримембранными белками и имеют много общего с клеточными мембранными белками. Как и последние, суперкапсидные белки обычно гликозилированы. Углеводные цепочки прикреплены к молекуле полипептида в определенных участках. Гликозилирование осуществляют клеточные ферменты, поэтому один и тот же вирус, продуцируемый разными видами клеток, может иметь разные у углеводные остатки: может варьировать как состав углеводов, так и длина углеводной цепочки и место прикрепления ее к полипептидному остову.
Основной функцией гликопротеидов является взаимодействие со специфическими рецепторами клеточной поверхности. Благодаря этим белкам осуществляется распознавание специфических клеточных рецепторов и прикрепление к ним вирусной частицы, т. е. адсорбция вируса на клетке. Поэтому гликопротеиды, выполняющие эту функцию, называют вирусными прикрепительными белками.
Другой функцией гликопротеидов является участие в слиянии вирусной и клеточной мембран, т. е. в событии, ведущем к проникновению вирусных частиц в клетку. Вирусные белки слияния ответственны за такие процессы, как гемолиз и слияние плазматических мембран соседних клеток, приводящие к образованию гигантских клеток, синцитиев и симпластов.
Неструктурные белки. Неструктурные белки изучены гораздо хуже, чем структурные, поскольку их выделяют не из очищенных препаратов вирусов, а из зараженных клеток, и возникают трудности в их идентификации и очистке от клеточных белков.
К неструктурным белкам относятся:
1) предшественники вирусных белков, которые отличаются от других неструктурных белков нестабильностью в зараженной клетке в результате быстрого нарезания на структурные белки;
2) ферменты синтеза РНК и ДНК (РНК- и ДНК- полимеразы), обеспечивающие транскрипцию и репликацию вирусного генома;
4) ферменты, модифицирующие вирусные белки, например протеиназы и протеинкиназы.
Однако многие неструктурные белки при ряде вирусных инфекций еще не идентифицированы и функции их не определены.
Сейчас известно 39 видов коронавирусов, в каждый вид могут входить десятки и сотни штаммов. Кроме того, есть еще 10 видов — кандидатов в коронавирусы. Специалисты пока только проверяют, можно ли их считать настоящими коронавирусами. У них широкий спектр хозяев среди птиц и зверей, у которых они вызывают заболевания дыхательной системы и желудочно-кишечного тракта. К людям коронавирусы приходят от животных: вирус атипичной пневмонии 2002—2003 годов SARS-CoV пришел от подковоносых летучих мышей, от которых он перескочил в мусанга, или малайскую пальмовую куницу, а из мусанга — уже в человека. (Любителям кофе малайская пальмовая куница должна быть знакома — это тот самый зверек, без которого не было бы кофе копи-лювак: мусангам скармливают кофейные зерна, которые определенным образом ферментируются в кишечнике, изменяя вкусовые свойства; кофе из зерен, которые прогнали через мусангов, считается особо изысканным и стоит весьма немалых денег.)
Еще один человеческий коронавирус известен по вспышке ближневосточного респираторного синдрома, первые случаи которого были зарегистрированы в 2012 году в Саудовской Аравии, — он получил название MERS-CoV. Этот вирус также пришел к людям от летучих мышей с промежуточной остановкой в одногорбых верблюдах (оттого его еще называют верблюжьим гриппом, что неправильно, — коронавирусы от вирусов гриппа отличаются). Умирают от него более трети заразившихся, однако заразиться им сложно: с момента появления вируса и до начала этого года в мире зарегистрировано лишь около двух с половиной тысяч случаев.
Подозревают, что и новый вирус SARS-CoV-2 тоже пришел к нам от летучих мышей.
Наконец, есть еще четыре человеческих коронавируса, два из которых, HCoV-229E и HCoV-OC43, были известны еще до атипичной пневмонии от SARS-CoV, а два других, HCoV-NL63 и HCoV-HKU1, открыли в 2004 и 2005 годах. Все четыре не вызывают ничего серьезнее мягкой простуды; хотя коронавирусная простуда встречается довольно часто — на ее счет относят 15—30% всей простуды в мире.
Но об эпидемиологии коронавирусов мы рассказывать не будем, а вместо этого поговорим о том, как они устроены и как на них реагируют наши клетки.
Обладатели белковой короны
И белок S, и белок HE сидят в мембранной липидной оболочке. Откуда она берется? Как мы помним, наши клетки окружены мембраной и внутри них существует много мембранных органелл — клеточных органов, выполняющих разные функции и ради правильной работы отделенных от остальной клетки двуслойной липидной мембраной. Ее-то вирус и заимствует, выходя из клетки, а как именно, скажем чуть ниже. Кроме S и HE в ней сидит очень много белка М, который поддерживает и структурирует мембрану, и еще немного белка E. Под липидной оболочкой с белками мы найдем геном вируса — нить молекулы РНК, которая усажена белком N: он упаковывает вирусную РНК в компактную свернутую спираль. (Белковая оболочка вирусов, непосредственно взаимодействующая с нуклеиновой кислотой, называется капсидом.) Когда РНК попадает в клетку, то на ней сразу можно синтезировать белки, и такую РНК у вирусов обозначают плюсом.
По этим признакам коронавирусы относят к РНК-содержащим вирусам, чей геном представляет собой одну-единственную плюс-цепь РНК. Так же выглядит геном у множества других вирусов, среди которых есть риновирусы (одна из самых частых причин простуды) и вирус гепатита С. В то же время коронавирусы относят к оболочечным вирусам, у которых кроме нуклеиновой кислоты и связанного с ней структурно-защитного белка (у коронавирусов это белок N) есть еще мембранная оболочка. К оболочечным вирусам еще относятся, например, вирусы герпеса, у которых наследственная информация хранится в ДНК, и ВИЧ. Как видим, по отдельности разные молекулярные черты можно найти у множества вирусов и лишь по их сочетанию отделить одну группу вирусов от другой.
Кстати, геном в виде РНК — это, можно сказать, слабость коронавирусов. В нуклеиновых кислотах время от времени появляются мутации либо из-за внешних факторов, вроде фоновой радиации, либо из-за стандартных ошибок белков, которые эти нуклеиновые кислоты копируют. Но в клеточной ДНК мутации могут быть исправлены специальными ремонтными белками. Этим же ремонтом способны воспользоваться вирусы с геномом в виде ДНК или же те, которые геномную РНК на время копируют в ДНК (такие вирусы называются ретровирусами). А в коронавирусной РНК ошибки никак не исправляются. Мутации помогают вирусам сменить хозяина, но среди мутаций есть очень много вредных, и если вирус не может никак корректировать дефекты в ДНК, они в какой-то момент могут сделать его просто нежизнеспособным.
Любые вирусы — это, грубо говоря, лишь комок молекул, пусть и сложно устроенный. Собственного обмена веществ у вирусов нет, и размножаться за пределами клетки они не могут. Вирусам с мембранной оболочкой проникнуть в клетку проще как из-за самой мембраны, так и благодаря сидящим на ней белкам: они хорошо подходят к клеточным рецепторам. Кроме того, белки мембранной оболочки, как собственно вирусные, так и те, которые вирус прихватил у клетки вместе с куском мембраны, помогают вирусу уходить от иммунной атаки. Но из-за мембраны такие вирусы более чувствительны к разным неблагоприятным факторам, вроде обезвоживания или моющих детергентов, мембрану разрушающих. Поэтому вирусы с мембранной оболочкой лучше всего передаются от хозяина к хозяину, а сидеть на какой-то поверхности и ждать, когда их оттуда снимет потенциальный хозяин, они долго не могут. Этим они отличаются от вирусов без мембраны, которые представляют собой нуклеиновую кислоту, заключенную в белковый капсид, — они более устойчивы в окружающей среде, но проникнуть в клетку для них зачастую сложнее.
Внедрение в клетку
Разные вирусы пользуются разными клеточными белками для входа. Так, вирус атипичной пневмонии SARS-CoV и относительно безобидный HCoV-NL63 связываются с ангиотензинпревращающим ферментом 2, который помогает регулировать кровяное давление, участвует в управлении иммунитетом и играет роль еще в целом ряде процессов. Но белка одного вида для входа бывает недостаточно, поэтому, например, SARS-CoV нужен еще белок TMPRSS2 — одна из сериновых протеаз, участвующая в разных биохимических реакциях. Вирус сначала связывается с одним белком на поверхности клетки, а потом второй белок на поверхности клетки режет вирусный белок S, после чего мембраны вируса и клетки соединяются.
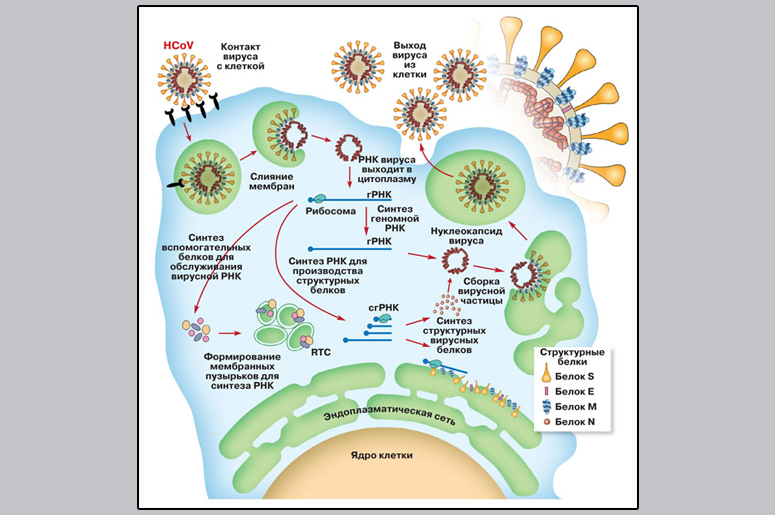
Схема жизненного цикла коронавируса. Проникнув в клетку, вирус высвобождает свою РНК, на которой рибосомы — клеточные машины для белкового синтеза — собирают вирусные белки, необходимые для формирования мембранных пузырьков и для синтеза плюс-цепи геномной РНК — гРНК. На вспомогательных мембранных пузырьках появляются вирусные белки, образующие RTC — replication transcription complex, этот комплекс выполняет репликацию (удвоение генома вируса) и транскрипцию — синтез коротких субгеномных РНК (сгРНК), предназначенных для сборки структурных вирусных белков. Структурный белок N соединяется с геномной РНК и образует нуклеокапсид вируса (геном плюс капсидный белок). На эндоплазматической сети синтезируются другие структурные белки, которые организуют вирусу липидную мембрану.
Вирус проник в клетку, и теперь он начинает копировать свой геном, то есть молекулу РНК, и синтезировать белки, нужные для копирования РНК и для формирования вирусных частиц. Кроме полных геномных РНК коронавирусы создают еще набор более коротких РНК — они синтезируются на больших геномных РНК и нужны только для синтеза белков; в вирусные частицы эти короткие РНК не попадают (точно так же ведут себя некоторые другие вирусы, которые вместе с коронавирусами объединяют в группу Nidovirales). Все вирусные РНК синтезируются в особых белковых комплексах, которые, в свою очередь, закреплены в небольших мембранных пузырьках. Эти пузырьки создает сам вирус: его белки вторгаются во внутриклеточные мембраны и фрагментируют их, создавая пузырьки-везикулы, чтобы РНК-синтезирующим комплексам было к чему пришвартоваться.
Часть насинтезированной РНК остается плавать в цитоплазме клетки — на ней синтезируется белок N, который будет упаковывать геномную вирусную РНК в спираль. Другие структурные белки, те, что потом окажутся в мембранной оболочке вируса (S, M и пр.), синтезируются на РНК, осевшей на особой внутриклеточной структуре — эндоплазматической сети, или эндоплазматическом ретикулуме (ЭР). Эндоплазматическая сеть — это огромная система мембранных канальцев, цистерн и пузырьков, на которых сидят белоксинтезирующие молекулярные машины рибосомы и собирают белки в соответствии с информацией в РНК. Готовые белки погружаются внутрь полостей ЭР, где приобретают правильную пространственную форму и потом либо переходят в клеточную цитоплазму, либо отправляются на экспорт, наружу из клетки, будучи заключены в транспортный мембранный пузырек.
Особенности внутриклеточной борьбы
О том, что у нее внутри орудует вирус, клетка может догадаться по неполадкам с внутренними мембранами — мы помним, что коронавирусы фрагментируют мембраны, чтобы дать опору своим белкам, синтезирующим РНК, и сами вирусные частицы прихватывают себе куски мембран. Кроме того, вирусные белки накапливаются в эндоплазматической сети и вызывают так называемый ЭР-стресс, то есть стресс эндоплазматического ретикулума. ЭР-стресс заставляет клетку остановить синтез белков (что, несомненно, бьет по вирусу — ведь он зависит от клеточной белоксинтезирующей машины) и активирует сигнальные молекулярные пути, которые включают программы клеточного суицида. Наконец, клетка может понять по вирусной РНК, что внутри у нее поселилась инфекция, и в ответ начать синтез интерферона первого типа. Это сигнальный белок, который выходит из клетки и оповещает всех об инфекции, в результате здоровые клетки готовятся защищаться от своей соседки, а иммунные клетки стремятся уничтожить зараженную клетку.
Читайте также:


